生活中盐类水解的应用ppt课件
盐类水解的应用优质课公开课课件

盐类水解的应用CO 32-+H 2O ⇌ HCO 3- + OH -(吸热)HCO 3-+H 2O ⇌ H 2CO 3 + OH -(吸热)1、热纯碱溶液去油污+ 3C 17H 35COONaC 17H 35COOCH 2C 17H 35COOCH 2C 17H 35COOCH +3NaOH →CH 2OH CH 2OHCHOH 硬脂酸甘油酯甘油硬脂酸(提示:油脂在碱性条件下可以发生水解反应生成甘油和高级脂肪酸盐而溶于水)加热:能促进CO 32-水解,产生更多OH -,使油脂水解更完全。
为什么用肥皂洗衣服时用温水比冷水洗得干净一些?肥皂主要成分:硬脂酸钠(C 17H 35COONa)硬脂酸(C 17H 35COOH)是一种一元弱酸C 17H 35COO - + H 2O ⇌ C 17H 35COOH + OH - (吸热)1、纯碱溶液去油污Al 3+ + 3H 2O ⇋Al(OH)3 (胶体) + 3H +Fe 3+ + 3H 2O ⇋ Fe(OH)3 (胶体) + 3H +【回顾】如何制备Fe(OH)3胶体?2、净水剂原理【问题】为什么明矾[KAl(SO 4)2·12H 2O ] 、 FeCl 3 等盐可用做净水剂? 可溶性的铝盐、铁盐本身无毒,水解生成胶体,胶体表面积大,有较强的吸附性,可以使水中细小的悬浮颗粒聚集成较大的颗粒而沉淀,常用作净水剂。
KAl(SO 4)2= K + + Al 3+ + 2SO 42-(1)明矾[KAl(SO 4) 2·12H 2O ](2)铁盐( FeCl 3)①实验操作:②反应原理:____________________________________。
将烧杯中的蒸馏水加热至沸腾向沸水中滴加几滴FeCl 3 饱和溶液继续煮沸至液体呈红褐色(3)氢氧化铁胶体的制备u 草木灰的成分—— K 2CO 3,水解呈碱性u 铵态氮肥——铵盐,水解呈酸性混合后,OH -与H +中和,促进水解,水解平衡向右移动,以致生成大量的NH 3·H 2O, NH 3·H 2O分解成NH 3逸出,从而降低了肥效。
盐类水解在生产、生活中的应用 课件

思考感悟
(1)配制FeCl3溶液时,能加少量硝酸抑制Fe3+水解 吗? (2)洗去油污时应选取Na2CO3还是NaHCO3,为什 么?
【提示】 (1)不能。引入杂质 NO- 3 。 (2) 应 选 择 Na2CO3 。 同 浓 度 的 Na2CO3 比 NaHCO3 水解程度大,c(OH-)大,去污能力强。
盐类水解 在生产、生活中的应用
盐类水解在生产、生活中的应用 1.用纯碱溶液清洗油污时,加热可增强去污能力。 2.化肥的施用 例如:草木灰与铵态氮肥不能混合施用,否则会使 肥效损耗,这是两种盐发生水解相互促进反应放出
氨气的缘故。 3.盐溶液的配制 例如:配制FeCl3、SnCl2溶液时应加入少量盐酸, 目的是_抑__制__F__e3_+_、__S__n_2+__的__水__解__。
5.混合溶液中各离子浓度的大小比较 根据电离程度、水解程度的相对大小分析。
(1)分子的电离大于相应离子的水解 例如等物质的量浓度的 NH4Cl 与 NH3·H2O 混合 溶液,c(NH+4 )>c(Cl-)>c(OH-)>c(H+)。 (2)分子的电离小于相应离子的水解 例如在 0.1 mol·L-1 的 NaCN 和 0.1 mol·L-1 的 HCN 溶液的混合液中,各离子浓度的大小顺序为 c(Na+)>c(CN-)>c(OH-)>c(H+)。
7.判断盐溶液中离子种类多少(如Na3PO4溶液中 存在哪些离子)。 8.采用加热的方法来促进溶液中某些盐的水解, 使之生成氢氧化物沉淀,以除去溶液中某些金属 离子。例如,不纯的KNO3溶液中常含有杂质Fe3+, 可用加热的方法来除去KNO3溶液中所含的Fe3+。
例1 在蒸发皿中加热蒸干并灼烧(<400 ℃)下列
物质的溶液,可以得到该物质的固体的是( )
《影响盐类水解的因素和盐类水解的应用》课件

根据实验数据,分析不同因素对盐类水解的影响,如温度、浓度等。比较不同盐类的水解 程度和速率,探讨其内在原因。
3. 讨论
结合实验结果和相关理论知识,讨论盐类水解的原理和应用。探讨如何优化实验条件,提 高实验的准确性和可靠性。同时,可以进一步拓展研究其他因素对盐类水解的影响,如催 化剂、溶剂性质等。
造纸行业应用情况介绍
造纸废水处理
盐类水解技术可用于处理造纸废水, 通过水解反应去除废水中的木质素、 纤维素等有机物,降低废水的BOD (生化需氧量)和COD含量。
纸浆漂白
在纸浆漂白过程中,盐类水解技术可 以作为漂白剂的补充或替代,提高纸 浆的白度和亮度。
皮革加工行业应用情况介绍
皮革脱脂
盐类水解技术可用于皮革脱脂过 程,通过水解反应去除皮革中的 脂肪和油脂,提高皮革的柔软度 和透气性。
指导工业生产
盐类水解研究有助于揭示化学反应的规律 和机理,为化学学科的发展提供理论支持 。
在化工、冶金、纺织等工业生产中,盐类 水解反应的应用对于优化生产工艺、提高 产品质量具有重要意义。
环境保护
生物化学
盐类水解反应在废水处理、土壤改良等环 境保护领域具有广泛应用,有助于改善生 态环境质量。
在生物体内,许多生物化学反应都涉及到 盐类水解过程,研究盐类水解有助于深入 了解生物体内的化学变化。
皮革染色
在皮革染色过程中,盐类水解技 术可以改善染料的溶解性和渗透 性,提高染色的均匀度和色牢度 。
其他工业生产领域应用举例
01
石油开采
在石油开采过程中,盐类水解技术可用于处理含油废水,通过水解反应
去除废水中的油类和有机物,降低废水的污染程度。
02
冶金工业
盐类水解的应用精选教学PPT课件

(2)判断盐对应酸或碱的相对强弱 例如:证明CH3COOH为弱酸的最简单的方法:取适 量CH3COONa晶体溶于水,用pH试纸测其溶液的pH>7。 (3)加热蒸发盐溶液析出固体
① 水解不生水成解不不挥分发解性的酸盐的如盐N[a如ClA l2SO43]溶―液―蒸→干盐
溶液蒸干 ②水解生成挥发性酸的盐(如AlCl3) ――→ 氢氧化物 ―灼―烧→氧化物
酸,目的是
。
• 4.用盐作净水剂 • 例如:利用FeCl3、明矾在水溶液中发生水解
产生的胶体,能吸附水中悬浮的杂质,起到净 水的作用。
• 5.泡沫灭火器原理 •大A反量lC2应(OS2,气O4体产)3和溶生A液l(O与H)3小沉淀苏打溶液发生,水将解燃相烧互物促质进
与空气隔离开来。离子方程式为Al3++3HCO3 -===Al(OH)3↓+3CO2↑。
6.利用水解反应来制纳米材料(氢氧化物可变为氧化 物)
TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl △
TiO2·xH2O=====TiO2+xH2O
• 盐类水解的综合应用 • (1)判断盐溶液的酸碱性与pH • 例如:①相同物质的量浓度的溶液pH: • NaAlO2>Na2CO3>NaHCO3>NaCl>CuCl2。 • ②用pH试纸鉴别NH4Cl(酸性)、NaCl(中性)、
• 答案: BC
• 当两种离子水解相互促进时,使水解程度增 大,有时会生成沉淀或气体,使两种离子水解
完全而不能在溶液中共存。通常发生水解相互 促 进 反 应 的 离 子 有 Al3 + 与 AlO2 - 、 CO32 - ( 或 HCO3 - ) 、 S2 - , Fe3 + 与 AlO2 - 、 CO32 - ( 或 HCO3-),Fe3+与S2-在溶液中也不能大量共存 ,不是因为水解相互促进,而是因为二者发生 氧化还原反应:2Fe3++S2-===2Fe2++S↓。
盐类水解在生产、生活中的应用 课件

离子浓度大小的比较规律
1.多元弱酸溶液 根据多步电离分析。例如:在 H2CO3 的溶液中,c(H +)>c(HCO-3 )>c(CO23-)。 2.多元弱酸的正盐溶液 根据弱酸根的分步水解分析,例如:Na2CO3 溶液中, c(Na+)>c(CO23-)>c(OH-)>c(HCO-3 )。
3.强酸强碱混合 (1)强酸与强碱正好完全反应,溶液呈中性,c(H+) = c(OH - ) 。 如 室 温 下 , 中 性 溶 液 的 c(H + ) = 10 - 7 mol/L,pH=7。 (2)强酸与强碱混合时,若酸过量,则求c(H+)过量, 若碱过量,则求c(OH-)过量,继而计算pH。 4.酸碱等体积混合 酸与碱pH之和为14,若为强酸与强碱,则pH=7; 若为强酸与弱碱,则pH>7; 若为弱酸与强碱,则pH<7。
6.利用守恒定律
特别提醒:(1)比较离子浓度大小时若出现等式则 考虑三个守恒:即原子守恒、电荷守恒、质子守 恒;若出现不等式,则应考虑电离或水解。 (2)比较离子浓度大小时若为溶液混合,则应先判 断溶液中的溶质及其浓度,再分情况分析。
例2 常温下,将甲酸与NaOH溶液混合,所得 溶液的pH=7,则此溶液中( ) A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+) C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的大小关系
【规律方法】 解此类题目时,必须清楚溶液中三
个守恒关系,即电荷守恒、质量守恒和质子守恒。
另外要综合考虑电离和水解因素。
物质的溶液,可以得到该物质的固体的是( )
A.AlCl3 C.MgSO4
B.NaHCO3 D 析 】 AlCl3 发 生 水 解 , AlCl3 + 3H2O Al(OH)3+3HCl,加热时生成的HCl不断挥发,使 上述平衡向右移动,致使不断生成Al(OH)3沉淀, 最终经灼烧得到Al2O3固体。NaHCO3、KMnO4溶 液 蒸 干 后 所 得 的 NaHCO3 、 KMnO4 固 体 受 热 分 解 得到Na2CO3、K2MnO4、MnO2固体,只有MgSO4 溶液蒸干并灼烧后才能得到MgSO4固体。 【答案】 C
三节三时盐类的水解的应用PPT课件
“焊药”—金属焊接时常用于除去金属表 面的氧化膜,常用ZnCl2、NH4Cl。
灭火器原理
消防灭火中的盐类水解知识
塑料筒里面放入的什么药品? 外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
问题:泡沫灭火器中装的是那两种溶液,其作用原理 是什么?
药品:Al2(SO4)3溶液、NaHCO3溶液
了肥效。
双水解
(三)工业生产中的盐类水解问题
问题10:金属镁与水反应比较困难,若
加一些NH4Cl马上产生大量气体?为什么?
NH4++H2O
NH3•H2O + H+
Mg+ 2H+ = Mg2+ + H2↑ △
NH3•H2O = NH3 ↑ + H2O
总方程式:
Mg+2NH4Cl=MgCl2+2NH3 +H2
(3)强碱弱酸盐水溶液蒸干后一般得到原物质。
如:蒸干 Na2CO3 溶液仍得到 Na2CO3 固体。 (4)对于具有强还原性的盐,如 FeCl2、Na2SO3 等, 在空气中将其溶液蒸干并灼烧时,会发生氧化还原
CO32- + H2O
HCO3- + OH-
SiO2 + 2OH- = SiO32- + H2O
6、加热蒸发可水解的盐溶液析出?固体
问题4:把FeCl3溶液蒸干灼烧,最后得到的固体 产物是什么,为什么?
FeCl3+3H2O ⑴加热促进水解
Fe(OH)3+3HCl ⑵HCl挥发
△
2Fe(OH)3 = Fe2O3 + 3H2O
Al3++3H2O
3盐类的水解ppt课件

A.④>①=②>③
B.①>④>②>③
C.④>①>③>②
D.④>②>①>③
课堂小结
谢谢观看
THANKS
CH3COO- + H2O ⇌ CH3COOH + OH-
电离程度: CH3COOH>H2CO3>HCN>HCO3水解程度: CH3COO-<HCO3-<CN-<CO32-
ClO- + H2O ⇌ HClO + OH-
课堂学习
盐类的水解
酸式盐的水溶液中存在哪些平衡,酸碱性如何判断?
1. 强酸的酸式盐只有电离而无水解,则呈酸性(例如 NaHSO4);
课堂学习
盐类的水解
盐类的水解属于可逆反应吗? 双水解属于可逆反应吗? 可逆反应具有什么样的特点?
你能写出下面两个反应的平衡常数吗?
NH4+ + H2O ⇌ NH3·H2O + H+ CH3COO- + H2O ⇌ CH3COOH + OH-
课堂学习
盐类的水解
对于醋酸钠溶液来说,溶液中除了存在水 解平衡以外,是否存在着其它平衡?其平 衡常数之间是否存在着一定关系?
课堂学习
盐类的水解
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大 小。那么是什么原因造成不同类型的盐溶液中c(H+)和c(OH-)相对大 小的差异呢?
盐的类型
强酸强碱盐 强酸弱碱盐 强碱弱酸盐
盐溶液酸碱性
中性
酸性
碱性
c(H+)和c(OH-)的 相对大小
c(H+)=c(OH-)
NH4+ + OH- ⇌ NH3·H2O
盐类的水解(共62张ppt)

六、离子浓度大小的比较
1)电离理论:
① 弱电解质电离是微弱的
如: NH3 ·H2O 溶液中:
HCl HNO3
NaOH KOH
强碱 中性
强酸盐
1、盐类的水解定义
在溶液中盐电离出来的离子(弱酸根、弱 碱根)跟水所电离出来的H+ 或OH-结合生成弱 电解质的反应,叫做盐类的水解。
2、水解的实质
破坏了水的电离平衡(促进水的电离)
3、水解反应与中和反应的关系:
酸+碱 2-、HS-、SO32-、HSO3-;
②Fe3+与HCO3-、CO32-、SiO32-、AlO2-; ③NH4+与SiO32-、AlO2-;
4、 双水解的写法:
(第三课时)
1、水解平衡常数及与电离平衡常、KW的关系 2、盐类水解的应用 3、盐类水解的三大守恒 4、离子浓度大小的比较
1、水解平衡常数及与电离平衡常、KW的关系
Fe2+ + 2H2O Fe(OH)2 + 2H+
配制 FeCl3溶液:加少量 稀盐酸 ;
配制 FeCl2溶液:加少量
稀盐酸和Fe粉;
加相应的 酸
配制 FeSO4溶液:加少量 稀硫酸和Fe粉;
保存NH4F溶液 :铅容器或塑料瓶 不能存放在玻璃瓶中!
(7) 判断盐溶液的酸碱性:(相同温度和浓度)
NaCl溶液 中性 CH3COONa溶液 碱性 NH4Cl溶液 酸性 CH3COONH4溶液中性 NaHCO3溶液 碱性
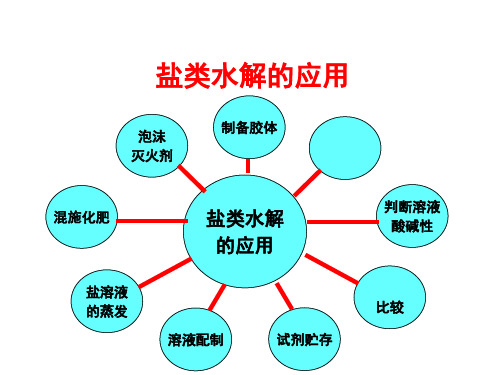
盐类水解的应用 PPT

总结
泡沫 灭火剂
判断离 子共存
判断离子种 类、数目
混施化肥
盐类水解 的利用
明矾净水 物质提纯
盐溶液 的蒸发
判断溶液 酸碱性
盐的配 制和存放
三、溶液酸碱性的判断
练习和思考:相同温度下同物质的量 浓度的下列溶液PH值由小到大的排序 是:
①NaOH
②NH3·H2O
④NaHSO4 ⑤NH4Cl
⑦NaHCO3 ⑧Ba(OH)2
⑩CH3COOH
③H2SO4 ⑥Na2CO3 ⑨NaCl
答案:③④⑩⑤⑨⑦⑥②①⑧
四、水解的盐的配制和存放
观察思考:
Fe(OH)3〔胶体〕+3H+ Al(OH)3〔胶体〕+3H+
3、农家谚语:“灰混粪,粪混灰,灰粪相混损肥分.” 为什么?
草木灰的成分:K2CO3,水解呈碱性.
CO32-+H2O HCO3-+H2O
HCO3- +OHH2CO3 +OH-
铵态氮肥——铵盐,水解呈酸性.
NH4++H2O
NH3·H2O+ H+
①观察新制和久置的FeCl3溶液,解释不同的原因? ②在溶液配制和存放的过程中如何解决此问题?
答案:
①久置的FeCl3溶液变得浑浊, 是因为Fe3++3H2O Fe(OH)3+3H+ ②配制FeCl3溶液的时候要入少量HCl防止Fe3+水解 【小结】:配制易水解的金属盐溶液应加少
量的___同___种__酸______
4、泡沫灭火器能灭火,为什么?
玻璃筒里面放入的什么药品?外筒(钢质)放入的是 什么药品? 泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HCO3- + OH- 正反应吸热 H2CO3 + OH- 正反应吸热
纯碱的去污能力也是由于CO32-水解显弱碱性
.
12
【应K2CO3,水解呈碱性
CO32-+H2O
HCO3- +OH- (主要),
HCO3-+H2O
H2CO3 +OH- (次要),
使水澄清。从而达到净水的目的。
.
6
【应用二】泡沫灭火剂
塑料筒里面放入 的是什么药品?
外筒放入的是什么药品?
.
7
【应用二】泡沫灭火剂
药品:塑料内筒放Al2(SO4)3溶液、 铁质外筒放NaHCO3溶液
Al3++3H2O
Al(OH)3+3H+,
HCO3-+H2O
H2CO3 +OH-,
H++ OH-
H2O
小知识:明矾是传统的食品改良剂和膨松剂, 经常被用在油条、粉丝、米粉等食品生产的 添加剂,使其变得蓬松,清亮。但是由于明 矾的化学成份为硫酸铝钾,含有铝离子,所 以过量摄入会影响人体对铁、钙等成份的吸 收,导致骨质疏松、贫血,甚至影响神经细 胞的发育,造成痴呆。因此,现在已经列为 禁用类的食品添加剂。
肥皂主要成分:硬脂酸钠(C17H35COONa)
硬脂酸(C17H35COOH)是一种一元弱酸
C17H35COO-+H2O
C17H35COOH+OH-
正反应吸热,升温平衡右移,碱性增强去污能力更强
.
11
【应用四】纯碱去污
Na2CO3 俗名:纯碱、苏打
CO32-水解
CO32-+H2O HCO3-+H2O
第三节 盐类的水解 (生活中盐类水解的应用)
2015.11.2
.
1
盐类的水解在我们日常生活中有哪些应用?
明矾净水
泡沫 灭火器
制备胶体
溶液配制
去污
混施化肥 等
.
2
.
3
【应用一】 明矾净水
明矾:化学式(KAl(SO4) 2.12H20),是一种复盐
(由两种或两种以上阳离子和一种阴离子组 成的盐),是一种常见的净水剂。
对于给定的化肥:
①K2CO3
②KCl ③Ca(H2PO4)2
④ (NH4)2SO4 ⑤氨水 最适宜的组合是:②③④(填序号)
.
15
Exercises
B 4. 盐类水解的过程中正确的说法是( )
A、盐的电离平衡破坏
B、水的电离平衡发生移动
C、溶液的pH减小
D、没有发生中和反应
.
16
【课外探究】
油条的制作口诀是“一碱、二矾、三钱盐”, 其中碱、矾、 盐分别是指:NaHCO3、 KAl(SO4)2·12H2O和NaCl,请分析制作油条的 原理是什么?
C、加少量铁粉 D、加少量稀盐酸 和铁粉
2.下列盐的水溶液中,哪些呈酸性( ①③④ )
哪些呈碱性( ②⑤ )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
.
14
Exercises
3.科学使用化肥,是农作物高产的有利保证,为了同
时对农作物施用分别含N、P、K三种元素的化肥,
.
17
FeCl3溶液Fe3+能发生水解
Fe3+ + 3H2O
Fe(OH)3 + 3H+ 正反应吸热
因为Fe3+ 水解是个吸热反应
升温可以促进水解
(2)溶液的配制:
配制FeCl3 溶液时须加入 少量盐酸
因为Fe3+ 水解显酸性,加入少量的稀盐酸 可以提供酸性环境抑制水解
.
10
【应用四】纯碱去污
在碱性条件下油污(油脂) 分解能力强。
总式:Al3++3HCO3- = Al(OH)3↓+3CO2↑
.
8
【应用三】胶体的制备及溶液的配制
(1) Fe(OH)3胶体的制备: 向沸水中逐滴滴加饱和的 FeCl3 溶液,继续煮沸至溶液呈红褐色, 即停止加热。
为什么能用FeCl3溶液来制备 Fe(OH)3胶体呢?
Fe(OH)3胶体
.
9
【应用三】胶体的制备及溶液的配制
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O
NH3·H2O+ H+,
混施后,OH-与H+中和生成水,使两种盐的水解
平衡强烈地向右移动,以至生成大量的NH3·H2O,进 一步分解成NH3逸出了,从而降低了肥效。
.
13
Exercises
D 1. 若要配制 FeCl2溶液需要加入(
)
A、加少量稀盐酸 B、加少量氢氧化钠
明矾晶体
.
4
【应用一】 明矾净水
净水原理:
(1)第一步:溶解、电离
溶液中的离子有哪些?
K+、Al3+、SO42+、OH-、H+
思考:上述离子有哪些能发生水解反应?
.
5
【应用一】 明矾净水
(2)第二步:Al3+水解
Al3+ + 3H2O
Al(OH)3(胶体) + 3H+
生成Al(OH) 3 胶体,氢氧化铝胶粒的表面积大 吸附能力强,可以吸附水里悬浮的杂质,并形成沉淀,
