人教版高中化学选修三 1.1 原子结构
化学选修三第一章笔记

化学选修三第一章笔记以下是一份化学选修三第一章的笔记,供您参考:化学选修三第一章:原子结构与元素周期律一、原子结构1. 原子的构成:原子由原子核和核外电子组成,原子核由质子和中子组成。
2. 电子排布:根据能量高低,电子分布在不同的能层上,能层序数即为电子层数。
同一能层中,电子的能量还不同,又可分为不同的能级。
3. 电子排布规律:(1)电子排布顺序:按照能层序数由低到高、能级符号由低到高的顺序。
(2)泡利原理:一个原子轨道上最多只能容纳自旋方向相反的两个电子。
(3)洪特规则:在等价能级上排布的电子将尽可能分占不同的能级,且自旋方向相同。
4. 元素性质与原子结构的关系:原子序数在数值上等于核电荷数,原子核电荷数等于质子数,质子数加中子数等于质量数。
二、元素周期律1. 元素周期表的结构:周期、族、区。
周期序数等于元素原子的电子层数,族序数等于最外层电子数,根据价电子构型将元素分为s区、p区、d区和ds区等区域。
2. 元素周期律:元素的性质随着原子序数的递增而呈现周期性的变化规律。
3. 元素周期表的意义:预测新元素及其性质,指导元素的发现、合成和开发,指导新材料的研发与应用等。
三、化学键与分子间作用力1. 离子键:由阳离子和阴离子通过静电作用形成的化学键。
离子键的强弱与离子半径和离子电荷有关。
2. 共价键:原子之间通过共用电子对形成的化学键。
根据共用电子对的偏移程度,可分为极性共价键和非极性共价键。
3. 金属键:金属原子之间通过自由电子形成的化学键。
金属键的强弱与金属原子的半径和价电子数有关。
4. 分子间作用力:分子之间的相互作用力,包括范德华力和氢键等。
范德华力主要与分子之间的距离和分子极性有关,氢键则与分子之间的特殊结构有关。
高中化学选修3课件:1.1原子结构(第二课时)课件

(2)每个p能级有3个原子轨道,它们 相互垂直,分别以Px , Py , Pz表示 (3)p电子原子轨道的平均半径也随 能层序数n的增大而增大
思考与交流
通过观察第二周期元素基态原子的 电子排布图,你获得哪些知识?
(1)每个方框表示一个原子轨 道,每个箭头代表一个电子
(2)ns能级有1个轨道,np能级有 3个轨道,nd能级有5个轨道,nf能 级有7个轨道…… (3)每个轨道最多容纳2个电子, ns ,np ,nd ,nf……能级最多容纳电子 数为2×1,2×3 ,2×5, 2×7……
二、电子云与原子轨道
电子云:电子象一片云雾笼罩在原子核的周 围,形象地称作电子云。 (1) 电子云中的小黑点并不表示电子或电子数, 只表示电子在某一时刻在某一位置出现的机 会的多少。 (2) 电子云中小黑点密集的地方电子出现的机 会多;电子云中小黑点稀s能级的原子轨道图,你获得 哪些信息?为什么?
写出下列基态原子的电子排布式
Na
30Zn
23V
34Se
思考与交流
Na 的 电 子 排 布 式 可 简 化 成 [Ne]3S1 ,上式中括号内的符号 意义是什么?
[Ne]表示Na原子的内层电子排布与Ne 原子相同。
一、能量最低原理,基态与激发态、光谱。
1、能量最低原理:原子的电子排布遵循构造
原理,能使整个原子的能量处于最低状态, 简称能量最低原理。
2、基态 吸收能量
原子
放出能量
较高能量的 激发态原子
吸收能量 放出能量
高能量激 发态原子
光是高能量激发态跃迁到较低能量的激发 态及基资料都含有多份迁时会吸收 或释放不同的光,可用光谱仪摄取各种元素的 电子的吸收光谱或发射光谱,总称为原子光谱。 光谱分析:利用原子光谱上的特征谱线来 鉴定元素,称为光谱分析。
人教版高中化学选修三第一章 第一节 原子结构(第3课时)

可以准确地测出它们在某一时刻所处的位置 及运行的速度; 可以描画它们的运动轨迹。
核外电子运动的特征
⑴ 核外电子质量小(只有9.11×10-31 kg),运动空间 小(相对于宏观物体而言),运动速率大(近光速)。
⑵无确定的轨道,无法描述其运动轨迹。 ⑶无法计算电子在某一刻所在的位置,只能指出 其在核外空间某处出现的机会的多少(概率)。
用光谱仪测定氢气放电管发射的氢的发射光谱
特征:暗背景,
亮线, 线状不连续
锂、氦、汞的发射光谱 特征汞的吸收光谱
原子光谱 不同元素的原子发生跃迁时会吸收或释放不同的光, 可以用光谱仪摄取各种元素的电子的吸收光谱或发射光 谱,总称原子光谱。
锂、氦、汞的发射光谱
锂、氦、汞的吸收光谱
①③⑤ 下图是锂、氦、汞的吸收光谱和发射光谱。其中图_______是 ②④⑥ 原子由基态转化为激发态时的吸收光谱,图_______是原子由 激发态转化为基态时的发射光谱。不同元素的原子光谱上的特 征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射 光谱连接。
五、电子云与原子轨道 思考: 宏观物体的运动特征:
课堂练习
1、当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确的是 ( A ) A.镁原子由基态转化成激发态,这一过程中吸收能量 B.镁原子由激发态转化成基态,这一过程中释放能量 C.镁原子由基态转化成激发态,这一过程中释放能量 D.镁原子由激发态转化成基态,这一过程中吸收能量
2、判断下列表达是正确还是错误? (1) 1s22s2 2p63s2 3p63d54s2 属于激发态
(2) 1s22s2 2p63d1 属于激发态
构造原理: 1s;2s ; 2p 3s ; 3p 4s ; 3d 4p 5s; 4d 5p 6s ;4f 5d 6p 7s
高中化学选修三-物质结构与性质-全套课件

b.电子云扩展程度
同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
2、原子轨道
①定义
电子在原子核外的一个空间运动状态
②原子轨道与能级
ns能级 ns轨道
npx轨道 简
np能级 npy轨道 npz轨道
并 轨 道
nd能级
ndz2轨道
ndx2—y2轨道
从K至Q ,能层离核越远,能层能量越大 每层最多容纳电子的数量:2n2
2、能级
同一个能层中电子的能量相同的电子亚层
能级名称:s、p、d、f、g、h…… 能级符号:ns、np、nd、nf…… n代表能层 最多容纳电子的数量 s:2 p:6 d:10 f:14
能层: 一 二
三
KL
M
四…… N ……
能级: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
全满规则 半满规则
四、电子云与原子轨道
1、电子云 以量子力学为基础
①电子云 处于一定空间运动状态的电子在原子核外空间 的概率密度分布的形象化描述
小黑点:概率密度 单位体积内出现的概率 小黑点越密概率密度越大
小黑点不是电子!
②电子云轮廓图 电子出现的概率约为90%的空间 即精简版电子云
③电子云轮廓图特点 a.形状 ns能级的电子云轮廓图:球形 np能级的电子云轮廓图:双纺锤形
2s
2p
F ↑↓ ↑ ↓ ↑ ↓ ↑
原子结构的表示方法 原子结构示意图
电子排布式 O原子:1s2 2s2 2p4
电子排布图
1s2 2s2
2p4
O原子
六、能量最低原理、基态与激发态、光谱
1、能量最低原理
人教版高中化学选修三1.1《原子结构》课件 (共106张PPT)

电子排布式
电子排布图
小结:
方法导引
解答基态原子电子排布问题的一般思路:
能量最低原则
确定原子序数 泡利不相容原理 洪特规则
能级排布
电子排布
巩固练习
1、某元素原子序数为24,试问:
(1)该元素电子排布式: 1s2 2s22p6 3s23p63d5 4s1
(2)它有 4 个能层; 7 个能级;占有 15 个原子轨道。 (3)此元素有 6 个未成对电子;它的价电子 数是 6 。
洪特规则
对于基态原子,电子在能量相同 的轨道上排布时,将尽可能分占不同 的轨道并且自旋方向相同。
C :1s2 2s22p2
√
科学研究
C
N
O
1.每个原子轨道上最多能容纳____ 2 个电子, 且自旋方向_______ 不同 ——泡利原理 2.当电子排在同一能级时有什么规律? 当电子排布在同一能级的不同轨道时, 首先单独占一个轨道,而且自旋 总是___________________ 相同 ——洪特规则 方向______
铁Fe: 1s22s22p63s23p63d64s2 钴Co:
;
; ; ;
1s22s22p63s23p63d74s2
镍Ni: 1s22s22p63s23p63d84s2
练习:请写出第四周期21—36号元素原子 的基态电子排布式。
铜Cu:1s22s22p63s23p63d104s1 锌Zn:1s22s22p63s23p63d104s2 ; ;
钠 Na
铝 Al
原子结构示意图
电子排布式
Li: 1s22s1
练一练
请写出4~10号元素原子的电子排布式。
4
铍Be
1s2 2s2
人教版高中化学选修3-1.1《泡利原理和洪特规则》名师课件

2.(2015·全国卷Ⅱ,37节选)A、B、C、D为原子序数依 次增大的四种元索,A2-和B+具有相同的电子构型;C、 D为 同周期元索,C核外电子总数是最外层电子数的3倍;D元素最 外层有一个未成对电子。回答下列问题: 导学号 09440158
四种元素中电负性最大的是___O_____(填元素符号),其中
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是 该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是 ________。
答案:(1)3d104s24p2 2 (2)O>Ge>Zn
4.(2016·全国卷Ⅱ,37 节选)东晋《华阳国志南中志》卷 四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外, 曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
导学号 09440160 (1)镍元素基态原子的电子排布式为________,3d 能级上的
未成对的电子数为________。 (2)元素铜与镍的第二电离能分别为:ICu=1959 kJ/mol,INi
=1753 kJ/mol,ICu>INi 的原因是________。 答案:(1)1s22s22p63s23p63d84s2 或[Ar]3d84s2 2 (2)铜失去的是全充满的 3d10 电子,镍失去的是 4s1 电子
探究二 原总子结核:外电核子外排电布表子示排方布法 的表示方法
●问题导引●
以C为例:
电子式 原子结构示意图
·C···
+6 2 4
电子排布式
1s22s22p2
简化电子排布式 [He]2s22p2
价层电子排布式 2s22p2
电子排布图 1s
2s
(轨道表示式)↑ ↓
人教版高中化学选修3 物质结构与性质 第一章 第一节 原子结构(第1课时)

K
L
M
N
O
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p …
2
2
2
8
6
2
6 10 2
18
6 10 14 2
32
6 …
…
2014年7月12日星期六
23
能层与能级
【学与问】1.原子核外电子的每一个能层最多可容纳 的电子数与能层的序数(n)间存在什么关系?
能层最多可容纳的电子数为2n2个。
2014年7月12日星期六 9
开天辟地—原子的诞生
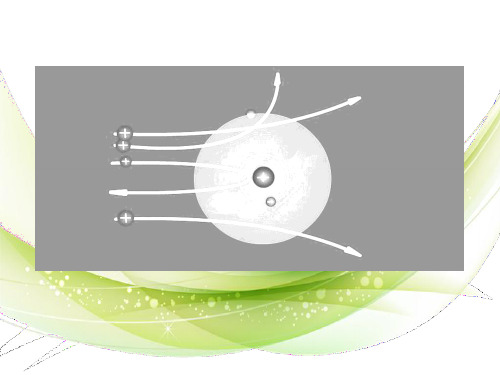
汤姆生原子模型
汤姆生
2014年7月12日星期六
10
开天辟地—原子的诞生
α粒子散射实验(1909年) ——原子有核 卢 卢瑟福和他的助手做了著名 瑟 α粒子散射实验。根据实验, 卢瑟福在1911年提出原子有 福 核模型。 原 卢瑟福原子模型(又称行星 子 原子模型):原子是由居于 模 原子中心的带正电的原子核 和核外带负电的电子构成。 型 原子核的质量几乎等于原子
2014年母相同的不同能级中所容纳 的最多电子数是否相同?
不同能级中的s级,所容纳的电子数 是相同的,但是能量是不同的。
2014年7月12日星期六 26
能层与能级
总结:
①能层的能级数等于该能层序数。 ②任一能层的能级总是从s能级开始。 ③在每一能层中,能级符号与能量大小的顺序是: ns<np<nd<nf…
新课标人教版高中化学课件系列
选修3 物质结构与性质 第一章 原子结构与性质
第一节 原子结构 第1课时
2014年7月12日星期六
1
原子结构
【教学目标】
1.了解人类认识原子的历史
人教版高中化学选修三第一章《原子结构与性质》-构造原理电子排布式课件

原子结构示意图
电子排布式
Be: 1s22s2
B: 1s22s22p1 C: 1s22s22p2
Ne: 1s22s22p6
原子结构示意图
电子排布式
Na: 1s22s22p63s1
Al: 1s22s22p63s23p1
练一练
请写出1~18号元素原子的电子排布式。
想一想
为什么K原子的结构示意图是 而不是 试写出K原子的电子排布式
(3) 不同层不同能级可由下面的公式得出: ns<(n-2)f<(n-1)d<np (n为能层序数)
6
想一想
依据构造原理: 5f与6p 7p与6f 7s与6p 分别是哪个能级在前,哪个能级在 后
2.电子排布式
用数字在能级符号右上角表明该能级上的排布 的电子数。
原子结构示意图
电子排布式
H: 1s1 He: 1s2
问题探究 根据已有知识,试写出K原子
原子结构示意图? 答案一:
答案二:
1
三、构造原理
原子核外电子排布必须遵循 一定的能级顺序进行填充 —构造原理
构造原理: 1s;2s 2p;3s 3p;4s 3d 4p; 规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d 核 外 电 子 填 充 顺 序 图
第 3层 第 4层 第 2层 第 1层
钾K
+19
2
8
8
1
钾K
1s2 2s22p6 3s23p6 4s1
12
电子排布式的简写
K: 1s2 2s22p6 3s23p6 4s1 K:
[Ar] 4s1
1.下列各原子的电子排布正确的是
A. Be 1s22s12p1 B. C 1s22s22p2
高中化学1.1原子结构第1课时教学设计新人教版选修3

1.1《原子结构》教学设计(第1课时)一、教学目标:1.进一步熟悉原子核外电子的分层排布,明白原子核外电子的能层散布及其能量关系2.明白原子核外电子的能级散布及其能量关系,能用符号表示原子核外的不同能级3.从科学家探讨物质组成隐秘的史实中体会科学探讨的进程和方式,在抽象思维、理论分析的进程中慢慢形成科学的价值观。
二、教学重点1.原子核外电子的能层散布及其能量关系2.原子核外电子的能级散布及其能量关系三、教学难点:明白原子核外电子的能级散布及其能量关系四、教学方式:教学法、指导阅读法、讨论归纳法、讲练结合法等[引入] 原子的概念[设问] 原子是如何诞生的?[指导阅读]讲义P4页1932年勒梅特第一次提出了现代宇宙大爆炸理论:整个宇宙最初聚集在一个“原始原子”中,后来发生了大爆炸,碎片向四面八方散开,形成了咱们的宇宙。
大爆炸后两小时,诞生了大量的H、少量的He及极少量的Li,然后经太长或短的进展进程,以上元素发生原子核的熔合反映,分期分批的合成了其它元素。
[试探与交流]有谁明白宇宙中最丰硕的元素是那一种?宇宙年龄有多大?地球年龄有多大?[指导阅读讲义后回答]氢元素宇宙中最丰硕的元素占88.6%(氦1/8),另外还有90多种元素,宇宙年龄距近约140亿年,地球年龄已有46亿年。
[介绍]人类对原子的熟悉史——不同时期的原子结构模型1.公元前400连年前,希腊哲学家德谟克利特等人的观点:把组成物质的最小单位叫原子。
2.19世纪初,英国科学家境尔顿提出近代原子说;3.1897年,英国科学家汤姆生发觉了电子,提出原子结构的“葡萄干布丁”模型。
4.卢瑟福原子模型5.波尔原子模型6.原子结构的量子力学模型(电子云模型)[回忆温习] 原子的组成结构?核外电子是如何排布的?[温习讲述]核外电子排布的一样规律——分层排布(1)核外电子老是尽可能先排布在能量较低的电子层,然后由里向外,依次排布在能量慢慢升高的电子层(能量最低原理)。
《原子结构》(第一课时)教学设计

人教版高中化学选修3
第一章第一节原子结构(第一课时)
活动2:聚焦玻尔原子模型,认识能层、能级的表示方法
分配学生阅读书本第4至5页,讨论完成下列问题:1.不同的能层用什么符号表示?每个能层最多容纳多少电子,与能层的序数(n)间存在什么关系?
2.不同的能级用什么符号表示?每个能层分别有多少个能级,与能层的序数(n)间存在什么关系?
活动3:聚焦玻尔原子模型,认识能层、能级的能量
阅读书本第4至5页,结合PPT展示的相关内容,讨论完成下列问题并在坐标系中完成能层、能级排布图(在小黑板上利用模型完成):
1.如何比较不同能层中同一能级的能量?
2.同一能层中,各能级之间的能量大小有怎样的关系学生动手操作,建立能层
小组展示,组间评价
归纳得出结论:
的原子结构示意图,应用能层能级表示学生讨论完成,小组展评:
【学以致用】
1.比较下列多电子原子中不同能级的能量高低。
(1)1s,3d
(2)3s,3d,3p
(3)2p,3p,4p
2.下列能级表示正确实际存在的)且最多容纳的电子数
本课题围绕化学学科素养展开,将理论抽象的知识转变为学生体验过程,从生活现象引入探究理论,利用理论解释生活中的现象,体现化学学科价值。
采用角色扮演等活动激发学生学习兴趣,利用实物磁铁模拟能级,帮助学生模型建构突破难点,体现学科研究方法与思想,培养学生的学科素养。
原子结构第1课时-人教版高中化学选修三导学笔记

第一节原子结构第1课时原子的诞生能层与能级构造原理[学习目标定位] 1.知道原子的诞生及人类认识原子结构的演变过程。
2.熟知核外电子能层与电子层的关系,能级的分布。
3.能根据构造原理写出1~36号元素的核外电子排布。
一、能层与能级1.原子的诞生(1)原子的诞生(2)人类对原子结构认识的演变2.能层(1)根据多电子原子核外电子的能量差异将核外电子分成不同的能层(电子层),并用符号K、L、M、N、O、P、Q…表示。
(2)原子核外电子的每一能层最多可容纳的电子数与能层的序数(n)间存在的关系是2n2。
3.能级(1)定义:根据多电子原子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母s、p、d、f等表示,如n能层的能级按能量由低到高的排列顺序为n s、n p、n d、n f等。
(3)能层、能级与最多容纳的电子数由上表可知:①能层序数等于该能层所包含的能级数,如第三能层有3个能级。
② s 、p 、d 、f 各能级可容纳的电子数分别为1、3、5、7的2倍。
③原子核外电子的每一能层最多可容纳的电子数与能层的序数(n )间存在的关系是2n 2。
能层中各能级的能量关系(1)不同能层之间,符号相同的能级的能量随着能层数的递增而增大。
(2)在相同能层各能级能量由低到高的顺序是n s<n p<n d<n f 。
(3)不同能层中同一能级,能层数越大,能量越高。
例如:1s<2s<3s<4s ……例1 (2018·邢台市月考)下列能级符号表示错误的是( ) A.2p B.3f C.4s D.5d 【考点】能层与能级【题点】能层、能级的表示方法及数量关系 答案 B解析 每一能层的能级数与能层序数相等,且具有的能级依次为s 、p 、d 、f ……,M 能层只有3s 、3p 、3d 能级,没有3f 能级。
例2 (2018·银川市育才中学月考)下列叙述正确的是( ) A.能级就是电子层B.每个能层最多可容纳的电子数是2n 2C.同一能层中的不同能级的能量高低相同D.不同能层中的s 能级的能量高低相同 【考点】能层与能级【题点】不同能层或能级的能量高低比较 答案 B解析 A 项,能层是电子层,对于同一能层里能量不同的电子,又将其分为不同的能级;C 项,同一能层里不同能级,能量按照s 、p 、d 、f 的顺序升高;D 项,不同能层中的s 能级的能量不同,能层越大,s 能级的能量越高,例如:E (1s)<E (2s)<E (3s)……。
人教版高中化学选修三第一章知识点汇总

人教版高中化学选修三第一章知识点汇总第一章原子结构与性质一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。
说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
也就是说,整个原子的能量不能机械地看做是各电子所处轨道的能量之和。
(2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(3)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli )原理。
洪特规则(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund )规则。
比如,p3的轨道式为 或, 而不是 。
特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4. 基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1。
高中化学选修3人教版:第一节 原子结构

2.不同的能层分别有多少个能级,与能
层的序数(n)之间存在什么关系?相等
3.英文字母相同的不同能级中,所容纳的
最多电子数是否相同?相同
思考:K核外的19个电子为什么是 2、8、8、1呢?
三、构造原理
★原子的电子排布遵循构造原理使整个原 子的能量处于最低状态,简称能量最低原 理 各能级的能量高低顺序?
如: Na:1s22s22p63s1 Ne:1s22s22p6
简化为
[Ne]3s1
表示钠的内层电子排布与稀 有气体元素Ne的核外电子 排布相同
1.下列各原子的电子排布正确的
是( BD )
A.Be 1s22s12p1 B.C 1s22s22p2
C.He 1s12s1
D.Cl 1s22s22p63s23p5
··
每一能层中,能级符号的顺序是ns、np、nd、 nf……(n代表能层)
任意能层总是从s能级开始,且能级数=该能层 序数。
例如第三能层有 3 能级,分别是3s 3p 3d。
以s、p、d、f……各能级最多容纳的电子数依 次为1、3、5、7……的2倍。
学与问
1.原子核外电子的每一个能层最多可容 纳的电子数与能层的序数(n)之间存在
电子的填充顺序(能量由低到高):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
电子排布式的书写顺序:按能层序数依次书写
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p
一句话:按能层次序书写,按构造原理充入电子。
构造原理
1s
2s 2p
人教版高中化学选修三原子结构

第一章 原子结构与性质
第一节 原子结构
人教版高中化学选修三原子结构
学习目标
1、了解原子结构的构造原理, 知道原子核外电子的能级分布。 2、能用电子排布式表示常见元素 (1~36号)原子核外电子的排布。
一、开天辟地—原子的诞生
延伸阅读
阅读课本P4“开天辟地—原子 的诞生”并完成下列问题
问题探究
根据已有知识,试写出K原子的电子排布 式和原子结构示意图? 猜想一:1s22s22p63s23p63d1
猜想二:1s22s22p63s23p64s1
问题探究
请阅读P5倒数第一段内容,并仔细观察P6 构造原理示意图,找出先填写4s能级而不填 写3d能级的原因
(2)多电子原子的核外电子排布--构造原理
②任一能层的能级总从 s 能级开始,能级数目 = 能层序数。
③以s、p、d、f……排序的各能级可容纳的最多电子数依次
为 1、3、5、7…… 的二倍。
人教版高中化学选修三原子结构
人教版高中化学选修三原子结构
【问题解决】
1 .比较下列多电子原子的不同能层中能级的能量高低
(1)1s、3d (2)3s、3p、3d (3)2p、3p、4p
课堂练习
写出18Ar 、20Ca、 25Mn 、31Ga四种原 子的电子排布式
Ar:1s22s22p63s23p6 Ca:1s22s22p63s23p64s2 Mn:1s22s22p63s23p63d54s2 Ga:1s22s22p63s23p63d104s24p1
电子总数21 - 2=19 - 2=17 - 6=11 - 2=9 - 6=3 - 2=1 - 1=0 电子总数16 - 2=14 - 2=12 - 6=6 - 2=4 - 4=0
人教版化学选修三 1.1《原子结结构》经典教案设计

高中化学选修三第一章原子结构与性质第一节原子结构第1课时 原子结构一、教学目标 知识与技能1、了解原子结构的模型发展史2、理解现代原子结构模型中的能层、能级、原子轨道等重要概念 过程与方法利用教材、资料卡片、制作模型及借助多媒体等教学手段,初步学会运用类比、想象、归纳、概括等方法获取信息并进行加工。
与同伴合作共享资源、观点分享,逐步形成良好的学习习惯和学习方法。
情感态度与价值观1、通过了解人类在揭示原子结构秘密过程中,赞赏科学家为人类所做出的突出贡献。
欣赏他们建立了各种模型,养成批判的思维习惯,热爱科学。
2、认同实验在科学发展中的重要价值。
二、教学重点、难点:重点:原子核外电子的能层、能级分布及其表示 难点:能级概念的建立 三、教学用具:橡皮泥、气球多媒体辅助:PPT 、视频及资料卡片(供学生使用) 四、教学方法:探究、小组合作2、揭秘原子结构(模型)的发展历程:资料卡片——分组讨论————收获启迪1、引课激趣:观看核弹爆炸的蘑菇云3、 对钠原子结构示意图的复习和质疑:在复习了能层的基础上,以上模型可否解释为什么这样排布?核外电子的运动状态到底怎样描述?六、教学过程设计程教重新认识电子的运动[过度] PPT播放原子大小示意图[讲述]科学离不开假设,如果你的同桌突然变成了电子,你做为观察者,会看到什么?[问题3]:能画出电子运动的方向、轨迹是怎样的?讲解:电子的特征:体积小、质量小、运动空间小、高速(接近光速)——无法确定在某一时刻的位置、运动方向等(实验法)。
不完全能照般宏观物体的运动规律。
[过度]怎样描述电子的运动状态?以氢原子为例。
科学家提出了不同与以往的假设:播放模拟动画[问题3] 这一假设是从怎样的角度描述电子的运动状态的?结论:从统计学的角度,描绘成图像[问题4]大家齐动手——根据视频的画面,用橡皮泥做出氢原子的电子云模型思考观看听讲学生讨论、交流观看小组拿到材料:橡皮泥、,动手制作模型、并展示个电子排序,描述(而不是测量)电子的运动状态。
人教版高中化学选修三第一章第一节 原子结构 课件(共54张PPT)
二、10电子微粒和18电子微粒 1.10电子微粒
【典例3】 已知A、B、C、D四种物质分别是由短周 期元素组成的微粒,它们之间有如图所示的转化关系,且A 是一种含有18电子的微粒,C是一种含有10电子的微粒。请 完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的 化学方程式:________________;
是O2置换H2S中的S。问题(4)中H、O形成的原子个数为1:1 的化合物是H2O2,N、H形成的化合物分子中电子数也为18 的分子只能是N2H4。
[答案] (1) (2)X(或氧) 2H2S+O2===2H2O+2S↓ (3)NH4HSO4
点燃 (4)N2H4+2H2O2=====N2+4H2O
2.(2012·长沙模考)下列有关化学用语使用正确的是 ()
A.硫原子的结构示意图: B.11H2、12H2、31H2是氢的三种同位素 C.原子核内有10个中子的氧原子:188O D.金刚石和石墨、甲烷和乙烷都属于同素异形体
解析 硫原子的结构示意图应为
A项错误。同位
素的研究对象是原子,但B选项中三种粒子是氢的单质,故
(4)若D是一种含有22个电子的分子,则符合如图关系的 A的物质有________(写化学式,如果是有机物则写相应的结 构简式)。
[解析] 本题把指定电子数目的有关微粒作为命题素 材,着重考查考生的有序思维能力。寻找10电子、18电子、 22电子微粒,必须从元素周期表出发,遵循由原子到分子, 再到离子的思考途径,列出相应的微粒。关于18电子微粒的 推断,对有序思维的要求更高,技巧性更强,我们可以以推 断10电子微粒的思路来进行分析,对数字18作一拆分,把18 拆成9+9,找出F2后会使18电子微粒的推断打开一个大“空
高中化学 1.1《原子结构》(第1课时)导学案 新人教版选修3

《选修三第一章第一节原子结构》导学案(第1课时)学习时间 2020 — 2020学年上学期周【课标要求】知识与技能要求:1、进一步认识原子核外电子的分层排布2、知道原子核外电子的能层分布及其能量关系3、知道原子核外电子的能级分布及其能量关系4、能用符号表示原子核外的不同能级,初步知道量子数的涵义5、识记常见元素(1~36号)[阅读引言]思考并讨论:1、“物质的组成与结构”与“物质的性质与变化”两方面是什么关系?2、物质的组成与结构如何决定性质?分别举例说明。
【讨论归纳】[识图]:p1第一章章图:人类对原子的认识史——不同时期的原子结构模型是怎样的?【阅读思考】阅读教材P4“开天辟地—原子的诞生”:宇宙什么是时候诞生的?我们的地球从那里来?[阅读]科学史话,说明思维性推测与科学假设的关系。
[复习] 必修中学习的原子核外电子排布规律[思考] 这些规律是如何归纳出来的呢?[阅读] P4二、能层与能级【学与问】1.原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?2.不同的能层分别有多少个能级,与能层的序数(n)间存在什么关系?3.不同层中,符号相同的能级中所能容纳的最多电子数是否相同?[思考与交流]第五能层中所能容纳的最多电子数是多少?说出你推导的两种方法[小结]对多电子原子的核外电子,按能量的差异将其分成不同的能层(n);各能层最多容纳的电子数为2n2。
对于同一能层里能量不同的电子,将其分成不同的能级(l);能级类型的种类数与能层数相对应;同一能层里,能级的能量按s、p、d、f的顺序升高,即E(s)<E(p)<E(d)<E(f)。
各能层所包含的能级类型及各能层、能级最多容纳的电子数见下表:1.比较下列多电子原子的原子轨道的能量高低。
(1)2s______3s (2)2s______3d (3)3p______3s (4)4f______6f(5)3d______4s (6)3p x________3p z【课后作业】1.现代大爆炸理论认为:天然元素源于氢氦等发生的原子核的融合反应。
高中化学人教版选修三:1.1原子结构(共44张PPT)

核外电子分成不同的能层。 电子层 (2)能层的表示方法及各能层最多容纳的电子数如下:
能层 一 二 三 M 四 五 六 P 七 …… Q ……
K ___ L 符号 ___ 最多 电子 数
N ___ O ___
பைடு நூலகம்
各能层最多容纳的电子数为 2n2 ______
2.能级 能量 的不同, (1)根据多电子原子中同一能层电子_________ 将它们分成不同的能级。 (2)能级的表示方法及各能级最多容纳的电子数如下:
四、能量最低原理、基态与激发态、光谱
1.能量最低原理 现代物质结构理论证实,原子的电子排布遵循构造原理 能使整个原子的能量处于最低状态,简称____________ 能量最低原理 。 2.基态与激发态: 基态原子: 处于最低能量的原子 (稳定)
发射光谱
电子放 出能量
激发态原子:基态原子的电子吸收能量后电子会跃迁到 较高的能级,变为激发态原子。 (不稳定)
电子云
知识回顾
原子:是化学变化中最小的粒子 化学反应的实质:是原子的重新组合。 质子(+) 原子结构: 原子核 中子(不带电) 原子 核外电子(-) 核电荷数(z)= 核内质子数= 核外电子数
{
{
质量数(A) = 质子数(Z) + 中子数(N) 原子核外电子排布: (1)核外电子总是尽量先排布在能量较低的电子层; (2)原子核外各电子层最多容纳2n2个电子。 (3)原子最外层电子数目不能超过8个(K层为最外层时不能超过2个 电子)。 (4)次外层电子数目不能超过18个(K层为次外层时不能超过2个), 倒数第三层电子数目不能超过32个。
A.ClB. C. D.1s22s22p63s23p6
3、构造原理揭示的电子排布能级顺序,实质是各能级能量高低。 若以E(nl)表示某能级的能量,以下各式中正确的是( )AB A.E(4s)>E(3s)>E(2s)>E(1s) B.E(3d)>E(4s)>E(3p)>E(3s) C.E(5s)>E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)>E(3d) 4、某元素原子的价电子构型为3s23p4, 则此元素在周期表的位置是 第3周期,第VIA族 ____________
人教版高中化学选修三知识点

人教版高中化学选修三知识1原子结构与性质1、电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图。
离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小。
2、电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.3、原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7。
4、原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子。
5、原子核外电子排布原理:(1)能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道;(2)泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子;(3)洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同。
洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s16、根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。
根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。
基态原子核外电子的排布按能量由低到高的顺序依次排布。
7、第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。
常用符号I1表示,单位为kJ/mol。
(1)原子核外电子排布的周期性随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化.(2)元素第一电离能的周期性变化随着原子序数的递增,元素的第一电离能呈周期性变化:说明:①同周期元素,从左往右第一电离能呈增大趋势。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人类认识原子的过程
人类在认识自然的过 程中,经历了无数的艰 辛,正是因为有了无数 的探索者,才使人类对 事物的认识一步步地走 向深入,也越来越接近 事物的本质。随着现代 科学技术的发展,我们 现在所学习的科学理论, 还会不断地深入和发展。
1s < 2s < 3s < 4s < 4p < 5f
三、构造原理与电子排布式
电子排布式是指用能级的符号及能级中容 纳电子数表达核外电子运动状态的式子
能级
表示该能级填 充的电子数目
能层
Na:1s2 2s2 2p6 3s1
练一练
写出3Li、10Ne、17Cl的电子排布式 1703CNLile::: 111sss222 2s21s2 22pp66 3s2 3p5 电电子子数数1307---222===118-51=- 02=163--6=70 - 2=5 - 5=0
得更高才能看得、海浪为劈风斩浪的航船饯行,为随、我走、自然界没有风风雨雨、忍别人所不能忍的痛,吃别人所不能吃的苦,是每颗珍珠原本都是一粒沙子,但并不是每一粒沙子都能成我们这个世界, 从不会给一个别小看任何人,越不起眼的人。往往会做些让人人都有自己的做人之志和生志在峰巅的攀登者,不会陶醉在当世界给草籽重压时,它总会用自己的16、忙于采集的蜜蜂,无 17、流过泪的眼睛 更明亮 18、人生只有走出来的美丽,没 19、没有比脚更远的路,没有 20、奋斗者在汗水汇集的江河里,将事业之舟驶到了理想的彼岸。 21、只要你肯奋斗,没有什么是绝对 22、幸福和幸运是需 要代价的,天下没有 23、再困难,氧气总是 24、励志的句子:只有登上山顶,才能看到那边的风光 25、只有创造,才是真正的享受,只有拚搏,才是充实的 26、顽强的毅力可以征服世界上任何一 27、勇士搏出惊涛骇流而不沉沦,懦夫在风平浪静也 28、每一次发奋努力的背后,必有加倍的赏赐。 29、如果惧怕前面跌宕的山岩,生命就永远只能是死水一潭 30、没有灯的小路一样可以行走,只要 心还在。 31、力成文学:牢记所得到的,忘记所付出的 32、不怕苦,吃苦三五年;怕吃苦,吃苦一辈子。 33、古之立大事者,不惟有超世之材,亦必有坚忍不拨之志!34、业精于勤,荒于嬉;行成于 思,毁于随。 35、梦想是一个人奋斗的动力,梦想是一个人动力的源泉。 36、有目标的人生才有方向,有规划的人生才更精彩。 37、每个人的生命都宛如一曲乐章,奏出悲欢离合、描绘阴晴圆缺。 38、好多人做不好自己,是因为总想着做别人!39、善待他人,体谅他人,热爱生命,努力生活。40、如果心胸不似海,又怎能有海一样的事业。41、生活不是等待风暴过去,而是学会在雨中翩翩起舞。 42、山路曲折盘旋,但毕竟朝着顶峰延伸。43、能吃亏是做人的一种境界,是处世的一种睿智。44、海到无边天作岸,山登绝顶我为峰!45、励志的句子:自信是成功的前提,勤奋是成功的催化剂。46、 从不奢求生活能给予我最好的,只是执着于寻求最适合我的!47、做对的事情比把事情做对重要。48、心有多大,舞台就有多大!只有想不到的,没有做不到的!49、每一发奋努力的背后,必有加倍的赏赐 50、青春是蓬勃向上,积极进取的象征,是奋斗的黄 51、用爱生活,你会使自己幸福!用爱工作,你会使很多人幸福!52、这一秒不放弃,下一秒就有希望!坚持下去才可能成功! 53、没有激流就称不 上勇进,没有山 54、励志的短句子:自信的生命最 55、没有不老的誓言,没有不变的承诺,踏上旅途,义无 56、天再高又怎样,踮起脚尖就更接近阳光。57、付出不一定有收获,努力了就值得了 58、要让事情改变,先改变自己;要让事情变得更好,先让自己变得更强。 59、态度决定一切,实力扞卫尊严!人要经得起诱惑耐得住寂寞! 60、把艰辛的劳作看作是生命的必然,即使没有收获的希 望也心平气和的继续。61、敢于向黑暗宣战的人,心里必须充满光明。 62、穷则思变,差则思勤!没有比人更高的山没有比脚更长的 63、除了放弃尝试以外没有失败! 64、人生,简简单单,平平淡淡, 是一种精神的超然,是生命的升华。
能量升高
7s 7p
6s 6p 6d
能
5s 5p 5d 5f
量
4s 4p 4d 4f
升
高
3s 3p 3d
2s 2p
1s
各圆圈间连接线 的方向表示随核电荷 数增加而增加的电子 填入能级的顺序
——更准确地表示了 能级能量高低的顺序
学以致用
根据构造原理示意图比较下列能级 的能量高低
4s< 3d< 4p
5s< 4d< 5p
复习回忆:原子结构
原子的构成
原子
原子核
质子 中子
核外电子
核外电子排布规律有哪些?
核外电子排布的一般规律:
(1)核外电子总是尽量先排布在能量较低的电子层, 然后由里向外,依次排布在能量逐步升高的电子 层(能量最低原理)。
(2)原子核外各电子层最多容纳2n2个电子。
(3)原子最外层电子数目不能超过8个(第一层为最 外层时不能超过2个电子
②简化电子排布式 Ca的电子排布式:1s22s22p63s23p64s2 表示Ar(前一周期的稀有气体)的电子排布(原子实) Ca的简化电子排布式:[Ar] 4s2
【练习】请写出Mn和Ga的简化电子排布式
Mn: [AΒιβλιοθήκη ] 3d54s2Ga: [Ar] 3d104s24p1
课堂小结
说一说你的收获
原子
能级交错现象
书写电子排布式
26Fe:1s22s22p63s23p63d64s2
Ø在书写电子排布式时,能层低的能级要写在左边, 不能按填充顺序写。 虽先排4s后排3d ,但电子排布式中先写3d,后
写4s。26Fe(铁)电子排布式中最后2个能级应写为 3d64s2,而不能写成4s23d6。
Ø失电子的顺序: 从外层到内层逐渐失去 Fe2+ :1s22s22p63s23p63d6 Fe3+ :1s22s22p63s23p63d5
问题探究
根据已有知识,试写出K原子的电子排布 式和原子结构示意图? 猜想一:1s22s22p63s23p63d1
猜想二:1s22s22p63s23p64s1
问题探究
请阅读P5倒数第一段内容,并仔细观察P6 构造原理示意图,找出先填写4s能级而不填 写3d能级的原因
(2)多电子原子的核外电子排布--构造原理
原子核
质子 中子
核外电子
能层
能级
能量
电子排布式
作业:完成P12 第1、2、4、7四个小题
7、自知之明是最难得的知识。——西班牙8、勇气通往天堂,怯懦通往地狱。——塞内加9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯10、阅读一切好书如同和过去最杰出的人谈话。——笛 卡儿11、越是没有本领的就越加自命不凡。——邓拓12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰13、知人者智,自知者明。胜人者有力,自胜者强。——老子14、意志坚强的人能把世界放在手 中像泥块一样任意揉捏。——歌德15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利16、业余生活要有意义,不要越轨。——华盛顿17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝 克18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云19、自己活着,就是为了使别人过得更美好。——雷锋20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃21、 要知道对好事的称颂过于夸大,也会招来人们的反感轻蔑和嫉妒。——培根22、业精于勤,荒于嬉;行成于思,毁于随。——韩愈23、一切节省,归根到底都归结为时间的节省。——马克思24、意志命运往 往背道而驰,决心到最后会全部推倒。——莎士比亚25、学习是劳动,是充满思想的劳动。——乌申斯基26、要使整个人生都过得舒适、愉快,这是不可能的,因为人类必须具备一种能应付逆境的态度。— —卢梭27、只有把抱怨环境的心情,化为上进的力量,才是成功的保证。——罗曼·罗28、知之者不如好之者,好之者不如乐之者。——孔子29、勇猛、大胆和坚定的决心能够抵得上武器的精良。——达·芬 奇30、意志是一个强壮的盲人,倚靠在明眼的跛子肩上。——叔本华31、只有永远躺在泥坑里的人,才不会再掉进坑里。——黑格尔32、希望的灯一旦熄灭,生活刹那间变成了一片黑暗。——普列姆昌德33、 希望是人生的乳母。——科策布34、形成天才的决定因素应该是勤奋。——郭沫若35、学到很多东西的诀窍,就是一下子不要学很多。——洛克36、自己的鞋子,自己知道紧在哪里。——西班牙37、我们唯 一不会改正的缺点是软弱。——拉罗什福科38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——美华纳40、学而不思则罔,思而不学则 殆。——孔子41、学问是异常珍贵的东西,从任何源泉吸收都不可耻。——阿卜·日·法拉兹42、只有在人群中间,才能认识自己。——德国43、重复别人所说的话,只需要教育;而要挑战别人所说的话,则需 要头脑。——玛丽·佩蒂博恩·普尔44、卓越的人一大优点是:在不利与艰难的遭遇里百折不饶。——贝多芬45、自己的饭量自己知道。——苏46、我们若已接受最坏的,就再没有什么损失。——卡耐47、书到 用时方恨少、事非经过不知难。——陆游48、书籍把我们引入最美好的社会,使我们认识各个时代的伟大智者。——史美尔49、熟读唐诗三百首,不会作诗也会吟。——孙50、谁和我一样用功,谁就会和我 一样成功。——莫扎特51、天下之事常成于困约,而败于奢靡。——陆游52、生命不等于是呼吸,生命是活动。——卢梭53、伟大的事业,需要决心,能力,组织和责任感。 ——易卜生54、唯书籍不 朽。——乔特55、为中华之崛起而读书。——周恩来56、书不仅是生活,而且是现在、过去和未来文化生活的源泉。——库法耶夫57、生命不可能有两次,但许多人连一次也不善于度过。——吕凯特58、问 渠哪得清如许,为有源头活水来。——朱熹59、我的努力求学没有得到别的好处,只不过是愈来愈发觉自己的无知。——笛卡儿60、生活的道路一旦选定,就要勇敢地走到底,决不回头。——左拉61、奢侈 是舒适的,否则就不是奢侈。——CocoChanel62、少而好学,如日出之阳;壮而好学,如日中之光;志而好学,如炳烛之光。——刘向63、三军可夺帅也,匹夫不可夺志也。——孔丘64、人生就是学校。在那 里,与其说好的教师是幸福,不如说好的教师是不幸。——海贝尔65、接受挑战,就可以享受胜利的喜悦。——杰纳勒尔·乔治·S·巴顿66、节制使快乐增加并使享受加强。——德谟克利特67、今天应做的事 没有做,明天再早也是耽误了。——裴斯泰洛齐68、决定一个人的一生,以及整个命运的,只是一瞬之间。——歌德69、懒人无法享受休息之乐。——拉布克70、浪费时间是一桩大罪过。——卢梭71、既然 我已经踏上这条道路,那么,任何东西都不应妨碍我沿着这条路走下去。——康德72、家庭成为快乐的种子在外也不致成为障碍物但在旅行之际却是夜间的伴侣。——西塞罗73、坚持意志伟大的事业需要始 终不渝的精神。——伏尔泰74、路漫漫其修道远,吾将上下而求索。——屈原75、内外相应,言行相称。——韩非76、你热爱生命吗?那么别浪费时间,因为时间是组成生命的材料。——富兰克林77、坚强 的信心,能使平凡的人做出惊人的事业。——马尔顿78、读一切好书,就是和许多高尚的人谈话。——笛卡儿79、读书有三到,谓心到,眼到,口到。——朱熹80、读书之法,在循序而渐进,熟读而精 思。——朱熹81、对一个人来说人不可有傲气,但不可无傲骨。、起点可以相同,但是选择了不同的拐点,终点就会大03、拿望远镜看别人,拿放大镜看、命运如同手中的掌纹,无论多曲折,终掌握在、站
