第六章理想气体的热力过程
理想气体的热力学过程
6
dV d p 0 V p
式中
Cp CV
, 在温度变化不很大时,可以看作常量。
将上式积分,得
ln V + ln p = 恒量
pV γ 恒量 或 这个关系称为泊松 (S.D.Poisson)公式。
根据泊松公式和理想气体物态方程, 可以分别得到
TV γ 1 恒量
T γ pγ 1 恒量
Qp = H 气 H水
= (2676.3103 419.06103 ) Jkg1
= 2257.2103 Jkg1
16
17
经绝热过程压缩气体做的功:
CV 20.44J mol K
1
1
m 4 A CV T2 T1 4.70 10 J M
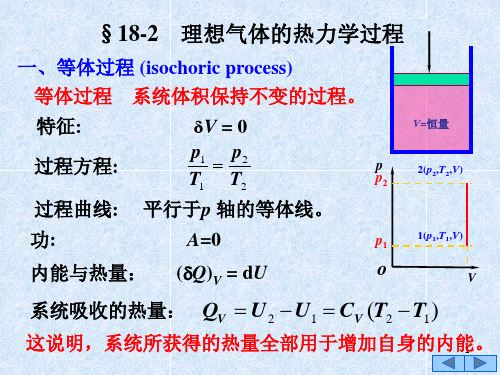
在等压过程中,系统从外界获得的热量,一部分用 以增大内能,一部分用以对外作功。 三、等温过程 (isothermal process) 等温过程 特征: 过程方程: 系统的温度保持恒定的过程。 T=0
p1V1 p2V2
p p1
T=恒量
恒温热源
1(p1,V1,T)
过程曲线:
内能增量:
等温线为等轴双曲线。
=1.40,可得:
p2 T2 T1 p 1
1 /
1 300 50
0.286
98.0K
19
例6 一定质量的理想气体先后经历 P 两个绝热过程即1态到2态,3态到4
态(如图所示)且T1=T3、T2=T4,在 1态与3态,2态与4态之间可分别连 接 两 条 等 温 线 。 求 证 :
考虑到 T1=T3,T2=T4,
T2 V1 1 2 T1 V2
理想气体热力过程及气体压缩

过程方程依据:过程方程线 p=f(v)2.确定初终 状态参数依据:状态方程 3.p-v 图与 T-s 图分 析 4.求传递能量,依据能量方程:Q-W=U 二、 参数关系式及传递能量(见下表)4.2 多变过程 已知某多变过程任意两点参数 ,求 n 一、多变过
轴功全部转化成热能向外放出.=2. 定熵压缩轴 功的计算,按稳态稳流能量方程 ,绝热压缩消耗 的轴功全部用于增加气体的焓 , 使气体温度升 高 ,该式也适用于不可逆过程 3. 多变压缩轴功 的计算按稳态稳流能量方程 , 多变压缩消耗的轴 功部分用于增加气体的焓 ,部分对外放热 ,该式 同样适用于不可逆过程结论 :可见定温过程耗功 最少 ,绝热过程耗功最多 4.4 多级压缩及中间 冷却由即:压力比越大 ,其压缩终了温度越高 , 较高的压缩气体常采用中间冷却设备 ,称多级压 气机.最佳增压比: 使多级压缩中间冷却压气机
出和吸收热量相等.4.5 活塞式压气机余隙影响 一 、余隙对排气量的影响余隙:为了安置进 、排 气阀以及避免活塞与汽缸端盖间的碰撞 ,在汽缸 端盖与活塞行程终点间留有一定的余隙 ,称为余 隙容积 ,简称余隙活塞式压气机的容积效率:活 塞式压气机的有效容积和活塞排量之比 ,结论: 余隙使一部分汽缸容积不能被有效利用 ,压力比 越大越不利 。二 、余隙对理论压缩轴功的影响式 中: 为实际吸入的气体体积 。结论:不论压气机 有无余隙 ,压缩每 kg 气体所需的理论压缩轴功 都相同 ,所以应减少余隙容积 。本章重点结合热
p1=1bar ,t1=5℃ 。若对 A 中的气体缓慢加热(电 热),使气体缓慢膨胀 ,推动活塞压缩 B 中的气 体,直至 A 中气体温度升高至 127℃ 。试求过程 中 B 气体吸取的热量 。设气体 kJ/(kmol·K), kJ/(kmol·K) 。气缸与活塞的热容量可以忽略不 计。
理想气体的绝热过程

4
1
3
2
V
3
2
mol
1-2为绝热压缩过程
P
3
2
绝热线
V T V T
1 1
2 1 1
2
V V
1
2
1
1
T T
T T
4
1
2
3-4为绝热膨胀过程
a 吸气 排气
o
V1 V2
1
V
V T V T
1 1
1 3 2
4
1
V V
p1 o
a
b
d
V
V1 2V1 3 3 Qbc CV (Tc Tb ) R(Tc Tb ) ( pcVc pbVb ) 3 p1V1 2 2 11 Qcd 0
Q
abcd
2
pV
1
1
方法二:对abcd整个过程应用热力学第一定律: p
Qabcd Aabcd Ead
4-5
一、绝热过程
理想气体的绝热过程
系统不与外界交换热量的过程。 dQ dE pdV dQ 0 , pdV dE
V2
V1
M pdV CV ( T2 T1 ) M mol
绝热过程中系统对外做功全部是以系统内能 减少为代价的。 气体绝热自由膨胀 绝热方程 Q=0, W=0,△E=0 pV 恒量
c
a b d V1 2V1 V
M RT 又根据物态方程 pV M mol
Ta Td
p1V1 Td Ta R
p pcVc 4 p1V1 Tc 4Ta R R 2p1 1 1 再根据绝热方程 TcVc TdVd
理想气体的热力性质及基本热力过程

在p-v图中,绝热过程线比定温 过程陡,均为双曲线; 在T-s图中,定容过程线比定压 过程陡,均为指数曲线。
①n顺时针方向增大。两图的过 程线和区间一一对应。 ②dv>0, 功量为正。 ③ds>0, 热量为正。 ④dT>0→du>0,dh>0。
9
概念:定温过程是工质在变化过程中温度保持不 变的热力过程。对理想气体,定温过程也是定热 力学能过程和定焓过程。 u 0 1、过程方程式: T = 定值 h 0 2、基本状态参数间的关系式:
p1v1 p 2 v2 T1 T2
p1v1 p2v2
•定温过程中,压力与比容成反比
03-理想气体的热力性质及基本热力过 程--SCH
03-理想气体的热力性质及基本热力过 程--SCH
19
17
03-理想气体的热力性质及基本热力过 程--SCH
03-理想气体的热力性质及基本热力过 程--SCH
18
理想气体概念与特点; 理想气体状态方程及应用,通用气体常数; 理想气体热力学能、焓、熵变化计算; 理想气体比热及类型,利用比热计算热量; 理想气体混合物的成分表示,分压力和分容积 定律; 四种典型热力过程的状态参数变化规律、在参 数坐标图的表示及特点; 四种典型热力过程的能量交换计算及特点。
03理想气体的热力性质及基本热力过程sch41理想气体的基本热力过程一研究热力过程的目的和方法一研究热力过程的目的和方法1研究目的过程中能量转换关系过程热量功量系统热力学能s图上的表示
4-1 理想气体的基本热力过程
一、研究热力过程的目的和方法
1、研究目的 ① 过程中能量转换关系(过程热量、功量,系统热力学能 和焓的变化); Δu、Δh 和Δs 按前述的方法计算。 ② 状态参数的变化关系(p 、v 、T 、s); ③ 过程曲线在p -v 图及T- s图上的表示。
热力学 第6章 水蒸气

x
湿饱和蒸汽
1 干饱和蒸汽
8
四、饱和状态压力和温度的关系
1.吉布斯相律 吉布斯相律 对于多元( 个组元 多相( 个相 个组元) 个相) 对于多元(如k个组元)多相(如f个相) 元化学反应的热力系,其独立参数, 元化学反应的热力系,其独立参数,即 自由度 n = k – f + 2 水在液相(或固相、气相) 例:水在液相(或固相、气相) k =1, , F =1,故n =1-1+2,此时压力,温度均可 , ,此时压力, 独立变化。水在汽液共存时k = 1,f = 2, 独立变化。水在汽液共存时 , , 故n =1,此时压力和温度中仅有一个可 , 自由变化。三相点: 自由变化。三相点:k =1,f = 3 故n = 0 ,
4
二、饱和状态(Saturated state) 饱和状态
当汽化速度=液化速度时, 当汽化速度 液化速度时,系统 液化速度时 处于动态平衡 宏观上气、 动态平衡, 处于动态平衡,宏观上气、液两相 饱和状态。 保持一定的相对数量—饱和状态 保持一定的相对数量 饱和状态。 饱和温度, 饱和状态的温度—饱和温度 饱和状态的温度 饱和温度,ts(Ts) (Saturated temperature) 饱和状态的压力—饱和压力 饱和压力, 饱和状态的压力 饱和压力,ps (Saturated pressure) ) 加热,使温度升高如 t',保持定 加热, , 系统建立新的动态平衡。 值,系统建立新的动态平衡。与之 对应, 变成 。 变成p 对应,p变成 s'。 所以
6
0.0 023 385 0.0 123 446 0.1 013 325
三、 几个名词
饱和液(saturated liquid)—处于饱和状态的液体 t = ts 处于饱和状态的液体: 饱和液 处于饱和状态的液体 干饱和蒸汽(dry-saturated vapor; dry vapor ) 干饱和蒸汽 —处于饱和状态的蒸汽 处于饱和状态的蒸汽:t = ts 处于饱和状态的蒸汽 未饱和液(unsaturated liquid) 未饱和液 —温度低于所处压力下饱和温度的液体 温度低于所处压力下饱和温度的液体:t < ts 温度低于所处压力下饱和温度的液体 过热蒸汽(superheated vapor) 过热蒸汽 —温度高于饱和温度的蒸汽 温度高于饱和温度的蒸汽:t > ts, t – ts = d 称过 温度高于饱和温度的蒸汽 热度(degree of superheat)。 热度 湿饱和蒸汽(wet-saturated vapor; wet vapor ) 湿饱和蒸汽 —饱和液和干饱和蒸汽的混合物 饱和液和干饱和蒸汽的混合物:t = ts 饱和液和干饱和蒸汽的混合物 使未饱和液达饱和状态的途径: 使未饱和液达饱和状态的途径:
09-3 理想气体的热力学过程

1878年 小部分未烧毁的手稿发表
2016/11/1
Sadi Carnot 1796 - 1832
22
物理化学II
热力学第一定律和热化学
理想气体的热力学过程
卡诺热机:1824 年
理想的假想热机
工作物质:理想气体
高温热源T1 Q1
卡诺 热机
Q1(正) W(负) Q2 (负)
理想情况:
Q1 W
理想气体的热力学过程
卡诺循环(Carnot cycle)
过程2:绝热可逆膨胀由 p2V2Th 到 p3V3Tc (B C)
Q2 0
W2 U2 CV ,m dT
Th Tc
所作功如BC曲线 下面积的负值:
物理化学II
26
热力学第一定律和ot cycle)
理想气体内能和焓都仅仅是温度
的单变量函数
物理化学II
5
热力学第一定律和热化学
理想气体的热力学过程
焦耳实验推论二:
理想气体恒温可逆膨胀,U = Q + W = 0
V2 p1 Q W nRT ln nRT ln V1 p2
焦耳实验推论三:
V 因 (U/V)T =0, C p CV p ( ) p CV nR T
W Qh Qc (Qc 0) Qh Qh
高温热源T1
卡诺 热机
或
V2 nR(Th Tc ) ln( ) Th Tc Tc V1 1 V2 Th Th nRTh ln( ) V1
i i
平动能
i ,t
2 h n nz ( 2 2) 8m a b c
2
2 x 2
n2 y
工程热力学-第六章 实际气体方程的性质及热力学一般关系式

定温过程:g vdp 1
可逆定温过程中自由焓的减少量是过程的技术功。
三、麦克斯韦关系
du=Tds-pdv dh=Tds+vdp df = -sdT – pdv dg=-sdT+vdp
T
p
(
v
)s
( s
)v
T v
( p
)s
( s ) p
( p T
)v
(
s v
)T
( v T
)p
(
s p
)T
四、热系数
(Vm
+
b)
6-3 对应态原理与通用压缩因子图
一、对应态原理 1、提出的缘由
(
p
+
a Vm2
)(Vm
-
b) =
RT
实际气体状态方程包含有与物质固有性质相 关的常数a、b,这些常数需要实验数据进行拟 合才能得到。
在临界点附近,所有流体显示出相似性质 2、对比参数:
pr
p pcr
,Tr
T Tcr
, vr
其在高压低温下偏差更大。
Z = pv = pVm RgT RT
Z
=
pv RgT
=
pVm RT
或pVm
=
ZRT
压缩因子Z偏离1的大小反映了实际气体对理想
气体偏离的程度
Z的大小与气体种类有关,随压力以及温度变化
临界点的压缩因子称为临界压缩因子:
Z cr
=
pcrv cr RgTcr
压缩因子Z的物理意义:
Vm
b
RT
p
27 64
R
T2 2 cr
pcr
1 Vm2
理想气体的绝热过程

D Q 2
T2
C
Q=0
V1
V4 V2
V3 V
W Q η = =1− 2 Q Q 1 1
P
A
T lnV V η =1− 2 3 4 T lnV V 1 2 1
T1
B
Q TV 1 2
γ− 1
=TV 2 3
γ− 1
TV 1 1
γ− 1
=TV 2 4
γ− 1
D
T2 V1 V4 V2
γ
P =C V 1 m Q PV = R T M
消去P: 消去 : 消去V: 消去 :
γ
TV
γ− 1
=C 2
P T =C 3
γ − −γ 1
=0 dV=0 等容 dA=0 等压 dP=0
PV图 图
升 温
Q(方程) (方程) Q=∆E =νCV(T2-T1)
能量转换(Q) 能量转换 全部用来 改变内能 部分转为内能 部分用来作功 全部用来 作功
系统放热Q 。 设:系统吸热Q1,系统放热 2。 系统吸热 循环过程的热力学第一定律: 循环过程的热力学第一定律:
Q −Q =W 1 2
热机效率:在一次循环过程中, 热机效率:在一次循环过程中,工作物质对
外作的净功与它从高温热源吸收的热量之比。 外作的净功与它从高温热源吸收的热量之比。
Q Q −Q =W 1 2
绝热过程的功: 绝热过程的功:
P =C V 1
绝热方程: 绝热方程:
γ
TV
γ− 1
=C 2
P T =C 3
γ − −γ 1
绝热方程的推导: 绝热方程的推导:
m Q dW = −dE ∴ PdV = − C dT V M P dV m − = dT C M V
5-6 理想气体的等值过程和绝热过程

5 3 R T2 T1 RT3 T2 2 2
根据理想气体的物态方程 pV RT 带入上式,得
11 Q p1V1 5.6 10 2 J 2
(3)对整个过程运用热力学第一定律
Q E W
得
W Q 5.6 10 J
等温过程
m dV m V2 WT RT RT ln M V M V1 V1
V2
V2
V2
V2
能量转换关系
m V2 m p1 QT WT RT ln RT ln M V1 M p2
例题: 3.2 103 kg 氧气的压强
p1 1.01310 Pa,温度 T 300 K ,先等体增压到 p2 3.039105 Pa;再等温
p
A
pC
解
B
QAB EAB WAB
QAC WAC
T C
C
QAD 0
WAB WAC WAD
dQ 0
D
EAB 0 , EAD 0
o VA
VB
V
QAB QAC QAD 0
例:讨论理想气Biblioteka 下图过程中,各过程P A* 1 2
Q
的正负。
绝热
*B
A— B
Q p E2 E1 pV2 V1
m i m Qp RT2 T1 RT2 T1 M 2 M dQ p ,m i 等压摩尔热容量 C p ,m CV ,m R R R dT 2
比热容比
C p ,m CV ,m 2i i
T1 Ⅰ
O
V1
T2 Ⅱ
理想气体的典型热力过程

理想气体的典型热力过程
1. 等压过程:在恒定的压力下,气体的体积增加或减少,热量从气体传给环境或从环境传给气体。
这类过程也称作“伯努利过程”。
2. 等温过程:在恒定的温度下,气体随着压力的变化而膨胀或收缩,此时所吸收或释放的热量与温度成正比例。
这类过程也称作“卡诺过程”。
3. 等体过程:在恒定的体积下,气体的压强增加或减少,需要向气体注入或从气体中抽取热能。
这类过程也称作“热容过程”。
4. 绝热过程:在没有热量交换的情况下,气体的压强、温度和体积都同时变化。
这类过程也称作“奥托过程”。
06工程热力学第六章 气体的流动

dMa
d 2 Ma
1 1
(
2
) 2 ( 1)
p0 v0
(6-13a)
喷管设计 —依要求的流量计算截面积。为使气体在喷管内充 分膨胀降压至背压pB ,应根据pB /p0设计喷管。 当pB /p0 ≥ pcr/p0,选用渐缩形喷管,这时令p2 =pB ,按式(613)得出口截面面积
)
2
(
p2 p0
) ( 1) ]
当pB /p0 = pcr/p0,则也可按式(6-13a)得出
q m A2 2
1 1
(
)
2 /( 1)
p0 v0
pB < pcr
若工作条件变动后有pB /p0 < pcr/p0 ,则由于渐缩形喷管出 口截面压力最低只能等于临界压力pcr,因而气体在喷管中得不 到充分膨胀降压,而只能在喷管出口外面补充膨胀使压力降低 到pB ,变成扰动损失。
q m Amin 2
1 1
(
2
)
2 /( 1)
p0 v0
pB>p2
pB<p2
缩放形喷管工作条件变动后,如pB/p0小于p2/p0的设计值,则 气体在喷管中只降压到设计值p2,然后在喷管出口外面补充膨胀 降压到pB ,产生扰动损失。 如果pB/p0高于p2/p0的设计值,则如图所示,在喷管出口附近 会产生冲击波,气体压力突然上升,流速降至声速,然后按扩压 管方式升压至背压流出喷管。因发生冲击波时产生很大的损失, 故应避免发生这种情况。
(6-14a)
进口截面面积一般不需计算,只要适当大于出口截面面积以 保持喷管一定的形状即可。
当pB /p0 < pcr/p0,选用缩放形喷管。此时需计算喉部面积和出 口面积。
热力学第六章

s3 s 0.4763kJ/(kg.K)
4点对应的是未饱和水,
p4 p1 5MPa h4 h3 137.72 kJ kg
s4 s3 0.4763kJ/(kg.K)
3.增加了过热器,蒸汽在过热器 中的吸热过程(6→1)也是定压 过程,提高了平均吸热温度, 从而提高了乏气的干度x,提高 了循环效率,也改善了汽轮机 的工作条件。
p 4 5 6 3
1
2 v
郎肯循环热效率的计算
1. 锅炉中的定压吸热过程(4→5→6→1)吸入的热量:
q1 h1 h4
2. 定熵膨胀过程(1→2)中工质(或汽轮机)做功:
制热
动力
T2 环境温度
T0
制冷
T2
s
热力循环其它分类
气体动力循环:空气为主的燃气 1. 按工质 如燃气轮机等,按理想气体处理 蒸汽动力循环:以水蒸气为主 如蒸汽轮机等,按实际气体处理 2. 按燃料燃 烧方式分 内燃式:燃料在内部燃烧,燃气即工质,
如内燃机、燃气轮机等。
外燃式:燃料在外部燃烧,燃烧放出的热
为克服蒸汽卡诺 循环的缺陷,工 程实际中学常用 朗肯循环
朗肯循环
朗肯循环(Rankine Cycle)
朗肯循环系统工作原理
蒸汽过 热器 锅 炉 汽轮机 四个主要装置: 锅炉 汽轮机 发电机 凝汽器 给水泵 凝汽器
给水泵
蒸汽电厂示意图
朗肯循环(Rankine Cycle)
二、蒸汽动力循环系统的简化(理想化)
h2 h x h h 137 kJ kg
例1:朗肯循环,蒸汽进入汽轮机初压 p1=5MPa,初温 t1=500℃, 乏汽压力 p2=5kPa,不计水泵功耗。要求:将朗肯循环表示在Ts图上,并求循环净功、加热量、循环热效率及汽耗率。
理想气体的热力学过程
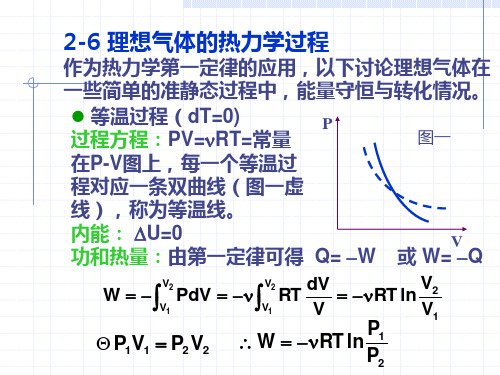
P
1
2
4
0
T1 3
T2
V1
V4 V2
V3
Q
34:与温度为T2的低温热源接触,T2不变, 体积由V3压缩到V4,从热源放热为 V3 Q 2 RT2 ln V4 41:绝热压缩,体积由V4变到V1,吸热为零。
在一次循环中,气体 对外作净功为 |W|= Q1-Q2 ( 参见能流图)
T1 Q1
1
1
2
1
W3 4
RT3 1
T4 1 T3
在两条等温线之间, 沿任意两条绝热线, 系统对外界作功相等。
考虑到 T1=T3 T2=T4 W12=W34
2-7 循环过程
历史上,热力学理论最初是在研究热机工作过 程的基础上发展起来的。 在热机中被用来吸收热量并对外作功的物质叫 工质。工质往往经历着循环过程,即经历一系 列变化又回到初始状态。
气体在多方过程中从外界吸的热量
R Q C mV T2 T1 C v T2 T1 n 1
当1 n 时,Cmn 0。说明气体在过程中对 外界所作的功大于它从外界吸收的热量。多作 的功是由于消耗了本身的内能,故虽然吸热, 但温度反而下降,产生负热容。
V2 dV W PdV RT RT ln V1 V1 V V1 P1 P1V1 P2 V2 W RT ln P2
V2 V2
等容过程(dV= 0)
过程方程:V=常数 在P-V图上,等容线为一条垂直 于V轴的直线。(图二虚线)
P
功:W=0 内能与热量: 由第一定律可得:U=Q 理想气体内能表达式
|W|
理想气体的等温过程和绝热过程

§6-5 理想气体的等温过程和绝热过程一、等温过程(Isothermal Process )1.特点:理想气体的温度保持不变,T =const 。
2.过程曲线:在PV 图上是一条双曲线,叫等温线。
3.过程方程:P 1V 1= P 2V 24.内能、功和热量的变化系统经过等温过程,从状态()T V P ,,11变成()T V P ,,22内能 012=-=∆E E E功 ⎰=21V V T PdV W由气体状态方程 RT M m PV =得 VRT M m P 1= 12ln 121V V RT M m dV V RT M m W V V T ==⎰——用体积表示。
用压强表示为21ln P P RT M m W T = 热量:由热力学第一定律得 1221ln ln V V RT M m P P RT M m Q T ==5.特征:在等压过程中,系统从外界吸收的热量,全部用来对外作功。
注意:对于等温过程,不能定义摩尔热容;如果要定义,则∞=C 。
二、绝热过程(Adiabatic Process )1.特点:系统与外界没有热量交换的过程,Q =0。
2.内能、功和热量的变化系统经过绝热过程,从状态()11T V P ,,变成()22T V P ,,内能 ()12,12T T C Mm E E E m V -=-=∆ 热量 Q =0由热力学第一定律 0=+∆=W E Q ,得功 ()12,T T C Mm W m V -=- 用状态参量P ,V 表示,根据状态方程R PV T M m =,可知()1 22112211,-=-γV P V P V P V P R C W mV --= 证明:由定义可知,m V m V m V m V mP C R C R C C C ,,,,,1+=+==γ 因而1,-=γm V C R 故 11,-=γR C m V 因而 12211-γV P V P W -= 3.特征:在绝热过程中,系统对外界所作的功是由于系统内能的减少来完成的。
热力学理想气体的等压过程推导

热力学理想气体的等压过程推导热力学是研究能量转换和传递的科学,而理想气体是指符合一定规律的气体模型。
在热力学中,等压过程是指气体在恒定压力下发生的过程。
本文将通过推导,详细介绍热力学理想气体的等压过程。
一、等压过程的定义等压过程是指在气体系统受到恒定压力作用下发生的过程。
在等压过程中,气体的压强保持不变,但是体积和温度可以发生变化。
这种过程在工业生产中非常常见,比如蒸汽锅炉的汽轮机工作过程。
二、理想气体的状态方程理想气体是指完全符合玻意耳定律的气体,其状态方程可以用公式表示为PV=nRT。
其中,P表示气体的压强,V表示气体的体积,n表示气体的物质量,R表示气体的气体常数,T表示气体的温度。
根据这个状态方程,我们可以推导等压过程的关键参数。
三、等压过程的推导在等压过程中,气体的压强保持不变,即P1=P2=P。
我们假设初始状态下气体的温度和体积分别为T1和V1,终态下的温度和体积分别为T2和V2。
根据理想气体的状态方程PV=nRT,我们可以推导出初始状态和终态下的气体物质量n1和n2分别为:n1 = (P1 * V1) / (RT1)n2 = (P2 * V2) / (RT2)由于等压过程中气体的压强保持不变,所以有P1 = P2 = P。
带入上述公式,可以得到:n1 = (P * V1) / (RT1)n2 = (P * V2) / (RT2)由于等压过程中压强不变,P1 = P2,我们可以得到:(V1 / T1) = (V2 / T2)根据上述推导结果可以发现,在等压过程中,气体的体积和温度是成正比的关系。
当气体的体积增大时,温度也增大;当气体的体积减小时,温度也减小。
这一结论与我们日常生活经验相符合。
四、等压过程的热力学性质在等压过程中,气体对外界做功可以通过体积的变化来计算。
根据热力学第一定律,等压过程中气体做的功W可以表示为:W = P * (V2 - V1)在等压过程中,气体的内能增加的大小可以由内能变化量ΔU来表示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
曲线斜率
p
p
2'
1
T
T
2
2'
1
v2
(
T s
)
p
T Cp
cp cv
w0
w0
q0
q0
T T
v
s cv cp
在T-s图上,同一v温度下定容线比定s压线的斜率大
p
4、能量转 换u cv (t2 t1) h cp (t2 t1)
2
1)过程功 dp 0 wt,p vdp0
1
2
wp pdv p(v2 v1)
RM 8314J /(kmol K)
2、气体常数与通用气体常数的关系:
pV
nRM T
m M
RM
T
pV mRT
R RM M
或 RM MR
➢M 为气体的摩尔质量(kg/kmol)
➢R单位为J/(kg.K)
3、不同物量下理想气体的状态方程式
pv RT pV mRT
1 kg 理想气体 m kg 理想气体
u cv (t2 t1) h cp (t2 t1)
1)热量
q0
u ws 0
或
u ws
封闭系统对外界做的膨胀功是系统内 能减少的结果
h wt,s 0 或 h wt,s 开口系统对外界做的技术功是工质焓
2)过程功
值减少的结果
ws
u
cv (T1
T2 )
k
R
1
(T1
T2 )
1( k 1
2、气体的比热与状态参数有关
q c(t2 t1)
按定值比热计算
q cm12 (t2 t1)
按直线关系计算
q
cm02
t2
cm10
t1
按曲线关系计算
真实质量比热 c dq / dt
平均质量比热 c2m1 q t2 t1
第三节 理想气体内能和焓
Internal energy and enthalpy of ideal gas
0.832m3
/ kg
终了状态的比容
v2
V1
P1 P2
0.832 1 6
0.139 m3 / kg
因 T1 T2 u 0
故
qT
wT
p1v1 ln
v2 v1
p1v1 ln
p1 1105 0.832 ln 1 149KJ / kg
p2
6
负号表示气体向外界放热。
四、 绝热过程( Adiabatic process )
等温过程中,外界加给封闭系统的热量全部用于系统
对外做膨胀功。故等温膨胀过程为吸热过程,等温压
缩过程为放热过程。
例 压力为lbar,温度为290K的1kg空气,在气缸内进 行定温压缩,设终了状态的压力为6bar,求起始和终
了的比容,气体与外界交换的热量。
解 起始状态的比容
v1
RT1 P
287 290 1105
pVM RMT pV nRMT
1 kmol 理想气体 n kmol 理想气体
4、应用理想气体状态方程的注意事项
(1)注意各个式子适用条件
(2)方程中适用的是绝对压力和绝对温度
(3)气体状态发生变化时,应用状态方程时,气体 的质量不能发生改变
二、比热及其分类
➢ 1、单位物量的物体温度升高1K所需的热量称为比热容:
(5)每千克气体的内能变化量
u cvT (cp R)(T2 T1) (1.157 0.287)(1200 600) 522kJ / kg
例 开始时活塞汽缸的体积为0.1m3,其中有压力为
1.15bar的空气0.1kg,若在压力不变的情况下,体积缩小为
原来的75%,求终点的温度,变化过程中换热量的大小和方
1
2)热量 qp cp (t2 t1)
2
开口系统
q h vdp
qp h 1 适用于任何工质
定压过程中,外界加给开口系统的热量全部用于增加 工质的焓
闭口系统 qp u wp
定压过程中,外界加给闭口系统的热量一部分用于增 加系统的内能,其余部分用于对外做膨胀功
例 压力为8bar,温度为327℃的空气进入燃烧 室内定压加热,使其温度升高到927℃。设燃
课程回顾
一、理想气体状态方程
1、克拉贝龙(Clapeyron)方程
pv RT 或 pV mRT
R为气体常数(单位J/(kg·K),与气体所处的状态
无关,随气体的种类不同而异
pVm RMT 或 pV nRMT
Vm为1kmol(Mkg)物质的体积
通用气体常数不仅与气体状态无关,与气体的种
类也无关
1)过程功
wT
2 1
pdv
2 1
RT v
dv
RT ln
v2 v1
RT ln
p1 p2
p1v1 ln
p1 p2
wt,T
2
vdp
1
2
1
RT p
dp
RT ln
p1 p2
RT ln
v2 v1
wT wt,T
2)热量
qT
wTLeabharlann wt,TRT ln v2 v1
RT ln
p1 p2
p1v1 ln
p1 p2
2)热量
qn
u
wn
cv (T2
T1)
R n 1 (T1
T2 )
(cv
R n 1)(T2
T1)
( cv
cp n
cv 1
)(T2
T1 )
(n n
1 1 cv
h cp (t2 t1)
第二节 基本热力过程分析
一、定容过程( Constant-volume process )
1.过程方程 v 常数 2.初、终状态参数关系
pv RT
v1 v2
p2 T2 p1 T1
3p .p-v图及T-s图
TT
曲线斜率
T T
v
( s
s
)v
Cv
s
V
4、能量计算与分析
Q U W mcvT m 1 pdv
❖ 开口系 dq dh dwt cpdT vdp
2
q h wt cpT 1 vdp
2
Q H Wt mc pT 1 Vdp
第六章 理想气体的热力过程 Process Of The Ideal Gas
§6-1 研究过程的目的和方法 Purpose and method
按直线关系计算
h
c
2 pm 0
t2
c
1 pm 0
t1
按曲线关系计算
三、定压比热容、定容比热容的关系
迈耶方程: cp cv R 或 cp cv R
定压比热容大于定容比热容 闭口系 dq du dw cvdT pdv cvdT dw
2
q u w cvT 1 pdv
2
良好绝热材料包围的系统发生的过程
进行得较快,系统来不及和外界交换热量的过程
1.过程方程 dq 0 对可逆绝热过程 dq Tds 0 ds 0或s 常数
可逆绝热过程又称为定熵过程 对理想气体可逆绝热过程,可以推导出其过程方程为
k cp cv
pvk 常数
绝热指数,其数值随气体的种类和温度而变
c p cv k 1 对于空气和燃气,k 1.4
2.初、终状态参数关系
p2 ( v1 )k
p1
v2
pvk 常数
pv RT
T2 ( v1 )k1 T1 v2
3.p-v图及T-s图
T2
(
p2
)
k 1 k
T1 p1
曲线斜率
p ( v )s
k
p v
在p-v图上,绝热线比定温线陡
4.能量转换
一、理想气体的内能
理想气体的内能和焓是温度的单值函数
u cv (t2 t1)
按定值比热计算
u cvm12 (t2 t1)
按直线关系计算
u
cvm02
t2
cvm10
t1
按曲线关系计算
理想气体的焓也仅仅是温度的函数。
h cp (t2 t1)
h
c
2 pm1
(t2
t1)
按定值比热计算
气的定压比热容Cp 1.157 KJ / Kg K 燃气的气体常数 R 287J /,kg求 K(1)燃烧前后气
体的比容(2)每千克气体的加热量(3)膨胀功(4) 内能的变化量
解 (1)燃烧前的比容
v1
RT1 P1
287
(327 8 10 5
273)
0.2153 m3
/ kg
(2)燃烧后的比容
例一:气缸内有0.002kg空气,温度为300℃,压力为 8bar,定容加热后的压力为40bar,求加热后的温度,
加给空气的热量,设空气的等容比热为0.71K8J / kg K
解 已知 T= 273+300= 573K, P=1 8bar
=P42 0 bar ,得加热后的空气温度为
T2
P2 P1
T1
负号表示对外界放热。
三、 定温过程(Isothermal process) 1.过程方程 pv 常数,T 常数
2.初、终状态参数关系
pv RT
T1 T2
3.p-v图及T-s图
v2 p1 v1 p2
曲线斜率
(
p v
)T
p v
4、能量转
换
u cv (t2 t1) 0
h cp (t2 t1) 0
40 8
573
2865
K
加热量为
