基础化学习题解答(第一章)
基础化学习题答案chap12

第一章绪论习题答案1.指出下列哪些单位属于SI单位,那些不是。
时间单位min、能量单位J、体积单位L、质量单位μg、长度单位nm、温度单位℃2.SI制的大体单位有哪几个?3.我国的法定计量单位和SI制单位有什么联系和不同?*******************************************************************************1.答:能量单位J、质量单位μg、长度单位nm、温度单位℃属于SI单位;其他不是。
2.答:SI大体单位:m、kg、s、A、K、mol、cd3.答:一切属于国际单位制的单位都是我国的法定计量单位。
按照我国的实际情况,在法定计量单位中还明确规定采用了若干可与国际单位制并用的非国际单位制单位。
第二章稀溶液的依数性习题答案1. 20C时,水的饱和蒸气压为2.34kpa。
若于100g水中溶入10.0g蔗糖(C12H22O11,相对分子质量为M r=342),求此溶液的蒸气压。
2.现有四种处于相同温度和压力下的理想稀溶液。
(1) 0.1 mol蔗糖溶于80 mol水中,水蒸气压为p1(2) 0.1 mol萘溶于80 mol苯中,苯蒸气压为p2(3) 0.1 mol葡萄糖溶于40 mol水中,水蒸气压为p3(4) 0.1 mol尿素溶于80 mol水中,水蒸气压为p4这四个溶液的蒸气压之间的关系为:( )(A) p1≠p2≠p3≠p4(B) p2≠p1=p4>p3(C) p1=p2=p4=(1/2)p3(D) p1=p4<2p3≠p23.医治脱水、电解质失调与中毒静脉滴注的林格氏(Ringer)液的处方是:在1.00L 注射用水中溶有8.50gNaCl,0.30gKCl,0.33gCaCl22H2O。
林格氏液的渗透浓度是多少?101.3kpa下凝固点为多少?它与人体血浆溶液等渗吗?4.将7.00g难挥发非电解质溶于250g水,该溶液在101.325kpa下,沸点为100.510C。
基础化学第1章习题辅导

树木内部树汁的上升是由渗透压造成的,设 树汁浓度为0.20 mol· -1,树汁小管外部的水 L 中含非电解质浓度为0.01 mol· -1(1 kPa = L 10.2 cm水柱高),则在25℃时树汁能上升的 最大高度是多少?
c RT
K f mB 1 k f 1.86K kg mol MB Tf m A
下列四种电解质,对某溶胶的聚沉值是: ① NaNO3 30.0 ② Na2SO4 14.8 ③ MgCl2 12.5 ④ AlCl3 0.17 (mmol · -1) L B 则它们的聚沉能力由大到小的顺序为 () (A) ① > ② > ③ > ④ (B) ④ > ③ > ② > ① (C) ③ > ② > ① > ④ (D) ① = ② = ③ = ④ 电解质的聚沉能力主要决定于与胶粒带相反 溶胶的特性是 (C ) 电荷的离子所带的电荷数。反离子的电荷数越 (A) 均相、稳定 (B) 均相、不稳定 高,聚沉能力就越强。可用聚沉值来衡量。 (C) 多相、不稳定 (D) 多相、稳定
kb m B 解: 由公式 M B Tb m A
得
496 10 3 g 1000 g 0.17 ℃ 0.512 ℃ mol 1 kg MA 10.0 g M B 149 g mol 1
《基础化学》课后习题参考答案(无机部分)
⑵
-2
⑶
-4
⑺ 1.1×10
1
⑻ 5.0×10-15
+
5.0×10
6.3×10
1.8×10
-5
1.1×10
-11
6.3×10
-8
1.0
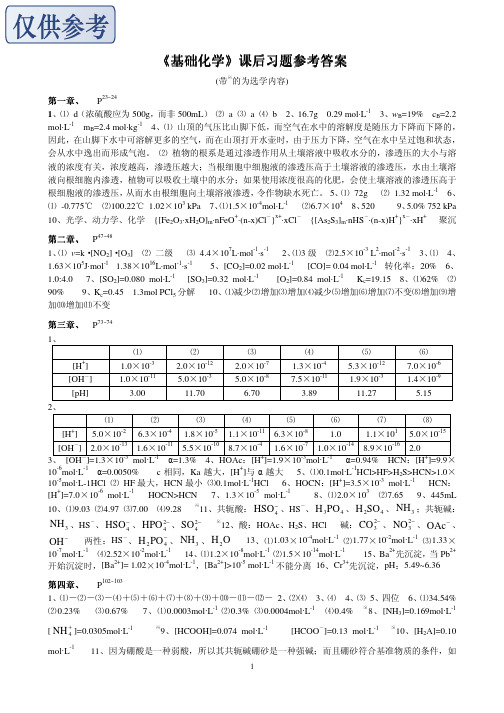
[OH ] 2.0×10-13 1.6×10-11 5.5×10-10 8.7×10-4 1.6×10-7 1.0×10-14 8.9×10-16 2.0 3、 [OH-]=1.3×10-3 mol·L-1 α=1.3% 4、HOAc:[H+]=1.9×10-3mol·L-1 α=0.94% HCN:[H+]=9.9× -6 -1 + 10 mol·L α=0.0050% c 相同,Ka 越大,[H ]与 α 越大 5、⑴0.1mol·L-1HCl>HF>H2S>HCN>1.0× 10-5mol·L-1HCl ⑵ HF 最大,HCN 最小 ⑶0.1mol·L-1HCl 6、HOCN:[H+]=3.5×10-3 mol·L-1 HCN: + -6 -1 -5 -1 3 [H ]=7.0×10 mol·L HOCN>HCN 7、1.3×10 mol·L 8、⑴2.0×10 ⑵7.65 9、445mL 10、⑴9.03 ⑵4.97 ⑶7.00 ⑷9.28
2
1 ⑷m = 0 2
5、 n ≥ 3 、 l = 0,1 、 l = 0 、 m = 0 、 m s = ±
2
1 2
2s
n 2 2
m 0 0
ms +1/2 -1/2
2p3
※
2 2 2
1 1 1
0 +1 -1
+1/2 +1/2 +1/2
《基础化学》教材习题答案(第3版)

第一章 习题答案1.答:能量单位J 、质量单位μg 、长度单位nm 、温度单位℃、属于SI 单位;其他不是。
2.答:SI 基本单位:m 、kg 、s 、A 、K 、mol 、cd 。
3.答:一切属于国际单位制的单位都是我国的法定计量单位。
根据我国的实际情况,在法定计量单位中还明确规定采用了若干可与国际单位制并用的非国际单位制单位。
第二章习题答案1. 解: 根据)()O H ()O H ()O H (222蔗糖n n n x +=0292m o l .0m o l 342g g0.10)( mol 56.5mol 18.0g g 100)O H (1-1-2=⋅==⋅=蔗糖n n 995.00.0292m o lm o l 56.5mol56.5)O H (2=+=xkPa 33.20.995kPa 34.2)O H ()O H (2*2=⨯==x p p2.解:)B ()O H ()()O H (999.00.1molmol 08mol08)O H ()O H ()O H ()O H (899.00.1molmol 04mol 04)O H ()O H ()O H ()(999.00.1molmol 80mol80)()()()O H (999.00.1mol mol 80mol80)O H ()O H ()O H (*2**2*22*22*2*22*23***2*2*22*21答案为苯苯苯苯苯∴>=+⋅===+⋅===+⋅===+⋅==p p p p x p p p p x p p p p x p p p p x p p 3.解:与人体血浆等渗。
11os f 11os f B f B f f 11-1-1-os L mmol 310L mol 31.0C58.0K58.0L mol 31.0mol kg K 86.1L mol 31.0L00.1mol 147g g33.03mol 74.6g g 30.02mol 58.5g g 50.82-----⋅=⋅=︒-==⋅⨯⋅⋅=≈≈=∆⋅=⋅⨯+⋅⨯+⋅⨯=c T c K c iK b iK T c4.解:K 85.1mol kg K 512.00.510Kmol kg K 86.1mol g 1.28mol kg 0281.00.510K 250g g 00.7mol kg K 512.011b b f B f f 111b A B b B =⋅⋅⋅⋅⋅=∆⋅=⋅=∆⋅=⋅=⨯⨯⋅⋅=∆⋅⋅=-----K T K b K T T m m K MT f = -1.85℃ 5. 解:压略高于人体眼液的渗透kPa 869K 310K mol L kPa 314.8L mol 337.0L mmol 337L mol 337.0mL10001.000LmL 1000mol 61.8g g 00.17mol 161.5g g 00.52111-os 1-1-1-1-os =⨯⋅⋅⋅⨯⋅==⋅=⋅=⨯⋅+⋅⨯=--RT c Πc6. 解:11A fB f B 11A b B b B mol kg 61.1100g0.220K g0.19mol kg K 86.1mol kg 62.1100g 0.0600K g 0.19mol kg .512K 0----⋅=⨯⨯⋅⋅=∆=⋅=⨯⨯⋅⋅=∆=m T m K M m T m K M用两种方法计算该物质的相对分子质量基本相同。
大学基础化学课后习题解答(1)

大学基础化学课后习题解答第一章 溶液和胶体溶液 第二章 化学热力学基础2-1 什么是状态函数?它有什么重要特点?2-2 什么叫热力学能、焓、熵和自由能?符号H 、S 、G 、∆H 、∆S 、∆G 、θf m H ∆、θc m H ∆、θf m G ∆、θr mH ∆、θm S 、θr m S ∆、θr m G ∆各代表什么意义? 2-3 什么是自由能判据?其应用条件是什么? 2-4 判断以下说法是否正确,并说明理由。
〔1〕指定单质的θf m G ∆、θf m H ∆、θm S 皆为零。
〔2〕,反应 O 2(g) +S(g) = SO 2(g) 的θr m G ∆、θr m H ∆、θr m S ∆分别等于SO 2(g)的θf m G ∆、θf m H ∆、θm S 。
〔3〕θr m G ∆<0的反应必能自发进行。
2-5 298.15K 和标准状态下,HgO 在开口容器中加热分解,假设吸热22.7kJ 可形成Hg 〔l 〕50.10g ,求该反应的θr m H ∆。
假设在密闭的容器中反应,生成同样量的Hg 〔l 〕需吸热多少?解:HgO= Hg(l)+1/2O 2(g)θr mH ∆=22.7× kJ·mol -1 kJ·mol -1 2-6 随温度升高,反应〔1〕:2M(s)+O 2(g) =2MO(s)和反应〔2〕:2C(s) +O 2(g) =2CO(g)的摩尔吉布斯自由能升高的为 (1) ,降低的为 (2) ,因此,金属氧化物MO 被硫复原反应2MO(s)+ C(s) =M(s)+ CO(g)在高温条件下 正 向自发。
2-7 热力学第一定律说明热力学能变化与热和功的关系。
此关系只适用于:A.理想气体;2-8 纯液体在其正常沸点时气化,该过程中增大的量是:A.蒸气压;B.汽化热;2-9 在298K 时,反应N 2(g)+3H 2(g) = 2NH 3(g),θr m H ∆<0则标准状态下该反应A.任何温度下均自发进行;B.任何温度下均不能自发进行;C.高温自发;2-10 298K ,标准状态下,1.00g 金属镁在定压条件下完全燃烧生成MgO(s),放热24.7kJ 。
基础化学第一章习题解答

基化第一章习题解答3.下列数据,各包括几位有效数字?⑴ 2.0321 g ⑵ 0.0215 L ⑶ Pk HIn = 6.30 ⑷ 0.01% ⑸ 1.0×10-5 mol 解:有效数字位数分别为,⑴ 5位 ⑵ 3位 ⑶ 2位 ⑷ 1位 ⑸ 2位7.求0.010 kg NaOH 、0.100 kg (+2Ca 21)、0.100 kg (32CO Na 21)的物质的量。
已知NaOH 、+2Ca 21、32CO Na 21的摩尔质量分别为40、20、53 g·mol -1 解:mol 89.1100053100.0)CO Na 21(mol 00.5100020100.0)Ca 21(mol 25.010*******.0)NaOH (322=⨯==⨯==⨯=+n n n8.20℃,将350 g ZnCl 2溶于650 g 水中,溶液的体积为739.5 mL 。
求此溶液的物质的量浓度和质量摩尔浓度。
ZnCl 2的摩尔质量为136 g·mol -1解:12L mol 48.35.7391361000350)ZnCl (-⋅=⨯⨯=c 12kg mol 95.36501361000350)ZnCl (-⋅=⨯⨯=b9.每100 mL 血浆含K + 和Cl - 分别为20 mg 和366 mg ,试计算它们的物质的量浓度/mmol·L -1。
解:1L mmol 1.5100010051.0)K (mmol 51.03920)K (-++⋅=⨯===c n 1L mmol 10310001003.10)Cl (mmol 3.105.35366)Cl (---⋅=⨯===c n10.如何用含结晶水的葡萄糖(C 6H 12O 6·H 2O )配制质量浓度为50.0 g·L -1的葡萄糖溶液500 mL ?该溶液密度为1.00 kg·L -1,该溶液的物质的量浓度和葡萄糖C 6H 12O 6的摩尔分数是多少?解:葡萄糖C 6H 12O 6的摩尔质量为180 g·mol -1n (C 6H 12O 6) =10005001800.50⨯= 0.139 mol m (C 6H 12O 6·H 2O) = 0.139×198 = 27.5 g 称取27.5 g 含结晶水的葡萄糖置入烧杯中,加入约300 mL 水搅拌使其溶解后完全转移到量筒或量杯中定容至500 mL ,即配制得到500 mL 质量浓度为50.0 g·L -1的葡萄糖溶液。
基础化学第三版习题解答

述溶液加入一定体积的ωB= 的 H2SO4(相对密度 d = kg·L-1)配制成
1 000 mL 浓度为 mol·L-1 的 H2SO4 溶液?
解:500 mL mol ·L-1H2SO4 中,
n(H2SO4) = c1V1 = 500× = (mmol)
300 mL 0mol ·L-1H2SO4 中,
溶液变稀,乙溶液变浓,直到二者蒸气压相等,两溶液的浓度不再变化。
(3) 设当达到系统蒸气压平衡时,从乙溶液转移到甲溶液的水的质量为 y g,平衡时两
20.0 y)g
18.02g mol-1
18.02g mol-1
(20.0 y)g
1.68g
液的密度为 1.13 kg·L-1,计算此溶液的质量摩尔浓度、物质的量浓度和摩尔分数。
解:
bB
95 / 98 (400 5) 103
2.4(mol
kg -1)
cB
500
95 / 98 10 3 /1.13
2.2(mol L1)
x(H2SO 4 )
(95
95 / 98 / 98 ) (405
1.68g
0.996
18.02g mol-1 342g mol-1
20.0g
18.02g mol-1
xA 20.0g
0.997 2.45g
18.02g mol-1 690g mol-1
乙溶液溶剂的摩尔分数大,所以乙溶液的蒸气压大。
(2) 在同一个恒温密闭的钟罩里,乙溶液的蒸气压大,乙溶液的水会向甲溶液转移,甲
量。
解:两份非电解质的溶液在同一温度下结冰,说明两溶液的质量摩尔浓度相同。设某
非电解质的摩尔质量为 MB g·mol-1,有
基础生物化学练习题及答案

基础生物化学习题第一章核酸的结构和功能一、选择题1、热变性的DNA分子在适当条件下可以复性,条件之一是()。
A、骤然冷却B、缓慢冷却C、浓缩D、加入浓的无机盐2、在适宜条件下,核酸分子两条链通过杂交作用可自行形成双螺旋,取决于()。
A、DNA的Tm值B、序列的重复程度C、核酸链的长短D、碱基序列的互补3、核酸中核苷酸之间的连接方式是()。
A、2’,5’—磷酸二酯键B、氢键C、3’,5’—磷酸二酯键D、糖苷键4、tRNA的分子结构特征是()。
A、有反密码环和3’—端有—CCA序列B、有反密码环和5’—端有—CCA序列C、有密码环D、5’—端有—CCA序列5、下列关于DNA分子中的碱基组成的定量关系()是不正确的。
A、C+A=G+TB、C=GC、A=TD、C+G=A+T6、下面关于Watson-Crick DNA双螺旋结构模型的叙述中()是正确的。
A、两条单链的走向是反平行的B、碱基A和G配对C、碱基之间共价结合D、磷酸戊糖主链位于双螺旋内侧7、具5’-CpGpGpTpAp-3’顺序的单链DNA能与下列()RNA杂交。
A、5’-GpCpCpAp-3’B、5’-GpCpCpApUp-3’C、5’-UpApCpCpGp-3’D、5’-TpApCpCpGp-3’8、RNA和DNA彻底水解后的产物()。
A、核糖相同,部分碱基不同B、碱基相同,核糖不同C、碱基不同,核糖不同D、碱基不同,核糖相同9、下列关于mRNA描述,()是错误的。
A、原核细胞的mRNA在翻译开始前需加“PolyA”尾巴。
B、真核细胞mRNA在 3’端有特殊的“尾巴”结构C、真核细胞mRNA在5’端有特殊的“帽子”结构D、原核细胞mRNA在5’端有特殊的“帽子”结构10、tRNA的三级结构是()。
A、三叶草叶形结构B、倒L形结构C、双螺旋结构D、发夹结构11、维系DNA双螺旋稳定的最主要的力是()。
A、氢键B、离子键C、碱基堆积力 D范德华力12、下列关于DNA的双螺旋二级结构稳定的因素中()是不正确的。
基础化学习题01

第一章 绪 论 首 页 难题解析 学生自测题 学生自测答案 章后习题答案 难题解析 [TOP]例1-1 市售过氧化氢(俗称双氧水)含量为30%,密度为1.11kg·L -1。
计算该溶液的浓度、质量摩尔浓度和摩尔分数。
析 市售过氧化氢含量为质量体积百分比30%,运用式(1.1)能把H 2O 2的质量(H 2O 2)转换为物质的量:n (H 2O 2) = m (H 2O 2)/ M (H 2O 2),然后除以体积,即得浓度。
求算质量摩尔浓度,需用溶剂的质量做分母。
这一步通过密度把溶液的体积转换为溶液质量可以求得,方法是:溶液质量=溶液体积×密度;m (H 2O)=溶液质量- m (H 2O 2)。
解 c (H 2O 2) = 1L1000m L 100m L m ol 30g/34g )O H (/)O H (12222⨯⋅=-V M m = 8.8 mol·L -1 密度=1.11kg·L -1=1mL1.11g b (H 2O 2)()⎥⎦⎤⎢⎣⎡⨯⎪⎭⎫ ⎝⎛-⨯÷⋅=-1000g 1kg 0g 31mL 1.11g mL 100mol 30g/34g 1=11mol·kg -1 x (H 2O 2) = 1111mol 30g)/18g ml 1.11g (100ml mol 30g/34g mol 30g/34g ----⋅-⋅⨯+⋅⋅= 0.16 例1-2 有3.18g 铜粉,先让它全部氧化成氧化铜,再用6.00 mol·L -1的硫酸转化为硫酸铜。
试计算反应中消耗了多少摩尔氧气,需要硫酸多少毫升?析 本题看似复杂,但各步反应中都涉及铜的转化,因此把握铜的物质的量是关键。
第一步反应,Cu 、21O 2和CuO 的物质的量相等;第一步反应,CuO 和H 2SO 4的物质的量相等。
计算中注意,以21O 2为基本单元的氧气的物质的量是以O 2为基本单元的氧气的物质的量的一半。
基础化学习题1

《基础化学》习题(一)一. 单选题1.将红细胞置于体积比为1∶2的9.0g ⋅L -1 NaCl 溶液和50.0 g ⋅L -1葡萄糖溶液的混合溶液中,红细胞将 ( ) (M NaCl =58.5 g ⋅mol -1,M 葡萄糖=180 g ⋅mol -1)。
(A) 萎缩 (B) 膨胀 (C) 不受影响 (D) 无法判断2.下列溶液的渗透压由大到小的顺序是( )。
① C(C 6H 12O 6)=0.2mol ⋅L -1 ② C(Na 2CO 3)=0.2mol ⋅L -1③ C(Na 3PO 4)=0.2mol ⋅L -1 ④ C(NaCl)=0.2mol ⋅L -1(A) ①>②>③>④ (B) ③>②>④>①(C) ③>②>①>④ (D) ①>④>②>③3.如果某一体系从状态A 变到状态B 有两条途径:(1)A →C →B ;(2)A →D →E →B ;体系热力学能的改变值 ∆U 为( )。
(A) ∆U 1>∆U 2 (B) ∆U 1≠∆U 2 (C) ∆U 1=∆U 2 (D) ∆U 1<∆U 24.实验测得下列反应的热效应:C 6H 4(OH)2(aq)=C 6H 4O 2(aq)+H 2(g) ∆r H 1=177.4 kJ ⋅mol -1O 2(g)+2H 2O(l)=2H 2O 2(aq) ∆r H 2=189.1 kJ ⋅mol -1H 2O(l)=H 2(g)+12O 2(g) ∆r H 3=285.8 kJ ⋅mol -1则反应C 6H 4(OH)2(aq)+H 2O 2(aq)=C 6H 4O 2(aq)+2H 2O(l) 的焓变为( )。
(A) -203.0 kJ ⋅mol -1 (B) 203.0 kJ ⋅mol -1 (C) -609.0 kJ ⋅mol -1 (D) 609.0 kJ ⋅mol -15.盐效应使弱电解质的解离度( )。
A 升高. B. 降低 C. 不变 D. 无法判断6.取等体积的C(AgNO 3)=0.10mol ⋅L -1的AgNO 3和C(KI)=0.05 mol ⋅L -1的KI 两溶液制备溶胶,则所得胶团结构式为( )。
基础化学习题解答(第一章)

习题解答(第一章物质结构基础)思考与习题1.填空题(1)原子核外电子运动具有波粒二象性、能量变化不连续的特征,其运动规律可用量子力学来描述。
(2)当主量子数为3时,包含有3s、3p、3d三个亚层,各亚层为分别包含1、3、5个轨道,分别能容纳2、6、10个电子。
(3)同时用n、l、m和m s四个量子数可表示原子核外某电子的运动状态;用n、l、m 三个量子数表示核外电子运动的一个轨道;而n、l两个量子数确定原子轨道的能级。
(4)改错的现象称为能级交错。
3d4S(6)原子序数为35的元素,其基态原子的核外电子分布式为1s22s22p63s23p63d104s24p5,用原子实表示为[Ar]3d104s24p5,其价电子构型为4s24p5,价电子构型的轨道表示式为;该元素位于元素周期表的第ⅦA 族,第四周期,元素符号是Br 。
(7)等价轨道处于全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,具有较低的能量,比较稳定。
这一规律通常又称为洪德规则的特例。
(8)原子间通过共用电子对而形成的化学键,叫做共价键。
共价键的本质是原子轨道的重叠,其形成条件是两个具有自旋相反单电子的原子轨道,尽可能达到最大重叠。
(9)表征化学键性质的物理量,统称为键参数,常用的有键能、键长、键角。
(10)H2S分子的构型为V形,中心原子S采取sp3不等性杂化,键角∠HSH<109°28′(提示:填写>,=或<)。
(11)完成下表2.选择题(1)下列原子轨道中,属于等价轨道的一组是( C )。
A .2s ,3sB .2p x ,3p xC .2p x ,2p yD .3d xy ,4d xy(2)下列用一套量子数表示的电子运动状态中,能量最高的是( B )。
A .4,1,-1,-12B .4,2,0,-12C .4,0,0,+12D .3,1,1,+12(3)下列不存在的能级是( C )。
大学化学基础课后习题答案工科

13.实验测得下反应:A(g)+B(g)→产物,对A为一级反应,B 为二级反应,在某温度下的速率常数为0.05mol-2L-2s-1。
解: (1) 三级 (2) ν = kAB2 = 0.05×0.1×(0.05)2 =
1.25×10-5 mol/L
第3章 溶液和水溶液中的离子平衡
9. 知HClO的电离常数Ka=2.95×10-8,计算 0.05mol·dm-3 HClO溶液中的[H+]、[ClO-]及电离度。
解:由于
c 0.05mol / L Ka 2.95108 400 则可用以下公式进行近似计算
H c K c
H 2.95108 0.05
[H ] 3.84105
[ClO ] [H ] 3.84105 mol / L
)
3
(393.5)
0
0
2
(824.2)
467.9kJ / mol
r Sm (298.15K ) 3 (213.64) 4 27.28 3 5.74 2 87.4
558J mol1 K 1
要使反应自发进行,则
rGm r Hm (298.15K) TrSm(298.15K) 0 467.9kJ / mol T 558J mol1 K 1 103 0
[ Ag ]
Ksp
[CrO4 ]
91012 3105 mol / L 0.01
故Cl-先沉淀
第6章 电化学原理及其应用
12.
解: 由题意得:
K
[A2 ]3 [B3 ]2
基础化学第三版习题解答

基础化学(第3版) 思考题和练习题解析第一章 绪 论1. 为什么说化学和医学的关系密切,医学专业学生必须学好化学? 答:(略)2. “1 mol 硫酸的质量是98.0g ”,对吗?答:错误!未指明基本单元,正确说法是1 mol H 2SO 4的质量是98.0g 或1 mol [(1/2) (H 2SO 4)]的质量是49.0g 。
3. 0.4 mol H 2SO 4溶解于水,配成500 m L 溶液,其浓度表示正确的是 A. c (H 2SO 4) = 0.8 mol ·L -1B. c [21(H 2SO 4)] = 0.8 mol ·L -1C. c [21(H 2SO 4) ]= 0.4 mol ·L -1 D. 硫酸的浓度为0.8 mol ·L -1 答;正确的是A 。
根据定义,1L 溶液中含有0.8 mol H 2SO 4,c (H 2SO 4) = 0.8 mol ·L -1。
4. 下列说法正确的是A. “1 mol O ”可以说成“1 mol 原子O ”B. 1摩尔碳C 原子等于12gC. 1 L 溶液中含有H 2SO 4 98 g ,该溶液的摩尔浓度是1 mol ·L -1D. 基本单元不仅可以是构成物质的任何自然存在的粒子或粒子的组合,也可以是想象的或根据需要假设的种种粒子或其分割与组合答:正确的是D 。
A 应说成“1 mol 氧原子”;B 应为“1摩尔碳C 原子的质量等于12g ”; C 不应该使用“摩尔浓度”,此术语已被废除。
5. 求0.100kg (21Ca 2+)的物质的量。
解:M (21Ca 2+) =(40.08 / 2)= 20.04 (g · mol -1), n (21Ca 2+) = [ m / M (21Ca 2+) ] = (0.100×103)/20.04 = 4.99 (mol) 6. 每100m L 血浆含K +为20mg ,计算K +的物质的量浓度,单位用mmol ·L -1表示。
基础化学课后习题答案

基础化学 第一章 习题参考答案3. (1) 5位,(2) 3位,(3) 2位,(4)1位,(5)2位。
4. %1.0001.01024.00001.01024.01024.01023.0-=-=-=-=RE5. kPa}){}{}({m N 10}){}{}({dm m N }){}{}({ L J }){}{}({K mol K J L mol }){}{}({ ])[][]([}){}{}({][}{][}{][}{2331111-T R c T R c T R c T R c T R c T R c T R c T T R R c c cRT Π⨯⨯=⋅⨯⨯⨯=⋅⋅⨯⨯=⋅⨯⨯=⨯⋅⋅⨯⋅⨯⨯=⨯⨯⋅⨯⨯=⋅⨯⋅⨯⋅==-----式中,花括号代表量的值,方括号代表量的单位。
6. 1 mi 3 = 1.609 3443 km 3 = 4.168 182 km 3, 所以水资源的总体积V = (317 000 000 + 7 000 000 + 2 000 000 + 30 000) × 4.168 182 km 3 =1.3590 ×109 km 37.m ol 0.25 kg 1g1000 m ol g )00.10.160.23(kg 0.010(NaOH)1-=⨯⋅++=nmol1.89 kg 1g 1000 mol g )00.16301.1299.222(21kg 0.100 )CO Na 21(mol4.99 kg 1g1000 mol g 08.4021kg 0.100 )Ca 21(1-321-2=⨯⋅⨯++⨯⨯==⨯⋅⨯=+n n8. m ol 2.57 m ol g )35.45 239.65(g350)(ZnCl 1-2=⋅⨯+=n1-21-2k mol 3.95 kg 1g1000 650mol 2.57 )(ZnCl L mol 3.48 L1mL1000 mL 39.57mol 2.57)(ZnCl g g b c ⋅=⨯=⋅=⨯=9. 1-1--3L mmol 5.1 mol 1mmol1000 L 1L 100mL 1000 mol g 9.13g 10 20 )(K ⋅=⨯⨯⨯⋅⨯=+c1-1--3-L mmol 103 mol1mmol 1000 L 1L 100mL 1000 mol g 5.453g 10 366 )(Cl ⋅=⨯⨯⨯⋅⨯=c10. 设称取含结晶水的葡萄糖(C 6H 12O 6·H 2O)的质量为m ,052600. molg 16.0)1.01g/[(2 50)-(1000 mol 0.28mol0.278 )O H (C Lmol 0.278 mol g )0.16601.1120.126(L g 0.05 )O H (C g 27.5L g 50.0 L.50001g )0.1601.120.16601.1120.126(g)0.16601.1120.126( O)H O H (C 1-61261-1-1-61261-26126=⋅+⨯+=⋅=⋅⨯+⨯+⨯⋅==⋅=⨯+⨯+⨯+⨯+⨯⨯+⨯+⨯⨯=⋅x c m m ρ11. L .41 L g .091g 3.02g )5.350.23( g 5.0 (NaCl)1-=⋅⨯+⨯=V12. ∵ 10KI + 2KMnO 4 + 8H + = 12K + + 2MnO 2 + 5I 2 + 4H 2O∴ mol 0.004 mol g )9.1262(21g 0.508 )I 21( )KMnO 51 (KI 1-24=⋅⨯⨯==+n n基础化学 第二章 习题参考答案1. 根据 BA AA n n n x +=,mol 56.5mol 18.0g 100g O)(H 1-2=⋅=n mol 0292.0molg 342g 0.10)(1=⋅=-蔗糖n 995.0mol0292.0mol 56.5mol 56.5)(O)(H O)(H O)(H 222=+=+=蔗糖n n n xkPa 33.2995.0kPa 34.2O)(H 20=⨯==x p p2. (1) mol 004912.0molg 342g68.1)(1=⋅=-甲n mol 003551.0molg 690g45.2)(1=⋅=-乙n 1kg mol 2456.0kg0200.0mol004912.0-⋅==(甲)b1kg mol 1775.0kg0200.0mol003551.0-⋅==(乙)b溶液乙的蒸气压下降小,故蒸气压高。
基础化学第三版习题解答

基础化学(第3版)思考题和练习题解析第一章 绪 论1. 为什么说化学和医学的关系密切,医学专业学生必须学好化学?答:(略)2. “1 mol 硫酸的质量是98.0g ”,对吗?答:错误!未指明基本单元,正确说法是1 mol H 2SO 4的质量是98.0g 或1 mol[(1/2) (H 2SO 4)]的质量是49.0g 。
3. 0.4 mol H 2SO 4溶解于水,配成500 m L 溶液,其浓度表示正确的是A. c (H 2SO 4) = 0.8 mol·L -1B. c [21(H 2SO 4)] = 0.8 mol·L -1 C. c [21 (H 2SO 4) ]= 0.4 mol·L -1 D. 硫酸的浓度为0.8 mol·L -1 答;正确的是A 。
根据定义,1L 溶液中含有0.8 mol H 2SO 4,c (H 2SO 4) = 0.8 mol·L -1。
4. 下列说法正确的是A. “1 mol O ”可以说成“1 mol 原子O ”B. 1摩尔碳C 原子等于12gC. 1 L 溶液中含有H 2SO 4 98 g ,该溶液的摩尔浓度是1 mol·L -1D. 基本单元不仅可以是构成物质的任何自然存在的粒子或粒子的组合,也可以是想象的或根据需要假设的种种粒子或其分割与组合答:正确的是D 。
A 应说成“1 mol 氧原子”;B 应为“1摩尔碳C 原子的质量等于12g ”; C 不应该使用“摩尔浓度”,此术语已被废除。
5. 求0.100kg (21Ca 2+)的物质的量。
解:M (21Ca 2+) =(40.08 / 2)= 20.04 (g · mol -1), n (21Ca 2+) = [ m / M (21Ca 2+) ] = (0.100×103 )/20.04 = 4.99 (mol) 6. 每100m L 血浆含K + 为20mg ,计算K +的物质的量浓度,单位用mmol·L -1表示。
朱步瑶 赵振国 界面化学基础 习题答案

V
r3
4.03 108 1.967 104 3 12 1.27 10
26. (略) 27.有关系,因外部试管太小,在内、外管间会形成一凹液面,从而使基准点位置不 易确定。 28.
2 gh1 r1
2 gh2 r2
g
rr (h1 h2 ) 1 2 2 r2 r1
优点,不必校正液柱高度 29. p 水 gh p 1 gh '
2 r
2 水 gh l gh ' r 2 2 水 g (h1 h2 ) r1 r2
水 g
2
(h1 h2 )(
r1r2 ) r2 r1
当两管端口在液体中心处于同一水平位置时,不必校正。
pr 2338 0.9998 Pa=2337 Pa
pr
p平
0.9998
9
当 r 5 10 m 时
pr
p平
0.8080
pr 1890 Pa
上述计算说明,曲率半径越小,凹形液面上的饱和蒸气压越小,蒸气越容易凝聚。 16.对液珠,r>0 同样利用开尔文公式可得 当 r 5 10 m 时 当 r 5 10 m 时
1273k (380
s
380 450)mN m-1 335.0mN m-1 3797
1
8. U (22.05 293 0.096)mN m 1 mol 甲醇的体积为 32/0.8=40cm 每个甲醇分子的半径为
3
50.18mJ m2
40 3 3 8 r cm 2.5110 cm 23 4 6.02 10
若考虑到弯液面校正 弯液面上液体面积为
大一工程化学基础习题答案

第一章 原子结构和元素周期系[基本要求] 了解微观粒子运动的特性,熟悉原子轨道的概念,掌握四个量子数取值范围,会用量子数确定原子轨道及微观状态,记熟s 、p 、d 原子轨道的角分布图。
理解屏蔽效应和钻穿效应,会用鲍林近似能级图排布多电子原子核外电子。
理解原子结构同周期系的关系。
熟悉原子结构同有效电荷、原子半径、电离能、电子亲合能及电负性变化的周期性间的关系。
[重点] 四个量子数及原子轨道角分布图、多电子原子核外电子的排布,原子结构与周期系的关系。
[难点] 微观粒子运动的特殊性、四个量子数和原子轨道。
[参考教学学时] 6学时习题参考答案1. 用里德堡公式计算H 原子电离是需要吸收多少能量?满足这个能量的波长是多少?解:H 原子电离即指核外的一个电子从基态(n=1)跃迁到无穷远(n=∞、核作用不到的地方)。
所以,其所许能量为: E=hv=hR )11(2221n n - =hR ()11(2∞-I =6.626×10-34×3.289×1015×6.02×1023)(102.1314J ⨯=)13121-•=mol KJ (满足这个能量的波长为:λ=vc =)11(10289.31032221158n n -⨯⨯=15810289.3103⨯⨯=9.12⨯108-(m )=91.2(nm ) 2. 假若H 原子核外有一系列轨道的能量分别为:(1) -5.45×1019-J (2) -2.42×1019- (3) -1×1019-J (4) 0 J (5) +5.45×1019-J问:那些轨道是合理的,这些合理轨道分别是第几能级。
解:H 原子的能级公式为:E n =- )(10179.2218J n-⨯ n=1,2,3,… 当n=1 时,E 1=-1810179.2-⨯(J )n=2 时,E 2=-218210179.2-⨯=-5.448×1019-(J ) n=3 时,E 3=-218310179.2-⨯=-2.412×1019-(J ) n=4 时,E 4=-218410179.2-⨯=-1.362×1019-(J ) n=5 时,E 5=-218510179.2-⨯=-8.716×1020-(J ) n=∞ 时,E ∞=-218510179.2-⨯=0(J ) ∴(1)、(2)、(4)都是合理的,分别是第二能级,第三能级和电离态(n=∞)。
基础化学习题解答第七版

第一章1. 为什么说化学是一门中心科学?试举几例说明化学和医学的关系。
解 因为现代化学几乎与所有的科学和工程技术相关联,起着桥梁和纽带作用;这些科学和技术促进了化学学科的蓬勃发展,化学又反过来带动了科学和技术的进展,而且很多科技进步以化学层面的变革为突破口。
因此,化学是一门中心科学。
化学和医学的关系极为密切,无论是制药、生物材料、医学材料、医学检验,还是营养、卫生、疾病和环境保护,乃致对疾病、健康、器官组织结构和生命规律的认识,都离不开化学。
2. SI 单位制由哪几部分组成?请给出5个SI 倍数单位的例子。
解 国际单位制由SI 单位和SI 单位的倍数单位组成。
其中SI 单位分为SI 基本单位和SI 导出单位两大部分。
SI 单位的倍数单位由SI 词头加SI 单位构成。
例如mg 、nm 、ps 、μmol 、kJ 等等。
3. 下列数据,各包括几位有效数字?(1) 2.0321 g (2) 0.0215 L (3) p K HIn =6.30 (4) 0.01﹪ (5) 1.0×10-5 mol 解 (1) 5位,(2) 3位,(3) 2位,(4)1位,(5)2位。
4. 某物理量的真实值T = 0.1024,实验测定值X = 0.1023,测定值的相对误差RE 是多少?运用公式TT X RE -=,以百分率表示。
解%1.0001.01024.00001.01024.01024.01023.0-=-=-=-=RE5. 关于渗透压力的Va n ′t Hoff 公式写作cRT Π=,式中,c 是物质的量浓度,R 是摩尔气体常数,T 是绝对温度。
通过量纲分析证明渗透压力Π的单位是kPa 。
解kPa}){}{}({m N 10}){}{}({dmm N }){}{}({ LJ }){}{}({K molKJ L mol }){}{}({ ])[][]([}){}{}({][}{][}{][}{2331111-T R c T R c T R c T R c T R c T R c T R c T T R R c c cRT Π⨯⨯=⋅⨯⨯⨯=⋅⋅⨯⨯=⋅⨯⨯=⨯⋅⋅⨯⋅⨯⨯=⨯⨯⋅⨯⨯=⋅⨯⋅⨯⋅==----- 式中,花括号代表量的值,方括号代表量的单位。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
习题解答(第一章物质结构基础)思考与习题1.填空题(1)原子核外电子运动具有波粒二象性、能量变化不连续的特征,其运动规律可用量子力学来描述。
(2)当主量子数为3时,包含有3s 、3p 、3d 三个亚层,各亚层为分别包含 1 、 3 、 5 个轨道,分别能容纳 2 、 6 、10 个电子。
(3)同时用n、l、m和m s四个量子数可表示原子核外某电子的运动状态;用n、l、m 三个量子数表示核外电子运动的一个轨道;而n、l两个量子数确定原子轨道的能级。
(4)改错的现象称为能级交错。
3d4S(6)原子序数为35的元素,其基态原子的核外电子分布式为1s22s22p63s23p63d104s24p5,用原子实表示为[Ar]3d104s24p5,其价电子构型为4s24p5,价电子构型的轨道表示式为;该元素位于元素周期表的第ⅦA 族,第四周期,元素符号是Br 。
(7)等价轨道处于全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,具有较低的能量,比较稳定。
这一规律通常又称为洪德规则的特例。
(8)原子间通过共用电子对而形成的化学键,叫做共价键。
共价键的本质是原子轨道的重叠,其形成条件是两个具有自旋相反单电子的原子轨道,尽可能达到最大重叠。
(9)表征化学键性质的物理量,统称为键参数,常用的有键能、键长、键角。
(10)H2S分子的构型为V 形,中心原子S采取sp3不等性杂化,键角∠HSH<109°28′(提示:填写>,=或<)。
(11)完成下表2.选择题(1)下列原子轨道中,属于等价轨道的一组是( C )。
A .2s ,3sB .2p x ,3p xC .2p x ,2p yD .3d xy ,4d xy(2)下列用一套量子数表示的电子运动状态中,能量最高的是( B )。
A .4,1,-1,-12B .4,2,0,-12C .4,0,0,+12D .3,1,1,+12(3)下列不存在的能级是( C )。
A .3sB .2pC .3fD .4d(4)根据元素在元素周期表中的位置,指出下列化合物中,化学键极性最大的是( B )。
A .H 2SB .H 2OC .NH 3D .CH 4(5)根据元素在元素周期表中的位置,指出下列同浓度溶液中,酸性最强的是( B )。
A .H 2SO 4B .HClO 4C .H 3PO 4D .HBrO 4(6)下列各键中,不具有饱和性和方向性特征的是( C )。
A .配位键B .共价键C .离子键D .氢键(7)下列化合物中,具有强极性共价键和配位键的离子化合物为A .NaOHB .H 2OC .NH 4ClD .MgCl 2(8)下列关于CS 2分子的杂化方式和空间构型的叙述中,正确的是( D )。
A .平面三角形,sp 2杂化B .V 形,sp 2杂化C .三角锥形,sp 3不等性杂化D .直线形,sp 杂化(9)下列分子中,偶极矩为零是( C )。
A .CHCl 3B .NF 3C .BF 3D .HCN(10)下列分子中,属于极性分子的是( D )。
A .O 2B .CO 2C .BBr 3D .CHCl 3(11)下列各组物质沸点比较正确的是( A )。
A .CH 3OH <CH 3CH 2OHB .H 2O <H 2SC .SiH 4<CH 4D .F 2>Cl 2(12)下列晶体中,只需克服色散力就能熔化的是( B )。
A .HFB .I 2C .NH 3D .HCl3.判断题(正确的划“√”,错误的划“×”)(1)原子中电子的能量只与主量子数有关。
( × )(2)磁量子数为零的轨道都是s 轨道。
( × )(3)主量子数为1时,有两个自旋方向相反的轨道。
( × )(4)当原子获得能量时,核外电子可以跃迁到较高的能级,使原子由基态变为激发态,因此3Li原子的核外电子分布可以是1s22d1。
(×)(5)同一原子中,不可能有运动状态完全相同的电子存在。
(√)(6)每个原子轨道必须同时用n、l、m和m s四个量子数来描述。
(×)(7)基态多电子原子中,E3d>E4S的现象称为洪德规则的特例。
(×)(8)28Ni2+的核外电子分布是[Ar]3d8,而不是[Ar]3d64s2(√)(9)根据元素在周期表中的位置,可以断定气态氢化物的稳定性PH3<H2O。
(√)(10)由于离子键具有无饱和性,无方向性的特征,所以阴、阳离子周围吸引带相反电荷离子的数目是任意的。
(×)(11)从本质上讲,共价键是通过原子轨道重叠而形成的化学键。
(√)(12)共价键不一定都具有饱和性和方向性。
(√)(13)s电子之间形成的共价键为σ键,p电子之间形成的化学键为π键。
(×)(14)原子轨道重叠越多,形成的共价键越稳定。
(×)(15)多原子分子中,键的极性越强,分子的极性越强。
(×)(16)按共用电子对偏移程度可将共价键分为极性健和非极性健,而极性强弱可由成键两原子的电负性之差来判断。
(√)(17)由于CHCl3分子中,C原子采取sp3杂化,所以其空间构型为正四面体。
(×)(18)只有非极性分子和极性分子之间才有诱导力。
(×)(19)CCl4的熔点、沸点低,所以分子不稳定。
(×)(20)HNO3可形成分子内氢键,因此其熔、沸点较低。
(√)4.简答题(1)为什么2p亚层,又可称为2p能级?答原子核外电子的能量仅取决于主量子数(n)和角量子数(l)。
若n、l值一经确定,电子的能量就已被确定,即各电子层的不同亚层,都有一个对应的能量状态,它们高低不同,像台阶一样,称之为能级。
因此,2s、2p、3d等亚层,又分别称为2s、2p、3d能级。
(2)当主量子数是4时,请指出包含的亚层和各亚层的轨道数,并归纳轨道总数及所能容纳的电子总数与主量子数的关系。
答当主量子数是4时,包含4s、4p、4d、4f四个亚层,各亚层的轨道数分别为1、3、5、7,共包含16个轨道,为42,即轨道总数是n2;由于每个轨道最多能容纳两个自旋方向相反的电子,因此该电子层所能容纳的电子总数为32,为2×42,即所能容纳的电子总数为2n2。
(3)举例说明什么是价电子构型?答原子中能参与化学反应,即形成化学键的电子,称为价电子。
价电子的电子分布称为价电子构型。
例如,Cl的价电子构型为3s23p5。
(4)总结元素周期表中,同周期从左至右,同族从上到下,主族元素的有效核电荷数、原子半径、电离能、电负性、氧化数、元素的金属性与非金属性等基本性质的变化规律。
答同周期从左至右,主族元素Z*↑,r↓,I1↑,X↑;最高氧化数=族序数,负氧化数=│8-最高氧化数│;金属性减弱,非金属性增强。
同主族从上到下,元素的Z*↑,r↑,I1↓,X↓;金属性增强,非金属性减弱。
(5)共价键有哪些特征?请举例说明之。
答共价键有饱和性和方向性的特征。
例如,H原子仅有一个单电子,根据电子配对原理,当其与另一个具有自旋方向相反H原子配对成键后,就不能再与其它原子配对成键了,这就是共价键的饱和性;而形成H—Cl键时,H原子的1s轨道只有沿x轴正方向与Cl原子的3p x轨道进行同号重叠,才能达到最大有效重叠,这就是共价键的方向性。
(6)指出配位键的形成条件及其表示方法。
答形成配位键需具备两个条件:提供共用电子对的原子(称为电子的给予体)其价电子层有孤对电子;接受共用电子对的原子(称为电子的接受体)其价电子层有空轨道。
配位键用“→”表示,箭头指向接受电子对的原子。
(7)说明共价键的两种断裂方式,并指出断裂后的产物。
答共价键的断裂方式有均裂和异裂两种。
若共价键断裂后,组成该键的共用电子对由两个成键原子各留一个,则称为均裂。
相反,如果共用电子对归一个原子所有,则这种断裂称为异裂。
均裂过程产生自由基;异裂过程产生了阴、阳离子。
(8)为什么组成、结构相似的分子,通常熔、沸点会随相对分子质量的增大而升高?答色散力士主要的分子间力,由于组成、结构相似的分子随相对分子质量的增大,分子的变形性增大,色散力增大,因此其熔、沸点会随之升高。
(9)为什么I2易溶于CCl4,而难溶于水?答I2、CCl4都是非极性分子,而H2O是极性分子,根据“相似相溶”规律,I2与CCl4易于相互溶解;而I2与H2O则难于相互溶解。
(10)氢键的形成过程如何示意?其形成条件是什么?为什么CH4、HCl均不能形成氢键?答氢键的形成可示意为X-H…Y,其中X、Y可以相同,也可以不同。
形成氢键的条件是:X、Y电负性大,原子半径小;X-H为强极性键,Y带有部分负电荷,具有吸引H 原子核的能力。
C的电负性比较小,即C—H键中C原子所带部分负电荷较少,吸引H原子核的能力较弱,因此CH4不能形成氢键;虽然Cl的电负性较大,但其原子半径较大,难以与H原子核形成较强的静电引力,因此HCl也不能形成氢键。
