气体摩尔体积计算
气体摩尔体积

二、影响物质体积大小的因素
①微粒数目 ②微粒大小 ③微粒间距
固体、液体:紧密排列 ∴微粒大小>>微粒间距 ∴固体、液体体积主要取决于微粒大小 和微粒数目 ∴1mol固体、液体体积一般不相同
气体: 微粒间距>>微粒大小 微粒间距取决于 ——温度和压强 ∴气体体积主要取决于温度、压强和微 粒数目 ∴1mol气体在相同的温度和压强下,体 积相同
三、阿伏加德罗定律
在相同的温度和压强下,相同体积的任何气 体都含有相同数目的分子。 推论1:在同温同压下,气体的体积正比于气 体的物质的量 推论2:在同温同压下,不同气体的体积比等 于它们的物质的量之比
1、相对密度(两种气体的密度之比)
ρ1 D= ρ2
ρ1 M 1 = ρ2 M2
2、混合气体平均式量(平均摩尔质量) (平均ቤተ መጻሕፍቲ ባይዱ对分子质量,平均分子量)
总质量 M= 总物质的量
M = M A × a % + M B × b% + ......
【练习】
1、空气的成分为:N2 78%,O2 21%,稀有 气体0.94%(全部看作成分最多的氩— 40),CO2 0.03%,水蒸气0.03%。 求(1)空气的平均式量,(2)150g空气 中含氧气的质量。 2、计算25℃、101kPa条件下,3L氧气和9L 甲烷组成的混合气体的平均式量。
第二节 气体摩尔体积
Molar Volume of Gas
计算1mol下列物质在0℃,1个标准大气 压下的体积:
①铁 ρ=7.8g/cm3 ②铝 ρ=2.7g/cm3 ③ 铅ρ=11.3g/cm3 ④水 ⑤ 纯硫酸ρ=1.81g/cm3 ⑥ 纯酒精 ρ=0.789g/cm3 ⑦ 氢气 ρ=0.0893g/L ⑧ 氧气 ρ=1.429g/L ⑨二氧化碳 ρ=1.97g/L
气体摩尔体积的计算共17页

3、掌握阿伏加德罗定律及其简单的推论
1同温同 V1 压 N1 n1
V2 N2 n2
2同温同 1 2压 M M1 2 D相对密
3同温同P1体 N积 1 n1
P2 N2 n2(二)Fra bibliotek型❖1、标准状况下气体体积、气体质量、气体物 质的量、气体分子数之间的相互换算。
2、求气体的相对分子质量
• 例1、 在标准状况下,测得1.92g某气 体的体积为672mL。计算此气体的相对 分子质量。
• (2)求混合气体中各组分的体积分数 及质量分数
• 例6、0.5molH2和0.5molO2在标准状况 下混合,求混合气中H2和O2所占的体积 分数及质量分数。
课堂练习
• 1. 150℃时碳酸铵完全分解产
• 生的气体混合物,其密度是相
• 同条件下氢气密度的( )
〖(NH4)2CO3=2NH3+CO2+H2O〗
• 生成9.6g C和7.2g D及另一气体E,已
• 知E的密度是H2密度的15.5倍,则气体 • E在标准状况下的体积是( )
• A. 2.24L
B. 4.48L
• C. 5.6L
D. 11.2L
• 4. 同温同压下,x g的甲气体与y g的乙气体占有相同 的体积,则x:y的值可以表示( )
• A. 甲与乙的相对分子质量之比
• 物质的量、气体体积、气体摩尔体积 之间的关系
n=V/Vm
1关系图
m M n NA
M
NA
N
Vm Vm
V(状况 )
2标准状 nV V 况 m2下 .4 2L V m o 1 l
关于气体摩尔体积的计算
(一)依据
1、准确理解物质的量、摩尔、摩尔质 量、气体摩尔体积等概念。
气体摩尔体积

判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( ╳ ) 2、常温常压,11.2LCl2含有的分子数为 0.5NA(╳ ) 3、常温常压,1molHe含有的原子数为NA ( √ ) 4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( √ )
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含
的原子数相同( ╳
)
) ) )
2. 1molCO2占有的体积约是22.4L( 3. 标况下, 1molH2O的体积约是22.4L( 4. CO在标况下占有的体积约是22.4L(
判断下列说法是否正确:
1. 同温同压时, 同体积的任何气体单质所含
╳ )
)
6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( 7. 标况下1L甲烷与1LH2所含分子数相同 ( 的质量一定不相等( ) ) 8. 同温同压下,amolCl2和bmolO2(a≠b)
5. 1molCO2和1molSO2所占有的体积相同,
所含的分子个数也相同(
╳ )
)
6. 1LCO和1LCO2气体,在同温同压下所含 的原子个数相同( ╳ 7. 标况下1L甲烷与1LH2所含分子数相同 ( 的质量一定不相等( ) ) 8. 同温同压下,amolCl2和bmolO2(a≠b)
判断下列说法是否正确:
1、200C,1个大气压时,11.2LO2所含原子 数为NA( ╳ ) 2、常温常压,11.2LCl2含有的分子数为 0.5NA( ) 3、常温常压,1molHe含有的原子数为NA ( ) 4、常温常压,2.3gNa由原子变为离子时,失 去的电子数为0.1 NA( )
判断下列说法是否正确:
气体摩尔体积

1.气体摩尔体积
(1)单位物质的量的气体所占的体积,叫气体摩尔体积,其符号是V m,即V m=,单位是L/mol和m3/mol。
(2)标准状况是指0℃、101 kPa时的状况,标准状况下1 mol任何气体所占的体积都约是22.4 L。
四个要点:
①必须是气体物质,不适用于固体、液体;
②物质的量为1 mol;
③必须是标准状况;
④体积约是22.4 L。
注意:标况下非气体H2O 苯四氯化碳乙醇三氧化硫碳数大于四的烃
2.标准状况下气体体积、物质的量、分子数之间的计算
(1)体积(V)与物质的量(n)的关系
(2)体积(V)与气体质量(m)的关系
(3)体积(V)与微粒数(N)的关系
规律总结
①气体摩尔体积的大小,与气体所处的温度和压强有关,故见到22.4 L/mol一定要标况
②气体摩尔体积(V m)不仅适用于纯净的气体,还适用于混合气体。
例:
1. 标况下,44.8L二氧化碳分子摩尔,氧原子摩尔,二氧化碳质量克,碳原子质量克,原子多少个,质子个,中子个,电子个。
2. 标况下,44.8L氨气,分子摩尔,氢原子摩尔,氨气质量克,氮原子质量克,原子多少个,质子个,中子个,电子个。
3. 标况下,4
4.8L甲烷,分子摩尔,氢原子摩尔,甲烷质量克,氢原子质量克,原子多少个,质子个,中子个,电子个。
4.标况下,水的体积44.8L ,水的质量克。
5.标况下,氢气和氧气混合气体共44.8L ,混合气体分子摩尔。
气体摩尔体积的计算
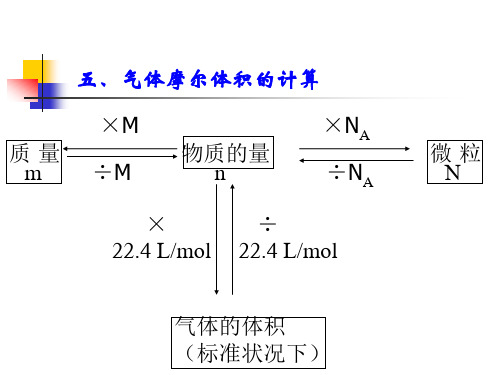
质量 m
×M ÷M
物质的量 n
×NA ÷NA
×
÷
22.4 L/mol 22.4 L/mol
微粒 N
气体的体积 (标准状况下)
五、气体摩尔体积的计算
(一氨在标准状态时的体积是多少升?
五、气体摩尔体积的计算
(二)、求式量
五、气体摩尔体积的计算
(三)、有关化学方程式的计算
△ MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
质量比:87 146
126 71
36
被氧化HCl
73
分子数比:1 4
11
2
2
物质的量比:1 4
11
2
2
体积关系:1mol 4mol
1mol 22.4L 2mol (标准状况)
2mol
五、气体摩尔体积的计算
五、气体摩尔体积的计算
将10.6gNa2CO3加入到足量盐酸 中,并将生成的气体全部通入溶有
0.50mol Ca(OH)2的溶液中,
充分反应后可得到沉淀
g。
作业
1、实验室利用MnO2与浓HCl反应制取 Cl2,若制取标准状况下的Cl23.36升,则 被氧化的盐酸的物质的量为多少摩尔,需 MnO2多少克?
A.11.2L B.5.6L C.22.4L D.16.8L
五、气体摩尔体积的计算
取50mLNa2CO3和Na2SO4的混合溶液, 加入过量的BaCl2溶液后得到14.51g白色 沉 淀 , 用 过 量 稀 HNO3 处 理 后 沉 淀 量 减 少到4.66g,并有气体放出。试计算: (1)原混合溶液中Na2CO3和Na2SO4的 物质的量。 (2)产生的气体在标准状况下的体积。
重难点八 气体摩尔体积及相关计算

重难点八气体摩尔体积及相关计算【要点解读】1.气体摩尔体积的正确理解2.气体摩尔体积的适用范围气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。
3.气体摩尔体积相关计算①气体的物质的量n=V Vm②气体的摩尔质量M=Vm·ρ=22.4ρ(标准状况下)③气体的分子数N=n·NA =VVm·NA④气体的质量m=n·M=VVm ·M【特别提醒】(1)气体摩尔体积与温度、压强有关,标准状况下的气体摩尔体积为22.4 L·mol-1,非标准状况下的气体摩尔体积也有可能是22.4 L·mol-1。
(2)使用22.4 L·mol-1时的注意事项①条件:必须为标准状况,因此使用时,一定要看清气体所处的状况。
②物质状态:必须为气体。
如水、酒精、四氯化碳等物质在标准状况下不是气体。
③数值:22.4 L·mol-1是近似值。
【重难点指数】★★★【重难点考向一】气体摩尔体积概念理解 【例1】下列说法中正确的是( )A .1 mol O 2和1 mol N 2所占的体积约为22.4 LB .标准状况下,H 2的气体摩尔体积约为22.4 LC .在标准状况下,1 mol H 2和1 mol H 2O 所占的体积都约为22.4 LD .在标准状况下,22.4 L 由N 2、N 2O 组成的混合气体中所含有的N 原子的物质的量约为2 mol【重难点点睛】气体摩尔体积使用时注意(1)1个条件:必须指明条件。
非标准状况下,1 mol 气体的体积不一定是22.4 L 。
(2)1种状态:必须为气态。
如水、酒精、SO 3、CCl 4等物质在标准状况下不是气体。
(3)1个单位:气体摩尔体积单位是L·mol -1,而不是L 。
【重难点考向二】气体摩尔体积的相关应用【例2】如图两瓶体积相等的气体,在同温、同压时瓶内气体的关系一定正确的是A .所含原子数相等B .所含分子数相等C .气体质量相等D .所含C 原子数相等 【重难点特训】1.如果ag 某气体中含有的分子数为b ,则cg 该气体在标准状况下的体积是( )A .22.4b ac A N LB .22.4ab c A N LC .22.4ac b A N LD .22.4bca A N L 2.一定温度和压强下,用mg 的CH 4、CO 2、O 2、SO 2四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )A .气球②中装的是O 2B .气球①和气球③中气体分子数相等C .气球①和气球④中气体物质的量之比为4∶1D .气球③和气球④中气体密度之比为2∶13.如图所示实验装置用于测定气体摩尔体积,相关叙述正确的是( ) A .用CCl4代替水,测得氢气的体积更准确B .量气管压入漏斗的水过多而溢出,会导致测定失败C .必须待体系温度降低到0℃时才可进行读数D .上提水准管,量气管液面高度不断改变,说明装置漏气 4.下列说法正确的是( )A .同温同压下甲烷和氧气的密度之比为2∶1B .1 g 甲烷和1 g 氧气的原子数之比为5∶1C .等物质的量的甲烷和氧气的质量之比为2∶1D .在标准状况下等质量的甲烷和氧气的体积之比为1∶2重难点八气体摩尔体积及相关计算【要点解读】1.气体摩尔体积的正确理解2.气体摩尔体积的适用范围气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。
气体摩尔体积及阿伏伽德罗定律和物质的量浓度计算

单位:L/mol 定义:1摩尔任何气体在标准状况下的体积都约为22.4升 符号:Vₘ 适用范围:适用于气体,不适用于液体、固体
计算公式:V=n×Vm 解释:V表示气体的摩尔体积,n表示物质的量,Vm表示摩尔体积常数 适用范围:适用于标准状况下的气体,不适用于非气体物质 注意事项:计算时需注意单位换算,如体积单位为升,物质的量单位为摩尔
物质的量浓度与阿伏伽德罗定律之间存在 密切关系,可以通过阿伏伽德罗定律推导 出来。
阿伏伽德罗定律表明,在等温、等压条 件下,气体的体积与物质的量成正比, 因此物质的量浓度与阿伏伽德罗定律之 间存在反比关系。
汇报人:XX
之间的距离。
添加标题
计算气体分子的平 均摩尔质量:利用 阿伏伽德罗定律可 以计算气体的平均 摩尔质量,这对于 确定气体的化学性 质和物理性质非常
重要。
添加标题
PART THREE
物质的量浓度是指单位体积溶 液中所含溶质的物质的量
常用单位为mol/L或mol/m³
计算公式为:c = n/V,其中n 为溶质的物质的量,V为溶液 的体积
添加标题
添加标题
添加标题
添加标题
适用于理想气体,不适用于真实气 体。
适用于温度和压强不变的情况。
物质的量与微粒数的关系:n = N/NA
物质的量与质量的关系:m = n*M
物质的量浓度与物质的量之间 的关系:c = n/V
气体摩尔体积与阿伏伽德罗定 律的关系:V = n*Vm
计算气体分子数: 利用阿伏伽德罗 定律可以计算一 定体积的气体所 含的分子数。
适用于标准状况下的气体
适用于气体物质,不适用于液体或 固体
添加标题
添加标题
适用于气体混合物
第二次课气体摩尔体积的计算

气体摩尔体积(V m)①定义:在标准状况下(0℃,101kPa时),1摩尔气体所占的体积叫做气体摩尔体积。
②定义公式为:③数值:气体的摩尔体积约为22.4升/摩(L/mol)。
④注意:对于气体摩尔体积,在使用时一定注意如下几个方面:一个条件(标准状况,符号SPT),一个对象(只限于气体,不管是纯净气体还是混合气体都可),两个数据(“1摩”、“约22.4升”)。
如“1mol氧气为22.4升”、“标准状况下1摩水的体积约为22.4升”、“标准状况下NO2的体积约为22.4升”都是不正确的。
⑤理解:我们可以认为22.4升/摩是特定温度和压强(0℃,101kPa)下的气体摩尔体积。
当温度和压强发生变化时,气体摩尔体积的数值一般也会发生相应的变化,如273℃,101kPa时,气体的摩尔体积为44.8升/摩。
5.阿伏加德罗定律①决定物质体积的三因素:物质的体积由物质的微粒数、微粒本身体积、微粒间的距离三者决定。
气体体积主要取决于分子数的多少和分子间的距离;同温同压下气体分子间距离基本相等,故有阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
反之也成立。
②阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
③阿伏加德罗定律及推论适用的前提和对象:可适用于同温、同压的任何气体。
6.阿伏加德罗定律的有关推论:(其中V、n 、p、ρ、M分别代表气体的体积、物质的量、压强、密度和摩尔质量。
)①同温同压下:;②同温同体积:。
标准状况下气体密度的计算根据初中所学知识,密度=质量÷体积,下面我们取标准状况下1mol某气体,则该气体的质量在数值上等于摩尔质量,体积在数值上等于摩尔体积,所以可得如下计算公式:标况下气体的密度(g·L-1)=气体的摩尔质量(g·mol-1)÷标况下气体的摩尔体积(L·mol-1)。
气体摩尔体积练习一、填空1.决定一定量气体体积大小的主要因素是()A.气体分子的质量B.气体分子的大小C.气体所含原子数的多少D.气体分子间平均距离大小2.下列说法正确的()A.任何情况下,气体摩尔体积都是22.4Lmol-1B.非标准状况下,1mol任何气体的体积不可能为22.4LC.22.4L任何气体中都约含有6.02×1023个分子D.0.1molH2、0.2molO2、0.3moN2和0.4molCO2组成的混合气体在标准状况下所占体积,也约为22.4L3.下列说法中正确的是()A.含0.1 mol BaCl2的溶液中Cl-数为0.2 N AB.22 g CO2所含有的分子数为0.5 N AC.11.2L CO2所含有的分子数为0.5 N AD.常温下N A个Cl2分子所占有的体积为22.4L4.标准状况下,32g某气体的分子数目与22 g CO2的分子数目相同,该气体M为( )A.32B.32 g/ molC.64g/ molD.645.下列物质中,所含分子数相等的是()A.等体积的H2和O2B.14gCO和0.5molO2C.22.4LH2和32gO2D.0.25molO2和5.6LH2S气体6.有一真空储气瓶,净重500g,在同温同压下,充满氧气后重508g,装满另一种气体A时重511g,则A的相对分子质量为()A .44B .48C .64D .717.在相同条件下,两个体积相等的容器,一个充满一氧化氮气体,另一个充满氧气和氮气的混合气体,这两个容器内一定具有相同的()A.原子总数B.质子总数C.分子总数D.质量8.在相同温度下,相同质量的下列气体分别通入相同容积的容器中,容器内压强最小的是()A.HF B.Ar C.SO2D.Cl2在标准状况下,下列四种气体的关系中,从大到小的是()9.①6.72LCH4②3.01×1023个HC1 分子③13.6gH2S ④0.2molNH3,A.体积④>①>②>③B.密度②>③>④>①C.质量②>③>①>④D.氢原子数①>②>③>④10.含有H2和CO(体积比为1:2)的混合气体VL,当其完全燃烧时,需相同条件下O2的体积为()A.3VL B.2VL C.VL D.0.5VL11.下列关于agH2和bgHe 的说法正确的是()A.同温同压下,H2和He的体积比是a:2bB.同温同压下,若a=b,则H2与He的物质的量之比是1:1C.体积相同时,He 的质量一定大于H2的质量D.同温同压下,若二者的物质的量相等,其体积也相等12.设N A代表阿伏加德罗常数,下列说法正确的是()A.2.3g金属钠变为钠离子时失去的电子数目为0.1N AB.常温常压下,11.2L氯气所含的原子数目为N AC.32g氧气的体积为22.4LD.体积相同的H2和O2含有相同的分子数13.有N2、CO、CO2三种气体,它们的质量比为1:2:2,在同温同压下它们的体积比()A.1:2:2 B.2:2:1 C.11:14:14D.7:14:1114.如果a g某气体中所含有的分子数为b,则c g该气体在标准状况下的体积是(式中N A为阿伏加德罗常数)()A.22.4bc/aN A LB. 22.4ab/cN A LC.22.4ac/ bN A LD. 22.4b/acN A L二、填空1.下列数量的各物质:(1)0.5molNH3 (2)标准状况下22.4L氦(He),(3)4。
气体摩尔体积

气体摩尔体积百科名片摩尔体积的计算在标准状况(STP)0℃( 273K)、1.01×10^5Pa下,1摩尔任何理想气体所占的体积都约为22.4升,这个体积叫做该气体的摩尔体积,单位是L/ mol(升/摩尔),即标准状况下(STP)气体摩尔体积为22.4L/mol。
目录简介解释阿伏加德罗定律推论为什么气体有摩尔体积而固液体没有展开简介定义:一单位物质的量(1mol)的气体所占的体积,叫气体摩尔体积。
使用时应注意:①必须是标准状况(0℃,101kPa)。
在高中化学学习中取22.4L/mol。
②“任何理想气体”既包括纯净物又包括气体混合物。
③22.4升是个近似数值。
④单位是L/mol,而不是L。
⑤决定气体摩尔体积大小的因素是气体分子间的平均距离及气体的物质的量;影响因素是温度,压强。
⑥在标准状况下,1mol H2O的体积也不是22.4L。
因为,标准状况下的H2O 是冰水混合物,不是气体。
⑦气体摩尔体积通常用Vm表示,计算公式n=V/Vm,Vm表示气体摩尔体积,V表示体积,n表示物质的量。
⑧标况下,1mol的任何气体的体积是22.4L,但22.4L的气体不一定是1mol单位物质的量的理想气体所占的体积叫做气体摩尔体积。
相同体积的气体其含有的粒子数也相同。
气体摩尔体积不是固定不变的,它决定于气体所处的温度和压强。
如在25度101KPa时气体摩尔体积为24.5L/mol。
定义:在相同的温度和压强下,1mol任何气体所占的体积在数值上近似相等。
人们将一定的温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积。
公式:n=m/M=N/NA=V/Vm解释体积与物质粒子的关系(1)总结规律:①相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体[水除外]。
②相同条件下,相同物质的量的气体体积近似相等,而固体、液体却不相等。
(2)决定物质体积大小的因素:①物质粒子数的多少;②物质粒子本身的大小;③物质粒子之间距离的大小。
气体的摩尔体积测定方法

气体的摩尔体积测定方法摩尔体积是指在标准温度和压力下,1摩尔气体所占据的体积。
摩尔体积的测定对于研究气体的性质和化学反应有着重要的意义。
本文将介绍几种常用的气体摩尔体积测定方法。
一、容积法容积法是最常用的测定气体摩尔体积的方法之一。
实验中,首先需要准备一个已知体积的容器,如气球或气管。
然后,将气体通过适当的装置(如气体收集瓶)收集到容器中,记录下气体的体积和温度、压力等相关参数。
根据理想气体状态方程PV=nRT,可以计算出气体的摩尔体积。
二、水位法水位法是一种简单而常用的测定气体摩尔体积的方法。
实验中,首先需要准备一个带有刻度的玻璃管,将一端封闭,另一端与水槽相连。
然后,将气体通过适当的装置(如气体收集瓶)收集到玻璃管中,观察气体的体积变化,同时记录下水位的变化。
根据气体与水的体积比例关系,可以计算出气体的摩尔体积。
三、密度法密度法是一种通过测定气体的密度来计算摩尔体积的方法。
实验中,首先需要准备一个已知体积的容器,如气球或气管。
然后,将气体通过适当的装置(如气体收集瓶)收集到容器中,同时测量气体的质量和体积。
根据气体的密度公式ρ=m/V,可以计算出气体的密度。
再根据理想气体状态方程PV=nRT,可以计算出气体的摩尔体积。
四、扩散法扩散法是一种通过测定气体的扩散速率来计算摩尔体积的方法。
实验中,首先需要准备一个扩散装置,如扩散管或扩散室。
然后,将气体通过适当的装置(如气体收集瓶)收集到扩散装置中,同时测量气体的扩散时间和距离。
根据扩散速率公式v=Δx/Δt,可以计算出气体的扩散速率。
再根据理想气体状态方程PV=nRT,可以计算出气体的摩尔体积。
总结:气体的摩尔体积测定方法有容积法、水位法、密度法和扩散法等。
不同的方法适用于不同的实验条件和气体性质。
在进行实验时,需要注意控制温度、压力和其他相关参数的准确测量,以确保实验结果的准确性和可靠性。
通过测定气体的摩尔体积,可以更好地理解气体的性质和化学反应机理,为相关研究和应用提供重要的参考依据。
气体摩尔体积

2mol×32g/mol+8mol×28g/mol M= 2mol + 8mol = 28.8g/mol 既混合气体的平均相对分子质量为 28.8 。
练习1:
某水煤气中H2和CO的体积分数都是50%,求 平均相对分子质量,若H2和CO的质量分数都 是50%,求平均相对分子质量。
【练习2】 碳酸铵在150 oC完全分解生成氨、二
②液体质量差量法 例2:天平两端各放一只质量相等的烧 杯,内盛等体积等浓度的足量稀盐酸,将 物质的量都为a mol的铝和镁分别放入左 盘和右盘的烧杯中,反应完毕后,在哪一 盘的烧杯中加入多少克同种金属才能平衡。 练习. 把 5g锌放入35g未知浓度的稀硫酸 中, 反应停止后,锌有剩余,取出锌,称量溶液 质量为36.5g ,求反应前稀硫酸的质量分数。
(A)XY3 (C)X3Y (B)XY (D)X2Y3
推论2:同温、同体积,气体的压强之比=分子 数之比 P n
1 —— = — 1 T、V相同, P2 n2
【练习4】常温下,在一容积不变的密闭容器 中,氯气与氨气刚好完全反应生成氯化铵和氮 气。求反应前后容器中的压强之比。 11︰1
[练习5] 求标准状况下氢气和氧气的密度比? 解:标准状况下,1mol的气体 2g/mol (H2)= 22.4L/mol 32g/mol (O2)= 22.4L/mol D---相对密度 H2 1 M1 MH2 任何气体 D= = M D= =M 2 2 O2 O2 (同温同压下) 推论3:同温同压下,任何气体的密度之比 =摩尔质量之比(既相对分子质量之比)
5、氢气和氧气的混和气体,在 120 oC 和一 大气压下体积为 a L,点燃后发生反应,待气体 恢复至原来温度和压强时,其体积为 b L。问原 混和气体中氢气和氧气各多少升?
气体摩尔体积

(2) 知道标准状况下气体的密度,有
ρ=
M 22.4L/mol
M = 22.4 ×ρ
m =22.4 × V
【例2】
【练习】
已知200mL的某种气体,在 标准状况下质量为0.393g,求这 种气体的相对分子质量。
0.393g 解: M = 22.4L/mol × 0.2L =44.0g/mol Mr =44.0
答: 这种气体的相对分子质量为44.0。
(3)知道A气体对B气体的相对密度D,
求A气体的相对分子质量,则有:
M (A) M (B)
=
ρ (A) ρ (B)
=D
【例3】已知气体A对空气的相 对密度是1.52,求气体A的相对分子 质量。
解: Mr(A)=29×1.52= 44.0 答:这种气体的相对分子质 量为44.0。
(5)气体的有关计算
V n = Vm
【练习】
下列说法正确的是( C ) A. 1.01×105Pa、25℃时,22.4L氯气 所含的分子数目为NA。 B. 在标准状况下,22.4L的氯气所含 的原子数目为NA。 C. 在标准状况下,22.4L氦气所含的 原子数约为NA D. 22.4L氧气所含的分子数目为NA。
练习
1、判断下列说法是否正确?为什么? × (1)气体的摩尔体积为22.4L/mol。 (2)标准状况下任何气体的体积都约是 × 22.4L。 (3)1molCO2占有的体积约为22.4L。 × (4)1mol水在标准状况下的体积约为 × 22.4L (5)1molSO2在20℃时的体积比22.4L × 大。 (6)1mol氯化氢在 3.03×105Pa时的体 积
n
NA
Vm Vm Vm N A
气体摩尔体积计算类型

答:在标准状况下2.2 g CO2的体积 为1.12 L。
(2)气体相对分子质量的计算
①摩尔质量法:M =m/n
②标态密度法:M =22.4×ρ ③相
m 1.92g n 0.03mol
例2:在标准状况下,测得1.92克 某气体的体积为 672 mL,计算此 气体的相对分子质量。
讨 论
1. 化学反应方程式中气体物质的计量系 数之比与其体积之比有何关系? 化学方程式中气体物质的计量系数 之比等于气体的体积之比。 2. 化学方程式中各物质的计量系数之比 与各物质的物质的量之比有何关系?
化学方程式中各物质的计量系数之比 等于各物质的物质的量之比。
研究性学习2:气体摩尔质量的 几种主要计算方法:
综合练习:由CO和CO2组成的混合 气体,其平均密度是氢气密度的18 倍,求此混合气体中CO和CO2的体 积比是多少?
m n1 M 1 n2 M 2 M n n1 n2
n1 28 n2 44 18 2 n1 n2 n1 n2
课堂练习
混合气体的平均摩尔质量: m总 m1+m2 n 1M1+n2M2 V1M1+ 研究性学习 3 :平均摩尔质量 V2M2 M= = = = n总 n1+n2 n1+n2 V1+V2 (同温同 压) 十字交叉法: M大 M平-M小 n大 M平 = M小 M大-M平 n小
• • • • • • • • 定义公式: M=m/n 导出公式1: M= m每个×NA 导出公式2: M= Vm × ρ 导出公式3: M= 22.4 × ρ (标况) 导出公式4: M= M 对× ρ相对 (相对于氢气、氧气、空气等) 导出公式5: M= m RT/PV 导出公式6: M= m总/ n 总
气体摩尔体积

气体摩尔体积★知识要点1.气体摩尔体积(1)决定物质体积的因素。
①微粒数的多少;①微粒之间的距离;①微粒本身的大小。
在固体和液体中,决定体积大小的主要因素是①和①。
而在气体中,决定体积大小的因素是①和①。
(2)气体摩尔体积的概念。
单位物质的量气体所占的体积叫做气体摩尔体积。
单位:L/mol ,物理量符号:V m ,计算公式:V m =V/n 。
在标准状况下(273K 、1.01×105Pa ),1mol 任何气体的体积都约为22.4L 。
2.阿伏加德罗定律(1)定义:同温同压同体积的气体含有相同的分子数。
(2)推论:①同温同压下,V 1/V 2=n 1/n 2①同温同体积时,p 1/p 2=n 1/n 2=N 1/N 2①同温同压等质量时,V 1/V 2=M 2/M 1①同温同压同体积时,M 1/M 2=ρ1/ρ2(注:V -体积 p -压强 n -物质的量 N -分子个数 M -摩尔质量 ρ-密度)◆学法指导理想气体状态方程与阿伏伽德罗定律1. 理想气体状态方程a. 公式:。
式中T 表示绝对温度,单位为开(K ),摄氏温度与绝对温度的换算关系为;p 表示大气压,单位为帕(Pa );V 表示气体的体积,单位为升(L );n 表示理想气体的物质的量;R 为常数。
(注:高中阶级不要求掌握理想气体状态方程,但用它可以更好地理解和应用阿伏加德罗定律。
)b. 推导阿伏加德罗定律。
由,可推知:、。
当p 、V 、T 均相同时,。
如何计算混合气体的摩尔质量(或相对分子质量)(1)已知标况下密度,求相对分子质量。
相对分子质量在数值上等于气体的摩尔质量,若已知气体在标准状况下的密度ρ,则M =ρ·22.4L/molnRT pV =t 273T +=1111RT n V p =2222RT n V p =1111RT V p n =2222RT V p n =21n n =(2)已知相对密度,求相对分子质量若有两种气体A 、B 将)()(B A ρρ与的比值称为A 对B 的相对密度,记作D B ,即 D B =)()(B A ρρ,由推论三,)()()()(B A B M A M ρρ==D B ⇒ M(A)=D B ·M(B) 以气体B (M 已知)作基准,测出气体A 对它的相对密度,就可计算出气体A 的相对分子质量,这也是测定气体相对分子质量的一种方法.基准气体一般选H 2或空气。
重难点八气体摩尔体积及相关计算

重难点八气体摩尔体积及相关计算【要点解读】1.气体摩尔体积的正确理解2.气体摩尔体积的适用范围气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混杂气体,如0.2 mol H2 与 0.8 mol O2 的混杂气体在标准状况下的体积约为22. 4 L 。
3.气体摩尔体积相关计算V①气体的物质的量n=V m②气体的摩尔质量M=V m·ρ=22. 4ρ(标准状况下)V③气体的分子数N=n·N A=·N AV mV④气体的质量m=n·M= ·MV m【特别提示】( 1)气体摩尔体积与温度、压强相关,标准状况下的气体摩尔体积为L·mol -1,非标准状况下的气体摩尔体积也有可能是22. 4 L ·mol-1。
(2)使用 22. 4 L ·mol- 1 时的注意事项①条件:必定为标准状况,因此使用时,必定要看清气体所处的状况。
②物质状态:必定为气体。
如水、酒精、四氯化碳等物质在标准状况下不是气体。
③数值: 22. 4 L ·mol -1是近似值。
【重难点考向一】气体摩尔体积看法理解【例 1】以下说法中正确的选项是()A. 1 mol O 2和 1 mol N 2所占的体积约为22.4 LB.标准状况下, H2的气体摩尔体积约为22.4 LC.在标准状况下, 1 mol H 2和 1 mol H 2O所占的体积都约为22.4 LD.在标准状况下, 22.4 L 由 N2、N2O组成的混杂气体中所含有的N 原子的物质的量约为 2 mol【重难点点睛】气体摩尔体积使用时注意(1)1 个条件:必定指明条件。
非标准状况下, 1 mol 气体的体积不用然是 22.4 L。
(2)1 种状态:必定为气态。
如水、酒精、SO3、CCl4等物质在标准状况下不是气体。
( 3)1 个单位:气体摩尔体积单位是L·mol-1,而不是 L。
理想气体摩尔体积

理想气体摩尔体积
理想气体摩尔体积是一个重要的概念,在化学、物理教学中都有涉及。
理想气
体摩尔体积是指一个温度和压强条件下,某个特定的气体体积中含有的分子数的量的表示。
摩尔体积的计算公式:Vm =n/N,其中,Vm 是摩尔体积,n为分子数,N
为浓度。
理想气体摩尔体积表示分子气体特性,这是一个能有效反映气体性质的重要数据。
通常情况下,摩尔体积与气体的温度和压强有关,但在有气体分压计的情况下,摩尔体积完全不受温度和压强的影响。
理想气体摩尔体积可以应用到工业生产中,它能够帮助企业计算出适当的浓度,以达到最优的生产效率。
另外,理想气体的摩尔体积也可以让研究者更加了解某种气体的性质,并且帮助科学家进行理论研究。
理想气体摩尔体积的概念也被广泛用于娱乐方面,比如许多大规模的气球彩排
活动中,常用到摩尔体积。
去气球店,气球大小和颜色也可以用摩尔体积来衡量,根据不同场合要求选择合适的气球,造就出一番精彩纷呈的景象,满足了广大消费者的多彩消费需求。
不仅如此,理想气体摩尔体积还可以用在室内空气清洁,调控室内空气室温,
减少室内空气中的空气污染,提高人体的健康水平,促进健康生活。
从上文可以看出,理想气体摩尔体积是难以置信的重要概念,在生活中可以有
效地应用到娱乐、工业生产、空气净化等多个领域,有助于保持室内空气清洁,改善人们的健康水平,满足不同消费者消费需求。
20度气体摩尔体积

20度气体摩尔体积
(实用版)
目录
1.气体摩尔体积的定义
2.20 度气体摩尔体积的计算方法
3.20 度气体摩尔体积的应用
正文
一、气体摩尔体积的定义
气体摩尔体积是指在一定的温度和压力下,一个摩尔气体所占的体积。
摩尔是物质的量单位,一个摩尔的气体在标准状态下(0 度,1 个大气压)体积为 22.4 升。
而在非标准状态下,气体摩尔体积需要通过温度和压力进行计算。
二、20 度气体摩尔体积的计算方法
在 20 度的温度下,气体的摩尔体积可以通过理想气体状态方程
PV=nRT 进行计算。
其中,P 为气体的压力,V 为气体的体积,n 为气体的物质的量,R 为气体常数,T 为气体的温度。
在 20 度的温度下,R 的值为 8.314 J/(mol·K)。
例如,如果一个气体的压力为 1 大气压,物质的量为 1 摩尔,那么在 20 度的温度下,该气体的摩尔体积为:
V = nRT/P = 1 mol × 8.314 J/(mol·K) × 293 K / 101325 Pa =
24.47 L
三、20 度气体摩尔体积的应用
20 度气体摩尔体积在实际应用中具有重要意义。
例如,在气体的储
存和运输过程中,需要根据气体的摩尔体积来确定气体的容器大小和运输方式。
在化工过程中,摩尔体积也常用于计算气体的反应速率和产量。
此
外,摩尔体积也是研究气体物理性质和化学性质的基础数据。
气体摩尔体积计算公式

气体摩尔体积计算公式
气体摩尔体积计算公式:n=V/Vm,摩尔体积是指单位物质的量的某种物质的体积,也就是一摩尔物质的体积,其中V为物质体积;n为物质的量(单位mol)。
单位物质的量的气体所占的体积叫做气体摩尔体积,相同气体摩尔体积的气体其含有的粒子数也相同。
气体摩尔体积不是固定不变的,它决定于气体所处的温度和压强,如在25 °C,101千帕时气体摩尔体积为24.5升/摩尔。
在外界条件相同的情况下,气体的摩尔体积相同。
扩展资料:
决定气体摩尔体积大小的因素是气体分子间的平均距离;而影响气体分子间的平
均距离的因素是温度和压强;相同条件下,相同物质的量的不同物质所占的体积:固体<液体<气体[水除外]。
决定气体体积大小的因素:气体分子间平均距离比分子直径大得多,因此,当气体的物质的量(粒子数)一定时,决定气体体积大小的主要因素是粒子间平均距离的大小。
气体摩尔体积推论

数目相同的任何气体体积相同.
推 论:
(1)同T 、P下,气体的体积之比等于物质的量之比。 V1: V2=n1:n2 (2)同T、P、V下,气体质量之比等于它们的摩尔质 量之比。 m1 : m2=M1:M2 (3)同T、P下,任何气体的密度之比等于它们的摩 尔质量之比。ρ1 : ρ2=M1:M2 (4)同T、V下,气体压强之比等于物质的量之比。 P1 : P2=n1:n2 (5)同T、P、m下,气体体积之比与它们摩尔质量的 反比。 V1 : V2=M2:M1
= 28.8
三、气体摩尔体积的计算
V Vm = n
N m n= = NA M
四、气体相对分子质量
1、气体的相对密度(同温同压)
ρ1 D= ρ 2 m总 M= 总 n
M1 = M 2
ቤተ መጻሕፍቲ ባይዱ
2、混合气体的平均相对分子质量
4 mol N2和1 mol O2混合气体的平 均相对分子质量为多少?
M=
m总 n
总
4×28+1×32 4+1
标准状况 (标况)
0℃ 1.01x105 kPa
在标准状况下,气体的摩尔 体积约为22.4 L/mol。
一、理想气体状态方程 PV = nRT
P:气体压强
V:气体体积 n:气体物质的量
T:气体绝对温度 R:常数 8.314 Pa· m 3· mol-1· K-1
二.阿伏加德罗定律
在相同温度和相同压强下,所含分子
摩尔体积计算公式

摩尔体积计算公式
摩尔体积计算公式=V÷n
V为物质体积(单位:L);n为物质的量(单位:mol)气体摩尔体积。
理想中一摩尔气体在标准大气压下的体积为22.4L,较精确的是:Vm=22.41410L/mol。
使用时应注意:
①必须是标准状况(101kpa、0℃)。
②“任何气体”既包括纯净物又包括气体混合物。
③22.4升是个近似数值。
④单位是升/摩尔(L/mol),而不是升(L)。
单位物质的量的气体所占的体积叫做气体摩尔体积,相同气体摩尔体积的气体其含有的粒子数也相同。
气体摩尔体积不是固定不变的,它决定于气体所处的温度和压强如在25度101千帕时气体摩尔体积为24.5升/摩尔,在外界条件相同的情况下,气体的摩尔体积相同。
气体摩尔体积Vm与T、P、n等之间关系:
1、同温度、同压强下,V相同,则N相同,n相同。
2、同温度、同压强下,V1/V2=n1/n2=N1/N2。
3、P·V=n·R·T。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巩固基础(阿伏加德罗定律): 巩固基础(阿伏加德罗定律):
√ √ √
1、下列说法中正确的是: 、下列说法中正确的是: A、同温同压下,含有相同分子数的两种气体占有 、同温同压下, 相同的体积
B、同温同压下,相同质量的两种气体含有相同分 、同温同压下, 子数
C、同温同压下,2LO2和N2的混合气体与 、同温同压下, 的混合气体与2LCO2和 CO的混合气体含有相同分子数 的混合气体含有相同分子数 D、同温同压下,相同物质的量的两种气体占有相同 、同温同压下, 的体积
化学计量数(系数 化学计量数 系数): 2 系数 物质的量(n/mol): 2 物质的量
计算步骤: 计算步骤:
1 1
2 2
1. 写出有关的化学方程式或由化学方程式找出关系式 2.在方程式下面注明有关的量(注明的量应为纯净 在方程式下面注明有关的量( 在方程式下面注明有关的量 物的量),单位:上下相同,左右成比例。 物的量),单位:上下相同,左右成比例。 ),单位 3. 列出比例式,计算出结果。 列出比例式,计算出结果。 4. 写出答案
ρ
M 1 Mr1 = = =d ρ 2 M 2 Mr 2
1
B、 同T、V下: 、 、 下
P1 n1 N1 = = P2 n2 N2
4、标准状况下气体的密度: 、标准状况下气体的度:
V V ρ标 = = Vm 22.4L/mol
物质的量在化学反应方程式中应用: 拓展 物质的量在化学反应方程式中应用 点燃 2H2+O2==2H2O 化学计量数(系数 化学计量数 系数): 2 系数 粒子数(N/个 粒子数 个): NAN(个) : 个 物质的量(n/mol): 物质的量 质量(m/g): 质量 2 1 1 2 2 2NA 2 36
练习
1、标准状况下,2.2gCO2的体积为多少? 、标准状况下, 的体积为多少? m n = M 2.2 g m(CO2) ( = n(CO2) = ( 44 gmol-1 M(CO2) ( = 0.05mol V Vm= V = n × Vm n = 0.05mol × 22.4Lmol-1 = 1.12L
2NA 1NA 2 4 1 32
1.2NaOH+H2SO4===Na2SO4+2H2O
高温
2.Fe2O3+3CO===2Fe+3CO2 3.2KClO3====2KCl+3O2 △ 4.2H2O2====2H2O+O2
MnO2 MnO2
结论: 结论:方程式中物质的量之比等于化学计量数之比
物质的量在化学反应方程式中应用: 物质的量在化学反应方程式中应用 2H2+O2==2H2O
2、标准状况下,测得1.92g某气体的体积为 、标准状况下,测得 某气体的体积为672mL, 某气体的体积为 , 计算此气体的相对分子质量? 计算此气体的相对分子质量?
672mL 0.672L V(X) ( ) n(X) = ( ) = = 0.03mol Vm 22.4Lmol-1 M(X) ( ) M(X)= ( ) n(X) ( ) Mr = 64 1.92g = = 64gmol-1 0.03mol
气体 体积 主要 取决 于
微粒数目 T 微粒间的距离 P
1、阿伏加德罗定律:同温同压下,相同体积的任 、阿伏加德罗定律:同温同压下, 何气体都含有相同数目的分子 2、数学表达式:同T、P下: V1 、数学表达式: 、 下
N1 n1 = = V 2 N2 n2
3、阿伏加德罗定律推论 、 A、 同T、P下: 、 、 下
16:1 。 :
2、填空: 、填空: 同温同压下,同体积的 同温同压下,同体积的H2和O2的质量比 1:16 。 : 。
: 同温同压下,同质量的 同温同压下,同质量的H2和O2的体积比 16:1 同温同压下, 同温同压下,H2和O2的密度之比 1: 1:16 。
同温同体积,同质量的 同温同体积,同质量的H2和O2的压强之比
