14-第十四章 β-二羰基化合物 (2学时)
第14章β-二羰基化合物

的酯在强碱 有α-H的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 发生缩合反应,失去一分子醇 生成β-羰基酯 一分子醇, 羰基酯的反应叫做酯 发生缩合反应,失去一分子醇,生成 羰基酯的反应叫做酯 缩合反应,又称为克莱森( 缩合反应,又称为克莱森(Claisen)缩合。 )缩合。
有机化学
上页 下页
重要β 二羰基化合物 重要 –二羰基化合物
O O C 2 H 5 O-C-CH 2 -C-OC 2 H 5
丙二酸二乙酯
O O CH3-C CH2-C-OC2H5
乙酰乙酸乙酯
有机化学
上页
下页
三、 丙二酸酯在有机合成上的应用
一.丙二酸二乙酯的制备 丙二酸二乙酯的制备
O O O O NaCN C H OH CH2-C-OH CH2-C-ONa 2 5 C2H5O-C-CH2-C-OC2H5 OH H2SO4 Cl CN
OH O CH3-C=CH-C-OC H5 2 烯醇式 (7%)
有机化学
上页
下页
二、 β –二羰基化合物碳负离子的反应 二羰基化合物碳负离子的反应
碳负离子是带部分负电荷的碳原子或氧原子, 碳负离子是带部分负电荷的碳原子或氧原子,都具 是带部分负电荷的碳原子或氧原子 亲核性, 有亲核性,在碳原子和氧原子上都有可能发生亲核 反应,主要发生在碳原子上 常见的反应有下列几种: 在碳原子上。 反应,主要发生在碳原子上。常见的反应有下列几种: (1)碳负离子与卤代烷的反应 卤代烷的反应 )碳负离子与卤代烷 羰基化合物的缩合反应 (2)碳负离子和羰基化合物的缩合反应 )碳负离子和羰基化合物 不饱和羰基化合物的共轭加成 (3)碳负离子和 ,β-不饱和羰基化合物的共轭加成 )碳负离子和α, 不饱和 反应
第14章 β-二羰基化合物

C
COOC2H5
5
O C + HCOOC2H5 (2) H + (1) NaOC2H5
O C CHO
六、完成下列反应式: 1
(1) O 3 (2) Zn, H
5% NaOH
+
CHO CHCHCHO
∆
CHO
2
CH3COCH2 COO C2H5 NaOC2H5 CH3 Cl CHCOC2 H5
Na CH3COCH COO C2H5 CH3 CHCOC2H5 CH3COCHCOO C2H5 CH3
CH3CCH2C-OH
CH3CCH2C-OH
十一、某酯类化合物A (C5H10O2),用乙醇钠的乙醇溶液处理,得到另一个 酯B (C8H14O3),B 能使溴水褪色,将B用乙醇钠的乙醇溶液处理后,再与碘 乙烷反应,又得到另一个酯C (C10H18O3). C和溴水在室温下不反应。把C用 稀碱水解再酸化,加热,即得一个酮D (C7H14O), D不发生碘仿反应。用锌 汞齐还原则生成3-甲基己烷,试推测A,B,C,D的结构,并写出各步反应式。 解:A,B,C,D的结构及各步反应式如下:
二、 写出下列化合物加热后生成的主要产物: 1
O C O C OH O C
O
2
O CH2COOH C CH3
C
CHCHCHCOOH
CHCHCHCOOH
3
CH3CH2CH(COOH)2 CH3 CH2 CH2COOH
三、试用化学方法区别下列各组化合物:
CH3 COCH(CH3 )COOCH2CH3
CH3COC(CH3)COOCH2 CH3 CH2CH3
解:加溴水:褪色
不变
CH3COCH2COOH
第十四章 β-二羰基化合物

-
C OC H 2 5 OR C CH O C OC2H5
O C6H5CCl
O C CH COC6H5 OC2H5
C- 烃化产物
(1) NaOEt, EtOH (2) R'X
O- 烃化产物
O H3 C C
O H3 C C C R R
O C OC2H5
C- 酰化产物
R = 伯卤代烷,而仲卤代烷和叔卤代烷在碱性条件下易发生消去反应
+ CH3CCH2CO2Et
反应机理
CH2(CO2Et)2 + EtO
-
CH(CO2Et)2 + EtOH
-
O
O
CH
CH
CH
CH2 + CH(CO2Et)2
O
-
O
CH
-
CH
CH CH2CH(CO2Et)2
-
CH CH2CH(CO2Et)2
CH2 CH2CH(CO2Et)2 + EtO
-
如:
O
O
+ CH2 CHCO2Et
1) H2O, KOH; 2) H3O+
CH3COCHCOOC2H5
3)
I
CH3COCH2CH2COCH3
2, 5 – 己二酮
2 CH3COCHCOOC2H5 Na+
-
CH2Cl2
CH3COCHCOOC2H5 CH2 CH3COCHCOOC2H5 1) H2O, KOH; 2) H3O+
3)
O
O
H3C C CH2 C OR
一. β- 酮酸酯的合成
Claisen Condensation:
第十四章_β-二羰基化合物
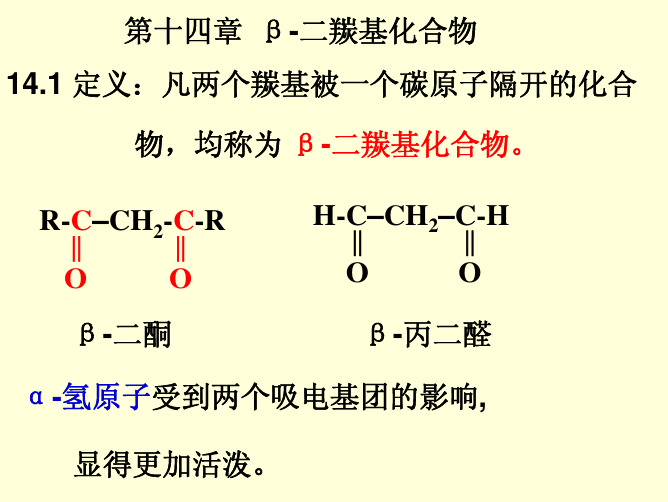
物,均称为 β-二羰基化合物。
R-‖C–CH2-‖C-R
O
O
β-二酮
H-‖C–CH2–C‖-H
O
O
β-丙二醛
α-氢原子受到两个吸电基团的影响,
显得更加活泼。
14.2 命名
HO-‖C–CH2-‖C-OH
O
O
β- 丙二酸
R-‖C–CH2–C‖-OR’
CH3︱CH=CH‖COC2H5 OH O
NaOC2H5 H+
CH3‖C CH-‖COC2H5 OO
Na
+
CH3‖CCH2C‖OC2H5 OO
①5%NaOH CH3COCH2COOH
②H+
CH3COCH3
△,-CO2
?
CH3‖CCH2C‖OC2H540%△NaOH OO
CH3‖COON+a
C2H5OH
CH3‖CO︱CCHH‖O2CCOHC2C2HO①5O5C%2H︱CNHaO2CHH2CCHO3‖OCO︱CCHHH2‖OCCOHN2CaOONa ②H+ , ③△ CH3‖CCH2
O
CH3‖C︱CCHH‖2CCOHC2C2HO5OC酮2式H 分解 OO
C︱H2CH2COOH CH3‖CCH2
O
︱CH2CH2COO酸C2式H分5 解
CH3‖CCH2C‖OC2H5 OO
H2N-OH H+
CH3‖CCH2COOC2H5 N-OH
Na CH3︱C= CH ‖COC2H5 ONa O
CH3︱C = CHC‖OC2H5 OH O
+ H2
CH3‖C-CH-‖COC2H5Na +
第十四章 β-二羰基化合物

+
1
O
2 3
例2:由 CH2(COOC2H5)2
解:
Oδ CH2(COOC2H5)2 O CH(COOC2H5)2
H2O/H
+
CH2-COOH
4 5
ONaOC2H5
+
+
δ
CH(COOC2H5)2 O CH(COOH)2
-CO2
CH3COOH
O
CH2COOH
25
本章要点
⑴丙二酸酯的制备和应用。 ⑵克莱森酯缩合反应。 ⑶乙酰乙酸乙酯的应用。 ⑷互变异构。 ⑸麦克尔反应。
C-CH3
②制二酮 β- 二酮 二酮(1,3-二酮 : 二酮): 二酮
O O CH3CCHCOC2H5
O
-
Na
+
R-C-Cl or (RCO)2O
1,4-二酮: 1,4-二酮: 二酮
O O 2 CH3-C-CH2-C-OC2H5
5%NaOH H+ NaOC2H5
O O CH3CCHCOC2H5 C=O R
6
①制备烃基取代乙酸
(ⅰ)
烃基不同, 烃基不同,分步取代 利用丙二酸酯α 碳上的烷基化反应是制备 烃基取 碳上的烷基化反应是制备α 利用丙二酸酯α-碳上的烷基化反应是制备α-烃基取 代乙酸最有效的方法。 代乙酸最有效的方法。
7
8
②制备二元羧酸
Br Br
2CH2(COOC2H5)2
H2O/H+
NaOC2H5
酮式
O C
5%NaOH
H
+
O CH 3 C-CH 2 - C-CH
1,5-二羰基化合物 (1,2-加成产物)
第14章_β-二羰基化合物和有机_[1]...
![第14章_β-二羰基化合物和有机_[1]...](https://img.taocdn.com/s3/m/489a41b68762caaedd33d446.png)
不含α-H的酯如草酸二乙酯、甲酸酯、碳酸二乙酯 苯甲酸酯等在酰化反应中可分别引入-COCO2C2H5, -CHO, -COOC2H5, -COPh基团。
2. 酰基化反应
使用草酸酯得到的产物既是β-酮酯,又是α-酮 酯。由于α-酮酯在加热时可脱去羰基,为合成取 代丙二酸酯及相关化合物提供一条方便的途径。
3. 迈克尔加成反应
活泼氢化合物在催化量碱(常用醇钠,季铵碱及 苛性碱等)作用下与α, β-不饱和化合物发生1, 4-加成的反应称为Michael加成反应。
催化量 C2H5ONa + CH2=CHCCH3 C2H5OH O O (H5C2O2C) 2CH CH2CH2CCH3
CH2(CO2C2H5)2
COOC2H5 C2H5ONa PhCH2CO2C2H5 + COOC2H5 COOC2H5 C CO2C2H5 O 178° C
Ph HC
PhCH(COOC2H5)2
Ph HC
COOC2H 5 C CO 2C 2H 5 O
H 3O+
COOH Ph CH C COOH - CO2 O
PhCH2COCOOH
CH 3 O O
2-甲基-1,3-环戊二酮
练习14.2
14.1.2 β-二羰基化合物活泼氢的酸性
• β-二羰基化合物的两个羰基之间的α-氢原子的 酸性,由于其相应阴离子的共振稳定化而大大增 强。 pKa在9~13之间。 在碱的作用下,活性亚甲基上的质子具有酸性,易 脱去形成二羰基碳负离子或烯醇负离子,存在着酮 式和烯醇式的互变异构。
+ NaX
C
OC2H5 + C2H5OH
二烃基乙酰乙酸酯
α-烃基乙酰乙酸乙酯的应用
第14章 β-二羰基化合物(2012)

CO2H
Michael加成 加成
亲核取代 -CH(COOC H ) 2 5 2 亲 核加 成 (α,β-不饱和醛酮的亲核加成----Michael加成) 不 加
Michael加成是非常有用的合成 5—二羰基化合物的反应 加成是非常有用的合成1, 加成是非常有用的合成 二羰基化合物的反应
O CH2(COOC2H5)2 + NaOC2H5 HOC2H5 CH(COOC2H5)2 O - CO2 CH2COOH 90% 酸化 水解 CH(COOC2H5)2 OH
14.3 乙酰乙酸乙酯的反应及其在有机合成中的应用 乙酰乙酸乙酯的反应及其在有机合成中的应用
1. 乙酰乙酸乙酯的酯缩合逆反应 乙酰乙酸乙酯的酯缩合逆反应
O O
O-
O
CH3C-CH2-COC2H5
C2H5O-
CH3C-CH2-COC2H5 OC2H5
O CH3-COC2H5
O
+
-
CH2-COC2H5 O CH3-COC2H5
3. 乙酰乙酸乙酯的酸式分解 乙酰乙酸乙酯的酸式分解
OO-
O
O
CH3C-CH2-COC2H5
-OH(浓) (
CH3C-CH2-C-OC2H5 OH OH
O
O CH3-COH
+ -CH2-COH + C2H5OH2O H2用下, 在浓碱作用下,α−与β−位碳原子间断裂生成二分子羧酸。 位碳原子间断裂生成二分子羧酸。
生成的烯醇式稳定的原因 (1)形成共轭体系,降低了体系的内能 )形成共轭体系,
(2)烯醇结构可形成分子内氢键(形成较稳定的六元环体系) )烯醇结构可形成分子内氢键(形成较稳定的六元环体系)
苯酚的烯醇与酮式互换
第十四章 β-二羰基
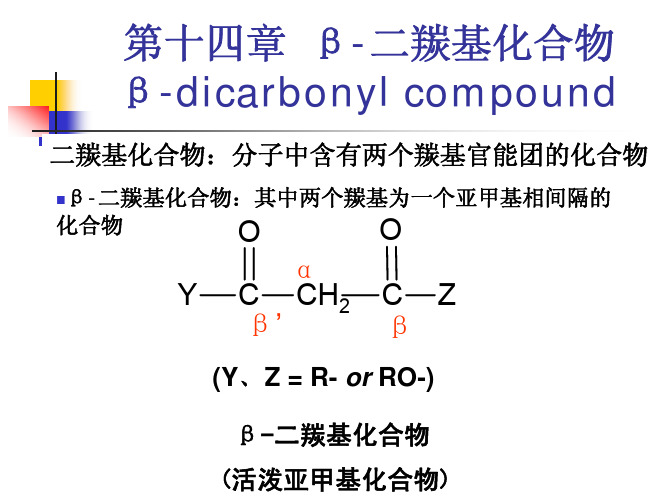
14.2 β-二羰基化合物碳负离子的反应
以乙酰乙酸乙酯为例
碳负离子可以写出三个共振式
O O C2H5OH OO-
CH3CCH2COC2H5 + NaOH O O
O
O
CH3CCHCOC2H5
CH3C=CHCOC2H5
+ CH3CCH=COC2H5 Na
(1)
>
(2)
>
(3)
碳负离子都具有带负电荷的C原子或O原子,都具有亲 核能力,反应主要发生在亲核的C原子 亲核反应 得到的主要是C原子上的烷基化或酰基化产物
二取代乙酸
应用:丙二酸酯法主要用来合成一取代、二取代乙酸 注意:1)禁用3ºRX(易消去)、乙烯型和卤苯型RX(活性差); 2)R≠R’时,应先引入大基团; 3)可同时失去两个α-H,得到双钠盐。
_ _
_ _
OH
-
COONa
H
+
COOH COOH
丙二酸酯在合成中的应用:
(1)合成一取代乙酸
举例:用丙二酸二乙酯合成4-甲基戊酸
P358-8(2)
⑵合成二取代乙酸
例:用丙二酸合成法合成2-苄基己酸
CH2(COOC2H5)2
+ C2H5ONa - [CH(COOC2H5)2]Na C2H5OH
-CH2Br
-CH2-CH(COOC2H5)2
(1)C2H5ONa (2)CH3(CH2)3Br
- -CH2-C(COOC2H5)2 CH2CH2CH2CH3
问题:能不能用酯化 的方法制备?
∵HOOC-CH2-COOH
不能用酯化的方法。
CH3COOH + CO2↑
丙二酸酯的结构
第十四章 β-二羰基化合物

N
CHO
+ CH2(COOH)2
H , 97
-H2O
CH C(COOH)2
- CO2
O
O
H5C2OC H5C2OC
O
CH2 CH2
C CH2
O
O
H5C2OC Br H5C2OC
OO
CH2
C
CH2 CH2
CH2
HOCCH CH2 环丁烷甲酸
CH2
习题14.5 用丙二酸二乙酯为原料合成下列化合物:
⑴ 丁二酸
COOC2H5 CH2
COOC2H5
C2H5ONa CH(COOC2H5)2
I2
O
O
H
CH3C
CH
COEt + O H
H
O
O
CH3C CH COEt + H2O
H
反应特点: 反应物至少是含有两个α–氢的酯
O
O
R CH2C OCH2CH3 + H CHC OCH2CH3
NaOC2H5 H3O+
R
O CH2C
O CHC R
R
OCH2CH3 + CH3CH2OH
含一个α–氢原子的酯缩合反应(使用更强的碱)
CH2COOH CH2
CH2COOH
⑹ 4-甲基戊酸
⑹ 4-甲基戊酸 COOC2H5
CH2 COOC2H5
C2H5ONa (CH3)2CHCH2Cl
COOC2H5 (CH3)2CHCH2 CH
COOC2H5
OH-, H+H
2.丙二酸亚异丙酯的合成及其应用(略) 四、克脑文盖尔(Knoevenagel) 缩合
第十四章 β二羰基化合物

O
实例 2
CH 3 CH 2CHCO 2C2H5 CH 2CH 2CO 2C2H5 CH 3 O CO 2C2H5 CH 3 OCO 2C2H5
CH 3
CO 2C2H5 O
实例 3
O O O
-
1 C2H5O CH3CH2C-CH2CH2CH2-COC2H5 + 2 H3O
CH3 O
实例 4
O O O O CH3
1 C2H5OCH3C-CH2CH2CH2CH2-COC2H5 + 2 H3O
实例 5
O CO 2C2H5
C2H5OC2H5OH
O
+ H3O
O
发生分子内酮酯缩合时, 总是倾向于形成五元环、六元环。
5. 酯缩合 (Claisen酯缩合)反应
凡有酯参与的缩合反应统称Claisen酯缩合反应。 1) 酯缩合 两分子酯在碱作用下失去一分子醇形成b-羰基酯。
3酮酯缩合
O CH3CCH3 + CH3CO2C2H5 O O O
C2H5Oor NaH H+
O
CH3C-CH2-CCH3 + CH3C-CH2-COC2H5 + OH O OH O
CH3C-CH2-CCH3 + CH3C-CH2-COC2H5 CH3 CH3
从理论上分析,有可能生成四种化合物。
ห้องสมุดไป่ตู้
O O EtOHC-OC 2H5 + H-CH2CCH 3
H2O
O O HC-CH2CCH 3
OO O EtOC2H5O-C-C-OC2H5 + H-CH2CCH3
O OO H2O C2H5O-C-C-CH2CCH 3
第十四章b二羰基化合物

O R' O
-NaX
CH3 C
C R
C
OC2H5
① R最好用1°,2°产量低,不能用3°和 乙烯式卤代烃(??碱性条件下)。
②二次引入时,第二次引入的R′要比R活泼。 (一般是体积先大后小)
③ RX也可是卤代酸酯和卤代酮。
(b) 酰基化:
OO CH3 C CH C OC2H5 Na
RCOX -NaX
2 CH3COOH + C2H5OH
OO CH3 C CH C OC2H5
ŨOH
CH3COOH + RCH2COOH + C2H5OH
R
OO
ŨOH
CH3 C CH C OC2H5
CH3COOH + RCOCH2COOH + C2H5OH
COR
14.3 丙二酸二乙酯
(1)制法:可以从氯乙酸的钠盐来制备丙二酸二乙酯。
H3C C
C C CH3 H
碳负离子和氧负离子都具有亲核性能,但反
应主要发生在亲核的碳原子上。
亚甲基活泼氢的性质:
1.酸性
α-H很活泼,具有一定的酸性,易与金属钠、乙醇 钠作用形成钠盐。
O
O
CH3 C CH2 C OC2H5 C2H5ONa
OO CH3 C CH C OC2H5 Na
Hale Waihona Puke pKa =1114.1.2 烯醇负离子的稳定性
乙酰乙酸乙酯:又叫β-丁酮酸乙酯。
以酮式和烯醇式两种结构以动态平衡而同时存在的互 变异构体。
1.互变异构现象
白() 白()
NaHSO3 OO
NH2OH CH3-C-CH2-C-OC2H5
Na H2 有活性氢 Br2/CCl4 溴褪色(具双键)
第十四章 β-二羰基化合物

二取代乙酸 试剂:CH3 X
CH3CH2CH2 X
CH2(COOC2H5)2
CH3CH2
CHCOOH CH3
2-甲基丁酸
CH2(COOC2H5)2
① C2H5ONa ② CH3I ① C2H5ONa ② CH3CH2Br
CH3CH2CH(COOC2H5)2
NaOH H2O H+
CH3CH2C(COOC2H5)2 CH3
OH H2C
O C O CH2 C OC2H5
O CH3 CH
OH O CH C OC2H5
CH
CH3
×
CH3 C
2. 乙酰乙酸乙酯在合成上的应用
(1)乙酰乙酸乙酯的合成 乙酰乙酸乙酯可用Claisen酯缩合反应合成。
O CH3 C OC2H5
+
O ① C2H5ONa CH3 C OC2H5
=
O O CH3 C CH2 C OC2H5
R X
O O CH3 C CH C OC2H5 Na+
RCOX
O O CH3 C CH C OC2H5 R O O CH3 C CH C OC2H5 R C =O
这是一个亲核取代反应,主要生成烃基化和酰基化产物。 这里卤代烷常用伯卤代烷或仲卤代烷,叔卤代烷容易消除而 不能用;乙烯型和芳基型卤代烃也不能用。
α-碳原子上的两个氢原子均可被烃基取代。
O O O R’ O ① C2H5ONa CH3 C C C OC2H5 CH3 C CH C OC2H5 X
② R’
R
R
(5)乙酰乙酸乙酯在合成上的应用
① dil. OH
O O CH3 C CH C OC2H5 R ( 酸式分解 ) ( 酮式分解 )
有机化学第14章 β-二羰基化合物
工业上乙酰乙酸乙酯可用二乙烯酮与乙醇作用制得:
乙酰乙酸乙酯为无色具有水果香味的液体,沸点181℃(稍有分解),
微溶于水,可溶于多种有机溶剂。乙酰乙酸乙酯对石蕊呈中性,但能 溶于稀氢氧化钠溶液。它不发生碘仿反应。
2.乙酰乙酸乙酯的性质
乙酰乙酸乙酯可在稀碱(或稀酸)的作用下,水解生成乙酰乙酸,
后者在加热的条件下,脱羧生成酮。这种分解称为酮式分解,可用
键形成一个稳定的六元环,另一方面烯醇式羟基氧原子上的未共用
电子对与碳碳双键和碳氧双键是共轭体系,发生了电子的离域,降 低了分子的能量的缘故。
酮—烯醇互变异构现象在羰基化合物中较为普遍,但它们的烯
醇式含量是不同的。
(在室温条件下)
14.2 乙酰乙酸乙酯的合成及应用
1.乙酰乙酸乙酯的合成
乙酰乙酸乙酯可用Claisen酯缩合反应合成。乙酸乙酯在强碱 (如乙醇钠、金属钠等)的催化下缩合,然后酸化,即可得到乙酰乙 酸乙酯。
曾讨论过烯醇式和酮式的互变异构现象。
但β-二羰基化合物的烯醇式结构却具有一定的稳定性。如β-
丁酮酸乙酯(又称为乙酰乙酸乙酯,俗称三乙),通常是以酮式和烯
醇式两种异构体的混合物形式存在的。
这种能够互相转变的两种异构体之间存在的动态平衡现象就 称为互变异构现象。
乙酰乙酸乙酯的两种异构体,可在较低的温度下,用石英容器精馏
反应式表示为:
另外,乙酰乙酸乙酯如与浓碱共热,则α-和β-碳原子之间的键
发生断裂,生成两分子乙酸盐。一般β-羰基酸都发生此反应,这种
分解称为酸式分解。
乙酰乙酸乙酯分子中亚甲基上的氢原子比较活泼,与醇钠等强碱
作用,可以生成钠的衍生物,后者可与卤代烷发生取代反应,生成烷
基取代的乙酰乙酸乙酯;在需要时还可以生成二烷基取代的乙酰乙酸 乙酯,使用更强的碱如叔丁醇钾替代乙醇钠进行反应效果更好。
第14章 β-二羰基化合物(答案)

1第十四章 β-二羰基化合物【重点难点】1.乙酰乙酸乙酯(1) 熟练掌握乙酰乙酸乙酯的制备 Claisen 酯缩合法。
CH 3C O CH 2OOC 2H 53+25CH 3COOC 2H 52①②注意:①反应条件:强碱性条件(如RONa );②反应发生在α-碳原子上,原料为碳原子数>3的一元酸生成的酯时, 产物有支链;RCH 2C O CH C OOC 2H 5RCH 2C OOC 2H 53+252①③分子内酯缩合——Dieckmann 反应。
①②OC OOC 2H 5CH 2CH 2CH 2CH 2C OOC 2H 5C OOC 2H 53+C 2H 5ONa(2) 熟练掌握乙酰乙酸乙酯在合成上的应用主要用于合成甲基酮、二酮、酮酸、环酮等。
②①①CH 3C OCH RR'CH 3C OCH 2RCH 3C O C R'COOH CH 3C OCH COOH 稀H +OH -+-CH 3C O C R'C OOC 2H 5C 2H 5ONa (or NaH)C 2H 5ONaCH 3C O CH C O OC 2H 5CH 3C O CH 2OOC 2H 5RXR'X①①②②2.丙二酸二乙酯(1) 熟练掌握丙二酸二乙酯的制备2CH 3COOH 2CH 2COOH -CH 2COO -NaCNCH 2COO-24CH 3CH 2OH CH 2(COOC 2H 5)2(2) 熟练掌握丙二酸二乙酯在合成上的应用主要用于制备乙酸的α-烷基或 -二烷基取代物,二元羧酸、环烷酸。
①②RXC 2H 5ONa R'X-+OH -+稀C 2H 5ONa CH(COOH)2R R CH 2COOHC(COOC 2H 5)2R R'C(COOH)2R R'CHCOOHRR'CH 2(COOC 2H 5)2①①①②②②R CH(COOC 2H 5)2▲3.Michael 加成掌握Michael 加成规律,能写出产物的结构。
14、有机化学:β-二羰基化合物(2H)

γ-二酮
RCOCH2CH2CO2H
γ-酮酸
第三节 丙二酸二乙酯的性质及其应用
丙二酸二乙酯为无色且具有香味的液体,沸点
199℃,微溶于水,能与醇、醚混溶,是重要的有机合
成中间体。 一、制法
ClCH2CO2H NaCN NaOH CH2CO2Na CN C2H5OH H2SO4 CO2C2H5 CH2 CO2C2H5
CH2CH(CO2Et)2 2)H+;3)
己二酸
CO2Et CH2 CO2Et 2)(CH2)nCO2Et CH2Br 1)NaOEt 1)OH-,H2O 2)H ;3)
+
CH(CO2Et)2 (CH2)n+1CO2Et
CO2H (CH2)n+2 CO2H
(n=1~5)
二元羧酸
3、合成三~六元环烷酸
丙酮
2、成酸分解:在浓碱条件下
O CH3C CH2 O C OC2H5
1)40%NaOH, 2)H
+
2CH3CO2H + C2H5OH
乙酸
3、亚甲基的活性
CH3COCH2CO2C2H5 C2H5ONa CH3COCHCO2C2H5 Na
三、在有机合成上的应用 1、合成增长碳链或支链的甲基酮和一元羧酸
1)C2H5ONa CH3COCH2CO2C2H5 2)RX CH3COCHCO2C2H5 R
(X=Cl/Br/I)
1)5%OH2)H , 1)40%OH2)H3O
+ +
CH3COCH2R
甲基酮
RCH2CO2H
一元羧酸
1)C2H5ONa CH3COCH2CO2C2H5 2)RX CH3COCHCO2C2H5 R
有机化学 高鸿宾 第四版 答案 第十四章 二羰基

第十四章 β-二羰基化合物(一) 命名下列化合物:(1)HOCH 2CHCH 2COOHCH 3(2)(CH 3)2CHCCH 2COOCH 3O(3) CH 3CH 2COCH 2CHO (4)(CH 3)2C=CHCH 23OH(5) ClCOCH 2COOH (6)CHOOCH 3(7)OCH 3NO 2(8)CH 2CH 2OHCl解:(1) 3-甲基-4-羟基丁酸 (2) 4-甲基-3-戊酮酸甲酯(3) 3-氧代戊醛 or 3-戊酮醛 (4) 5-甲基-4-己烯-2-醇 (5) 丙二酸单酰氯or 氯甲酰基乙酸 (6) 4-羟基-3-甲氧基苯甲醛(7) 2-硝基苯甲醚 (8) 2-间氯苯乙醇 or 2-(3-氯苯基)乙醇(二) 下列羧酸酯中,那些能进行酯缩合反应?写出其反应式。
(1) 甲酸乙酯 (2) 乙酸正丁酯 (3) 丙酸乙酯(4) 2,2-二甲基丙酸乙酯 (5) 苯甲酸乙酯 (6) 苯乙酸乙酯 解:(2)、(3)、(6)能进行酯缩合反应。
反应式如下: (2) 2CH 3COO(CH 2)3CH 3CH 3CCH 2CO(CH 2)3CH 3O O25(3) 2CH 3CH 2COOCH 2CH 3CH 3CH 2CCHCOC 2H 5OO325(6)25CH 2COOC 2H 5CH 2CCHCOOC 2H 5O(三) 下列各对化合物,那些是互变异构体?那些是共振杂化体?(1)CH 3CH CH 3OH OCH 3C CH H 3C OH O 和(2) CH 3C O -H 3C CO-O和(3) 和CH 2=CH CH=CH 2CH 2CH=CH CH 2(4)和OOH解:(1)、(4)两对有氢原子核相对位置的移动,是互变异构体,(2)、(3)两对中只存在电子对的转移,而没有原子核相对位置的移动,是共振杂化体。
(四) 写出下列化合物分别与乙酰乙酸乙酯钠衍生物作用后的产物。
(1) 烯丙基溴 (2) 溴乙酸甲酯 (3) 溴丙酮(4) 丙酰氯 (5) 1,2-二溴乙烷 (6)α-溴代丁二酸二甲酯解:(1) CH 3CCH OC 2H 5OO 2CH=CH 2(2) CH 3C CH C OC 2H 5O O 2COOCH 3(3) CH 3CCH OC 2H 5OO CH 2COCH 3(4) CH 3C CH OC 2H 5OO COC 2H 5(5)CH 3CCH OC 2H 5O O H 2C CH 2CH 3CCHC OC 2H 5OO (6)CH 3C CH OC 2H 5OOCHCH 2COOCH 3COOCH 3(五) 以甲醇、乙醇及无机试剂为原料,经乙酰乙酸乙酯合成下列化合物。
第十四章 β-二羰基化合物

一、β-二羰基化合物的酸性和烯醇负离子的稳定性 构造式 羰基化合物的pKa值 pKa 名称
乙酸乙酯
丙酮 丙二酸二乙酯 25 20
乙酰乙酸乙酯 ( β-丁酮酸酯)
2,4-戊二酮 (乙酰丙酮)
13
11 9
β-二羰基化合物的酸性所以比一般羰基化合物强 得多,是由于它们能发生互变异构而生成稳定的烯醇 式结构所致。 以用2,4-戊二酮为例,它在碱的作用下生成的负 离子如下式所示:
第十四章 β-二羰基化合物
学习提要
1、掌握β-二羰基化合物的酸性和烯醇负离子的稳 定性规律,学习其碳负离子的反应,包括烃化和酰 化反应。 2、学习酯缩合反应及其机理
3、学习乙酰乙酸乙酯和丙二酸乙酯在有机合成上 的应用
4、掌握麦克尔加成反应及其在合成含氧化合物上 的应用
二羰基化合物: 分子中含有两个羰基官能团的化合物。
CH3 CH2 CH COOH 引入 CH2COOH
二、乙酰乙酸乙酯在有机合成上的应用 1、制备(克莱森酯缩合法)
2、应用: 乙酸乙酯的烃化、水解和脱羧结合进行可以得到 各种甲基酮和酸。
例1:合成
O CH3 C CH2 CH2 原 引
经结构分析,需引入
CH2
O CH3 C CH CH2CH=CH2 原
(1,4-加成)
O
O
EtONa + CH2(CO2Et)2 CH3CO2H
CH(CO2Et)2
二、丙二酸酯在有机合成上的应用 1、制备
2、应用 用途:用于合成各种类型的羧酸(一取代乙酸, 二取代乙酸,环烷基甲酸,二元羧酸等)。
例如,用丙二酸二乙酯法合成下列化合物,其结 构分析如下:
有机化学课后习题答案14第十四章β-二羰基化合物 答案
(4)不能。 (5)不能。 (6)
CH2COOCH2CH3 2 NaOEt CH2 O C CHCOOEt
五、 1. 互变异构。
2. 共振杂化。 3. 共振杂化。 4. 互变异构。 六、 1.
CH3
O C CHCOOEt CH2CH=CH2
2.
CH3
O C CHCOOEt CH2COOCH3
O C CCOOEt H2C CH2
O CH3 COOCH3 CH3O _ _ O OCH3 CH3 COOCH3 O OCH3 _ CH3 O CH3OH OCH3 CH3 COOCH3
COOCH3
_ CH3O
O _
OCH3 COOCH3 CH3
_ O H3COOC
OCH3 CH3 CH3O
_ H3C
O COOCH3
八、 1. (1)
1) 40%NaOH CH3CH2CH2CH2COOH 2) H+
(2)
CH3COCH2COOEt
CH3CH2Br NaOEt
5%NaOH
CH3CH2CH2COCH3
(3)
CH3COCH2COOEt
CH3CH2CH2Br NaOEt
5%NaOH
NaBH4
OH CH3CHCH2CH2CH2CH3
(H3 C2H5OOCCCOOC2H5 CH2CH3
12.
O H H3C C C CH2COOCH3 CH3
二、 1.
CH3CH2
O C CHCOOC2H5 CH3
2.
O C CHCOOC2H5
3.
COOH
4.
CH2COOH O
5.
O
6.
CH3 O C CH2CH2CH2COOH
第14章-β-二羰基化合物

4. -二羰基化合物的碳负离子通过Michael加成反应合 成1,5-二羰基化合物.
酮 -H活泼
◆常用丙酮或其他甲基酮和酯缩合来合成 -二酮。 比较克莱森(酯)缩合反应与羟醛缩合 反应的异同?
(5)克诺文格尔缩合反应 *——制备,-不饱和酸
◆醛、酮可以和-二羰基化合物(一般是丙二酸及其 衍生物),在弱碱(氨或胺)作用下缩合:
亲核加成-消除
肉桂酸 ◆这种制备制备,-不饱和酸的方法叫Knoevenagel
CH3COCHCOOC2H(C5 H2)2
CH3CO(CH2)4COCH3
CH3COCHCOOC2H5
用三乙法合成:
1,3-丁二烯与Br2的 1,4加成, 氢化.
与无-H的醛缩合
(6) 与酰卤或酸酐作用——羰基亲核加成-消除反应 例如:与酰氯的反应
NaH
非质子溶剂
酰基化产物
-二酮
◆在合成上乙酰乙酸乙酯更多的用来合成酮类。 (合成羧酸时,常有酮式分解)
乙醇得到乙酰乙酸乙酯(-丁酮酸酯):
乙酰乙酸乙酯
◆凡有-H原子的酯,在乙醇钠或其他碱性催化剂(如氨 基钠)存在下,都能进行克莱森(酯)缩合反应。克莱 森(酯)缩合反应是合成-二羰基化合物的方法。
(2)克莱森(酯)缩合反应历程——亲核加成-消除
乙酸乙酯 加成步骤 消除过程
(3)含有-H原子的酯与无-H原子的酯之间缩合 ①与苯甲酸酯缩合——位引入苯甲酰基 例如:-苯甲酰丙酸乙酯的合成
◆分子中含有两个羰基官能团的化合物叫二羰基化合物; 其中两个羰基为一个亚甲基相间隔的化合物叫-二羰 基化合物。
有机化学:第14章 β-二羰基化合物

H
H RC
HO R C C R' + H2O
OH C R' + OH
2、化合物的结构对酮–烯醇平衡的影响
酮式
烯醇式
乙酸乙酯 乙醛
单羰基化合物 酮式比烯醇式更稳定。 能差:45~60 kJ • mol-1
丙酮 环己酮
超共轭效应有利于烯 醇式生成
β–二羰基化合物的平衡
O O
O O
OO O
OO
OO Ph
O-
CH2=C-OC 2H5
O
O-
CH3-C-O-C2H5 +
-CH2COOC 2H5
亲核加成
CH3-C-CH 2COOC 2H5 OC2H5
-C2H5O消除
OO CH3-C-CH 2C-OC 2H5
有酸性,PKa=11
C2H5O-
ONa O
CH3C=CH-COC 2H5 + C2H5OH
乙酰乙酸乙酯钠盐
CH3 O
CH2CH-C-OC2H5
CH2
CH2CH2C-OC2H5
O
位阻少
(酸性大)
C2H5ONa -C2H5OH
CH3
O
CH — C
CH2
CH-COOC2H5
CH2—CH2
2、乙酰乙酸乙酯的性质
酮式分解: β-酮酸加热 脱羧 生成酮
O
O
O
O
CH3C
CH2
C
OC2H5
5%NaOH
△
CH3C
CH2
OC2H5
C2H5ONa
OO
(HR)CH2C
C C OC2H5 H(R)
Na+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十四章 β-二羰基化合物 (2学时)基本要求:1.掌握酯的水解和克来森(Claisen )酯缩合历程。
2.掌握乙酰乙酸乙酯和丙二酸二酯在合成上的应用。
3. 理解互变异构。
4.理解合成路线设计的基本知识。
5.了解麦克尔加成的涵义和应用。
计划课时数 2课时重点:酯的水解和克来森(Claisen )酯缩合历程,乙酰乙酸乙酯和丙二酸二酯在合成上的应用。
难点:互变异构,碳负离子和α,β-不饱和羰基化合物的共轭加成——麦克尔反应。
教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
§ 14.1β-二羰基化合物的酸性和烯醇负离子的稳定性§ 13-5 乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的应用14.1.1乙酰乙酸乙酯(1)性质1.互变异构现象(1)生成的烯醇式稳定的原因1°形成共轭体系,降低了体系的内能。
2°烯醇结构可形成分子内氢键(形成较稳定的六元环体系)(2)其他含活泼亚甲基化合物的互变异构体中烯醇式的含量见P 350表14-1。
14.2β-二羰基化合物碳负离子的反应 1.亚甲基活泼氢的性质 (1)酸性乙酰乙酸乙酯的α-C 原子上由于受到两个吸电子基(羰基和酯基)的作用,α-H 很活泼,具有一定的酸性,易与金属钠、乙醇钠作用形成钠盐。
3-C-CH 2-C-OC 2H 5O O2黄白白有活性氢溴褪色(具双键)CH 322H 5O O CH 3-C=CH-C-OC 2H 5OH O酮式烯醇式室温(93%)(7%)CH 3-C-CH 2-C-OC 2H 5O O32H 5πππP πP 体系CH 3-C=CH-C-OC 2H 5OH CH 3C CH C OC 2H 5OO O CH 3C CH 2C OC 2H 5O O CH 3C CH C OC 2H 5O O 25Na pKa =11(2)钠盐的烷基化和酰基化乙酰乙酸乙酯的钠盐与卤代烃、酰卤反应,生成烃基和酰基取代的乙酰乙酸乙酯。
烷基化:注:① R 最好用1°,2°产量低,不能用3°和乙烯式卤代烃。
② 二次引入时,第二次引入的R ′要比R 活泼。
③ RX 也可是卤代酸酯和卤代酮。
酰基化:3.酮式分解和酸式分解酮式分解 乙酰乙酸乙酯及其取代衍生物与稀碱作用,水解生成β-羰基酸,受热后脱羧生成甲基酮。
故称为酮式分解。
例如:酸式分解 乙酰乙酸乙酯及其取代衍生物在浓碱作用下,主要发生乙酰基的断裂,生成乙酸或取代乙酸,故称为酸式分解。
例如:14.3丙二酸二乙酯 (1)制法(2)性质1.酸性和烃基化CH 3C CH C OC 2H 5O O Na RX3CH OC 2H 5O O R CH 3C CH C OC 2H 5O O R 253C C C OC 2H 5O O R Na R'X CH 3C C C OC 2H 5O O R R'CH 3CH C OC 2H 5O O Na RCOX CH 3CH OC 2H 5O OCORCH 3C CH 2C OC 2H 5O O CH 3C CH C OC 2H 5O O R 稀CH 3C CH 3OC 2H 5OH + CO 2CH 3C CH C OC 2H 5O O COR 稀CH 3C CH 2R OC 2H 5OH + CO 2稀OH CH 3C CH 2O C OR C 2H 5OH + CO 2CH 3C CH 2C OC 2H 5O OCH 3C CH C OC 2H 5O ORCH 3COOH CH 3C CH C OC 2H 5O OCOR OHOH 2CH 3COOH +RCH 2COOH + C 2H 5OH CH 3COOH +RCOCH 2COOH + C 2H 5OH+ C 2H 5OH浓浓CH 3COOH P Cl CH 2COOH Cl CH 2COONa CN 2524CH 2COOC 2H 5COOC 2H 5COOC 2H 5CH 2NaOC 2H5NaCOOC 2H 5CHpKa = 132.水解脱羧丙二酸二乙酯及其取代衍生物水解生成丙二酸,丙二酸不稳定,易脱羧成为羧酸。
例如:(3)丙二酸二乙酯在有机合成的应用丙二酸二乙酯的上述性质在有机合成上广泛用于合成各种类型的羧酸(一取代乙酸,二取代乙酸,环烷基甲酸,二元羧酸等)。
例如,用丙二酸二乙酯法合成下列化合物,其结构分析如下:具有活泼亚甲基的化合物容易在碱性条件下形成稳定的碳负离子,所以它们还可以和羰基发生一系列亲核加成,例如,柯诺瓦诺格(Knoevenagel )反应,迈克尔(Michael )反应。
见P 356。
14.4.酯缩合反应:CHCOOC 2H 5COOC 2H 5Na RX CHCOOC 2H 5COOC 2H 5R CH COOC 2H 5COOC 2H 5R NaOC H C COOC 2H 5COOC 2H 5R NaRX C COOC 2H 5COOC 2H 5R R'2CH 2(COOC 2H 5)2X(CH 2)nX 25(CH 2)n CH(COOC 2H 5)2CH(COOC 2H 5)2NaOC 2H 522(CH 2)n C(COOC 2H 5)2C(COOC 2H 5)2CH 2n = 3~7NaOC H CH 2(COOC 2H 5)2(1)COOC 2H 5COOC 2H 5Br(CH 2)4Br R CH COOC 2H 5COOC 2H 5NaOH2R CH (2)CO 2R CH 2COOHR C R'COOC 2H 52H 5NaOH 2(1) H CO 2R CHCOOHR'COOC 2H 5COOC 2H 5NaOH2(1) H (2)CO 2COOH CH 原有①Claisen缩合这类反应称为Claisen缩合反应历程:乙酸乙酯的酸性是很弱的(Pka~24),而乙醇钠又是一个比较弱的碱(乙醇Pka~15.9)。
因此,可以想到乙酸乙酯形成的负离子在平衡体系中是很少的。
这也就是说,用乙氧负离子把乙酸乙酯变为-CH2COOC2H5是很困难的。
但是在实际上为什么这个反应会进行的如此完全呢?其原因就是最后产物乙酰乙酸乙酯是一个比较强的酸(Pka~11),形成很稳定的负离子,可以使平衡朝产物方向移动。
体系中乙酸乙酯负离子浓度虽然很低,但一形成后,就不断的反应,结果使反应完成。
当酯的α-碳上只有一个氢时,由于增加了烃基的诱导效应,酸性减弱了,进行酯缩合反应时,需要使用比醇钠更强的碱(如ph3CNa,NaH),夺取酯的α氢,形成较稳定的α负碳离子,才能迫使反应朝右方进行。
②交叉Claisen缩合如两个酯只有一个酯有α—H,相互缩合就能得到一个单纯产物。
③酮与酯缩合酮的α-H比酯的α-H活泼:④ Dieckmann缩合反应酯缩合反应也可在分子内进行,形成环酯,这种环化酯缩合反应又称为Dieckmann反应。
(己二酸酯和庚二酸酯在醇钠作用下进行自身的酯缩合反应)注意!酯缩合常用的碱性催化剂是醇钠RONa,不是醇加钠。
醇加钠是一组还原剂,它要将酯还原成醇。
它是合成五元环、六元碳环的一个方法。
(并不是所有的二元酸酯都能发生环缩合,一般局限于生成稳定的五、六碳环。
所以,只是有α氢的己二酸酯和庚二酸酯才能起Dieckmann 缩合)如:14.5乙酰乙酸乙酯在有机合成上的应用由于乙酰乙酸乙酯的上述性质,我们可以通过亚甲基上的取代,引入各种不同的基团P405。
例1:合成例2:合成例3:合成说明:乙酰乙酸乙酯合成法主要用其酮式分解制取酮,酸式分解制酸很少,制酸一般用丙二酸二乙酯合成法。
CH3C CH2OCH2经结构分析,需引入原引原要分两次引入,先引入再引入CH3CH2CH=CH 2CH3CHOCH3O引原原§14.6 不饱和羰基化合物不饱和羰基化合物是指分子中即含有羰基,又含有不饱和烃基的化合物,根据不饱和键和羰基的相对位置可分为三类。
(1) 烯酮(RCH=C=O )(2) α,β-不饱和醛酮(RCH=CH-CHO )(3) 孤立不饱和醛酮 (RCH=CH (CH 2)n CHO ) n ≥1孤立不饱和醛酮兼有烯和羰基的性质,α,β-不饱和醛酮、烯酮有其特性及用途,下面我们主要讨论这两类化合物。
14.6.1乙烯酮 最简单且最重要的烯酮是乙烯酮,其制法和性质见P 345~346,(略) 14.6.2α,β-不饱和醛酮α,β-不饱和醛酮的结构特点是碳碳双键与羰基共轭,故α,β-不饱和醛酮兼有烯烃、醛、酮和共轭二烯烃的性质,若与亲电试剂加成,则应加到碳碳双键上,若与亲核试剂加成则应加到羰基上,但其特性反应是共轭加成。
1.共轭加成(1,2-加成或1,4-加成)反应为1,2-加成还是1,4-加成决定于三个方面:(1)亲核试剂的强弱 弱的亲核试剂主要进行1,4-加成,强的主要进行1,2-加成。
(2)反应温度 低温进行1,2-加成,高温进行1,4加成。
(3)立体效应 羰基所连的基团大或试剂体积较大时,有利于1,4加成。
1. 麦克尔(Michael )反应α,β-不饱和醛酮、羧酸、酯、硝基化合物等与有活泼亚甲基化合物的共轭加成反应称为麦克尔(Michael )反应,其通式是:例如:麦克尔(Michael )反应在有机合成上有其应用价值14.7 有机合成路线设计 (自学)C C C O αβδδδ由于羰基的极化和共轭 键的离域,不仅羰基碳上带有部分正电荷, 上也带有部分正电荷,因此与亲核试剂加成时就有两种可能πβC C C C O + NuC C ONu C C C O Nu HHC C C OH Nu C C C OHC H C C ONu C C H + R C C Z ( 代表能和共轭的基团)Z C=C CH 3CH=CH-C-CH 3O +CH 2COOC 2H 5COOC 2H 5CH 3CH-CH 2-C-CH 3OCH (COOC 2H 5)2在科研中,若从天然产物中得到一个很有用的化合物,我们采取的一般步骤是纯化,确定其结构,若为一新化合物,我们就用人工已知、可靠的合成方法把它合成出来,以验证其结构。
所以,有机合成路线设计是有机化学工作者必备的手段。
合成路线的好坏,也反映出一个化学工作者的知识水平与能力。
有机化学合成路线设计方法通常是倒推法,也叫逆合成分析。
合成设计的一般程序为:1.分析a.认出目标分子中的官能团。
b.用已知和可靠的反应进行切断。
c.必要时重复进行切断,直至达到易于取得的起始原料。
2.合成a.根据分析,写出合成计划,加进试剂和条件;b.根据实验中遇到的失败和成功,修改计划;一.碳胳的切断与合成㈠切断介绍⒈主导思想:切断是为了合成,切断时一定要想到合成。
