第十四章 杂环化合物
大学有机化学课件第十四章 杂环化合物

邢其毅主编 基础有机化学 下册 高等教育出版社 1983 年 花文廷编著 杂环化学 北京大学出版社 1995 年
青霉素 V
磺胺噻唑(ST)是磺胺类药物的一种,用作肠道消炎药。2-巯基苯并噻唑是一种重要的 橡胶硫化促进剂。
H2N
N
SO2NH
S
磺胺噻唑
N SH
S
2-巯基苯并噻唑
第三节 六元杂环
一、吡啶的结构和性质
1.吡啶的结构 在吡啶分子中,碳原子与氮原子均以sp2杂化,形成了六个σ链,每个原子还均有一个
含一个电子的p轨道,相互交差形成一个闭合的共轭体系,此体系的π电子数为 6,符合 4n+2 规律,故具有芳香性,但是氮原子上还有一个sp2杂化轨道上有一对未成键电子,易与质子 结合,所以吡啶具有碱性。吡啶的pKb=8.75,碱性比苯胺(pKb=9.40)强。
O
CHO Zn4O0-0。CCr2O3
H2 , Ni O
O
呋喃
四氢呋喃(THF)
五、噁唑、噻唑、咪唑和吲哚的性质
N
N
N
O
S
N H
N H
噁唑
噻唑
咪唑
吲哚
(oxazole)
(thiazole)
(imidazole)
(indole)
以咪唑为例来讨论含二个杂原子的五元环的结构,咪唑环上五个原子都采用sp2杂化,
糠醛
糠醛是重要的化工原料,它的主要反应和用途有:
第十四章杂环化合物

C O O OCH3
CH3
CH3
R'=(CH3)2CHCH2CH2(CH2CHCH2CH2)CH2C=C CH2
O S H3C N H O O CH3
R
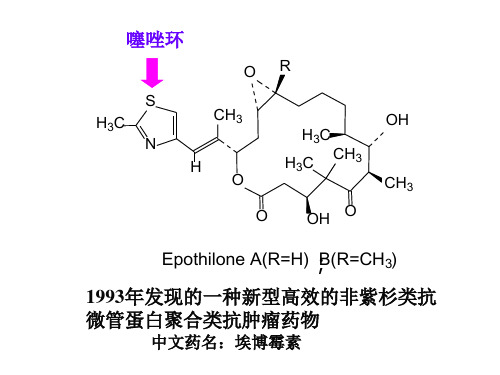
OH H3C H3C CH3 CH3 OH O
Epothilone A(R=H); B(R=CH3)
1993年发现的一种高效抗癌物质
14.1 杂环的分类和命名 14.1.1 分类
o
Br
Br2
Br +
Br
(c )卤化
N
300 C
o
N
N
(d)还原 吡啶可被催化加氢为六氢吡啶(哌 啶)。六氢吡啶的碱性(PKb=2.7)与一般脂肪族 仲胺相近。
+ 3H2 N Ni 180C
o
N H
5 、 吡啶环上的亲核取代
NaNH2 N
N H2O NHNa
N
NH2
C6H5Li N
N C6H5
吡啶2-和4-位上甲基具有酸性(类羟醛缩合)。
路易斯酸
SO3 N CH2Cl2,室温 N
SO3 N
SO3
N SO3 HCl O ClCH2CH2Cl,1000C O SO3 N H O SO3H (41%)
吡啶是良好的亲核试剂,与卤代烷、酰卤等反应 形成吡啶盐,都是很好的固体,有芳香性(反应时并 未破坏它的环状封闭共轭体系),是活性强而温和的 硝化、磺化、烷基化或酰基化试剂。
2 1
N
5
3 4
9 8
N
7
1,3,5-三嗪 1,3,5-triazine
酞嗪 Phthalazine
6
1,10-菲咯啉
1,10phenanthroline
第14章杂环化合物

+N N N H
SO3H
NN N H
SO3H
呋喃和噻吩不能偶联,说明吡咯环电子密度高。
(三)吡咯的重要衍生物(P.306)
与生命有着密切关系的两大色素:叶绿素和血红 素,以及维生素B12都含有卟吩环。
NH N N HN
卟吩(porphine)
卟吩(porphine)是由4个吡咯环的α碳原子通过次甲基 (-CH=)相连而成的复杂的共轭体系,成环的原子 共平面,有26个π电子,符合4n+2的规则,有芳香性, 其取代物则称为卟啉(porphyrin)。
O 1 CH3
2-甲基呋喃 (α -甲基呋喃) (2-methylfuran)
N S CH3
5-甲基噻唑 5-methylthiazole
H3C N
N H
4-甲基咪唑 4-methylimidazole
3. 稠杂环的命名
对于稠杂环则有固定的编号顺序,通常是从一端开始,
依次编号,公用的碳原子一般不编号,并尽可能使杂原
1. 吡咯、呋喃和噻吩的结构 结构特点:
杂原子上的孤对电子,参与闭合的共轭体系。 π电子数为6,具有一定的芳香性,芳香性比 苯差。
芳香性: 苯> 噻吩 > 吡咯 > 呋喃 共振能: 150.6 121.3 87.8 66.9 (kJ·mol-1)
亲电取代活性比苯大, 且α位比β位活泼。
1. 吡咯、呋喃和噻吩的结构
N
S 噻吩
N
N H 咪唑
HC
N3 C H
N1 H
C H
S和仲N原子上的孤对电子处于P轨道,参与共轭; 叔N原子的孤电子对处于SP2杂化轨道,未参与共轭。
水溶性比相应单杂环高。
第十四章 杂环化合物

(4)吡咯和呋喃不能直接用强酸进行硝化和磺化反应。这是由 于它们遇强酸时, 杂原子能质子化, 使芳香大π 键被破坏。所 以, 需用较温和的非质子性试剂进行硝化和磺化反应。例如, 吡咯用硝酸乙酰酯进行硝化,用吡啶磺酸进行磺化:
5、 吡咯的衍生物 吡咯衍生物广泛地存在于动植物体内, 如叶绿素、血红素、维生素B12、 胆红素及许多生物碱中均含有吡咯环, 它们都具有重要的生理活性。 例如血红素(haem),其基本骨架为卟吩(porphin),它是由4个吡咯环通过4个 次甲基在吡咯的α-位相连而成的大环。成环的原子都在一个平面上,是一个复 杂的共轭体系,因此相当稳定。 血红素是卟吩以共价键及配位键与亚铁原子所形成的配合物, 同时在吡咯 环的β-位置还有不同的取代基。血红素与蛋白质结合称为血红蛋白, 存在于人 和动物的红血细胞中, 是运输氧气的物质。
卟吩
血红素
第四节 稠杂环化合物
稠杂环化合物是指两个或两个以上杂环稠合或由苯环与杂环稠合而成的 杂环化合物。由苯环与杂环化合物稠合的杂环化合物又称为苯稠杂环。常见 的稠杂环化合物有嘌呤、吲哚、喹啉等及其衍生物,本节主要讨论嘌呤及其 衍生物的结构和性质。 从结构上看, 嘌呤是嘧啶和咪唑两个杂环稠合而成。结构式为:
β-吲哚乙酸 β-indole acetic acid
6) 为了命名方便, 有时也将杂环作为取代基, 例如:
2-呋喃甲醛(糠醛) 2-furaldehyde(furfural)
3-吡啶甲酸(烟酸) 3-pyridine carboxylic acid (nicotinic acid)
7)含有“饱和原子”的杂环化合物的命名 在杂环化合物中,当杂环上含有一个“饱和”原子时,往往存在互变异 构体,为了区别异构体,在命名时要将“饱和”原子上的氢原子的位置用阿 拉伯数字表示出来,并同大写斜体“H”一起写在词首,作为环系名称的一部 分;在编号尚有选择时,要给“饱和”原子以最低编号。例如:
有机化学第十四章杂环化合物和生物碱

(四)嘧啶及其衍生物
1. 嘧啶 嘧啶的电子结构与吡啶相似,2个氮原子均以sp2杂化轨道成
键,每个氮原子上都含有未共用电子对。
2. 嘧啶的衍生物 (1)尿嘧啶、胞嘧啶和胸腺嘧啶
尿嘧啶
胞嘧啶
胸腺嘧啶
19
(2)磺胺嘧啶 (3)维生素B1
20
(五)吲哚及其衍生物
吲哚由苯环与吡咯环稠合而成。吲哚是无色片 状晶体,熔点52℃,沸点23.5℃,不溶于水,可溶 于热水和有机溶剂中,有恶臭,但吲哚在浓度极稀 时,有花的香味,可作为香料使用。
卟吩
血红素
16
(三)吡啶及其衍生物
1. 吡啶
吡啶有弱碱性,可与强酸成盐。吡啶用于合成维生素和药 物等,并用做溶剂,也是一些有机反应的介质和分析化学试剂。
2. 吡啶的衍生物 (1)烟酸和烟酰胺
烟酸和烟酰胺的结构式如下:
烟酸
烟酰胺
17
(2)异烟肼 (4)维生素B6
(3)尼可刹米
吡哆醇
吡哆醛
吡哆胺
18
(一)呋喃及其衍生物
1. 呋喃 呋喃是最简单的五元含氧杂环,存在于松木焦油中。呋喃可使 盐酸浸过的松木片呈绿色,称为松木片反应,可用于检验呋喃。 2. 呋喃衍生物 (1)呋喃西林
(2)糠醛
15
(二)吡咯及其衍生物
1. 吡咯 吡咯是最简单的五元含氮杂环,存在于煤焦油和骨焦油中。 吡咯蒸汽遇醮有盐酸的松木片显红色,可用于吡咯的鉴别。 2. 吡咯的衍生物
(二)沉淀反应 生物碱在酸性水或酸性稀醇中与某些试剂生成难溶于水的复盐 或络合物的反应。 用途: 鉴别——试管、TCL或PPC显色剂; 提取分离——检查是否提取完全。
(三)显色反应
大多数生物碱能和一些试剂反应呈现出不同的颜色。这些能 使生物碱发生颜色反应的试剂称为生物碱显色剂。常用的生物碱 显色剂有钼酸钠、甲醛、钒酸铵、高锰酸钾等的浓硫酸溶液。如 10 g·L-1的钒酸铵的浓硫酸溶液与阿托品显红色,与吗啡显棕 色,与可待因显蓝色。这些颜色反应可用于生物碱的鉴定。
第十四章芳香杂环化合物

磺胺的抑菌作用是由于其结构与细菌生长所必须的对氨基
苯甲酸(PAPB)的结构极为相似,能产生竞争性拮抗, 干扰细菌的酶系统对PAPB的利用。
临床上使用的药物:
N
N
发烟 H2SO4
250oC
N
NO2
亲电取代发生在 SO3H β位。
齐齐巴宾反应
亲核取代发生 在α位。 当α位上有易离 去基团时,与 较弱的亲核试 剂就能发生亲 核取代反应
(4)、吡啶类化合物侧链氧化反应 氧化难、还原易(抗氧化性比苯强)
N KMnO4 HOOC
N
N HNO3
COOH NH3
N
全饱和时可不标明位置。例如:
N H
N H
O
1,2,3,4-四氢喹啉 2,5-二氢吡咯 四氢呋喃
含活泼氢的杂环化合物及其衍生物,可能存在着互变异 构体,命名时需按上述标氢的方式标明之。例如:
N
N
H
N
N
N
N H
NN
9H-嘌呤
7H-嘌呤
第二节、芳香五元杂环化合物
一、吡咯、呋喃和噻吩 1、结构与芳香性
sp2
O
H2N
N SO2NH
N
磺 胺 嘧 啶 ( SD)
F HN
5-氟 尿 嘧 啶
O
N H
( 5-FU)
抗肿瘤药
第四节 稠杂环化合物
嘌呤及衍生物
嘌呤 两个互变异构体的平衡体系
6
1N
5
7
N
2
98
14杂环化合物4

4C 1O 共面 共面. 与苯环比较, 呋喃、噻吩、 原子共用6 与苯环比较 呋喃、噻吩、吡咯为 5原子共用6 电子, 故环上π电子云密度比苯环大 属于“ 电子云密度比苯环大, 个π电子 故环上 电子云密度比苯环大 属于“多π 芳杂环” 芳杂环”。
26
呋喃
噻吩
吡咯
芳香性 (环的稳定性): 苯 > 噻吩 > 吡咯 > 呋喃 环的稳定性):
27
H N
N原子 原子 给电子共轭>>吸电子诱导 给电子共轭 吸电子诱导
N
吡啶N: 吡啶 : 吸电子诱导
吡啶N: 吡啶 :吸电性
吡咯N: 吡咯 :给电性
28
(二)吡咯、呋喃和噻吩的性质 吡咯、 1.吡咯的酸碱性 .
钝化 β取代
NO2
发烟 HNO3 / 发烟 H2SO4
N(CH3)3
N(CH3)3
16
由于氮原子的电负性大, 由于氮原子的电负性大 吡啶环上碳原子的电子云密度 较苯低,尤其与质子或 Lewis 酸结合使N带正电荷后,环 较苯低, 酸结合使 带正电荷后, 带正电荷后 的电子云密度更低。 上 C 的电子云密度更低。吡啶的亲电取代反应要比苯难得 多,与硝基苯相似,亲电取代反应主要进入 β 位。 与硝基苯相似,
吡咯N上孤电子对因参与环的共轭 故碱性极弱, 吡咯 上孤电子对因参与环的共轭, 故碱性极弱 上孤电子对因参与环的共轭 比苯胺还弱得多, 不能与酸形成稳定的盐。 比苯胺还弱得多 不能与酸形成稳定的盐。
NH2 > NH3 >
7
9.6
13.6
29
另一方面, 上的H 另一方面,吡咯 N上的 却有微弱的酸性 上的 (pKa=17.5 ), 与醇相当,而比酚弱。吡咯在无水条件 与醇相当,而比酚弱。 下可以与固体氢氧化钾加热生成钾盐。 下可以与固体氢氧化钾加热生成钾盐。
第十四章 杂环化合物(已修改)

7,没有固定名称的稠杂环命名(自学) ,没有固定名称的稠杂环命名(自学)
21
第二节 五元杂环化合物
Pentheterocycles
22
一,呋喃,噻吩,吡咯 呋喃,噻吩, ) (Furan, Thiophene and pyrrole)
(一) 结构
电子离域的结果使环上 各C原子的电子云密度增大 原子的电子云密度增大 ),这类杂环称 (6/5),这类杂环称"多π" ),这类杂环称" 芳杂环. 芳杂环.它们的亲电取代 比苯容易. 比苯容易.
H N 1H-吡咯 N 2H-吡咯 O O
2H-吡喃
4H-吡喃
15
4,若杂环不含有最多数目的非聚集双键, ,若杂环不含有最多数目的非聚集双键, 这样的饱和H称为"外加氢" 命名时, 这样的饱和 称为"外加氢".命名时, 称为 需标明外加氢的位置和数目, 需标明外加氢的位置和数目,全饱和的 可省略位置, 可省略位置,例:
5
本章着重讨论的杂环化合物, 本章着重讨论的杂环化合物,其环系较稳定并 具有一定程度的芳香性, 具有一定程度的芳香性,把它们统称为芳(香)杂环 其它不具有芳香性的杂环化合物, 化合物.其它不具有芳香性的杂环化合物,统称非 芳香杂环化合物(或称杂脂环化合物) 芳香杂环化合物(或称杂脂环化合物).
芳香性:平面环, 个电子, ※ 芳香性:平面环,4n+2个电子,难氧化 个电子 而易取代. 而易取代.
4
O
O
O
N H
O
杂环化合物种类繁多,数量庞大, 杂环化合物种类繁多,数量庞大,在自然界分 布极为广泛,大多数的生物碱为杂环化合物, 布极为广泛,大多数的生物碱为杂环化合物,植 物中的叶绿素,动物中的血红蛋白等,中心结构 物中的叶绿素,动物中的血红蛋白等, 都为杂环, 都为杂环,作为生命基础物质的核酸基本组成单 碱基也为杂环碱. 位—碱基也为杂环碱.在现代药物中,杂环化合 碱基也为杂环碱 在现代药物中, 物占了相当大的比重, 物占了相当大的比重,现在已成为一门独立的学 杂环有机化学. 科—杂环有机化学. 杂环有机化学
第十四章杂环化合物与维生素
5. 命名
按生理功能和发现先后:A、B、C、D 等
根据化学结构:初发现时以为是一种,以后 证实是几种维生素的混合物,则根据化学结构 的不同在字母右下方注以1、2、3等,如A1
邓健 制作 罗美明 审校
35
二、脂溶性维生素
(一)维生素A 1. 结构
H3C CH3 CH3
维生素B6包括下列三个组分:
CH2OH
CHO
CH2NH2
HO
CH2OH HO
CH2OH HO
CH2OH
H3C N
H3C N
H3C N
吡哆醇
吡哆醛
吡哆胺
维生素B6是蛋白质代谢的必要物质,缺乏它蛋白质代 谢就不能正常进行。
维生素PP。 COOH
CONH2
N
N
-吡啶甲酸(烟酸)
-吡啶甲酰胺(烟酰胺)
雷米封,是一种有效的抗结核病的药物。
2. 特点
既不供给能量,也不构成组织成分 体内不能合成或合成甚微,必须由食物供给 需要量很少 (μg—mg/d ), 但不可缺少
3. 功能
参与体内物质代谢与调节 参与辅酶组成
人民卫生电子音像出版社
34
4. 分类
脂溶性维生素:A、D、E、K。此类维生素因排 泄效率不高,过多摄入会在体内蓄积而导致中毒
NH2
NN
H2N N NH2 三聚氰胺(cyanuramide) ,含氮量高达66.6%
三聚氰胺是一种三嗪类含氮杂环有机化合物,被用作化 工原料,对身体有害,不可用于食品加工或食品添加物。 三聚氰胺摄入人体后进入肾细胞中,三聚氰胺在氰尿酸存 在下两者形成结晶沉积从而造成肾结石,堵塞肾小管,最 终造成肾衰竭。由于三聚氰胺结石微溶于水,对于成年人, 由于经常喝水使得结石不容易形成。但对于哺乳期的婴儿, 由于喝水很少并且相比成年人肾脏狭小,造成更容易形成 结石。
第14章杂环化合物

43
5 12
S
NH2
5 43 61 2
N
CH3
Br
Br
' 43
5 12
Br ' N
Br
H
2-氨基噻吩 3-甲基吡啶 (氨基噻吩) (甲基吡啶)
2,3,4,5-四溴吡咯 (,,,-四溴吡咯)
2.环上有两个或两个以上相同的杂原子时,应 使杂原子位次之和最小,并将连有氢原子或取 代基的杂原子编号定为1。如环上有不同杂原子 时,按O、S、-NH-和-N=的顺序编号。
sp2杂化轨道上,伸向环平面外侧,未参与
共轭,可结合质子,因此吡啶具有弱碱性。
H
H
H
N
H
H
吡啶的分子轨道示意图
d+
d-
d-
d+ N
d+
d-
电子云的 交替极化
吡啶环上电子云密度的分布不平均,氮原 子上的电子云密度较大,碳原子的电子云 密度较低,尤其是氮原子邻位、对位的电 子云密度降低得比间位多,所以吡啶的亲 电取代反应比苯难,并且主要发生在间位 (即位)上。像吡啶这类环碳上的电 子云密度比苯低的芳杂环亦称为“缺” 芳杂环。吡啶是一个极性分子;氮原子的 诱导效应和共轭效应的方向一致。
3.尿酸(urate):2,6,8-三氧嘌呤称为尿 酸
O HN ON
H
NH NO H
OH
N
N
HO N
N OH H
2,6,8-三氧嘌呤(酮型) 2,6,8-trioxypurine
2,6,8-三羟基嘌呤(烯醇型) 2,6,8-trihydroxypurine
第二节 维生素
维生素是维持人体正常代谢机能不可缺少的微 量有机化合物. 脂溶性维生素: 维生素A、D、K、E 水溶性维生素: B族 维生素,维生素C,维生 素P等
中国药科大学有机化学课件—第十四章杂 环 化 合 物

(一) 吡啶
1 电子结构
孤电子对 在sp2杂化 轨道上。
共轭效应和诱导效应都是吸电子的
结构:吡啶N是sp2杂化,孤电子对不参与共轭。 反应:碱性较强。环不易发生亲电取代反应但易发生亲核
取代反应。发生亲电取代反应时,环上N起间位定 位基的作用。发生亲核取代反应时,环上N起邻对 位定位基的作用。
2 物理性质
中国药科大学有机化学课件—第十四章杂 环 化 合 物
主要内容
第一节 杂环化合物的分类和命名 第二节 六元杂环化合物 第三节 五元杂环化合物
第一节 杂环化合物的分类和命名
(一)分类
1、脂杂环 三元杂环
没有芳香特征的杂环化合物称为脂杂环。
O (环氧乙烷)
H
N (氮杂环丙烷)
四元杂环 五元杂环 七元杂环
N(CH3)3
发烟 HNO3 / 发烟 H2SO4
NO2 N
取代在 b 位 NO2
N(CH3)3
其它反应现象
Friedel-Crafts 反应
无反应发生
浓 H2SO4 / HgSO4
SO3H
N
220oC
N
Br2 / 浮石 300oC
Br N
环上有给电子基时反应相对较易进行
KNO3 / 浓 H2SO4
N
160℃
N N2H
N NH 2
利用亲核取代反应可制取烃基取代的二嗪。
N
+
3 C 2 C C H 2 C H H 2 L H i乙 醚
N
H C 4 H 9 - n
C 4H 9-n
N i LK M 4nO N
N
丙 酮
N
(3) 氧化
二嗪不易被氧化。若用过酸氧化,得嘧啶单N-氧化物
第十四章 杂环化合物

异噁唑 isoxazole
(2) 含两个杂原子的五元单杂环
噻唑 thiazole
异噻唑 isothiazole
(2) 含两个杂原子的五元单杂环 Ø 母核确定后,编号从杂原子开始,选择杂原子顺 序为:
-O- > -S- > -NH- > -N=
Ø 同时使其他杂原子编号位次尽可能小; Ø 在此基础上,若有取代基,使其位次尽可能小。
吡啶-4-甲酸 2-甲基吡啶 2-methylpyridine pyridine-4-carboxylic acid γ-吡啶甲酸 γ-pyridinecarboxylic acid
(4) 含两个杂原子的六元单杂环
哒嗪 pyridazime
嘧啶 pyrimidine
吡嗪 pyrazine
(4) 含两个杂原子的六元单杂环 Ø 例:
N H
5、根据杂环中碳原子电子云密度: 富π电子杂芳环和缺π电子杂芳环 Ø 五元杂芳环富电子 Ø 六元含氮杂芳环缺电子
N
吡啶
O
呋喃
(二)杂环化合物的命名 命名原则: 按IUPAC命名原则规定,保留特定45个杂环化合物的 俗名和半俗名并作为命名的基础。以此原则为准,我 国多采用“音译法”,即按英文名称的读音,选用同 音口字旁的汉字(“口”字旁表示为杂环),对杂环 化合物进行命名。 注意:命名时需要记住母环名称,编号时不同的母环 有不同的编号方法。
Ø 具有生物活性的杂环骨架化合物:
一、杂环化合物的分类和命名 (一)杂环化合物的分类 1、根据环的大小: 五元杂环和六元杂环
N
吡啶
O
呋喃
2、根据环中所含杂原子种类:N、O、S
O
呋喃
N H
吡咯
杂环化合物

第14章杂环化合物杂环化合物是由碳原子和非碳原子共同组成环状骨架结构的一类化合物。
这些非碳原子统称为杂原子,常见的杂原子为氮、氧、硫等。
前面已经学过的内酯、内酰胺、环醚等化合物都是杂环化合物,但是这些化合物的性质与同类的开链化合物类似,因此都并入相应的章节中讨论。
本章将主要讨论的是环系比较稳定、具有一定程度芳香性的杂环化合物,即芳杂环化合物。
杂环化合物的种类繁多,数量庞大,在自然界分布极为广泛,许多天然杂环化合物在动、植物体内起着重要的生理作用。
例如:植物中的叶绿素、动物血液中的血红素、中草药中的有效成分生物碱及部分苷类、部分抗生素和维生素、组成蛋白质的某些氨基酸和核苷酸的碱基等都含有杂环的结构。
在现有的药物中,含杂环结构的约占半数。
因此,杂环化合物在有机化合物(尤其是有机药物)中占有重要地位。
第一节分类和命名一、杂环化合物的分类芳杂环化合物可以按照环的大小分为五元杂环和六元杂环两大类;也可按杂原子的数目分为含一个、两个和多个杂原子的杂环,还可以按环的多少分为单杂环和稠杂环等。
见表14-1。
表14-1 有特定名称的杂环的分类、名称和标位二、杂环化合物的命名杂环化合物的命名比较复杂。
现广泛应用的是按IUPAC(1979)命名原则规定,保留特定的45个杂环化合物的俗名和半俗名,并以此为命名的基础。
我国采用“音译法”,按照英文名称的读音,选用同音汉字加“口”旁组成音译名,其中“口”代表环的结构。
见表14-1。
(二)杂环母环的编号规则当杂环上连有取代基时,为了标明取代基的位置,必须将杂环母体编号。
杂环母体的编号原则是:1.含一个杂原子的杂环含一个杂原子的杂环从杂原子开始编号。
见表14-1中吡咯、吡啶等编号。
2.含两个或多个杂原子的杂环含两个或多个杂原子的杂环编号时应使杂原子位次尽可能小,并按O、S、NH、N 的优先顺序决定优先的杂原子,见表14-1中咪唑、噻唑的编号。
3.有特定名称的稠杂环的编号有其特定的顺序有特定名称的稠杂环的编号有几种情况。
第十四章 芳香杂环化合物

Cl
三、嘌呤
N N
N
N N N
NH
N H (Ⅰ) 9H 嘌呤
( Ⅱ) 7H 嘌呤
嘌呤为无色晶体,m.p216~217℃,易溶于水,其水溶液呈中性, 但能与酸或碱成盐。 纯嘌呤环在自然界不存在,嘌呤的衍生物广泛存在于动植物体内。
1.尿酸 存在于鸟类及爬虫类的排泄物中,含量很多,人尿中也含少量。
O HN O N H N H NH O HO N N N H OH N OH
2.糠醛的性质 同有α-H的醛的一般性质。 (1)氧化还原反应
CuO, Cr2O3 150 ℃, 10MPa O CHO KMnO4 弱碱性 O V2O5 - MoO O2, 320 ℃, O O O + CO2 + H2O COOH O CH2OH
(2)歧化反应
O CHO 浓碱 O COOH + O CH2OH
3
5 6
4 N N 1
4
3 2
2
吡啶(pyridine)
嘧啶(pyrimidine)
吡嗪(pyrazine)
4 5 6 N 1 3 N2
5 6 O 1
3 2
哒嗪(pyridazine)
吡喃(pyran)
5 6 7 8
4 5 6 7
4 3 N 1 2
6 7
5
4 3 N2
8
1
喹啉(quinoline)
CH3 N KMnO4 / H COOH N β 吡啶甲酸(烟酸) HNO 3 N COOH N α 吡啶甲酸
O CH3C-OOH N N O
NO2 HNO 3 N O H2SO4 90 ℃ N O PCl3
NO2 + POCl3 N
医学生物化学第十四章芳香杂环化合物

(尿酸)烯醇式
磺胺类药物:
4
1
H2N
SO2NH2
磺胺
H2N
SO2NHR
H2N
SO2 N H
N
O CH3
对-氨基苯磺酰胺 磺胺甲基异噁唑(SMZ) 含有“饱和原子”的杂环化合物的命名
O
H N
5 2
1
N
2 3
4
四氢呋喃
2,5 – 二氢吡咯
3,4 – 二氢喹啉
N
KMnO4 溶 液
N
COOH
CH 3 KMnO 4溶 液
COOH
N
N
吡啶比苯易还原:
N
Na+C2H5OH
或H2 / Pt
N H
六 氢 吡 啶(仲 胺 )
吡啶的衍生物 β- 吡啶甲酸 (烟酸)
N
COOH
N
CONH2 β-吡啶甲酰胺
(烟酰胺)
1N 2
(二) 嘧啶及其衍生物
NH2
4
3
N1 N3
O
4
3
N
OH N
5 4
4
N N H
5 6
3
COOH
H2N 2 N
3
Br
7
N1 H
2
4-嘧啶甲酸
2-氨基-6-羟基嘌呤
6-溴吲哚-3-甲酸
(三) 标氢(标记氢原子)
6 6 5 4
O
H
O
H H H
1
N
2
N N H
9
7 8
1
N
2
5 4
7
NH N
9 8
N
3
N
3
2H - 吡喃
第十四章 芳香杂环化合物

第十四章芳香杂环化合物1.吡啶的亲电取代反应为什么较难,且取代基主要进入β位?2.为什么哌啶的碱性比吡啶强?3.从吡咯和吡啶的结构解释二者水溶性和碱性的大小。
4.什么叫生物碱?5.临床上使用生物碱药物时为什么不能与碱性药物并用?6.命名下列化合物7.写出下列化合物的结构式⑵-甲基-六氢吡啶2,5⑴-二溴呋喃 4⑷-二甲基喹啉4⑶-羟基-5-氟嘧啶 2,8⑹-甲基-2-氨基嘌呤⑸-吡啶甲酰胺 638.将下列化合物按碱性由强到弱排列顺序9.指出下列杂环化合物所含的杂环母核10.试比较吡咯、吡啶、苯的亲电取代反应活性大小11.请解释为什么吡啶的碱性比苯胺强?12.2—氨基吡啶能在比吡啶温和的条件下进行硝化或磺化反应,取代主要发生在5位,说明其原因。
13.吡啶溴代不使用FeBr3等Lewis酸催化剂,为什么?14.比较下列各化合物中不同氮原子的碱性强弱15.下列各杂环化合物哪些具有芳香性?在具有芳香性的杂环化合物中,指出参与共轭体系的未共用电子对16.完成下列反应式17.某些取代吡啶的pKa如下:试用取代基对苯胺碱性的影响,解释上述结果。
18.试写出齐齐巴宾反应的反应过程。
19.比较下列各组化合物的碱性强弱:20.组胺(Histamine)分子中,哪个氮原子碱性最强?写出强弱顺序并说明理由。
21.判断下列化合物哪些具有芳香性?22.解释下列各现象:(1)①吡啶类化合物和H3O+反应时,表现出的碱性是2,6-二甲基吡啶>吡啶?②为什么吡啶的碱性比脂肪胺小得多?(2)溴代丁二酸二乙酯与吡啶作用生成不饱和的反丁二烯二酸二乙酯。
吡啶在此起什么作用?它比通常使用的请氧化钾乙醇溶液有什么优点?23.以吡啶为原料合成下列化合物:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
进一步脱水
糠醛
(C5H8O4)n + n H2O
戊多糖
3%~5% H2SO4 △,水解
n C5H10O5
戊糖
HO-CH—CH-OH H-CH CH-CHO 戊糖 OH OH
-3H2O
△
O
-CHO
糠醛
2. 性质及用途
糠醛是无色透明液体,沸点161.7℃,在空气中逐渐变 为黄棕色,能溶于醇、醚及其它有机溶剂中,糠醛本身是 一个良好的溶剂,在工业上有广泛的用途,常用于精炼石 油、精制松香、溶解硝酸纤维等,在有机合成工业上也很 重要,是油漆、树脂工业的重要原料。
一、 呋喃、吡咯、噻吩的结构与芳香性
物理方法证明:呋喃、吡咯、噻吩都是平面结构,环上所 有原子都是SP2 杂化,各原子均以SP2 杂化轨道重叠形成σ键。 碳原子未杂化的 P 轨道中有一个电子,杂原子的 P 轨道 中有一对电子,P 轨道互相平行重叠,形成闭合的共轭体系。
N H
· ·
五 中 心 六 电 子 ( 富 电 子 环 )
(CH3CO)2O + HONO2
酸酐
CH3COONO2 + CH3COOH
乙酰基硝酸酯 Ac2O 5℃
+ CH3COONO2 N H
+ CH3COONO2
N H 83%
Ac2O
-NO2 +
-NO2
N H 17%
O
+ CH3COONO2
-30 ℃~-5 ℃
O
-NO2
35%
Ac2O -10 ℃
S
S
-NO2 +
有 机 化 学
第十四章
杂环化合物
ORGANIC CHEMISTRY
学习内容
1.基本掌握杂环化合物的命名规则
2.掌握五元杂环化合物的物理和化学性质
3.掌握六元杂环化合物的物理和化学性质 4.了解部分稠杂环化合物和生物碱的性质
ORGANIC CHEMISTRY
在自然界中杂环化合物分布很广 如:使植物中成绿色的叶绿素
600 ℃ ~650℃
S
+ 3 H2S
+ SO2
高温
S
噻吩在硫酸的作用下发生蓝色的反应
呋喃和氨在高温下反应制得吡咯:
+ NH3 O
Al2O3 430 ℃
+ H2 O N H
吡咯的蒸气遇到盐酸浸湿的松木片呈红色,可 以用来检验吡咯及其低级同系物。 呋喃遇到盐酸浸湿的松木片呈绿色,称为松木 片反应。 噻吩在硫酸的作用下发生蓝色的反应。
N H
N H
噻吩比较稳定,既可以用硫酸在室温下直接磺化(产 率稍低),也可以用温和的磺化试剂磺化。
¨ H2SO4 Å
S
Ò Î Ê Â
S
SO3H
¨± £ ½ Ô Ú Ê Ò Î Â Ï Â » ² Ä Ü » Ç ¯ » ¡ £ £ ©
说明:① 噻吩环芳香性比呋喃环和吡咯环强,较稳定;
② 噻吩环上电子云密度比苯环大,更容易磺化。
O (3.5) > N (3.0) > S (2.5)
若电负性 , 则对外层电子吸引力 , 孤电子离域性
, 故芳香性
。
芳香性与稳定性: > S > >
N H
O
由于呋喃、噻吩、吡咯都是五中心六电子,属于富电子环
π电子密度: 反 应 活 性: 稳 芳 定 性: 香 性: 杂环 > 苯环 杂环 > 苯环 杂环 < 苯环 杂环 < 苯环
5 6 4
OH
8-羟基喹啉
4
N1 2-氨基嘧啶
N -NH 2 2
3
CH3-
N3
2
N1 CH3 4-甲基咪唑 N-甲基吡咯 或1-甲基吡咯 4 β 3 -CH2COOH 5
N
2
5
1
S1 5-甲基噻唑
5
6
3-吲哚乙酸
7
N1
2α
或β-吲哚乙酸
第二节 五元杂环化合物
典型的五元杂环是呋喃、吡咯、噻吩。它们是最重要的含 一个杂原子的五元环化合物。它们的衍生物不单种类繁多,而 且有些是重要的工业原料,有些具有重要的生理作用。 呋喃(Furan)是最简单的含氧五元杂环化合物。它存在
吡咯表面上 是个仲胺,但实 际上吡咯是一个 很弱的碱,碱性 比苯胺弱得多, 它只能慢慢地溶 解在冷的稀酸溶 液中。 氮上电子云 少,H 易离 解,显一定 的酸性。 酸性: pka: N H
CH3 I
N MgBr N CH3
.. N H -OH
氮上孤电子 对参与环内 共轭,减弱 了对H+吸引 能力。 > R-OH 18 + H 2O
> N 15 H
△
10 + KOH
NK + 吡咯钾盐
+
MgIBr
吡咯卤化镁
四、呋喃衍生物——糠醛(α- 呋喃甲醛)
O -CHO 糠醛是呋喃衍生物中最重要的一个, 最初从米糠制得而得名。
1. 制备
由米糠、甘蔗渣、高粱杆、玉米芯、花生壳等与 酸共热、蒸馏制取。
农业副产品 含戊多糖
打碎
稀H2SO4 △
水解为 戊糖
含两个杂原子:
N
N
N Pyrimidine
Pyridazine
哒嗪
嘧啶
√
吡嗪
N N Quinoline N Isoquinoline N
N N N
喹啉 稠杂环
√
N H Indole
异喹啉
√
N N N N H Purine
喋啶
吖啶
N H Carbazole
吲哚
√
嘌啉
√
咔唑
2.环上有取代基时,应以杂环为母体,将杂环母核编号 ① 杂原子编号最小(即从杂原子开始编号);
X
Y
H
H Y Y X X
H Y
正电荷分布在俩个原子上
β- 位
X
亲电试剂进攻发生在α- 位和β- 位,但α- 位更容易些。
① 卤代反应 像苯酚和苯胺一样,吡咯、呋喃、噻吩很容易发生卤 代反应。 氯代、溴代不但不需催化剂,而且为避免多取代物, 往往采用温和条件,如用溶剂稀释和采用低温。
吡咯反应活性最大,在低温下进行,一般得多卤产物。 Br-Br C2H5OH + Br2 Br-Br 0℃ N N H H 四溴吡咯
利用磺化反应可分离苯和噻吩:
(
ß bH2SO4 Ò Î Ê Â Ö Ò · º ô Á Õ ó
Þ à Î ç · Ô ± ½
S ß ( b.p84 C) .
S
SO3H ¨ ßß á ßß
④ 傅克酰基化反应 五元杂环化合物酰化时,需要在较温和催化剂甚至不 用催化剂即可反应。
吡咯不用催化剂可以直接酰化:
+ (CH3CO)2O
150 ℃~160 ℃
N N H H 2-乙酰基吡咯 呋喃与酸酐或酰氯在催化剂作用下发生酰基化反应。 + (CH3CO)2O
BF3
-COCH3 60%
O
(或CH3COCl)
H2PO4
或SnCl4
O 2-乙酰基呋喃
-COCH3 75%~92%
噻吩酰化反应要用磷酸或氯化锡作催化剂。
· ·· O · · ·
体系中π 电子数: 4+2=6
噻吩的分子结构
吡咯的结构:
共轭效应是给电子的。 诱导效应是吸电子的。
N
孤电子对在p轨道上。
吡
咯
结构:吡咯N是sp2杂化,孤电子对参与共轭。 反应:碱性较弱,环易发生亲电取代反应,环上相当于
有一个邻对位定位基。
呋喃、噻吩的结构请同学自己分析。
三种杂环具有一定程度的芳香性,杂原子电负性大小:
噻吩侵入途径为吸入、食入、经皮吸收,具有引起兴奋 和痉挛的作用,其蒸气刺激呼吸道粘膜,对造血系统亦有毒 性作用(刺激骨髓中白细胞的生命)。急救方法: 皮肤接触:脱去污染的衣服,立即用流动清水彻底冲洗。 眼睛接触:立即提起眼睑,立即用流动清水彻底冲洗。 吸入:迅速脱离现场至空气新鲜处。呼吸困难时给输氧, 呼吸停止时,立即进行人工呼吸,就医。 食入:误服者给饮大量温水,催吐,就医。
于松木焦油中,为无色液体,沸点为32℃,具有类似氯仿的
气味,难溶于水,易溶于有机溶剂,常用作溶剂。它有麻醉 和弱刺激作用,极度易燃。吸入后可引起头痛、头晕、恶心、 呼吸衰竭。呋喃具有毒性且致癌。呋喃环具有芳环性质,可 发生卤化、硝化、磺化等亲电取代反应,常作为合成其他复
杂有机物的起始原料。
吡咯(Pyrrole)是最简单的含氮五元杂环化合物,主要存 在于骨焦油中,煤焦油中存在的量很少。 健康危害:吡咯属低毒类,虽然急性口服毒性不强,但有 积蓄性毒性,注射于哺乳动物能使尿变色。对中枢神经系统有 抑制麻醉作用,吸入蒸气可致麻醉,并可引起体温持续增高。 吡咯在空气中加热能产生毒性强的气体,使用时需加注意。 燃爆危险:易燃,其蒸气与空气可形成爆炸性混合物,遇 明火、高热能引起燃烧爆炸。其蒸气比空气重,能在较低处扩 散到相当远的地方,遇火源会着火回燃。 噻吩(Thiophene)是最简单的含硫五元杂环化合物,存在于 煤焦油和页岩油中。无色流动性、有难闻的臭味的液体,熔点38.2℃,沸点84.2℃ ,易燃、有毒,经皮肤吸收或吸入蒸气会 引起中毒。其蒸气与空气形成爆炸性混合物,遇明火、高热能 引起燃烧爆炸。与氧化剂能发生强烈反应。其蒸气比空气重, 能在较低处扩散到相当远的地方,遇火源会着火回燃。
编号原则 ② 环上含两个以上相同杂原子时,应使杂原子的 编号最小(一般从连有取代基的杂原子开始); ③ 环上有不同杂原子时,按O、S、N的顺序编号; ④ 尽可能使连有取代基的碳原子编号最小。
4 5 6 β 3 -CH 5 4 3
