大学无机化学 第十二章 杂环化合物总结
杂环化学总结
三员杂环链状醚、硫醚、仲胺比饱和三元杂环的健角小,因此有较大的张力。
三元杂环的构象都是平面形。
氢原子的重叠也是它们产生张力的一个原因。
饱和三元杂环的杂原子都有孤电子对,容易受亲电试剂进攻。
环有偶极矩,亲电试剂和亲核试剂都容易与它们反应。
亲核开环反应亲核试剂,如氨或胺,可使环氧化物开环生成氨基醇:脱氧成烯烯烃的环氧化在Prileschajew反应中,常用的是过氧苯甲酸,间氯过氧苯甲酸或单过氧邻苯二甲酸。
Sharpless环氧化反应是用过氧叔丁醇,在四异丙氧基钛和(R,R)-(+)-或(S,S)-(-)-酒石酸二乙酯(DET)存在下,烯丙醇和取代烯丙醇与该试剂反应。
3.Darzens反应(缩水甘油酸酷合成法)在乙醇钠存在下,a-卤代酸酯与羰基化合物反应生成2一乙氧羰基环氧化合物,该类产物也称作缩水甘油酸酯。
Corey合成法该合成方法是由卤化三烷基锍盐或卤化三烷基亚砜盐衍生的S一叶立德与羰基化合物反应四员杂环1.β-氨基酸环化脱水制得【2+2】环加成反应(1)亚胺十烯酮.亲电取代反应呋喃发生亲电取代反应的速度要比苯快。
原因如下:①呋喃的共振能比苯低;②呋喃环上每个原子的电子密度大于1,而苯环上每个原子的 电子密度等于1。
1,4-二羰基化合物(Paal-Knorr反应)在酸碱平衡中,酸加到1,4-二羰基体系13中的一个羰基上,使第2个羰基能与其发生分子内亲核反应形成14;最后,在酸催化下,发生β-消除反应。
.Feist-Benary合成a-卤代羰基化合物和β-酮羧酸酯发生环缩合反应生成3-呋喃酸。
噻吩噻吩的芳香性小于苯大于呋喃,原因:①因为硫和氧相比有较低的电负性,硫上的电子对能更有效地共轭;②硫,作为第二短周期的元素,能够扩展其八隅体。
噻吩的亲电取代反应活性和苯甲醚相近。
反应机制与呋喃相同,取代反应发生在2-位或2,5-位。
光异构化反应最简单的方法是1,4-二碳基化合物硫化后再环化脱水,这和呋喃的Paal-Knorr合成类似。
《有机化学(第二版)》第12章:杂环化合物与生物碱
N
H O
H
19:46
3、化学性质
①碱性
19:46
碱性大小:脂肪族胺>氨>吡啶>苯胺
(CH3)3N > NH3
> N
> N
NH2
19:46
②亲电取代反应
发生在β位
19:46
若吡啶环上有第一类定位基时,能使吡啶环 活化,能使亲电取代反应较容易进行,并且取代 位置由第一类定位基决定。
Br2/ CH3COOH N
3-甲基吡唑
5-甲基吡唑
H3C N H
N
H3C N
H N
4-甲基咪唑
5-甲基咪唑
19:46
3、吡唑及其重要衍生物 吡唑为无色针状结晶,熔点70℃。它的一些衍生 物是常用的药物。例如:
H3C NaO3SCH2
N O N N
CH3 CH3
1-苯基-2,3-二甲基-4-(N-甲基-N-磺酸钠甲基)胺基-5-吡唑酮
H NH O H
19:46
2、化学性质
(1)酸碱性 碱性都很弱,吡咯具有弱酸性
N H
pKb 13.6
N H
3.7
19:46
(2)亲电取代反应 容易发生亲电取代反应 活性顺序为:吡咯>呋喃>噻吩>苯
①卤代反应
19:46
Br2 乙 醚 N H 0℃
Br Br
N H
Br Br
四溴吡咯
Br2 二氧 六 环 O 0℃
N CH2
罂粟碱
OMe OMe
1-[(3,4-二甲氧基)甲基]-6,7-二甲氧基异喹啉
19:46
2、嘌呤及衍生物
①嘌呤的结构
19:46
②物性与存在
第十二章 杂环化合物

N S O3
S O 3H
NO2
(二)喹啉和异喹啉
N
N
1. 物理性质: 喹啉为无色油状液体,有特殊气体, 沸点238 ℃。异喹啉为无色油状液体,沸点243℃, 熔点26.5℃。它们微溶于水,易溶于有机溶剂。
2. 化学性质:
N O2 浓 H NO3
N
浓 H2S O4
+
N
N O2
N
浓 H 2S O4
N
+
N
H Cl
+
Cl
N H
+
N
B F3
+
B F3
N
+
N
S O3
+
N S O3
+
N
C H 3I
I
+
N
CH3
(2)亲电取代反应 比苯难进行亲电取代反应,主要取代 -位 H。
Br2 Br
N
浓HNO
300℃
N
3
浓H
2 SO 4
N O2
N
浓H
300℃,24h
N
4
2 SO 4
HgSO
S O 3H
N
220℃
C O OH
N
H2
Ni
N
N H
五、稠杂环化合物
(一)吲哚
N H
1. 物理性质:吲哚为白色晶体,熔点52℃,沸点 235℃。加热至沸点时,有分解现象。吲哚可溶于 热水、乙醇及乙醚,有极臭的气味,吲哚能使浸有 盐酸的松木片显红色。
2. 化学性质
+
N H
+
Br2
0℃ N H
有机化学第十二章

N H
100℃
N
H
3.磺化+ H2SO4 H2SO 付4—克反应
N
发烟 220℃ N
SO 3H SO 3H
150~200℃ +(CH 3CO2O )
COCH 3
N H
N H
H2 Pt
HA c
N
01
N H
二、加成反应 H2 Pt
N H
180℃ 产物为仲胺, N H
Zn
HAc
N
N
H
H
02
不具有芳香性
01
烟酸
04
N
N
CH 3
烟碱(尼古丁)
二、嘧啶极其 衍生物
OH N
O HN
NH 2 N
HO N 尿嘧啶 U OH N
HO N 胸腺嘧啶T
ON H
HO N 胞嘧啶 C
O
CH 3
HN
CH 3
ON H
NH 2 N
ON H
4 5
一、吲6哚及其 衍生物 7
3
2
N1 H
吲哚
6 稠杂环化合 物
CH2COOH
N H
ቤተ መጻሕፍቲ ባይዱ三、氧化反应
CH 3
N
HNO 3
02
五元杂环是富电子的芳杂环,和氧 化剂作用,常导致
环的破裂或发生聚合作用得到焦油状 聚合物。
COOH
六元杂环是缺电子的芳杂环,一般对
氧 化N剂 相 当 稳 定 。
HN3O
COOH
回流
COOH
N
N
四、酸碱性
在吡咯分子中,由于氮上未共用的孤对电子 参与环上的共轭体系,使氮上电子云密度降 低而减弱对质子的吸引力,使得这个氢原子 能以质子的形式解离,所以吡咯表现出一定 的弱酸性(pKa=15)。
十二 杂环化合物
(二) 喹啉
N
重要的衍生物
OH CH3O N CH3 CH(CH2)3N(C2H5)2 N N HO O O O
扑疟喹啉
10-羟基喜树碱
1 喹啉的碱性
.
. . . . . . . . . .N
.
.
PKb
N 9.1
N 8.8
喹啉的碱性与吡啶相当
2 亲电取代
6
5 8
4
N
活化环 7
3 2
1
钝化环
有利于亲核取代生, 且主要发生在2位
CH2CHCOOH N H 色氨酸 OH HO O NH2 N H 色胺 O O CH OH OH S O 硫靛蓝 S CH2CH2NH2
(一) 吲哚
[试分析] 亲电取代发生在苯环还是杂环上?
3
..
并指出具体位置。
亲电取代主要发生在杂环3位
N H
N N C6H5 N H + C6H5N
+
N ClN H
综上所述:亲电取代主要发生在吡啶环的β位,、位 不发生反应。
Br2
300℃ HNO3, H 2SO4 300℃ H2SO4, HgSO4 220℃
Br N NO2 N S O3H N
N
吡啶环也象硝基苯一样,不能发生傅克烷基化和酰基化反应
3、 亲核取代反应
吡啶环容易发生亲核取代反应。 、位,以位为主。
C6H5Li
+ LiH N C6H5
N
CH3ONa
N
Cl
Cl CH3OH
N
OCH3
NH2
+ NH3 N N
+ HCl
4、 氧化
CH3
第12章 杂环化合物和生物碱

O
2p
2s ↓ ↑ ↓ ↑ ↑ ↑
sp 杂化 ↓ ↑ ↑ ↑
2
2p ↓ ↑
末杂化
呋 喃
O
能量
O:1s22s22p4
S 2p 2s ↓ ↑ 能量 ↓↑↑ ↑ sp 杂化 ↓ ↑ ↑↑
2
2p ↓ ↑
噻 吩
S
末杂化
S:1s22s22p63s23p4
N
2p 2s ↓ ↑ 能量 ↑ ↑ ↑
sp2 杂化 ↑ ↑ ↑
CONH2
CHO O
SO3H S
N 3-吡啶甲酰胺
2-呋喃甲醛
2-噻吩磺酸
二、杂环化合物的命名
OH SO3H
N
CH2COOH N H
5-羟基-3-喹啉磺酸
N N COOCH3
3-吲哚乙酸
2-嘧啶甲酸甲酯
二、杂环化合物的命名
(5)有些稠杂环有特定的编号。
6 5 7
1N
N
8
8 7
6 5
9
1
2
2
N
3
吡啶与无机酸反应生成盐,但产物遇 水即分解:
+ HCl
N
N
. HCl
三、氧化反应
吡啶比苯稳定,不易被氧化,一般 都是侧链被氧化,而杂环不被破坏, 结果生成吡啶甲酸。
CH3 N
KMnO4
COOH N
OHHNO3
COOH N COOH
N
△
四、取代反应
1.卤代反应
呋喃、噻吩和吡咯环中的杂原子上 的未共用电子对参与了环的共轭体 系,使环上的电子云密度增加,故 它们都比苯容易发生亲电取代反应, 取代通常发生在α位上。 亲电取代反应的活性:
杂环化合物总结
NO2
N
SO3H Br
Br2 H2SO4
+
N
N
Br
KNH2 NH3a, EtOH
N
H
S
S
Na, EtOH
+
S
S
Zn, HAc
N
H2, Ni
H
4. 吡咯的酸碱性
+
N
N
H2, Ni 200oC
N
H
H
H
RMgX
CH3I
N
RH
N
MgXI
N
H
MgX
CH3
KOH,
(1)CO2
(2)H2O
N COOH
N
CO2
K
H O
N H
C OK H3O
N COOH H
C6H5COCl
N O C C6H5
5. 鉴别 呋喃蒸汽遇到被盐酸浸湿过的松木片时,即呈现绿色
噻吩在浓硫酸的存在下,与靛红一同加热显示蓝色
吡咯的蒸汽或其醇溶液,能使进过浓盐酸的松木片变成红色
1. 碱性 (CH3)3N>吡啶>苯胺>吡咯
CH3
+ CH3I
N
280 290oC
+
NI CH3
N CH3 HI
N HI
2. 对氧化作用稳定,氧化侧链
CH2CH3 O
COOH
六
N
N
元 杂
3. 亲电取代,在位,不发生酰基化,烷基化反应
环
Br
化
Br2
合 物
N
N SO3H
H2SO4
N
N
NO2
H2SO4 HNO3 N
第十二章杂环化合物

第十七章杂环化合物基本内容和重点要求⏹杂环化合物的分类和命名;⏹杂环化合物的结构和芳香性;⏹五元杂环化合物的化学性质;⏹六元杂环化合物的化学性质;⏹生物碱重点要求掌握芳香性;五元、六元杂环化合物的化学性质,杂环化合物的亲电取代反应的活性及规律;酸碱性规律。
12.1 杂环化合物的分类和命名1、分类:杂环大体可分为:单杂环和稠杂环两类。
分子中含有由碳原子和其它原子共同组成的环的化合物称为杂环化合物。
杂环中的非碳原子称为杂原子,最常见的杂原子有N、O、S等。
象环醚、内酯、环酐及内酰胺等似乎也应属于杂环化合物。
但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质又与相应的脂肪族化合物类似,因此,一般不放在杂环化合物中讨论。
本章讨论的是环系比较稳定,并且在性质上具有一定芳香性的杂环化合物。
根据环数的多少分为单杂环和多杂环;单杂环又可根据成环原子数的多少分为五元杂环及六元杂环等;多杂环稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。
稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。
2、命名(1)用音译法是按外文名称的音译,并加口字旁,表示为环状化合物。
如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为α ,β, γ, δ …)来编号。
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小:(2)系统命名法:是把杂环看作杂原子转换了相应碳环中的碳原子,命名时以相应的碳环为母体,在碳环名称前加上杂原子的名称,称为“某(杂)某”。
如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘。
杂环母环的编号规则(1)含1个杂原子的杂环,从杂原子开始用阿拉伯数字或从靠近杂原子的碳原子开始用希腊字母编号。
(2)如有几个不同的杂原子时,则按O 、S 、-NH-、-N=的先后顺序编号,并使杂原子的编号尽可能小。
(3)有些稠杂环母环有特定的名称和编号原则。
第十二章 杂环化合物

0.1431 0.1361
0.1362 O 0.70D
0.1423 0.1370
0.1714 S 0.51D
芳香性:苯 > 噻吩 > 吡咯 > 呋喃
N H
1.58D
键长
0.1429
0.1371
0.1383 N H
1.81D
8
2、吡咯、呋喃、噻吩的化学性质 (1) 亲电取代反应(Electrophilic Substitution)
N S
浓H2SO4,SO3
N S
1,2-唑取代 在4-位
Br
N
Br2
N AcOH-H2O
H
N N H
N
O2N N
HNO3,H2SO4
N
N
H
H
O2N NH 咪唑环取代在4-位
N
N 发烟H2SO4
S
HgSO4, 250℃ HO3S
N
噻唑环取代以5-位为主
S
25
唑的烷基化或酰基化通常发生在氮原子上。
N CH3I S
碱性:
NH O pKa -2.03
H N O 1.3
H N S 2.4
NH N H 2.5
1,2-唑与1,3-唑的亲电取代反应的活性顺序有:
H N N H 7.0
1,2-唑 1,3-唑
N>
N H
N >
N H
N>
N
S
O
N
> S
N O
24
亲电取代反应
N HNO3,H2SO4 O
O2N N
O
HO3S
H2S
O
NH
3
H2O
H 2S
12杂环化合物

六元杂环:
N
吡啶 Pyridine
N N
N N
哒嗪
嘧啶
pyridazine pyrimidine
N
N
吡嗪 pyrazine
稠杂环:
O
苯并呋喃
S
苯并噻吩
N H
吲哚(苯并吡咯)
benzofuran thionaphthene indole
N
N
N NN
N H
O
S
NN
H
苯并咪唑 苯并 唑 苯并噻唑
•吡啶不能起傅-克反应
亲电取代 位取代
②亲核取代
• 与硝基苯相似:吡啶与强的亲核试剂起亲核取代反 应,主要生成取代产物(齐齐巴宾反应):
强的亲核试剂
亲核取代 取代产物
• 与2-硝基氯苯相似,2-氯吡啶与碱或氨等亲核试剂 作用,可生成相应的羟基吡啶或氨基吡啶:
(3)氧化与还原——吡啶比苯稳定,不易被氧化剂氧 化。吡啶的同系物被氧化时总是侧链先氧化而芳杂 环不破坏,生成相应的吡啶甲酸:
• 学名: -呋喃甲醛。制造糠醛树脂等。 1. 糠醛的制法(麦杆、花生壳、甘蔗渣等含多缩戊糖
的物质):
2. 性质和用途
• 糠醛在醋酸存在下与苯胺作用显红色—检验糠醛; • 糠醛可发生银镜反应; • 糠醛具有一般醛基的性质:
• 糠醛为没有-氢的醛,其性质与苯甲醛或甲醛相似: 坎尼扎罗反应(歧化反应)
• 吡啶用过氧羧酸氧化(或30%的H2O2和CH3COOH 作用)时,生成吡啶N-氧化物或称氧化吡啶:
• 吡啶经催化氢化或用乙醇和钠还原,可得六氢吡啶:
吡啶的衍生物
COOH N
O C NH2
N
烟 酰 胺 (维 生 素 pp)
第十二章杂环化合物

第⼗⼆章杂环化合物第⼗⼆章杂环化合物⼀、定义和分类分⼦中含有由碳原⼦和其它原⼦共同组成的环的化合物称为杂环化合物。
杂环中的⾮碳原⼦称为杂原⼦,最常见的杂原⼦有N 、O 、S 等。
象环醚、内酯、环酐及内酰胺等似乎也应属于杂环化合物。
但是,由于这些环状化合物容易开环形成脂肪族化合物,其性质⼜与相应的脂肪族化合物类似,因此,⼀般不放在杂环化合物中讨论。
本章讨论的是环系⽐较稳定,并且在性质上具有⼀定芳⾹性的杂环化合物。
根据环数的多少分为单杂环和多杂环;单杂环⼜可根据成环原⼦数的多少分为五元杂环及六元杂环等;多杂环稠杂环、桥杂环及螺杂环,其中以稠杂环较为常见。
⼆、命名杂环化合物的名称包括杂环母体及环上取代基两部分。
杂环母环的命名有⾳译法和系统命名法2种。
⾳译法:是⽤外⽂谐⾳汉字加“⼝”偏旁表⽰杂环母环的名称。
如呋喃等。
系统命名法:是把杂环看作杂原⼦转换了相应碳环中的碳原⼦,命名时以相应的碳环为母体,在碳环名称前加上杂原⼦的名称,称为“某(杂)某”。
如吡啶称为氮(杂)苯,喹啉称为1-氮(杂)萘。
杂环母环的编号规则(1)含1个杂原⼦的杂环,从杂原⼦开始⽤阿拉伯数字或从靠近杂原⼦的碳原⼦开始⽤希腊字母编号。
(2)如有⼏个不同的杂原⼦时,则按O 、S 、-NH-、-N=的先后顺序编号,并使杂原⼦的编号尽可能⼩。
(3)有些稠杂环母环有特定的名称和编号原则。
杂环的命名如下:2-硝基吡咯 4-甲基吡啶 2-甲基-5-苯基噻唑α-硝基吡咯γ-甲基吡啶3-甲基-8-羟基喹啉 1-甲基-7-氯异喹啉 1-甲基-2-巯基咪唑 2-呋喃甲醛(糠醛) 2-噻吩磺酸 3-吡啶甲酰胺α-呋喃甲醛α-噻吩磺酸β-吡啶甲酰胺N H NO 2N CH 3N S C 6H 5CH 3N CH 3CH 3N Cl N CH 3N SH O CHO S SO 3H N CONH 2三、五元杂环化合物(⼀)吡咯、呋喃和噻吩1、结构与芳⾹性吡咯环的4个碳原⼦和1个氮原⼦都以SP 2杂化轨道成键。
杂环化合物的分类和命名
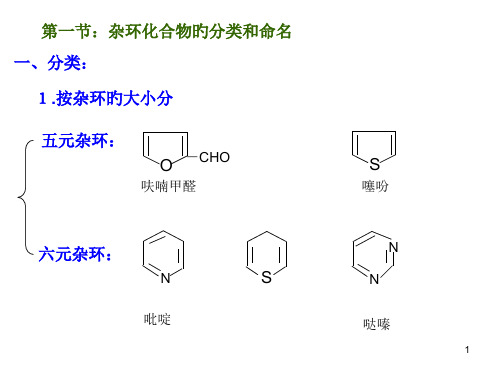
1.按杂环旳大小分
五元杂环:
O -CHO
呋喃甲醛
六元杂环:
N
S
吡啶
S
噻吩
N N
哒嗪
1
2.按杂原子旳不同分 氧杂环: O
呋喃
硫杂环:
S 噻吩
氮杂环:
N 吡咯
O -COOH H3C- O -CH3
呋喃甲酸
α,α‘-二甲基呋喃
N
吡啶
2
3.按分子内所含环旳数目分:
②吡啶同系物氧化时总是侧链先氧化而芳杂环不破 坏
-CH3 KMnO4,OH-
N
△
-COOH N
还原:
H2,Pt
或C2H5OH+Na N
N
28
二、喹啉和异喹啉:
存在:存在于煤焦油或骨焦油中
1.制备——斯克洛浦合成法:
- -
- - - - -
CH2-CH-CH2 OH OH OH
浓H2SO4 -3H2O
10
1.制备
⑴工业制法:将糠醛和H2O气,经过加热至400~415℃旳催化剂 (ZnO-Cr2O3-MnO2)脱羰基
+
O -CHO
H2O
400~415℃ 催化剂
O
+ CO2 + H2
⑵试验室制法:糠酸在Cu催化下,在喹啉介质中,加热脱酸
O -COOH
Cu,喹啉 △
+ CO2
O
返回11
2.呋喃旳化学性质: ⑴亲电取代
--- -- -
HH HO-C C-OH
H-C-H C-H OH OH CHO
O -CHO
返回14
《有机化学》第十二章 杂环化合物

第十二章杂环化合物杂环化合物指分子结构中含有除碳原子外,其他原子共同组成的环状化合物。
杂环中除碳原子外的其他原子称为杂原子,常见的杂原子有N、O、S等。
杂环化合物广泛存在于自然界中,数量庞大,大多具有一定的生理活性,是许多生物体的重要组成部分。
如植物体中的叶绿素、动物体中的血红素、核苷酸中的碱基等都含有杂环化合物。
杂环化合物对生物体的生长、发育、繁殖和衰亡等过程都起着非常重要的作用。
杂环化合物的应用范围非常广泛,在生物材料、分子器件、医药、染料及农药等领域均十分常见。
杂环一般包括脂环和芳环,其中,脂环易开环,其性质与开链化合物类似,因此,一般不把它们放在杂环化合物中讨论,本章主要讨论的是性质稳定也具有一定芳香性的杂环化合物。
一、杂环化合物的分类根据杂环母环的结构中所含环的数目,可将杂环化合物分为单杂环和稠杂环化合物两大类。
最常见的单杂环化合物中,根据原子的数目不同,可分为五元环和六元环。
根据杂原子的种类和数目,可分为1个、2个或以上杂原子的杂环化合物。
另外,稠杂环按稠合环的形式分为苯杂环化合物和杂环稠环杂环化合物。
常见杂环化合物的结构和名称见表12-1。
表12-1 一些常见杂环化合物的母环和分类二、杂环化合物的命名杂环化合物的命名比较复杂,目前在我国主要有两种方法:一种是音译法;另一种是系统命名法。
在命名时,杂环化合物的名称包括杂环母核及环上的取代基,其中,对杂环母核的命名一般采用音译法,对取代基的命名与前述章节基本一致。
音译法是按照1979年规定的IUPAC 命名原则所推荐的通用名,按外文发音来汉化命名,名称带“口”字旁。
例如:吡啶(pyridine )吲哚 (indole )N N HO S 呋喃(furan )噻吩(thiophene )当杂环上有取代基时,以杂环为母体,需先将杂环母环编号,以注明取代基的位次。
编号一般从杂原子开始,若含有2个或2个以上相同杂原子构成单杂环进行编号时,从连接有氢原子的杂原子开始编号,例如:4-甲基嘧啶2345O N N 16 25 341H 3C H 3C 4,5-二甲基呋喃CH 3当只有1个杂原子时,从杂原子开始用阿拉伯数字编号,也可用希腊字母编号,以靠近杂原子的第一个的碳原子为α-位,其次用β、γ等编号。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
O
O O
(环氧乙烷) (β-丙内酯)
H N
O NH
(氮杂环丙烷) (β-丙内酰胺)
(顺丁烯二酸酐) (氧杂桌)
N H
(1H-氮杂桌)
多杂原子环 或多杂环
O N H N
1-氧-4-氮杂环己烷
奎宁环
1.2 芳香杂环化合物的分类
杂化化合物特指: 环状化合物具有芳香结构(闭合共轭体系),一定程度的 稳定性。
吡 咯 N( 孤 电 子 对参与共轭,所 以碱性较弱)
N O
<
N S
N
N H 吡咯N(孤电子对参与 共轭,所以碱性较弱)
<
1,2-唑与1,3-唑都有未成键孤电子对,所以都有碱性。
2 唑类杂化的反应--亲电取代反应
唑的反应性比呋喃、噻吩、吡咯差,这是因为分子中多了一个 吡啶N,使共轭体系的电子云密度降低,所以亲电反应活性降低。
CH3
4
3 O 2 1
Br Br
2-甲基-5-硝基-1-(2’-羟 乙基)吡咯
5
2,3-二溴呋喃
(2) 五元杂环苯并体系
4 5 6 7 O 1 3 2
5 6 7 S 1 4 3 2
5 6 7 N H1 4 3 2
苯并呋喃 (benzofuran)
苯并噻吩 (benzothiophene)
苯并吡咯 吲哚 (indole)
磺化须强烈条件下进行反应
HO3S S
N S
S O3 + 浓 H2S O4
N
S
发烟 H 2S O4 , HgS O 4
N
N
(90 %)
250℃
HO3S
(65 %) S
硝化、卤化须有给电子取代基
H3C S H3C CH3
Br2 C HC 3 l,
N
N S CH3 (63 %)
Br
第四节 六元杂环化合物
农业副产品 含戊多糖
打碎
稀H2SO4(Δ)
水解为 戊糖
脱水
糠醛
(C5H8O4)n + n H2O
戊多糖
3%~5% H2SO4 △,水解
n C5H10O5
戊糖
HO-CH—CH-OH
H-CH CH-CHO OH OH
-3H2O
△
-CHO O 糠醛
戊糖
3.2 性质及用途
糠醛是无色透明液体,在空气中逐渐变为黄棕色。能溶作为 一个良好的溶剂。在有机工业是油漆、树脂和多种精细化工产品 的重要原料。 糠醛与苯甲醛具有类似结构,表现出无α-H的醛的性质。
+ SO3 N
C H2C l2 室温
N SO3
100 oC
HCl N H SO3- N H N H SO3HN H源自+N SO3
噻吩比较稳定,既可以直接磺化(产率稍低),也可 以用温和的磺化试剂磺化。
(4) 呋喃、噻吩、吡咯的卤化反应 反应强烈,易得多卤取代物。为了得一卤代 (Cl, Br)产 物,要采用低温、溶剂稀释等温和条件。
Furan
呋喃
吡咯
噻吩
1 呋喃、吡咯和噻吩的结构
1.1 电子结构和芳香性
O
S
N H
(1)单杂原子五元杂环结构和电子云特点:
A:构成环的原子都是sp2杂化,五个原子在同一平面内。 B:每个碳原子的 p轨道有一个电子,杂原子的 p轨道有二个电子。 这五个p轨道都垂直于分子所在平面,侧面相互交盖,形成(4n+2) π电子共轭体系。
>
吡咯最容易发生亲电取代反应,噻吩最困难。 五元杂环进行亲电取代反应绝大多数都在 α-位上。
(2) 呋喃、噻吩、吡咯的硝化反应
呋喃、 噻吩和吡咯易氧化, 一般不用硝酸直接硝化; 通常用比较温和的非质子硝化试剂,如:硝酸乙酰酐在低温 下进行反应。
O O CH3COCCH3 + HNO3
AcONO2 O oC
(2)单杂原子五元杂环的芳香性
A:符合Hü ckel规则,具有芳香性。 B:共轭体系是 π56 结构,芳环结构电子云密度较大,亲电 反应活性强。 C: 杂原子电负性比C大,周围电子云密度较大。环上电子 云分布不均,芳香性不如苯。 O电负性最大,呋喃上电子云最 不均匀,芳香性最差 。
D:芳香性
O
<
N H
N H
Cl
(80 %)
(5) 呋喃、噻吩、吡咯的傅-克酰基化反应
呋喃、噻吩的酰化反应在-C上发生,而吡咯的酰化反应 (不用催化剂)既能在 -C上发生,又能在N上发生。在 -C上 发生比在N上发生容易。
+ Ac 2O
150 - 200 ℃
O N H
O Ph C C l
N H
CCH3
(60 %)
O CH3CONO2 + CH3COOH NO2
S
Ac2O/AcOH
S 60 %
NO2 + S 10 % NO NO2 + N H 13 %
2
AcONO2 O oC
N H
Ac2O/AcOH
N H 51 %
(3) 呋喃、噻吩、吡咯的磺化反应
吡咯、呋喃不太稳定,所以须用温和的磺化试剂磺化。常用 的温和的非质子的磺化试剂有:吡啶与三氧化硫的加合化合物。
4 5 6
HO
3 2
HO
7
S 1
3-甲氧基苯并呋喃
5,6-二羟基苯并噻吩
2.2 单杂原子的六元杂环化合物的命名
(1) 单原子六元杂环
γ 4 5 6 N 1 3β 2α 5 6 O 1 γ 4 3β 2α
5 6 O 1 O 4 3 2
5 6 O 1 4 3 2 O
吡啶(pyridine)
吡喃(pyran)
Na
N H
或 NaOH(浓)
N Na+
N COPh
(70 %)
O
+ Ac2O
BF3 O
O CCH3 (75%-92 %)
O
Ac2O 与 Al C 3 l的 混 合 体 系
S
S
CCH3
3 重要化工原料--糠醛(α- 呋喃甲醛)
CHO
最初从米糠制得而得名。
3.1 制备:
O
由米糠、甘蔗渣、高粱杆、玉米芯、花生壳等与酸共热、蒸馏制取。
苯并吡喃(benzopyran)
2.3 含有多个杂原子的杂环化合物 (1)含有两个杂原子的 五元杂环
4 5
3 N2 O 1
5
4
N3 O1 2
异噁唑(isoxazole)
1,2- 两 个 杂 原 子的五元杂环
噁唑(oxazole)
1,3-两个杂原 子的 五元杂环
含有两个杂原子的五元杂环,若至少有一个杂原子是
4 5 6 N 1 N3 2
5 6
4 N N 1
3 2
哒嗪(pyridazine) (2)其他杂环结构
6 1N 2 7 5 N 8 N 4 N 9 H 3
嘧啶(pyrimidine)
吡嗪(pyrazine)
嘌呤(purine)
喋啶
第二节 含有一个杂原子的五元杂环体系
O
N H
Pyrrole
S
Thiophene
当两个杂原子不相同时,编号的次序是:价数小的在前, 大的在后。
2.1 五元杂环化合物的命名 (1)单杂原子五元杂环命名
4 5
O 1
3β 2α
4 5
S 1
3β 2α
4 5 1N H
3β 2α
呋喃(furan)
噻吩(thiophene)
吡咯(pyrrole)
只含一个杂原子的杂环,可把靠近杂原子的位臵叫做α位, 其次为β位。
单环 含一个杂原子
O
N H
Pyrrole
S
Thiophene
Furan
五元环
呋喃
N O
Oxazole
吡咯
N N H
lmidazole
噻吩
N S
Thiazole
噁唑
咪唑
噻唑
含两个杂原子
O N N H N S N
Isoxazole
Pyrazole
Isothiazole
异 噁唑
吡唑
异噻唑
含一个杂原子:
N Pyridine
本章主要讨论芳香杂环化合物。
2 杂环化合物的命名
命名总体原则 : 母体杂环名称:音译名 ,同音汉字加“ 口”字旁。
O
N H
Pyrrole
S
Thiophene
Furan
呋喃
环上原子的编号顺序
吡咯
噻吩
① 无论取代基如何,都从杂原子开始 1,2,3,4……
② 不止一个杂原子,按O,S,N顺序编号 ③ 取代基位次之和最小原则
Cl Cl + Cl Cl2 -40℃ O
O
Br2, 0℃
O
O
Br2 AcO H
O 稀释
O
Br
(86 %)
S
Br
(78 %)
S
I2, HgO C6H6, 0℃
S
I
碘不活泼,要用催化剂 才能发生一元取代
Br Br
Br Br
Br2, 0℃ EtO H SOCl2 (1 mol)
N H
N H
Et2O, 0℃
咪唑(inidazole)
命名时的编号原则是: 1)让杂原子的位号尽可能小; 2)当两个杂原子不相同时,编号的次序是:价数小的在前,大的 在后; 3)价数相等时,原子序数小的在前,大的在后。
O、S、N的 次序如左:
O
