第7章 蛋白质的分离、纯化和表征
第七章蛋白质的分离纯化与表征

第七章 蛋白质的分离、纯化和表征
二、蛋白质分子的大小与形状
(三) 蛋白质的扩散和扩散系数 平移扩散:由于浓度差引起的溶质分子的净迁移称为平移扩散 扩散系数:当浓度梯度为一个单位时,在一秒钟内通过1cm2面积 所扩散的溶质的量。
蛋白质的扩散系数与分子大小和形状及溶剂的粘度有关。
扩散过程受到蛋白质分子与溶剂间的内磨擦阻力所反抗,这种阻 力大小不仅取决于蛋白质分子的质量,并且还强力地取决于它的 颗粒形状。
2020/3/1
2020/3/1
第七章 蛋白质的分离、纯化和表征
•分离蛋白质的目的 许多蛋白质的研究与应用都要获得 纯蛋白质。如研究蛋白质的分子结构、组成和某些物理 化学性质,需要纯的、均一的甚至是结晶的蛋白质样品 。 •分离和纯化蛋白质方法的原理 根据蛋白质的之间的各 种特性的差异,包括分子的大小和形状、酸碱性质、溶 解度、吸附性质和对配体分子的特异生物学亲和力进行 分离。
2020/3/1
第七章 蛋白质的分离、纯化和表征
五、蛋白质的分离纯化方法
(四) 利用选择性吸附的纯化方法 1.羟磷灰石层析 2.疏水作用层析(苯基琼脂糖、辛基琼脂糖) (五) 利用对配体的特异生物学亲和的纯化方法 (六)高效液相层析和快速蛋白质液相层析
六、蛋白质的含量测定与纯度鉴定
(一) 蛋白质含量测定 凯氏定氮法、双缩脲法、Folin-酚试剂法、紫外吸收法、染料结合法 (Bradford)、胶体金测定法等。 (二)蛋白质纯度鉴定 电泳、沉降、HPLC、SDS-PAGE等。
二、蛋白质分子的大小与形状
(一) 根据化学组成测定最低相对分子质量
•如果已知蛋白质分子中含某种微量元素,并已知其含量,则可测 定此微量元素的含量,计算出最低相对分子质量。
new 第7章 蛋白质的分离纯化和表征

第 7 章 蛋 白 质 的 分 离、 纯 化 和 表 征
分子筛层析
YOUR SITE HERE
第 7 章 蛋 白 质 的 分 离、 纯 化 和 表 征
按照分子量大 小分离开
YOUR SITE HERE
(三 )
第 7 章 蛋 白 质 的 分 离、 纯 化 和 表 征
盐析和有机溶剂沉淀 盐溶:中性盐低浓度时,可以增加蛋
双缩脲
Cu2+ CuSO4
(硷性溶液)
红紫色络合物
YOUR SITE HERE
第 7 章 蛋 白 质 的 分 离、 纯 化 和 表 征
Folin-酚试剂法
Lorry法的显色原理与双缩脲方法是相同的,只是加入了第 二种试剂,即Folin—酚试剂,以增加显色量,从而提高了 检测蛋白质的灵敏度。 在碱性条件下,蛋白质中的肽键与铜结合生成复合物。 Folin—酚试剂中的磷钼酸盐—磷钨酸盐被蛋白质中的酪氨 酸和苯丙氨酸残基还原,产生深兰色(钼兰和钨兰的混合 物)。在一定的条件下,兰色深度与蛋白的量成正比。
YOUR SITE HERE
4. 蛋白质变性与复性
第 7 章 蛋 白 质 的 分 离、 纯 化 和 表 征
5. 蛋白质的紫外吸收光谱
蛋白质在远紫外光 区 ( 200-230nm ) 有 较 大的吸收,在 280nm 有
一特征吸收峰,可利用
这一特性对蛋白质进行 定性定量鉴定。
测定范围:0.1~0.5mg/ml
结构 高级结 构破坏
功能 生理功 能丧失
YOUR SITE HERE
第 7 复性(renaturation) 章 蛋 变性的可逆性 白 可逆变性:除去变性因素,蛋白质空间结构可以恢复原状。 不可逆变性:除去变性因素,蛋白质空间结构不能恢复原状。 质 的 蛋白质的变性作用如果不过于剧烈, 分 则是一种可逆过程 离、 纯 化 胃蛋白酶加热至80℃-90℃时,变性、无消化蛋白质的 能力,失去溶解性。如将温度下降到37℃,就复性,又 和 恢复溶解性和消化蛋白质的能力。但如变性时间加长, 表 条件加剧,变性程度加深,就成为不可逆变性。 征
第七章蛋白质的分离

第七章蛋白质的分离、纯化与表征一、是非题1 一个蛋白质样品,在某一条件下用电泳检查,显示一条带。
因此说明,该样品是纯的()2 逆流分溶和纸层析,这两个分离氨基酸的方法是基于同一原理()3 蛋白质的SDS聚丙稀酰胺凝胶电泳和圆盘电泳是两种完全不同的技术()4 凝胶过滤法可用于测定蛋白质的分子量,分子量小的蛋白质先流出柱,分子量大的后流出柱()5 蛋白质在小于等电点的PH溶液中,向阳极移动,而在大于等电点的PH溶液中,将向阴极移动()6 电泳和等电聚焦都是根据蛋白质的电荷不同,即酸碱性质不同的两种分离蛋白质混合物的方法()二、填空题1 现欲分离某蛋白质溶液中的四个蛋白质成分,它们分子量和等电点列于表内蛋白质成分Mr pIA 12000 10B 62000 4C 28000 7D 9000 5如不考虑次要因素,它们在葡聚糖凝胶G-75柱上分离时,流出的先后次序将是:最先,,其次,最后流出的蛋白质是如选用羧甲基纤维素柱分离上面四种蛋白质,并用盐浓度梯度洗脱,流出的先后次序将是:、、、2 分离蛋白质混合物的各种方法主要根据蛋白质在溶液中的下列性质,,,3 蛋白质时两性电介质,当溶液的PH在其等电点以上时蛋白质分子带电荷,而PH在等电点一下时,带电荷三、选择题1.下列哪种方法可得到蛋白质的“指纹”图谱?A.酸水解,然后凝胶过滤B.彻底碱水解并用离子交换层析测定氨基酸的组成C.用氨肽酶降解并测定被释放的氨基酸的组成D.用胰蛋白酶降解,然后进行纸层析和纸电泳E.用2,4-二硝基氟苯处理蛋白质2.若用电泳分离Gly-Lys、Asp-Val和Ala-His三种二肽,在下列哪个pH条件下电泳最为合适?A.pH2以下B.pH2~4C.pH7~9D.pH10~12E.pH12以上3.进行疏水吸附层析时,以下哪种条件比较合理A.在有机溶剂存在时上柱,低盐溶液洗脱B.在有机溶剂存在时上柱,高盐溶液洗脱C.低盐条件下上柱,高盐溶液洗脱D.高盐溶液上柱,按低盐,水和有机溶剂顺序洗脱。
蛋白质的分离纯化方法一

楚雄师范学院化学与生命科学系
范树国
2.聚丙烯酰胺凝胶电泳(PAGE)
3.毛细管电泳
楚雄师范学院化学与生命科学系
范树国
4.等电聚焦电泳
等电聚焦电泳法测定蛋白质pI
5.SDS-PAGE
6.离子交换层析
离子交换纤维素: 离子交换交联葡聚糖:兼有分子筛效应 离子交换交联琼脂糖:
楚雄师范学院化学与生命科学系
楚雄师范学院化学与生命科学系
范树国
普通电泳、等电聚焦、 双向电泳、脉冲电泳、 毛细管电泳 从电泳结果分:自由界 面电泳、区带电泳、盘 状电泳 从装置上分: 圆盘电 泳(柱状)、水平板电 泳、垂直板电泳。 从支持物分: 自由界 面电泳、纸电泳(或薄 膜电泳)、凝胶电 泳( PAGE ,琼脂糖胶, 淀粉胶等)
沉降的速度与颗粒的重量、密度和形状有关。离心后按其沉降 的速度不同,彼此分开形成区带。再进行光学定位,针刺或冰 冻切片采样分析。
蔗糖密度梯度
聚蔗糖密度梯度
楚雄师范学院化学与生命科学系
范树国
3.凝胶过滤
交联葡聚糖(Sephadex);聚丙烯酰胺凝胶(Bio-Gel P );琼脂糖凝胶(Sepharose,Bio-Gel A)
稳定蛋白质胶体溶液的主要因素 ①蛋白质表面极性基团形成的水化膜将蛋白质颗粒彼此隔开, 不会互相碰撞凝聚而沉淀。 ②两性电解质非等电状态时,带同种电荷,互相排斥不致聚集 而沉淀。
一旦电荷被中和或水化膜被破坏,蛋白质颗粒聚集,便从溶液 中析出沉淀。
楚雄师范学院化学与生命科学系
范树国
(二)蛋白质的沉淀
①盐析法 向蛋白质溶液中加入大量的中性盐[(NH4)2SO4、 Na2SO4、NaCl],使蛋白质脱去水化层而聚集沉淀。 ②有机溶剂沉淀法 破坏水化膜,降低介电常数。 ③重金属盐沉淀 pH大于等电点时,蛋白质带负电荷,可与 重金属离子(Hg2+. Pb2+. Cu2+ 等)结成不溶性沉淀 ④生物碱试剂和某些酸类沉淀法 pH小于等电点时,蛋白质 带正电荷,易与生物碱试剂和酸类的负离子生成不溶性沉淀。 生物碱试剂:是指能引起生物碱沉淀的一类试剂,单宁酸、 苦味酸、钨酸。酸 类:三氯乙酸、磺基水杨酸。 ⑤加热变性沉淀 往往是不可逆的。
生物化学 第7章 蛋白质理化性质及其分离纯化

蛋白质的沉淀可分为
不变性沉淀∶用于分离活性的天然蛋白质产品。 如:酶、抗体等。
变性沉淀∶用于生物制品中除去蛋白质。
变性后的蛋白质由于 疏水基团的暴露而易 于沉淀,但沉淀的蛋 白质不一定都是变性 后的蛋白质。
变性不一定沉淀,沉淀也不一定变性
使蛋白质沉淀的方法
1. 等电点沉淀 2. 盐析 3. 有机溶剂沉淀 4. 重金属盐沉淀 5. 生物碱试剂沉淀 6. 热变性沉淀
去除尿素 β-巯基乙醇
有活性
无活性
/biochemistry/gif/1.jpg
P300
四、蛋白质的沉淀
当破坏了维持蛋白质胶体稳定的水化膜和表面
电荷,蛋白质胶体失去稳定性,从溶液中析出,这 种现象称为蛋白质的沉淀(precipitation)。
应用:
(1)蛋白质分离纯化 (2)解毒 (3)临床检验 (4)低温贮存
根据蛋白质电离性质,可利用电泳的实 验方法,将蛋白质进行分离、纯化和鉴 定。
电泳(electrophosesis) 带电粒子在电场中向电性相反的电
极移动的现象。
蛋白质在等电点pH条件下,不发生电泳 现象。
电泳(electrophosesis)
二、蛋白质的胶体性质
真溶液的溶质分子的颗粒大小<1nm; 胶体溶液中溶质分子的颗粒大小在1-100nm; 蛋白质分子的相对分子量在1-100万,其颗粒大
盐析(NH4)2SO4
盐析
向蛋白质溶液中加入大量硫酸铵后蛋白质会 沉淀析出
蛋白质分子表面的疏水区域,聚集了许多水分子,高 盐浓度使水化层被破坏,暴露出的疏水区域,它们发 生相互作用而沉淀
蛋白质是两性电解质。在溶液中的带 电状况主要取决于溶液的pH值。
生物化学课件 第7章 - 蛋白质分离纯化和表征(9-21)

思考题 2012年厦门大学生物化学
5. 一多肽有侧链羧基30个(pk1=4.3),咪唑基15个(pk2 =
6.0) ,氨基10个(pk3=10)。两端羧基,氨基的pk分别为
COOH = 3.5 和 NH3+ = 9.5。求该蛋白的PI值
+26
分析:
pk1=4.3
30 × COOH
+25
NH3+ pk1=9.5
当一种氨基酸的净电荷用q=pI-pH表达时,若q为正值,则 该氨基酸带正电荷;若q为负值,则该氨基酸带负电荷。
q值的正与负和该氨基酸所带电荷的种类是一致的。如 果采用q=pH-pI来表达,则会出现相反的结果,即q为负值时, 氨基酸带正电荷;q为正值时,氨基酸带负电荷。因此,用 pI-pH更好。
思考题
第7章 蛋白质的分离纯化和表征
一、蛋白质的理化性质 P291
(一)蛋白质的酸碱电离
蛋白质分子除两端的氨基和羧基可解离外,氨基酸残基 侧链中某些基团,在一定的溶液pH条件下都可解离成带 负电荷或正电荷的基团。
当蛋白质溶液处于某一pH时,蛋白质解离成正、负离子 的趋势相等,即成为兼性离子,净电荷为零,此时溶液的 pH称为蛋白质的等电点。在等电点时蛋白质的溶解度最小, 在电场中不移动。
试剂的酸根离子结合而产生沉淀。
生物碱试剂和某些酸类沉淀
实例分析
实例分析:在啤酒生产工艺中有麦芽汁加啤酒 花煮沸的工序,其目的之一就是借酒花中的单 宁类物质怀变性蛋白质或盐形成沉淀,使麦芽 汁得以澄清,从而防止成品啤酒产生蛋白质混 浊。
“ 柿石症”的产生就是由于空腹吃了大量的 柿子,柿子中含有大量的单宁酸,使肠胃中的 蛋白质凝固变性而成为不能被消化的“柿石”
第七章_蛋白质分分离纯化和表征09

(三)根据电荷不同的纯化方法
电泳 :在外电场的作用下,带电颗粒向着与其电性相反的 电极移动,这种现象称为电泳。 原则上按电泳的原理来分,可分为: 自由界面电泳 区带电泳 滤纸电泳和薄膜电泳(醋酸纤维素薄膜、聚酰胺薄膜) 粉末电泳(淀粉、纤维素粉、硅胶粉,粉末与适当溶剂调 和,铺板) 细丝电泳,如尼龙丝和其它人造丝电泳,这是一类微量电 泳 凝胶电泳,最常用的支持介质是聚丙烯酰胺凝胶和琼脂糖 凝胶
几种蛋白质等电点
二、蛋白质的分子大小与分子量的测定
蛋白质的分子量的范围:
6×103~1×106 Da
测定蛋白质相对分子量的原理和方法
(一)根据化学组成测定最低相对分子量 用化学分析方法测出蛋白质中某一微量元素的 含量。并假设蛋白质分子中含有一个被测元素的原 子,则可由此计算出蛋白质的最低分子量。 例:肌红蛋白和血红蛋白含铁量均为0.335%, 计算二者的相对分子质量。
溶剂的密度(g/cm3)
(四)凝胶过滤法测定Mr
凝胶过滤(层析)可按照蛋白质分子量大小进行分离 的技术,同时可以测定蛋白质分子量。 蛋白质通过凝胶柱的速度即洗脱体积与其分子量有关: 先测得几种标准蛋白质的 Ve (Ve为洗脱体积) ,并 以其分子量对数对Ve作图得 一直线,再测出待测样品的 Ve,查标准曲线即可确定分 子量,并以其分子量对数对 Ve作图得一直线,再测出待 测样品的Ve,查标准曲线即 可确定分子量。
① 盐析法(salting out) : 中性盐(NH4SO4,NaSO4,NaCl等)→ 蛋白质脱去水 化层。 优点:不引起蛋白质变性。
盐溶(salting in):稀盐溶液中蛋白质溶解度增 加的现象。
② 有机溶剂沉淀法: 极性有机溶剂(甲醇,乙醇,丙酮)→脱去水化层以及 降低介电常数 而增加带电质点间的相互作用。 条件:低温操作,缩短时间。
第七章蛋白质的分离纯化和表征

第二节 蛋白质的分子大小与形状 (略)
第三节
蛋白质的胶体性质与沉淀、变性
一、蛋白质的胶体性质
由于蛋白质分子量很大,在水溶液中形成1100nm的颗粒,因而具有胶体溶液的特征。可溶性
蛋白质分子表面分布着大量极性氨基酸残基,对水
有很高的亲和性,通过水合作用在蛋白质颗粒外面 形成一层水化层,同时这些颗粒带有电荷,因而蛋 白质溶液是相当稳定的亲水胶体。
2、引起蛋白质变性的因素有:
①.物理因素 热(60~100℃)、紫外线、X射线、超声波、 高压、表面张力,以及剧烈的振荡、研磨、搅拌 等;
②.化学因素
化学因素又称为变性剂,包括:酸、碱、有 机溶剂(如乙醇、丙酮等)、尿素、盐酸胍、重 金属盐、三氯醋酸、苦味酸、磷钨酸以及去污剂 等。
3、变性表现及变性机理
pI是蛋白质的一个特征常数。
蛋白质两性解离性质和等电点
Pr
NH3
+
+ +
OHH+
Pr
NH3 COO-
+
+ OH+ H+
Pr
NH2 COO-
COOH
pH< pI
净电荷为正
pH = pI
净电荷=0
pH > pI
净电荷为负
当蛋白质溶液在某一定pH值时,使某特定蛋白质分子上所带正负
电荷相等,成为两性离子,在电场中既不向阳极也不向阴极移动,此
去除上述变性剂 可使蛋白质回复 原态而恢复活性 是为复性
并非所有蛋白质 均可顺利复性 恢复原来活性
5、变性的利用和预防
在医疗上,高温高压蒸煮手术器械,紫外线照 射手术室,75%酒精消毒手术部位的皮肤,使病菌、 病毒的蛋白质发生变性,失去致病作用,达到消毒 杀菌,防止伤口被感染的目的。
第七章 蛋白质的分离、纯化和表征.

第七章蛋白质的分离、纯化和表征7.1 本章主要内容1)蛋白质的酸碱性质2)蛋白质分子的大小和形状3)蛋白质的胶体性质与蛋白质的沉淀4)蛋白质分离纯化方法7.2 教学目的和要求:通过本章学习,使学生掌握蛋白质的物理化学性质,在此基础上对现实生活中的现象给出合理的解释,同时为后续知识的学习打下基础。
7.3 重点难点1.蛋白质分离纯化方法2.蛋白质物理化学性质及应用7.4 教学方法与手段讲授与交流互动相结合,采用多媒体教学。
7.5 授课内容一、蛋白质的酸碱性质蛋白质也是一类两性电解质,能和酸、碱发生作用。
在蛋白质分子中,可解离基团主要是侧链基团,及少数N端-NH2和C端-COOH。
天然球状蛋白质的可解离基团大部分可被滴定,而某些天然蛋白质中有一部分可解离基因由于埋藏在分子内部或参与氢键形成而不能解离。
1.等电点和等离子点(中性盐Ca2+、Mg2+、cl、HPO42++)等电点:以兼性离子形式存在的蛋白质的pH 值。
在等电点条件下,蛋白质的电导性、溶解度最小,粘度最大。
蛋白质的等电点和它所含的酸性氨基酸残基和碱性氨基酸残基的比例有关。
等离子点:没有其它盐类干扰时,蛋白质质子供体解离出的质子数与质子受体结合的质子数相等时的pH值称等离子点,是每种蛋白质的特征常数。
2.蛋白质的电泳分离3.离子交换层析分离蛋白质二、蛋白质的大小与形状测分子量的方法:1.化学组成法2.凝胶过滤法3.SDS-PAGE法4.沉降分析法5.渗透压法三、胶体性质与蛋白质的沉淀蛋白质分子直径在1-100nm之间,在水溶液中具有胶体溶液的通性(布朗运动,丁达耳现象,不能通过半透膜)透析:将含小分子杂质的蛋白质放入透析袋中,置水溶液中,小分子杂质不断从袋中出来,大分子蛋白质仍留在袋中。
蛋白质在水中溶解度依赖于多肽链氨基酸残基侧链基团的相对极性,离子化基因数量越多,溶解度越大。
1.稳定蛋白质胶体溶液的主要因素(1)蛋白质表面极性基团形成的水化膜将蛋白质颗粒彼此隔开,不会互相碰撞凝聚而沉淀。
第7章 蛋白质的分离、纯化和表征

one particular protein from all the others in the starting material, exploits利用: Solubility Size Charge Hydrophobicity or/and specific binding affinity of the protein of interest
用来确定Mr。
7.2.4 沉降分析法测定相对分子质量
蛋白质溶液在电场中受到强大的离心力作用时,如果
蛋白质的密度大于溶液的密度,蛋白质分子就会沉降。 沉降的速率与蛋白质分子大小和密度有关,而且与分 子形状、溶液的密度和粘度有关。
沉降速率法 沉降平衡法
沉降分析法测定相对分子质量
离心机 转速 60 000-80 000rpm
Protein size and shape
55.8
例如,肌红蛋白相对分子质量=───×100 0.335
=16700 用其他物理化学法法测得的 肌红蛋白Mr与此极为接近,可 见肌红蛋白分子中只含一个 铁原子。
7.2.2 渗透压法测定相对分子质量 渗透与渗透压
渗透压法测定相对分子质量
溶剂分子由纯溶剂(或稀溶液)向溶液(或浓
第7章 蛋白质的分离、纯化 和表征
Protein Separation, Purification and Characterization
Protein Purification and CharacterizatPurification and Characterization
单位离心场的沉积速度是个定值,称为沉降系
数(sedimentation 数。
coefficient)或沉降常
第7章蛋白质的分离纯化和表征

第7章蛋白质的分离纯化和表征第七章蛋白质的分离、纯化和表征第一节蛋白质的酸碱性质每个解离基团的pK 值与游离氨基酸的不完全相同。
等电点应通过等电点聚焦和其他方法来确定。
第二节蛋白质分子的大小和形状首先,根据化学成分确定最低相对分子质量假设只有一种微量组分,在测量其百分含量后,可以用比例公式计算出最低相对分子质量。
如果测量两种痕量组分的百分比含量,并且通过比例公式计算的最低相对分子质量不同,则可以计算两种最低相对分子质量的近似值的最小公倍数。
实施例:纯酶含有1.65%亮氨酸(MR 131)和2.48%异亮氨酸(MR 131), 以找到最低的相对分子质量。
解决方案:根据Leu 的百分比,最低Mr x1: x1 = (100'131)/1.65 = 7939.4。
最低X2先生:X2 = (100 ' 131)/2.48 = 528是3艮据lie的百分比含量计算的。
由于X1 和X2 数之间的巨大差异,建议该酶包含一个以上的Leu 和l i e 。
为了估计Leu 和lie 的数量,首先计算:X1/X2=7939.4/5282.3 〜1.5 .该酶含有的任何氨基酸的数量应为整数,表明该酶至少含有2个Leu 和3个Ile ,其最小相对分子质量为7939.4 ‘2=15878.8或5282.3 3=15846.9二、渗透压法测定相对分子质量三、沉降分析法测定相对分子质量基本原则:(a)离心力(Fc)当粒子(生物大分子或细胞器)在高速旋转下受到离心力时,离心力“ FC由以下公式定义:f = m a = m w 2ra-粒子旋转加速度,m-沉降粒子的有效质量,w粒子旋转角速度,r- 粒子旋转半径(cm)。
②相对离心力(RCF) 由于各种离心机转子的半径或离心管到转轴中心的距离不同,离心力也不同。
因此,文献中常用相对离心力”或数X g来表示离心力。
只要RCF 值不变,样品在不同的离心机上可以获得相同的结果。
高中生物第7章蛋白质的分离、纯化和表征
马铃薯块茎、甜菜的块根、玉米胚等 酶 C6H12O6 2C3H6O3+ 能量
D.无氧呼吸的能量利用率:1mol的葡萄糖在细胞内 分解成乳酸后,只释放出196.65kj的能量,其中只有 61.08 kj的能量储存在ATP中,近69%的能量都以热 能形式散失了。
无氧呼吸的能量转换率≈ 61.08÷196.65≈31% 1mol的葡萄糖在细胞内分解成乳酸后,生成的 ATP数≈61.08÷30.54 ≈2(个)
酶
第二阶段: 2C3H4O3 + 4[H] 2C3H4O3 + 4[H] C.总反应式: 酶 C6H12O6 (少) 酶 C6H12O6
细胞质基质 酶 细胞质基质
2C2H5OH+2CO2
2C3H6O3
2C2H5OH(酒精)+2CO2+能量 2C3H6O3(乳酸)+能量(少)
第二阶段: 2C3H4O3 + 4[H]
或.
酶
2C3H4O3 + 4[H]
细胞质基质 酶 细胞质基质
2C2H5OH+2CO2
2C3H6O3
思考1:第二阶段的反应物一样,为什么生成
物不一样呢? 酶不同。
思考2:在同一个细胞里有可能生成酒精,又
生成乳酸吗? 不可能。
无氧呼吸的类型
酒精类型
酵母菌(发酵) 苹果等大多数植物细胞 在缺氧条件下 酶
2、无氧呼吸:细胞在无氧参与的情况下通过多种酶的
催化作用,把葡萄糖等有机物不彻底地氧化分解,产生 酒精和CO2或乳酸,释放少量能量,生成少量ATP的过程。 A.场所:细胞质基质中 B.过程:(分两个阶段,第一阶段与有氧呼吸相同) 第一阶段: C6H12O6
酶
蛋白质的结构层次
测定蛋白分子量
测定蛋白
标准蛋白
logMr=K1-K2R
三、蛋白质的胶体性质与蛋白质的沉淀
• • • • 1、蛋白质溶液是一种胶体溶液; 水化作用,双电层结构 2、蛋白质沉淀 (1)盐析:加入中性盐,破坏蛋白水 化层引起沉淀 • (2)有机溶剂沉淀:加入极性有机溶 剂,脱水化层,破坏双电层 • (3)重金属盐沉淀:结合成不溶性盐 • (4)加热变性
第七章 蛋白质的分离、纯化和表征
一、蛋白质的酸碱性质
• 蛋白质是两性电解质 • 可解离基团:-氨基, -羧基,侧 链R基团
• 蛋白质等电点:在某一pH值,蛋白 所带正负电荷相等,即净电荷为零 时溶液的pH称为该蛋白等电点。
二、蛋白质分子大小与形状
• (一)根据化学组成测定最低分子量 例:肌红蛋白含铁量为 0.335%,其最小分 子量是多少?血红蛋白含铁量也是 0.335%。试求其分子量。 • 解:肌红蛋白的分子量为: • 100:0.335=M:56 • M=100*56/0.335=16716.4 • 血红蛋白的分子量为: • 100:0.335=M:(456) M=66865.7
(二)几种测定蛋白分子量方法
• 1、渗透压法:=cRT/Mr • 2、测定扩散系数法:随Mr增加而降 低 • 3、沉降法
• 规定ห้องสมุดไป่ตู้0-13秒为一个单位,称为沉降系 数单位,用S表示。
• *4、凝胶过滤法 • **5、SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE)法
凝胶过滤法和SDS-聚丙烯酰胺凝胶电泳 (SDS-PAGE)法测定蛋白质分子量
• • • • • •
在某一溶液中含有三种蛋白质,其性质如下: 蛋白 相对分子量 等电点 A 40000 8.5 B 40000 5.9 C 60000 5.9 试设计一个方案分离纯化这三种蛋白质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
渗透压法测定相对分子质量
在浓度不大时,渗透压与溶质的相对分子量的
关系为: π= RT(c/Mr
+ K c2 )
Mr = RT/ limπ/c
c→0
7.2.3 蛋白质的扩散和扩散系数
扩散(diffusion) dm/dt =-DA dc/dx
D 扩散系数, A 扩散面积
分离和纯化蛋白质的各种方法主要是利
用蛋白质之间各种特性的差异,包括:
分子的大小和形状 酸碱性质
溶解度
吸附性质
对配体分子的特异生物学亲和力
Protein Purification and Characterization
The aim of protein purification is to isolate
铁的原子量 铁的百分含量=─────── ×100 最低相对分子质量 铁的原子量 最低相对分子质量=───────×100 铁的百分含量
Protein size and shape
55.8
例如,肌红蛋白相对分子质量=───×100 0.335
=16700 用其他物理化学法法测得的 肌红蛋白Mr与此极为接近,可 见肌红蛋白分子中只含一个 铁原子。
7.3 蛋白质的胶体性质
与蛋白质的沉淀
Protein’s colloid character and deposition
7.3.1 蛋白质的胶体性质
蛋白质溶液是一个分散系统 分散相质点 <1nm的为真溶液,
> 100nm的为悬浊液, 介于1-100nm的为胶体溶液。
Protein colloid character and deposition
可以发生明显的变化。 蛋白质等电点在一定程度上决定于介质中离子的组成。
没有其他盐类干扰时,蛋白质质子供体基团解
离出来的质子数与质子受体基团结合的质子数 相等时的pH称为等离子点(isoionic point)。
Ionization of protein
+
Overall charge on protein acid excess positive charge Cation exchanger isoelectric point balanced positive and negative charge
dm’=- DA dc/dx dt
沉降分析法测定相对分子质量
当净离心力与扩散力平衡时,在离心池内从液
面到液底形成一个由低到高的恒定浓度梯度, 因此:
2RTdln(c2 / c1) Mr = ───────── (1-υρ) ω2(x22-x12)
7.2.5 凝胶过滤法测定相对分子质量
胶体系统的稳定条件:
1 分散相质点的大小 2 分散相质点带有同种电荷 3 分散相质点能与溶剂形成溶剂化层
+ + +
Protein colloid character and deposition
每克蛋白质分子能结合0.3-0.5克水。 蛋白质溶液具有:丁达尔效应,布朗运动及
凝 胶 过 滤 法 测 定 相 对 分 子 质 量
lg
层析柱的洗脱体积与分子量的关系: Ve=K1-K2lgM
7.2.6 SDS聚丙烯酰胺凝胶电泳法测定
相对分子质量
SDS, 有效变性剂,带负电荷 巯基乙醇,打开二硫键 蛋白质亚基在电场中的行为只与分子大小有关。
Rf =
K1-K2 lg M
Marker
Electrophoresis of Protein
In polyacrylamide(聚丙烯酰胺) gel
electrophoresis (PAGE) proteins are applied to a porous(可渗透的,多孔的) polyacrylamide gel and separated in an electric field on the basis of their net negative charge and their size. Small/more negatively-charged proteins migrate further through the gel than larger/less negatively-charged proteins
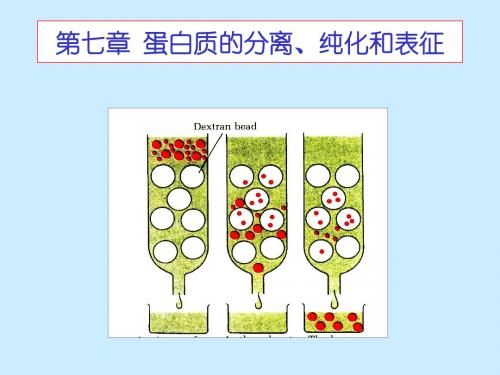
In contrast, the larger molecules have only the liquid surrounding the beads accessible to them, and thus move through the column faster, emerging out of the bottom (eluting洗脱) first. The smaller molecules move more slowly through the column and elute later.
deposition Principles of Protein purification Protein content and purity determination
Protein Purification and Characterization
因材施法,有的放矢
Protein Purification and Characterization
Small molecules can enter the pores in the beads whereas larger or more elongated molecules cannot. The smaller molecules therefore have a larger volume of liquid accessible (可达到的,可接近 的) to them; both the liquid surrounding the porous heads and that inside the beads.
alkaline excess negative charge Anion exchanger
3
10
pH
The overall charge on a protein depends on pH _
7.2 蛋白质分子的大小与形状
Protein size and shape
7.2.1 根据化学组成测定最低相对分子质量
one particular protein from all the others in the starting material, exploits利用: Solubility Size Charge Hydrophobicity or/and specific binding affinity of the protein of interest
不能通过半透膜的性质。
Protein colloid character and deposition
The hydrophobic and hydrophilic parts on the surface of protein
7.1 蛋白质的酸碱性质
Ionization of protein
对某一种蛋白质来说,在某一pH,它所带的正
电荷和负电荷恰好相等,也即净电荷为零,这
一pH称为蛋白质的等电点 (isoelectric
point, pI)。
Ionization of protein
蛋白质的滴定曲线形状和等电点,在有中性盐存在下
沉降速率法 沉降平衡法
沉降分析法测定相对分子质量
离心机 转速 60 000-80 000rpm(rotation per
minute ) 离心力 400 00- 700 000g
沉降分析法测定相对分子质量
离心力 4π2 v 2 r F = ----------g :离心力,单位以地心引力的倍数g表示(即g 或×g) :重力加速度,等于980.6 cm2/s2. : 通常指自离心管中轴底部内壁到离心转轴中心之间 的距离(cm) :为转速,即离心机每秒的转数,若以每分钟转数 (rpm)表示,则上式应为 4π2 v 2 r F = ----------- (1/60)2 g
7.2.4.2 沉降平衡法
利用沉降平衡法测定相对分子质量是在较低速度
(8000 -20000r/min)的离心场中进行的。
蛋白质的沉降平衡(图7-3)
沉降 分析 法测 定相 对分 子质 量
在时间dt内浓度为c的溶液越过横截面A的溶质量:
dm=-cA
dx/dt dt
因此扩散作用沿相反方向越过横截面A的溶质量:
对蛋白质分子进行的各种研究, 要建立在对蛋白质分子本身的性质(特别是区别于其它生 物与化学分子的独特的性质) 和各种实验手段的原理和适用性深入了解的基础上。
蛋白 质
大分 半透 子
透析 袋内
小分 子
膜
透析 袋外
小分 子
Protein Purification and Characterization
Gel filtration chromatography
凝胶过滤法的原理
Gel filtration chromatography
Size exclusion chromatography Molecular sieve(筛子) chromatography
Molecules are separated on the basis of their size and shape. The protein sample in a small volumes is applied to the top of a column of porous(有孔的) beads that are made of an insoluble but highly hydrated (亲水的) polymer such as polyacrylamide (Bio-Gel) or the carbohydrates dextran (葡聚糖 ) (Sephadex) or agarose (琼脂糖) (Sepharose)
