人干扰素调节因子IRF酶联免疫分析ELISA
人β干扰素IFNβ酶联免疫分析

人β干扰素(IFN-β)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T1pg/ml-32pg/ml使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中β干扰素(IFN-β)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人β干扰素(IFN-β)水平。
用纯化的人β干扰素(IFN-β)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入β干扰素(IFN-β),再与HRP标记的β干扰素(IFN-β)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的β干扰素(IFN-β)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人β干扰素(IFN-β)浓度。
1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
酶联免疫方法检测细胞因子步骤

酶联免疫方法检测细胞因子步骤酶联免疫方法(enzyme-linked immunosorbent assay, ELISA)是一种广泛应用于生物医学研究领域的检测技术,它能够快速、准确地检测细胞因子等生物大分子的含量。
细胞因子是一类在调节和介导细胞间相互作用中发挥重要作用的细胞因子,它们在免疫反应、炎症反应和细胞信号传导等生理过程中具有重要的调节作用。
本文将对酶联免疫方法检测细胞因子的步骤进行详细介绍,让读者对该技术有一个全面的了解。
第一步:样品处理在进行酶联免疫法检测细胞因子之前,首先需要对样品进行处理。
样品处理的目的是提取细胞因子,并将其置于适宜的条件下以便后续的检测。
对于细胞因子的提取可采用离心、超声波破碎等方法,以获取高纯度的样品。
同时,对于血清、血浆等液体样品,还需通过凝胶过滤、醋酸纤维素柱层析等步骤进行净化处理,以去除样品中可能存在的干扰物质。
第二步:酶标记抗体的制备酶联免疫法的关键之一是酶标记抗体的制备。
酶标记抗体一般是通过将抗体与酶(如辣根过氧化物酶、碱性磷酸酶等)进行共价结合而得到的。
在制备酶标记抗体时,需要考虑到抗体与酶的比例、结合条件等因素,并通过一系列的实验来优化制备条件,以确保酶标记抗体的稳定性和活性。
第三步:微板上样品的包被完成样品的处理和酶标记抗体的制备之后,下一步是将样品包被到微板上。
微板是一种通常由聚苯乙烯、聚碳酸酯等材料制成的微量反应容器,其表面具有一定的亲和性,可以吸附蛋白质等生物分子。
在将样品包被到微板上时,需注意包被的时间、温度等因素,以使样品能够均匀地吸附到微板上,并且保持其天然的构象和生物活性。
第四步:酶标记抗体的添加将样品包被到微板上之后,接下来就是添加酶标记抗体。
酶标记抗体作为二抗,可以与包被在微板上的靶分子结合,形成特异性的抗原-抗体复合物。
为了确保酶标记抗体的特异性和灵敏度,通常需要对酶标记抗体进行适当的稀释,并加入到微板上进行孵育。
第五步:底物的加入与反应在酶标记抗体添加完毕后,需要加入底物并进行反应。
干扰素调节因子7(IRF7)与系统性硬化症关系研究进展

doi:10.3969/j.issn.1000⁃484X.2020.21.026干扰素调节因子7(IRF7)与系统性硬化症关系研究进展闭雄杰 (广西科技大学第一附属医院,柳州545002) 中图分类号 R593.25 文献标志码 A 文章编号 1000⁃484X (2020)21⁃2686⁃05作者简介:闭雄杰,男,硕士,主任技师,主要从事免疫学方面的研究㊂[摘 要] 系统性硬化症(SSc)是一种以血管病变㊁皮肤和内脏纤维化㊁免疫调节紊乱为特征的致死风险高的自身免疫性疾病,其首要死因是肺纤维化和肺动脉高压㊂如何破解SSc 纤维化难题,是降低SSc 患者死亡率的关键㊂目前,SSc 病因尚不清楚,尚无有效的治疗方案㊂近年来研究表明,Ⅰ型干扰素(IFN)在SSc 纤维化的发病中起重要作用,而IRF7作为Ⅰ型IFN 的最主要调节因子参与Ⅰ型IFN 诱导基因的转录调控及促进单核/巨噬细胞的表达和TGF⁃β信号转导,可能参与了SSc 发病中纤维化的形成㊂[关键词] 干扰素;系统性硬化症;干扰素调节因子7Research progress of relationship between interferon regulatory factor 7(IRF7)and systemic sclerosisBI Xiong⁃Jie .The First Affiliated Hospital of Guangxi University of Science and Technology ,Liuzhou 545002,China[Abstract ] Systemic sclerosis (SSc)is an autoimmune disease characterized by angiopathy,skin and visceral fibrosis,andimmune regulation disorders.The primary cause of death is pulmonary fibrosis and pulmonary hypertension.How to solve the problem of SSc fibrosis is the key to reduce the mortality of SSc patients.At present,the etiology of SSc is not clear,and there is no effective treat⁃ment.Recent studies have shown that type Ⅰinterferon (IFN)plays an important role in the pathogenesis of SSc fibrosis.IRF7,as the most important regulator of type ⅠIFN,participates in the transcription regulation of type ⅠIFN⁃induced genes,promotes the expression of monocytes /macrophages and TGF⁃βsignal transduction,and may be involved in the formation of fibrosis in the pathogenesis of SSc.[Key words ] Interferon;Systemic sclerosis;Interferon regulatory factor 7 系统性硬化症(systemic sclerosis,SSc)是一种以血管病变㊁皮肤和内脏纤维化㊁免疫调节紊乱为特征的慢性㊁多系统自身免疫性疾病[1,2]㊂目前,SSc 的病因尚不清楚,尚无有效的治疗方案㊂近年来,相关研究结果表明,Ⅰ型干扰素(IFN)在SSc 纤维化的发病中起着重要作用,但是其诱导的下游分子如何参与SSc 病理生理的确切机制尚不清楚㊂最近研究发现,IRF7被认为是Ⅰ型IFN 的最主要调节因子,其过度激活可能参与SSc 纤维化的发病机制,现就有关研究进展综述如下㊂1 IRF7基因结构IRF7,被称为淋巴特异性因子㊂人IRF7基因位于11p15.5染色体上,有4种剪接体,分别是IRF7A㊁⁃B㊁⁃C 和⁃H,不同的剪接体表现某一个结构域的缺失(图1),通过随机基因敲除的方法确定IRF7识别的序列为5′⁃GAAA /TNC /TGAAANT /C⁃3′㊂IRF7的氨基端含有一个由115个氨基酸组成的可与DNA 结合的结构域(DNA binding domain,DBD),其中DBD 能特异性结合IFN 于ISRE,DBD 确定为1~149位氨基酸,紧邻DBD 结构域的是CAD(constitutive activation domain),即活化结构域,确定为150~246位氨基酸㊂SRD(signal response domain)位于278~305位氨基酸,称为病毒功能结构域,增加病毒诱导产生的活性㊂ID 位于372~467位氨基酸称为抑制结构域,主要抑制反式激活作用㊂C 末端为VAD (virus activated domain),是副诱导区域,同时这个区域也是IRF7的磷酸化位点所在区域㊂上述区域是根据其诱导IFN 过程中的作用进行的划分[3]㊂IRF7受Ⅰ型IFN 的调控,也受TLR3㊁TLR4㊁TLR7/9的调控[4]㊂激活的IRF7可导致大量Ⅰ型IFN 的分泌㊂据研究报道,已经确定IRF7基因有几个易感位点与自身免疫性疾病相关,其中位点rs1131665与SSc 密切有关[5,6]㊂2 IRF7的激活Ⅰ型IFN㊁TNF⁃α㊁IL⁃1β和病毒感染均可诱导IRF7在脾脏㊁胸腺和外周血淋巴细胞的B 细胞浆㊁㊃6862㊃中国免疫学杂志2020年第36卷浆细胞树突状细胞(pDCs)和单核细胞中持续表达㊂未活化的IRF7存在于细胞质中㊂在病毒感染的早期,病原体与识别受体(PRRs)结合,激发TLR9/7诱导IRF7磷酸化;IRF7磷酸化后与磷酸化的IRF3(受TLR3㊁TLR4诱导)进入细胞核内,与其他协同激活因子(如P300结合蛋白)形成转录复合物;该转录复合物与IFN⁃α和IFN⁃β启动子中的病毒应答物质(VRES)结合诱导产生少量Ⅰ型IFN [7]㊂这些少量Ⅰ型IFN 与细胞膜上的IFN 受体(IFNR)结合,激活JNK 激酶信号,导致信号转导子和转录激活因子(STAT)⁃1和⁃2的磷酸化而激活;激活的STAT⁃1和⁃2与IRF9形成复合物 IFN 刺激的基因因子3”;该复合物与IRF7启动子上的IFN 刺激反应物结合,诱导合成更多的IRF7㊂新合成的IRF7通过正反馈调节促进生成更多的IFN 而产生强大的放大效应㊂除TLR9/7和IFN 受体外,炎症细胞因子IL⁃1β也能刺激人星形胶质细胞IRF7的表达㊂IL⁃1β是一种由活化的单核/巨噬细胞和上皮细胞产生的炎症细胞因子,对宿主产生炎症㊁感染性或免疫攻击的反应[8]㊂动物模型研究结果表明,IL⁃1β诱导的急性肺炎症㊁重塑和纤维化依赖于IL⁃1R1和MyD88信号通道㊂在培养的小鼠IRF7缺失的胚胎成纤维细胞中,病毒诱导的MyD88信号通道对IFN⁃α/βmRNA 水平不升高反而明显降低[9]㊂此外,IRF7诱导pDCs 和单核细胞产生炎症细胞因子IL⁃6[10]㊂由此可见,IRF7在炎症㊁组织重塑和纤维化等方面具有重要的作用㊂本文根据Honda 等[11]报道的IRF7在细胞内模式识别受体激活及在Ⅰ型干扰素基因正反馈调控中的作用机理,提出IRF7激活的可能机制(图2)㊂图1 IRF7的4种剪接体示意图[3]Fig.1 Four splicing variants of IRF7[3]Note:Four splicing variants of IRF7have been identified,named IRF⁃7A,IRF⁃7B,IRF⁃7C,and IRF⁃7H.DBD is localized in the N⁃terminal region of IRF7.C⁃terminal region of IRF⁃7contains multipledomains,includingconstitutiveactivationdomain(CAD),virus⁃activated domain(VAD),inhibitory domain (ID),and signal response domain (SRD).3 IRF7与SScIRF7与包括SSc 在内的多种自身免疫性疾病有关[5,12]㊂基因芯片研究显示早期SSc 患者外周IRF7mRNA 表达上调[13]㊂最近一项研究也表明[14]:与健康对照组相比,SSc 患者的外周血单个核细胞中IRF7mRNA 表达升高;此外,对不同类型的SSc 患者分析,结果显示局限性皮肤系统硬化症患者的IRF7mRNA 表达显著高于健康对照组,而弥漫性皮肤系统硬化症患者IRF7mRNA 表达不升高,这可能与IRF7基因多态性有关㊂另一项独立研究表明,IRF7基因区域的变异与SSc 患者自身抗体ACA 的产生密切有关,并对疾病的发生发展起关键作用[6]㊂另一项研究显示,SSc 患者外周血单个核细胞IRF7转录水平与对照组相比差异无统计学意义,可能与该研究样本为晚期SSc 疾病患者且样本量较小有关[15]㊂因此,IRF7在SSc 发病中的作用机制需要进一步研究㊂4 IRF7在SSc 发病中的作用机制4.1 IRF7参与Ⅰ型IFN 诱导基因的转录调控 IRFs 在哺乳动物中该家族由9名成员组成:IRF1㊁图2 可能的IRF7激活机制示意图[11]Fig.2 Possible mechanisms of IRF7activation [11]Note:DNA or RNA of virus in the cytosol of virus⁃infected cells triggerstype ⅠIFN gene induction through TLR pathway;TLR3/TLR4recognizes dsRNA;TLR7mediates recognition of ssRNA;TLR9recognizes CpG DNA of viruses.TLR3utilizes TRIF;TLR4utilizes TRAF6.TLR7,TLR9use only MyD88;Phosphorylated IRF3,enabling IRF7interact with P300,initiate efficient transcription of target genes;After initial activation of type ⅠIFN genes isachieved by IRF7,positive⁃feedback regulation comes into effect.㊃7862㊃闭雄杰 干扰素调节因子7(IRF7)与系统性硬化症关系研究进展 第21期IRF2㊁IRF3㊁IRF4(又称LSIRF㊁PIP或ICSAT)㊁IRF5㊁IRF6㊁IRF7㊁IRF8(又称ICSBP)和IRF9(又称ISGF3γ),其最主要特征是参与Ⅰ型IFN和IFN诱导基因的转录调控,在调节先天和适应性免疫反应中发挥关键作用[12,16]㊂Ⅰ型IFN是天然免疫系统的关键调节因子,对免疫细胞的分化㊁增殖和促进炎症细胞因子的产生起关键的调节作用[17]㊂近年来,研究发现SSc患者外周血细胞中存在Ⅰ型IFN诱导基因功能失调和早期阶段甚至在没有发生皮肤纤维化之前血清中存在Ⅰ型IFN系统激活[18⁃20]㊂有报道,接受IFN⁃α治疗慢性病毒性肝炎的患者中并发SSc[21]㊂此外,对早期SSc患者皮下注射IFN⁃α治疗组与安慰剂治疗组相比,IFN⁃α治疗导致肺功能恶化,皮肤评分也没有改善[22]㊂有研究小组也报告了SSc患者外周血和皮肤组织中异常调控的Ⅰ型IFN诱导基因的转录模式[23⁃25]㊂有证据表明TLR的激活触发细胞内信号转导通路而参与了SSc的病理生理过程[26]㊂最近的研究结果显示,TLR3配体Poly I∶C刺激SSc皮肤成纤维细胞Ⅰ型IFN和TGF⁃β反应基因的表达[27];Ⅰ型IFN也通过上调SSc中TLR3的表达而增加真皮成纤维细胞的炎症潜能[28]㊂Bhattacharyya 等[29]通过激活典型的Smad信号和抑制抗纤维化的microRNA miR⁃29的表达,证实了TLR4信号激活成纤维细胞,促进胶原合成并增加组织重塑和细胞外基质基因的表达㊂因此,Ⅰ型IFN信号通路是通过TLR激活促进SSc纤维化㊂虽然Ⅰ型IFN激活系统的存在,但这种调控异常的Ⅰ型IFN信号转导和干扰素诱导下游分子参与SSc病理生理的确切机制尚不清楚㊂而近年来研究结果表明,在免疫反应中IRF7被认为是Ⅰ型IFN的最主要调节因子可能参与SSc纤维化的发生和发展[9]㊂4.2 IRF7参与促进单核/巨噬细胞的表达 单核/巨噬细胞系具有相当的多样性和可塑性,受信号分子㊁转录因子和表观遗传机制的复杂网络调控㊂单核/巨噬细胞是由循环血液单核细胞进入组织内转变而来㊂在组织内单核/巨噬细胞受到刺激做出反应,并显著改变其生理活性㊂单核/巨噬细胞大致可分为经典激活(M1型)和交替激活(M2型)两种类型[30]㊂两类单核/巨噬细胞功能并不相同,M1型主要参与炎症性的反应,而M2型被更多认为参与组织重塑和纤维化[31]㊂据有关报道,SSc患者血清中IL⁃4㊁IL⁃13表达增加,而IL⁃4或IL⁃13能够激活单核/巨噬细胞变成为M2型[32⁃34]㊂SSc患者皮肤活检结果表明M2单核/巨噬细胞表达增加[35]㊂目前研究结果认为,SSc患者M2单核/巨噬细胞表达增加与IL⁃6水平升高关系密切,使用IL⁃6受体阻滞剂能减少SSc患者皮肤M2的表达[36,37];Maier等[38]认为磷酸二酯酶4(PDE4)抑制剂通过干扰M2单核/巨噬细胞中的IL⁃6释放从而降低SSc皮肤纤维化的发生㊂最近报道,用博莱霉素(BLM)诱导的小鼠模型中,IRF5+/+小鼠中单核/巨噬细胞皮肤和肺内表达显著上升,但是在IRF5-/-小鼠则明显下降[39]㊂由于IRF7和IRF5具有高度的同源性,IRF7如何促进单核/巨噬细胞的表达,目前确切机制尚不清楚[40]㊂皮肤真皮组织中可能的M2型单核/巨噬细胞激活机制的示意图[30]㊂见图3㊂4.3 IRF7激活参与β转化生长因子(TGF⁃β)信号转导 SSc发病机制主要是由正常组织结构被渐进性的纤维化组织代替所致㊂最近的研究阐明,在许多重要的致纤维化的细胞因子和炎症介质中,TGF⁃β被认为是在SSc发生纤维化过程中起最重要作用的因子[41]㊂TGF⁃β促进成纤维细胞的增殖㊁分化㊁迁移㊁黏附和活化,并诱导细胞因子分泌,最重要的是促进胶原和细胞外基质的合成㊂鉴于TGF⁃β在SSc发病中的关键作用,TGF⁃β已成为一种潜在的图3 皮肤真皮纤维化中的巨噬细胞替代激活的可能机制和功能Fig.3 Possible mechanisms and functions of alternative activation of macrophages in dermal fibrosis Note:In the early inflammatory phase of the fibrotic process,in situ M2 polarization of macrophages may be induced by infiltrating Th2 cells via the release of several mediators,mainly IL⁃4and IL⁃13.In particular,M2macrophages may further promote Th2effector responses,neovascularization,and contribute to the transition of fi⁃broblasts into apoptosis⁃resistant profibrotic myofibroblasts via the production and release of fibrogenic cytokines and growth factors, such as TGF⁃β.㊃8862㊃中国免疫学杂志2020年第36卷治疗靶点㊂目前,TGF⁃β抗体已经在动物模型和临床SSc患者中进行了应用研究,并取得良好的治疗效果[42]㊂有研究表明,TLR3激动剂Poly(Ⅰ∶C)在体外和体内均能激活皮肤纤维化及Ⅰ型IFN表达升高[43];升高的Ⅰ型IFN通过激活Smad2/3促进TGF⁃β表达升高,而升高的TGF⁃β对SSc纤维化起关键作用[44]㊂有研究证实,Smad转录因子家族的C⁃末端区域与IRF7的C末端区域同源,诱导TGF⁃β的反应,其中Smad3是刺激TGF⁃β信号通路中生成胶原的关键成分[45]㊂Smad3与IRF7相互作用并在TGF⁃β/Smad3信号转导中调控IRF7的转录活性㊂IRF7激活后与其他IRF(如IRF3)形成转录复合物,该转录复合物与另一个转录共激活因子P300结合蛋白结合,参与Smad依赖性TGF⁃β信号转导并促进胶原合成㊂IRF7与P300结合蛋白四个不同区域相互作用不仅刺激了IRF7的内在转录活性,而且增强其与其他转录因子协同的能力[46]㊂IRF7与CBP/P300的相互作用有助于形成更多稳定蛋白转录复合物CBP/P300,增强TGF⁃β的转录反应从而促进胶原蛋白过度生成[47]㊂5摇展望SSc10年生存率约为66%,且伴随内脏受侵犯生存率骤降为38%[48],Elhai等[49]的一项40年2691例SSc患者的队列荟萃分析发现SSc是致死风险非常高的风湿免疫性疾病,过去40年其死亡风险并未得到改善,而首要死因就是心肺并发症,包括肺纤维化和肺动脉高压㊂因此,如何破解SSc的纤维化难题㊁有效改善肺纤维化,是降低SSc患者死亡率的关键㊂IRF7单核苷酸多态性(SNP)与SSc易感性有关,其中多态性位点rs1131665与SSc易感性关系最密切㊂IRF7参与Ⅰ型IFN诱导基因的转录调控及促进单核/巨噬细胞的表达和TGF⁃β信号转导㊂因此,IRF7作为Ⅰ型IFN的主要调节因子,其过度表达和激活可能参与了SSc纤维化的发病机制,可作为抗炎和抗纤维化药物发展的合适治疗靶点,从而减缓SSc的纤维化进程㊂参考文献:[1] Allanore Y,Simms R,Distler O,et al.Systemic sclerosis[J].NatRev Dis Primers,2015.doi:org/10.1038/nrdp.2015.2. [2] Chizzolini C,Brembilla NC,Montanari E,et al.Fibrosis andimmune dysregulation in systemic sclerosis[J].Autoimmunity Rev,2011,10:276⁃281.[3] Zhang L,Pagano JS.Structure and function of IRF⁃7[J].JInterferon Cytokine Res,2002,22:95⁃101.[4] 张 辉,崔焕忠,杨 欢,等.调控抗病毒干扰素产生的信号转导机制研究进展[J].中国免疫学杂志,2014,30(8): 1135⁃1139.Zhang H,Cui HZ,Yang H,et al.Progress in the regulation of signal transduction mechanism of antiviral interferon production [J].Chin J Immunol,2014,30(8):1135⁃1139.[5] Fu Q,Zhao J,Qian X,et al.Association of a functional IRF7variant with systemic lupus erythematosus[J].Arthritis Rheumat, 2011,63:749⁃754.[6] Carmona FD,Gutala R,Simeon CP,et al.Novel identification ofthe IRF7region as an anticentromere autoantibody propensity locus in systemic sclerosis[J].Ann Rheum Dis,2012,71:114⁃119.[7] Yang H,Lin CH,Ma G,et al.Interferon regulatory factor⁃7synergizes with other transcription factors through multiple interactions with p300/CBP coactivators[J].J Biol Chem,2003, 278:15495⁃15504.[8] Dunne A,O′Neill LA.The interleukin⁃1receptor/Toll⁃likereceptor superfamily:signal transduction during inflammation and host defense[J].Sci STKE,2003.doi:10.1126/stke.2003.171.re3.[9] Honda K,Yanai H,Negishi H,et al.IRF⁃7is the master regulatorof type⁃Ⅰinterferon⁃dependent immune responses[J].Nature, 2005,434:772⁃777.[10] Yasuda K,Richez C,Maciaszek JW,et al.Murine dendritic celltype I IFN production induced by human IgG⁃RNA immunecomplexes is IFN regulatory factor(IRF)5and IRF7dependentand is required for IL⁃6production[J].J Immunol,2007,178:6876⁃6885.[11] Honda K,Taniguchi T.IRFs:Master regulators of signalling byToll⁃like receptors and cytosolic pattern⁃recognition receptors[J].Nat Rev Immunol,2006,6:644⁃658.[12] Wu M,Assassi S.The role of type1interferon in systemicsclerosis[J].Front Immunol,2013.doi:10.3389/fimmu.2013.00266.[13] Tan FK,Zhou X,Mayes MD,et al.Signatures of differentiallyregulated interferon gene expression and vasculotrophism in theperipheral blood cells of systemic sclerosis patients[J].Rheumatology,2006,45:694⁃702.[14] Rezaei R,Mahmoudi M.IRF7gene expression profile andmethylation of its promoter region in patients with systemicsclerosis[J].Int J Rheumat Dis,2017,20:1551⁃1561. [15] Oliveira DBd,FAlmeida GMd,Guedes ACM,et al.Basalactivation of typeⅠinterferons(alpha2and beta)and2′5′oasgenes:Insights into differential expression profiles of interferonsystem components in systemic sclerosis[J].Int J Rheuma,2011.doi:10.1155/2011/275617.[16] Tamura T,Yanai H,Savitsky D,et al.The IRF familytranscription factors in immunity and oncogenesis[J].Annl RevImmunol,2008,26:535⁃584.[17] van Bon L,Cossu M,RadstakeTR.An update on an immunesystem that goes awry in systemic sclerosis[J].Curr OpinRheumatol,2011,23:505⁃510.[18] Jiao Y,Chen H,Gu T,et al.Molecular network of important genesfor systemic sclerosis⁃related progressive lung fibrosis[J].BMC闭雄杰 干扰素调节因子7(IRF7)与系统性硬化症关系研究进展 第21期Res Notes,2015.doi:10.1186/s13104⁃015⁃1510⁃4. [19] Lenna S,Farina AG,Martyanov V,et al.Increased expression ofendoplasmic reticulum stress and unfolded protein response genesin peripheral blood mononuclear cells from patients with limitedcutaneous systemic sclerosis and pulmonary arterial hypertension[J].Arthritis Rheumat,2013,65:1357⁃1366.[20] Brkic Z,van Bon L,Cossu M,et al.The interferon type I signatureis present in systemic sclerosis before overt fibrosis and mightcontribute to its pathogenesis through high BAFF gene expressionand high collagen synthesis[J].Ann Rheum Dis,2016,75:1567⁃1573.[21] Solans R,Bosch JA,Esteban I,et al.Systemic sclerosis developingin association with the use of interferon alpha therapy for chronicviral hepatitis[J].Clin Exp Rheumatol,2004,22:625⁃628. [22] Black CM,Silman AJ,Herrick AI,et al.Interferon⁃alpha does notimprove outcome at one year in patients with diffuse cutaneousscleroderma:Results of a randomized,double⁃blind,placebo⁃controlled trial[J].Arthritis Rheum,1999,42:299⁃305. [23] Radstake TR,Gorlova O,Rueda B,et al.Genome⁃wide associationstudy of systemic sclerosis identifies CD247as a newsusceptibility locus[J].Nat Genet,2010,42:426⁃429. [24] Gorlova O,Martin JE,Rueda B,et al.Identification of novelgenetic markers associated with clinical phenotypes of systemicsclerosis through a genome⁃wide association strategy[J].PLoSGenet,2011,7:e1002178.[25] Wu M,Baron M,Pedroza C,et L2in the circulationpredicts long⁃term progression of interstitial lung disease inpatients with early systemic sclerosis:data from two independentcohorts[J].Arthritis Rheumatol(Hoboken,N.J.),2017,69:1871⁃1878.[26] Takeda K,Akira S.Toll⁃like receptors[J].Curr ProtocolImmunol,2015,109:141211⁃10.[27] Zhou Y,Guo M,Wang X,et al.TLR3activation efficiency byhigh or low molecular mass poly I:C[J].Innate Immun,2013,19:184⁃192.[28] Agarwal SK,Wu M,Livingston CK,et al.Toll⁃like receptor3up⁃regulation by type I interferon in healthy and scleroderma dermalfibroblasts[J].Arthritis Res Ther,2011.doi:10.1186/ar3221.[29] Bhattacharyya S,Kelley K,elichian DS,et al.Toll⁃like receptor4signaling augments transforming growth factor⁃beta responses:Anovel mechanism for maintaining and amplifying fibrosis inscleroderma[J].Am J Pathol,2013,182:192⁃205. [30] Manetti M.Deciphering the alternatively activated(M2)phenotype of macrophages in scleroderma[J].Exp Dermatol,2015,24:576⁃578.[31] Wynn TA,Vannella KM.Macrophages in tissue repair,regeneration,and fibrosis[J].Immunity,2016,44:450⁃462. [32] Scala E,Pallotta S,Frezzolin Ai,et al.Cytokine and chemokinelevels in systemic sclerosis:relationship with cutaneous andinternal organ involvement[J].Clin Exp Immunol,2004,138:540⁃546.[33] Riccieri V,Rinaldi T,Spadaro A,et al.Interleukin⁃13in systemicsclerosis:Relationship to nailfold capillaroscopy abnormalities[J].Clin Rheumatol,2003,22:102⁃106.[34] Gordon S,Martinez FO.Alternative activation of macrophages:Mechanism and functions[J].Immunity,2010,32:593⁃604.[35] Higashi⁃Kuwata N,Makino T,Inoue Y,et al.Alternativelyactivated macrophages(M2macrophages)in the skin of patientwith localized scleroderma[J].Exp Dermatol,2009,18:727⁃729.[36] Khanna D,Denton CP,Jahreis A,et al.Safety and efficacy of sub⁃cutaneous tocilizumab in adults with systemic sclerosis(faSScinate):A phase2,randomised,controlled trial[J].Lancet(London,England),2016,387:2630⁃2640.[37] Distler O,Distler JH.Tocilizumab for systemic sclerosis:Implications for future trials[J].Lancet(London,Engl),2016,387:2580⁃2581.[38] Maier C,Ramming A,Bergmann C,et al.Inhibition ofphosphodiesterase4(PDE4)reduces dermal fibrosis byinterfering with the release of interleukin⁃6from M2macrophages[J].Ann Rheum Dis,2017,76:1133⁃1141.[39] Saigusa R,Asano Y,Taniguchi T,et al.Multifaceted contribution ofthe TLR4⁃activated IRF5transcription factor in systemic sclerosis[J].Proc Natl Acad Sci U S A,2015,112:15136⁃15141. [40] Barro M,Patton JT.Rotavirus NSP1inhibits expression of type Iinterferon by antagonizing the function of interferon regulatoryfactors IRF3,IRF5,and IRF7[J].J Virol,2007,81:4473⁃4481.[41] Varga J,Abraham D.Systemic sclerosis:A prototypic multisystemfibrotic disorder[J].J Clin Invest,2007,117:557⁃567. [42] Varga J,Pasche B.Transforming growth factor beta as atherapeutic target in systemic sclerosis[J].Nat Rev Rheumatol,2009,5:200⁃206.[43] Farina GA,York MR,Di Marzio M,et al.Poly(Ⅰ:C)drives typeI IFN⁃and TGFbeta⁃mediated inflammation and dermal fibrosissimulating altered gene expression in systemic sclerosis[J].JInvest Dermatol,2010,130:2583⁃2593.[44] Alvarez Mde L,Quiroga AD,Parody JP,et al.Cross⁃talk betweenIFN⁃alpha and TGF⁃beta1signaling pathways in preneoplastic ratliver[J].Growth Factors(Chur,Switzerland),2009,27:1⁃11.[45] Eroshkin A,Mushegian A.Conserved transactivation domainshared by interferon regulatory factors and Smad morphogens[J].J Mol Med,1999,77:403⁃405.[46] Lee KJ,Ye JS,Choe H,et al.Serine cluster phosphorylationliberates the C⁃terminal helix of IFN regulatory factor7to bindhistone acetyltransferase p300[J].J Immunol,2014,193:4137⁃4148.[47] Qing J,Liu C,Choy L,et al.Transforming growth factor beta/Smad3signaling regulates IRF⁃7function and transcriptionalactivation of the beta interferon promoter[J].Mol Cell Biol,2004,24:1411⁃1425.[48] Steen VD,Medsger TA.Changes in causes of death in systemicsclerosis,1972⁃2002[J].Ann Rheum Dis,2007,66:940⁃944.[49] Elhai M,Meune C,Avouac J,et al.Trends in mortality in patientswith systemic sclerosis over40years:A systematic review andmeta⁃analysis of cohort studies[J].Rheumatology,2012,51:1017⁃1026.[收稿2019⁃03⁃28 修回2019⁃06⁃14](编辑 张晓舟 刘格格)邮发代号12-89 半年价216.00元 单价18.00元中国免疫学杂志2020年第36卷。
Elisa检测 人γ干扰素 IFN-γ原理步骤

用双抗体夹心ELISA法检测样本中IFN-γ的浓度IFN-γ简介:被称为II型干扰素的IFN-γ,是由143个残基构成的,有20和25kDa亚型的糖蛋白,以头尾相连的同型糖蛋白的形式存在。
IFN-γ由T淋巴细胞和NK细胞产生,用以抗病毒和干扰增殖,此外,IFN-γ还有与免疫调节相关的几种功能包括调节细胞的增殖和程序性死亡,刺激或抑制不同基因的表达。
IFN-γ能通过诱导产生吲哚胺2,3-双加氧酶来抗弓形虫和衣原体的感染。
IFN-γ是效应强烈的单核吞噬细胞增强剂,IFN-γ是通过增强单核吞噬细胞的的Mac-1的表达来达到增强胞饮作用和吞噬作用的。
IFN-γ通过增加巨噬细胞的氧自由基和TNF-α的释放来达到增强杀肿瘤细胞的作用。
IFN-γ选择性地提高包括因LPS刺激的B细胞的IgG2a和因2型T细胞呈递抗原而引起的B细胞的IgG3的释放量。
有报道称IFN-γ能引起细胞的自分泌IFN-γ作用的增强。
检测原理:本试剂盒采用双抗体夹心ELISA法检测样本中IFN-γ的浓度。
IFN-γ捕获抗体已预包被于酶标板上,当加入标本或参考品时,其中的IFN-γ会与捕获抗体结合,其它游离的成分通过洗涤的过程被除去。
当加入生物素化的抗人IFN-γ抗体后,抗人IFN-γ抗体与IFN-γ接合,形成夹心的免疫复合物,其它游离的成分通过洗涤的过程被除去。
随后加入辣根过氧化物酶标记的亲合素。
生物素与亲合素特异性结合,亲合素连接的酶就会与夹心的免疫复合物连接起来;其它游离的成分通过洗涤的过程被除去。
最后加入显色剂,若样本中存在IFN-γ将会形成免疫复合物,辣根过氧化物酶会催化无色的显色剂氧化成蓝色物质,在加入终止液后呈黄色。
通过酶标仪检测,读其450nm处的OD值,IFN-γ浓度与OD450值之间呈正比,通过参考品绘制标准曲线,对照未知样本中OD值,即可算出标本中IFN-γ浓度。
标本收集:1.标本的收集请按下列流程进行操作:A.细胞上清标本离心去除悬浮物后即可;B.血清标本应是自然凝固后,取上清,避免在冰箱中凝固血液;C.血浆标本,推荐用EDTA的方法收集若待测样本不能及时检测;D.标本收集后请分装,冻存于-20℃,避免反复冻融。
大鼠α干扰素(IFN-α)酶联免疫分析(ELISA)试剂盒使用说

大鼠α干扰素(IFN-α)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定大鼠血清,血浆及相关液体样本中大鼠α干扰素(IFN-α)的含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中大鼠α干扰素(IFN-α)水平。
用纯化的大鼠α干扰素(IFN-α)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入α干扰素(IFN-α),再与HRP标记的IFN-α抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的α干扰素(IFN-α)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD 值),通过标准曲线计算样品中大鼠α干扰素(IFN-α)含量。
样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2. 血浆:应根据标本的要求选择EDTA或柠檬酸钠作为抗凝剂,混合10-20分钟后,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3. 尿液:用无菌管收集,离心20分钟左右(2000-3000转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4. 细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100万/ml左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20分钟左右(2000-3000转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5. 组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
干燥综合征2023年最新进展

干燥综合征2023年最新进展前言干燥综合征是一种慢性自身免疫性疾病,其特征是由泪腺和唾液腺功能障碍引起的眼部和口腔干燥。
此外,可能会出现各种全身表现,几乎涉及任何器官系统。
因此,该疾病的特点是多样化临床表现,其特征和严重程度可能因患者而异。
干燥综合征可以被定义为原发性或继发性,这取决于它是单独发生还是与其他全身性自身免疫性疾病相关。
干燥综合征的发病机制仍然难以捉摸,然而,已经提出了涉及遗传和环境因素的不同而非相互排斥的模型来解释其发展。
无论如何,异常自身反应性B淋巴细胞的出现,进行自身抗体的产生和免疫复合物的形成,似乎对疾病的发展至关重要。
干燥综合征的诊断基于特征性临床体征和症状,以及包括唾液腺组织病理学和自身抗体在内的特定测试。
最近,主要出于研究目的开发了新的分类标准和疾病活动评分,它们也可以成为日常临床实践中的有用工具。
干燥综合征的治疗范围从旨在控制干燥的局部和对症治疗到全身药物,包括疾病缓解剂和生物药物。
本文的目的是总结最近关于干燥综合征的文献,从发病机制到当前的最新治疗选择,分析干燥综合征最新学术进展。
介绍干燥综合征(SS)是一种病因不明的全身性慢性自身免疫性疾病,其特征是唾液腺和泪腺免疫介导的损伤,导致口干(口干症)和眼干(干眼症)。
此外,干燥可能影响气道、消化道和阴道等其他黏膜表面,导致“干燥综合征”或“干燥综合征”的临床表现。
作为一种全身性疾病,SS几乎可以涉及任何器官系统,导致极其多形的临床表现。
关于SS对生活质量的影响,由于疲劳、抑郁、焦虑和身体机能下降的高发率,该疾病对患者的日常活动产生负面影响。
如果SS与其他疾病无关,则SS被定义为“原发性”,如果与潜在的自身免疫性结缔组织疾病相关,例如 RA、SLE 或系统性硬化症(SSc),则定义为“继发性”。
SS的名字来源于瑞典眼科医生Henrik Samuel Conrad Sjögren(1899-1986),他在1933年首次将干燥性角膜结膜炎、口干症和多发性关节炎三联征联系起来。
人干扰素调节因子

人干扰素调节因子8(IRF8)酶联免疫分析试剂盒使用说明书本试剂盒仅供体外研究使用!预期应用ELISA法定量测定人血清、血浆或其它相关生物液体中IRF8含量。
实验原理用纯化的抗体包被微孔板,制成固相载体,往包被抗IRF8抗体的微孔中依次加入标本或标准品、生物素化的抗IRF8抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的IRF8呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为10ng/ml,做系列倍比稀释(注:不要直接在板中进行倍比稀释)后,分别稀释成10ng/ml,5ng/ml,2.5ng/ml,1.25ng/ml,0.625ng/ml,0.312 ng/ml,0.156ng/ml,样品稀释液直接作为标准浓度0ng/ml,临用前15分钟内配制。
如配制5ng/ml标准品:取0.5ml(不要少于0.5ml)10ng/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml。
4.检测稀释液A:1×10ml。
5.检测稀释液B:1×10ml。
6.检测溶液A:1×120μl(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(100μl/孔),实际配制时应多配制0.1-0.2ml。
如10μl检测溶液A加990μl检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7.检测溶液B:1×120μl/瓶(1:100)临用前以检测稀释液B1:100稀释。
稀释方法同检测溶液A。
IFN-αβR,人αβ干扰素受体(IFN-αβR)酶联检测分析ELISA使用说明书
IFN-α/βR,人α/β干扰素受体(IFN-α/βR)酶联检测分析ELISA使用说明书本试剂仅供研究使用标本:血清或血浆樊克生物专业供应:使用目的:本试剂盒用于测定人血清、血浆及相关液体样本α/β干扰素受体(IFN-α/βR)含量。
试验原理:IFN-α/βR试剂盒是固相夹心法酶联免疫吸附实验(ELISA).已知IFN-α/βR浓度的标准品、未知浓度的样品加入微孔酶标板内进行检测。
先将IFN-α/βR和生物素标记的抗体同时温育。
洗涤后,加入亲和素标记过的HRP。
再经过温育和洗涤,去除未结合的酶结合物,然后加入底物A、B,和酶结合物同时作用。
产生颜色。
颜色的深浅和样品中IFN-α/βR的浓度呈比例关系。
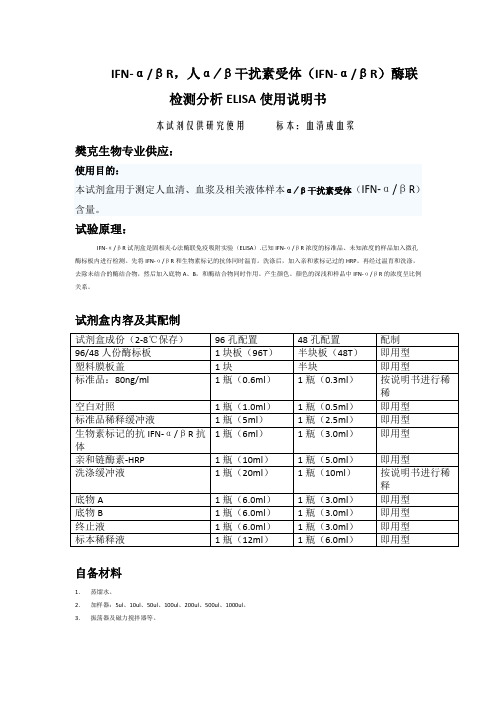
试剂盒内容及其配制试剂盒成份(2-8℃保存)96孔配置48孔配置配制96/48人份酶标板1块板(96T)半块板(48T)即用型塑料膜板盖1块半块即用型标准品:80ng/ml 1瓶(0.6ml)1瓶(0.3ml)按说明书进行稀稀空白对照1瓶(1.0ml)1瓶(0.5ml)即用型标准品稀释缓冲液1瓶(5ml)1瓶(2.5ml)即用型1瓶(6ml)1瓶(3.0ml)即用型生物素标记的抗IFN-α/βR抗体亲和链酶素-HRP 1瓶(10ml)1瓶(5.0ml)即用型洗涤缓冲液1瓶(20ml)1瓶(10ml)按说明书进行稀释底物A 1瓶(6.0ml)1瓶(3.0ml)即用型底物B 1瓶(6.0ml)1瓶(3.0ml)即用型终止液1瓶(6.0ml)1瓶(3.0ml)即用型标本稀释液1瓶(12ml)1瓶(6.0ml)即用型自备材料1.蒸馏水。
2.加样器:5ul、10ul、50ul、100ul、200ul、500ul、1000ul。
3.振荡器及磁力搅拌器等。
安全性1.避免直接接触终止液和底物A、B。
一旦接触到这些液体,请尽快用水冲洗。
2.实验中不要吃喝、抽烟或使用化妆品。
3.不要用嘴吸取试剂盒里的任何成份。
操作注意事项1.试剂应按标签说明书储存,使用前恢复到室温。
植物激素的酶联免疫吸附测定法(ELISA)

植物激素的酶联免疫吸附测定法(ELISA)免疫测定是利用抗原、抗体特异性反应而建立的,根据可视化方法的不同可分为:酶联免疫、放射免疫、荧光免疫、化学发光免疫测定、生物发光免疫测定、浊度免疫测定法等。
由于酶联免疫吸附分析法(Enzyme-linked Immunosorbent Assays, 简称ELISA)具有灵敏性、特异性高,且方便、快速、安全、成本低廉的特点,而日益被广泛应用于植物激素测定。
目前,几大类植物激素IAA,ABA, GA3、GA4、iPA、ZR、DHZR等都建立了相应的ELISA方法并有试剂盒出售。
植物激素的酶联免疫检测方法有两种形式,一种是在固相载体上包被抗体(直接法),另一种是包被抗原(间接法)。
直接法利用游离抗原和酶标抗原与吸附的抗体进行竞争。
间接法利用游离抗原和吸附抗原与游离抗体进行竞争。
间接法的原理可用下式表示:Ab+H+HP=AbH+AbHP其中Ab表示抗体,H表示游离激素,HP表示吸附在板上的激素-蛋白质复合物。
根据质量作用定律,当该反应体系中Ab及HP的量确定时,游离H越多,结合物AbH形成的就越多,而AbHP形成的就越少,即结合在板上的抗体就越少,通过酶标二抗检测结合物AbHP的多少,就可以确定游离H 量的多少。
材料、试剂及设备1 材料各种新鲜植物材料2 仪器设备研钵,冷冻离心机,台式快速离心浓缩干燥器或氮气吹干装置,酶联免疫分光光度计,吸水纸,恒温箱,冰箱,酶标板(40孔或96孔),可调微量液体加样器(10μl,40μl,200μl,1000μl),带盖瓷盘(内铺湿纱布)。
3 试剂(1) 磷酸盐缓冲液(PBS):称取8.0g NaCl, 0.2g KH2PO4, 2.96g Na2HPO4·12H2O,用量筒加1 000 ml蒸馏水,pH为7.5。
(2) 样品稀释液:500 ml PBS中加0.5 ml Tween-20,0.5g明胶(稍加热溶解)。
人表皮生长因子(EGF)酶联免疫分析(ELISA)
人表皮生长因子(EGF)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中人表皮生长因子(EGF)含量。
实验原理:本试剂盒应用双抗体夹心法测定标本中人表皮生长因子(EGF)水平。
用纯化的人表皮生长因子(EGF)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入表皮生长因子(EGF),再与HRP 标记的表皮生长因子(EGF)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的表皮生长因子(EGF)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中人表皮生长因子(EGF)浓度。
试剂盒组成:样本处理及要求:1.血清:室温血液自然凝固10-20 分钟,离心20 分钟左右(2000-3000 转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA、者柠檬酸钠或肝素作为抗凝剂,混合10-20 分钟后,离心20 分钟左右(2000-3000 转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3.尿液:用无菌管收集,离心20 分钟左右(2000-3000 转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4.细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20 分钟左右(2000-3000 转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100 万/ml 左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20 分钟左右(2000-3000 转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5.组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
伽马干扰素的检测原理

伽马干扰素的检测原理
伽马干扰素(IFN-gamma)是一种由免疫细胞分泌的蛋白质分子,具有调节免疫系统功能的作用。
检测伽马干扰素的原理是通过特定的试剂与样品中的伽马干扰素发生特异性的反应,从而产生可测量的信号。
常用的伽马干扰素检测方法包括酶联免疫吸附实验(ELISA)和流式细胞术。
以下是ELISA法的原理:
1. 首先,将样品中的伽马干扰素与固相抗体充分结合,形成伽马干扰素和抗体的复合物。
2. 接下来,加入与伽马干扰素结合的辣根过氧化物酶标记的二抗,形成复合物。
3. 经过适当的洗涤步骤,除去未结合的物质。
4. 加入底物,使辣根过氧化物酶催化反应发生,产生可测量的颜色。
5. 通过读取光密度或荧光强度,可以定量测量样品中的伽马干扰素浓度。
通过ELISA法检测伽马干扰素的浓度可以用于评估免疫反应的水平,判断某些疾病的发展和预后情况,以及评估免疫治疗的效果。
干扰素调节因子家族成员及功能简述

作者简介:李雪平(1982—),女,硕士研究生,执业兽医,现从事畜禽诊断试剂研发和技术服务工作。
E-mail:********************通讯作者:曹立辉,男,主要从事畜禽诊断试剂产学研和运营工作。
E-mail:133****************干扰素调节因子家族成员及功能简述李雪平,蔡晓丽,曹立辉*(广州悦洋生物技术有限公司广州510300)扰素调节因子(IRF)是一类大的转录因子家族,参与宿主免疫反应、细胞分化及免疫调节。
IRF-1和IRF-2可以作为干扰素激活因子和抑制因子出现。
IRF3和IRF7是重要的抗病毒调节因子。
IRF-4和IRF-8高度同源、功能类似,与细胞分化和炎症有关。
IRF-5与凋亡和针对病原的免疫反应有关。
IRF-6是角质化细胞从增殖到分化重要的转化调节因子。
IRF-9在I型IFN的抗病毒反应中非常重要。
扰素;调节因子;免疫干扰素(IFN)是一类由单核细胞和淋巴细胞产生的具有多种功能的活性蛋白质。
它们在同种细胞上具有广谱的抗病毒、影响细胞生长,以及分化、调节免疫功能等多种生物活性。
IFN基因表达受干扰素调节因子(interferon regulatory factors,IRF)调节,并经IRF及干扰素刺激性应答基因(ISG)产物介导,激活相关信号转导途径而发挥其生物学效应。
IRF是一类大的转录因子家族,它们通常具有特异的螺旋-转角-螺旋DNA结合域(DBD)(该结构域可与IFN-β启动子上的IFN调节因子元件结合),参与宿主免疫反应、造血细胞分化及免疫调节。
1IRF家族成员哺乳动物中至少存在10种IRF,有些起激活作用(如IRF-1、IRF-3、IRF-5、IRF-9和IRF-10),有些起抑制作用(如IRF-8),有些则二者兼具(如IRF-2、IRF-4和IRF-7)。
IRF-1在所有脊椎动物中均存在,其基因长度在2163~9028bp之间。
IRF-1有9个外显子(斑马鱼中只有8个)和8个内含子。
干扰素调节因子1通过调控细胞焦亡参与小鼠肝脏缺血再灌注损伤

实验研究干扰素调节因子1通过调控细胞焦亡参与小鼠肝脏缺血再灌注损伤刘钰1,2,王朝阳3,李世朋4,胡莎莎1,2,杨爽3,蔡金贞2,张国梁2△摘要:目的探讨小鼠肝脏缺血再灌注损伤(LIRI)过程中干扰素调节因子-1(IRF-1)对焦亡的影响。
方法(1)24只C57BL/6正常雄性小鼠按照随机数字表法分为假手术(Sham)组与缺血再灌注(IR)2h、6h和12h组,每组6只。
Sham组不进行IR处理,其他3组采用血管夹夹闭肝中叶、左叶脉管(门静脉、动脉与胆道)60min后分别再灌注2、6、12h建立LIRI模型。
全自动生化仪检测各组血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST);酶联免疫吸附测定(ELISA)法检测血清白细胞介素-1β(IL-1β)水平;HE染色观察肝脏病理改变;免疫组织化学染色检测IRF-1表达情况;TUNEL染色检测肝脏细胞凋亡和焦亡情况;Western blot检测IRF-1、半胱天冬氨酸蛋白酶-1(Caspase-1)、Cleaved-Caspase-1及gasdermin D(GSDMD)蛋白水平;透射电镜检测肝组织细胞形态变化。
(2)将小鼠正常肝脏AML12细胞分别进行过表达和沉默IRF-1表达后进行模拟IR处理,分为过表达IRF-1+IR组、空载体+IR组、IRF-1 siRNA+IR组及其对照组(NC+IR组)。
Western blot检测4组细胞IRF-1、Caspase-1、Cleaved-Caspase-1和GSDMD蛋白水平;透射电镜检测细胞形态变化;流式细胞术检测细胞焦亡情况;酶标仪检测细胞上清乳酸脱氢酶(LDH)释放量。
结果(1)体内实验结果显示,与Sham组比较,IR6h组和12h组血清ALT、AST和IL-1β水平均有明显升高(P<0.05),IRF-1、Caspase-1和GSDMD蛋白表达升高(P<0.05);同时肝细胞出现肿胀、排列紊乱、空泡、片状坏死和红细胞淤积并伴有核膜损伤和线粒体肿胀。
ELISA法检测干扰素

ELISA法检测干扰素干扰素(IFN)是一类具有广谱抗病毒活性的蛋白质,仅在同种细胞上发挥作用。
根据其来源、理化及生物学性质的不同,可分为IFN-α、IFN-β、IFN-γ3种干扰素。
其中,IFN-α主要由白细胞产生,IFN-β由成纤维细胞产生,IFN-γ主要由T细胞在免疫应答中受到抗原或丝裂原活化后分泌产生。
3种干扰素中,IFN-α、IFN-β抗病毒作用较强,IFN-丁免疫调节作用较强。
目前已可用基因重组技术制备干扰素投入临床使用。
干扰素不能直接灭活病毒,其抗病毒作用是由于它能激活细胞内抗病毒蛋白基因,制造抗病毒蛋白,抑制病毒在体内复制。
干扰素不仅可抑制已感染细胞内病毒的复制,而且还可使未感染细胞处于抗病毒状态,对中断病毒的细胞间传播有一定作用;但对病毒整合基因可能仅有暂时抑制其mRNA的转录作用,不能清除病毒基因。
干扰素的免疫调节作用表现为它是重要的巨噬细胞活化因子(macro-phageactivating factor,MAF),活化的巨噬细胞能杀死病原微生物或杀伤肿瘤细胞。
干扰素能增强各种细胞表达MAF分子从而有利于递呈抗原或利于T细胞对靶细胞的识别和杀伤;还能促进T、B细胞的分化,活化NK细胞和中性粒细胞,从而有助于加强免疫应答。
由于干扰素不是一种淋巴细胞的生长因子,故常抑制淋巴细胞(特别是B 细胞)的增殖。
IFN抗病毒活性的特点如下:①仅仅是抑制作用,IFN消失后病毒将重新复制,因此必须足量反复应用;②有相对的种属特异性,IFN-γ较IFN-α、IFN-β严格;③IFN不直接灭活病毒,而是通过细胞基因组产生另一些蛋白因子来发挥效能,因此不同细胞对IFN的敏感性不同;④不同感染状态的病毒-细胞系统对IFN 的敏感性不同,病毒大量复制、引起细胞炎症应答时,IFN易产生效应;对完整细胞中的整合型病毒无作用。
[检测方法] ELISA法[方法学原理] 抗人IFN抗体包被在微孔反应板上,待测标本和标准品中的IFN会与抗人IFN抗体结合,游离的成分被洗去,同时加入生物素化的抗人IFN抗体和辣根过氧化物酶标记的亲和素。
干扰素调节因子的研究进展

干扰素调节因子的研究进展沈金花;吕印;刘庆华【摘要】指出了干扰素调节因子(IRFs)是一类在干扰素(IFN)信号通路中起重要调控作用的多功能转录因子,目前已经发现10个IRFs成员,它们在IFN的诱导、病毒防御、免疫调节、细胞分化、细胞生长与凋亡和许多疾病的调节中具有重要作用.对IRFs的结构、IRFs在免疫系统、细胞分化、细胞凋亡和相关疾病如肿瘤、系统性红斑狼疮中的功能作了综述.【期刊名称】《中南民族大学学报(自然科学版)》【年(卷),期】2014(033)002【总页数】4页(P41-44)【关键词】干扰素调节因子;功能;疾病【作者】沈金花;吕印;刘庆华【作者单位】中南民族大学生命科学学院医学生物研究所,武汉430074;中南民族大学生命科学学院医学生物研究所,武汉430074;中南民族大学生命科学学院医学生物研究所,武汉430074【正文语种】中文【中图分类】R392IRFs是指一类能对IFN基因表达起调控作用的转录因子,它们能结合到IFN基因顺式作用元件和干扰素刺激应答基因(ISC)序列中干扰素刺激性反应元件(ISRE)上,诱导和调节IFN及其信号通路基因的表达.目前已发现10个IRFs成员,IRF1~IRF9和病毒IRF(V-IRF).IRFs作为IFN信号通路中起关键调控作用的转录因子,在IFN的诱导、病毒防御、免疫调节、细胞分化、细胞生长与凋亡和诸多疾病的调节中均具有重要作用.本文将从IRFs的结构、功能和免疫活性等方面作一综述.1 IRFs的结构、功能和激活所有IRFs成员的DNA结合区(DBD)都位于氨基端的前115个氨基酸内[1].含有一个由5个色氢酸残基组成的基序,每个色氨酸被10~18个氨基酸隔开,这个基序介导IRF结合到ISRE的核心序列GAAA上.除IRF6外,其他的IRF还包含一个羧基端IRF相关结构域(IAD),促进不同成员间形成异二聚体.IRFs作为IFN信号通路中起关键调控作用的转录因子,在免疫调节、细胞分化、肿瘤调节、病毒防御、应激反应、细胞凋亡和细胞周期调节中具有重要作用.IRFs的激活主要是依赖于C末端和相关结构域的磷酸化及其形成多聚体而实现的.IRFs对IFNs的诱导是通过对IFN基因的顺式作用元件的调节实现的,其信号通路中涉及许多细胞因子,如CBP/p300、TBK1和IKKe等.2 IRFs与免疫IRFs作为转录因子在IFN的转录调控、病原体的免疫反应、造血干细胞的发育、淋巴细胞分化及先天性免疫和适应性免疫、细胞周期和增殖调控等方面均发挥着重要作用.2.1 IRFs在免疫应答中的作用PRRs成员的Toll样受体家族(TLR)与IFN相互作用,能识别病原体感染和启动先天免疫防御反应.TLR与PAMP结合,诱导炎症反应清除病原体的感染.LPS、dsRNA和PAMP可被特定的TLR识别,由IRF3、IRF7等介导,诱导IFN的表达,从而激活IFN下游靶基因表达,同时诱导T细胞分化,激活机体特异抗病原体的适应性免疫途径. PRRs识别特异的PAMP后通过其特有的接头蛋白以及MyD88信号,引起IRF3、IRF7和NF-κB的激活,诱导IFN、IL、TNF的转录,激活非特异的抗病毒途径和特异的获得性免疫.在髓样树突细胞(mDC)中,IRF3、IRF5和IRF7通过下游MAVS信号共同调节Ι型干扰素应答.各类IRF在免疫应答中的作用见表1[2].表1 IRFs在免疫应答中的作用Fig.1 The role of IRFs in the immune responseIRFs免疫应答中的作用被调节的靶基因编码蛋白IRF1刺激IFN诱导基因的表达,与MyD88 结合,增强TLR依赖性的诱导GBP、iNOS、Caspase-1、Cox-2、CIITA、TAP1、和LMP2[3]IRF2拮抗IRF1,IRF9,减弱Ι型IFN应答,一些情况下又可以协同IRF1激活基因转录IL-12p40 和 Cox-2[2]IRF3诱导Ι型IFN、趋化因子、TLR和胞质DNA刺激IFN-α4、IFN-β 和 CXCL10[3]IRF4与MyD88 结合,负调控TLR依赖性的促炎细胞因子 IL-12p40、IL-6、和TNF-α[2]IRF5与MyD88 结合,正调控TLR依赖性的促炎细胞因子IL-12p40、IL-6、和TNF-αIRF6尚无报道IRF7与MyD88 结合,通过TLR途径诱导Ι型IFNΙ型IFNsIRF8与TRAF6 结合,DCs中TLR9信号途径所必需,刺激IFN-γ和PAMP诱导的基因,使DC产生Ι型IFNIL-12p40、iNOS、FcγRI、PML 和I IFNs等[4]IRF9 与STAT1 和 STAT2结合,诱导Ι型IFN产生OAS、PKR、IRF7等[5]2.2 IRFs与免疫细胞分化IRF在调节免疫细胞,如T、B细胞、NK细胞和巨噬细胞的分化发育和功能调节等方面起着重要的作用[2].不同的IRF通过不同的信号通路对不同的免疫细胞分化产生不同影响[2].通过对IRF8-/-、IRF4-/-和 IRF8-/-/IRF4-/-小鼠的研究发现,CD4+ DCs、CD8α+ DCs 和pDC的分化主要由IRF4、IRF8调控,同时也受IRF1和IRF2的调控.IRF8还能通过调节骨髓细胞分化凋亡的关键基因的表达调节骨髓细胞生长、分化和凋亡,如IRF8 直接诱导 Prdm1 、Etv3 、Blimp-1 和 METS的表达.NK细胞由IRF1,IRF2共同调节,IRF1诱导IL-15促进NK细胞分化,IRF2可能是通过细胞内在方式和促进细胞凋亡来促进NK细胞分化[2].B细胞分化也主要由IRF4和IRF8调节,IRF8能通过IECS直接与EBF的启动子结合,激活EBF的表达,EBF能激活与B细胞分化有关的基因,如 Pax5, Cd79a, Vpreb1.IRF4是B细胞成熟分化成浆细胞必需的转录因子,IRF4通过与Fas凋亡抑制分子(FAIM)IRF4结合位点结合,调节B细胞凋亡,IRF4结合位点突变,失去Fas基因对B细胞凋亡控制,导致B细胞增殖和恶变[6].2.3 IRFs与Th细胞分化IRFs通过IL、TGF、STAT等一系列细胞因子调节T细胞分化,这些因子也会影响IRFs的表达,形成一个复杂的网络调控系统[1].IRFl与IRF2能强烈启动Thl应答,IRFl促使编码IL-12的p35亚基、编码IL-12和IL-23的p40亚基及Caspase1基因上调,导致IFN-β产生增多,从而促进Th1细胞的分化.另外,IRFl刺激NOS的表达,IRF2通过IAD2介导的与IRF8的相互作用来增加IL-12和IL23的p40亚基表达,促进Th1的分化.IRF2也参与NOS的转录后修饰来增加NO的产量.反过来,IFN-β通过STATl的活性来诱导T 细胞中IRFl的表达,形成一个正反馈调节.IRF5和IRF8通过调节IL-l2促进向Th1细胞分化[1].IRF4主要参与Th2细胞分化.IRF4通过直接或间接机制结合在IL-4启动子的一个元件上,并与活化T细胞核因子(NFAT)和STAT6相互作用,触发IL-4的转录,从而促进CD4+ T细胞向Th2细胞分化.IRF4还能控制GATA3等Th2细胞分化的主要调节因子表达[7].IRFl通过结合IL-4启动子的3个不同位点从而抑制其转录,抑制CD4+T向Th2细胞分化,IRFl、IRF2使之向Th1方向偏移,IRF4使之向Th2方向偏移.它们共同作用,调节CD4+T细胞的Th1/Th2分化平衡.IRF4还可以调节Th9和Th17细胞的分化,IRF5对Th17细胞的分化也有促进作用,但是IRF8却有抑制CD4+ T向Th17分化的作用[8].IRF4对Treg也有调节作用,可能是通过控制Foxp3的表达而实现[7].2.4 IRFs与细胞生长、细胞凋亡和肿瘤研究发现,除IRF2、IRF4和V-IRF对肿瘤发生有促进作用外,其余的IRFs对肿瘤发生均有抑制作用[9].IRF1可与p53协同作用于p21启动子,抑制DNA损伤诱导的细胞增殖,表明IRF1通过参与p53通路而行使对细胞周期和凋亡的调控作用,IRF1的表达能诱导小鼠乳腺癌细胞凋亡和抑制肿瘤生长,IRF1的缺失可以明显增加肿瘤易感性[10].IRF3能增强病毒诱导的凋亡,而且这种调节作用不依赖于p53和IFN,当细胞DNA损伤时,DNA-PK可使IRF3磷酸化,磷酸化的IRF3从胞浆移位到胞核,激活凋亡相关基因的转录[11]. IRF5通过参与p53凋亡通路而促使肿瘤细胞凋亡.非磷酸化的IRF6能与Maspin协同调节细胞周期,对肿瘤的发生、进展产生抑制.P53能和IRF6结合,增强靶基因的表达[12],也能与Notch结合,调节对肿瘤的抑制[13].IRF7可被I型干扰素和TNF-α诱导,IRF7诱导的I型干扰素基因表观遗传沉默破坏了抑癌的I型干扰素途径. IRF8是I型干扰素基因的激活剂,可通过免疫调节发挥抗肿瘤活性,IRF8通过诱导 Cdkn2b 抑制细胞周期,促进细胞凋亡,通过抑癌基因Bcl2l 和 Bcl2 抑制癌症的发生,如抑制黑素瘤的发生[14].IRF2与IRFl的识别位点相同,一方面,IRF2会与IRFl竞争而抑制IRFl的转录,所以IRF2在肿瘤调节过程中具有与IRFl相反的作用,另一方面,IRF2能与Blimpl共同结合于IFN-β基因VRE的PRDI结构域,IRF2能抑制Blimpl的作用而引起细胞癌变.在HTLV-1感染的T细胞中,癌蛋白Tax能诱导IRF4 mRNA高表达,持续表达的IRF4抑制了G2-M 检验点基因cyclinBl和DNA修复基因Rad51,XRRPA、PCNA的表达,从而引起癌变.有研究报道IRF2和IRF4在抑制肿瘤中具有双重作用,IRF2可以通过调节p53的表达及泛素化抑制肿瘤[15, 16],IRF4则通过 p27KIP1途径抑制肿瘤细胞的增殖[17].V-IRF主要是通过抑制其他IRFs,如IRF3、IRF5、IRF7的活性,以及对p53和IFN的负调控来促进肿瘤的发生[18].2.5 IRFs与系统性红斑狼疮干扰素调节因子家族通过对淋巴细胞分化的调节,诱导IFN的产生及对IFN相关基因表达的调控,在系统性红斑狼疮(SLE)的发病机制中起作用[4].不同干扰素调节因子通过相同或不同的作用机制对SLE产生正性或负性调节.影响SLE的IRFs主要有IRF5、IRF7、IRF8.IRF5和IRF7可诱导IFN-α基因转录,而SLE病人血清中IFN-α大量增加,IRF5、IRF7变异或过表达会诱发SLE的产生.目前,“gene + antibody = high IFN-α”前反馈调节学说认为:SLE相关自身抗体通过TRP信号途径,使MyD88衔接蛋白与IRF5/IRF7相互作用,IRF5/IRF7磷酸化激活,导致IFN-α大量产生,最终诱发SLE的产生[19-21].在TRP应答中,缺乏IRF8的DC细胞不能产生炎症因子. 研究显示,SLE患者Th1的应答下降.IRF1-/-小鼠由于外周血中IL12p3缺乏,Th1细胞分化缺陷,具有Th2应答倾向,可推测IRFl功能缺陷是SLE患者Th1应答下降,Th2细胞优势活化的主要原因.由于IRF2具有下调Th2和上调Th1的功能,对SLE也具有抑制作用.IRF3对SLE具有双重作用,一方面,IRF3在病毒感染早期间接激活IRF7而产生IFN,IFN大量增加可能诱发SLE或加重SLE患者的病情,另一方面,IRF3可通过活化IL-12p35而使Th1的功能上调而抑制SLE,除病毒感染早期外,IRF3也是SLE的保护因子.SLE中,IRF4的高表达诱导IL-4的高表达,导致Th1应答低下,Th2应答增强,使B细胞的功能亢进而产生大量的自身抗体和免疫复合物.2.6 IRFs在其他疾病中的研究进展IRFs在许多疾病中发挥作用.IRF7通过TLR9和MyD88途径与FXR启动子结合,控制FXR的表达,具有抑制肠炎的作用[22].在气道平滑肌细胞中,IRF1的表达增加哮喘的发作[23];IRF3通过Th2途径应答气道过敏反应.通过对IRF3基因敲除小鼠和心脏IRF3过表达小鼠的研究发现,IRF3在心肌肥大模型小鼠中通过钝化ERK1/2 对心脏起防护作用,故IRF3可能作为预防和治疗心肌肥大的新靶点.3 总结与展望IRFs主要在免疫系统中通过对IFN的诱导、病毒防御、免疫调节、细胞分化、细胞生长与凋亡等调节许多疾病的发生,如IRF4是调节淋巴细胞分化的核心,可将IRF4作为一个靶位治疗或缓解某些炎症疾病[24].某些IRFs如IRFl、IRF2、IRF4、IRF8在Th细胞分化中起关键的调节作用,可将特定IRF作为一个理想的靶位干预Th分化,如用模拟IRFl、IRF2、IRF8的制剂或IRFl、IRF2、IRF8的激动剂可上调Th1细胞分化,拮抗IRF4的制剂如IRF4受体、抗IRF4抗体或增加IRF4结合蛋白等以减少Th2的应答和自身抗体的产生而治疗SLE、IRFl、IRF5、IRF7、IRF9等在病毒感染后诱导Ι型IFN的产生过程中起重要的作用,IFN-α的产生将诱发或者加重SLE患者的病情.IRF对肿瘤的调节主要是通过调节细胞周期、凋亡或抑癌基因p53而实现的,也有的是调节抗肿瘤免疫(如IRF8),或调节干扰素信号通路(如IRF9).深入了解IRFs的生物学功能不仅对宿主免疫调节研究具有重要意义,而且可为癌症和许多疾病的治疗提供分子基础.参考文献【相关文献】[1] Zhang R, Chen K, Peng L, et al. Regulation of T helper cell differentiation by interferon regulatory factor family members[J]. Immunol Res, 2012,54(1/3):169-176.[2] Savitsky D,Tamura T,Yanai H,et al. Regulation of immunity and oncogenesis by the IRFtranscription factor family[J]. Cancer Immunol Immun, 2010,59(4):489-510.[3] Saha B, Jyothi Prasanna S, Chandrasekar B, et al. Gene modulation and immunoregulatory roles of interferon gamma[J]. Cytokine, 2010,50(1):1-14.[4] Wang H, Morse H C 3rd. IRF8 regulates myeloid and B lymphoid lineage diversification[J]. Immunol Res, 2009,43(1/3):109-117.[5] Stark G R, Darnell J E Jr. The JAK-STAT pathway at twenty[J]. Immunity, 2012,36(4):503-514.[6] Kaku H, Rothstein T L. Fas apoptosis inhibitory molecule expression in B cells is regulated through IRF4 in a feed-forward mechanism[J]. J Immunol, 2009,183(9):5575-5581.[7] Zheng Y, Chaudhry A, Kas A, et al. Regulatory T-cell suppressor program co-opts transcription factor IRF4 to control T(H)2 responses[J]. Nature, 2009,458(7236):351-356.[8] Ouyang X, Zhang R, Yang J, et al. Transcription factor IRF8 directs a silencing programme for TH17 cell differentiation[J]. Nat Commun, 2011,2:314.[9] Yanai H, Negishi H, Taniguchi T. The IRF family of transcription factors: Inception, impact and implications in oncogenesis[J]. Oncoimmunology, 2012,1(8):1376-1386. [10] Narayan V, Halada P, Hernychova L, et al. A multiprotein binding interface in an intrinsically disordered region of the tumor suppressor protein interferon regulatory factor-1[J]. J Biol Chem, 2011,286(16):14291-14303.[11] Tokunaga T, Naruke Y, Shigematsu S, et al. Aberrant expression of interferon regulatory factor 3 in human lung cancer[J]. Biochem Biophys Res Commun,2010,397(2):202-207.[12] Moretti F, Marinari B, Lo Iacono N, et al. A regulatory feedback loop involving p63 and IRF6 links the pathogenesis of 2 genetically different human ectodermal dysplasias[J]. J Clin Invest, 2010,120(5):1570-1577.[13] Restivo G, Nguyen B C, Dziunycz P, et al. IRF6 is a mediator of Notch pro-differentiation and tumour suppressive function in keratinocytes[J]. EMBO J,2011,30(22):4571-4585.[14] Mattei F, Schiavoni G, Sestili P, et al. IRF-8 controls melanoma progression by regulating the cross talk between cancer and immune cells within the tumor microenvironment[J]. Neoplasia, 2012,14(12):1223-1235.[15] Guichard C, Amaddeo G, Imbeaud S, et al. Integrated analysis of somatic mutations and focal copy-number changes identifies key genes and pathways in hepatocellular carcinoma[J]. Nat Genet, 2012,44(6):694-698.[16] Pettersson S, Kelleher M, Pion E, et al. Role of Mdm2 acid domain interactions in recognition and ubiquitination of the transcription factor IRF-2[J]. Biochem J,2009,418(3):575-585.[17] Pathak S, Ma S, Trinh L, et al. IRF4 is a suppressor of c-Myc induced B cell leukemia[J]. PLoS One, 2011,6(7):e22628.[18] Wies E, Hahn A S, Schmidt K, et al. The Kaposi′s sarcoma-associated herpesvirus-encoded vIRF-3 inhibits cellular IRF-5[J]. J Biol Chem, 2009,284(13):8525-8538.[19] Salloum R, Niewold T B. Interferon regulatory factors in human lupus pathogenesis[J]. Transl Res, 2011,157(6):326-331.[20] Cham C M, Ko K, Niewold T B. Interferon regulatory factor 5 in the pathogenesis of systemic lupus erythematosus[J]. Clin Dev Immunol, 2012,2012:780436.[21] Salloum R, Franek B S, Kariuki S N, et al. Genetic variation at the IRF7/PHRF1 locus is associated with autoantibody profile and serum interferon-alpha activity in lupus patients[J]. Arthritis Rheum, 2010,62(2):553-561.[22] Renga B, Mencarelli A, Cipriani S, et al. The bile acid sensor FXR is required for immune-regulatory activities of TLR-9 in intestinal inflammation[J]. PLoS One,2013,8(1):e54472.[23] Wang L J, Hao L, Li H T, et al. Expressions of OB-R, IRF-1 and GR-beta in airway smooth muscle cells of obese rats with asthma[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2012,28(10):1037-1040.[24] Xu D, Meyer F, Ehlers E, et al. Interferon regulatory factor 4 (IRF-4) targets IRF-5 to regulate Epstein-Barr virus transformation[J]. J Biol Chem, 2011,286(20):18261-18267.。
抗体亲和力检测方法

抗体亲和力检测方法
抗体亲和力检测方法有多种,以下是其中一些常见的:
1. ELISA法:酶联免疫吸附试验(Enzyme-Linked Immunosorbent Assay,简称ELISA)是一种常用的抗体亲和力检测方法。
该方法利用特异性抗原与待测抗体之间的结合反应来测定抗体的亲和力。
在ELISA中,将待测抗体与已知浓度的抗原混合后加入微孔板中,然后用酶标记的二抗或底物进行反应,最后通过测量吸光度值来确定待测抗体的亲和力。
2. SPR法:表面等离子共振技术(Surface Plasmon Resonance,简称SPR)是一种基于光学原理的抗体亲和力检测方法。
该方法利用金属薄膜表面的等离子体共振现象来检测分子间的相互作用。
在SPR中,将待测抗体和已知浓度的抗原分别注入到两个不同的通道中,然后通过测量反射光强度的变化来确定待测抗体的亲和力。
3. Biacore法:Biacore是一种基于表面等离子共振技术的高通量筛选平台,可以同时检测多个样品中的抗体亲和力。
在Biacore中,将待测抗体和已知浓度的抗原分别注入到不同的通道中,然后通过测量反射光强度的变化来确定待测抗体的亲和力。
4. FRET法:荧光共振能量转移(Fluorescence Resonance Energy Transfer,简称FRET)是一种基于荧光共振能量转移原理的抗体亲和力检测方法。
该方法利用荧光标记的抗原和待测抗体之间的相互作用来测定抗体的亲和力。
在FRET中,将待测抗体和已知浓度的抗原分别注入到两个不同的通道中,然后通过测量荧光信号的变化来确定待测抗体的亲和力。
人IFN-γ检测试剂盒ELISA法说明书
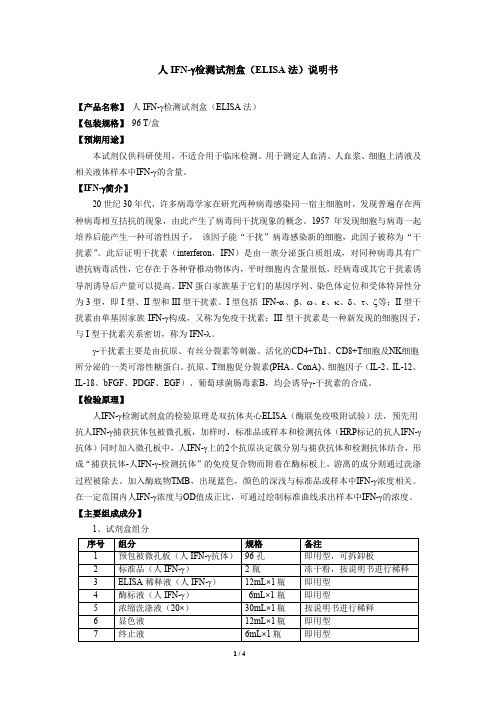
人IFN-γ检测试剂盒(ELISA法)说明书【产品名称】人IFN-γ检测试剂盒(ELISA法)【包装规格】96 T/盒【预期用途】本试剂仅供科研使用,不适合用于临床检测。
用于测定人血清、人血浆、细胞上清液及相关液体样本中IFN-γ的含量。
【IFN-γ简介】20世纪30年代,许多病毒学家在研究两种病毒感染同一宿主细胞时,发现普遍存在两种病毒相互拮抗的现象,由此产生了病毒间干扰现象的概念。
1957年发现细胞与病毒一起培养后能产生一种可溶性因子,该因子能“干扰”病毒感染新的细胞,此因子被称为“干扰素”。
此后证明干扰素(interferon,IFN)是由一族分泌蛋白质组成,对同种病毒具有广谱抗病毒活性,它存在于各种脊椎动物体内,平时细胞内含量很低,经病毒或其它干扰素诱导剂诱导后产量可以提高。
IFN蛋白家族基于它们的基因序列、染色体定位和受体特异性分为3型,即I型、II型和III型干扰素。
I型包括IFN-α、β、ω、ε、κ、δ、τ、ζ等;II型干扰素由单基因家族IFN-γ构成,又称为免疫干扰素;III型干扰素是一种新发现的细胞因子,与I型干扰素关系密切,称为IFN-λ。
γ-干扰素主要是由抗原、有丝分裂素等刺激、活化的CD4+Th1、CD8+T细胞及NK细胞所分泌的一类可溶性糖蛋白。
抗原、T细胞促分裂素(PHA、ConA)、细胞因子(IL-2、IL-12、IL-18、bFGF、PDGF、EGF)、葡萄球菌肠毒素B,均会诱导γ-干扰素的合成。
【检验原理】人IFN-γ检测试剂盒的检验原理是双抗体夹心ELISA(酶联免疫吸附试验)法,预先用抗人IFN-γ捕获抗体包被微孔板,加样时,标准品或样本和检测抗体(HRP标记的抗人IFN-γ抗体)同时加入微孔板中,人IFN-γ上的2个抗原决定簇分别与捕获抗体和检测抗体结合,形成“捕获抗体-人IFN-γ-检测抗体”的免疫复合物而附着在酶标板上,游离的成分则通过洗涤过程被除去。
人β干扰素IFN-β酶联免疫分析

人β干扰素(IFN-β)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用。
检测范围:96T1μg/L -40μg/L使用目的:本试剂盒用于测定人血清、血浆及相关液体样本中β干扰素(IFN-β)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中人β干扰素(IFN-β)水平。
用纯化的人β干扰素(IFN-β)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入β干扰素(IFN-β),再与HRP标记的β干扰素(IFN-β)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的β干扰素(IFN-β)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人β干扰素(IFN-β)浓度。
试剂盒组成标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP)活性。
操作步骤1.标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀2.加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
在酶标包被板上标准品准确加样50μl,待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3.温育:用封板膜封板后置37℃温育30分钟。
4.配液:将30倍浓缩洗涤液用蒸馏水30倍稀释后备用5.洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干。
6.加酶:每孔加入酶标试剂50μl,空白孔除外。
7.温育:操作同3。
8.洗涤:操作同5。
9.显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.10.终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人干扰素调节因子(IRF)酶联免疫分析(ELISA)
试剂盒使用说明书
本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中人干扰素调节因子(IRF)含量。
实验原理:
本试剂盒应用双抗体夹心法测定标本中人干扰素调节因子(IRF)水平。
用纯化的人干扰素调节因子(IRF)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入干扰素调节因子(IRF),再与HRP 标记的干扰素调节因子(IRF)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的干扰素调节因子(IRF)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中人干扰素调节因子(IRF)浓度。
试剂盒组成:
样本处理及要求:
1.血清:室温血液自然凝固10-20 分钟,离心20 分钟左右(2000-3000 转/分)。
仔细收集上清,保存过程中如出现沉淀,应再次离心。
2.血浆:应根据标本的要求选择EDTA、者柠檬酸钠或肝素作为抗凝剂,混合10-20 分钟后,离心20 分钟左右(2000-3000 转/分)。
仔细收集上清,保存过程中如有沉淀形成,应该再次离心。
3.尿液:用无菌管收集,离心20 分钟左右(2000-3000 转/分)。
仔细收集上清,保存过程中如有沉淀形成,应再次离心。
胸腹水、脑脊液参照实行。
4.细胞培养上清:检测分泌性的成份时,用无菌管收集。
离心20 分钟左右(2000-3000 转/分)。
仔细收集上清。
检测细胞内的成份时,用PBS(PH7.2-7.4)稀释细胞悬液,细胞浓度达到100 万/ml 左右。
通过反复冻融,以使细胞破坏并放出细胞内成份。
离心20 分钟左右(2000-3000 转/分)。
仔细收集上清。
保存过程中如有沉淀形成,应再次离心。
5.组织标本:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备
用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
离心20 分钟左右(2000-3000 转/分)。
仔细收集上清。
分装后一份待检测,其余冷冻备用。
操作步骤:
1. 标准品的稀释与加样:在酶标包被板上设标准品孔10 孔,在第一、第二孔中分别加标准品100μl,然后在第一、第二孔中加标准品稀释液50μl,混匀;然后从第一孔、第二孔中各取100μl 分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50μl,混匀;然后在第三孔和第四孔中先各取50μl 弃掉,再各取50μl 分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液50ul,混匀;混匀后从第五、第六孔中各取50μl 分别加到第七、第八孔中,再在第七、第八孔中分别加标准品稀释液50μl,混匀后从第七、第八孔中分别取50μl 加到第九、第十孔中,再在第九第十孔分别加标准品稀释液50μl,混匀后从第九第十孔中各取50μl 弃掉。
2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。
在酶标包被板上待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5 倍)。
加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。
3. 温育:用封板膜封板后置37℃温育30 分钟。
4. 配液:将30(48T 的20 倍)倍浓缩洗涤液用蒸馏水30(48T 的20 倍)倍稀释后备用。
5. 洗涤:小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 秒后弃去,如此重复5 次,拍干。
6. 加酶:每孔加入酶标试剂50μl,空白孔除外。
7. 温育:操作同3。
8. 洗涤:操作同5。
9. 显色:每孔先加入显色剂A50μl,再加入显色剂B50μl,轻轻震荡混匀,37℃避光显色15分钟.
10. 终止:每孔加终止液50μl,终止反应(此时蓝色立转黄色)。
11. 测定:以空白空调零,450nm 波长依序测量各孔的吸光度(OD 值)。
测定应在加终止液后15 分钟以内进行。
注意事项:
1.试剂盒从冷藏环境中取出应在室温平衡15-30 分钟后方可使用,酶标包被板开封后如未用完,板条应装入密封袋中保存。
2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。
3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。
一次加样时间最好控制在5 分钟内,如标本数量多,推荐使用排枪加样。
4.请每次测定的同时做标准曲线,最好做复孔。
如标本中待测物质含量过高(样本OD 值大于标准品孔第一孔的OD 值),请先用样品稀释液稀释一定倍数(n 倍)后再测定,计算时请最后乘以总稀释倍数(×n×5)。
5.封板膜只限一次性使用,以避免交叉污染。
6.底物请避光保存。
7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准.
8.所有样品,洗涤液和各种废弃物都应按传染物处理。
9.本试剂不同批号组分不得混用。
10. 如与英文说明书有异,以英文说明书为准。
计算:
以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值
由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD 值计算出标准曲线的直线回归方程式,将样品的OD 值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
保存条件及有效期:
1.试剂盒保存:;2-8℃。
2.有效期:6 个月。
