高等有机化学课件立体化学
合集下载
《立体化学》课件

化学是研究物质的组成、性质和变化的科 学领域。
了解原子、分子、元素、化合物等基础概 念,以及化学反应和化学方程式的表示方 法。
立体化学的基本原理
1 空间取向
探讨原子和键在空间中 的相互关系,以及分子 空间构型的影响。
2 手性性质
3 立体异构体
认识手性分子和对映体, 以及手性的重要性。
了解不同类型的立体异 构体,如构象异构体和 对映异构体,并研究它 们的性质和特点。
《立体化学》PPT课件
欢迎来到《立体化学》PPT课件!在本课程中,我们将从化学的基础概念开 始,探讨立体化学的基本原理,并深入研究分子结构、手性分子、立体异构 体以及立体对反应机理的影响。最后,我们还将探讨立体化学在药物设计和 天然产物 基础概念
以及它们在化学反应中的影响。
3
构象异构体
分析构象异构体的形成原理和常见示 例,如顺式和反式异构体。
光学异构体
讨论光学异构体的旋光性质,包括D和L-系列化合物。
反应机理中的立体影响
反应路径
探究反应路径中立体构型对反应速率和产物选择 性的影响。
过渡态理论
了解过渡态理论以及过渡态的构象和立体要求。
应用:药物设计和天然产物的活性成分
药物设计
介绍立体化学在药物设计中的重要性,以及 立体异构体对药效的影响。
天然产物
研究天然产物中的活性成分,如碳水化合物 和天然产物的手性性质。
分子结构和键的构型
分子结构
探索分子的结构和形状,以及化学键的构型和键 长。
球棍模型
使用球棍模型来可视化分子结构和化学键的空间 排列。
手性分子和对映体
手性分子
解释什么是手性分子,以及手性分子的定义和性质。
有机化学课件立体化学ppt课件

量子化学计算
基于量子力学原理计算分子的电子结构和性质,可深入揭示有机 物的立体化学本质和反应机理。
人工智能与机器学习
结合大数据和机器学习算法,可加速新有机物的设计和合成,为 立体化学研究提供新的思路和方法。
06
总结与展望:立体化学发展趋势和挑 战
当前存在问题和挑战
01
立体化学合成方法有限
目前立体化学合成方法仍然相对有限,对于复杂分子的合成仍面临较大
05
立体化学分析方法与技术进展
传统分析方法回顾(如:极谱法、色谱法等)
极谱法
利用物质在电解过程中的电极电位与浓度之间的关系进行分析,主要用于无机物和有机物的定性和定量分析。
色谱法
基于物质在固定相和流动相之间的分配平衡,通过流动相的洗脱将不同物质分离,常用于复杂样品的分离和纯化。
现代波谱技术在立体化学中应用(如
立体选择性合成是获得具有特定立体构型药物分子的关键步骤,对于提高药物疗效和降低副 作用具有重要意义。
面临的挑战
立体选择性合成面临着反应条件苛刻、合成步骤繁琐、产物纯度难以控制等挑战。
机遇与发展
随着有机合成化学、计算化学等学科的不断发展,立体选择性合成的方法和技术也在不断改 进和完善,为药物研发提供了更多的机遇和可能性。例如,利用不对称催化、新型手性配体 等策略,可以实现高效、高选择性的立体选择性合成。
对称性与手性判断
对称性判断
通过观察分子是否具有对称轴、对称 面等对称因素来判断。
手性判断
通过判断分子是否具有手性碳原子或其 他不对称因素来判断。具有手性碳原子 的分子一定是手性分子,但手性分子不 一定具有手性碳原子。
立体化学原理ห้องสมุดไป่ตู้应用
立体化学原理
基于量子力学原理计算分子的电子结构和性质,可深入揭示有机 物的立体化学本质和反应机理。
人工智能与机器学习
结合大数据和机器学习算法,可加速新有机物的设计和合成,为 立体化学研究提供新的思路和方法。
06
总结与展望:立体化学发展趋势和挑 战
当前存在问题和挑战
01
立体化学合成方法有限
目前立体化学合成方法仍然相对有限,对于复杂分子的合成仍面临较大
05
立体化学分析方法与技术进展
传统分析方法回顾(如:极谱法、色谱法等)
极谱法
利用物质在电解过程中的电极电位与浓度之间的关系进行分析,主要用于无机物和有机物的定性和定量分析。
色谱法
基于物质在固定相和流动相之间的分配平衡,通过流动相的洗脱将不同物质分离,常用于复杂样品的分离和纯化。
现代波谱技术在立体化学中应用(如
立体选择性合成是获得具有特定立体构型药物分子的关键步骤,对于提高药物疗效和降低副 作用具有重要意义。
面临的挑战
立体选择性合成面临着反应条件苛刻、合成步骤繁琐、产物纯度难以控制等挑战。
机遇与发展
随着有机合成化学、计算化学等学科的不断发展,立体选择性合成的方法和技术也在不断改 进和完善,为药物研发提供了更多的机遇和可能性。例如,利用不对称催化、新型手性配体 等策略,可以实现高效、高选择性的立体选择性合成。
对称性与手性判断
对称性判断
通过观察分子是否具有对称轴、对称 面等对称因素来判断。
手性判断
通过判断分子是否具有手性碳原子或其 他不对称因素来判断。具有手性碳原子 的分子一定是手性分子,但手性分子不 一定具有手性碳原子。
立体化学原理ห้องสมุดไป่ตู้应用
立体化学原理
高等有机化学立体化学

∴既无对称面也没有对称中心的,一般可判定为是手性分子。
分子的手性是对映体存在的必要和充分条件。
(四)对映体
实验事实:
同为乳酸, 为什么会具 有不同的光 学性质呢?
CH3 CH COOH
OH α 羟基丙酸 ( 乳酸)
来源 从肌肉中得到的肌肉乳酸 葡萄糖发酵得到的乳酸 酸牛奶中得到的乳酸
旋光性 。
+ 3.82 。
HO H
CH
3
3
横前 竖后
CHO
CHO
H
C CH3 NH2
Fischer H 投 影 式
NH2 CH3
CHO
CHO
CHO
H
C CH3 NH2
Fischer H N H 2 投 影 式
NCH H23 CH H 3
使用费歇尔投影式应注意的问题: 基团的位置关系是“横前竖后” 不能离开纸平面翻转180°,也不能在纸平面上旋转 90°或270°与原构型相比。 将投影式在纸平面上旋转180°,仍为原构型。
5. 比旋光度(specific rotation)
为]来表示:—— 在一定温度和波长(通常为钠光灯,
波长为589 nm)条件下,样品管长度为1dm,样品浓度
为1g•ml-1时测得的旋光度。是一物理常数。 D --- 钠光源,波长为589nm;
aDT
3.82
。 0
COOH
COOH
HC
H
HO C3H
OH
C3 H
-
COOH
COOH
C3 H
H OH
CH H3C OH
-
旋光性与比旋光度
一、旋光性 1. 偏振光( plane-polarized light ) 光是一种电磁波,光波的振动方向与光的前进方向垂直。
分子的手性是对映体存在的必要和充分条件。
(四)对映体
实验事实:
同为乳酸, 为什么会具 有不同的光 学性质呢?
CH3 CH COOH
OH α 羟基丙酸 ( 乳酸)
来源 从肌肉中得到的肌肉乳酸 葡萄糖发酵得到的乳酸 酸牛奶中得到的乳酸
旋光性 。
+ 3.82 。
HO H
CH
3
3
横前 竖后
CHO
CHO
H
C CH3 NH2
Fischer H 投 影 式
NH2 CH3
CHO
CHO
CHO
H
C CH3 NH2
Fischer H N H 2 投 影 式
NCH H23 CH H 3
使用费歇尔投影式应注意的问题: 基团的位置关系是“横前竖后” 不能离开纸平面翻转180°,也不能在纸平面上旋转 90°或270°与原构型相比。 将投影式在纸平面上旋转180°,仍为原构型。
5. 比旋光度(specific rotation)
为]来表示:—— 在一定温度和波长(通常为钠光灯,
波长为589 nm)条件下,样品管长度为1dm,样品浓度
为1g•ml-1时测得的旋光度。是一物理常数。 D --- 钠光源,波长为589nm;
aDT
3.82
。 0
COOH
COOH
HC
H
HO C3H
OH
C3 H
-
COOH
COOH
C3 H
H OH
CH H3C OH
-
旋光性与比旋光度
一、旋光性 1. 偏振光( plane-polarized light ) 光是一种电磁波,光波的振动方向与光的前进方向垂直。
高等有机化学课件3-第三章 立体化学

联苯类化合物
NO2 CO2H
NO2 CO2H
有对称面(能同镜影分子重选),非手性。
NO2 CO2H
CO2H NO2
CO2H NO2
NO2 CO2H
手性分子
6
Br Br 6'
Br
Br
2' 2 Cl Cl
Cl
Cl
(R)-2,2’-二氯-6,6’-二溴联苯
(R)-2,2’-dibromo-6,6’-dichlorobiphenyl
构型异构: 顺反异构: H
Cl CH3 Cl H
COOH H OH CH3 HO
CH3 H
COOH H CH3
H
对映异构:
D-(-)-乳酸 mp: 52.8° 非对映异构: H
H COOH OH OH CH3
L-(+)-乳酸
COOH H HO OH H CH3
构象异构:
H H
CH3 H H CH3
V U X
R R
V W Z W Z
S S
V
V W X W X
S R
U X
U Z
R S
U Z
Y (A)
Y ( B)
Y (C)
Y ( D)
A和B(C和D)为对映异构体,A和C或者D(B和 C或者D)为非对映异构体。
• 对映异构体之间有相同的性质(除了对偏 振光和手性环境),然而非对映异构体具 有不同的熔点、沸点、溶解度、反应性等 物理、化学及光谱性质。 • 多手性中心的分子最多具有2n个异构体(n =分子中手性中心数),但有时分子内存 在着对称面,这时异构体数减少。
今有两试管分别置入(-)乳酸和(+)乳酸,我 们如何知道它们的构型?
NO2 CO2H
NO2 CO2H
有对称面(能同镜影分子重选),非手性。
NO2 CO2H
CO2H NO2
CO2H NO2
NO2 CO2H
手性分子
6
Br Br 6'
Br
Br
2' 2 Cl Cl
Cl
Cl
(R)-2,2’-二氯-6,6’-二溴联苯
(R)-2,2’-dibromo-6,6’-dichlorobiphenyl
构型异构: 顺反异构: H
Cl CH3 Cl H
COOH H OH CH3 HO
CH3 H
COOH H CH3
H
对映异构:
D-(-)-乳酸 mp: 52.8° 非对映异构: H
H COOH OH OH CH3
L-(+)-乳酸
COOH H HO OH H CH3
构象异构:
H H
CH3 H H CH3
V U X
R R
V W Z W Z
S S
V
V W X W X
S R
U X
U Z
R S
U Z
Y (A)
Y ( B)
Y (C)
Y ( D)
A和B(C和D)为对映异构体,A和C或者D(B和 C或者D)为非对映异构体。
• 对映异构体之间有相同的性质(除了对偏 振光和手性环境),然而非对映异构体具 有不同的熔点、沸点、溶解度、反应性等 物理、化学及光谱性质。 • 多手性中心的分子最多具有2n个异构体(n =分子中手性中心数),但有时分子内存 在着对称面,这时异构体数减少。
今有两试管分别置入(-)乳酸和(+)乳酸,我 们如何知道它们的构型?
有机化学立体化学PPT课件

官能团对分子极性和溶解性的影响
03
官能团的电性和极性会影响分子的极性和溶解性,从而影响分
子在溶液中的行为。
官能团间相互作用和转化规律
官能团间的相互作用
不同官能团之间可能存在相互作用,如共轭效应、诱导效应 等,这些相互作用会影响分子的性质和反应。
官能团的转化规律
在一定条件下,官能团可以发生转化,如醇氧化成醛、醛还 原成醇等,这些转化规律是有机化学中的重要内容。
不对称烷基化反应
通过手性辅剂或催化剂的作用,实现烷基化反应的不对称诱导, 生成具有手性中心的产物。
不对称氧化反应
利用手性氧化剂或催化剂对底物进行不对称氧化,生成具有手性 中心的产物。
立体选择性反应在药物合成中应用
手性药物合成
手性药物具有特定的生理活性和药效,其合成过程中常涉及立体选择性反应。例如,通过 不对称催化氢化合成治疗心血管疾病的L-多巴等手性药物。
异构体间相互转化机理
包括化学键的断裂和形成、原子或基团的迁移等过程。
异构体间相互转化实例
如顺反异构体之间可以通过光照或加热等条件进行相互转 化;对映异构体之间可以通过手性试剂进行拆分或外消旋 化等过程进行相互转化。
05 立体选择性反应 原理及应用
立体选择性反应概念及分类
立体选择性反应定义
指在一定条件下,反应物分子中某一特定立体构型的原子或基团优先发生反应,生成具有特定立体构型的产物的 化学反应。
碳-碳单键旋转自由度受限情况
碳-碳单键 旋转自由度受限,导致有机分子具有特定构象。
环状化合物中碳原子构型判断
环状化合物中碳原子构型判断方法
通过比较环上相邻碳原子的相对构型,可以确定整个环状化合物的立体构型。
环状化合物中碳原子构型与性质关系
高等有机化学第三章立体化学

高等有机化学第三章立体化学
contents
目录
• 立体化学基本概念 • 碳原子立体化学 • 手性分子结构与性质 • 立体化学在有机合成中应用 • 立体化学在药物设计中的应用 • 实验方法与技巧
01
立体化学基本概念
立体异构现象
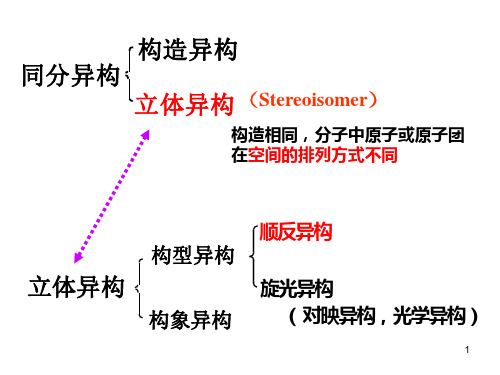
立体异构体
分子式相同,但空间排列不同的化合 物,具有不同的物理和化学性质。
碳原子手性判断
对称面与对称中心
若一个分子中存在一个对称面或对称中心,则该分子不具有旋光性。对称面是指能将分子分为两个互为镜像的部 分的平面;对称中心是指能将分子中任意一点与另一点重合的点。
潜手性与非对映异构体
潜手性是指分子中某些基团可以围绕单键旋转而产生手性的现象。非对映异构体是指具有相同分子式、不同结构 且不能通过旋转操作相互转化的立体异构体。
感谢观看
。
化学性质差异
手性分子在化学反应中可能表 现出不同的反应速率和选择性
。
生物活性差异
许多生物活性物质都是手性的 ,其生物活性与手性密切相关 ,不同手性分子的生物活性可
能存在显著差异。
手性识别与拆分方法
手性识别
通过对手性分子的结构和性质进行分析,确定其手性特征。常见的方法包括X射线晶体学、圆二色光 谱、核磁共振等。
构型与构象
构型
分子中原子或基团在空间中的相 对位置关系,是固定的空间排列
。
构象
由于单键旋转而产生的不同空间排 列,是动态的空间排列。
构型与构象的关系
构型是构象的基础,构象是构型的 动态表现。不同的构型可能产生不 同的构象,而同一构型也可能产生 多种不同的构象。
02
碳原子立体化学
碳原子杂化类型
sp杂化
03
contents
目录
• 立体化学基本概念 • 碳原子立体化学 • 手性分子结构与性质 • 立体化学在有机合成中应用 • 立体化学在药物设计中的应用 • 实验方法与技巧
01
立体化学基本概念
立体异构现象
立体异构体
分子式相同,但空间排列不同的化合 物,具有不同的物理和化学性质。
碳原子手性判断
对称面与对称中心
若一个分子中存在一个对称面或对称中心,则该分子不具有旋光性。对称面是指能将分子分为两个互为镜像的部 分的平面;对称中心是指能将分子中任意一点与另一点重合的点。
潜手性与非对映异构体
潜手性是指分子中某些基团可以围绕单键旋转而产生手性的现象。非对映异构体是指具有相同分子式、不同结构 且不能通过旋转操作相互转化的立体异构体。
感谢观看
。
化学性质差异
手性分子在化学反应中可能表 现出不同的反应速率和选择性
。
生物活性差异
许多生物活性物质都是手性的 ,其生物活性与手性密切相关 ,不同手性分子的生物活性可
能存在显著差异。
手性识别与拆分方法
手性识别
通过对手性分子的结构和性质进行分析,确定其手性特征。常见的方法包括X射线晶体学、圆二色光 谱、核磁共振等。
构型与构象
构型
分子中原子或基团在空间中的相 对位置关系,是固定的空间排列
。
构象
由于单键旋转而产生的不同空间排 列,是动态的空间排列。
构型与构象的关系
构型是构象的基础,构象是构型的 动态表现。不同的构型可能产生不 同的构象,而同一构型也可能产生 多种不同的构象。
02
碳原子立体化学
碳原子杂化类型
sp杂化
03
有机化学ppt课件第八章立体化学

05
立体选择性合成策略与方 法
不对称合成策略简介
不对称合成定义
利用非手性原料合成具有特定构型手性化合物的 方法。
不对称合成意义
获得单一手性化合物,避免消旋体的产生,提高 药物疗效和降低副作用。
不对称合成策略
手性源合成法、手性辅剂诱导合成法、动力学拆 分和热力学拆分方法等。
手性源合成法
手性源概念
农业科学
立体化学在农业科学中也有潜在 的应用价值,例如通过研究农药 和化肥的立体结构来提高其效果 和降低对环境的负面影响。
THANKS
感谢观看
构型对化合物性质的影响
不同构型的碳原子在化合物中具有不 同的化学和物理性质,如旋光性、反 应活性等。
Fisher
Fisher投影式是一种表示有机化合物立体结构的方法,通过横线
和竖线表示碳原子的键合关系。
Fisher投影式的书写规则
02
在Fisher投影式中,横线代表伸向纸面前方的键,竖线代表伸向
具有手性的起始原料, 可提供手性中心。
手性源合成法原理
以手性源为原料,通过 保留或转化其手性中心 ,合成目标手性化合物 。
手性源合成法应用
天然产物全合成、药物 合成等。
手性辅剂诱导合成法
01
手性辅剂概念
在反应中能与底物形成非对映异构体,从而控制反应立体选择性的添加
剂。
02
手性辅剂诱导合成法原理
手性辅剂与底物形成非对映异构体,利用非对映异构体之间的性质差异
判断手性碳原子构 型
根据旋光度的正负及大小,结合其他信息判断手性碳原子 的构型。
注意事项
旋光法只能判断化合物是否具有旋光性,不能确定其绝对 构型。
X射线衍射法确定绝对构型
有机化学立体化学课件
(c)和(d)之间是何种关系?
30
将 (d) 在纸平面上旋转180,就和 (c) 完全相同。
CCOOOOHH
COCOOHOH
COOH
HH OOHH HHOO H H
H OH H
HHO OHH
HHO OHH
H OH H
CCOOOOHH
COCOOHOH
COOH
(c)
(d)
象 (c) 这种构型的分子, 虽然有两个手性中心, 但作 为分子整体来说是非手性的。 (c) 称为内消旋化合 物 (meso compound)。
8
问题:下列化合物哪些含手性碳原子?
1. CH3CHCH2CH3
*CH3
2.CH3CHClCH2CH3
**
3. CH3-CH-CH-CH2CH3 OH OH
有对称因素的分
有手性碳就一定有手性吗?
子没有手性
三、对称面和非手性分子
有对称面的分子与它的镜像能重合,因此没有对 映异构现象,称为非手性分子
对称因素
透视式是书写立体结构式常见的方法之一。
应注意它的书写方法,通常实线 “” 代表位 于纸平面上的键;虚线 “ ” (或“ ”) 代表 伸向纸平面后方的键,楔形线 “ ” 代表伸 向纸平面前方的键。
CO2H
CO2H
Cl
Cl
CH HC
I C Br Br C I
H3C OH
HO
CH3
H
H
13
(三) 费歇尔投影式 横前竖后
纯液体为密度 通常还要注明溶剂
比例常数 [α] 称为比旋光度。它是单位长度和单 位浓度下的旋光度。
如:[α]D20 = +98.3o (C, 0.05, CH3OH)
高等有机化学课件立体化学

VS
间位定位效应
当苯环上连有某些特定取代基时,如硝基 、羧基、磺酸基等,这些取代基会通过吸 电子效应降低苯环的反应性,使得新引入 的取代基主要进入苯环的间位。
2024/1/25
20
多环芳烃空间排列方式
平行排列
多环芳烃中,相邻的苯环可能以平行的方式 排列,这种排列方式使得分子具有较大的共 轭体系,稳定性较高。
交错排列
多环芳烃中,相邻的苯环也可能以交错的方 式排列,这种排列方式使得分子具有较小的 共轭体系,但可能具有某些特殊的性质或反 应活性。
2024/1/25
21
非苯芳烃结构特点
杂原子取代
非苯芳烃中,可能含有杂原子如氮、氧、硫等取代苯环上的碳原子 ,这些杂原子的存在会影响分子的电子分布和反应性。
环外双键
构效关系是指药物分子的化学结构与生物活性之 间的关系。在手性药物设计中,需要考虑手性中 心对药物活性的影响,以及不同手性构型对药效 的差异。
2024/1/25
手性匹配是指药物分子与靶标生物大分子的手性 构型相匹配,从而实现药物与靶标的特异性结合 。这可以通过计算机模拟和实验筛选等方法进行 预测和优化。
2024/1/25
5
立体异构现象
构型异构
指分子式相同但构型不同的异构现象。构型异构主要包括手性异构和非手性异构,如旋光异构和顺反 异构等。构型异构体具有不同的物理和化学性质,如熔点、沸点、溶解度、化学反应活性等。
构象异构
指分子式相同且构型也相同,但由于单键旋转而产生的不同空间排列的异构现象。构象异构体具有相 同的物理和化学性质,但在某些特定条件下可能表现出不同的反应活性或生物活性。例如,环己烷的 船式构象和椅式构象就是典型的构象异构体。
2024/1/25
高等有机第三章立体化学ppt课件

结构解析与精修 利用直接法、帕特森函数等方法解析晶体结构,并通过最 小二乘法进行结构精修。
核磁共振波谱在确定结构中应用
核磁共振原理
利用核自旋磁矩在外磁 场中发生能级分裂,通 过射频脉冲激发核自旋 跃迁,产生核磁共振信 号。
数据收集与处理
通过调整射频脉冲频率 和磁场强度收集不同核 的核磁共振信号,并利 用计算机程序进行数据 处理和谱图分析。
糖类的立体化学与生物活 性
糖类的立体构型对其生物活性具有重要影响, 如多糖的免疫调节作用、糖蛋白的识别作用等。
生物活性小分子中立体化学问题
手性小分子的生物活性
许多生物活性小分子具有手性中心,其不同的立体构型可能会导致不同的生物活性。
小分子与生物大分子的相互作用
生物活性小分子如激素、神经递质等,与生物大分子如受体、酶等的相互作用具有立体 选择性。
醇在酸性条件下失去质子形成碳正离子,然后发生1,2-重排生成更稳定的碳正离子,最后捕 获质子生成重排产物。
Pinacol重排
二醇在酸性条件下失去一分子水形成碳正离子,然后发生1,2-重排生成醛或酮。
立体化学结果
重排反应的立体化学结果取决于底物的构型和重排过程中涉及的中间体的稳定性。
影响立体化学反应因素
拉曼光谱原理
利用光与分子相互作用产生的拉 曼散射光谱进行分析。
结构解析与验证
根据特征峰位、峰强等参数推断 分子结构中的官能团和化学键信 息,并通过与其他实验数据相互
验证。
其他实验方法及技术
圆二色光谱
01
用于研究生物大分子(如蛋白质)的二级结构和构象变
化。
质谱技术
02
用于确定化合物的分子量和元素组成,以及研究分子间
底物结构
核磁共振波谱在确定结构中应用
核磁共振原理
利用核自旋磁矩在外磁 场中发生能级分裂,通 过射频脉冲激发核自旋 跃迁,产生核磁共振信 号。
数据收集与处理
通过调整射频脉冲频率 和磁场强度收集不同核 的核磁共振信号,并利 用计算机程序进行数据 处理和谱图分析。
糖类的立体化学与生物活 性
糖类的立体构型对其生物活性具有重要影响, 如多糖的免疫调节作用、糖蛋白的识别作用等。
生物活性小分子中立体化学问题
手性小分子的生物活性
许多生物活性小分子具有手性中心,其不同的立体构型可能会导致不同的生物活性。
小分子与生物大分子的相互作用
生物活性小分子如激素、神经递质等,与生物大分子如受体、酶等的相互作用具有立体 选择性。
醇在酸性条件下失去质子形成碳正离子,然后发生1,2-重排生成更稳定的碳正离子,最后捕 获质子生成重排产物。
Pinacol重排
二醇在酸性条件下失去一分子水形成碳正离子,然后发生1,2-重排生成醛或酮。
立体化学结果
重排反应的立体化学结果取决于底物的构型和重排过程中涉及的中间体的稳定性。
影响立体化学反应因素
拉曼光谱原理
利用光与分子相互作用产生的拉 曼散射光谱进行分析。
结构解析与验证
根据特征峰位、峰强等参数推断 分子结构中的官能团和化学键信 息,并通过与其他实验数据相互
验证。
其他实验方法及技术
圆二色光谱
01
用于研究生物大分子(如蛋白质)的二级结构和构象变
化。
质谱技术
02
用于确定化合物的分子量和元素组成,以及研究分子间
底物结构
有机化学第六章立体化学ppt课件

在化学反应中,对称性分子的构型可能会发 生变化。
手性分子与对称性分子的关系
01
02
区别
联系
手性分子不能与其镜像重合,而对称性分子可以与其镜像重合。
某些手性分子在特定条件下可以转化为对称性分子,例如通过化学反 应或构象变化。同时,对称性分子在某些情况下也可能表现出手性特 征,例如在某些化学反应中产生的瞬间手性现象。
立体异构体在生物活性、药物设计等领域的应用
不同立体异构体具有不同的生物活性和药理作用,对药物设计和合成有重要意义
02
手性与对称性
手性分子的定义与性质
手性分子的定义
不能与其镜像重合的分子称为手性分子 。
旋光性
手性分子能使偏振光的振动平面发生旋 转。
对映异构体
一个手性分子与其镜像不能重合,但具 有相同的物理和化学性质,互为对映异 构体。
立体化学在药物设计与合成中的应用
药物与受体的相互作用
药物与受体的相互作用是药物发挥作用的基础,立体化学在药物设计中需要考虑药物与受体的空间匹配性。
手性药物的设计与合成
手性药物是指具有手性中心的药物分子,其不同手性构型可能具有不同的生物活性。立体化学在手性药物的 设计与合成中具有重要作用,可以通过手性合成和手性拆分等方法获得所需的手性药物。
立体化学对有机化合物的性质、反应和合成有重要影响
立体化学的历史与发展
早期立体化学观念
范托夫、勒贝尔等科学家的贡献
现代立体化学的发展
X射线衍射、核磁共振等技术的应用
立体化学在有机化学中的应用
立体选择性合成
通过控制反应条件,选择性地合成特定立体异构体
立体异构体的分离与鉴定
利用物理和化学方法分离和鉴定立体异构体
有机化学第八章立体化学PPT课件

配体设计
手性催化剂的配体设计是关键, 通过选择合适的配体,可以实现
对反应的立体选择性控制。
反应机理
手性催化剂的选择性合成通常涉 及特定的反应机理,如协同反应 或逐步反应,这些机理决定了催
化剂对立体异构体的选择性。
手性拆分技术
手性拆分技术
手性拆分技术是利用化学或物理方法将外消旋混合物分离成各自 的立体异构体的过程。
非对映异构体的性质
非对映异构体的物理性质通常不同,如沸点、熔点和折射率等。它 们的旋光性和比旋光度也可能不同,但通常比对映异构体的差异更 小。
非对映异构体的合成
非对映异构体的合成是有机化学中的重要研究内容,需要采用特定的 合成策略和技巧来制备。
顺反异构体
顺反异构体定义
顺反异构体是指由于双键的存在导致取代基在空间中不能处于同一侧的分子。这种排列方 式使得分子具有不同的物理性质和化学反应特性。
越来越多的手性药物被发现和开发。
手性药物的发展阶段
02
手性药物的研发经历了三个阶段,包括手性源药物、手性拆分
药物和手性合成药物。
手性药物的现状与未来
03
目前,手性药物已经成为药物研发的重要组成部分,未来随着
手性技术的不断进步,将会有更多的手性药物问世。
手性药物的药理作用
手性药物的药效
手性药物的药效与其手性构型密切相关,不同构型的手性药物可 能具有不同的药理作用。
手性药物的作用机制
手性药物的作用机制涉及多个方面,包括与靶点的选择性结合、影 响细胞信号转导等。
手性药物的疗效与副作用
手性药物在临床应用中具有疗效高、副作用小的优势,但也存在一 定的个体差异和不良反应。
手性药物的合成与制备
手性药物的合成方法
高等有机化学课件立体化学

第一类:凡具有对称面、对称中心或四重交替对称轴的分子都能和其镜像重叠。这 样的分子叫对称分子或非手性分子(symmeric molecule)
第二类:只有对称轴而无其它三种对称因素的分子,称为非对称分子(dissymmeric) 第三类:完全不具有任何对称因素的分子,称为不对称分子(asymmeric molecule)。 第二类和第三类------不能与其镜像重叠------手性分子(chiral molecule) * 手性分子的必要和充分条件是既没有对称面、没有对称中心,也没有四重交替对称轴。 在有机分子中只有四重交替对称轴而没有对称面或对称中心的化合物是极个别的,因此, 一般情况下,只要分子中没有对称面和对称中心,就可以断定分子是手性的。
上述具有手性轴化合物的构型标记方法是在遵循手性中心化合物的构型标记 规定之外,还有一条规则(0)。
规则 1 :沿手性轴望见手性轴分子时,靠近目测者的一端优先取代基的位 次与手性中心化合物的情况一样。把要标记构型的联苯型衍生物的两个苯环相互垂 直,在任意一个苯环侧沿轴目测时,沿轴的直角投影四个取代基,那么可以得到上 记两个投影式。
即前手性面(prochiral face)。其中,Si -面和 re-面的确定是,在正面看去O--->C--->H的 顺序其转向是顺时针的,那么这一面就叫做 re-面;从平面的后侧看去时,O--->C--->H的 顺序其转向是反时针的就叫做Si -面。分子中这两个面也是对映异位关系。
re-面
O H3C H
CH3
COOH H Br
CH3 (R)
CH3 HH
CH3
COOH HH R CH3 S
CH3 XH
CH3
COOH Br H
CH3 (S)
第二类:只有对称轴而无其它三种对称因素的分子,称为非对称分子(dissymmeric) 第三类:完全不具有任何对称因素的分子,称为不对称分子(asymmeric molecule)。 第二类和第三类------不能与其镜像重叠------手性分子(chiral molecule) * 手性分子的必要和充分条件是既没有对称面、没有对称中心,也没有四重交替对称轴。 在有机分子中只有四重交替对称轴而没有对称面或对称中心的化合物是极个别的,因此, 一般情况下,只要分子中没有对称面和对称中心,就可以断定分子是手性的。
上述具有手性轴化合物的构型标记方法是在遵循手性中心化合物的构型标记 规定之外,还有一条规则(0)。
规则 1 :沿手性轴望见手性轴分子时,靠近目测者的一端优先取代基的位 次与手性中心化合物的情况一样。把要标记构型的联苯型衍生物的两个苯环相互垂 直,在任意一个苯环侧沿轴目测时,沿轴的直角投影四个取代基,那么可以得到上 记两个投影式。
即前手性面(prochiral face)。其中,Si -面和 re-面的确定是,在正面看去O--->C--->H的 顺序其转向是顺时针的,那么这一面就叫做 re-面;从平面的后侧看去时,O--->C--->H的 顺序其转向是反时针的就叫做Si -面。分子中这两个面也是对映异位关系。
re-面
O H3C H
CH3
COOH H Br
CH3 (R)
CH3 HH
CH3
COOH HH R CH3 S
CH3 XH
CH3
COOH Br H
CH3 (S)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C6H5
C -C10H7
C6H5 C10H7-
Chiral axial
[20oC =+437o [20oC =-437o
原因:
单键旋转受阻的联苯型化合物 在邻位上连接体积较大的取代基时,单键旋转 受阻;如果取代基又不相同,
则该分子具备了不对称条件而具有手性轴,这 样的分子也具有手性。
CH3 CH3
CH3
COOH H Br
CH3 (R)
CH3 HH
CH3
COOH HH R CH3 S
CH3 XH
CH3
COOH Br H
CH3 (S)
丙酸中被取代的两个氢原子的地位并不相等,分别处在一个为右旋的和另一个为左 旋的结构环境中。显然,丙酸中的C-2 原来是一个非手性中心,经 α-溴代后变成了一 个手性中心。因此 当一个碳原子连接着两个相同基团和两个不同基团时,如CX2YZ, 此碳原子称为前手性中心(预手性中心)(prochiral center).
O
HOOC 3 R-构型
H2C HOOC
H2C
CH2 COOH
CH2
R,S-构型
3 2 1O R-构型
3 2 1O S-构型
(1)手性面是苯环的平面。 (2)为了决定从哪个方向瞭望手性面,按下列规则选择参照原子。在与手性面
直接相连的面外的原子中,选择位次最高的原子作为参照原子。 (3)与参照原子直接相连的手性面上的原子开始,按位次规则编号。 (4)从参照原子方向开始,按顺序旋转,旋转方向为右,那么化合物的构型是
C 2' CH
H O
HO H3C H3C
CH2OH Br
2' CH2OH H Br
6'CH3
6'-位为中心时
O (C) C (C) (C) C 6' H CH H
因此,后者的立体构型是 S-构型而不是 R-构型。
(二) 具有手性面的化合物的构型标记法 现举几个例子:
CH2 (CH2)n CH2
1O 2
CH2
对蕃烷(paracyclophane)化合物也具 有手性面,因此是一种旋光性化合物。
具有手性轴和手性面化合物的构型表示方法
(一) 具有手性轴化合物
H
C6H5
C
C6H5
H
HOOC
NO2
NO2 COOH
3C6H5 2 H C6H5
4H 1
R-构型
3COOH O2N COOH 2 4NO2 1
S-构型
O C O
二重对称轴
O C O
Cl Cl
Cl
Cl
二重对称轴
这些分子虽具有二重交替对称轴,但没有其它对称因素,所以属于手性分子。为
了区别于不含任何对称因素的不对称分子,把它叫做非对称分子。这个区分在某些
立
体化学上是需要的,但在一般的情况下,只要考虑是否能与镜像重叠的问题,也就
是手性问题。
手性中心:一个分子的手性通常与分子中一个或多个原子有关,人们就把这个特定
二、 前手性关系(prochirarity)
(一) 前手性中心(prochiral center) 对于非手性分子如丙烷。其C-2上的任意氢原子被取代后所形成的两个新化合物完全 一样的,乃是一个非手性分子。表现出完全相同的物理和化学性质。这两个基团的这 一关系称为(homotopic)等位关系。
CH3 HX
欢迎
一、分子的对称因素和手性 对称因素:对称轴、对称面、对称中心和四重交替对称轴(也叫做更替对称轴)
第一类:凡具有对称面、对称中心或四重交替对称轴的分子都能和其镜像重叠。这 样的分子叫对称分子或非手性分子(symmeric molecule)
第二类:只有对称轴而无其它三种对称因素的分子,称为非对称分子(dissymmeric) 第三类:完全不具有任何对称因素的分子,称为不对称分子(asymmeric molecule)。 第二类和第三类------不能与其镜像重叠------手性分子(chiral molecule) * 手性分子的必要和充分条件是既没有对称面、没有对称中心,也没有四重交替对称轴。 在有机分子中只有四重交替对称轴而没有对称面或对称中心的化合物是极个别的,因此, 一般情况下,只要分子中没有对称面和对称中心,就可以断定分子是手性的。
R-构型,左向的话其构型是S-构型。
OH
OH
CH3
HO
C
指出中央碳原子的立体构型。
H HO
H 3C O
OCH3 O
H
指 出 6 a ,1 2 a ,5 '的 立 体 构 型 。 ro te n o n e
12a
O 6a
O H
5' O
H CH3
H
9N
H 14
13
HO
O5 H
6 H
OH
指 出 9 ,1 4 ,1 3 ,5 ,6 的 立 体 构 型 。 m o rp h in e
的
原子称为手CO性OH中心(chiral center)。 C2H5
+ I-
H2N C H
C10H7 As C3H7
CH2OH
CH2C6H5
L-serine
手性中心是碳原子
手性中心是砷原子
O
O
O BO
H
O
O
手性中心是硼原子
手性轴:有些化合物并没有手性中心,但也具有旋光性。 象两端连有两个不同取 代基的丙二烯衍生物具有的不对称轴叫手性轴(Chiral axial)。具有手性 轴的化合物具有旋光性。
上述具有手性轴化合物的构型标记方法是在遵循手性中心化合物的构型标记 规定之外,还有一条规则(0)。
规则 1 :沿手性轴望见手性轴分子时,靠近目测者的一端优先取代基的位 次与手性中心化合物的情况一样。把要标记构型的联苯型衍生物的两个苯环相互垂 直,在任意一个苯环侧沿轴目测时,沿轴的直角投影四个取代基,那么可以得到上 记两个投影式。
规则 2:如果一方苯环2,6-位上上没有取代基的话,不可能区别开来,可 以参看3,4位的取代基。如果同侧苯环的2,6-和 3,5-位的取代基组都不相同的情况 下首先考虑靠近的2,6-位取代基。
O2N H3C
COOH Br
COOH H Br
NO2 S-构型
2'-位为中心时
C H (C)
(C) (C)
CH3 CH3
NH2 H2N
(R)-(+)-2,2'-diamino-6,6'dimetylbiphynyl
a
a'
C
b
b'
a=b
NH2 H2N (S)-(-)-2,2'-diamino-6,6'-
dimetylbiphynyl
aa
bb
a+a or b+b >0.29nm
手性面: 还有一种分子中既没有手性中心,也没有手性轴但存在对映体。这种化合物具有
手性面。所谓的手性面就是通过分子的,在它的两侧有不同的取代基而使该分子失去 对称的平面。这样一个分子的苯环在旋转时,由于体积较大的羧基的影响其旋转受到 阻碍,由此产生手性面。它的手性面是包括氧原子并与苯环垂直的平面。
(CH2)8
O
O
HOOC
(CH2)8
O
O
COOH
H2C
H2C HOOC
CH2 COOH
