载脂蛋白A1测定试剂盒(免疫比浊法)产品技术要求丹大
载脂蛋白A1、B校准品产品技术要求华宇亿康

载脂蛋白A1、B校准品适用范围:本校准品与本公司生产的载脂蛋白A1、B测定试剂盒(免疫比浊法)配套使用,用于载脂蛋白A1、B检测系统的校准。
1.1 产品型号/规格冻干粉型(复溶体积):6×1mL;1×1mL。
1.2 主要组成成分本校准品以人血清为基质,并添加了特定项目的生物源性物质和化学成分,具体内容见下表。
表1 载脂蛋白A1、B校准品主要组成成分注:校准品具有批特异性,具体浓度见值单。
2.1 外观和性状2.1.1 外包装完整无破损;中文包装标签应清晰、准确、牢固。
2.1.2 本校准品应为白色至浅黄色冻干粉;复溶后应为浅黄色或黄色透明液体,无浑浊,无未溶解物。
2.2 水分含量水分含量应不大于5%。
2.3 量值溯源依据GB/T 21415有关规定建立溯源性,量值溯源见表1,赋值过程见附录。
2.4 赋值结果及其不确定度的表示方式赋值结果±扩展不确定度。
2.5 正确度︱≤1。
各项目量值传递的正确度应符合︳En2.6 均匀性2.6.1 瓶内均匀性各项目的瓶内均匀性变异系数(CV)应不大于10%。
瓶内2.6.2 瓶间均匀性)应不大于10%。
各项目的瓶间均匀性变异系数(CV瓶间2.7 稳定性2.7.1 复溶稳定性复溶后的校准品密封保存于2 ℃~8 ℃、避光环境中,可稳定3天;复溶后的校准品密封保存于不高于-18℃、避光环境中,可稳定10天。
在稳定期内赋值结果的变化趋势不显著。
2.7.2 效期稳定性校准品保存于2 ℃~8 ℃,有效期为24个月。
在有效期内赋值结果的变化趋势不显著。
APOA1文档,载脂蛋白A1测定试剂盒(ApoA1)检测标准操作规程

1、方法依据:深圳迈瑞生物医疗电子股份有限公司载脂蛋白A1测定试剂盒(ApoA1)测定方法2、适用范围:适用于人血清载脂蛋白A1 (ApoA1)的测定。
3、试剂仪器:3.1 试剂:深圳迈瑞生物医疗电子股份有限公司原装试剂盒。
3.2未开启的试剂盒避光保存于2℃~8℃有效期为一年。
试剂开瓶后应避光保存,在2℃~8℃可稳定28天。
试剂不可冰冻。
3.3 仪器:迈瑞BS-2000M全自动生化分析仪.4、操作程序4.1方法原理使用羊抗人ApoA1抗体和样品中的ApoA1进行抗原-抗体反应。
反应完成后,用透射比浊法检测吸光度的变化反映ApoA1浓度。
4.2样本要求血清。
稳定性:2℃~8℃保存可稳定7天;-20℃保存可稳定3个月。
样本不可反复冻融。
不可使用已被污染的样本。
4.3上机操作4.3.1试剂装载、校准、样品和质控血清分析操作详见“《迈瑞BS-2000M全自动生化分析仪标准操作、维护、保养规程》”。
4.3.2 校准:4.3.2.1 标准液的准备:校准品使用深圳迈瑞生物医疗电子股份有限公司配套冻干品,按说明书要求稀释后分装,-20℃冷冻保存,用前提前15分钟从冰箱中取出,复溶到室温后上机检测。
4.3.2.2 校准程序:首次使用校准。
当有以下情况时需重新定标:1)换试剂批号或出现质控漂移时;2)当仪器做完保养后;3)仪器进行零件更换时。
每次试验前用准备好的校准品进行定标,定标通过后进行检测。
4.3.2.3 质控:在标本开始之前做质控,质控通过后方能进行标本的检测。
4.3.3 测试基本参数4.4参考范围1.00~1.60 g/L (注:各实验室应有自己的参考范围。
)4.5 方法评价本法可报告范围在(0.2~2.3)g/L内。
当样本测定值超过上限时,应将样本用生理盐水稀释,重新测定,结果乘以稀释倍数。
精密度:批内变异系数:CV ≤ 4.0%;批间变异系数:CV ≤ 5.0%。
准确度:测定质控血清,测定结果在靶值范围内。
载脂蛋白A2(APOA2)测定试剂盒(免疫比浊法)产品技术要求lideman

载脂蛋白A2(APOA2)测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人血清中载脂蛋白A2的含量。
1.1规格试剂1(R1):2×45mL,试剂2(R2):2×15mL;试剂1(R1):2×60mL,试剂2(R2):2×20mL;试剂1(R1):2×60mL,试剂2(R2):2×12mL;试剂1(R1):2×60mL,试剂2(R2):2×15mL。
1.2试剂组成见表1:试剂1(R1)(以下简称R1),试剂2(R2)(以下简称R2)。
表1 试剂组成2.1 外观液体双试剂: R1:无色液体;R2:无色或浅黄色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、600 nm波长、1cm光径条件下,试剂空白吸光度应<0.3 ABS。
2.4 分析灵敏度浓度为(22.9±4.6)mg/dL时,吸光度变化>0.03ABS之间。
2.5 线性范围在[0 – 60]mg/dL线性范围内,线性相关系数r2 ≥0.995。
在(20-60]mg/dL,范围内的相对偏差≤10%;测定结果为[0-20]mg/dL时绝对偏差≤2 mg/dL。
2.6 精密度试剂盒测试项目精密度 CV< 6 %。
2.7 批间差不同批号之间测定结果的相对偏差应< 10 %。
2.8 准确度回收试验:回收率80%-120%。
2.9 稳定性原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其准确度和线性,试验结果满足2.5、2.8的要求。
临床化学脂类质控血清产品技术要求yuepu
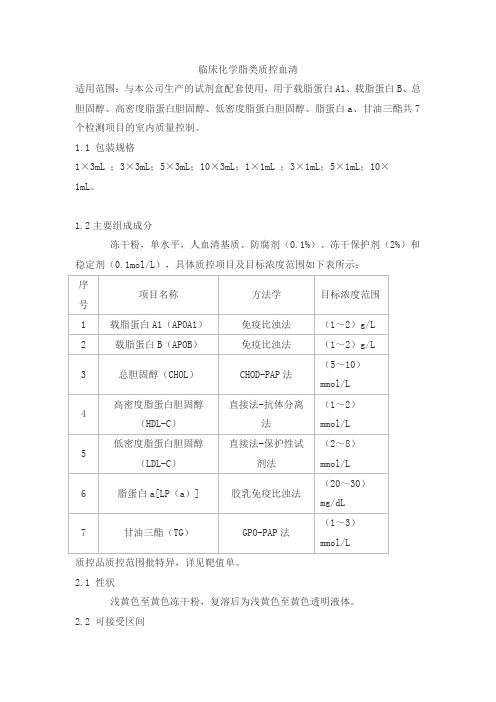
临床化学脂类质控血清
适用范围:与本公司生产的试剂盒配套使用,用于载脂蛋白A1、载脂蛋白B、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、脂蛋白a、甘油三酯共7个检测项目的室内质量控制。
1.1 包装规格
1×3mL ;3×3mL;5×3mL;10×3mL;1×1mL ;3×1mL;5×1mL;10×
1mL。
1.2主要组成成分
冻干粉,单水平,人血清基质、防腐剂(0.1%)、冻干保护剂(2%)和稳定剂(0.1mol/L),具体质控项目及目标浓度范围如下表所示:
质控品质控范围批特异,详见靶值单。
2.1 性状
浅黄色至黄色冻干粉,复溶后为浅黄色至黄色透明液体。
2.2 可接受区间
质控品各项目测值应在质控范围内。
2.3 瓶间均匀性
使用配套试剂盒测定,瓶间变异系数(CV)应不超过10%。
2.4 稳定性
2.4.1 效期稳定性
原包装试剂盒在2℃~8℃密封避光保存条件下有效期为36个月。
在稳定期内赋值结果的变化趋势不显著。
2.4.2 复溶稳定性
质控品复溶后在2℃~8℃密闭避光保存,稳定期为7天;-20℃冰冻保存稳定期为28天。
在稳定期内赋值结果的变化趋势不显著。
血清载脂蛋白A测定标准操作规程

血清载脂蛋白A1测定标准操作规程1 检验申请单独检验项目申请:血清载脂蛋白A1(缩写apo A1)测定;组合项目申请:血脂测定,血载脂蛋白测定。
临床医生根据需要提出检验申请。
2 标本采集与处理2.1标本采集2.1.1常规静脉采血约2 ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
2.1.2检验申请单和血标本试管标上统一且唯一的标识符。
2.1.3急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5下列标本为不合格标本2.1.5.1标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2对反应吸光度有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3无法确认标本与申请单对应关系的。
2.1.5.4其他如标识涂改、标本试管破裂等。
2.2标本保存2.2.1接收标本后在30min内将标本离心分离出血清。
2.2.2标本保存时间:室温(15~25℃)下可稳定1天,普通冰箱中(2~8℃)稳定7天。
-20℃可保存数月;-70℃至少可保存半年;应避免标本反复冻溶。
为避免标本中水分挥发使血清浓缩,对保存时间超过1天的标本均加塞密闭或覆盖湿巾。
2.2.3 已完成测试的标本保持完整的识别号,置4~8℃冰箱内保存7天。
2.3 标本采集的注意事项2.3.1 采血前使受检者保持平静、松弛和空腹状态。
抽血前3天内避免高脂饮食,24小时内不饮酒。
2.3.2 不建议采集抗凝血标本,如果必须使用血浆,推荐的抗凝剂是肝素。
EDTANa 2(1mg /mL)抗凝。
2.1.5 抽血前最好停用影响血脂的药物(如调脂药、避孕药、某些降压药、激素等)数天或数周,否则应记录用药情况。
3 方法原理透射免疫浊度法。
APO A-1与特异的抗血清反应形成不溶性的复合物,可在340nm 测定该不溶性复合物的浊度。
载脂蛋白A1 B校准品产品技术要求柏定

载脂蛋白A1/B校准品适用范围:与本公司生产的载脂蛋白A1测定试剂盒(免疫比浊法)和载脂蛋白B测定试剂盒(免疫比浊法)配套使用,用于检测系统的校准。
1.1 规格1ml×1。
1.2 主要组成成分冻干粉,人血清基质。
甘露醇20g/L,牛血清白蛋白10g/L。
目标浓度:载脂蛋白A1:2.4g/L,载脂蛋白B:2.0g/L。
注:靶值批特异,详见瓶标签。
2.1 外观2.1.1 试剂为冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。
2.1.2 包装外观应整洁,标签字迹清晰,不易脱落。
2.2 含水量含水量应不超过3%。
2.3 溯源性根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至柏定公司内部工作校准品,并与已上市产品比对赋值。
2.4 准确度与已上市产品进行对比试验,载脂蛋白A1的相关系数r≥0.975,[0.5,1]g/L区间内,绝对偏差应不超过±0.1g/L;(1,2.3]g/L区间内,相对偏差应不超过±10%。
与已上市产品进行对比试验,载脂蛋白B的相关系数r≥0.975,[0.2,1]g/L 区间内,绝对偏差应不超过±0.1g/L;(1,2.5]g/L区间内,相对偏差应不超过±10%。
2.5 批内重复性重复测试校准品,批内重复性(CV)应不大于5%。
2.6 批内瓶间差批内瓶间差(CV)应不大于5%。
2.7 稳定性2.7.1 效期稳定性原装产品在2℃~8℃避光保存可稳定12个月。
有效期满后1个月内测试结果应符合2.1、2.4、2.5和2.6要求。
2.7.2 复溶稳定性产品复溶后2℃~8℃避光保存可稳定3天。
稳定期过后4小时内测试结果与复溶后初测值相对偏差不超过±5%。
脂蛋白(a)测定试剂盒(胶乳免疫比浊法)0产品技术要求zhongshengbeikong

脂蛋白(a)测定试剂盒(胶乳免疫比浊法)适用范围:本产品用于体外定量测定人血清中脂蛋白(a)的浓度。
1.1包装规格液体双剂型试剂1(R1):60mL×1,试剂2(R2):15mL×1;试剂1(R1):60mL×4,试剂2(R2):15mL×4;试剂1(R1):42mL×2,试剂2(R2):24mL×1。
1.2 主要组成成分1.2.1 试剂1(R1)(液体)甘氨酸100mmol/L 1.2.2 试剂2(R2)(液体)羊抗人Lp(a)抗体包被胶乳颗粒2mg/mL2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为无色或浅白色溶液,无杂质,无絮状物,外包装完整无破损;2.1.2 试剂2(R2)应为乳白色溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长700nm(光径1cm)处,试剂空白吸光度(A)应≤0.800。
2.4准确度用中生试剂和已上市同类试剂分别测定40个在测定范围内不同浓度的样本,计算两组数据的相关系数(r)及测值的相对偏差,线性相关系数r应≥0.975;相对偏差应不超过±15%。
2.5分析灵敏度对应于浓度为120mg/L的Lp(a)所产生的吸光度差值(△A)的绝对值应在0.020~0.070范围内。
2.6重复性重复测试高、低浓度样本,变异系数(CV)应≤5%。
2.7批间差测定同一样本,批间差(R)应≤5%。
2.8线性范围在[50,1000]mg/L范围内,线性相关系数r应≥0.990;在(250,1000]mg/L范围内,线性相对偏差应不超过±10%;在[50,250]mg/L范围内,线性绝对偏差应不超过±25mg/L。
2.9稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
载脂蛋白A1(ApoA1)测定试剂盒(免疫比浊法)产品技术要求derui

载脂蛋白A1(ApoA1)测定试剂盒
2、性能指标
2.1外观和性状
外观和性状应符合表2要求。
表2 试剂盒内各组分的外观性状
2.2试剂空白吸光度
试剂以蒸馏水为空白时,波长340nm,光径1.0 cm,温度37℃,吸光度≤0.2。
2.3分析灵敏度
试剂盒测试浓度为1.00 g/L被测物时,吸光度差值≥0.30。
2.4线性范围
2.4.1 试剂盒在0.20~2.40 g/L区间(范围)内,其回归系数r≥0.990。
2.4.2 在0.20~2.40 g/L 区间(范围)内,线性相对偏差应不超过±10%。
2.5精密度
2.5.1试剂盒重复性CV 值应≤
3.0%。
2.5.2试剂盒批间相对极差(R)应≤10.0%。
2.6准确度
测试企业参考品,相对偏差应不超过±10%。
2.7液体装量
试剂盒不同规格的净含量应不少于其标示量。
载脂蛋白A1B校准品产品技术要求wantaiderui

载脂蛋白A1/B校准品
适用范围:该产品与本公司生产的载脂蛋白A1测定试剂盒(免疫比浊法)、载脂蛋白B测定试剂盒(免疫比浊法)配套使用。
用于临床检验载脂蛋白A1和载脂蛋白B项目的系统校准。
1.1包装规格
1.0mL/瓶×1(1个水平);
2.0mL/瓶×1(1个水平)。
1.2 组成成分
载脂蛋白A1/B校准品是在人血清中加入重组人源性的载脂蛋白A1和载脂蛋白B 而组成的冻干品。
载脂蛋白A1/B校准品中ApoA1的标示值范围为2.0g/L~3.1g/L,ApoB的标示值范围为1.6g/L~2.4g/L,具体浓度见瓶签。
2.1 外观
淡黄色冻干粉;复溶后为淡黄色液体。
2.2 含水量
含水量应≤5 %。
2.3 瓶间均一性
瓶间均一性应≤12%。
2.4准确度
测试WHO的ApoA1和ApoB参考物质SP1-01,SP3-08,测定结果均值与标示值的相对偏差应不超过±15%。
2.5 稳定性
2.5.1效期稳定性
原包装校准品在2℃~8℃条件下贮存,有效期为12个月。
校准品性能应符合2.1、2.3、2.4要求。
2.5.2复溶稳定性
复溶后校准品在2℃~8℃条件下密闭避光保存,可稳定7天。
校准品性能应符合2.1、2.3、2.4要求。
2.6校准品溯源性
按照GB/T21415-2008要求,该校准品可溯源至WHO的ApoA1和ApoB参考物质SP1-01、SP3-08。
载脂蛋白A1(ApoA1)测定试剂盒(免疫透射比浊法)产品技术要求mairui

2性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2净含量
液体试剂的净含量应不少于标示值。
2.3试剂空白吸光度
试剂以水为空白在37 ℃ 1℃,340 nm 波长条件下,吸光度应小于0.3 A。
2.4分析灵敏度
当样本浓度为 1.5 g/L 时,吸光度变化应不小于0.86 A。
2.5线性范围
试剂盒在(0.2~2.3)g/L 范围内:
a)线性相关系数r 应不小于0.9900;
b)当样本浓度不大于1.25 g/L 时,线性绝对偏差应不大于±0.125 g/L;当样本浓度大于1.25 g/L 时,线性相对偏差应不大于±10.0%。
2.6测量精密度
2.6.1重复性
变异系数:CV 应不大于 4.0%。
2.6.2批间差
相对偏差:R 应不大于 5.0%。
2.7准确度
测定校准品,测定结果与靶值的相对偏差应不大于±10.0%。
2.8分析特异性
血红蛋白浓度在500 mg/dL 内、抗坏血酸浓度在30 mg/dL 内、内源性酯浓度在500 mg/dL 内、胆红素浓度在40 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
2.9校准品均一性
试剂盒校准品的均一性:CV 应不大于 4.0%。
2.10生物安全性
校准品的HBsAg、HIV抗体、HCV抗体、梅毒螺旋体TP抗体检测应为阴性。
1。
食品药品监管总局关于发布载脂蛋白A1测定试剂等3项注册技术审查指

食品药品监管总局关于发布载脂蛋白A1测定试剂等3项注册
技术审查指导原则的通告
【法规类别】医疗器械药品药材进出口
【发文字号】食品药品监管总局通告2018年第9号
【发布部门】国家食品药品监督管理总局
【发布日期】2018.01.08
【实施日期】2018.01.08
【时效性】现行有效
【效力级别】部门规范性文件
食品药品监管总局关于发布载脂蛋白A1测定试剂等3项注册技术审查指导原则的通告
(食品药品监管总局通告2018年第9号)
为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家食品药品监督管理总局组织制定了《载脂蛋白A1测定试剂注册技术审查指导原则》《载脂蛋白B 测定试剂注册技术审查指导原则》《D-二聚体测定试剂(免疫比浊法)注册
1 / 1。
载脂蛋白A1测定试剂盒(免疫比浊法)产品技术要求meigaoyi

载脂蛋白A1测定试剂盒(免疫比浊法)适用范围:用于体外定量测定人血清中载脂蛋白A1的浓度。
1.1包装规格a) 试剂1:2×45ml,试剂2:2×15ml;b)试剂1:6×60ml,试剂2:2×60ml;c)试剂1:4×60ml,试剂2:4×20ml;d) 试剂1:3×60ml,试剂2:3×20ml;e)试剂1:2×300ml,试剂2:2×100ml;f) 试剂1:12×16.8ml,试剂2:12×5.6ml ;g)试剂1:2×54ml,试剂2:2×18ml;h)试剂1:1×45ml,试剂2:1×15ml。
1.2 主要组成成分试剂1主要组成成分:Tris缓冲液(PH 7.0-9.0)8mmol/L聚乙二醇6000 6mmol/L试剂2主要组成成分:羊抗人Apo A1抗体适量聚乙醇酯适量2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色透明溶液;试剂2应为无色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白测定试剂空白吸光度,应≤0.15。
2.4 分析灵敏度测试2.2g/L的被测物时,吸光度变化(ΔA)应不低于0.065。
2.5 准确度回收率80%~120% 范围内。
2.6 重复性变异系数(CV)应不超过5%。
2.7 线性2.7.1 在[0.35,2.5]g/L范围内,线性回归的确定系数应不低于0.990;2.7.2 [1.0,2.5]g/L范围内,相对偏差≤15%;2.7.3 [0.35,1.0)g/L范围内,绝对偏差≤0.15g/L。
2.8 批间差对同一份样品进行重复测定,相对偏差<10%2.9 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.2、2.3、2.4、2.5、2.6、2.7之规定。
0137《载脂蛋白A1(APOA1)测定试剂盒(免疫比浊法)》注册产品标准讲解

YZB/豫医疗器械注册产品标准YZB/豫0137-2013载脂蛋白A1(APOA1)测定试剂盒(免疫比浊法)2013-04-08发布2013-05-08实施有限公司发布前言载脂蛋白A1(APOA1)测定试剂盒(免疫比浊法)目前尚无国家标准和行业标准,为组织生产,保证产品质量,特制定本标准。
本标准由有限公司提出并起草。
本标准主要起草人:本标准复核单位:河南省食品药品监督管理局。
本标准首次发布日期:2013年4月8日。
载脂蛋白A1(APOA1)测定试剂盒(免疫比浊法)1 范围本标准规定了载脂蛋白A1(APOA1)测定试剂盒(免疫比浊法)的成分、规格、要求、试验方法、检验规则、标志、使用说明书、包装、储存等内容。
本标准适用于载脂蛋白A1(APOA1)测定试剂盒(免疫比浊法)(以下简称试剂盒)。
2 规范性引用文件下列文件对本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191-2008 包装储运图示标志3 成分与规格3.1 组成及成分: R1: PEG-6000、氯化钠、叠氮钠、Tris-HCl缓冲液R2: Tris-HCl缓冲液、抗人APOA1特异抗体。
3.2 规格:本试剂盒有以下4种规格40mL (R1:1×30mL,R2:1×10mL);80mL (R1:2×30mL,R2:2×10mL);160mL(R1:2×60mL,R2:2×20mL);320mL(R1:4×60mL,R2:4×20mL);4 要求4.1 物理性状R1应为无色透明液体,无絮状物及沉淀;R2应为微黄色透明液体,无絮状物及沉淀。
4.2 试剂瓶外观封盖紧密,无漏液。
R1瓶盖为白色,R2瓶盖为蓝色。
4.3 试剂装量试剂装量:±3%。
4.4 试剂空白吸光度值APOA1试剂空白A≤1.0。
载脂蛋白A1(APOA1) 免疫比浊法

目录1. 检测原理2. 标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理APO A-1与特异的抗血清反应形成不溶性的复合物,可在340nm测定该不溶性复合物的浊度。
通过测定标准品,建立一个吸光度对APO A-1浓度的标准曲线就可以测定出样品中的APO A-1浓度。
2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
妊娠后期各项血脂都会增高,应在产后或中哺乳后3个月检验才能反应其基本血脂水平。
注意有无应用影响血脂的药物,如降血脂药、避孕药等。
此外,对于体检者,采血的季节都应做相关记录,因为血脂水平有季节性变动,为了前后比较应在每年同一季节检验,应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆使用EDTANa2(1mg/mL)作为抗凝剂。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:本科使用湖南永和阳光科技有限责任公司APOA1试剂盒,为液体双试剂,各组分如下:3.2:校准血清使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的2SD范围,需要全点定标。
载脂蛋白A1APOA1免疫透射比浊法作业指导书

载脂蛋白A1APOA1免疫透射比浊法作业指导书1、前言试验名称:载脂蛋白A1测定,英文名称:APOA1,方法:免疫透射比浊法。
本文件适用于安阳鼎城糖尿病医院检验科生化实验室,目的是指导工作人员正确的在科华KHB450全自动生化分析仪上测定血清、血浆样本中的APOA1浓度,以保证测定结果的准确可靠。
本试验用体外定量测定人血清或血浆样本中APOA1的浓度。
载脂蛋白A1是一个抗动脉粥样硬化的指标,它与冠心病的危险因素负相关。
本实验在临床上常和载脂蛋白B、高密度脂蛋白胆固醇、总胆固醇、甘油三酯等同时测定,用于对受检者脂代谢状态和动脉粥样硬化发病风险的评价。
2、测定原理本方法基于样品中的人APOA1与特异抗血清反应形成不溶性的复合物,可在340nm波长处测出该不溶性复合物的浊度,通过标准品建立的一个吸光度对APOA1的标准曲线测定出样品中的APOA1的浓度。
3、试剂试剂生产商:上海科华公司。
剂型:液体双试剂。
包装量:R1:4*40ml R2:3*35ml注册号:沪食药监械(准)字2011第2400011号。
生产许可证号:沪药管械生产许20030916号。
基本成份:试剂1聚乙二醇≤4%Tris/HCL缓冲液15mmol/l试剂2抗人APOA1抗体106mmol/l储存条件和有效期:试剂储存于2―8℃,开启和未开启试剂均可稳定致试剂盒标注的有效期。
注意:试剂用过后应加盖保存。
4、标准品:使用试剂盒附带标准品。
用1ml蒸馏水复溶,放置30分钟后使用。
5、质控品:生产商:英国Randox公司。
剂型:干粉试剂,用5ml去离子水复溶,完全溶解30分钟后使用。
保存条件:未溶解时2―8℃稳定至有效期,复溶后2―8℃稳定一周。
6、、样品要求:样品采集前病人宜清淡饮食,禁酒至少三天以上,空腹用肝素锂抗凝管或促凝管常规方法肘静脉采血,血标本4000转离心3分钟,分离血清或血浆样品,室温可稳定1周,2-8℃可稳定4周。
-20℃冷冻标本可稳定两个月。
脂联素测定试剂盒(胶乳免疫比浊法)产品技术要求模板

医疗器械产品技术要求编号脂联素测定试剂盒(胶乳免疫比浊法)1.产品型号/规格及其划分说明1试剂组成试剂1:Tris缓冲溶液100mmol/L试剂2:脂联素抗体结合乳胶适量校准品(冻干粉):磷酸盐缓冲液(pH=7.4),人血清(≥5%),脂联素,目标浓度:水平1:2.5μg/mL,水平2:5.0μg/mL,水平3:10.0μg/mL,水平4:20.0μg/mL,水平5:40.0μg/mL。
质控品(冻干粉):磷酸盐缓冲液(pH=7.4),人血清(≥5%),脂联素,质控品靶值范围:水平1:5.0μg/mL~15.0μg/mL;水平2:15.0μg/mL~35.0μg/mL。
校准品质控品批特异,具体浓度见瓶签。
1.2型号规格1)试剂1:20mL×1、试剂2:5mL×1;2)试剂1:48mL×1、试剂2:12mL×1;3)试剂1:48mL×3、试剂2:12mL×3;4)600测试/盒(试剂1:71mL×1、试剂2:23mL×1);5)1200测试/盒(试剂1:71mL×2、试剂2:23mL×2);6)2400测试/盒(试剂1:71mL×4、试剂2:23mL×4);7)1750测试/盒(试剂1:100mL×2、试剂2:25mL×2);8)1050测试/盒(试剂1:20mL×6、试剂2:10mL×3);9)1680测试/盒(试剂1:48mL×4、试剂2:12mL×4);10)800测试/盒(试剂1:24mL×2、试剂2:6mL×2);11)480测试/盒(试剂1:48mL×2、试剂2:12mL×2);12)1260测试/盒(试剂1:48mL×3、试剂2:11mL×3);13)600测试/盒(试剂1:48mL×1、试剂2:11mL×1);校准品:1.0mL×5(5水平,选配);质控品水平1:1.0mL×1(选配);质控品水平2:1.0mL×1(选配)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
载脂蛋白A1测定试剂盒(免疫比浊法)
适用范围:本品用于体外定量测定人血清中载脂蛋白A1的含量。
1.1规格
规格1: (试剂1:25mL;试剂2: 5mL);
规格2: (试剂1:50mL;试剂2:10mL); .
规格3: (试剂1:100mL;试剂2:20mL);
校准品(冻干品):为选配
规格1(0.3mL×1;1水平);规格2(0.5mL×1;1水平);
规格3(1.0mL×1;1水平);
质控品(冻干品):为选配
规格1(0.5mL×2;2水平);规格2(1.0mL×2;2水平)。
1.2组成
试剂盒组成见表1
表1 载脂蛋白A1测定试剂盒组成
2.1试剂
2.1.1外观
试剂盒外观应整洁,文字符号标识清晰;试剂盒组分齐全,液体无漏液;试剂1、试剂2均为无色透明液体,不得有沉淀和絮状物。
2.1.2装量
每瓶不少于标示值。
2.1.3试剂空白吸光度
用指定的空白样品测试试剂(盒),在光径1cm下,在A340nm处测定试剂空白吸光度A≤0.2。
2.1.4分析灵敏度
测试浓度为1.00g/L的样品,吸光度差值△A≥0.1。
2.1.5线性范围
2.1.5.1在[0.4,2.5]g/L内,相关系数R≥0.990。
2.1.5.2在 [0.4,2.5]g/L内,线性相对偏差不超过±10%。
2.1.6 重复性
重复测试(1.0±0.5)g/L样本,所得结果的变异系数(CV%)应不大于3%。
2.1.7批间差
测定(1.0±0.5)g/L样本,所得结果的批间相对极差(R)应不大于10%。
2.1.8准确度
用国家标准物质GBW(E) 090620检测,实测值与标示值的相对偏差在±15%内。
2.2校准品
2.2.1外观
校准品为冻干品。
2.2.2瓶间差
瓶间差CV≤10%。
2.2.3准确度
与配套试剂组成测试系统,指标要求同2.1.8。
2.2.4校准品溯源性
根据GB/T21415-2008的要求,本产品校准品溯源到国家标准物质(GBW(E) 090620)。
2.3质控品
2.3.1外观
质控品为冻干品。
2.3.2瓶间差
瓶间差CV≤10%。
2.3.3赋值有效性
试剂盒内的质控品,检测结果均在质控范围内。
2.4 效期稳定性
试剂(所有组份)有效期为12个月到效期后一个月内进行检测,测定结果应符合2.1.3-2.1.8(除2.1.7批间差)、2.2.3和2.3.3项要求。
