六味地黄丸微生物限度检查检验方法验证方案(2015年度出版)
六味地黄丸的质量分析(中药制剂检验课件)

≤1000
≤100
≤30000 ≤30000
≤100 ≤100
≤100000
≤500
-16-
大肠埃希 菌
(个/g)
不得检出
大肠菌 群
(个/g)
沙门菌 (个/10g)
不得检出
不得检出
不得检出 不得检出Fra bibliotek≤100 ≤100
不得检出
不得检出 ≤100
五、含量测定
取莫诺苷对照品、马钱苷对照品和 丹皮酚对照品适量,精密称定,加 50%甲醇制成每1ml含莫诺苷与马钱 苷各40μg、含丹皮酚90μg的混合溶 液,即得。
供试品溶液的 制备
分别精密吸取对照品溶液与供试品溶液各
测
10µl,注入液相色谱仪,测定,即得。
定
本品含酒萸肉以莫诺苷(C17H26O11 ) 和马
法
钱苷(C17H26O10) 的总量计,不得 少于
0.37mg;含牡丹皮以丹皮酚(C9H10O3) 计,
不得少于0.32mg。
-17-
-13-
四、检查
2 ·
重量差异
试验方法:以10丸为1份(丸重1.5g及1.5g以上的以1丸为1份),取 供试品10份,分别称定重量,再与每份标示重量(每丸标示量×称取 丸数)相比较(无标示重量的丸剂,与平均重量比较)。 标准规定:每丸重量与平均丸重相比较,超出重量差异限度的不得多 于2丸,并不得有1丸超出限度1倍。
淀粉粒三角状卵形或矩圆形,直径24 µm,脐点短缝状 或人字状 (山药)。
-6-
2
熟地黄的鉴别
三、鉴别
薄层色谱法
供试品溶液的制备:取本品10g,研细,加水100ml,温热使充分溶 散,加热至沸,放冷,用脱脂棉滤过,取滤液,用乙酸乙酯振摇提取2 次(必要时离心),每次30ml,合并乙酸乙酯液,蒸干,残渣加甲醇 lml使溶解,作为供试品溶液。 对照药材溶液的制备:取熟地黄对照药材4g,加水60ml,煎煮30分 钟,放冷,用脱脂棉滤过,取滤液,用乙酸乙酯振摇提取2次,每次 20ml,合并乙酸乙酯液,蒸干,残渣加甲醇1ml使溶解,作为对照药 材溶液。 试验方法:照薄层色谱法(通则0502)试验,吸取上述两种溶液 3~5μl,分别点于同一硅胶G薄层板上,以二甲苯-乙酸乙酯(1:1)为 展开剂,展开,取出,晾干,2,4-二硝基苯肼乙醇试液。 检测结果:供试品色谱中,在与对照药材色谱相应的位置上,显相同 颜色的主斑点。
六味地黄丸有效成分的测定

六味地黄丸有效成分的测定作者:封巍来源:《中国科技博览》2014年第11期论文摘要:文章分析了六味地黄丸(浓缩丸)有效成份的含量测定技术。
主题词:六味地黄丸测定中图分类号:Q501六味地黄丸(浓缩丸)质量标准收载于部颁标准第11册。
该方出于宋代·钱乙《小儿药证直诀·卷下》,系中医补肾的经典方,为滋阴补肾之著名方剂。
笔者参考《中国药典》对该产品进行研究,在原部颁标准的基础上,对质量标准进行整理提高,用HPLC法测定牡丹皮中丹皮酚及山茱萸中马钱苷的含量,并进行了方法学考察。
现将结果报道如下。
1 仪器与材料1.1 仪器Waters液相色谱仪,Waters2487双波长紫外检测器,515泵(美国),7715 i进样器(美国),Empower色谱工作站(美国),C18色谱柱(依利特:250 mm×4.6 mm,5μm)。
1.2 试剂甲醇、乙腈为色谱纯(中国上海陆都试剂厂),乙醚、乙醇、磷酸、四氢呋喃等均为分析醇,水为高纯水。
1.3 对照品丹皮酚对照品(中国药品生物制品检定所,110708-9704),马钱苷对照品(中国药品生物制品检定所,111640-200401)1.4 样品六味地黄丸(浓缩丸)为苏州长甲药业有限公司生产。
2 方法与结果2.1 牡丹皮的含量测定2.1.1 色谱条件C18柱(依利特;250 mm×4.6 mm,5 μm),流动相:甲醇-水(6:4),流速1.0 ml·min-1,柱温30℃,检测波长为274 nm。
2.1.2 供试品溶液的制备取本品适量,研细,精密称取0.5 g,置具塞锥形瓶中,精密加入甲醇100 ml,密塞,摇匀,称定重量,超声处理30 min(功率250 W,频率40 kHz),放冷,再次称重,用甲醇补足减失的重量,摇匀,过滤,取续滤液作为供试品溶液。
2.1.3 对照品溶液的制备精密称取对照品适量,加甲醇制成每毫升含16 μg的溶液,作为对照品溶液。
六味地黄丸质量检验结果分析

六味地黄丸生产工艺规程

六味地黄丸生产工艺规程1 主题内容本工艺规程规定了六味地黄丸生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容。
本工艺规程具有技术法规作用。
2 适用范围本工艺规程适用于六味地黄丸生产全过程。
3 引用标准《中华人民共和国药典》2000年版《药品生产质量管理规范》1998年(修订)4 职责编写:生产部、质量部技术人员汇审:生产部、质量部及其他相关部门负责人审核:生产部经理、质量部经理批准:总经理执行:各级生产质量管理人员及操作人员监督管理:QA、生产质量管理人员5 产品概述5.1 产品名称六味地黄丸Liuwei Dihuang Wan5.2 产品特点5.2.1 性状本品为棕黑色的水蜜丸,味甜而酸。
5.2.2 规格每瓶装60g5.2.3 功能与主治滋阴补肾。
用于肾阴亏损,头晕耳鸣,腰膝酸软,骨蒸潮热,盗汗遗精,消渴。
5.2.4 用法与用量口服,一次6g,一日2次。
5.2.5 贮藏密封。
5.2.6 有效期三年。
5.2.7 新药类别本品为国家中药仿制品种。
5.3 处方来源本处方出自《中华人民共和国药典》2000版一部第415页。
6 工艺流程图物料工序检验入库中转站7 处方和依据7.1 处方熟地黄160g 山茱萸(制)80g 、牡丹皮60g 山药 80g茯苓60g 泽泻 60g7.2 依据本处方出自《中华人民共和国药典》2000年版本。
批准文号为:ZZ-0127-国药准字ZF20000307号。
制法:以上六味,粉碎成细粉,混匀。
每100g细粉加炼蜜35-50g与适量的水,泛丸,干燥,制成水蜜丸,即得。
8 原药材的整理炮制8.1 整理炮制依据《中国药典》2000年版一部8.2 整理炮制方法和操作过程8.2.1 熟地黄8.2.1.1 拣选挑出异物、霉变、虫蛀部分。
8.2.1.2 定额包装每件定额包装(50kg/件),入净药材中间站备用。
8.2.2 山茱萸8.2.2.1 拣选挑出异物和霉变、虫蛀部分。
六味地黄丸微生物限度检查方法学验证研究

行 方 法 学 验 证 。 方 法 : 用 茵 液 组 、 试 品 对 照 组 、 验 组 、 释 剂 对 照 组 进 行 3次 独 立 平 行 试 验 , 别 计 算 各 试 采 供 试 稀 分 验 茵 每 次 试 验 的 回 收 率 。 结 果 : 试 验 茵 的 回 收 率 均 高 于7 各 0% , 释 剂 对 5种 试 验 茵 的 回 收 率 均 高 于 7 稀 0% 。 结 论 : 用常规 法 可以进行 本 品的微 生物 限度检 查 。 采 [ 键 词 ] 六 味 地 黄 丸 ; 生 物 限 度 检 查 ; 法 关 微 方 [ 图 分 类 号 ] R9 7 1 中 2 . [ 献 标 识 码 ] A 文 [ 章 编 号 ] 1 7 — 1 6 2 0 O10 0 —3 文 6 10 2 ( 0 7) — 0 10
( i e nt ue o Drg C nrl fS a x rvne if n 0 1 0 L n nIsi t f r u o to o h n i o ic ,L n e 4 0 0,S a x ,C ia) f t P h n i hn
[ B T C Obet e oep r h cuayadrlblyo h ehdo corai l tt nt to A S RA T] jci :T x l eteacrc n eait f em to f rogns i ai e f v o i i t mi m mi o s
o v n i a c n e t n l t o s o me h d .
[ E WOR S iw i iun i; c rai l tt nt t vri t no too g K Y D ]Lu e DhagP1 mio gns i ai s; eic i f h l y 1 r m mi o e fao me d o
ZHC1107·00·001-03六味地黄丸(浓缩丸)工艺规程

ZHC1107·00·001-03六味地黄丸(浓缩丸)工艺规程张恒春药业有限公司第 2 页共 32 页六味地黄丸(浓缩丸)工艺规程文件编码ZHC1107·00·001-03 Copy №起草:日期:审核:日期:批准:日期:执行批准:日期:变更内容修订号修订原因与内容执行日期00新制订01更改标准依据和生产批量02工艺变更03组织机构变更分发单位质量技术部[]生产供应部[]行政部[]财务审计部[]销售部[]市场部[]招商部[] QA 室[]QC 室[]前处理提取车间[]固体制剂一车间[]固体制剂二车间[]设备动力车间[]液体制剂车间[]目录1.主题内容………………………………………………………………………………………32.适用范围………………………………………………………………………………………33.引用标准………………………………………………………………………………………34.职责……………………………………………………………………………………………35.产品概述………………………………………………………………………………………36.处方和依据……………………………………………………………………………………47.工艺流程图……………………………………………………………………………………58.原药材的整理炮制……………………………………………………………………………69.操作过程及工艺条件…………………………………………………………………………710.质量监控………………………………………………………………………………………1111.原辅料、中间体、成品、包装材料的质量标准 (12)12.原料、辅料、包装材料消耗定额及技术经济指标的计算 (19)13.技术安全及劳动保护…………………………………………………………………………2014.工艺卫生………………………………………………………………………………………2115.工序收率计算、物料平衡及生产周期的批量规定 (23)16.劳动组织与岗位定员…………………………………………………………………………2517. 动力消耗定额…………………………………………………………………………………2718. 设备……………………………………………………………………………………………2719. 综合利用和环境保护…………………………………………………………………………30附录A 常用理化常数、换算表 (32)1 主题内容本工艺规程规定了六味地黄丸生产全过程的工艺技术、质量、物耗、安全、工艺卫生、环境保护等内容。
2015年版中国药典微生物限度检查方法验证方案

2015年版中国药典微生物限度检查方法验证方案佛山市华普生药业有限公司文件编码:TS-VP-4201-00页数:1/56 人工牛黄甲哨唑胶囊微生物限度检查方法验证方案人工牛黄甲硝唑胶囊微生物限度检查方法验证方案起草部门:QC组签名:日期:审核部门:QC组签名:日期:部门:质量部签名:日期:批准质量负责人签名:日期:质量部颁发本文件根据需要应分发于以下部门:01 质量部下表用于记录修订/变更主要内容及历史。
佛山市华普生药业有限公司文件编码:TS-VP-4201-00页数:2/56 人工牛黄甲哨唑胶囊微生物限度检查方法验证方案文件编号修订原因修订日期TS-VP-4201-00 按GMP(2010年修订版)要求新制定2015.10.22佛山市华普生药业有限公司文件编码:TS-VP-4201-00页数:3/56 人工牛黄甲哨唑胶囊微生物限度检查方法验证方案目录1. 概述2. 验证目的和范围3. 组织及职责4. 验证进度计划表5. 验证所需要的仪器设备及相关文件的确认6. 验证所需要的菌种、培养基、检验样品的确认7.验证项目和验证方法7.1试验菌株7.2需氧菌总数检查、霉菌和酵母菌总数检查方法验证的菌液制备7.3需氧菌总数检查、霉菌和酵母菌总数检查方法验证--常规倾注平皿法7.4需氧菌总数检查方法验证—离心沉淀-薄膜过滤法7.5控制菌检查方法验证—离心沉淀-薄膜过滤法8.偏差与漏项控制佛山市华普生药业有限公司文件编码:TS-VP-4201-00页数:4/56 人工牛黄甲哨唑胶囊微生物限度检查方法验证方案9.验证报告会审佛山市华普生药业有限公司文件编码:TS-VP-4201-00页数:5/56 人工牛黄甲哨唑胶囊微生物限度检查方法验证方案1. 概述我公司生产品种人工牛黄甲硝唑胶囊,产品微生物限度检查项目为需氧菌总数、霉菌和酵母菌总数、以及大肠埃希菌检查和沙门菌检查。
参照《中国药典》2015版四部附录1105:微生物计数法,以及1106:控制菌检查法的规定,本公司对该产品的微生物限度检查方法予以验证。
六味地黄丸质量标准

六味地黄丸质量标准六味地黄丸是一种中药材,具有滋阴补肾、益精安神的功效。
在中医药领域中,六味地黄丸被广泛应用于肾阴亏虚、肾阳虚弱、精神不振、腰膝酸软等症状的治疗。
因此,对于六味地黄丸的质量标准的制定显得尤为重要。
一、外观特征。
六味地黄丸的外观应呈棕黄色,表面应光滑,无明显凹凸、裂纹和杂质。
丸面不应有霉斑、霉点、虫蛀、变色等现象,丸体应匀称,大小一致。
二、理化指标。
1.含量测定,六味地黄丸中地黄、山药、牡蛎、山茱萸、牛膝、鹿角霜的含量应符合国家药典规定。
2.水分含量,六味地黄丸的水分含量应符合国家药典规定,以保证产品的稳定性和质量。
3.微生物限度,六味地黄丸中细菌、霉菌等微生物的数量应符合国家药典规定,以保证产品的卫生安全。
三、质量控制。
1.原材料选择,生产六味地黄丸的原材料应符合国家相关标准,且应经过严格的质量检验和筛选。
2.生产工艺,生产过程中应严格按照国家药典和相关法规进行操作,确保产品的质量稳定和安全性。
3.贮存条件,六味地黄丸在贮存过程中应避免阳光直射、高温潮湿等环境,以免影响产品的质量。
四、检验方法。
1.外观检查,采用肉眼观察,检查六味地黄丸的外观特征是否符合标准要求。
2.含量测定,采用高效液相色谱法等方法进行含量测定,确保六味地黄丸中各成分的含量符合标准要求。
3.微生物检验,采用菌落总数法、大肠杆菌和沙门氏菌的检验方法,确保产品的微生物限度符合标准要求。
五、质量标准执行。
生产企业在生产过程中应严格按照六味地黄丸的质量标准进行生产,确保产品的质量稳定和安全。
同时,监管部门应加强对六味地黄丸产品的抽检,对不符合质量标准的产品进行处罚,以保障患者的用药安全。
六、结语。
六味地黄丸作为一种中药材,其质量标准的制定对于保障产品的质量和安全具有重要意义。
只有严格执行质量标准,才能确保六味地黄丸的药效和安全性,为患者带来更好的治疗效果。
因此,各生产企业和监管部门都应高度重视六味地黄丸的质量标准,共同努力,为中药材的质量和安全保驾护航。
六味地黄丸(浓)工艺验证风险评估

六味地黄丸(浓缩丸)工艺验证风险评估1评估工艺参数关键性评估报告基本定义和方法1、基本定义与概念术语定义备注用来描述为了确保药品符合规格标准,必须控制在预定范围内的工艺步骤、工艺条件测试要求或其关键的他有关参数或项目。
在某个工艺下定义单个条件的单个参数。
比如工艺参数有溶媒、温度,压力,时间,密度,pH,数参数/工艺参数量等等一个的直接或间接的影响物料质量的物理化学或微生物特性。
产品指标是生产者提出和证明、由法质量属性规机构批准的质量特性。
在确认过的范围内的工艺参数下进行操作,同时保持其他参数不变,能生产出符合其相应质量特性可接受范围的物料活性成分的关键质量特性是指一种质量特性,如果它与已建立的既定的标准发生偏差的话,将会导关键质量属性致形成的药品在保证其质量、安全性或药品功效方面大大降低。
22、评估流程2.1 工艺流程图:34三步法评估关键工艺参数1)列出产品生产工艺过程相关的质量风险。
2)筛选影响与工艺相关的关键质量属性的工艺步骤3)筛选影响质量的工艺参数确定工艺参数最终关键性3、风险的评估标准表格。
表1:风险的严重程度(SEV)评分制(10分制)结果结果的严重性评分在没有任何预兆或有预兆的情况下发生的,影响操作人员和机器安全或违反有关法律法规的及其严重的严重危害9-10 失败模式。
造成生产线的较大破坏,可能造成产品部分或全部报废,使产品或系统主要功能失败或或降级工作,且7-8 高顾客(包括下工序和最终用户)不满意。
对生产线造成较小的破坏,可能有部分产品需报废(但无需挑选)或需对100%产品进行返工。
顾客感中等5-6 觉到不方便或有些不满。
对生产线造成较小的破坏,可能需对产品进行挑选,部分产品进行返工。
有一半到大部分的顾客可以发低3-4 现这些缺陷。
对生产线造成微小的破坏,部分产品需进行返工。
但很少有顾客可以发现到缺陷,或者对产品无影响,微小1-2 客户很难发现到缺陷。
5表2:风险的发生几率(OCC)评分制(10分制)失败发生的可能性失败的几率举例评分非常高:几乎不可避免失败≥1/3 极频繁的发生9-10高:反复发生的失败≥1/20 每日发生7-8中等:偶尔发生的失败≥1/2000 每月发生5-6低:相对非常少发生的失败≥1/10000 每几个月发生一次3-4微小:几乎不可能发生的失败≤1/150000 仅发生过一次1-2表3:风险被检测或发现的可能性(DET)评分制(10分制)发现的可能性在发生之前通过过程控制可以检测出缺陷的可能性大小评分绝度不可能或极小完全没有有效的方法或目前的方法几乎不可能检测出失败模式9-10 可能性较低目前的方法只有较低的可能性可以检测出失败模式7-8中等可能性目前的方法有中等的可能性可以检测出失败模式5-6可能性较大目前的方法有较大的可能性可以检测出失败模式3-4可能性非常大或几乎肯定能目前的方法可以检测出失败模式的可能性非常大或几乎可以肯定,有可靠的检测方法。
六味地黄丸 质量标准

六味地黄丸质量标准六味地黄丸是一种常见的中药材,被广泛应用于中医临床治疗中。
为了确保六味地黄丸的质量,制定了一系列的质量标准,以便于监督和检测。
本文将对六味地黄丸的质量标准进行详细介绍,以便于相关人员了解和遵守。
一、外观特征。
六味地黄丸的外观应为圆形,色泽黄褐色,具有特殊的药香味。
外观应干燥,无明显的霉变、虫蛀、异物等现象。
二、理化指标。
1. 挥发性物质,应不超过5.0%。
2. 残留溶剂,应符合国家标准规定。
3. 酸碱度,应在5.5-7.0之间。
4. 含水量,应不超过10.0%。
5. 微生物限度,应符合国家标准规定。
三、有效成分含量。
六味地黄丸的有效成分含量应符合国家药典规定,主要包括地黄、山药、牡丹皮、山茱萸、熟地、桑椹等成分。
其中,地黄和山药的含量应在一定范围内,以确保药效的稳定性和疗效。
四、微生物检测。
六味地黄丸在生产过程中需进行微生物检测,包括菌落总数、大肠杆菌、霉菌和酵母菌等指标。
微生物限度应符合国家标准规定,以确保产品的卫生安全。
五、重金属及有害物质检测。
六味地黄丸需进行重金属及有害物质检测,包括铅、汞、砷、镉等重金属元素的含量,以及农药残留、硫代硫酸盐等有害物质的检测。
相关指标应符合国家标准规定,以确保产品的安全性。
六、贮存要求。
六味地黄丸在贮存过程中,应避免阳光直射,存放在阴凉干燥处,远离异味。
贮存期内应定期检查产品的外观和理化指标,确保产品质量稳定。
七、包装要求。
六味地黄丸的包装应符合国家药典规定,包括包装材质、标签标识、防伪措施等。
包装应完整,标识清晰,防伪措施有效,以保障产品的质量和安全。
总结。
六味地黄丸作为一种重要的中药材,其质量标准对于保障产品质量和使用效果具有重要意义。
各生产企业和相关部门应严格按照国家标准执行,确保产品质量稳定可靠,为中医临床治疗提供有力支持。
同时,消费者在购买和使用六味地黄丸时,也应注意选择正规渠道购买,遵医嘱使用,以确保安全有效。
六味地黄丸(水蜜丸)微生物限度检查法适用性试验研究

六味地黄丸(水蜜丸)微生物限度检查法适用性试验研究刘鑫;欧阳丽影【摘要】目的:对六味地黄丸(水蜜丸)进行微生物限度检查法适用性试验的研究.方法:按照2015版《中国药典》四部通则的要求检查,通过回收率的比较来确定适宜的检查方法.结果:需氧菌总数取1:100的供试液采用平皿倾注法,霉菌和酵母菌总数取1:10的供试液采用平皿倾注法,控制菌大肠埃希菌培养基用量为100ml,沙门菌培养基用量为200ml,耐胆盐革兰阴性菌培养基用量为10ml.结论:建立了六味地黄丸的微生物限度检查法,该方法有效可行.【期刊名称】《黑龙江医药》【年(卷),期】2017(030)004【总页数】4页(P718-721)【关键词】六味地黄丸;微生物限度检查法;2015版《中国药典》【作者】刘鑫;欧阳丽影【作者单位】黑龙江省食品药品检验检测所黑龙江哈尔滨150088;黑龙江省食品药品检验检测所黑龙江哈尔滨150088【正文语种】中文【中图分类】R927.12六味地黄丸是中医名方,是滋补肾阴的基础方剂,组方上具有“三补三泻”的特点[1]。
用于肾阴亏损,头晕耳鸣,腰膝酸软,骨蒸潮热,盗汗遗精,消渴,现代常用本方治疗口腔溃疡、高血压、男性不育等病[2]。
六味地黄丸由熟地黄、酒萸肉、牡丹皮、山药、茯苓、泽泻六味药材组成,按8∶4∶4∶3∶3∶3的比例配伍成方[3-4]。
将六味药材粉碎成细粉,过筛,混匀。
用乙醇泛丸,干燥,制成水丸,或每100g粉末加炼蜜35~50g与适量的水,制丸,干燥,制成水蜜丸;或加炼蜜80~110g制成小蜜丸或大蜜丸,即得[5]。
根据六味地黄丸的处方和工艺可知其含有生药原粉,按照2015版《中国药典》四部附录通则1107的规定,需氧菌总数每克不得大于3×104cfu,霉菌和酵母菌总数不得大于102cfu,大肠埃希菌每克不得检出,沙门菌每10克不得检出,耐胆盐革兰阴性菌每克应小于102cfu[6]。
根据其微生物限度标准,并参照《黑龙江省药品微生物检验方法汇编》中六味地黄丸的微生物限度检查法,按照2015版《中国药典》四部附录通则1105、1106的要求对六味地黄丸微生物限度检查法适用性实验进行研究。
六味地黄丸(浓缩丸)申报资料

已有国家标准的中成药注册分类第9类受理编号:原始编号:申请编号:六味地黄丸(浓缩丸)申报资料目录(一)综述资料资料1药品名称资料2证明性文件资料3立题目的与依据资料4对主要研究结果的总结及评价资料5药品说明书样稿、起草说明及最新参考文献资料6包装、标签设计样稿(二)药学研究资料资料7药学研究资料综述资料8药材来源及鉴定依据资料12生产工艺的研究资料及文献资料,辅料来源及质量标准资料15药品标准草案及起草说明资料16样品及检验报告书资料17药物稳定性研究的试验资料及文献资料资料18直接接触药品的包装材料和容器的选择依据及质量标准已有国家标准的中成药注册第9类六味地黄丸(浓缩丸)申报资料(一)综述资料资料1药品名称资料2证明性文件资料3立题目的与依据资料4对主要研究结果的总结及评价资料5药品说明书样稿、起草说明及最新参考文献资料6包装、标签设计样稿药品名称1、中文名:六味地黄丸(浓缩丸)2、汉语拼音名:Liuwei Dihuang Wan3、命名依据:六味地黄丸收载于部颁标准《中药成方制剂》第11册36页证明性文件1.药品生产企业《营业执照》复印件(附后)2.药品生产企业《药品生产许可证》复印件(附后)3.《药品生产质量管理规范》认证证书复印件(附后)4.直接接触药品的《药品包装材料和容器注册证》复印件(附后)实业有限公司《药品包装材料和容器注册证》5.中药保护品种情况检索结果报告单复印件(附后)保证书六味地黄丸(浓缩丸)收载于《中华人民共和国卫生部药品标准》(中药成方制剂)第11册36页,经国家中药品种保护审评委员会检索,该品种未受保护,不存在侵权的问题。
立题目的与依据1.立题目的与依据六味地黄丸(浓缩丸)是用于调理人体机能,治疗肝肾阴虚的经典传统中药。
随着当前中国社会的进步、人们生活方式的演变和人们以及工作压力的增强,对于滋补肝肾,辅佐调理人体机能且无毒副作用的药物就愈加需求。
六味地黄丸(浓缩丸)是根据祖国医学的滋补肝肾的原则,在传统丸剂的基础上,结合现代药理学,中药化学等理论,开发研制的药物。
六味地黄丸成份测定

论文摘要:文章分析了六味地黄丸(浓缩丸)中测定丹皮酚、马钱苷含量的高效液相色谱方法。
主题词:六味地黄丸成份测定中图分类号:tq421.1六味地黄丸(浓缩丸)质量标准收载于部颁标准第11册。
该方出于宋代?钱乙《小儿药证直诀?卷下》,系中医补肾的经典方,为滋阴补肾之著名方剂。
笔者参考《中国药典》对该产品进行研究,在原部颁标准的基础上,对质量标准进行整理提高,用hplc法测定牡丹皮中丹皮酚及山茱萸中马钱苷的含量,并进行了方法学考察。
现将结果报道如下。
1 仪器与材料1.2 试剂甲醇、乙腈为色谱纯(中国上海陆都试剂厂),乙醚、乙醇、磷酸、四氢呋喃等均为分析醇,水为高纯水。
1.3 对照品丹皮酚对照品(中国药品生物制品检定所,110708-9704),马钱苷对照品(中国药品生物制品检定所,111640-200401)1.4 样品六味地黄丸(浓缩丸)为苏州长甲药业有限公司生产。
2 方法与结果2.1 牡丹皮的含量测定2.1.1 色谱条件c18柱(依利特;250 mm×4.6 mm,5 μm),流动相:甲醇-水(6:4),流速1.0 ml?min-1,柱温30℃,检测波长为274 nm。
2.1.3 对照品溶液的制备精密称取对照品适量,加甲醇制成每毫升含16 μg的溶液,作为对照品溶液。
2.1.4 空白对照实验按处方去牡丹皮制成空白制剂,取空白对照样品0.44 g,精密称定,置具塞锥形瓶中,精密加入甲醇100 ml,与供试品制备相同方法制得缺牡丹皮空白溶液。
分别取出对照品溶液、样品供试液、空白对照溶液依法进样检验。
结果显示空白对照无干扰。
2.1.5 线性关系的考察精密称取丹皮酚对照品适量,加甲醇稀释至54.1 μg/ml,摇匀。
分别精密吸取丹皮酚对照品溶液1,2,3,4,5 ml,加甲醇稀释至10 ml,摇匀,分别得浓度为5.41,10.82,16.23,21.64,27.05 μg/ml的丹皮酚溶液。
照高效液相色谱法,进样10 μl,测定其峰面积。
六味地黄丸微生物限度检查检验方法验证方案(2015年版)

1.概述1.1六味地黄丸(浓缩丸)是中国药典品种,批准文号:国药准字Z42020681,其处方由熟地黄、酒萸肉、牡丹皮、山药、茯苓、泽泻组成,具有滋阴补肾之功效,用于肾阴亏损,头晕耳鸣,腰膝酸软,骨蒸潮热,盗汗遗精,消渴。
有效期:36个月。
1.2根据剂型与产品处方判断,六味地黄丸(浓缩丸)的微生物限度检查内容应包括需氧菌总数、霉菌和酵母菌总数,以及大肠埃希菌、沙门菌、耐胆盐革兰阴性菌检查;根据六味地黄丸(浓缩丸)的成分和历史验证数据分析,该产品无明显的抑菌活性,拟采用“平皿法”进行微生物限度检查,采用“常规法”进行控制菌检查。
2.目的确认所采用的方法适用于该产品的微生物计数,以确保测定方法的可靠性,确保检验结果的准确可靠。
若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
3.依据《中国药典》2015年版四部“非无菌产品微生物限度检查:微生物计数法”、“非无菌产品微生物限度检查:控制菌检查法”、“非无菌产品微生物限度标准”。
4.范围本验证方案适用于公司六味地黄丸微生物限度检查检验方法的适用性试验。
5.职责5.1验证领导小组5.1.1负责验证方案的审批。
5.1.2负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
5.1.3负责验证数据及结果的审核。
5.1.4负责验证报告的审批。
5.1.5负责发放验证证书。
5.2质量部5.2.1负责验证所需的培养基、样品、菌液、缓冲液等的准备。
5.2.2负责取样及对样品的检验。
5.3项目验证小组5.3.1负责拟订验证方案。
5.3.2负责验证方案的实施和收集各项验证试验记录,并对试验结果进行分析后,起草验证报告,报验证领导小组。
6.验证实施条件6.1验证方案培训:在验证实施前,应对参与验证的人员进行验证方案以及与验证相关的文件进行培训,确保相关人员掌握了验证的相关要求与知识。
6.2微生物限度检测室:检验所使用的检测室应经过HVAC系统确认,并符合要求。
六味地黄丸中微量元素分析

六味地黄丸中微量元素分析王磊;朱冬;李超;温辉煌;唐志华【摘要】采用湿法、干法处理同一厂家生产的不同剂型的六味地黄丸,并分别用原子吸收分光光度法测其Fe、Cu、Mn、Zn、Ca等微量元素的含量。
结果表明,2种六味地黄丸中都含有丰富的Fe、Cu、Mn、Zn、Ca元素,浓缩丸所含尤为丰富。
不同剂型的六味地黄丸,其所含的微量元素也不同。
%To treat Liuwei Dihuangpill by hydro-assimilation and dry-ashing at the same time, and to determine the five trace elements Fe,Cu,Mn,Zn,Ca by AAS. The results showed that there had rich trace elements in Liuwei Dihuang pill, the richest trace elments in concentrated pill. There had different content of trace element in different forms of Liuwei Dihuang pill.【期刊名称】《宁夏农林科技》【年(卷),期】2012(053)005【总页数】2页(P113-114)【关键词】六味地黄丸;微量元素;分析【作者】王磊;朱冬;李超;温辉煌;唐志华【作者单位】陕西理工学院化学与环境科学学院,陕西汉中723001;陕西理工学院化学与环境科学学院,陕西汉中723001;陕西理工学院化学与环境科学学院,陕西汉中723001;陕西理工学院化学与环境科学学院,陕西汉中723001;陕西理工学院化学与环境科学学院,陕西汉中723001【正文语种】中文【中图分类】R917六味地黄丸源于宋代医学家钱乙的《小儿药证直诀》,其主要功能是滋阴补肾,用于肾阴亏损、头晕耳鸣、腰膝酸痛、遗精盗汗等症的治疗[1],历经千年仍备受青睐。
六味地黄丸质量考察

RSD (%)
0.1
2.4样品含量测定 依法测定5批样品,结果芍药苷含量分别为3.48,3.53,3.49,
3.54,3.45 mg/g。
3 讨论 3.1 考察了以40%乙醇、稀乙醇和60%乙醇作为提取溶剂,采用 超声提取方式提取,发现采用稀乙醇的提取效率稍高于其他两种 溶剂;同时对超声提取时间进行比较,发现芍药苷在较短的时间内 即能提取完全,为确保样品提取彻底,故选择超声处理30 min。
溶出度检查项目。
关t词:六味地黄丸;含量测定;溶出度
中图分类号:R286.O;I匕跗.1
文献标识码:A
文章编号:1006—4931(2008)02—0039—02
Quality Investigation of Liuweidihuang Pill Qin Xiao,Rao Weiwen,Zhou耽njie
取3 mL,用氯仿萃取3次(10,5,5 mL),定容至25 mL,在276 nm波 长处测定吸光度,用标准曲线计算出样品中丹皮酚含量,并以此值 作为该样品100%溶出时的
含量,将在上述各时间点1
取样测得的结果与100%
溶出量相比较,即得各样
品的累积溶出百分率,按
照不同剂型比较其平均 值,结果见表1和图1。 3讨论
剂型厂家批号
表1 12批样品质量考察结果
鱼兰!竖!!!±丝墨塑鲞坐主!丝:!!!!溶出参数溶散时限
马钱苷丹皮酚15 min 30 min 60 min 120 min‰(min) (rain)
2.2溶散时限比较 根据2005年版《中国药典(一部)》附录丸剂的溶散时限检查
法,取样品(大蜜丸除外)6丸,置规定孔径筛网的吊篮中,加上挡 板,于水浴温度为(37±1)℃的崩解试验仪中检查溶散时限。结果 均符合规定,15,30,60,120 rain时平均累积溶出率,水蜜丸分别为 12.8%,22.1%,33.6%,47.3%,浓缩丸分别为15.4%,29.2%, 49.6%,73.4%,大蜜丸分别为38.4%,59.2%,73.0%,78.1%,详 见表1。 2.3体外溶出度他1比较
六灵丸生药粉检验操作规程
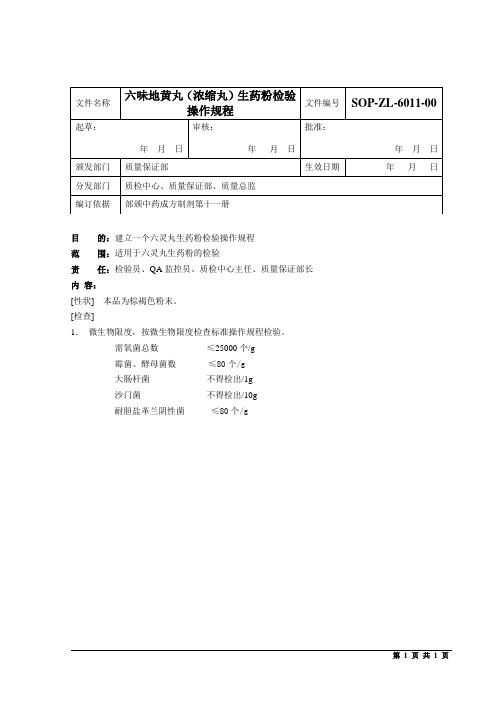
[性状]本品为棕褐色粉末。
[检查]
1.微生物限度,按微生物限度检查标准操作规程检验。
需氧菌总数≤25000个/g
霉菌、酵母菌数≤80个/g
大肠杆菌不得检出/1g
沙门菌不得检出/10g
耐胆盐革兰阴性菌≤80个/g
文件名称
六味地黄丸(浓缩ห้องสมุดไป่ตู้)生药粉检验操作规程
文件编号
起草:
年月日
审核:
年月日
批准:
年月日
颁发部门
质量保证部
生效日期
年月日
分发部门
质检中心、质量保证部、质量总监
编订依据
部颁中药成方制剂第十一册
目的:建立一个六灵丸生药粉检验操作规程
范围:适用于六灵丸生药粉的检验
责任:检验员、QA监控员、质检中心主任、质量保证部长
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
G M P文件 湖北****药业有限公司本文件为受控文件,仅限湖北****药业有限公司内部使用。
未经授权,不得使用、泄露或拷贝!1 1.概述1.1六味地黄丸(浓缩丸)是中国药典品种,批准文号:国药准字Z42020681,其处方由熟地黄、酒萸肉、牡丹皮、山药、茯苓、泽泻组成,具有滋阴补肾之功效,用于肾阴亏损,头晕耳鸣,腰膝酸软,骨蒸潮热,盗汗遗精,消渴。
有效期:36个月。
1.2根据剂型与产品处方判断,六味地黄丸(浓缩丸)的微生物限度检查内容应包括需氧菌总数、霉菌和酵母菌总数,以及大肠埃希菌、沙门菌、耐胆盐革兰阴性菌检查;根据六味地黄丸(浓缩丸)的成分和历史验证数据分析,该产品无明显的抑菌活性,拟采用“平皿法”进行微生物限度检查,采用“常规法”进行控制菌检查。
2.目的确认所采用的方法适用于该产品的微生物计数,以确保测定方法的可靠性,确保检验结果的准确可靠。
若检验程序或产品发生变化可能影响检验结果时,计数方法应重新进行适用性试验。
3.依据《中国药典》2015年版四部“非无菌产品微生物限度检查:微生物计数法”、“非 无菌产品微生物限度检查:控制菌检查法”、“非无菌产品微生物限度标准”。
4.范围本验证方案适用于公司六味地黄丸微生物限度检查检验方法的适用性试验。
5.职责5.1验证领导小组5.1.1负责验证方案的审批。
5.1.2负责验证的协调工作,以保证本验证方案规定项目的顺利实施。
5.1.3负责验证数据及结果的审核。
5.1.4负责验证报告的审批。
5.1.5负责发放验证证书。
5.2质量部5.2.1负责验证所需的培养基、样品、菌液、缓冲液等的准备。
5.2.2负责取样及对样品的检验。
5.3项目验证小组 5.3.1负责拟订验证方案。
5.3.2负责验证方案的实施和收集各项验证试验记录,并对试验结果进行分析后,起草验证报告,报验证领导小组。
6.验证实施条件6.1验证方案培训:在验证实施前,应对参与验证的人员进行验证方案以及与验证相关的文件进行培训,确保相关人员掌握了验证的相关要求与知识。
6.2微生物限度检测室:检验所使用的检测室应经过HVAC系统确认,并符合要求。
6.3检验用水:验证过程使用的纯化水其制备系统应经过确认并符合要求,纯化水质量应经过检验并符合《中国药典》2015年版二部的要求。
6.4检验仪器设备:验证涉及的检验仪器(设备)与检验方法,应经过技术监督局校验合格或者公司确认/验证合格。
6.5培养基:验证所使用的培养基应经过培养基的适用性检查,其结果符合《中国药典》的相关要求。
见附件2:培养基确认。
6.6验证菌种:验证所使用的菌种,其种类与传代次数应符合《中国药典》的相关要求。
菌种情况见附件3:菌种确认。
7.合格标准7.1在需氧菌、霉菌及酵母菌计数的三次独立平行试验中,试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值应在0.5~2范围内。
7.2在控制菌检查的试验中试验组应检出试验菌,阳性对照组应检出试验菌,阴性对照组不得检出试验菌。
8.验证方法8.1菌液制备:8.1.1取铜绿假单胞菌、金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌的新鲜培养物各1ml,分别加0.9%无菌氯化钠溶液9ml,10倍递增稀释至10-5-10-7。
取黑曲霉的新鲜培养物加入3-5ml含0.05%(ml/ml)聚山梨脂80的0.9%无菌氯化钠溶液,将孢子洗脱。
然后,采用适宜的方法吸出孢子悬液至无菌试管内,用含0.05%(ml/ml)聚山梨脂80的0.9%无菌氯化钠溶液制成适宜浓度的黑曲霉孢子悬液。
8.1.2取1ml上述制备的铜绿假单胞菌、金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌菌液分别注入平皿中,立即倾注胰酪大豆胨琼脂培养基,每株试验菌平行制备2个平皿,按平皿法测定其菌数。
8.1.3、取1ml上述制备白色念珠菌、黑曲霉菌液注入平皿中,立即倾注沙氏葡萄糖琼脂培养基,每株试验菌平行制备2个平皿,按平皿法测定其菌数。
8.1.4结果:见附件4:菌液浓度确定。
8.2需氧菌、霉菌和酵母菌计数方法适用性试验8.2.1供试液制备:称取供试品10g,用胰酪大豆胨液体培养基稀释至100ml,用匀浆仪等适宜的方法混匀,制成1:10供试液。
8.2.2试验组:吸取1:10的供试液9.9ml,共5份,每份中加入0.1ml的试验菌悬液后摇匀。
8.2.3菌液对照品:吸取稀释液胰酪大豆胨液体培养基9.9ml ,共5份,每份中加入与试验组相同的菌悬液后摇匀。
8.2.4试验组和菌液对照组摇匀后,分别从所有试验菌试管中吸取1ml 注入直径90mm 的平皿中,倾注胰酪大豆胨固体培养基;另分别吸取白色念珠菌1ml 注入直径90mm 的平皿中,倾注沙氏葡萄糖琼脂培养基;平行2份。
8.2.5供试品对照组:吸取1:10的供试液1ml 注入直径90mm 的平皿中,平行四份,其中两个平皿中注入胰酪大豆胨琼脂培养基,另两个注入沙氏葡萄糖琼脂培养基,摇匀。
8.2.6将以上平皿分别置30~35℃或20~25℃培养,需氧菌培养不超过3天,真菌培养不超过5天,在3天和5天分别进行计数。
8.2.7计算公式:25.0-=-菌液对照组菌落数供试品对照组菌落数试验组菌落数8.2.8试验结果:8.2.8.1见附件5:需氧菌总数计数方法适用性检查结果8.2.8.2附件6:霉菌和酵母菌总数计数方法适用性检查结果8.3控制菌检查8.3.1大肠埃希菌8.3.1.1供试液制备:同“需氧菌、霉菌和酵母菌计数方法适用性试验”供试液制备。
8.3.1.2试验组:取1:10供试液10ml和≤100cfu大肠埃希菌菌液加入100ml 胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24h;取上述培养物1ml接种至100ml麦康凯液体培养基中,42~44℃培养24~48h;取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35℃培养18~72h。
8.3.1.3阳性对照:取≤100cfu大肠埃希菌菌液加入100ml胰酪大豆胨液体培养基中,其他同试验组。
8.3.1.4阴性对照:取100ml胰酪大豆胨液体培养基,30~35℃培养18~24h;其他同试验组。
8.3.1.5结果:见附件6:大肠埃希菌方法适用性检查结果8.3.2沙门菌8.3.2.1供试液制备:同“需氧菌、霉菌和酵母菌计数方法适用性试验:供试液制备。
8.3.2.2试验组:8.3.2.2.1取供试液10ml和≤100cfu乙型副伤寒沙门菌菌液,加入200ml胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24h。
8.3.2.2.2取上述培养物0.1ml接种至10mlRV沙门增菌液体培养基中,30~35℃培养18~24h。
8.3.2.2.3取少量RV沙门增菌液体培养物划线接种于木糖赖氨酸脱氧胆酸盐琼脂培养基平板上,30~35℃培养18~48h。
8.3.2.3阳性对照:取≤100cfu乙型副伤寒沙门菌试验菌液,加入200ml胰酪大豆胨液体培养基。
其他同试验组。
8.3.2.4阴性对照:取200ml胰酪大豆胨液体培养基,30-35℃培养18-24h。
其他同试验组。
8.3.2.5结果:见附件7:沙门菌方法适用性检查结果8.3.3.耐胆盐革兰阴性菌8.3.3.1供试液制备:称取供试品10g,用胰酪大豆胨液体培养基稀释至100ml,用匀浆仪等适宜的方法混匀,制成1:10、1:100、1:1000的供试液,20~25℃培养2h。
8.3.3.2试验组:取10ml/支肠道菌增菌液体培养基3支,分别加入上述预培养的1:10、1:100、1:1000的供试液各1ml,和≤100cfu大肠埃希菌菌液,混匀,30~35℃培养24~48h;取上述每一培养物分别划线接种于紫红胆盐葡萄糖琼脂平板上,30~35℃培养18~24h。
8.3.3.3阳性对照:取≤100cfu大肠埃希菌菌液加入10ml/支的肠道增菌液体培养基中,混匀,30~35℃培养24~48h;其他同试验组。
8.3.3.4阴性对照:取1支肠道增菌液体培养基10ml管,加入胰酪大豆胨液体培养基1ml,混匀,30~35℃培养24~48h;其他同试验组。
8.3.3.5结果:见表9:耐胆盐革兰阴性菌方法适用性检查结果。
8.3.3.6结论:三个批次样品,试验组均:□检出,□未检出试验菌;阳性对照组均:□检出,□未检出试验菌;阴性对照组均:□检出,□未检出试验菌,拟定该产品耐胆盐革兰阴性菌检查采用法进行检查。
8.3.3.7结果:见附件9:耐胆盐革兰阴性菌方法适用性检查结果9.异常情况与偏差处理:当出现偏差时,应按《偏差处理管理规程》进行处理。
10.验证结果评定、结论与建议验证小组组长负责收集各项验证、试验记录,根据验证、试验结果对验证效果进行综合评审,起草验证报告、做出验证结论。
对验证结果的评审应包括一下内容:10.1验证试验是否有遗漏?10.2验证实施过程中对验证方案有无修改?修改原因、依据以及是否经过批准?10.3验证记录是否完整?10.4验证试验结果是否符合标准要求?偏差及对偏差的说明是否合理?是否需要进一步补充试验?11.附件11.1 附件1:验证实施条件确认11.2 附件2:培养基确认11.3 附件3:菌种确认11.4 附件4:菌液浓度确定11.5 附件5:需氧菌总数计数方法适用性检查结果11.6 附件6:霉菌和酵母菌总数计数方法适用性检查结果11.7 附件7:大肠埃希菌菌方法适用性检查结果11.8 附件8:沙门菌方法适用性检查结果11.9 附件9:耐胆盐革兰阴性菌方法适用性检查结果11.10 附件10:验证结果审批表附件1:设施设备验证确认确认人:确认日期:附件2:培养基确认确认人:确认日期:附件3:菌种确认确认人:确认日期:结论:根据要求,菌数要控制在每1ml中含菌数在≤100cfu,因此,我们确定菌液制备:铜绿假单胞菌:稀释金黄色葡萄球菌: 稀释大肠埃希菌:稀释枯草芽孢杆菌: 稀释白色念珠菌(胰酪): 稀释白色念珠菌(沙氏): 稀释黑曲霉(胰酪):稀释黑曲霉(沙氏):稀释附件5:需氧菌总数计数方法适用性检查结果供试品对照组:胰酪大豆胨琼脂培养基:()CFU/平皿1,()CFU/平皿2阴性对照组:附件6:霉菌和酵母菌总数计数方法适用性检查结果供试品对照组:沙氏葡萄糖琼脂培养基:()CFU/平皿1,()CFU/平皿2阴性对照组:附件7:大肠埃希菌方法适用性检查结果附件8:沙门菌方法适用性检查结果附件9:耐胆盐革兰阴性菌方法适用性检查结果附件10:验证结果审批表附件11:人员培训记录。
