1.1元素周期表
化学必修二 1.1元素周期表

你能否:
将前20号元素编一个周期表?
原则:体现元素周期律
回到5
元素周期表编排方法:
1、把电子层数目相同的各种元素 按原子序数递增的顺序从左到右排成横行 2、把不同横行中最外层电子数相同的 元素按电子层数递增的顺序由上而下 排成纵行
1. 周期(横行) 具有相同的电子层数而又按原子序数递 增的顺序排列的一系列元素,称为一个 周期。周期序数=电子层数。
小结
通过比较碱金属单质卤族元素单质的性质,我们可以看
出,元素性质与原子结构有密切关系,主要与原子核 最外层电子数 外电子的排布,特别是_______________ 有关。原子结
构相似的一族元素,它们在化学性质上表现出 ______ 相似性
递变性 和_________。 在元素周期表中,同主族元素从上到下原子核外电子 层数依次 增多,原子半径逐渐_____ ,失电子能力 增大 逐渐 增强 ,得电子能力逐渐 减弱 ,所以金属性 增强 逐渐 ,非金属性逐渐 减弱 _____.
非 金 属 性 逐 渐 增 强
3锂 Na 11钠 K 19钾 Rb 37铷 Cs 55铯
同一主族元素最高价氧化物对应水化物的酸碱性
IA 2 Li
IIA Li2O
IIIA LiOH
碱 性 增 强
IVA
VA
VIA
VIIA
3 Na Na2O NaOH 4 K K2O KOH
酸 性 增 强
Cl2O7 HClO4 Br2O7 HBrO4 I2O7 HIO4
常见族的别名 第ⅠA族(除氢外): 碱金属元素 第ⅣA族: 碳族元素 第ⅤA称: 氮族元素 第ⅥA族: 氧族元素 第ⅦA族: 卤族元素 0族: 稀有气体元素
二、元素性质与元素在周期表中 位置的关系
人教版高中化学必修二课件:1.1《元素周期表》(共37张PPT)

2KI+Br2 = I2+2KBr 静置后,液体分层, 氧化性: Br2 > I2
上层 无色 ,
下层 紫色 。
结论
氧化性:Cl2 > Br2 > I2 还原性:I - > Br - > Cl 小结: 氧化性:F2> Cl2> Br2>I2 还原性:F-> Cl- > Br- > I-
氧化性:F2> Cl2> Br2>I2。 Cl2可从溴、碘的盐 溶液中置换出相应的卤素单质,F2与氯、溴、 碘的盐溶液可以置换出相应的卤素单质吗?
H2+F2 = 2HF H2+Cl2 = 2HCl 暗处剧烈反应并爆炸;HF很稳定 光照或点燃反应;HCl较稳定
H2+Br2 = 2HBr
H2+I2
加热500℃ ,HBr不稳定
2HI 需不断加热,HI同时分解
■都能跟氢气反应,体现相似性 反应通式:H2 + X2 = 2HX (X= F、Cl、Br、I) ■单质氧化性减弱,体现递变性
① 除9、10、18纵行(列序)外,族序数=列序个位数。(记忆方法) ②18个纵行,只16个族;0族和第VIII族不属主族,也不属副族。
一、碱金属元素结构和化学性质的相似性和递变性
Li Na K Rb Cs
1.相似性:
最外层上都只 有一个电子 2.递变性: 核电荷数↑ 电子层数↑ 原子半径↑ 失电子能力↑ 化学性 质相似
3.请在下面的线框中用色笔画出周期表的轮廓。并标出族序数,写
出七个主族元素(可参考课本)和 0族元素的元素符号。
周期 ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB VIIB
IB IIB ⅢA ⅣA ⅤA Ⅵ AⅦA 0 种类
化学:《元素周期表-周期表结构》课件(新人教版必修2)

氕 (氢)
(重氢) 氘
(超重氢) 氚
H、D、T这三种核素互称为同位素
常见的同位素:
碳 碳-12
12C
6
碳-13
13C
6
碳-14
14C
6
氧 氯 铀
16O
8
17O
8
18O
8
35Cl
17 92
37Cl
17
234U
235U
92
238U
92
【同位素小结】
两同(同质子数、同一元素)
两不同(中子数不同、原子不同)
(2)碱金属元素从上到下(Li 、Na、K、 Rb、Cs),随着核电荷数的增加,碱金属 元素原子的电子层数逐渐 增多 ,原子核 对 最外层电子 的引力逐渐减弱,原子失 电子的能力逐渐 增强 。 元素的金属性逐渐 增强 ,与水和氧气 的反应越来越 剧烈 ,生成的氧化物越来 越 复杂 。最高价氧化物对应水化物的碱 性越来越 强 。
第88号元素: 88-86 =2
第五周期第ⅦA 族。
第七周期第ⅡA 族。
第82号元素:
第六周期第ⅣA 族。
6、下列各表为周期表的一部分(表中为 原子序数),其中正确的是( D )
A.0 11 18 19
C.
6 11 12 13 24
D.
6 14 31 32
7
7. A、B、C是周期表中相邻的三种元素,其中A、B是同 周期,B、C是同主族。此三种元素原子最外层电子数之
卤素原子结构的相似性,决定了单质化学性质的相似性。
与氢反应的能力渐弱 氢化物的稳定性渐弱 与水反应的能力渐弱
元素非金属性强弱判断依据:
1、单质跟氢气反应生成气态氢化物的 难易;
人教版高中化学必修二1.1《元素周期表》(第4课时 核素同位素)word学案

核素同位素1.了解质量数的定义。
2.了解原子的表示方法。
3.了解核素和同位素的概念。
4.能识别不同概念间的相互关系。
要点一 原子的组成 1.原子的构成。
原子(AZ X)⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧质子(带正电)中子(不带电)核外电子(带负电)2.数值关系。
(1)质量数:忽略电子的质量,将核内所有质子和中子的相对质量取近似整数值相加所得的数值。
(2)数值关系。
质量关系:质量数(A )=质子数(Z)+中子数(N)。
数量关系:原子序数=核电荷数=质子数=核外电子数。
3.表示方法。
AZ X 中X 表示某元素的原子,Z 表示质子数,A 表示质量数。
核素、同位素 1.核素。
把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
2.同位素。
(1)定义。
质子数相同而中子数不同的同一元素的不同原子互称为同位素,即同一元素的不同核素互称为同位素。
(2)特点。
天然存在的同位素,相互间保持一定的比率。
(3)核素与元素之间的关系:有的元素有多种核素,有的元素只有一种核素,所以元素分单核素元素和多核素元素。
(4)同位素的用途。
同位素在日常生活、工农业生产和科学研究中有着重要的用途。
如:①146C在考古工作中用于测定一些文物的年代;②23592U用于制造原子弹、核电站发电;③21H、31H用于制造氢弹;④放射性同位素释放的射线可用于育种、治疗癌症和肿瘤等。
【应用思考】1.所有原子的原子核都有质子和中子吗?提示:不一定。
原子核中一定含质子,但不一定有中子,如11H中只有质子而没有中子。
2.质子数相同而中子数不同的微粒一定互为同位素吗?提示:不一定。
例如:OH-与F-,它们质子数均为9,核外电子数均为10,但不能说它们互为同位素,因为它们不是同一种元素构成的。
3.结合核外电子排布讨论:互称同位素的不同核素为什么具有几乎完全相同的化学性质?提示:同种元素的不同核素核内质子数相同,具有完全相同的核外电子排布,因此化学性质几乎完全相同。
【人教版】化学必修二:1.1.1《元素周期表(1)元素周期表》课件

(2)周期的分类:
有4个,分别是第4、5、6、7周期
(3)周期序数与电子层数的关系:
周期序数 = 电子层数
第十页,共35页。
一、元素周期表
(二)元素周期表的结构
数一数,每一个(yī ɡè)周期有多少种元素?
课本(kèběn)第4页
元素(yuán sù
• ●典例透析
❖
(2014·灌云县四中高一检测(jiǎn
cè))X、Y、Z是周期表中相邻的三种短周期
元素,X和Y同周期,Y和Z同主族,三种元素
原子的最外层电子数之和为17,核内质子数
之和为31,则X、Y、Z是( )
❖ A.Mg、Al、Si B.Li、Be、Mg
❖ C.N、O、S D.P、S、O
第十六页,共35页。
(2)观察元素周期表是如何排列的呢?可以从横行,纵行分别 考虑
横行:
把电子层数相同的元素,按原子序数递增的顺序从左到
右排列。
纵行: 把最外层电子数相同的元素,按电子层数递增的顺序自上
而下排列。
(3)引入两个概念 周期:我们把横行称为周期
族: 我们把一纵行称为族
第七页,共35页。
元素(yuán sù) 周期表
一( )
二( ) 三( )
四( ) 五( ) 六( ) 七( )
第十一页,共35页。
元素(yuán sù) 周期表
第十二页,共35页。
族上面都有什么东西(dōngxī),罗马数字与英文符号都代 表什么呢?
A 表示主族 B 表示副族 罗马数字表示一二三等等
罗马数字记忆( jìyì)方法 罗马数字(Luómǎ
第三十二页,共35页。
6.短周期元素X、Y、Z在周期表中的位置关系如图所示,据此回 答下列问题(wèntí): (1)X元素形成单质的分子式是__________; (2)写出Y元素形成的单质跟水反应的化学方程式
19-20版:1.1.1 元素周期表(创新设计)

第一节元素周期表第1课时元素周期表[知识梳理]一、元素周期表的发展历程和编排原则1.发展历程2.编排原则二、元素周期表的结构1.元素周期表的结构2.常见族的特别名称第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素。
【自主思考】1.短周期元素中族序数与周期数相同的元素有哪些?提示短周期中族序数与周期数相同的有三种元素:若族序数(或周期数)为1,则为氢;若族序数(或周期数)为2,则为铍;若族序数(或周期数)为3,则为铝。
2.在元素周期表中每一纵行的元素的原子的最外层电子数都相同,这种说法对吗?提示这个说法不正确。
He元素的原子最外层电子数为2,不是排在ⅡA族,而排在0族(其他元素的原子最外层电子数为8)。
[效果自测]1.判断正误,正确的打“√”,错误的打“×”。
(1)现行元素周期表的编排依据是相对原子质量()(2)一个横行即是一个周期,一个纵行即是一个族()(3)最外层电子数相同的元素一定是同族元素()(4)每一周期都是碱金属元素开始,稀有气体元素结束()答案(1)×(2)×(3)×(4)×2.观察元素周期表,确认每一纵行各代表哪一族,如:按从左到右的顺序排列,第3纵行是第________族,第15纵行是第________族,第9纵行是第________族,ⅤB族在第________纵行,ⅢA族处于第________纵行等。
答案ⅢBⅤAⅧ5133.将下列元素或原子序数所对应的位置用短线连接起来。
①C a.第二周期第ⅥA族②O b.第三周期第ⅦA族③13 c.第二周期第ⅣA族④17 d.第三周期第ⅢA族答案①—c②—a③—d④—b探究一、周期表的结构【合作交流】1.为什么将Li、Na、K等元素编在元素周期表的同一个主族?提示最外层电子数相同的主族元素属于同一主族。
2.元素周期表中所含元素种类最多的是哪一个族?提示因ⅢB族中含有镧系和锕系元素,元素种类最多。
原创1:1.1.1 元素周期表

? Er= 56 La= 94
? Yt= 60 Di= 95
? In= 75.6 Th=118?
Zr= 90 Nb=94 Mo=96 Rh=104.4 Ru=104.4 Pd=106.6 Ag=108 Cd=112 U=116 Sn=118 Sb=122 Te= 128?
I= 127 Cs= 133 Ba= 137
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
元素周期表
1.周期表编排原则
第 10 页
1.1原子序数:按照元素在周期表中的顺序给元素编号 原子序数=__质__子__数_____=_核___电__荷__数____=_核___外__电__子__数_____
1.2编排原则 (1)周期:把___电__子__层__数____相同的元素,按_原___子__序__数__递___增___的顺序,
第6 页
如果发现第114号、 第116号、第118号、 第166号……等新元 素,它们又该安置 在元素周期表的什 么位置?
元素周期表
第7 页
1.周期表编排原则
H 周期表中各元素的原子序数是如何确定的?He
原子序数其实就是核电荷数
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
元素周期表
第 20 页
4.判断正误
× (1)最外层电子数为2的元素一定在第ⅡA族。( )
2He
如:氦
10Ne
√ (2)若发现了115号元素,则该元素肯定位于第7周期第ⅤA族。( 18Ar)
118 – 115 = 3 即在第7周期第ⅤA族
36kr
(3)位于同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子54X序e数
§1.1元素周期表导学案(1)
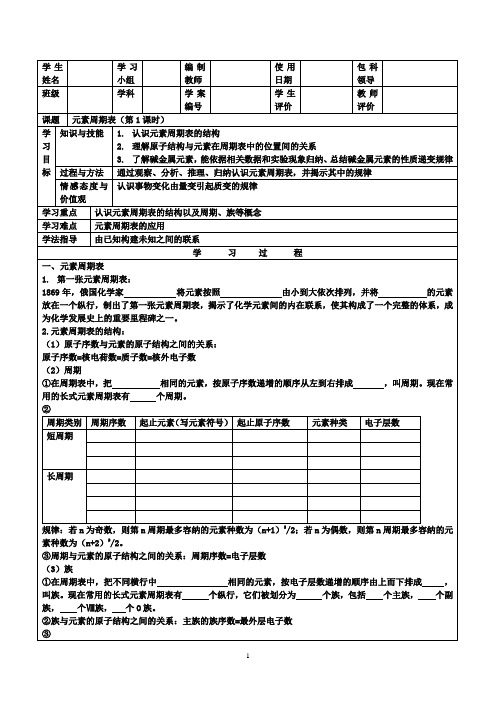
确定元素原子序数的常用方法学法指导不分版本一、利用元素周期表来确定原子序数例1:A、B两种元素中,A的原子序数为x,A和B所在的周期含有的元素种类总数分别为m和n。
(1)如果A和B同在第IA族,当B在A的上一周期时,B的原子序数为________,当B在A的下一周期时,B的原子序数为________。
(2)如果A和B同在第VIIA族,当B在A的上一周期时,B的原子序数为________,当B在A的下一周期时,B的原子序数为________。
答案:(1)(2)归纳:推测原子序数的方法1. 用各周期元素的种类总数作为基数规则①:对于第IA、IIA族,下一周期元素的原子序数(数值等于元素的核电荷数即质子数)等于相邻的上一周期同族元素的原子序数与上一周期元素种类总数之和。
如。
规则②:对于第IIIA~VIIA族、0族,下一周期元素的原子序数等于相邻的上一周期同族元素的原子序数与所求原子序数的元素所在周期的元素种类总数之和。
如。
例2:第3、4周期主族元素A和B的离子结构相差2个电子层,A在第m族,B在第n族,B为非金属元素,则A、B原子的核外电子数分别为___________、___________。
ⅠA、ⅡA族的相邻元素,原子序数差值依次为一二周期差2、二三周期差8、三四周期8、四五周期差18、五六周期差18、六七周期差32。
这些差值实际上都是相邻周期中前一个周期所包含的元素种类数目。
ⅢA~ⅦA以及零族的相邻元素,原子序数差值依次为8、8、18、18、32、32。
这些差值实际上都是相邻周期中后一个周期所包含的元素种类数目。
设B的原子序数为y如果A和B同在IlA族,当B在A的上一周期时,A的原子序数为x=y+n;所以y =x-n当B在A的下一周期时,B的原子序数为y=x+m如果A和B同在lIIA族,当B在A的上一周期时,A的原子序数为x=y+m;所以y=x-m当B在A的下一周期时,B的原子序数为y=x+n确定元素原子序数的常用方法一、利用元素周期表来确定原子序数例1:A、B两种元素中,A的原子序数为x,A和B所在的周期含有的元素种类总数分别为m和n。
§1.1元素周期表(2)

质量数、同位素、核素的概念
教学方法
自主——合作——探究
教学手段
教学过程
[导入]类比碱金属元素的性质递变规律的方法,结合已学过的氯元素的性质,根据教材提供卤素资料研究有关卤素的性质,以及学习核素的有关知识。
[板书]二.元素的性质与原子结构
2.卤族元素
(1)原子结构特点:
[阅读]教材P7学与问并完成学案内容:
[合作探究]完成学案
条件
产物稳定性
化学方程式
F2
很稳定
Cl2
较稳定
Br2
稳定性差
I2
不稳定
结论
随着核电荷数的增加,卤素单质与H2反应的变化
①剧烈程度逐渐减弱;②生成HX的稳定性逐渐减弱;
③生成HX的条件由易到难;
④HX的水溶液的酸性逐渐增强(HF为弱酸其余为强酸)。
拓展:⑤除氟外,最高价氧化物的水化物的酸性逐渐减弱。
卤族元素的原子结构如下所示:
根据卤素的原子结构,请你试着推测一下氟、氯、溴、碘在化学性质上所表现的相似性和递变性。
[讲解]元素的非金属性强弱的判断依据:可以从其最高价氧化物的水化物的酸性强弱,或与氢气生成气态氢化物的难易程度以及氢化物的稳定性来推断。
[合作探究]卤素的相似性和递变性
①相同点:最外层都只有7个电子.
②一般说来,较活泼的非金属单质能将较不活泼的非金属单质从其盐溶液里置换出来。但氟单质特殊,可以与水反应,反应方程式为2F2+2H2O=4HF+O2(爆炸)。其他卤素与水反应可用通式表示:
X2+H2O = HX+HXO
(5)同主族元素性质递变与原子结构的关系:
随着核电荷数增加,电子层数增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱.所以金属性逐渐增强,非金属性逐渐减弱.
新人教版必修2高中化学-1.1《元素周期表》教案

2)递变性(从锂到铯):①密度逐渐增大
( K 反常) ②熔点、沸点逐渐 降低 。
3.碱金属化学性质的相似性和递变性:
( 1)相似性 :与 O2、与 H 2O 反应
△
①与 O2 : 4Li + O 2
Li 2O
△
2Na + O 2
△
Na2O2 2K + O2
K 2O2
② 与 H2O: 2 Na + 2H 2O = 2NaOH + H 2↑ 2K + 2 H 2O = 2KOH + H 2↑(比钠与水剧烈)
( 1)解释:从上到下 (从 Li 到 Cs),随着核电核数的增加
,碱金属原子的电子层数逐渐
3
增多 ,原子半径逐渐 增大 ,
核对最外层电子的引力逐渐 减弱 ,原子失去电子的能力 增强 ,所以从上到下金属性逐渐
( 2)应用:根据元素的金属性强弱的判断其性质
(或根据其性质判断元素金属性的强弱)
还原性 强
元素组
例外元素
其他元素所属类型编号
S、N 、 Na、 Mg
N
(3)
P、 Sb、Sn、 As
Sn
(4)
Rb、 B、 Te、Fe
Fe
(1)
归属类型:( 1)主族元素 ( 2)过渡元素 (3)同周期元素 ( 4)同族元素
( 5)金属元素 ( 6)非金属元素
6.若某Ⅱ B 族元素原子序数为 x,那么原子序数为 x+1 的元素位于 ---------------------------( B )
A .Ⅲ B 族
B .Ⅲ A 族
C.Ⅰ B 族
D .Ⅰ A 族
2
第一节 元素周期表
高中化学必修二 1.1元素周期表(第1课时)元素周期表学案 (有答案)

元素周期表1.简单了解元素周期表的发展历程。
2.了解元素周期表的编排规则及结构。
3.能描述元素在元素周期表中的位置。
要点一错误!1.形成。
1869年,由俄国化学家门捷列夫初步绘制完成。
2.编排原则。
1按原子序数递增的顺序从左到右排列,把电子层数相同的元素排成一横行。
2把不同横行中最外层电子数相等的元素,按电子层数递增的顺序从上到下排成一纵行。
3.周期。
周期表中有7个横行,叫做周期。
周期的序数就是该周期元素的原子具有的电子层数。
第一、二、三周期称为短周期;第四、五、六周期称为长周期;第七周期称为不完全周期。
4.族。
周期表有18个纵行,称为族,主族元素的族序数后标A,副族元素的族序数后标B。
第8、9、10三纵行称为第Ⅷ族,第18纵行称为0族。
5.相互关系。
原子序数=核电荷数=质子数=核外电子数。
【应用思考】1.1最外层电子数是2的元素都是第ⅡA族吗?2同周期第ⅡA和第ⅢA族元素的原子序数一定相差1吗?提示:1不一定,0族的He原子最外层也是两个电子。
(2)不一定,第四周期之后的不是,因为有副族元素的存在。
要点二错误!【应用思考】2.观察元素周期表,确认每一纵行各代表哪一族,如:按从左到右的顺序排列,第3纵行是第____族,第15纵行是第____族,第9纵行是第____族,ⅤB族在第____纵行,ⅢA 族处于第____纵行等。
提示:ⅢBⅤAⅧ 5 133.若某离子最外层电子数与次外层电子数相同,则它位于元素周期表的什么位置?提示:若为阴离子,则它位于第三周期;若为阳离子,则它位于第四周期。
4.电子层结构相同的离子,它们一定位于同一周期吗?提示:不一定,电子层结构相同的离子,有一些是阴离子,有一些是阳离子,是连续的两个周期,阴离子在同周期,阳离子在下周期。
要点三错误!1.过渡元素:元素周期表中部从第ⅢB族到ⅡB族10个纵行共60多种元素,通称为过渡元素,这些元素都是金属,所以又把它们叫做过渡金属。
2.镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素,它们原子的电子层结构和性质十分相似,总称镧系元素。
§1.1元素周期表(1)

[讲述]门捷列夫把已经发现的63务。
他还在表中留下空位,预言了类似硼、铝、硅的未知元素的性质,而他在周期表中也没有机械地完全地按照相对原子质量数值的顺序排列。
若干年后,他的预言都得到了证实。
为了纪念他的功绩,就把元素周期律和周期表称为门捷列夫元素周期律和门捷列夫周期表。
[板书]2.现行元素周期表(1)排序依据:原子的核电荷数(2)原子序数:按照元素在周期表中的顺序给元素编号(3)结构特点:(1)原子序数与元素的原子结构之间的关系:原子序数=核电荷数=质子数=核外电子数[质疑]1. 在元素周期表中横行和纵行称为什么?2. 元素周期表中有多少横行,多少周期?多少纵行,多少族?(2)周期①在周期表中,把电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行,叫周期。
现在常用的长式元素周期表有 7 个周期。
②主族:由短周期元素和长周期元素共同构成的族,符号为副族:完全由长周期元素构成的族,符号为B。
第Ⅷ族:第8,9,10三个纵行。
如:铁、钴、镍。
O族:最外层电子数为8的元素化学性质不活泼,通常很难与其他物质发生化学反应,把它们的化合价定为O,因而叫做O族。
过渡元素:ⅢB族到ⅡB族共10列统称为过渡元素。
包括Ⅷ族和7个副族,是从左边主族向右边主族过渡的元素。
③1 2 3 4 5 6 7 8 9 10 11列数(4)元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般既有金属性,也有非金属性。
(5)对角线规则:沿周期表中金属与非金属分界线方向对角质相似,这一规律以第二、三周期元素间尤为明显。
如锂和镁、铍和铝、硼和硅[小结]现行元素周期表的结构特点:1.每一横行原子电子层数相同2.每一纵行原子最外层电子数相同【练习】以下是元素周期表的一部分,根据图示回答下列问题:[板书】二、元素的性质与原子结构[实验探究]教材P6实验(1)将一干燥的坩埚加热,同时取一小块钾,擦干表面的煤油后,迅速投到热的坩埚中,观KO22Li.指出原子序数为5、19、26、35的元素在周期表中的位置(用周期和族表示)及符号。
化学:1.1.1《元素周期表-周期表结构》课件

决定
最外层电子数
。
第 一 节
1829 年,德国科学家德贝莱纳在对当时已知的54种元素进行了系统的分析研究之后,提
元 出了元素的“三元素组”规则。他发现了几组元素,每组都有三个化学性质相似的成员。 素
周
并且,在每组中,居中的元素的原子量,近似于两端元素原子量的平均值。 如锂钠钾、
期 表
钙锶钡、磷砷锑、氯溴碘。
元素周期表的由来
B=11
Al=27.4
?=68
Ur=116 Au=197?
C=12
Si=28
?=70
Sn=118
N=14
P=31
As=75 Sb=122 Bi=210
O=16
S=32
Se=79.4 Te=128?
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4 Cs=133 Tl=204
①七个横行,七个周期。其中:三个短周期(1、2、 ),三个长周期(4、5、6),一个不完全周期(7)
②每一周期元素电子层数相同,从左到右原子序数递增。
③周期序数=电子层数
类别 短周期
长周期 不完全周期
周期序数 1 2 3 4 5 6 7
包括元素种数
2 8 8 18 18 32 26
稀有气体元素原子序数
十分相似,总称镧系元素。 第7周期中,89号元素锕(Ac)到103号元素铹 (Lr),共15种元素,它们原子的电子层结构和
性质也十分相似,总称锕系元素。
含元素最多的周期是哪一个?
4、课堂小结
元素周期表的结构: 七主七副七周期, Ⅷ族零族镧锕系。
元素原子结构与其在周期表中位置的关系:
19-20版:1.1.1 元素周期表(步步高)

第一节元素周期表第1课时元素周期表一、认识元素周期表1.元素周期表的历史2.现行元素周期表的编排原则(1)原子序数含义:按照元素在周期表中的顺序给元素编号。
原子序数与原子结构的关系:原子序数=核电荷数=质子数=核外电子数。
(2)编排原则3.元素周期表的结构(1)周期①数目:元素周期表有7个横行,即有7个周期。
②分类a.短周期:第一、二、三周期,每周期所含元素的种类数分别为2、8、8。
b.长周期:第四、五、六、七周期,每周期所含元素的种类数分别为18、18、32、32。
(2)族①数目:元素周期表有18个纵列,但只有16个族。
②分类(3)注意事项①元素位置与原子结构的关系周期序数=电子层数,主族序数=最外层电子数。
②常见族的特别名称第ⅠA族(H除外):碱金属元素。
第ⅦA族:卤族元素。
0族:稀有气体元素。
(1)周期表中共有7个周期,其中第一、二、三、四周期元素种类数分别为2、8、18、18(×)(2)元素周期表有18个纵列,共18个族(×)(3)元素周期表中每一个长周期均包含32种元素(×)(4)最外层电子数是2的元素一定为第ⅡA族的元素(×)(5)过渡元素有10个纵列,且都是金属元素(√)(6)每个主族中都既有金属元素又有非金属元素(×)1.同周期第ⅡA族与第ⅢA族元素的原子序数可能相差1、11、25。
2.(1)钠、钾元素分别在三、四周期,所在周期元素种数分别为8、18,都在ⅠA族,钠与钾元素的原子序数之差为8。
(2)氯、溴元素分别在第三、四周期,所在周期元素种数分别为8、18,都在ⅦA族,氯与溴元素的原子序数之差为18。
(3)同是第三、四周期的氯、溴元素原子序数之差为什么比钠、钾元素的原子序数之差多10。
提示钠、钾是ⅠA族元素,在过渡元素的左边,氯、溴是ⅦA族元素,在过渡元素的右边,第四周期比第三周期多10种过渡元素,所以氯、溴元素原子序数之差比钠、钾元素的原子序数之差多10。
1.1.1元素周期表
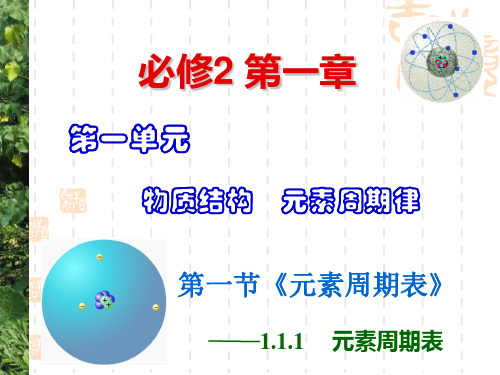
族
纵行
共七个主族 副族: Ⅰ B , Ⅱ B , Ⅲ B , Ⅳ B ,Ⅴ B , Ⅵ B , Ⅶ B 共七个副族 0族: 稀有气体元素 三个纵行(8、9、10),位于Ⅶ B 第Ⅷ族:
与ⅠB中间
七主七副零八族
族的别称
2、哪周期元素种类最多?族呢?
注 意
周 —— 2 种 第 1周期 总结: 期 短周期 第 2周期 —— 8 种 表 —— 8 种 里 第 3周期 —— 18 种 数 第 4周期 周期 周 —— 18 种 第 5周期 (7个) 期 长周期 —— 32 种 第 6周期 , 第 7周期 —— 32 种 1 2 共 7 个主族,包括短周期和长周期元素 主族 3 共 7 个副族,只包括在长周期中 4 副族 族 5 第VIII族 包括第8、9、10 纵行 6 (16个) 0族 稀有气体元素 7
卤素的用途
卤素在工业生产、大众生活领域和科学 研究中有着广泛的用途
SF6是很稳定的气体,在高温下也不分解, 氟 :
因此可作为理想的气体绝缘材料。大量的氟气用 于制取氟的有机化合物,如氟利昂-12(CCl2F2)用 于制冷剂,CCl3可用作杀虫剂,CBr2F2可用作灭火 剂。液态氟也是火箭、导弹和发射人造卫星方面 所用的高效燃料。
难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性 强弱。碱性越强,则原金属元素的金属性越强。 3、可以根据对应阳离子氧化性强弱判断。金属 阳离子氧化性越弱,则单质金属性越强。
卤族元素
小资 料
氟的发现是一篇悲壮的历史
氟是卤族中的第一个元素,但发现得最晚。从1771年瑞典化 学家舍勒制得氢氟酸到1886年法国化学家莫瓦桑分离出单质氟经 历了100多年时间。 在此期间,戴维、盖· 吕萨克、诺克斯兄弟等 很多人为制取单质氟而中毒,鲁耶特、尼克雷因中毒太深而献出 了自己的生命。
人教版高中化学必修二课件1.1.1元素周期表(46张)

(3)2
O、S
8
(4)磷
第3周期第ⅤA族
9.根据下表回答问题:
(1)元素⑦在周期表中的位置是_________________________。
2.试确定53号元素所在族,并总结确定元素所在族的方法。 提示:54-53=1,即53号元素在氙的左侧第一格,即第ⅦA族。
确定元素所在族的方法是:找出与所给元素原子序数相近的 0
族元素。然后求该元素与0族元素的原子序数之差,如果该元 素原子序数小于0族元素,则该元素在0族元素左侧的差值列;
如果该元素原子序数大于0族元素,则该元素在0族元素下一周
素的种数。例如,氯和溴的原子序数之差为:35-17=18(溴所 在第4周期所含元素的种数)。
【典题训练】 我国的纳米基础研究能力已跻身于世界前列,曾制得一种合成 纳米材料,其化学式为RN。已知该化合物中的Rn+核外有28个电 子,则R元素位于元素周期表的( A.第3周期第ⅤA族 B.第4周期第ⅢA族 C.第5周期第ⅢA族 )
D.第4周期第ⅤA族
【解题指南】解答该类题时应注意:
(1)准确判断该化合物中Rn+的化合价及离子的原子序数与电 子数之间的关系。 (2)熟记并利用稀有气体元素的原子序数给元素定位。
【解析】选B。据化学式RN知N为-3价,则R为+3价,所以R的原 子序数为28+3=31;与31最邻近的稀有气体元素的原子序数为 36(氪:第4周期),所以31-36=-5,因此R元素也在第4周期, 8-|-5|=3,则R元素在第ⅢA族,故选B。
1.周期表从左到右18列对应的族序数 列数 1 2 3 4 5 6 7 8、9、10 Ⅷ 18 0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.思考与交流: 钠和钾的性质有什么相 似性和不同? 通过大量实验和研究,人们得出了如下结论:
碱金属元素原子的最外层都有1个电子, 它们的化学性质彼此 相似 ,它们都能 与 水、氧气 等非金属单质反应,表现 出金属性(还原性).
金属性的递变规律又如何呢?
Li 与O2 反应 反应不 如钠剧 烈,生 成Li2O
4Li+O2=2Li2O 2Na+O2=Na2O2 2Na+2H2O=2NaOH +H2↑ 2K+2H2O=2KOH +H2↑
上述反应的产物中,碱金属元素的化合价都是 从Li到Cs,金 属 性 逐 渐 增 强。
+1
。
随着核电荷数的增加,碱金属元 素原子的电子层数逐渐 增多 , 原子半径逐渐 增大 ,原子核对 最外层电子的引力逐渐 减弱 。
长周期:第4~7周期
1 2
3
周期数=电子层数
注意:
①除第1、7周期外,每个周期都是从碱金属元 素开始,逐渐过渡到卤素,最后以稀有气体元素 结束. ②镧57La – 镥71Lu 共15 种元素称镧系元素 , 它们的电子层结构和性质十分相似 位于第6周期. ③锕89Ac – 铹103Lr 共15 种元素称锕系元素 , 它们的电子层结构和性质十分相似 位于第7周期. ④超铀元素: 92号元素铀以后的元素
原子半径 电子层数
依次增多,
逐渐增大。
结构决定性质,碱金属的性 质又有何异同?
2.实验:
钠 与氧气 剧烈燃烧,火焰呈 黄 反应 色, 生成 淡黄 色 的固体 与水反 应(绿 豆大一 块) 浮在水面上、 成银 熔 白色、在水面上四 游 、发出嘶嘶的 响 处 声滴入酚酞溶液呈 红 色 钾 剧烈燃烧,火焰 呈 色 ,生 紫 成黄色固体。 浮 在水面上、 成 熔 银白色、在水面上四 处 游 、发出嘶嘶的 响声,滴入酚酞溶液 呈 红 色,有微弱爆 炸 。
F2
Cl2 Br2
I2
小结:
相似性 卤素单质都能跟氢气发生反 应,生成卤化氢(气体)。
高 A、反应条件越来越____
递变性
低 B、剧烈程度越来越____ 弱 C、产物的稳定性越来越____
与 水 反 应 的 剧 烈 程 度 逐 渐 减 弱
3)卤素与水反应
X2 + H2O HX+ HXO
F2的特 殊性
1) 主族:由短周期元素和长周期元素共同构成的族。 表示方法:在罗马数字表示的族序数后面标“A” 字。ⅠA、ⅡA、ⅢA、…(1、2、13...17)
2)
副族:完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、 ⅢB、…(11、12、3...7)
3) 第VⅢ族: (“8、9、10” 三个纵行) 1) 0族:
(C)
6 11 12 13 24
(D)
5、下图为元素周期表中的一部分, 表中数字为原子序数,其中M的原子 序数为37的是( B )
19 M 55 A M 56 B C 5 D 3 20 26 M 28 1 7
M
结构与性质
(1)元素周期表中为什么把锂、 钠、钾等元素编在一个族中? 它们的原子结构和性质有什 么联系? (2)元素的结构和元素的性质 有什么联系?
银白色(除了Cs)
熔沸点 导电导热性
递 变 性 密度变化 熔沸点变化
都比较柔软 密度小 较低
导热、导电 密度呈增大趋势 熔点、沸点 逐渐降低
问题:结合表中的密度数据判断,在实验室中金属
锂、钠、钾应如何保存?(煤油密度为0.8g/cm3) 金属钠和钾保存在煤油中,金属锂保存在石蜡中
总结: 1.相似性 : 最外层上 都只有1 个电子 2.递变性: 核电荷数
族
ⅥA
ⅠA
练习与思考: 1、推算原子序数为6、13、34、53、88 的元素在周期表中的位置。
原子 序数 周期 族
6
2 IVA
13
3 IIIA
34
4
53
5
88
7 IIA
VIA VIIA
4、下列各表为周期表的一部分(表中为原 子序数),其中正确的是( D )
(A)
2
3 4 11 19
(B)
2 10 11 18 19 6 7 14 31 32
实验
现象
方程式
NaBr+氯水, 溶液分层, 2NaBr+Cl2=2NaCl+Br2 上层颜色变浅, CCl4 下层颜色橙黄色 溶液分层, KI+氯水, 2KI+Cl2=2KCl+I2 上层颜色变浅, CCl4 下层颜色紫红色 KI+溴水, CCl4 溶液分层, 上层颜色变浅, 下层颜色紫红色 2KI+Br2=2KBr+I2
总结:
(1)周期数=核外电子层数
(2)主族序数=最外层电子数 (3)核电荷数=质子数=原子序数=核外电 子数
元素性质的周期性变化 是元素原子的核外电子排布 的周期性变化的必然结果 周期序数=电子层数 主族族序数=最外层电子数
结构决定性质
结构决定位置
元素性质是元素在周期表中的位置的外在放映
或元素在元素周期表的位置反映了元素的一定性质
族的别称
• ⅠA称为
• ⅡA称为
碱金属
元素(除H外)
碱土金属 元素 • ⅣA称为 碳族 元素 • ⅤA称为 氮族 元素 • ⅥA称为 氧族 元素 卤族 • ⅦA称为 元素
• 零族称为
稀有气体
元素
练习
已知某主族元素的原子结构示意图, 判断其在周期表中的位置
第3周期ⅦA族
第4周期ⅠA族
原子结构
位置
2.主族元素在周期表中的位置取决于该元素 的( B )
1、根据金属单质与水或者与酸反应置换出氢 的难易程度。 置换出氢越容易,则金属性越强。 2、根据金属元素最高价氧化物对应水化物碱 性强弱。 碱性越强,则原金属元素的金属性越强。 3、置换反应 根据对应阳离子的氧化性强弱判断。金属阳离 子氧化性越弱,则元素金属性越强。
碱金属的物理性质 碱金属 单质
Li Na 颜色和状态 银白色,柔软 银白色,柔软
Na
K
Rb 遇空气 立即燃 烧,生 成更复 杂的氧 化物
Cs 遇空气 立即燃 烧,生 成更复 杂的氧 化物
点燃剧 燃烧更 烈燃烧, 加剧烈 生成比 生成 过氧化 Na2O2 物复杂 的氧化 物
与 H 2O 反应
剧烈, 生成H2
更剧烈, 生成H2
遇水立 遇水立 轻微的 即燃烧, 即燃烧, 爆炸, 爆炸 爆炸 生成H2
Cl
Ar
由1—18号元素的原子结构分析
1.每一横行有什么相同点? 横行:电子层数相同 2.每一纵行有什么相同点? 纵行:最外层电子数相同(He除外)
原子序数=核电荷数=质子数=核外电子数
• 对任意元素的原子: 原子序数=核电荷数=质子数=核外电子数 原子序数=核电荷数=质子数=核外电子数 • 对任意元素的阳离子: 原子序数=核电荷数=质子数>核外电子数 质子(带正电) • 对任意元素的阴离子: 原子核 中子(不带电) 原子序数=核电荷数=质子数<核外电子数 原子
(2)族(纵行)
最外层电子数相同的元素按照 电子层数递增的顺序排列的一 系列元素,称为一个族。
纵 行 1 2 3 4 5 6 7 8、9、10 11 12 13 14 15 16 17 18 族 Ⅰ ⅡⅢ Ⅳ Ⅴ Ⅵ Ⅶ A A B B B B B
Ⅷ
ⅠⅡⅢⅣⅤⅥⅦ 0 B B A A A A A
(2)族(纵行)
A. 相对原子质量和核外电子数
B. 电子层数和最外层电子数
C. 相对原子质量的最外层电子数
D. 电子层数的次外层电子数
1. 某元素原子最外层上只有2个电子,该元 素( D )
A. 一定是金属元素
B.一定是过渡元素
C. 一定是Ⅱ A族元素
D. 可能是金属也可能不是金属
3.判断下列说法是否正确 1、短周期元素全是主族元素 错,还有0族元素 2、短周期元素共有20种元素
Cl2
Br2
I2
At
(aì )
砹
单质
F2 Cl2 Br2 I2
颜色和状态
密度
1.69g/L
熔点℃ 沸点℃
-219.6 -188.1
气 淡黄绿色气体 浅
黄绿色气体
小
低
低
深红棕色液体 3.119g/cm 3
液 固
3.124g/L
-101 -7.2
-34.6 58.78
深
大
高
高
紫黑色固体
4.93g/cm3
核外电子 (带负电)
(1)周期(横行) 具有相同的电子层数而又按 原子序数递增的顺序排列的一系 列元素,称为一个周期。
周期序数 一 元素种类 2 最后元素的 2 原子序数 二 8 10 三 8 18 四 18 36 五 18 54 六 32 86 七 32 118
短周期:第1~3周期
周 期
周 期
稀有气体元素
同周期相邻主族元素原子序数可能 25 1 11 相差____、____或____。
同主族相邻周期的元素的原子序数可能 相差____、____、____或____。 18 32 8 2
ⅠA
0
ⅡA
ⅢA
Ⅳ A
ⅤA
ⅥA
ⅦA
主族序数=最外层电子数
注 意
②各族在元素周期表中的位置
主族元素需记清。
113.5
184.4
结构上的相同
决定
性质上的相似
(最外层均为7个电子)
(回忆氯气的性质)
(1)都能与金属反应生成金属卤化物 (2)都能与氢气反应生成卤化氢(HX) (3)都能与水反应 (4)都能与碱反应
卤素单质的化学性质
