血液透析及相关治疗用水等 90项医疗器械行业标准编号、名称及适用范围
国家食品药品监管总局公告2016年第74号――关于批准发布YY 0053—2016

国家食品药品监管总局公告2016年第74号――关于批准发布YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准的公告【法规类别】行业标准管理【发文字号】国家食品药品监管总局公告2016年第74号【发布部门】国家食品药品监督管理总局【发布日期】2016.03.23【实施日期】2017.01.01【时效性】现行有效【效力级别】XE0303国家食品药品监管总局公告(2016年第74号)关于批准发布YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准的公告YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准已经审定通过,现予以公布。
其中,强制性医疗器械行业标准自2018年1月1日起实施,推荐性医疗器械行业标准自2017年1月1日起实施,其标准编号、名称及适用范围见附件。
强制性医疗器械行业标准内容可在国家食品药品监督管理总局网站()或中国食品药品检定研究院网站()进行查询。
特此公告。
附件:YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准编号、名称及适用范围国家食品药品监管总局2016年3月23日附件YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共28项)(一)YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》本标准适用于人体使用的血液透析器、血液透析滤过器、血液滤过器和血液浓缩器。
本标准规定了血液透析器、血液透析滤过器、血液滤过器和血液浓缩器的产品要求,包括生物学评价、机械性能、使用性能、有效期等。
YY《血液透析及相关治疗用水》等标准

附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK )等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
YY 0572-2015《血液透析及相关治疗用水》等标准

附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
YY 0572-2015《血液透析及相关治疗用水》等标准

附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
YY0572_2016年《血液透析和相关治疗用水》等标准

附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
医药行业标准血液透析和相关治疗用水

医药行业标准:血液透析和相关治疗用水本标准的全部技术内容为强制性。
本标准修改采用国际标准ISO13959:2002《血液透析和相关治疗用水》。
本标准与国际标准的修改在于:------国际标准中3.1条验证和监测经处理的水,因无具体的测试方法,只是一个原则上的规定,故将此条单列出来,作为总则。
------国际标准中3.2条微生物要求是包含了细菌总数和细菌内毒素两个指标,故本标准将之分成了两个条款。
且将其不明确的地方(或不得低于国家法规和同类法规的要求)删除。
------国际标准中4.1中对细菌总数提出了多种确定方法和不建议使用的方法,本标准明确采用了国内常用的倾注平板法为仲裁方法,也可采用膜过滤法。
------国际标准中4.2所列举的各元素的检验方法有很多,本标准对此明确了仲裁方法。
并对一些明显是精确度较低的,但比较经济的测试方法,增加了精确度较高的测试方法,如砷、硫酸盐等。
本标准由国家食品药品监督管理局提出。
本标准由全国医用体外循环设备标准化技术委员会归口。
本标准起草单位:广东省医疗器械质量监督检验所。
本标准主要起草人:颜林、李伟松、张扬、莫富诚。
YY0572-2005引言要想保证血液透析或血液透析滤过既安全又有效,极其重要的一个方面,就是要保证水质优良。
血液透析和血液透析滤过,患者通过血液透析器或血液透析滤过器的半透膜,每周可能要接触超过300L的水。
而一个健康的人,每周摄人的水很少超过12 L。
与水接触的量增加近30倍,因此,应控制和监测水质,以避免已知的或估计有害的物质过量。
制备透析液的用水通常都要经过一定的处理,使水质达到规定的要求。
这类水处理系统可包括各种设备:水质软化器、沉淀物过滤器、反渗透装置、去离子装置、高效过滤器、微型过滤器、活性炭过滤器、紫外线消毒器和水箱。
水处理系统的这些设备性能如何,取决于原水的水质和整个系统的功能,看它能否制备出并持续生产出合格的处理水。
微量元素和微生物源污染长期存在着潜在的危害,现在对此了解正越来越多,处理饮用水的技术已获得持续发展,为此,本标准亦将相应地向前发展,并日臻完善。
《血液透析及其相关治疗用水》2017新标准

《血液透析及其相关治疗用水》2017新标准国家食品药品监督管理局(CFDA)前不久发布《血液透析及其相关治疗用水》YY 0572—2015,以取代已执行达十年之久的YY0572—2005,并将从2017年1月1日起实施,过度期1年9个月,的确有点长。
我们还是先看看新标准有哪些新变化和新要求吧?新标准(YY 0572—2015)与旧标准(YY 0572—2005)相比,增加了对总氯、锑、铍、铊四种化学物最大允许量的要求;提高了对内毒素的控制要求;删除了对氯胺、氯、锡三种化学污染物最大允许量的要求;均比老标准要求高而严了。
透析用水的基本概念与干预水平透析用水:是指满足于YY 0572-2015要求的且适用于血液透析用途的水,包括透析液的制备用水、透析器的相处理用水、透析浓缩液的制备用水和在线置换液制备用水。
干预水平:污染物浓度,当达到该浓度时应采取干预措施阻断其升高至不可接受的水平。
新标准对微生物与内毒素含量的要求(1)透析用水中的细菌总量:应不超过100cfu/ml,干预水平是最大允许水平的50%。
(2)透析用水中的内毒素含量:应不超过0.25EU/ml,干预水平是最大允许水平的50%。
新标准对化学污染的最大允许量要求(1)透析用水中有毒化学物的最大允许量(mg/L):铝0.01、总氯0.1、铜0.1、氟化物0.2、铅0.005、盐酸盐(氮)2、硫酸盐100、锌0.1。
(2)透析溶液中的电解质最大允许量mg/L(mmol/L):钙2(0.05)、镁4(0.15)、钾8(0.2)、钠70(3.0)。
(3)透析用水中微量元素的最大允许量(mg/L):锑0.006、砷0.005、钡0.1、铍0.0004、镉0.001、铬0.001、汞0.0002、硒0.09、银0.005、铊0.002。
关于批准发布YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准的公告

附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
CFDA最新发布的65项医疗器械行业标准

CFDA最新发布的65项医疗器械行业标准2016年4月29日,国家食品药品监督管理总局发布YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准。
其中,28项强制性医疗器械行业标准自2018年1月1日起实施,65项推荐性医疗器械行业标准自2017年1月1日起实施,其标准编号及名称如下:一、强制性行业标准(共28项)(一)YY 0053—2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》(二)YY 0267—2016《血液透析及相关治疗血液净化装置的体外循环血路》(三)YY 0302.2—2016《牙科学旋转器械车针第2部分:修整用车针》(四)YY 0325—2016《一次性使用无菌导尿管》(五)YY 0477—2016《角膜塑形用硬性透气接触镜》(六)YY 0503—2016《环氧乙烷灭菌器》(七)YY 0504—2016《手提式蒸汽灭菌器》(八)YY 0604—2016《心肺转流系统血气交换器(氧合器)》(九)YY 0714.2—2016《牙科学活动义齿软衬材料第2部分:长期使用材料》(十)YY 0792.1—2016《眼科仪器眼内照明器第1部分:通用要求和试验方法》(十一)YY 0983—2016《激光治疗设备红宝石激光治疗机》(十二)YY 0992—2016《内镜清洗工作站》(十三)YY 1048—2016《心肺转流系统体外循环管道》(十四)YY 1271—2016《心肺转流系统一次性使用吸引管》(十五)YY 1272—2016《透析液过滤器》(十六)YY 1273—2016《血液净化辅助用滚压泵》(十七)YY 1274—2016《压力控制型腹膜透析设备》(十八)YY 1275—2016《热空气型干热灭菌器》(十九)YY 1277—2016《蒸汽灭菌器生物安全性能要求》(二十)YY 1282—2016《一次性使用静脉留置针》(二十一)YY 1289—2016《激光治疗设备眼科半导体激光光凝仪》(二十二)YY 1290—2016《一次性使用胆红素血浆吸附器》(二十三)YY 1296—2016《光学和光子学手术显微镜眼科用手术显微镜的光危害》(二十四)YY 1298—2016《医用内窥镜胶囊式内窥镜》(二十五)YY 1300—2016《激光治疗设备脉冲掺钕钇铝石榴石激光治疗机》(二十六)YY 1301—2016《激光治疗设备铒激光治疗机》(二十七)YY 1412—2016《心肺转流系统离心泵》(二十八)YY 1413—2016《离心式血液成分分离设备》二、推荐性标准65项(一)YY/T 0043—2016《医用缝合针》(二)YY/T 0064—2016《医用诊断X射线管组件电气及负载特性》(三)YY/T 0079—2016《医用金属夹》(四)YY/T 0243—2016《一次性使用注射器用活塞》(五)YY/T 0291—2016《医用X射线设备环境要求及试验方法》(六)YY/T 0294.1—2016《外科器械金属材料第1部分:不锈钢》(七)YY/T 0481—2016《医用诊断X射线设备测定特性用辐射条件》(八)YY/T 0583.2—2016《一次性使用胸腔引流装置第2部分:干封阀式》(九)YY/T 0589—2016《电解质分析仪》(十)YY/T 0624—2016《牙科学正畸弹性体附件》(十一)YY/T 0625—2016《牙科学正畸丝》(十二)YY/T 0663.3—2016《心血管植入物血管内器械第3部分:腔静脉滤器》(十三)YY/T 0905.1—2016《牙科学场地设备第1部分:吸引系统》(十四)YY/T 0971—2016《放射治疗用多元限束装置性能和试验方法》(十五)YY/T 0972—2016《有源植入医疗器械植入式心律调节设备用四极连接器系统尺寸和试验要求》(十六)YY/T 0973—2016《自动控制式近距离后装设备放射治疗计划系统性能和试验方法》(十七)YY/T 0975—2016《麻醉和呼吸设备麻醉期间用于贴示在含药物注射器上的标签颜色、图案和特性》(十八)YY/T 0976—2016《医用电气设备放射治疗用电离室剂量计》(十九)YY/T 0977—2016《麻醉和呼吸设备口咽通气道》(二十)YY/T 0978—2016《麻醉储气囊》(二十一)YY/T 0979—2016《一次性使用流产吸引管》(二十二)YY/T0980.1—2016《一次性使用活组织检查针第1部分:通用要求》(二十三)YY/T 0981—2016《一次性使用五官冲洗器》(二十四)YY/T 0982—2016《热磁振子治疗设备》(二十五)YY/T 0984—2016《泪道塞》(二十六)YY/T 0985—2016《麻醉和呼吸设备上喉部通气道和接头》(二十七)YY/T0987.1—2016《外科植入物磁共振兼容性第1部分:安全标记》(二十八)YY/T0987.2—2016《外科植入物磁共振兼容性第2部分:磁致位移力试验方法》(二十九)YY/T0987.3—2016《外科植入物磁共振兼容性第3部分:图像伪影评价方法》(三十)YY/T 0987.4—2016《外科植入物磁共振兼容性第4部分:射频致热试验方法》(三十一)YY/T0987.5—2016《外科植入物磁共振兼容性第5部分:磁致扭矩试验方法》(三十二)YY/T 0988.1—2016《外科植入物涂层第1部分:钴-28铬-6钼粉末》(三十三)YY/T 0988.2—2016《外科植入物涂层第2部分:钛及钛-6铝-4钒合金粉末》(三十四)YY/T0988.11—2016《外科植入物涂层第11部分:磷酸钙涂层和金属涂层拉伸试验方法》(三十五)YY/T0988.12—2016《外科植入物涂层第12部分:磷酸钙涂层和金属涂层剪切试验方法》(三十六)YY/T0988.13—2016《外科植入物涂层第13部分:磷酸钙、金属和磷酸钙/金属复合涂层剪切和弯曲疲劳试验方法》(三十七)YY/T0988.14—2016《外科植入物涂层第14部分:多孔涂层体视学评价方法》(三十八)YY/T0988.15—2016《外科植入物涂层第15部分:金属热喷涂涂层耐磨性能试验方法》(三十九)YY/T 1031—2016《持针钳》(四十)YY/T 1043.1—2016《牙科学牙科治疗机第1部分:通用要求与测试方法》(四十一)YY/T 1146—2016《医用光学仪器照度测试方法》(四十二)YY/T 1276—2016《医疗器械干热灭菌过程的开发、确认和常规控制要求》(四十三)YY/T1283—2016《可吸收性明胶海绵》(四十四)YY/T1287.1—2016《颅外引流系统第1部分:颅脑穿刺外引流收集装置》(四十五)YY/T 1291—2016《一次性使用胰岛素泵用皮下输液器》(四十六)YY/T 1293.1—2016《接触性创面辅料第1部分:凡士林纱布》(四十七)YY/T1293.2—2016《接触性创面敷料第2部分:聚氨酯泡沫敷料》(四十八)YY/T 1306—2016《熏蒸治疗仪》(四十九)YY/T 1307—2016《医用乳腺数字化X 射线摄影用探测器》(五十)YY/T 1308—2016《自动控制式近距离治疗后装设备》(五十一)YY/T 1309—2016《清洗消毒器超声清洗的要求和试验》(五十二)YY/T 1400—2016《牙科学牙科设备表面材料耐受化学消毒剂的测定》(五十三)YY/T 1401—2016《牙齿美白冷光仪》(五十四)YY/T 1402—2016《医疗器械蒸汽灭菌过程挑战装置适用性的测试方法》(五十五)YY/T 1404—2016《含铜宫内节育器用铜的技术要求与试验方法》(五十六)YY/T 1405—2016《机械避孕器械可重复使用的天然和硅橡胶阴道隔膜要求和试验》(五十七)YY/T 1406.1—2016《医疗器械软件第1部分:YY/T0316应用于医疗器械软件的指南》(五十八)YY/T 1407—2016《放射治疗模拟机影像系统性能和试验方法》(五十九)YY/T 1408—2016《单光子发射及X 射线计算机断层成像系统性能和试验方法》(六十)YY/T 1409—2016《等离子手术设备》(六十一)YY/T 1410—2016《平衡测试训练系统》(六十二)YY/T 1411—2016《牙科学对改善或维持牙科治疗机治疗用水微生物质量的措施进行评估的试验方法》(六十三)YY/T 1414—2016《血液透析设备液路用电磁阀技术要求》(六十四)YY/T 1415—2016《皮肤吻合器》(六十五)YY/T1416.1—2016《一次性使用人体静脉血样采集容器中添加剂量的测定方法第1部分:乙二胺四乙酸(EDTA)盐》。
YY05722015《血液透析及相关治疗用水》等标准

本标准适用于体部X辐射放射治疗立体定向及计划系统。该系统与医用电子加速器配合使用,对体部病变区域进行立体定向放射治疗。本标准规定了体部X辐射放射治疗立体定向及计划系统的术语和试验方法等要求。
(十二)YY0952-2015《医用控温毯》
本标准适用于在医疗机构临床使用环境下,通过控制设备内循环液体的温度,具有对人体进行体外物理升温和/或降温功能,达到辅助调节人体温度目的的设备。本标准规定了医用控温毯的术语、定义、分类、组成、试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。本标准不适用于热垫式治疗仪、仅用于四肢和额头冷/热敷的设备。
(三)YY0599-2015《激光治疗设备准分子激光角膜屈光
治疗机》
本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。本标准替代YY0599-2007《准分子激光角膜屈光治疗机》。
(九)YY 0948-2015《心肺转流系统一次性使用动静脉插管》
本标准适用于心肺转流系统一次性使用动静脉插管,供体外循环施行心脏直视手术时配套心肺转流系统引流或灌注血液使用。本标准规定了无菌的一次性使用动静脉插管的分类与结构、试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
(十)YY0950-2015《气压弹道式体外压力波治疗设备》ﻩ本标准适用于利用压缩空气产生的能量驱动治疗手柄内的子弹体,使子弹体脉冲式冲击治疗头,利用二者的弹性碰撞产生压力波,经皮传导作用于疼痛部位治疗的设备。本标准规定了气压弹道式体外压力波治疗设备的术语、定义、组成、试验方法、检验规则、标志、使用说明书、包装、运输和贮存等要求。本标准不适用于气压弹道式碎石设备。
国家食品药品监督管理总局 2016年(第74号)

国家食品药品监督管理总局2016年(第74号)关于批准发布YY0053-2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准的公告(2016年第74号)YY特此公告。
附件:YY0053-2016《血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器》等93项医疗器械行业标准编号、名称及适用范围食品药品监管总局2016年3月23日序号标准编号标准名称代替标准发布日期实施日期1YY0053-2016血液透析及相关治疗血液透析器、血液透析滤过器、血液滤过器和血液浓缩器YY0053-20082016-03-232018-01-012YY0267-2016血液透析及相关治疗血液净化装置的体外循环血路YY0267-20082016-03-232018-01-013YY0302.2-2016牙科学旋转器械车针第2部分:修整用车针2016-03-232018-01-014YY0325-2016一次性使用无菌导尿管YY0325-20022016-03-232018-01-015YY0477-2016角膜塑形用硬性透气接触镜YY0477-20042016-03-232018-01-016YY0503-2016环氧乙烷灭菌器YY0503-20052016-03-232018-01-017YY0504-2016手提式蒸汽灭菌器YY0604-20072016-03-232018-01-018YY0604-2016心肺转流系统血气交换器(氧合器)YY0604-20072016-03-232018-01-019YY0714.2-2016牙科学活动义齿软衬材料第2部分:长期使用材料YY0714.2-20092016-03-232018-01-0110眼科仪器眼内照明器第1部分:通用要求和试验方法2016-03-232018-01-0111YY0983-2016激光治疗设备红宝石激光治疗机2016-03-232018-01-0112YY0992-2016内镜清洗工作站2016-03-232018-01-0113YY1048-2016心肺转流系统体外循环管道2016-03-232018-01-0114YY1271-2016心肺转流系统一次性使用吸引管2016-03-232018-01-0115YY1272-2016透析液过滤器2016-03-232018-01-0116YY1273-2016血液净化辅助用滚压泵2016-03-2317YY1274-2016压力控制型腹膜透析设备2016-03-232018-01-0118YY1275-2016热空气型干热灭菌器2016-03-232018-01-0119YY1277-2016蒸汽灭菌器生物安全性能要求2016-03-232018-01-0120YY1282-2016一次性使用静脉留置针2016-03-232018-01-0121YY1289-2016激光治疗设备眼科半导体激光光凝仪2016-03-232018-01-0122YY1290-2016一次性使用胆红素血浆吸附器2016-03-232018-01-0123YY1296-2016光学和光子学手术显微镜眼科用手术显微镜的光危害2016-03-232018-01-0124YY1298-2016医用内窥镜胶囊式内窥镜2016-03-232018-01-0125YY1300-2016激光治疗设备脉冲掺钕钇铝石榴石激光治疗机2016-03-232018-01-0126YY1301-2016激光治疗设备铒激光治疗机2016-03-232018-01-0127YY1412-2016心肺转流系统离心泵2016-03-232018-01-0128YY1413-2016离心式血液成分分离设备2016-03-232018-01-0129YY/T0043-2016医用缝合针YY0043-2005YY0666-20082016-03-232017-01-0130YY/T0064-2016医用诊断X射线管组件电气及负载特性YY/T0064-20042016-03-232017-01-0131YY/T0079-2016医用金属夹YY/T0079-20062016-03-232017-01-0132YY/T0243-2016一次性使用注射器用活塞YY/T0243-20032016-03-232017-01-0133YY/T0291-2016医用X射线设备环境要求及试验方法YY/T0291-20072016-03-232017-01-0134YY/T0294.1-2016外科器械金属材料第1部分:不锈钢YY/T0294.1-20052016-03-232017-01-0135YY/T0481-2016医用诊断X射线设备测定特性用辐射条件YY/T0481-20042016-03-232017-01-0136YY/T0583.2-2016一次性使用胸腔引流装置第2部分:干封阀式2016-03-232017-01-0137YY/T0589-2016电解质分析仪YY/T0589-20052016-03-232017-01-0138YY/T0624-2016牙科学正畸弹性体附件YY0624-20082016-03-232017-01-0139YY/T0625-2016牙科学正畸丝YY0625-20082016-03-232017-01-0140YY/T0663.3-2016心血管植入物血管内器械第3部分:腔静脉滤器2016-03-232017-01-0141YY/T0905.1-2016牙科学场地设备第1部分:吸引系统2016-03-232017-01-0142YY/T0971-2016放射治疗用多元限束装置性能和试验方法2016-03-232017-01-0143YY/T0972-2016有源植入医疗器械植入式心律调节设备用四极连接器系统尺寸和试验要求2016-03-232017-01-0144YY/T0973-2016自动控制式近距离后装设备放射治疗计划系统性能和试验方法2016-03-232017-01-0145YY/T0975-2016麻醉和呼吸设备麻醉期间用于贴示在含药物注射器上的标签颜色、图案和特性2016-03-232017-01-0146YY/T0976-2016医用电气设备放射治疗用电离室剂量计2016-03-232017-01-0147YY/T0977-2016麻醉和呼吸设备口咽通气道2016-03-232017-01-0148YY/T0978-2016麻醉储气囊2016-03-232017-01-0149YY/T0979-2016一次性使用流产吸引管2016-03-232017-01-0150YY/T0980.1-2016一次性使用活组织检查针第1部分:通用要求2016-03-232017-01-0151YY/T0981-2016一次性使用五官冲洗器2016-03-232017-01-0152YY/T0982-2016热磁振子治疗设备2016-03-232017-01-0153YY/T0984-2016泪道塞2016-03-232017-01-0154YY/T0985-2016麻醉和呼吸设备上喉部通气道和接头2016-03-232017-01-0155YY/T0987.1-2016外科植入物磁共振兼容性第1部分:安全标记2016-03-232017-01-0156YY/T0987.2-2016外科植入物磁共振兼容性第2部分:磁致位移力试验方法2016-03-232017-01-0157YY/T0987.3-2016外科植入物磁共振兼容性第3部分:图像伪影评价方法2016-03-232017-01-0158YY/T0987.4-2016外科植入物磁共振兼容性第4部分:射频致热试验方法2016-03-232017-01-0159YY/T0987.5-2016外科植入物磁共振兼容性第5部分:磁致扭矩试验方法2016-03-232017-01-0160YY/T0988.1-2016外科植入物涂层第1部分:钴-28铬-6钼粉末2016-03-232017-01-0161YY/T0988.2-2016外科植入物涂层第2部分:钛及钛-6铝-4钒合金粉末2016-03-232017-01-0162YY/T0988.11-2016外科植入物涂层第11部分:磷酸钙涂层和金属涂层拉伸试验方法2016-03-232017-01-0163YY/T0988.12-2016外科植入物涂层第12部分:磷酸钙涂层和金属涂层剪切试验方法2016-03-232017-01-0164YY/T0988.13-2016外科植入物涂层第13部分:磷酸钙、金属和磷酸钙/金属复合涂层剪切和弯曲疲劳试验方法2016-03-232017-01-0165YY/T0988.14-2016外科植入物涂层第14部分:多孔涂层体视学评价方法2016-03-232017-01-0166YY/T0988.15-2016外科植入物涂层第15部分:金属热喷涂涂层耐磨性能试验方法2016-03-232017-01-0167YY/T1031-2016持针钳YY/T1031-20042016-03-232017-01-0168YY/T1043.1-2016牙科学牙科治疗机第1部分:通用要求与测试方法2016-03-232017-01-0169YY/T1146-2016医用光学仪器照度测试方法YY91146-19992016-03-232017-01-0170YY/T1276-2016医疗器械干热灭菌过程的开发、确认和常规控制要求2016-03-232017-01-0171YY/T1283-2016可吸收性明胶海绵2016-03-232017-01-0172YY/T1287.1-2016颅外引流系统第1部分:颅脑穿刺外引流收集装置2016-03-232017-01-0173YY/T1291-2016一次性使用胰岛素泵用皮下输液器2016-03-232017-01-0174YY/T1293.1-2016接触性创面辅料第1部分:凡士林纱布2016-03-232017-01-0175YY/T1293.2-2016接触性创面敷料第2部分:聚氨酯泡沫敷料2016-03-232017-01-0176YY/T1306-2016熏蒸治疗仪2016-03-232017-01-0177YY/T1307-2016医用乳腺数字化X射线摄影用探测器2016-03-232017-01-0178YY/T1308-2016自动控制式近距离治疗后装设备2016-03-232017-01-0179YY/T1309-2016清洗消毒器超声清洗的要求和试验2016-03-232017-01-0180YY/T1400-2016牙科学牙科设备表面材料耐受化学消毒剂的测定2016-03-232017-01-0181YY/T1401-2016牙齿美白冷光仪2016-03-232017-01-0182YY/T1402-2016医疗器械蒸汽灭菌过程挑战装置适用性的测试方法2016-03-232017-01-0183YY/T1404-2016含铜宫内节育器用铜的技术要求与试验方法2016-03-232017-01-0184YY/T1405-2016机械避孕器械可重复使用的天然和硅橡胶阴道隔膜要求和试验2016-03-232017-01-0185YY/T1406.1-2016医疗器械软件第1部分:YY/T0316应用于医疗器械软件的指南2016-03-232017-01-0186YY/T1407-2016放射治疗模拟机影像系统性能和试验方法2016-03-232017-01-0187YY/T1408-2016单光子发射及X射线计算机断层成像系统性能和试验方法2016-03-232017-01-0188YY/T1409-2016等离子手术设备2016-03-232017-01-0189YY/T1410-2016平衡测试训练系统2016-03-232017-01-0190YY/T1411-2016牙科学对改善或维持牙科治疗机治疗用水微生物质量的措施进行评估的试验方法2016-03-232017-01-0191YY/T1414-2016血液透析设备液路用电磁阀技术要求2016-03-232017-01-0192YY/T1415-2016皮肤吻合器2016-03-232017-01-0193YY/T1416.1-2016一次性使用人体静脉血样采集容器中添加剂量的测定方法第1部分:乙二胺四乙酸(EDTA)盐2016-03-232017-01-01。
YY0572-2015《血液透析和相关治疗用水》等实用标准

附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
YY0572-2015血液透析及治疗相关用水质量标准

YY 0 5 7 2 —2 0 1 5代替YY 0 5 7 2 —2 0 0 5血液透析及相关治疗用水W a t e r fo r h a e m o d ia l y s is a n d r e l a t e d th e r a p ie s( IS O 1 3 9 5 9 : 2 0 0 9 , M OD)2 0 1 5 - 03 - 0 2 发布 2 0 1 7 - 0 1 - 0 1 实施国家食品药品监督管理总局发布Y Y 0 5 7 2 — 2 0 1 5-J—刖g本标准按照GB /T 1 . 1 - 2 0 0 9 给出的规则起草。
本标准代替YY 0 5 7 2 —2 0 0 5 《血液透析和相关治疗用水》。
与YY 0 5 7 2 —2 0 0 5 的主要技术差异如下:——增加对总氯、锑、铍、铊四种化学污染物最大允许量的要求;——提高对内毒素的要求;——删除对氯胺、氯、锡等三种化学污染物最大允许量的要求;——增加了附录A( 资料性附录)、附录B ( 资料性附录)。
本标准修改采用国际标准IS O 1 3 9 5 9 : 2 0 0 9 《血液透析及相关治疗用水》。
本标准与IS O 1 3 9 5 9 :2 0 0 9 相比,主要差异如下:——删除已在GB /T 1 3 0 7 4 —2 0 0 9 界定的术语和定义;——增加了附录B ( 资料性附录);——相关技术要求和试验方法有修改。
请注意本文件的某些内容可能涉及专利。
本文件的发布机构不承担识别这些专利的责任。
本标准由国家食品药品监督管理总局提出。
本标准由全国医用体外循环设备标准化技术委员会( S AC /T C 1 5 8 ) 归口。
本标准起草单位:国家食品药品监督管理局广州医疗器械质量监督检验中心。
本标准主要起草人:吴静标、吴伟荣。
本标准于2 0 0 5 年首次发布,2 0 1 5 年第一次修订。
IY Y 0 5 7 2 — 2 0 1 5血液透析及相关治疗用水1 范围本标准规定了血液透析、血液透析滤过和在线(on- line ) 血液滤过或在线(on- line ) 血液透析滤过中制备透析浓缩液和透析液及血液透析器再处理所用水的最低要求。
YY0572-2015《血液透析及其相互治疗用水》等规范标准

附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
北京市医疗器械质量监督检验中心承检范围

医疗器械检测资格认可范围及限制要求
名称:国家食品药品监督管理局北京医疗器械质量监督检验中心
地址:北京市中关村科技园通州园光机电一体化产业基地兴光二街7号
序号
产品名称
项目/参数
检测标准(方法)名称
及编号(含年号)
限制范围及说明
序号
名称
1
多床透析和相关治疗用水处理设备
全部项目
YY 0793.1-2010 血液透析和相关治疗用水处理设备技术要求 第1部分:用于多床透析
扩项
碳量的测定
GB/T 4698.14-2011 海绵钛、钛及钛合金化学分析方法 碳量的测定
扩项
氢量的测定
GB/T 4698.15-2011 海绵钛、钛及钛合金化学分析方法 氢量的测定
扩项
37
血袋
全部项目
GB/T 14232.3-2011 人体血液及血液成分袋式塑料容器 第3部分:含特殊组件的血袋系统
53
正畸基托聚合物
全部项目
YY/T 0270.2-2011 牙科学 基托聚合物 第2部分:正畸基托聚合物
扩项
54
牙科学根管器械
全部项目
YY 0803.1-2010 牙科学 根管器械 第1部分:通用要求和试验方法
扩项
全部项目
YY/T 0803.2-2010 牙科学 根管器械 第2部分:扩大器
扩项
55
血管支架
扩项
15
呼吸面罩及应用附件
全部项目
YY 0671.2-2011 睡眠呼吸暂停治疗 第2部分:面罩和应用附件
扩项
16
腹腔镜用剪
全部项目
YY 0672.2-2011 内镜器械 第2部分:腹腔镜用剪
医疗器械行业标准信息表(2023年第8号)
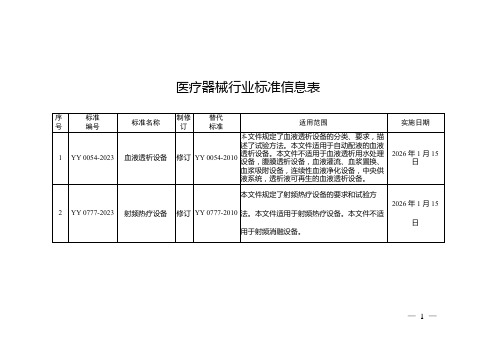
2
YY 0777-2023
射频热疗设备
修订
YY 0777-2010
本文件规定了射频热疗设备的要求和试验方法。本文件适用于射频热疗设备。本文件不适用于射频消融设备。
2026年1月15日
3
YY 9706.230-2023
医用电气设备第2-30部分:自动无创血压计的基本安全和基本性能专用要求
2024年1月15日
10
YY/T 0720-2023
一次性使用产包通用要求
修订
YY/T 0720-2009
本文件规定了用于产科的一次性使用产包的通用要求、产包配置及技术要求、制造商提供的信息以及包装。本文件适用于剖腹产用手术包及自然分娩用手术包。
2024年1月15日
11
YY/T 0730-2023
心血管外科植入物和人工器官心肺旁路和体外膜肺氧合(ECMO)使用的一次性使用管道套包的要求
医疗器械行业标准信息表
序号
标准
编号
标准名称
制修订
替代
标准
适用范围
实施日期
1
YY 0054-2023
血液透析设备
修订
YY 0054-2010
本文件规定了血液透析设备的分类、要求,描述了试验方法。本文件适用于自动配液的血液透析设备。本文件不适用于血液透析用水处理设备,腹膜透析设备,血液灌流、血浆置换、血浆吸附设备,连续性血液净化设备,中央供液系统,透析液可再生的血液透析设备。
医疗器械标准化工作指南涉及安全内容的标准制定
修订
YY/T 1473-2016
本文件为标准编写者提供了在医疗器械标准中纳入与安全有关内容的要求和建议。这些要求和建议基于已建立的风险管理概念和方法。
血液透析及相关治疗浓缩物(行业标准)

血液透析及相关治疗浓缩物前言本标准修改采用ISO 13958-2002《血液透析及相关治疗浓缩物》,并根据我国血液透析及相关治疗用浓缩物产品的特点,结合临床使用要求编制。
本标准被采用的国际标准的主要技术性差异见附录NA。
本标准为全文强制性标准。
本标准由国家食品药品监督管理局提出。
本标准由中国药品生物制品检定所归口本标准由百特(中国)投资有限公司、中国药品生物制品检定所医疗器械检验中心起草。
本标准主要起草人:冯小明、潘志成、王健、母瑞红、柯林楠、黄清泉、奚廷斐引言透析液含有的电解质与细胞外体液浓度相似。
也可能含有非电解质,如葡萄糖。
由于透析液用量较大,透析液通常由特定质量的透析用水将浓缩物稀释配制而成。
浓缩物提供的形式可以是液体或者干粉。
醋酸盐浓缩物是单一产品并且不利于细菌的生长。
碳酸氢盐浓缩物常与酸性浓缩物配套混合使用。
碳酸氢盐浓缩物易于长菌,碳酸氢盐浓缩物的原料和制备技术应该使微生物和化学污染减低到最小限度,容器和储存状况也应该保持原有水平。
这些浓缩物在使用和配制期间,应能够有效预防和避免微生物污染。
由制造商按本标准生产、包装并标识的浓缩物,配制成为最终透析液,配制透析液所使用的大量透析用水应符合YY0572标准要求。
水处理设备的操作、浓缩物的处理是整个血液透析系统中不可分割的部分。
因为最终透析液的配制不为制造商所控制,本标准不包括临床操作的技术要求,血液透析专业人员应选定适用的透析技术(血液透析、血液透析滤过、血液过滤和后处理设备)并且必须知道使用这些透析液进行每一种治疗的安全要求和风险。
本标准是针对透析浓缩物制造商的基本要求,也利于透析过程的控制,最终的目的是透析液的安全和正确的使用。
血液透析及相关治疗用浓缩物1范围本标准适用于血液透析或血液透析滤过用透析液的浓缩物。
规定了浓缩物的化学成分组成及其纯度,微生物污染,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试。
本标准不适用治疗中浓缩物与透析用水配成最终使用浓度的混合过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件YY 0572-2015《血液透析及相关治疗用水》等90项医疗器械行业标准编号、名称及适用范围一、强制性行业标准(共14项)(一)YY 0572-2015《血液透析及相关治疗用水》本标准适用于血液透析、血液透析滤过和在线血液滤过或在线血液透析滤过中制备透析浓缩液、透析液和血液透析器再处理用水。
本标准规定了相关用水的最低要求。
本标准不涉及水处理设备的操作,亦不涉及由处理水与浓缩物混合后制成供治疗用的透析液。
本标准不适用于透析液再生系统。
本标准代替YY 0572-2005《血液透析和相关治疗用水》。
(二)YY 0598-2015《血液透析及相关治疗用浓缩物》本标准适用于血液透析及相关治疗用浓缩物。
本标准规定了浓缩物的化学成分组成及其纯度,微生物污染的监测,浓缩物的处理、度量和标识,容器的要求和浓缩物质量检验所需要的各项测试等要求。
本标准不适用于治疗中浓缩物与透析用水配制成最终使用浓度的混合过程和透析液的再生系统。
本标准代替YY 0598-2006《血液透析及相关治疗用浓缩物》。
(三)YY 0599-2015《激光治疗设备准分子激光角膜屈光治疗机》本标准适用于准分子激光角膜屈光治疗机(以下简称治疗机),治疗机采用193nm准分子激光去除角膜组织来改变角膜形状从而改善视力,主要用于屈光性角膜切削术(PRK)、原位角膜磨镶术(LASIK)等角膜屈光矫正术和治疗性角膜切削术(PTK)。
本标准规定了治疗机的术语、定义、结构、基本参数、试验方法、检验规则、标志、包装、运输和贮存等要求。
本标准替代YY 0599-2007《准分子激光角膜屈光治疗机》。
(四)YY 0603-2015《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》本标准适用于多功能系统的贮血器件,该系统可能有整体性的部件,如血气交换器(氧合器)、血液过滤器、祛泡器、血泵等。
本标准规定了对无菌、一次性使用的体外循环心脏手术硬壳贮血器、静脉贮血器系统(带或不带过滤器)和静脉贮血软袋(简称贮血器)的试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
上述器件拟供进行心肺转流手术(CPB)时贮血使用。
本标准代替YY 0603-2007《心血管植入物及人工器官心脏手术硬壳贮血器/静脉贮血器系统(带或不带过滤器)和静脉贮血软袋》。
(五)YY 0605.9-2015《外科植入物金属材料第9部分:锻造高氮不锈钢》本标准适用于外科植入物,且符合标准成分要求的不锈钢钢棒、钢丝、钢板和钢带等,取自成品试样的力学性能可不遵循本标准。
本标准规定了外科植入物用含氮量为0.25%~0.50%的不锈钢的化学成分、完全退火状态下的显微组织、耐腐蚀性、力学性能及相应试验方法等要求。
本标准代替YY 0605.9-2007《外科植入物金属材料第9部分:锻造高氮不锈钢》。
(六)YY 0831.2-2015《γ射束立体定向放射治疗系统第2部分:体部多源γ射束立体定向放射治疗系统》本标准适用于体部多源γ射束立体定向放射治疗系统,该系统同时使用多个60Co密封放射源(可以是运动的,也可以是静止的)对体部病变区域进行聚束辐照。
本标准规定了体部多源γ射束立体定向放射治疗系统的术语、定义和试验方法等要求。
(七)YY 0832.2-2015《X辐射放射治疗立体定向及计划系统第2部分:体部X辐射放射治疗立体定向及计划系统》本标准适用于体部X辐射放射治疗立体定向及计划系统。
该系统与医用电子加速器配合使用,对体部病变区域进行立体定向放射治疗。
本标准规定了体部X辐射放射治疗立体定向及计划系统的术语和试验方法等要求。
(八)YY 0945.2-2015《医用电气设备第2部分:带内部电源的体外心脏起搏器安全专用要求》本标准适用于带内部电源的体外心脏起搏器和患者电缆(若使用)。
本标准规定了带内部电源的体外心脏起搏器和患者电缆(若使用)的安全专用要求。
本标准不适用于直接或间接连到供电网的设备,也不适用于起搏电极或其它用于心电刺激的设备,如从外部通过胸腔或食道刺激的设备、在高速起搏上提供抗心动过速能量的设备、提供起搏系统分析功能的设备。
(九)YY 0948-2015《心肺转流系统一次性使用动静脉插管》本标准适用于心肺转流系统一次性使用动静脉插管,供体外循环施行心脏直视手术时配套心肺转流系统引流或灌注血液使用。
本标准规定了无菌的一次性使用动静脉插管的分类与结构、试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
(十)YY 0950-2015《气压弹道式体外压力波治疗设备》本标准适用于利用压缩空气产生的能量驱动治疗手柄内的子弹体,使子弹体脉冲式冲击治疗头,利用二者的弹性碰撞产生压力波,经皮传导作用于疼痛部位治疗的设备。
本标准规定了气压弹道式体外压力波治疗设备的术语、定义、组成、试验方法、检验规则、标志、使用说明书、包装、运输和贮存等要求。
本标准不适用于气压弹道式碎石设备。
(十一)YY 0951-2015《干扰电治疗设备》本标准适用于同时将两路以上(含两路)不同频率的中频(1000Hz~100000Hz范围内)交流电流交叉地作用于人体,在组织内形成低频调制电流来进行治疗的设备。
本标准规定了干扰电治疗设备的术语、定义、分类、试验方法、检验规则、标志、使用说明书、包装、运输和贮存等要求。
(十二)YY 0952-2015《医用控温毯》本标准适用于在医疗机构临床使用环境下,通过控制设备内循环液体的温度,具有对人体进行体外物理升温和/或降温功能,达到辅助调节人体温度目的的设备。
本标准规定了医用控温毯的术语、定义、分类、组成、试验方法、标志、标签、使用说明书、包装、运输和贮存等要求。
本标准不适用于热垫式治疗仪、仅用于四肢和额头冷/热敷的设备。
(十三)YY 0953-2015《医用羧甲基壳聚糖》本标准适用于以壳聚糖或甲壳素为原料,经脱乙酰化、羧化、纯化而制成的医用级羧甲基壳聚糖,用于医疗器械产品。
本标准规定了医用羧甲基壳聚糖的原料、试验方法、检验规则、包装、运输和贮存等要求。
(十四)YY 0954-2015《无源外科植入物-I型胶原蛋白植入剂》本标准适用于以纯化的(非交联的)I型胶原蛋白为原料制备的注射型胶原蛋白植入剂。
本标准规定了注射型胶原蛋白植入剂的专用要求和检验方法,并对产品预期性能、设计属性、材料、设计评价、检验方法、临床评价、上市后监督、制造、包装,以及由制造商提供的信息等做了具体说明。
二、推荐性行业标准(共76项)(一)YY/T 0058-2015《牙科学病人椅》本标准适用于各种结构的牙科病人椅,包括人工操作、电力驱动或其它方式运行,或以上方式组合控制的牙科病人椅。
本标准规定了牙科病人椅的试验方法、制造商信息、标记和包装等要求。
本标准代替YY/T 0058-2004《牙科病人椅》。
(二)YY/T 0066-2015《眼科仪器名词术语》本标准适用于眼科仪器标准的制订、技术文件的编制、教材和书刊的编写及文献的翻译等。
本标准规定了眼科仪器的名词术语和定义。
本标准代替YY 0066-1992《眼科光学仪器名词术语》。
(三)YY/T 0107-2015《眼科A型超声测量仪》本标准适用于采用A型显示的眼科超声测量仪,该产品主要用于眼科角膜厚度和眼轴长度的测量。
本标准规定了眼科A型超声测量仪的产品分类、试验方法、检验规则、标志和使用说明等要求。
本标准代替YY 0107-2005《眼科A型超声测量仪》。
(四)YY/T 0113-2015《牙科学复合树脂耐磨耗性能测试方法》本标准适用于光固化和化学固化的牙科复合树脂耐磨耗性能测试。
本标准规定了牙科复合树脂耐磨耗性能的测试方法。
本标准代替YY/T 0113-1993《牙科复合树脂耐磨耗性能测试方法》。
(五)YY/T 0308-2015《医用透明质酸钠凝胶》本标准适用于辅助眼科手术、外科手术防粘连、填充增加组织容积等的医用透明质酸钠凝胶。
本标准规定了医用透明质酸钠凝胶的分类、检验规则、标志和包装等要求。
本标准代替YY 0308-2004《医用透明质酸钠凝胶》。
(六)YY/T 0310-2015《X射线计算机体层摄影设备通用技术条件》本标准适用于X射线计算机体层摄影设备(以下简称CT扫描装置),其中包括为放射治疗计划提供图像数据的CT扫描装置。
本标准规定了CT扫描装置的术语、定义、分类、组成和试验方法等要求。
本标准代替YY 0310-2005《X射线计算机体层摄影设备通用技术条件》。
(七)YY/T 0328-2015《一次性使用动静脉穿刺器》本标准适用于与血路和血液处理系统配套使用的一次性使用动静脉穿刺器。
本标准规定了一次性使用动静脉穿刺器的要求,以保证与所配套的血路和血液处理系统相适应。
本标准代替YY 0328-2002《一次性使用机用采血器》。
(八)YY/T 0330-2015《医用脱脂棉》本标准适用于采用棉葵草棉属植物成熟种子的毛茸,经除去夹杂物,脱脂、漂白、加工而成的不含任何有色添加物质的医用脱脂棉。
医用脱脂棉主要供医院临床作敷料用。
本标准规定了医用脱脂棉的要求。
本标准代替YY 0330-2002《医用脱脂棉》。
(九)YY/T 0466.2-2015《医疗器械用于医疗器械标签、标记和提供信息的符号第2部分:符号的制订、选择和确认》本标准适用于提出和制订医疗器械标签、标记和提供信息的符号。
本标准规定了用于医疗器械标签、标记和提供信息的符号的制订、选择和确认过程的要求。
本标准部分代替YY 0466-2003《医疗器械用于医疗器械标签、标记和提供信息的符号》。
(十)YY/T 0468-2015《医疗器械质量管理医疗器械术语系统数据结构》本标准适用于提供和交换医疗器械产品信息。
本标准规定了医疗器械术语系统数据结构的规则和指南,以促进国际范围内医疗器械数据信息的交换。
本标准代替YY/T 0468-2003《命名用于管理资料交流的医疗器械命名系统规范》。
(十一)YY/T 0583.1-2015《一次性使用胸腔引流装置第1部分:水封式》本标准适用于无菌供应的水封式一次性使用的胸腔引流装置。
该装置既可进行重力引流,也可与负压吸引系统连接,实现吸引引流。
本标准规定了无菌供应的水封式一次性使用的胸腔引流装置的要求。
本标准不适用于插入病人胸腔的胸腔引流导管、干封式胸腔引流装置和带自体血回输系统的胸腔引流装置上自体血回输系统,也不适用于病人携带的引流装置。
本标准代替YY 0583-2005《一次性使用胸腔引流装置水封式》。
(十二)YY/T 0593-2015《超声经颅多普勒血流分析仪》本标准适用于超声经颅多普勒血流分析仪。
本标准规定了超声经颅多普勒血流分析仪的术语、定义、产品分类、试验方法、检验规则、标志和使用说明等要求。
