海洋化学5
海洋资源化学

海洋资源化学
海洋资源化学是研究海洋环境中各种化学资源的分布、形成机制、提取利用及其环境效应的学科。
它涉及的内容广泛,主要包括以下几个方面:
1. 海洋无机化学资源:如海水中的溶解盐类(主要是氯化钠)、稀有金属元素(如锂、铀、锰、钴等)、以及非传统矿产资源(如深海沉积物中的锰结核、富集在海水或海底的稀土元素)。
2. 海洋有机化学资源:包括海洋生物资源中的天然产物,如从海洋动植物和微生物中提取的各种活性化合物,这些化合物在医药、化工等领域具有重要价值,例如抗肿瘤药物紫杉醇、抗病毒药物、生物酶抑制剂等。
3. 海洋能源资源:研究可再生能源的开发与利用,如潮汐能、波浪能、海洋温差能及海洋生物质能(如藻类产生的生物燃料)。
4. 海洋环境保护与修复:关注海洋环境污染问题,研究污染物在海洋环境中的行为、转化规律以及对生态系统的影响,并探索污染治理技术和生态修复方法。
5. 海洋新材料:基于海洋资源研发新型功能材料,比如从海洋生物中提取的生物胶原蛋白、壳聚糖等可用于生物医药和环保材料领域。
海洋资源化学不仅关注资源的开发和利用,同时强调可持续发展,注重保护海洋生态环境,在发掘和利用海洋资源的过程中实现经济效益与生态效益的和谐统一。
海洋化学 期末复习资料

海洋化学期末复习资料第一章1. 海洋化学的定义是什么,研究内容是什么?海洋化学是研究海洋各部分的化学组成、物质分布、化学性质和化学过程,以及海洋资源在开发利用中的化学问题的科学,是海洋科学的一个分支(学科定义)。
研究内容概括:含量、迁移、过程、通量①海洋环境中各种物质的含量、存在形式、化学组成及其迁移变化规律;②控制海洋物质循环的各种过程与通量,特别是海-气、海-底、海-陆、海-生等界面的地球化学过程与通量。
2. 海洋化学和化学海洋学的定义与区别。
化学海洋学是研究海洋各部分的化学组成、物质分布、化学性质和化学过程的科学,是海洋化学的主要组成部分。
海洋化学包括:化学海洋学、海洋资源化学区别:海洋化学是研究海水或是海洋里物质的化学,是以化学为主。
化学海洋学是用化学的方法来研究海洋。
3. 海洋中广泛存在五大化学作用分别为:氧化还原作用、沉淀溶解作用、酸碱作用、络合作用、界面作用第二章1. 海水中包含各种各样的物质,分为几类,分别是什么?(p16,元素存在形态)颗粒物质:包括由海洋生物碎屑等形成的颗粒有机物和各类矿物所构成的颗粒无机物;胶体物质:包括多糖、蛋白质等构成的胶体有机物个Fe、Al等无机胶体;气体:包括保守性气体(N2、Ar、Xe)和非保守气体(O2、CO2);真正溶解物质:包括溶解于海水中的无机离子和分子以及小分子量的有机分子。
2.Marcet-Dittmar 恒比规律是什么?海水中常量元素基本保持恒定的原因是什么?影响海水中常量元素恒定性的原因是什么?Marcet-Dittmar恒比规律,即表示海水的大部分常量元素,其含量比值基本上是不变的。
(意味着不管盐度从一个地方到另一个地方如何变化,海水中常量元素的比值几乎是恒定的。
)海水中常量元素基本保持恒定的原因是:水体在海洋中的迁移速率快于海洋中输入或迁出这些元素的化学过程的速率。
(加入和迁出不改变海洋中元素总量,只改变离子浓度和盐度)海水常量成分恒定性成因:混合作用――大洋海水通过环流、潮流、垂直流等运动,连续不断地进行混合。
海洋化学试题及解析答案

海洋化学试题及解析答案1. 海洋中溶解氧的主要来源是什么?A. 海洋生物呼吸B. 海洋植物光合作用C. 海洋底部化学反应D. 大气中的氧气溶解答案:B2. 下列哪种物质在海水中的浓度随深度增加而增加?A. 盐分B. 温度C. 溶解氧D. 压力答案:D3. 海洋酸化的主要原因是什么?A. 海洋生物排放的二氧化碳B. 工业排放的二氧化硫C. 火山活动释放的硫化氢D. 大气中二氧化碳的溶解答案:D4. 海洋中磷循环的主要途径包括哪些?A. 沉积物中的磷释放B. 海洋植物的吸收C. 海洋动物的摄取D. 所有以上选项答案:D5. 以下哪项不是海洋化学研究的内容?A. 海水的化学成分B. 海洋生物的生理过程C. 海洋沉积物的物理性质D. 海洋污染物的分布答案:C6. 海洋中重金属污染的主要来源是什么?A. 工业废水排放B. 农业化肥使用C. 大气沉降D. 所有以上选项答案:D7. 海水的盐度通常用哪个单位表示?A. 克/升B. 毫克/千克C. 摩尔/摩尔D. 千分比答案:D8. 海洋中氮的主要存在形式是什么?A. 氨B. 硝酸盐C. 亚硝酸盐D. 氮气答案:B9. 海洋中碳循环的主要过程包括哪些?A. 海洋植物的光合作用B. 海洋动物的呼吸作用C. 海洋沉积物的碳埋藏D. 所有以上选项答案:D10. 海洋中放射性物质的来源有哪些?A. 自然衰变B. 核试验C. 工业排放D. 所有以上选项答案:D解析:1. 海洋中溶解氧的主要来源是海洋植物的光合作用,它们通过光合作用将二氧化碳和水转化为氧气和葡萄糖。
2. 随着海水深度的增加,压力也会增加,因此选项D是正确的。
3. 海洋酸化的主要原因是大气中二氧化碳的溶解,这会导致海水的pH 值降低。
4. 海洋中磷循环的主要途径包括沉积物中的磷释放、海洋植物的吸收以及海洋动物的摄取。
5. 海洋化学研究的内容主要包括海水的化学成分、海洋生物的生理过程以及海洋污染物的分布。
6. 海洋中重金属污染的主要来源包括工业废水排放、农业化肥使用以及大气沉降。
海水主要化学成分可以分为哪五种

海水主要化学成分可以分为哪五种
海水是地球上最广泛的溶液,其中含有多种元素和化合物。
海水的主要化学成
分主要可以分为五种:无机盐类、氧气、溶解气体、微量元素和有机物质。
一、无机盐类
海水中的无机盐类是海水中最主要的组成部分,其主要包括氯化钠(NaCl)、
硫酸盐、碳酸盐等。
氯化钠是海水中含量最丰富的无机盐,占海水总溶解固体的大部分。
硫酸盐和碳酸盐也在海水中起重要作用,影响着海水的酸碱度和化学性质。
二、氧气
海水中溶解的氧气对海洋生物的生存至关重要。
氧气在海水中的溶解度受温度、盐度等因素影响。
海水中的氧气来源于大气中的氧气通过气体交换、植物光合作用等途径输入海水中。
三、溶解气体
除氧气外,海水中还溶解有二氧化碳、氮气、氩气等多种气体。
其中二氧化碳
是海水中含量较高的气体,与海水中的碳酸平衡反应密切相关,影响着海水的酸碱性质。
四、微量元素
海水中含有多种微量元素,如铁、锌、锰、铜等,虽然它们在海水中的含量很少,但对海洋生物的生长和发育却具有重要作用。
这些微量元素参与了海洋生态系统的多种生物化学过程。
五、有机物质
海水中的有机物质主要由生物排泄物、腐败有机体等组成,是海洋生态系统中
的重要组成部分。
有机物质的存在影响着海水的营养状况、生态平衡等,对海洋生物的生存和繁衍起着重要作用。
综上所述,海水主要化学成分可以分为无机盐类、氧气、溶解气体、微量元素
和有机物质五种,这些成分共同构成了丰富多彩的海洋生态系统,对地球生命和环境都具有至关重要的意义。
海洋资源化学

农业用水
海水富含硝酸盐、磷酸盐、矽酸盐等营养物 质,且水质纯净,不含作物常见的病菌,有 利用植物的生长。
海水灌溉 的优点
用海水直接灌溉省去了兴修水利之苦。
地球上荒废的大量盐碱地和滨海湿地可得到使 用,给发展农业和粮食生产提供新的土地资源 。
海洋深层水
海洋学上一般将海水分为三层:“海洋表层水”为水深
(一)海水直接利用
海水直接利用就是指海水代替淡水做工业、农业 商业和城市生活用水,环节沿海地区淡水资源短 缺的矛盾。
海水养殖 海水灌溉 游泳 浴池
工业
农业
城市
商业
冷却
冲厕
水淬
洗涤 净化 除尘
洗刷
消防
工业用水
工业用水主要是冷却用水,在沿海工业城市中 工业用水占城市总用水量的80%。因此,用海 水代替淡水做工业冷却用水可以节省城市用水 淡水用量的一半用水。国外的大型冶金、化工、 火电和核电站等需要消耗大量冷却水的工程项 目,大都尽可能建在海边,直接利用海水作为 冷却水。我国沿海城市早在20世纪30年代就 开始用海水做冷却用水,但发展规模小,发展 速度慢,至今海水年用量只有60×108,远远 落后于发达国家的利用水平。
重水资源。构成水分子的氢原子如果是氢的同位 素氘(2H或D)或氚(3H或T) ,这样的水就是 重水。重水发生核聚变可以释放出巨大的能量, 是核反应堆的减速剂和传热介质,也是制造氢弹 的原料。海水中重水的总储量2500 ×1012 t。 现在较大规模地生产重水的方法有蒸馏法、电解 法、化学交换法和吸附法等。 目前全世界还没有核融合的发电厂,一旦受控热 核聚变技术和从海水中大规模提取重水的技术能 够实现,建成以氖为原料的热核电厂。海洋就能 够为人类提供取之不尽用之不竭的新能源。人类 持续发展所遇到的能源问题,或许就一劳永逸。
初中化学《海洋化学资源》教案

初中化学《海洋化学资源》教案第一章:引言1.1 教学目标了解海洋化学资源的概念和重要性。
激发学生对海洋化学资源的兴趣和好奇心。
1.2 教学内容海洋化学资源的定义和分类。
海洋化学资源在人类生活中的应用。
1.3 教学方法通过图片和视频展示海洋化学资源的实例,引起学生兴趣。
引导学生进行小组讨论,分享对海洋化学资源的了解和看法。
第二章:海水中的溶解物质2.1 教学目标了解海水中溶解的主要物质及其含量。
掌握海水中的重要溶解物质及其作用。
2.2 教学内容海水中溶解的盐类、气体、有机物等物质。
氯化钠、氯化镁、硫酸钙等重要溶解物质的含量和作用。
2.3 教学方法通过实验和观察,让学生了解海水中溶解物质的性质和特点。
引导学生进行小组讨论,分析海水中的溶解物质对海洋生态系统的影响。
第三章:海洋生物资源3.1 教学目标了解海洋生物资源的种类和特点。
掌握海洋生物资源的利用和保护。
3.2 教学内容海洋生物资源的分类,包括浮游植物、鱼类、贝类等。
海洋生物资源的利用方式,如渔业、养殖业等。
3.3 教学方法通过图片和视频展示海洋生物资源的实例,引起学生兴趣。
引导学生进行小组讨论,分享对海洋生物资源的了解和看法。
第四章:海洋矿物资源4.1 教学目标了解海洋矿物资源的种类和特点。
掌握海洋矿物资源的开发和利用。
4.2 教学内容海洋矿物资源的分类,包括石油、天然气、盐等。
海洋矿物资源的开发技术和环境影响。
4.3 教学方法通过图片和视频展示海洋矿物资源的实例,引起学生兴趣。
引导学生进行小组讨论,分析海洋矿物资源的开发和利用对环境的影响。
第五章:海洋可再生能源5.1 教学目标了解海洋可再生能源的概念和特点。
掌握海洋可再生能源的开发和利用。
5.2 教学内容海洋可再生能源的种类,如潮汐能、波浪能、太阳能等。
海洋可再生能源的开发技术和前景。
5.3 教学方法通过图片和视频展示海洋可再生能源的实例,引起学生兴趣。
引导学生进行小组讨论,分享对海洋可再生能源的了解和看法。
海洋化学

专业名称:海洋化学课程编号:S0901000707001 课程名称:化学海洋学课程英文名称:Chemical Oceanography学分: 6 总学时:108课程性质:学位基础课适用专业:海洋化学/环境科学教学内容及基本要求:教学内容:在海洋不同区域化学元素的分布和周转、不同层圈之间的相互作用对通量的影响、稳定与放射性同位素、生物地球化学循环与食物网、生源要素的循环和生物标志物、沉积过程的地球化学问题等等。
基本要求:学生在理解讲课内容的基础上,阅读相关文献与组织讨论,从而对基本知识、前沿技术有深入的理解。
考核方式及要求:闭卷与开卷考试结合学习本课程的前期课程要求:分析化学、物理化学与普通海洋学教材及主要参考书目、文献与资料:lero F.J.:Chemical Oceanography (2nd Edition). CRC Press, Roca Raton,1996。
2.Chester R.:Marine Geochemistry 2nd Edition). Blackwell Science, Oxford, 2000.3.赵其渊(主编):海洋地球化学。
地质出版社,北京,1989。
4.郭锦宝(主编):化学海洋学。
厦门大学出版社,厦门,1997。
填写人:张经审核人:课程编号:S09010007070034 课程名称:高等仪器分析及实验课程英文名称:Instrumental Analysis and Practice学分: 5 总学时:90课程性质:学位基础课适用专业:海洋化学教学内容及基本要求:教学内容:气相色谱与色-质连用、稳定同位素质谱、高分辨率发射光谱-质谱、流式细胞计、原子吸收光谱、高效液相色谱、环境磁学测量仪器、分子荧光、放射性同位素测量等等;其中2/3的学时安排为实验内容,1/3的学时为授课学时。
基本要求:学生在理解讲课内容的基础上,亲自做仪器分析实验,从而提高研究工作所需的实验技能。
海洋化学复习资料

第一章1.化学海洋学的研究内容:(p2)研究海洋环境中各种物质的含量,存在形式,化学组成及其迁移变化规律以及控制海洋物质循环的各种过程与通量,特别是海——气,海——底,海——陆,海——生等界面的地球化学过程与通量,可用“含量,迁移,过程,通量”来概括化学海洋学的研究内容。
2.化学海洋学的奠基者-挑战者号的意义(p3,p6)化学海洋学是一门年轻的学科,以英国的“挑战者”号调查为起点。
挑战者号航行了13万千米,调查了南北美,南非,澳大利亚,新西兰,香港,日本及数百个大西洋和太平洋岛屿,获得了大西洋,太平洋和南大洋大约1.3万种不同的动物和植物样本以及1441份水样,成功地确定了海底的两个主要路标:大西洋中脊和马里亚纳海沟。
挑战者号对深海的勘测以及对世界海洋的温度,洋流,化学成分,海洋生物的调查,开启了人们对海洋物理,化学和生物学性质的了解。
第二章1.水的性质水具有异常高的冰点和沸点,导致其具有高的热容量水具有异常的密度变化水中盐分的增加导致渗透压增加水中盐分的增加导致冰点的降低以及达到最大密度的温度降低水是极好的溶剂2.现代海水的种类:颗粒物质,胶体物质,气体,真正溶解物质颗粒物质:由海洋生物碎屑等形成的颗粒有机物和各种矿物所构成的颗粒无机物;胶体物质:多糖、蛋白质等构成的胶体有机物和Fe、Al等无机胶体;气体:保守性气体(N2、Ar、Xe)和非保守气体(O2、CO2);真正溶解物质:溶解于海水中的无机离子和分子以及小分子量的有机分子。
3.海水的元素组成:微量元素,常量元素常量元素:在海水中的浓度一般高于0.05mmol/kg,其中包括钠,钾,钙,镁,Sr等5种阳离子,氯,硫酸根,溴,碳酸氢跟(碳酸根),氟等5中阴离子和H3BO3 分子,它们构成了海水溶解态组分的99%以上微量元素:在海水中的浓度一般小于0.05μmol/kg,包括Li,Ni,Mn,Fe,Zn,Pb,Cu,Co,U,Hg等金属元素4.Marcet-Dittmar恒比定律,原因(p18-19)Marcet-Dittmar恒比定律:尽管各大洋各海区海水的含盐量可能不同,但海水主要溶解成分的含量间有恒定的比值原因:水体在海洋中的迁移速率快于海洋中运输或迁出这些元素的化学过程的速率。
海洋化学资源概况

引言:海洋化学资源是指存在于海洋中的各种化学元素和化合物,包括海水、海洋沉积物、海藻、海洋生物等。
这些资源拥有广泛的应用领域,从食品工业、医药领域到能源和环境保护等方面都有着重要的意义。
本文将对海洋化学资源进行概述,介绍其类型、分布、利用和挑战。
概述:海洋化学资源非常丰富多样,包括海洋化学元素和化合物。
海洋化学元素主要包括氧、氮、磷、硅等,它们是构成海洋生态系统的重要组成部分。
海洋化合物则涵盖了海洋中的有机和无机物质,如蛋白质、多糖、有机酸、无机盐等。
这些资源不仅支持着海洋生物的生长发育,还具有广泛的应用前景。
正文:1.海洋水体中的化学资源1.1海水中的溶解氧和二氧化碳1.2海水中的盐度和溶解盐1.3海水中的重金属和有机污染物1.4海水中的营养物质和微量元素1.5海水中的放射性物质和稀土元素2.海洋沉积物中的化学资源2.1沉积物中的有机质2.2沉积物中的矿物质和金属元素2.3沉积物中的磷和硅2.4沉积物中的稀土元素和放射性同位素2.5沉积物中的有害物质和污染物3.海洋生物中的化学资源3.1海洋生物中的蛋白质和多糖3.2海洋生物中的有机酸和酶3.3海洋生物中的抗氧化物质和抗菌物质3.4海洋生物中的生物活性物质和天然产物3.5海洋生物中的微量元素和稀有元素4.海洋化学资源的利用4.1食品工业的应用4.2医药领域的应用4.3能源和化工领域的应用4.4环境保护和污染控制的应用4.5新材料研发和生物技术的应用5.海洋化学资源面临的挑战5.1过度开发和过度利用5.2海洋污染和生态破坏5.3气候变化和海洋酸化5.4法规和管理的缺失5.5资源可持续利用的问题总结:海洋化学资源是一种重要而丰富的自然资源,具有广泛的应用前景。
海洋水体中的化学资源,沉积物中的化学资源和海洋生物中的化学资源都具有独特的特点和潜力。
海洋化学资源的利用也面临着一系列的挑战,需要通过科学研究、合理开发和管理来实现其可持续利用。
这对于海洋经济的发展和环境保护都具有重要意义。
海洋化学 知识点

1海洋中存在的一些气体,如氧气、一氧化二氮、一氧化碳、甲烷等,会因为人类活动或其他生物地球化学过程的影响而偏离保守行为,故将其称为非保守的活性气体。
氮气、氩气、氙气等则不受人类活动或生物地球化学过程的影响而偏离保守行为。
2化学耗氧量(Chemical Oxygen Demand,简称COD)是以化学方法氧化水样中的还原性物质,主要是有机物,所消耗的氧化剂以氧表示的量。
3生物需氧量(Biochemical Oxygen Demand,简称BOD)是指在一定期间内,微生物分解一定体积水样中的某些可生化降解的物质,所消耗的溶解氧的量。
4从质量的角度来说,海洋中含量最多的元素是氧,约占海水总质量的85.79%。
5溶解氧在水中的溶解度随温度的升高而降低。
表层海水温度自赤道向两极高纬度地区呈逐渐降低的变化趋势,对溶解氧含量产生显著影响。
6在水体稳定度比较好且生物光合作用较强烈的海区真光层内,在海洋表面以下数十米深度,可观察到由浮游生物光合作用所形成的溶解氧极大值,其出现深度通常与初级生产力最高的层次相一致。
7溶解氧和pH 都是反映水环境健康的主要指标。
当前低氧已经成为世界范围内沿岸物理交换不良水域的一个主要环境问题。
伴随低氧现象而出现的近海局部季节性酸化现象,与开阔大洋相比危害更加显著。
典型的例子如墨西哥湾、长江口、珠江口、渤海湾季节性大范围底层酸化现象。
8pH 指溶液中氢离子的活度的负对数值,海水pH 常用实用标度表示。
在天然海水正常pH范围内,其酸碱缓冲容量的约95%是由二氧化碳碳酸盐体系所贡献。
在几千年以内的短时间尺度上,海水的pH 主要受控于该体系。
9海水的pH 一般在7.5~8.2 变化,属于弱碱性范围。
10通常海洋表层水为弱碱性,pH 在8.0~8.2。
工业革命以来海洋吸收了人类排放二氧化碳总量的1/3,对减缓全球变暖具有重要作用,但海洋持续吸收大气二氧化碳会导致pH 下降,即海洋酸化。
11海洋生物的钙化过程吸收海水中的碳酸盐,这个过程并不移除二氧化碳,却导致海水pH降低和游离二氧化碳浓度升高,反而促进海洋酸化。
海洋中的化学

第一节海洋化学资源【知识梳理】一、海洋是巨大的资源宝库1、海水中的物质:①海水是溶液:海洋中含水96.5%,溶解在其中的盐类化合物约占3.5%,盐类物质主要有:NaCl、MgCl2、CaCl2、Na2SO4、KCl等。
②利用海水制取金属镁的原理:海水中主要含有的盐为NaCl,其次是MgCl2,利用化学反应可以将MgCl2中镁元素转化为镁单质,具体操作是:将石灰乳加入到海水中沉淀出氢氧化镁,过滤出来氢氧化镁,氢氧化镁再与盐酸反应生成氯化镁,电解熔融状态氯化镁即能制得金属镁。
金属镁广泛用于火箭、导弹和飞机制造业。
制取熟石灰的方法:①高温煅烧石灰石:;②制熟石灰:;③④⑤化学反应原理:③:;④:;⑤:;2、海底矿物:(1)海底蕴藏常规化石燃料:煤、石油、天然气,此外,在海底还发现了“可燃冰”这种新型矿产资源。
所谓“可燃冰”是由天然气(主要成份为甲烷)和水在低温、高压下形成的冰状固体,是一种天然气水合物(CH4·H2O),因其极易燃烧,又被称为可燃冰。
可燃冰优点:①产热量高或热值大;②燃烧后不产生残渣或废气。
可燃冰被称为“未来能源”,“21世纪能源”。
思考:可燃冰燃烧后生成物有什么?请写出甲烷(CH4) 燃烧的化学方程式。
可燃冰燃烧后生成CO2和H2O。
甲烷(CH4)燃烧的化学方程式::;(2)海底蕴藏金属矿物金属矿物主要以多金属结核形式存在,主要含有锰铁镍铜钴钛等20多种金属元素。
此外,海洋中还有丰富的动植物生物资源,还能提供动力资源。
可见海洋是人类共有的巨大的资源宝库。
二、海水的淡化:地球上可供人类使用的淡水不到总水量的1%,淡水资源的短缺越来越成为制约社会发展的重要因素,从海水中获取淡水对解决淡水危机具有重大意义。
海水淡化的方法:①多级闪急蒸馏法、②结晶法、③膜法。
70%的淡化海水是采用①方法生产的。
思考:海洋是人类的共同财富,人类正在运用各种方法开发利用海洋资源,在合理开发海洋资源的同时,如何保护海洋环境?随着海洋资源的开发,海洋污染越来越严重,为保护海洋资源,可采取多种措施,如:①海洋环境立法:禁止向其中排放工业“三废”;②建立海洋保护区;③加强对海洋环境监测;④提高消除污染的技术水平等。
海洋化学

1.地球形成初期,火山活动持续不断,底下熔融的岩浆从地表爆发出来,释放出CO2,N2,CH4,H2和水蒸气,随着地球的冷却,聚集在大气中的水蒸气转化为一场持续几百万年的大雨,加上带有冰的彗星不断落在地球上,水蒸气的冷凝及冰的融化形成液态水,液态水累积在低洼地带,形成了海洋。
海洋中水的来源:海水是地球内部物质排气作用的产物,即水汽和其它气体是通过岩浆活动和火山作用不断从地球内部排出的。
差别:原始海水中Mg2+,Ca2+,K+含量远比现代海水的多,而Na+远比现代的少。
2.来源和输入途径:陆地径流,大气输入,冰川运动,海底火山作用,水热活动不是,因为海水中阴离子Cl->SO2->CO2-,阳离子Na+>Mg2+>Ca2+,河水中阴离子CO2->SO2->Cl-,阳离子Ca2+>Na+>Mg2+,浓度比不一样,所以不是成分的简单浓缩。
3.平均盐度:3.5% 平均离子强度:0.74.海水的大部分常量元素,其含量比值基本上是不变的。
5. 定义:某元素以一稳定的速率向海洋输送,如果要把全部水中该元素置换出来需要的时间。
通过元素逗留时间的长短来反映元素在海洋中的性质或行为。
6.最长:Cl,Br,Na最短:Al,Fe关系:碱金属和碱土金属逗留时间长,并随原子序数增加而减少。
因为这些是海洋生物生长所需要的主要营养盐,它们的分布主要由海洋生物决定,同时还与区域,深度,季节有关。
7.垂直分布:保守型,消除型,再循环型水平分布:由海水的运动和所处的环境决定时间分布:与生物活动密切相关8.克纽森盐度:在1千克海水中,当溴和碘为等摩尔的氯所取代,所含氯的克数,单位g/kg 实用盐度:在1个标准大气压下,15o C的环境温度下,海水样品与KCl标准溶液的电导比。
9.在开阔大洋,表层水盐度主要受控于蒸发导致的水分损失与降雨导致的水分增加之间的相对平衡。
表层水在南北纬20o-30o的亚热带海域有较高的盐度,而在赤道与极地附近海域盐度较低。
5海洋中的营养盐

TDN vs. nitrates at stations in the central basins of the Pacific (34oN to 76oS) (Jackson and Williams, 1985)
§ 5-2
海洋中的无机氮化物
一、海水中氮的形态和转化
3. 氮的循环与形态转化 海洋浮游植物对氮的吸收 NO3-、NO2-、NH4 +,分子量不大的DON(如尿素、氨基酸等)。 生物吸收转化而成的有机氮经排泄或生物体死亡后,被微生物生化 分解转变为无机氮,构成氮的循环。 硝化作用 通常将有机氮→NH4+→NO2-→NO3- 的过程称作“硝化作用”。
区域变化例:太平洋年平均硝酸盐浓度 (μmol l−1; Conkright et al., 1998)
北太平洋硝酸盐与新生产的分布
(Goes et al., 2002)
海洋中营养盐的垂直分布
第五章
海洋中的营养盐
§5-1 海洋中的磷
生物功能 -能量传送反应(ATP and ADP), -细胞壁组分。
在不同介质中各种磷酸盐形式随pH变化不同,为什么?
§ 5-1
海洋中的磷
一、海水中磷的形态
2. 海水中无机磷酸盐的存在形式 磷酸的解离平衡常数(与温度和盐度的关系;Millero, 1996)
ln K1′ = 115.54 − 4576.752 / T − 18.453ln T + (0.069171 − 106.736 / T ) S 0.5 + (−0.01844 − 0.65643 / T ) S ′ ln K 2 = 172.1033 − 8814.71/ T − 27.927 ln T + (1.3566 − 160.340 / T ) S 0.5 + (−0.05778 − 0.37335 / T ) S ′ ln K 3 = −18.126 − 3070.75 / T + (2.81197 + 17.27039 / T ) S 0.5 + (−0.09984 − 44.99486 / T ) S
海洋化学小知识

1873年2月,由英国海洋学家汤姆森教授担任首席 科学家的远洋科学考察船“挑战者”号,在进行环球 海洋考察时发现了一些类似于鹅卵石的团块,经过分 析化验,这些鹅卵石竟是沉睡在大洋底部达亿万年之 久的“深海珍宝”它几乎是由纯氧化锰和氧化铁组成 的。1882年被科学家正式定名为:锰结核。它主要存 在于3000米-6000米水深的大洋底部。 对于它的产生,一般的说法是:陆地及海岛上的岩 石风化后,分解出的金属离子被河流送入大海,进入 大洋,渐渐凝聚,沉降到洋底,并依附在贝克、石子、 鱼骨等物体上,经过几百年的时间,如同滚雪球似的 越长越大,就成了锰结核。
从200米深度往下,就是人们所说的无光区 了,在这个终年无光的黑暗水体中,溶解 氧很快降到最小值,而在300米以下,溶解 氧的含量有随着海洋深度的增加而逐步增 大,这是为什么呢?这是由于两极地区有 表层水不仅温度低,含氧量高而且密度大, 它们会不断的沉入海底,并向各处运动, 从而使深层水的到氧的补充,所以,虽然 海底层一片黑暗,但由于有了氧的供应而 充满生机。
随着科学技术的发展,海洋污染问题日益突出。
2001年1月24日,在厄尔多尔 加拉镈戈斯群岛,生物学家正 在清洗一头遭石油浸泡的海豹。
海豹分布在全球各处海域,也 出现在神秘的贝加尔湖。它们 在陆地上憨态可掬,在水中却 优雅自如;它们和人类拥有相 近的体温,却将极地的严寒视 若等闲。尽管拥有强大的生存 能力和惹人怜爱的外表,它们 却不能幸免于全球变暖和海洋 污染的威胁,更不能逃离人类 逐利的枪口。为了保护这种大 眼睛的海中精灵,人们把每年 的3月1日定为国际海豹日。
时至今日,世界上盐业生产主要有三种方法: 盐田法、电渗析法和冷冻法。世界上大多数的国 家使用的是盐田法制盐,但与先前的技术相比, 盐田法的生产技术已经大大改进,生产中的各个 环节基本上已经实现机械化,产量也大大提高。 电渗析法制盐与电渗析法淡化海水方法一样,它 较盐田法的优势:占地面积小、节省劳动力、基 础建设少,制盐后的卤水含量高,因此电渗析法 制盐具有十分广阔的前途,目前日本是世界上唯 一用电渗析法完全取代盐田法制盐的国家 。冷冻 法制盐最适合纬度较高的国家,它通过海水冷冻 后,取走冰,用剩下的高浓度海水制盐,目前, 像俄罗斯、瑞典等位于寒带的国家多使用此法。
初中化学海洋化学资源教案

初中化学海洋化学资源教案
一、教学内容
本节课主要介绍海洋化学资源的相关知识,包括海水成分、海洋矿产等内容。
二、教学目标
1. 了解海洋的重要性及海洋化学资源的种类;
2. 掌握海水的成分和特点;
3. 了解海洋矿产的类型及分布情况。
三、教学重点和难点
重点:海洋化学资源的种类及特点;
难点:海洋矿产的分布情况。
四、教学过程
1. 导入:通过图片、视频等形式展示海洋的美丽和神秘,引导学生对海洋的兴趣。
2. 学习海水的成分和特点:介绍海水的主要成分为淡水和盐水,盐分浓度为
3.5%,含有多种元素和化合物。
3. 讨论海洋化学资源的种类:海洋化学资源包括海水、海底热液、沉积物、矿石等,通过案例和实例展示其重要性。
4. 了解海洋矿产的类型及分布情况:介绍海洋矿产的种类有锰结核、磷灰石、硅藻土等,讨论其在海洋中的分布情况。
5. 订正:对学生可能存在的错误或不理解的地方进行订正和补充。
6. 总结:复习本节课所学内容,概括海洋化学资源的主要种类和特点。
五、教学方法
1. 启发式教学法:通过引导学生提出问题和建议,激发他们的学习兴趣;
2. 实验教学法:通过实验展示海水成分的分析方法和海洋矿产的提取技术;
3. 讨论交流法:通过小组讨论、案例分析等方式,促进学生思考和交流。
六、教学评价
1. 课堂练习:要求学生完成测验,检验对海洋化学资源知识的掌握程度;
2. 课堂讨论:鼓励学生积极参与讨论,分享自己的见解和观点;
3. 作业布置:布置相关作业,巩固和拓展所学内容。
通过本节课的学习,学生将对海洋化学资源有更深入的认识,增强对环境保护和资源利用的意识和能力。
海水中的化学知识点

第三单元海水中的化学一、海洋化学资源1、海水中的物质1海水由%的水和%的溶解的盐组成;①海水中主要有4种金属离子Na+、Mg2+、Ca2+、K+和2种酸根离子Cl-、SO42-;当把海水蒸干时,任一金属离子和酸根离子都可以结合构成一种盐,故海水中主要的盐有:Na2SO4、NaCl、MgSO4、MgCl、CaSO4、CaCl、K2SO4、KCl;②海水之最:含量最多的金属离子:Na+,含量最多的非金属离子或酸根离子:Cl-含量最多的非金属元素:O,含量最多的金属元素:Na海水盐分中含量最多的非金属元素:Cl;2海水制镁Ⅰ.流程:Ⅱ.化学方程式:①MaCl2+CaOH2=MgOH2↓+CaCl2②MgOH2+2HCl=2H2O+MgCl2③MgCl2通电Mg+Cl2↑注意:①海水中原本就有氯化镁,为什么要先加石灰乳生成氢氧化镁沉淀,再加盐酸得到氯化镁呢海水中氯化镁的含量很低,要想得到它,首先要设法使之富集;提取镁时,如果直接以海水为原料,则将其中的氯化镁转化为沉淀的过程就是为了使镁元素富集;如果以卤水为原料,则在海水晒盐阶段就经过了一次富集,转化为沉淀的目的即可使镁元素进一步富集,又可除去其中的氯化钠等杂质;②从海水中提取镁时,选择石灰乳做沉淀剂的原因是什么因为石灰乳价廉易得,大海中富含贝壳,它们的主要成分为碳酸钙,可就地取材通过大海制得石灰乳,反应的化学方程式为:CaCO3高温CaO+CO2↑、CaO+H2O=CaOH22、海底矿物1可燃冰①可燃冰——天然气水合物——固体——极易燃烧②形成:由天然气主要成分是CH4和水在低温、高压条件下形成的冰状固体;③优点:燃烧产生的热量比同等条件下的煤或石油产生的热量多得多;燃烧后几乎不产生任何残渣或废气,被科学家誉为“未来能源”、“21世纪能源”;注意:①纯净的天然气水合物呈白色,形似白雪,可以像固体酒精一样直接被点燃,被形象的称为“可燃冰”;②人类开采可燃冰,面临着许多问题:A.收集海水中的气体十分困难,可燃冰在海底大面积分,其分解出来的甲烷很难聚集在某一地区内收集,而且一离开海床便迅速分解,容易发生喷井意外;B.甲烷的温室效应很强,若处理不当,分解出来可能造成大陆架边缘动荡而引发海底塌方,甚至导致大规模海啸,带来灾难性后果;因此,可燃冰也是一种存在安全隐患的能源;2锰结核①海底还蕴藏着一种含有多种金属的矿物——多金属结核,也称:锰结核含锰最多;②锰结核含有锰、铁、镍、铜、钴和钛等20多种金属元素,多金属结核的全球总储量在30000亿吨以上;3、海洋资源的开发和利用海洋资源指的是与海水水体本身有着直接关系的物质和能量;①海洋资源:化学资源溶解于海水中的化学元素——工业用冷却水源、食盐等各种盐类、淡水、溴矿产资源滨海、大陆架及深海海底所蕴藏的矿产资源——滨海砂矿:富含砂、贝壳等建筑材料,大陆架:石油、天然气、煤、硫、磷,金属矿产;海盆:深海锰结核;动力资源海水波浪、潮汐及海流所产生的能量、贮存的热量——潮汐发电、波浪发电生物资源海水中生存的生物——鱼、虾、贝、藻②海洋污染:陆源污染、海上污染;③防止污染措施:海洋环境立法、建立海洋自然保护区、加强海洋环境监测、提高消除污染的技术水平等;注意:开发海洋资源的同时要保护海洋过度索取会遭到海洋的报复;4、海水淡化1蒸馏法淡化海水Ⅰ.实验装置:如右图所示;Ⅱ.实验现象:加热后大试管中的海水沸腾,小试管中有少量无色液体;向小试管的冷凝水中滴加硝酸银溶液后无白色沉淀产生;Ⅲ.注意事项:①实验前要先检查装置的气密性,气密性良好才能使用;②玻璃导管尽量长些延长水蒸气在导管中的滞留时间,有利于热的水蒸气冷凝;③为防止暴沸,可在大试管中加几粒沸石或碎瓷片;④试管中的液体量不能超过试管容积的1/3.Ⅳ.实验结论:采用蒸馏的方法可除去海水中的可溶性杂质得到淡水;Ⅴ.注意:①蒸馏是通过加热蒸发而将液体从溶液中分离出来的一种方法,是分离液体混合物的一种方法;分离混合物的方法:过滤、结晶、蒸馏②NaCl溶液中加入AgNO3溶液会产生白色沉淀,其反应化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3向溶液中加入AgNO3溶液,看是否产生白色沉淀,是检验溶液中有无Cl-的常用方法;2世界范围内海水淡化能做到规模化和产业化的主要方法:①膜法——反渗透法利用的是渗透压的原理②热法——低温多效蒸馏法、多级闪急蒸馏法二、海水“晒盐”1、粗盐提纯实际问题:海水“晒盐”得到的粗盐,往往含有可溶性杂质如Na2SO4、CaCl2、MgCl2等和不溶性杂质如泥沙等,必须对其进行分离和提纯,才能用于工业生产和人们的生活; 1除去粗盐中的不溶性杂质①方法:将粗盐晶体溶解在水中,过滤除去不溶物,再通过蒸发结晶得到比较纯净的氯化钠晶体;②步骤:溶解→过滤→蒸发2除去粗盐中的可溶性杂质粗盐中可溶性杂质主要有Na2SO4、CaCl2、MgCl2;①方法:加入过量的BaCl2可除去Na2SO4,加入过量的NaOH可除去MgCl2,加入过量的Na2CO3可除去CaCl2和过量的BaCl2,然后进行过滤把沉淀除去,再加入适量的盐酸,将溶液的pH调为7,除去多余的Na2CO3和NaOH;②原理:Na2SO4+BaCl2=BaSO4↓+2NaCl、MgCl2+2NaOH=MgOH2↓+2NaClCaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaClNa2CO3+2HCl=2NaCl+H2O+CO2↑、NaOH+HCl=NaCl+H2O注意:Ⅰ.所用试剂都是过量的:每滴加一滴试剂,都要观察一次现象,看沉淀是否继续增加;若有沉淀增加,则需继续滴加试剂;若不再有沉淀增加,则停止滴加试剂;故最后一滴试剂不参加反应,所以所用试剂都是过量的;Ⅱ.除杂质时所加试剂的顺序要求是:①Na2CO3必须在BaCl2之后加入,目的:除去过量的Ba2+;②过滤之后加HCl,目的:除去过量的CO32-和OH-;③除以上两点要求外,其它试剂顺序可调整;如:BaCl2、NaOH、Na2CO3、过滤、HCl;或BaCl2、Na2CO3、NaOH、过滤、HCl;或NaOH、BaCl2、Na2CO3、过滤、HCl;2、食盐的用途①工业:制造烧碱、纯碱、氮气、盐酸、化学肥料、塑料、合成橡胶、染料等;②生活:用作调味品和食品添加剂;③医疗:生理盐水是使用氯化钠配制的;④农业:用一定浓度的氯化钠溶液选种;三、海水“制碱”1、氨碱法质纯碱Ⅰ.Ⅱ.媒介:氨Ⅲ.原理:向饱和食盐水中通入氨气制成饱和氨盐水,然后在加压的条件下向氨盐水中通入足量的二氧化碳生成碳酸氢钠,由于碳酸氢钠在该状态下溶解度小,呈晶体析出,过滤得到NaHCO3固体,NaHCO3不稳定,受热后会分解成Na2CO3、H2O和CO2,因此给NaHCO3加热就可得到Na2CO3;Ⅳ.相关反应化学方程式:①NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl②2NaHCO3△Na2CO3+H2O+CO2↑NH4Cl的处理:2NH4Cl+CaOH2△CaCl2+2H2O+2NH3↑Ⅴ.优缺点优点:①原料易得、便宜;②CO2和NH3可回收使用,能连续生产;缺点:①食盐利用率不高;②回收NH3时产生大量污染环境的CaCl2;2、侯氏制碱法联合制碱法优点:①食盐利用率高;②产生两种有用产物NH4Cl和Na2CO3,不产生污染环境的CaCl2;3、纯碱的性质1物理性质:白色粉末,易溶于水;2化学性质:①与指示剂的作用——纯碱溶于水溶液显碱性,能使无色酚酞试液变红,使紫色石蕊试液变蓝;注意:A.碳酸钠属于盐而不属于碱,它的水溶液呈碱性,是因为它能与水反应生成很少量的氢氧化钠;B.盐类物质的水溶液有的呈中性如NaCl,有的呈碱性如Na2CO3,有的呈酸性如CuSO4;C.家庭中利用纯碱溶液显碱性的性质除去油污;②与CaOH2反应现象:产生白色沉淀;化学方程式:Na2CO3+CaOH2=2NaOH+CaCO3↓注意:A.工业制烧碱的方法就是利用上述反应;B.制取碱类物质原理:选取含有相应金属离子或铵根离子的盐类物质的溶液与氢氧化钠等可溶性碱反应;如氢氧化铜的制取可用:CuSO4+2NaOH=CuOH2↓+Na2SO4③与酸HCl、H2SO4反应现象:生成无色、无味的气体,该气体能使澄清的石灰水变浑浊;化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑Na2CO3+H2SO4=Na2SO4+H2O+CO2↑注意:Na2CO3和NaHCO3都能与酸HCl、H2SO4反应产生CO2,检验某物质中是否含有CO32-或HCO3-的方法为:A.试剂:稀盐酸、澄清石灰水、待测样品;B.操作方法:取待测样品于试管中,向其中滴加适量的稀盐酸,观察到有气泡冒出,将生成的气体通入澄清石灰水中,石灰水变浑浊,证明待测样品中含有CO32-或HCO3-;④与某些盐如BaCl2、CaCl2反应现象:生成白色沉淀;化学方程式:Na2CO3+BaCl2=BaCO3↓+2NaClNa2CO3+CaCl2=CaCO3↓+2NaCl4、盐的性质①盐+酸→新盐+新酸条件:反应物——盐可溶或难溶,酸必须可溶;生成物——必须有气体、沉淀或水;例如:Na2CO3+2HCl=2NaCl+H2O+CO2↑、CaCO3+2HCl=CaCl2+H2O+CO2↑AgNO3+HCl=AgCl↓+HNO3、BaCl2+H2SO4=BaSO4↓+2HCl注意:氯化银AgCl和硫酸钡BaSO4既不溶于水,也不溶于酸;②盐+碱→新盐+新碱条件:反应物——盐与碱都必须溶于水;生成物——必须有气体、沉淀或水;例如:Na2CO3+CaOH2=CaCO3↓+2NaOH、CuSO4+2NaOH=Na2SO4+CuOH2↓③盐+盐→新盐+新盐条件:反应物——的两种盐必须都溶于水;生成物——必须有沉淀;例如:Na2SO4+BaNO32=2NaNO3+BaSO4↓、NaCl+AgNO3=AgCl↓+NaNO3、K2CO3+CaCl2=CaCO3↓+2KCl④盐+金属→新盐+新金属例如:Fe+CuSO4=Cu+FeSO45、复分解反应①定义:由两种化合物互相交换成分,生成另外两种化合物的反应;属于化学反应的基本类型;②条件:生成物中至少有沉淀、气体、水中的一种时,复分解反应才会发生;碱+盐和盐+盐的反应中,反应物都必须可溶③特点:复分解反应中,各元素的化合价保持不变;。
海洋化学试题及答案

海洋化学试题及答案海洋化学是研究海洋中化学元素的分布、存在形式、化学反应以及这些过程对海洋环境和生态系统的影响的科学。
以下是一份海洋化学的试题及答案,供参考:一、选择题(每题2分,共20分)1. 海洋中的盐分主要是由哪种元素组成的?A. 钠B. 钙C. 镁D. 钾答案:A2. 海洋中溶解氧的浓度通常与哪些因素有关?A. 温度B. 盐度C. 压力D. 所有以上选项答案:D3. 以下哪种物质不是海洋中常见的污染物?A. 重金属B. 石油C. 塑料D. 氧气答案:D4. 海洋酸化的主要原因是什么?A. 海水温度升高B. 海水盐度增加C. 二氧化碳溶解增加D. 海洋生物活动增强答案:C5. 海洋中的碳循环主要涉及哪些过程?A. 光合作用和呼吸作用B. 沉积物形成和分解C. 碳的溶解和释放D. 所有以上选项答案:D二、填空题(每空1分,共10分)6. 海洋中的_是生命之源,它通过_和_等过程参与到海洋生态系统中。
答案:水;光合作用;呼吸作用7. 海洋中的_现象是指海水pH值降低,这通常与大气中_的增加有关。
答案:酸化;二氧化碳8. 海洋中的_是重要的营养盐,对海洋生物的生长至关重要。
答案:氮、磷9. 海洋中的重金属污染主要来源于_和_等人类活动。
答案:工业排放;矿业活动10. 海洋中的_是衡量水质的重要指标之一。
答案:溶解氧三、简答题(每题10分,共30分)11. 简述海洋中氮循环的主要过程。
答案:海洋中的氮循环包括氮的固定、矿化、硝化、反硝化等过程。
氮的固定是指大气中的氮气被固氮细菌转化为氨;矿化是指有机氮转化为无机氮;硝化是指氨转化为亚硝酸盐和硝酸盐;反硝化是指硝酸盐还原为氮气返回大气。
12. 描述海洋中溶解氧的分布特点及其对海洋生物的影响。
答案:海洋中溶解氧的分布通常在表层较高,随着深度的增加而减少。
溶解氧是海洋生物生存和代谢活动的必要条件,低溶解氧区域可能导致生物多样性下降,甚至形成死亡区域。
13. 解释海洋酸化对海洋生态系统的潜在影响。
讲座5 海洋酸化

钙化速率受控于[Ca2+][CO32-]的乘积,而非 pH、CO2或[CO32-]单独控制
大气CO2增加,珊瑚生态系钙化作用降低
大气CO2增加,两种球石藻钙化速率降低
Lough和Barnes,2000
分析12个岩心结果显示,20世纪早期至20世 纪末珊瑚钙化速率没有明显降低
Feely等,2004;Sabine,2004 Orr等,2005
综合历史数据确定海洋是大气CO2的汇,预 测未来CaCO3饱和度的变化
预测南大洋和亚北极太平洋的文石将于2100 年成为不饱和
海洋酸化的化学机制与响应
pH值变化的实测记录
亚热带北太平洋 ALOHA站
pH值变化的实测记录
亚热带北大西洋 BATS站
Kileypas等,2006
pH值变化的模型预测
《海洋化学进展》讲座5
海洋酸化 Ocean Acidification
陈敏 厦门大学海洋与环境学院
A Sea Change(2009)
报告提纲
海洋酸化的概念 海洋酸化的认识历程 海洋酸化的化学机制与响应 海洋酸化的生物学响应 生物泵与碳酸盐泵的反馈作用 海洋酸化的历史记录
大气CO2浓度变化
冰期-间冰期变化速率: 10-2 ppm/a
现代变化速率: 100 ppm/a
现在大气CO2浓度的变化比自然变化快约100倍
海洋中人类来源CO2的空间变化
大气CO2浓度增加的效应
气候变化
海洋酸化
海水酸化的定义
海水向偏酸性转化,非处于酸性 人类工农业活动向近海输送H2SO4、HNO3等导致的酸化仅
在区域海洋起作用,全球尺度上,CO2导致的酸化为主导。
海水酸化的认识历程
第5章海洋中的营养盐和环境海洋化学(精)
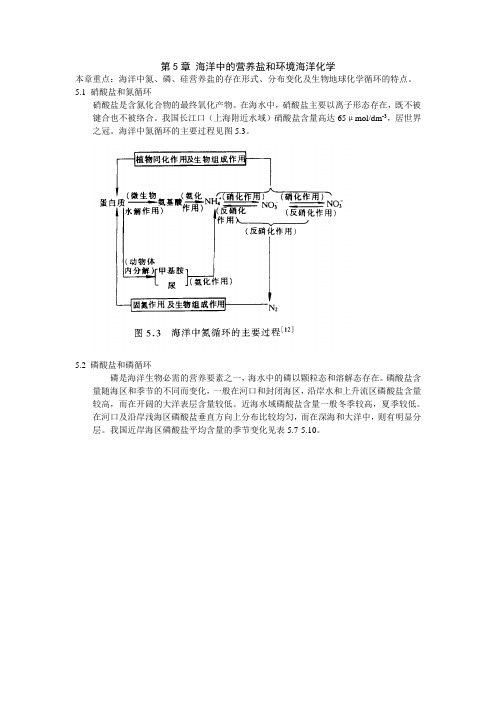
第5章海洋中的营养盐和环境海洋化学本章重点:海洋中氮、磷、硅营养盐的存在形式、分布变化及生物地球化学循环的特点。
5.1 硝酸盐和氮循环硝酸盐是含氮化合物的最终氧化产物。
在海水中,硝酸盐主要以离子形态存在,既不被键合也不被络合。
我国长江口(上海附近水域)硝酸盐含量高达65μmol/dm-3,居世界之冠。
海洋中氮循环的主要过程见图5.3。
5.2 磷酸盐和磷循环磷是海洋生物必需的营养要素之一,海水中的磷以颗粒态和溶解态存在。
磷酸盐含量随海区和季节的不同而变化,一般在河口和封闭海区,沿岸水和上升流区磷酸盐含量较高,而在开阔的大洋表层含量较低。
近海水域磷酸盐含量一般冬季较高,夏季较低。
在河口及沿岸浅海区磷酸盐垂直方向上分布比较均匀,而在深海和大洋中,则有明显分层。
我国近岸海区磷酸盐平均含量的季节变化见表5.7-5.10。
5.3 硅酸盐及其河口化学5.3.1 海洋中活性硅酸盐我国近岸海区硅酸盐平均含量的季节变化见表5.12-5.15。
5.3.2 硅酸盐的河口化学5.4 中国近海营养盐的生物地球化学所谓营养盐是对生物而言的,传统上在海洋化学中只指N、P、Si元素的盐类为海水营养盐。
20世纪以来,海水营养盐一直是化学海洋学的一项重要的研究内容。
其来源主要是大陆径流带来的岩石风化物质,有机物腐解的产物及排入河川的废弃物。
5.5 富营养化与赤潮5.5.1 富营养化富营养化是水体衰老的一种现象。
由于径流对地表的冲刷和淋溶,雨水对大气的淋洗,以及废水、污水,带有一定的营养物质向湖泊和近海水域汇集,使得水体的沿岸带扩大,沉积物增加,N、P等营养元素数量大大增加,往往造成水体的富营养化。
富营养化现象在人为污染水域或自然状态水域均有发生。
5.5.2 赤潮a)赤潮与富营养化;b) 赤潮引发和消亡的初步规律。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、海水中氮的形态和转化
2. 海水中氨(铵)的存在形式 海水NH4+与NH3之间存在着平衡: NH3 + H+ = NH4
+
K′ =
aH+ cNH+
4
cNH3
当t=10℃,S=35时, pK’=9.8。若海水pH=8.0,则
cNH+
4
cNH3
= 63
即NH4+占98.4%。温度一定时,NH3的含量取决于海水pH值。
在不同介质中各种磷酸盐形式随pH变化不同,为什么?
§ 5-1
海洋中的磷
一、海水中磷的形态
2. 海水中无机磷酸盐的存在形式 磷酸的解离平衡常数(与温度和盐度的关系;Millero, 1996)
ln K1′ = 115.54 − 4576.752 / T − 18.453ln T + (0.069171 − 106.736 / T ) S 0.5 + (−0.01844 − 0.65643 / T ) S ′ ln K 2 = 172.1033 − 8814.71/ T − 27.927 ln T + (1.3566 − 160.340 / T ) S 0.5 + (−0.05778 − 0.37335 / T ) S ′ ln K 3 = −18.126 − 3070.75 / T + (2.81197 + 17.27039 / T ) S 0.5 + (−0.09984 − 44.99486 / T ) S
亚硝酸菌 2NH 3 +3O 2 ⎯⎯⎯⎯ 2NO − +2H 2 O+4H + → 2 专性、自养
1 硝酸菌 − → NO + O 2 ⎯⎯⎯⎯ NO3 兼性、自养 2
− 2
§ 5-2
海洋中的无机氮化物
一、海水中氮的形态和转化
3. 氮的循环与形态转化 硝化作用 -铵的氧化:NH4+被氧化为NO2-的反应有3种: 光化学氧化:在UV线照射下, NH4+很快被氧化为NO2- ,但是 这种作用仅能发生在海洋表面。 化学氧化作用:主要指由O2进行的氧化。 细菌作用下的氧化:硝化细菌作用下NH4+ 转化为 NO2-。 海水中主要是两种作用。
介 质 0.68 mol/l NaCl溶液 人工海水 (S=33.0)
2.35±0.15
0.88±0.06
1.37±0.15
2. 海水中无机磷酸盐的存在形式33.0)
各种形式磷酸盐在不同pH下的分布情况(20℃) (Kester and Pytkowicz, 1967)
缔合形式 MH2PO4+ MHPO40 MPO4- X H2PO4- HPO42- PO43- Free X 92.3 49.3 0.2 lgβ'MgX 0.14 1.23 3.36 MgX 7.0 45.8 26.6 lgβ'CaX -0.15 0.97 4.51 CaX 0.7 4.9 73.2
区域变化例:太平洋年平均硝酸盐浓度 (μmol l−1; Conkright et al., 1998)
北太平洋硝酸盐与新生产的分布
(Goes et al., 2002)
海洋中营养盐的垂直分布
第五章
海洋中的营养盐
§5-1 海洋中的磷
生物功能 -能量传送反应(ATP and ADP), -细胞壁组分。
1 1.98 3.64
压力对磷酸存在形式的影响(S=35,25℃) 压力(bar) 0 500 1000 H3PO4 0 0 0 H2PO4- 0.5 0.2 0.1 HPO42- 79.2 66.1 33.7 PO43- 20.4 33.7 48.3
§ 5-1
海洋中的磷
一、海水中磷的形态
2. 海水中无机磷酸盐的存在形式 磷酸的离子对(与Ca2+和Mg2+)
二、海水中磷的含量、分布和变化
1. 海水中磷酸盐的含量 大洋表层海水约0.5-1.0 μmol dm-3 (热带表层海水约<0.1-0.2 μmol dm-3); 深层海水可达2-3 μmol dm-3 。
2. 断面分布
§ 5-1
海洋中的磷
二、海水中磷的含量、分布和变化
3. 垂直分布
Mediterranean data: GEOSECS Sta. 404 at 35o35’N, 17o15’E (Weiss et al., 1983) Atlantic data: TTO sta. 241 at 36o18’N, 56o27’W (PACODF, 1986) Pacific data: GEOSECS Sta. 204 at 31o22’N, 150o29’W (Broecker et al., 1982)
Chemical Oceanography
第五章
§5-1 §5-2 §5-3 §5-4 §5-5
海洋中的营养盐
海洋中的磷 海洋中的无机氮化物 海洋中的硅 海洋中营养盐的垂直循环 富营养化与赤潮
第五章
海洋中的营养盐
概述
营养盐 营养盐再生 海洋中营养盐的某些特征
概述
营养盐
化学海洋学中营养盐(Nutrients)一般指磷、氮、硅元素的盐类。 ●海洋浮游植物生长所必须的成分,是海洋生产力的食物链的基础; ●在真光层被浮游植物吸收直至限制其生长。
浮游植物生长所需的营养成分还包括海水主要成分、一些微量元素如 Fe、Mn、Cu、Zn、Co、Mo等和一些有机化合物如维生素等,但其含量 一般不限制生长( Fe、Mn可能除外) 。
概述
营养盐
来源 ●陆源物质:岩石风化物质 有机物腐解产物 排入河川中的废弃物 包括大陆径流、大气中的灰尘和极区冰川作用等输入途径。
TDN vs. nitrates at stations in the central basins of the Pacific (34oN to 76oS) (Jackson and Williams, 1985)
§ 5-2
海洋中的无机氮化物
一、海水中氮的形态和转化
3. 氮的循环与形态转化 海洋浮游植物对氮的吸收 NO3-、NO2-、NH4 +,分子量不大的DON(如尿素、氨基酸等)。 生物吸收转化而成的有机氮经排泄或生物体死亡后,被微生物生化 分解转变为无机氮,构成氮的循环。 硝化作用 通常将有机氮→NH4+→NO2-→NO3- 的过程称作“硝化作用”。
§ 5-1
海洋中的磷
一、海水中磷的形态
2. 海水中无机磷酸盐的存在形式 磷酸的解离平衡常数(压力的影响;Millero, 1996)
压力对磷酸解离平衡常数的影响(25℃) 压力(bar) 0 500 1000
Κ1P/ Κ10
1 1.36 1.78
Κ2P/ Κ20
1 1.65 2.61
Κ3P/ Κ30
近岸海水中总磷以DOP为主,DIP次之。
§ 5-1
海洋中的磷
一、海水中磷的形态
2. 海水中无机磷酸盐的存在形式
H 3 PO 4
表5.4
′ K1
H + +H 2 PO- 4
′ K2
2 2H + +HPO 4-
′ K3
3H + +PO3- 4
人工海水和0.68 mol/l NaCl的解离常数(20℃) K1'(×10-2) 2.83±0.08 K2' (×10-6) 0.41±0.04 K3 ' (×10-9) 0.010±0.001
§ 5-1
海洋中的磷
一、海水中磷的形态
3. 磷的循环与形态转化
(教材P129图5.9)
TDP vs. DIP at 15 stations in the north and south central Pacific (Jackson and Williams, 1985)
§ 5-1
海洋中的磷
Dark
硅藻(PN)
通气!
Von Brand and Rakestraw (1930) in Harvey (1957)
§ 5-2
海洋中的无机氮化物
一、海水中氮的形态和转化
3. 氮的循环与形态转化 颗粒氮转化为溶解无机氮的模拟实验
硅藻(PN)
通气!
Von Brand and Rakestraw (1930) in Harvey (1957)
二、海水中磷的含量、分布和变化
日变化
南海中部磷酸盐周日变化
§ 5-1
海洋中的磷
二、海水中磷的含量、分布和变化
5. 河口区磷酸盐的缓冲现象
November 1981
June 1980
长江口磷酸盐 (Edmond et al., 1985)
§ 5-1
海洋中的磷
二、海水中磷的含量、分布和变化
5. 河口区磷酸盐的缓冲现象
5 m Depth, the Departure Bay, Vancouver Island, British Columbia (Strickland and Austin, 1960)
§ 5-1
海洋中的磷
二、海水中磷的含量、分布和变化
4. 季节变化
胶州湾某站海水磷酸盐季节变化
§ 5-1
海洋中的磷
§ 5-2
海洋中的无机氮化物
一、海水中氮的形态和转化
3. 氮的循环与形态转化
大气 海洋
固
氮
反硝化作用(脱氮作用)
亚硝酸还原 氨化作用 生物合成 铵氧化
硝酸还原 亚硝酸 氧化
硝化作用
输出 输入 氮的价态
有机氮
§ 5-2
海洋中的无机氮化物
一、海水中氮的形态和转化
3. 氮的循环与形态转化 颗粒氮转化为溶解无机氮的模拟实验
