K12推荐学习2018高考化学第一轮复习 专题 化学能转化为电能习题 鲁科版
2018高考化学第一轮复习 专题 电能转化为化学能 电解习题 鲁科版
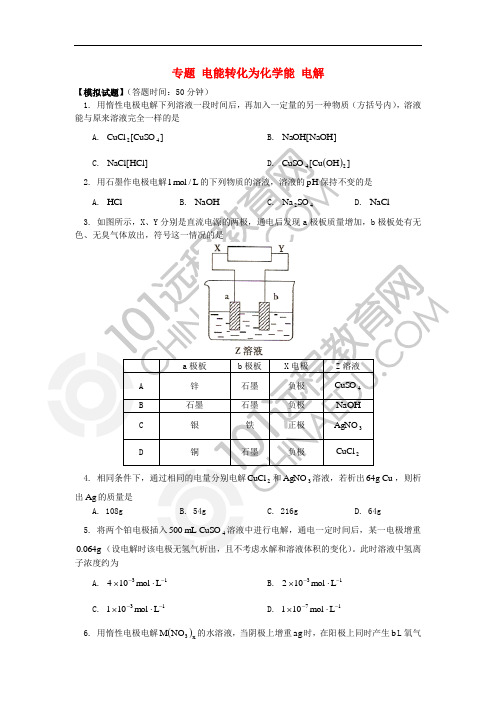
专题 电能转化为化学能 电解【模拟试题】(答题时间:50分钟)1. 用惰性电极电解下列溶液一段时间后,再加入一定量的另一种物质(方括号内),溶液能与原来溶液完全一样的是A. ]CuSO [CuCl 42B. ]NaOH [NaOHC. ]HCl [NaClD. ()]OH Cu [CuSO 242. 用石墨作电极电解L /mol 1的下列物质的溶液,溶液的pH 保持不变的是A. HClB. NaOHC. 42SO NaD. NaCl3. 如图所示,X 、Y 分别是直流电源的两极,通电后发现a 极板质量增加,b 极板处有无色、无臭气体放出,符号这一情况的是a 极板b 极板 X 电极 Z 溶液A 锌 石墨 负极 4CuSOB 石墨 石墨 负极 NaOHC 银 铁 正极 3AgNO D铜石墨负极2CuCl4. 相同条件下,通过相同的电量分别电解2CuCl 和3AgNO 溶液,若析出Cu g 64,则析出Ag 的质量是A. 108gB. 54gC. 216gD. 64g5. 将两个铂电极插入4CuSO mL 500溶液中进行电解,通电一定时间后,某一电极增重g 064.0(设电解时该电极无氢气析出,且不考虑水解和溶液体积的变化)。
此时溶液中氢离子浓度约为A. 13L mol 104--⋅⨯B. 13L mol 102--⋅⨯C. 13L mol 101--⋅⨯D. 17L mol 101--⋅⨯6. 用惰性电极电解()x 3NO M 的水溶液,当阴极上增重ag 时,在阳极上同时产生b L 氧气(标准状况),从而可知M 的相对原子质量为A.bax4.22 B.bax2.11 C.bax6.5 D.bax5.2 7. 某溶液中含有两种溶质NaCl 和42SO H ,它们的物质的量之比为3:1。
用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段,下列叙述不正确的是( )A. 阴极自始至终只析出2HB. 阳极先析出2Cl ,后析出2OC. 电解最后阶段为电解水D. 溶液pH 不断增大,最后为78. 用电源串联电解分装在两个烧杯里的200 1L mol 3.0mL -⋅NaCl 溶液和1L mol 1.0mL 300-⋅的3AgNO 溶液,以Pt 作电极,过一段时间取出电极,将两杯溶液混合,则对混合溶液的pH 判断正确的是A. 小于7B. 大于7C. 等于7D. 大于或等于7 9. 下图装置中,a 、b 都是惰性电极,通电一段时间后,b 极附近溶液呈红色。
【配套K12】[学习]2018高考化学第一轮复习 专题 电能转化为化学能 电解习题 鲁科版
![【配套K12】[学习]2018高考化学第一轮复习 专题 电能转化为化学能 电解习题 鲁科版](https://img.taocdn.com/s3/m/7335b3fe76a20029bd642de5.png)
专题 电能转化为化学能 电解【模拟试题】(答题时间:50分钟)1. 用惰性电极电解下列溶液一段时间后,再加入一定量的另一种物质(方括号内),溶液能与原来溶液完全一样的是A. ]CuSO [CuCl 42B. ]NaOH [NaOHC. ]HCl [NaClD. ()]OH Cu [CuSO 242. 用石墨作电极电解L /mol 1的下列物质的溶液,溶液的pH 保持不变的是A. HClB. NaOHC. 42SO NaD. NaCl3. 如图所示,X 、Y 分别是直流电源的两极,通电后发现a 极板质量增加,b 极板处有无色、无臭气体放出,符号这一情况的是4. 相同条件下,通过相同的电量分别电解2CuCl 和3AgNO 溶液,若析出Cu g 64,则析出Ag 的质量是A. 108gB. 54gC. 216gD. 64g5. 将两个铂电极插入4CuSO mL 500溶液中进行电解,通电一定时间后,某一电极增重g 064.0(设电解时该电极无氢气析出,且不考虑水解和溶液体积的变化)。
此时溶液中氢离子浓度约为A. 13L mol 104--⋅⨯B. 13L mol 102--⋅⨯C. 13L mol 101--⋅⨯D. 17L mol 101--⋅⨯6. 用惰性电极电解()x 3NO M 的水溶液,当阴极上增重ag 时,在阳极上同时产生b L 氧气(标准状况),从而可知M 的相对原子质量为A.bax4.22 B.bax2.11 C.bax6.5 D.bax5.2 7. 某溶液中含有两种溶质NaCl 和42SO H ,它们的物质的量之比为3:1。
用石墨做电极电解该混合溶液时,根据电极产物,可明显分为三个阶段,下列叙述不正确的是( )A. 阴极自始至终只析出2HB. 阳极先析出2Cl ,后析出2OC. 电解最后阶段为电解水D. 溶液pH 不断增大,最后为78. 用电源串联电解分装在两个烧杯里的200 1L mol 3.0mL -⋅NaCl 溶液和1L mol 1.0mL 300-⋅的3AgNO 溶液,以Pt 作电极,过一段时间取出电极,将两杯溶液混合,则对混合溶液的pH 判断正确的是A. 小于7B. 大于7C. 等于7D. 大于或等于7 9. 下图装置中,a 、b 都是惰性电极,通电一段时间后,b 极附近溶液呈红色。
2018版高考化学一轮总复习第6章化学反应与能量第2节电能转化为化学能_电解课后分层训练鲁科版

电能转化为化学能——电解A组专项基础达标(建议用时:30分钟)1.观察下列几个装置示意图,有关叙述正确的是( )A.装置甲中阳极上析出红色固体B.装置乙中铜片应与电源负极相连C.装置丙中外电路电流方向:b极→a极D.装置丁中阴极反应:2Cl--2e-===Cl2↑C[A项,阳极上生成Cl2;B项,铜片应作阳极,与电源正极相连;D项,阴极反应应为2H++2e-===H2↑。
]2.下列说法中正确的是 ( )A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4C.电镀工业中,X是待镀金属,Y是镀层金属D.外加电流的阴极保护法中,Y是待保护金属D[电解饱和食盐水时,阴极区得到H2和NaOH。
铜的电解精炼时,应用粗铜作阳极、纯铜作阴极。
电镀时,应以镀层金属作阳极、待镀金属作阴极。
]3.(2015·上海高考)研究电化学腐蚀及防护的装置如图所示。
下列有关说法错误的是( )A.d为石墨,铁片腐蚀加快B.d为石墨,石墨上电极反应为O2+ 2H2O+4e-===4OH-C.d为锌块,铁片不易被腐蚀D.d为锌块,铁片上电极反应为2H++2e-===H2↑D[A.由于活动性:Fe>石墨,所以铁、石墨及海水构成原电池,Fe为负极,失去电子被氧化变为Fe2+进入溶液,溶解在海水中的氧气在正极石墨上得到电子被还原,比没有形成原电池时的速率快,正确。
B.d为石墨,由于是中性电解质,所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,电极反应为O2+2H2O+4e-===4OH-,正确。
C.若d为锌块,则由于金属活动性:Zn>Fe,Zn为原电池的负极,Fe为正极,首先被腐蚀的是Zn,铁得到保护,铁片不易被腐蚀,正确。
D.d为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,在铁片上电极反应为O2+2H2O+4e-===4OH-,错误。
]4. 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图所示,下列说法正确的是( )A.阳极电极方程式为2Al-6e-+6OH-===Al2O3+3H2OB.随着电解的进行,溶液的pH逐渐增大C.当阴极生成气体3.36 L(标准状况)时,阳极增重2.4 gD.电解过程中H+移向铝电极C[A项,硫酸溶液为酸性,阳极反应式为2Al-6e-+3H2O===Al2O3+6H+;B项,阴极反应式为6H++6e-===3H2↑,电解过程中H2O减少,pH减小;D项,电解过程中H+移向阴极(石墨极)。
2018高考化学第一轮复习专题化学能转化为电能学案鲁科版

专题化学能转化为电能【本讲教育信息】」•教学内容:高考第一轮复习《化学选修4》第1章化学反应与能量第3节化学能转化为电能一一电池1. 原电池的工作原理。
2. 化学电源。
(1)锌锰干电池(2)铅蓄电池(3)氢氧燃料电池3. 金属的腐蚀与防护(1)金属腐蚀的电化学原理(2)金属的防护二.教学目的:1. 了解原电池工作原理。
2. 掌握根据电极反应判断阴极和阳极、根据电流方向判断电池正极和负极的方法。
3. 了解电极反应的概念。
4. 了解原电池的实际应用、常见化学电源的种类及工作原理。
5. 了解金属腐蚀的电化学原理以及防护的原则。
、* Xrflzi t it- fl W W J 、名f三.重点和难点1. 原电池的工作原理。
2. 电池电极的判断,电极反应和电池反应式的书写。
3. 金属腐蚀的电化学原理及金属的防护。
四.考点分析本节内容在高考中的主要考查点是:1. 原电池原理的应用。
2. 电池电极的判断。
3. 电极反应和电池反应式的书写。
4. 金属腐蚀的电化学原理及金属防护措施。
五.知识要点1. 原电池是 ______________ 的装置。
盐桥既可以使___________________ ,又可以使_______________ ,其导电原理是_____________________________________________ 。
2. 在铜锌原电池中,电极反应分别是:正极____________________ ,负极________________ 。
总反应式是3. 可充电电池放电时是_________________ ,将______________ 能转化为_______________ 能,充电时是一个_______________ ,将 _______________能转化为 _____________ 能储存起来。
4. 锌锰干电池分为_________________和______________ 两种干电池,负极上发生的电极反应为____________________________ ,正极上发生的电极反应为 _________________________________ 。
化学一轮复习20化学能转化为电能__电池含解析鲁科版

化学能转化为电能—-电池(本栏目内容,在学生用书中以独立形式分册装订!) 1.根据右图,可判断出下列离子方程式中错误的是()A.2Ag(s)+Cd2+(aq)===2Ag+(aq)+Cd(s)B.Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)C.2Ag+(aq)+Cd(s)===2Ag(s)+Cd2+(aq)D.2Ag+(aq)+Co(s)===2Ag(s)+Co2+(aq)A[从两个原电池的电极可以判断出三种金属的活动性关系为:Cd〉Co〉Ag,则氧化性关系为:Cd2+〈Co2+<Ag+,根据氧化还原反应规律知A项错误。
]2.某位同学利用家中废旧材料制作了一个可使玩具扬声器发出声音的装置,如图所示.下列有关该电池工作时的说法错误的是()A.铝罐将逐渐被腐蚀B.电子流向为铝制汽水罐→导线→扬声器→导线→木炭棒C.食盐水中的Na+向木炭棒移动D.木炭棒上发生的反应为2H++2e-===H2↑D[该原电池中铝作负极被腐蚀,浸透食盐水的木炭棒作正极,A正确;在外电路中,电子由铝罐流出沿导线流向扬声器,再由扬声器沿导线流向木炭棒,B正确;食盐水中的阳离子向正极移动,即Na+向木炭棒移动,C正确;木炭棒为正极,正极发生还原反应,在中性环境下,发生吸氧腐蚀,即O2+4e-+2H2O===4OH-,D错误。
]3.有关下图所示原电池的叙述不正确的是()A.电子沿导线由Cu片流向Ag片B.正极的电极反应是Ag++e-===AgC.Cu片上发生氧化反应,Ag片上发生还原反应D.反应时盐桥中的阳离子移向Cu(NO3)2溶液D4.如图所示装置中,观察到电流计指针偏转,M棒变粗,N 棒变细,由此判断表中所列M、N、P物质,其中可以成立的是()M N PA Zn Cu稀H2SO4B Cu Fe稀HClC Ag Zn AgNO3溶液D Zn FeFe(NO3)3溶液C[在装置中电流计指针发生偏转,说明该装置构成了原电池,根据正负极的判断方法,溶解的一极为负极,增重的一极为正极,所以M棒为正极,N棒为负极,且电解质溶液能析出固体,则只有C项正确。
最新-2018学年高中化学第一章第三节化学能转化为电能

2018-2018学年高二化学选修4(鲁科版)同步练习第一章第三节化学能转化为电能—电池一. 教学内容:第3节:化学能转化为电能-电池教学目的:1. 掌握原电池的工作原理,会写典型原电池反应。
2. 了解不同类型的化学电源的工作原理。
3. 理解金属电化学腐蚀的原理和类型。
4. 掌握金属防护的方法以及金属的电化学防护原理。
二. 重点、难点:原电池的工作原理及金属电化学腐蚀的原理知识分析:(一)原电池的工作原理1. 原电池定义:能把化学能转化为电能的装置叫做原电池。
2. 原电池工作原理:具有还原性的物质在一个电极上失去电子发生氧化反应,失去的电子通过导线流向另一电极,在该电极上具有氧化性的物质接受电子发生还原反应,从而形成电子的定向运动,也就形成了电流。
3. 构成条件:两个物质条件和两个关系条件。
两个物质条件:两个电极和电解质溶液或熔融状态的电解质。
两个关系条件:两电极要直接或间接相连,两电极要同时与同一电解质溶液相接触。
4.5. 电极反应和电池反应电极上物质的变化情况以及电子的转移情况可用电极反应式来表明。
在原电池中,氧化反应和还原反应是在两个电极上分别进行的,每个电极上只发生一个方向的电子转移,相当于氧化还原反应的一半,常称为半反应。
这种在电极上进行的半反应叫做电极反应。
电极反应总是涉及含有同一元素的不同价态的两种物质,一种处于较高价态,另一种处于较低价态,通常用单箭头表示这种有确定电子流向的电极反应。
以Cu- Zn (H2SO4 ) 原电池为例:负极反应:Zn→ Zn2+ + 2e (氧化反应)正极反应:2H++ 2e → H2↑(还原反应)电池总反应:Zn + H2SO4 =ZnSO4 + H2↑(化学方程式)Zn +2H+ =Zn2++H2↑(离子方程式)6. 闭合电路:具有还原性的物质失去的电子从原电池的负极出发,通过导线流向原电池的正极,在该电极上具有氧化性的物质获得电子发生还原反应。
与此同时,根据在同一闭合回路中同性电荷运动方向相同而异性电荷运动方向相反的规律,在电解质溶液中,阴离子移向负极,阳离子移向正极,从而在两部分导体中形成闭合回路,如下图所示。
高考化学一轮复习 第6章 化学反应与能量转化 第20讲 电能转化为化学能电解试题 鲁科版

电能转化为化学能-电解考点一电解的原理1.电解定义在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
2.能量转化形式电能转化为化学能。
3.电解池(1)构成条件①有与电源相连的两个电极。
②电解质溶液(或熔融盐)。
③形成闭合回路。
(2)电极名称及电极反应式(如图)(3)电子和离子的移动方向特别提醒电解时,在外电路中有电子通过,而在溶液中是依靠离子定向移动形成电流,即电子本身不会通过电解质溶液。
4.分析电解过程的思维程序(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H +和OH -)。
(3)然后排出阴、阳两极的放电顺序阴极:阳离子放电顺序:Ag +>Fe 3+>Cu 2+>H +(酸)>Fe 2+>Zn 2+>H +(水)>Al 3+>Mg 2+>Na +>Ca 2+>K +。
阳极:活泼电极>S 2->I ->Br ->Cl ->OH ->含氧酸根离子。
注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。
②最常用、最重要的放电顺序:阳极:Cl ->OH -;阴极:Ag +>Cu 2+>H +。
③电解水溶液时,K +~Al 3+不可能在阴极放电,即不可能用电解水溶液的方法得到K 、Ca 、Na 、Mg 、Al 等金属。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
深度思考1.用分析电解过程的思维程序分析电解下列物质的过程,并总结电解规律(用惰性电极电解)。
(1)电解水型答案 不一定,如用惰性电极电解饱和Na 2SO 4溶液,一段时间后会析出Na 2SO 4·10 H 2O 晶体,剩余溶液仍为该温度下的饱和溶液,此时浓度保持不变。
高三复习鲁科版 化学能转化为电能——电池 单元测试(含解析)

化学能转化为电能——电池1.原电池中,B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的()A.A是Zn,B是Cu,C为稀硫酸B.A是Cu,B是Zn,C为稀硫酸C.A是Fe,B是Ag,C为稀AgNO3溶液D.A是Ag,B是Fe,C为稀AgNO3溶液解析:选C在原电池中,一般活泼金属作负极,失去电子发生氧化反应(金属被氧化)而逐渐溶解(或质量减轻);不活泼金属(或导电的非金属)作正极,发生还原反应有金属析出(质量增加)或有气体放出;依据题意可知A为负极、B为正极,即活泼性A大于B,且A 能从电解质溶液中置换出金属单质。
所以,只有C选项符合题意。
2.(2018·湖南长郡中学模拟)下列有关金属腐蚀与防护的说法正确的是()A.常温下,断开K时,若M溶液为浓硫酸,则铁发生化学腐蚀B.关闭K,若M为氯化钠,则铁极的电极反应式为O2+4e-+2H2O===4OH-C.关闭K,若M为硫酸铵,则石墨极的电极反应式为2H++2e-===H2↑D.关闭K,若M溶液为海水,石墨换成铜或银,则叫外加电流的阴极保护法解析:选C常温下,断开K时,若M溶液为浓硫酸,金属铁发生钝化,铁受到保护,故A项错误;关闭K时,若M为氯化钠,则发生金属铁的吸氧腐蚀,金属铁是负极,电极反应式为Fe-2e-===Fe2+,故B项错误;关闭K时,若M为硫酸铵,则溶液呈酸性,发生金属铁的析氢腐蚀,金属铁是负极,石墨极的电极反应式为2H++2e-===H2↑,故C 项正确;关闭K时,若M溶液为海水,石墨换成铜或银,此时金属铁是负极,会加快金属Fe的腐蚀,且装置中没有外加电流,故D项错误。
3.由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。
下图是氢氧燃料电池驱动LED发光的装置。
下列有关叙述正确的是()A.a处通入氧气,b处通入氢气B.该装置中只涉及两种形式的能量转化C.电池正极电极反应式为O2+2H2O+4e-===4OH-D.P-型半导体连接的是电池负极解析:选C根据电子移向,a处应通H2,b处应通O2,A错误;在该装置中化学能转化为电能,电能转化为光能、热能等,B错误;P-型半导体连接的是电池正极,D错误。
高考化学一轮复习 第6章 化学反应与能量转化 第20讲 电能转化为化学能电解试题 鲁科版

电能转化为化学能-电解考点一电解的原理1.电解定义在电流作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
2.能量转化形式电能转化为化学能。
3.电解池(1)构成条件①有与电源相连的两个电极。
②电解质溶液(或熔融盐)。
③形成闭合回路。
(2)电极名称及电极反应式(如图)(3)电子和离子的移动方向特别提醒电解时,在外电路中有电子通过,而在溶液中是依靠离子定向移动形成电流,即电子本身不会通过电解质溶液。
4.分析电解过程的思维程序(1)首先判断阴、阳极,分析阳极材料是惰性电极还是活泼电极。
(2)再分析电解质水溶液的组成,找全离子并分阴、阳两组(不要忘记水溶液中的H +和OH -)。
(3)然后排出阴、阳两极的放电顺序阴极:阳离子放电顺序:Ag +>Fe 3+>Cu 2+>H +(酸)>Fe 2+>Zn 2+>H +(水)>Al 3+>Mg 2+>Na +>Ca 2+>K +。
阳极:活泼电极>S 2->I ->Br ->Cl ->OH ->含氧酸根离子。
注意 ①阴极不管是什么材料,电极本身都不反应,一定是溶液(或熔融电解质)中的阳离子放电。
②最常用、最重要的放电顺序:阳极:Cl ->OH -;阴极:Ag +>Cu 2+>H +。
③电解水溶液时,K +~Al 3+不可能在阴极放电,即不可能用电解水溶液的方法得到K 、Ca 、Na 、Mg 、Al 等金属。
(4)分析电极反应,判断电极产物,写出电极反应式,要注意遵循原子守恒和电荷守恒。
(5)最后写出电解反应的总化学方程式或离子方程式。
深度思考1.用分析电解过程的思维程序分析电解下列物质的过程,并总结电解规律(用惰性电极电解)。
(1)电解水型答案 不一定,如用惰性电极电解饱和Na 2SO 4溶液,一段时间后会析出Na 2SO 4·10 H 2O 晶体,剩余溶液仍为该温度下的饱和溶液,此时浓度保持不变。
高考化学大一轮复习 第六章 第三讲 化学能转化为电能电池配套试题(含解析)鲁科版

第三讲化学能转化为电能——电池一、选择题1.下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是()。
解析A项是将电能转化成化学能;B项是将水的势能转化成电能;C项是将太阳能转化成热能。
答案 D2.下列有关钢铁腐蚀与防护的说法正确的是()A.钢管与电源正极连接,钢管可被保护B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+解析钢管与电源正极相连,则钢管作阳极,发生氧化反应而被腐蚀,A项错误;铁遇冷浓硝酸表面钝化,在表面生成一层致密的氧化膜保护内部不被腐蚀,B项正确;钢管与铜管露天堆放在一起,形成原电池时钢管作负极,发生氧化反应而被腐蚀,C项错误;钢铁发生析氢腐蚀时,负极反应为:Fe-2e-===Fe2+,D项错误。
答案 B3.已知蓄电池在充电时作电解池,放电时作原电池。
铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”。
关于标有“+”的接线柱,下列说法中正确的是()A.充电时作阳极,放电时作正极B.充电时发生还原反应,放电时发生氧化反应C.充电时作阴极,放电时作负极D.充电、放电时均发生氧化反应解析“+”接线柱标明放电时作正极,即放电时发生还原反应,则充电时应发生氧化反应,应该作阳极。
答案 A4.如图甲是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片上的描述合理的是()。
卡片号:22012.8.15实验后的记录:②Cu为阳极,Zn为阴极②Cu极上有气泡产生③SO2-4向Cu极移动④若有0.5 mol电子流经导线,则可产生0.25 mol气体⑤电子的流向是:Cu→导线→Zn⑥正极反应式:Cu+2e-Cu2+图乙A.①②③B.②④C.④⑤⑥D.③④⑤解析①中Cu为正极,Zn为负极,③中SO42-向负极移动,⑤中电子的流向是:Zn→导线→Cu,⑥中正极反应式:2H++2e-===H2↑,故①③⑤⑥错。
高考化学一轮总复习 第6章 化学反应与能量 第3节 化学能转化为电能-电池课后分层训练 鲁科版(20

2018版高考化学一轮总复习第6章化学反应与能量第3节化学能转化为电能-电池课后分层训练鲁科版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018版高考化学一轮总复习第6章化学反应与能量第3节化学能转化为电能-电池课后分层训练鲁科版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018版高考化学一轮总复习第6章化学反应与能量第3节化学能转化为电能-电池课后分层训练鲁科版的全部内容。
化学能转化为电能—-电池A组专项基础达标(建议用时:30分钟)1。
(2017·泉州模拟)课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。
下列结论错误的是( )A.原电池是将化学能转化成电能的装置B.原电池由电极、电解质溶液和导线等组成C.图中a极为铝条、b极为锌片时,导线中会产生电流D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片D[D项,a极为负极,电子由负极(锌片)流出。
]2.根据下图判断,下列说法正确的是()A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大D[A项,装置Ⅰ中的负极为Zn;B项,装置Ⅱ中的正极反应为2H++2e-===H2↑;C项,阳离子向正极移动,装置Ⅰ中向左侧移动。
]3.(2013·全国卷Ⅱ)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔.下列关于该电池的叙述错误..的是( )A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三价铝离子C.正极反应为:NiCl2+2e-===Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动B[A项,在负极Na失电子生成Na+,正极反应为NiCl2+2e-===Ni+2Cl-,故电池反应中有NaCl生成;B项,电池的总反应是金属钠还原二价镍离子;C项,正极上NiCl2发生还原反应,电极反应为NiCl2+2e-===Ni+2Cl-;D项,钠在负极失电子,被氧化生成Na+,Na+通过钠离子导体在两电极间移动。
高考化学一轮复习 第6章 化学反应与能量转化 第21讲 化学能转化为电能电池试题 鲁科版

化学能转化为电能-电池考点一原电池的工作原理1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
2.原电池的构成条件(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
3.工作原理以锌铜原电池为例(1)反应原理①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
②盐桥的作用:①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
(3)图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
关键点:盐桥原电池中,还原剂在负极区,而氧化剂在正极区。
深度思考1.正误判断,正确的划“√”,错误的划“×”(1)在原电池中,发生氧化反应的一极一定是负极( )(2)在原电池中,负极材料的活泼性一定比正极材料强( )(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )(4)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )(5)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( )答案(1)√(2)×(3)×(4)√(5)×2.能用金属代替盐桥吗?答案不可以,在电路接通的情况下,这个盐桥只是整个回路的一部分,随时要保持电中性,琼胶作为盐桥因其中含有两种离子,可以与溶液中的离子交换,从而达到传导电流的目的,而且琼胶本身可以容纳离子在其中运动;若用金属代替盐桥,电子流向一极后不能直接从另一极得到补充,必然结果就是向另一极释放金属阳离子或者溶液中的金属阳离子在电子流出的那一极得电子析出金属,从而降低了整个电池的电势。
高考化学第一轮复习 专题 化学能转化为电能习题 鲁科版

专题化学能转化为电能【模拟试题】(答题时间:50分钟)1. 关于如图所示装置的叙述,正确的是()A. 铜是阳极,铜极上有气泡产生B. 铜极质量逐渐减少C. 电流从锌极经导线流向铜片D. 氢离子在铜极表面被还原2. 将Mg条、Al条平行插入一定浓度的NaOH溶液中,用电器连接成原电池。
此电池工作时,下列叙述中正确的是()A. Mg比Al活泼,Mg失去电子被氧化成 2MgB. Al条表面虽有氧化膜,但可不必处理C. 该电池的内、外电路中,电流均是由电子定向移动形成的D. Al 是电池负极,开始工作时溶液中会立即有白色沉淀析出3. 下列描述中,不符合生产实际的是( ) A. 电解熔融的氧化铝制取金属铝,用铁作阳极 B. 电解法精炼粗铜,用纯铜作阴极C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极D. 在镀件上电镀锌,用锌作阳极4. 关于电解NaCl 水溶液,下列叙述正确的是( ) A. 电解时在阳极得到氯气,在阴极得到金属钠 B. 若在阳极附近的溶液中滴加KI 溶液,溶液呈棕色 C. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性5. 埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是( ) A. 在含铁元素较多的酸性土壤中 B. 在潮湿疏松透气的土壤中 C. 在干燥致密不透气的土壤中D. 在含碳粒较多、湿潮透气的土壤中6. a 、b 、c 三种金属分别放入稀SO H 2中,只有c 产生2H ,a 、b 同时放入a 的硝酸盐溶液中,a 的质量增加,则离子氧化能力的顺序是( ) A. ++++>>>H c b a 222 B. ++++>>>H c a b 222C. ++++>>>222c H b aD. ++++>>>222a b H c7. 将铁片和银片用导线联接插入硫酸铜溶液中,当线路中有0.2mol 的电子发生转移时,负极的质量变化是( )A. 增加0.8gB. 增加6.4gC. 减轻5.6gD. 增加5.6g8. 将等质量的两份锌粉a 、b 分别加入过量的稀硫酸,同时向a 中加少量4CuSO 溶液,下列各图中产生2H 的体积VL 与时间t min 的关系,基本正确的是( )9. 已知空气—锌电池的电极反应为: 锌片:--++→+e 2O H ZnO OH 2Zn 2 石墨:--→++OH 2e 2O H O 2122 据此判断,锌片是( ) A. 负极,并被氧化 B. 负极,并被还原C. 正极,并被氧化D. 正极,并被还原10. 下列防腐措施中,属于电化学保护法的是( ) A. 用氧化剂使金属表面生成致密稳定的氧化物保护膜 B. 在金属中加入一些铬或镍制成金属合金 C. 在轮船的船壳水线以下部分,装上一锌锭D. 金属表面喷漆11. 随着人们生活质量的不断提高,废电池进行集中处理的问题被提到议事日程,其首要原因是( ) A. 利用电池外壳的金属材料B. 防止电池中汞、镉和铅等金属离子对土壤和水源的污染C. 不使电池中渗泄的电解液腐蚀其他的物品D. 回收其中石墨电极12. 氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。
高考化学一轮复习 第六章 第2讲 电能转化为化学能 电解 鲁科版

变式训练
1.(2015·山西临汾模拟)用如图甲装置电解一定量的 CuSO4 溶液,M、N 为惰性 电极。电解过程实验数据如图乙所示。x 轴表示电解过程中转移电子的物质的 量,y 轴表示电解过程中产生气体的总体积。则下列说法不正确的是( B )
A.电解过程中 N 电极表面先有红色物质生成,后有气泡产生 B.A 点所得溶液只需加入一定量的 CuO 固体就可恢复到起始状态 C.Q 点时 M、N 两电极上产生的气体在相同条件下体积相同 D.若 M 电极材料换成 Cu 做电极,则电解过程中 CuSO4 溶液的浓度不变
(6)甲烧杯中滴入石蕊试液,
终得到
溶液。
,
,
, 析出物质
mol。
, 析出气体
mL(标准状况)。
极附近变红,如果继续电解,在甲烧杯中最
答案: (1)负 正 (2)4Ag++4e- 4Ag 0.025
(3)4OH-―4e- 2H2O+O2↑ 140 (4)Cu2++2e- Cu 0.012 5 (5)2Cl--2e- Cl2↑ 280 (6)B HNO3
考点二 电解规律及计算 考点剖析
1. 以惰性电极电解电解质溶液的规律
电解 类型
电解质 类别
电解 水型
强碱、含氧酸、活 泼金属的含氧酸 盐
电解 电解 质型
放 H2 生碱 型 放 O2 生 酸 型
无氧酸、不活泼金 属的无氧酸盐
活泼金 属的无 氧酸盐
不活泼 金属的 含氧酸盐
实例
电解 NaOH 溶液
电解稀 H2SO4 电解 Na2SO4
第2讲 电能转化为化学能——电解
考纲导向
热点导学
1.了解电解池的工作原理。 2.能写出电极反应和电池反应方 程式。
高三化学一轮复习 第六章 第3讲 化学能转化为电能 电池 鲁科版

金属被氧化的过程
较活泼的金属被 氧化. 的过程
相互 两种腐蚀往往同时发生,但电化学腐蚀更普遍,危害更严
关系
重
精选课件
(2)电化腐蚀的两种途径比较(以钢铁生锈为例)
吸氧腐蚀
析氢腐蚀
条件
金属表面水膜 呈 弱酸性、中性或碱性.
金属表面水膜 酸性较高.
电 极
正
反
应负 式
O2+2H2O+4e-―→4OH- 2Fe―→2Fe2++4e-
第3讲 化学能转化为电能——电池
精选课件
1.了解原电池的工作原理,能写出电极反应和电池反应方程 式。 最新 3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止 金属腐蚀的措施。
1.原电池的工作原理分析,尤其是带盐桥的原电池装置。
2.根据所给自发进行的反应设计原电池,并能绘制装置图。 热点 定位 3.了解常用化学电源的构造及新型电源的工作原理。
2H++2e-―→H2↑ Fe―→Fe2++2e-
电池反应式 2Fe+O2+2H2O===2Fe(OH)2
Fe+2H+===Fe2++ H2↑
精选课件
2.金属的防护 (1) 改变金属的组成结构,如不锈钢。 (2) 在金属表面覆盖保护层 ,如电镀、喷漆。 (3)电化学保护法:① 牺牲阳极的阴极保护法 ;
② 外加电流的阴极保护法 。
精选课件
精选课件
1.(2009年广东高考)出土的锡青铜(铜锡合金)文物常有 Cu2(OH)3Cl覆盖在其表面。下列说法正确的是(多选)( )
A.锡青铜的熔点比纯铜高 B.在自然环境中,锡青铜中的锡可对铜起保护作用 C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过 程 【解析】 合金的熔点比成分金属的低,A错;金属的电化学腐 蚀属于化学反应,D错。 【答案】 BC
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题化学能转化为电能
【模拟试题】(答题时间:50分钟)
1. 关于如图所示装置的叙述,正确的是()
A. 铜是阳极,铜极上有气泡产生
B. 铜极质量逐渐减少
C. 电流从锌极经导线流向铜片
D. 氢离子在铜极表面被还原
2. 将Mg条、Al条平行插入一定浓度的NaOH溶液中,用电器连接成原电池。
此电池工作时,下列叙述中正确的是()
Mg
A. Mg比Al活泼,Mg失去电子被氧化成 2
B. Al条表面虽有氧化膜,但可不必处理
C. 该电池的内、外电路中,电流均是由电子定向移动形成的
D. Al是电池负极,开始工作时溶液中会立即有白色沉淀析出
3. 下列描述中,不符合生产实际的是()
A. 电解熔融的氧化铝制取金属铝,用铁作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D. 在镀件上电镀锌,用锌作阳极
4. 关于电解NaCl水溶液,下列叙述正确的是()
A. 电解时在阳极得到氯气,在阴极得到金属钠
B. 若在阳极附近的溶液中滴加KI溶液,溶液呈棕色
C. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
5. 埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是()
A. 在含铁元素较多的酸性土壤中
B. 在潮湿疏松透气的土壤中
C. 在干燥致密不透气的土壤中
D. 在含碳粒较多、湿潮透气的土壤中
6. a 、b 、c 三种金属分别放入稀SO H 2中,只有c 产生2H ,a 、b 同时放入a 的硝酸盐溶液中,a 的质量增加,则离子氧化能力的顺序是( ) A. ++++>>>H c b a 222 B. ++++>>>H c a b 222
C. ++++>>>222c H b a
D. ++++>>>222a b H c
7. 将铁片和银片用导线联接插入硫酸铜溶液中,当线路中有0.2mol 的电子发生转移时,负极的质量变化是( ) A. 增加0.8g B. 增加6.4g C. 减轻5.6g D. 增加5.6g 8. 将等质量的两份锌粉a 、b 分别加入过量的稀硫酸,同时向a 中加少量4CuSO 溶液,下列各图中产生2H 的体积VL 与时间t min 的关系,基本正确的是( )
9. 已知空气—锌电池的电极反应为: 锌片:--++→+e 2O H ZnO OH 2Zn 2
石墨:
--→++OH 2e 2O H O 2
1
22 据此判断,锌片是( ) A. 负极,并被氧化 B. 负极,并被还原 C. 正极,并被氧化 D. 正极,并被还原 10. 下列防腐措施中,属于电化学保护法的是( ) A. 用氧化剂使金属表面生成致密稳定的氧化物保护膜 B. 在金属中加入一些铬或镍制成金属合金 C. 在轮船的船壳水线以下部分,装上一锌锭 D. 金属表面喷漆
11. 随着人们生活质量的不断提高,废电池进行集中处理的问题被提到议事日程,其首要原因是( )
A. 利用电池外壳的金属材料
B. 防止电池中汞、镉和铅等金属离子对土壤和水源的污染
C. 不使电池中渗泄的电解液腐蚀其他的物品
D. 回收其中石墨电极
12. 氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。
氢镍
电池的总反应式是)
OH (NiO H 2
1
2+2)OH (Ni 。
根据此反应式判断,下列叙述中正
确的是( )
A. 电池放电时,电池负极周围溶液的pH 不断增大
B. 电池放电时,镍元素被氧化
C. 电池充电时,氢元素被氧化
D. 电池放电时,2H 在负极放电
13. 铁钉与碳棒用导线连接后,浸入到0.01mol/L 的食盐溶液中,可能发生的反应是( ) A. 碳棒上放出2Cl B. 碳棒附近产生 OH
C. 碳棒上放出2O
D. 铁钉被氧化
14. 把锌片和铁片放在盛有稀食盐水和酚酞混合液的U 型管中,如图所示,最终可在A 极观察到酚酞变红。
问A 是原电池正极还是负极?代表锌还是代表铁?写出电极上的反应式和总反应式。
15. 如图所示,在大试管里放入一段光亮无锈的弯成螺旋状的铁丝,把试管倒入水中,把这个装置这样放置约一周后,观察到铁丝发生的变化是______________原因是______________试管里的水面会上升,最终上升高约为______________,原因是______________________________________________________________________。
16. 常用干电池是锌围成的圆铜作负极,石墨粉和二氧化锰粉包围在碳棒的周围并压成圆筒形作正极,内充糊状的2ZnCl 、Cl NH 4。
工作时某一种阳离子在正极放电产生两种气体,一种气体分子可被2MnO 氧化,且生成O H 2和32O Mn ,另一气体显碱性。
试写出干电池工作时的电极反应式,注明反应类型:
负极____________________________,反应类型____________________________; 正极____________________________,反应类型____________________________。
17. 燃料电池是目前正在探索的一种新型电池。
它主要是利用燃料在燃烧过程中把化学能直接转化为电能,目前已经使用氢氧燃料电池的基本反应是 x 极:--→++OH 4e 4)(O H 2)(O 22液气 y 极:--+→+e 2)(O H 2OH 2)(H 22液气
回答下列问题:
(1)x 是______________,发生______________反应。
(2)y 是______________,发生______________反应。
总反应方程式为____________________________。
(3)若反应后得到5.4g 液态水,此时氢氧燃料电池转移的电子数是______________。
18. 阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:O H 2O H 2222=+,电解质溶液为KOH 溶液或42SO H 溶液,其电极反应式分别为: 负极________________________________________________________, 正极________________________________________________________; 负极________________________________________________________,
正极________________________________________________________。
【试题答案】
1. D
2. B
3. A
4. B
5. C
6.
C 7. C
8. A 9. A 10. C 11. B 12. D 13. BD
14. A 是正极,Fe 作正极材料。
负极:-++→e 2Zn Zn 2
正极:--→++OH 4e 4O O H 222
总反应:-++=++OH 4Zn 2O H 2O Zn 2222
15. 铁丝表面形成一层红褐色铁锈 发生吸氧腐蚀 试管体积的5
1
铁和氧气反应,时间足够时消耗空气中全部氧气,在空气中2O 约占总体积的5
1 16. 氧化反应
还原反应 17. (1)正极 还原
(2)负极 氧化 O H 2O H 2222=+
(3)0.6A N
18. --
+=+e O H OH H 22222
--=++OH e O H O 4422 -++=e H H 222
O H H e O 22244=+++-。
