磷及其化合物
磷及其化合物

P4O6 + 6H2O = 4H3PO3 (亚磷酸)
4P + 5O2 P4O10
燃烧
4P + 3O2 P4O6
燃烧
⑴五氧化二磷
五氧化二磷单斜晶系,白色粉末状,Tf = 420℃,在300℃时升华,有很强的吸水性,在空气中易潮解,有腐蚀性。 五氧化二磷还可从很多物质中夺取化合 态的水,使其脱水;与有机物接触,会发生 燃烧。 P4O10 + 6H2SO4 = 6SO3 + 4H3PO4 P4O10 + 12HNO3 = 6N2O5 + 4H3PO4
P
P
P
P
问题讨论
实验室中如何保管白磷好试剂?
②红磷
P + 5HNO3 = H3PO4 + 5NO2 + H2O
白磷 红磷
533K
红磷是紫磷的无定形体,暗红色粉末(分子结构不详),不溶于水及 CS2,无毒,燃点TI = 260℃,化学活性比白磷小得多。 红磷与空气长期接触也会进行及其缓慢的氧化作用,形成易吸水的氧化物使红磷变潮。 红磷易被硝酸氧化为磷酸,与氯酸钾摩擦即着 火甚至爆炸。
黄磷尾气净化生产甲醇
【改进工艺路线】
改进分离、提纯技术,走“湿法”炼 磷路线。
磷矿石 磷酸 磷酸盐
H2SO4
2.磷的化学性质
单质磷的化学活性比氮的高,它能与氧发生激烈反应,也能在氯气中自燃。
P4 + 3NaOH + 3H2O = PH3↑+ 3NaH2PO2
2.制取磷酸
过滤
粗产品(H3PO4)
⑴粗磷酸的制取
⑵纯磷酸的制取
含磷有机化合物的分类

含磷有机化合物的分类1. 介绍含磷有机化合物是指分子中含有磷原子的有机化合物。
它们具有广泛的应用领域,包括农药、药物、聚合物、催化剂等。
考虑到其重要性和多样性,对含磷有机化合物的分类和性质的研究具有重要意义。
本文将深入探讨含磷有机化合物的分类,以期对这一领域进行全面、详细的介绍。
2. 无机磷化合物 vs. 有机磷化合物在开始对含磷有机化合物进行分类之前,有必要先区分含磷有机化合物和无机磷化合物。
无机磷化合物是指不含碳元素的磷化合物,如磷酸、亚磷酸等。
而有机磷化合物则是指分子中既含有碳元素又含有磷原子的化合物。
3. 有机磷化合物的基本结构有机磷化合物的基本结构可以分为几类,包括:3.1 烷基磷化合物烷基磷化合物是其中最简单的一类,它们的分子中只含有一个或多个烷基基团与磷原子连接。
根据烷基的不同,可以进一步分为烷基氧化物、二烷基磷酸酯等。
3.2 膦化合物膦化合物是一类含有P-C键的化合物,其分子中的磷原子与碳原子直接相连。
膦化合物根据配体的不同,可以进一步分为膦酚、膦醇、膦酰胺等。
- 膦酸的例子有三苯膦酸、二甲基膦酸等。
- 膦醇的例子有三苯膦醇、二乙基膦醇等。
- 膦酰胺的例子有三苯膦酰胺、二苯基膦酰胺等。
3.3 膦酸酯膦酸酯是指分子中既含有磷酸基团又含有有机基团的化合物。
它们可以通过酸催化反应或酯交换反应得到,并且具有较好的稳定性。
例如,二甲基膦酸二甲酯就是一种常见的膦酸酯。
4. 含磷有机化合物的重要性含磷有机化合物具有广泛的应用价值,其重要性体现在以下几个方面:4.1 农药和杀虫剂很多农药和杀虫剂中都含有磷元素,如有机磷杀虫剂马拉硫磷。
这些化合物可以有效地控制农作物和园艺作物中的害虫,提高农作物的产量和质量。
4.2 药物一些含磷有机化合物在药物领域有重要应用。
例如,抗癌药物伊立替康就是一种含磷有机化合物。
这些化合物可以通过干扰病原体的生理过程来治疗疾病。
4.3 聚合物含磷有机化合物可以用于合成多种聚合物,如磷酸酯树脂、聚醚膦等。
2020年高中化学·强化讲义 第31节 磷及其重要的化合物

第31节磷及其重要的化合物一、磷磷主要以磷酸盐的形式存在于矿石中。
此外动物的骨骼牙齿、脑髓和神经组织中都含有磷。
植物的果实和幼芽中也含有磷。
磷对于维持生物体正常的生理机能有重要的作用。
磷有多种同素异形体,白磷、红磷和黑磷。
白磷分子是由4个磷原子构成的正四面体,键角60°(如图6-26所示)。
白磷是一种蜡状固体,有剧毒,难溶亍水,易溶于二硫化碳。
白磷的密度是1.8g /cm3,熔点为44.1℃,沸点为280.5℃。
着火点低,会自燃。
把白磷隔绝空气加热到260℃时会转变为红磷。
红磷是一种暗红色粉末,结构复杂,没有毒,不溶于水,也不溶于二硫化碳。
密度为2.2g /cm 。
.红磷加热到416℃以上会升华,它的蒸气迅速冷却后变成白磷。
磷的化学性质活泼,容易与氧、卤素以及许多金属直接化合。
(1)磷与氧气的化合反应2254P 5O 2P O +−−→白磷比红磷更易燃烧,当其与空气接触即发生缓慢氧化,氧化时会发光,在暗处可以看到。
积聚的热量使温度达到40℃时会自燃,因此必须储存在密闭容器内,少量的白磷可保存在水中。
红磷的着火点是240℃,常温下存放在空气中是安全的。
(2)磷与氯气经点燃化合,可生成PCl3和PCl5,伴有白色的烟雾产生。
232P 3Cl 2PCl +→点燃252P 5Cl 2PCl +→点燃(3)当白磷与热的浓碱液反应时会产生无色、有剧毒的气体磷化氢。
23224P 3KOH 3H O PH 3KH PO ++−−→↑+二、磷的氧化物常见的磷的氧化物有三氧化二磷和五氧化二磷.五氧化二磷极易与水化合,两者反应剧烈,同时放出大量的热,可用作干燥剂2523P O H O 2HPO +→磷酸(偏磷酸,有毒)25234P O H O 2H PO +→热水(磷酸,无毒)三、磷酸及磷酸盐磷酸是无色透明的晶体,熔点为42.35℃,具有吸湿性,能与水以任意比例互溶。
通常用的浓磷酸是浓度为85%的无色黏稠状液体。
含磷有机化合物

含磷有机化合物简介有机化合物是由碳和氢以及其他一些元素组成的化合物,是生物体中的基本构建块。
含磷有机化合物指的是其中包含磷元素的有机化合物。
磷是生物体中重要的元素之一,它在细胞代谢、骨骼形成、DNA和RNA合成等方面起着重要的作用。
含磷有机化合物广泛存在于自然界中,具有多样的结构和功能。
含磷有机化合物的分类1. 有机磷化合物有机磷化合物是最常见的含磷有机化合物之一,它们通常由磷元素与碳原子通过共价键结合而成。
有机磷化合物具有广泛的应用,例如农药、医药、火灾阻燃剂等。
2. 亚磷酸酯亚磷酸酯是一类含有磷酸酯结构的有机化合物,其中的磷酸根(PO32-)与碳原子相连。
亚磷酸酯在生物体中起着重要的作用,如参与能量代谢、细胞信号传导等。
3. 磷酸酯磷酸酯是一类含有磷酸基团(PO43-)的有机化合物,通常是三个氧原子与一个磷原子形成连接。
磷酸酯广泛存在于生物体中,如DNA和RNA中的磷酸二酯键。
含磷有机化合物的合成方法含磷有机化合物的合成方法多种多样,以下是一些常见的方法:1. 加成反应加成反应是含磷有机化合物的一种重要合成方法。
例如,将乙烯与三甲氧基氯磷反应,可以得到苯基氯磷二甲酯。
2. 烷基化反应烷基化反应是将烷基基团引入到含磷有机化合物中的一种方法。
例如,利用烷基溴化物与亚磷酸酯反应,可以得到相应的烷基亚磷酸酯。
3. 磷基化反应磷基化反应是将磷基基团引入到有机化合物中的一种方法。
例如,将熔融的三甲基膦与醛酮类化合物反应,可以得到相应的磷酸酯。
含磷有机化合物的应用1. 农药含磷有机化合物广泛应用于农药领域。
例如,有机磷化合物杀虫剂可以通过抑制昆虫神经系统的酯酶活性来杀死害虫。
2. 药物含磷有机化合物在药物领域也有重要的应用。
例如,一些抗癌药物中含有磷酸酯结构,可以通过干扰癌细胞的DNA和RNA合成来抑制肿瘤生长。
3. 火灾阻燃剂含磷有机化合物还被广泛应用于火灾阻燃剂中。
这些化合物可以抑制火焰的蔓延,减少火灾对人类和环境的危害。
含磷有机化合物

含磷有机化合物概述含磷有机化合物是指化学结构中含有磷元素的有机化合物。
它们在生命体系中具有重要的作用,如构成核酸分子、ATP等。
同时,含磷有机化合物也被广泛应用于农业、医药和工业等领域。
分类根据磷原子的化学环境和连接方式,含磷有机化合物可以分为三类:膦、膜和酯。
1. 膦类化合物膦类化合物是指含有P-C键的有机分子,其中P原子的电子结构为sp3杂化。
它们通常具有良好的配位性能,被广泛应用于催化反应、金属离子识别和荧光探针等领域。
2. 膜类化合物膜类化合物是指含有P-O-C键的有机分子,其中P原子的电子结构为sp3杂化。
它们通常具有良好的亲水性和表面活性,被广泛应用于表面活性剂、乳液稳定剂和胶束等领域。
3. 酯类化合物酯类化合物是指含有P-O-C键的有机分子,其中P原子的电子结构为sp3杂化。
它们通常具有良好的生物降解性和低毒性,被广泛应用于医药、农药和染料等领域。
应用1. 农业领域含磷有机化合物在农业领域中被广泛应用于肥料和农药的制造。
其中,膦类化合物常用于制造杀虫剂和除草剂,膜类化合物常用于制造杀菌剂和植物生长调节剂,酯类化合物常用于制造肥料。
2. 医药领域含磷有机化合物在医药领域中被广泛应用于抗癌、抗病毒和抗生素等药物的制造。
其中,膦类化合物常用于制造抗癌药物,膜类化合物常用于制造抗病毒药物,酯类化合物常用于制造抗生素。
3. 工业领域含磷有机化合物在工业领域中被广泛应用于阻燃、润滑和塑料等材料的制造。
其中,膦类化合物常用于阻燃剂的制造,膜类化合物常用于润滑剂的制造,酯类化合物常用于塑料的制造。
环境影响含磷有机化合物在生产、使用和处理过程中会对环境产生一定的影响。
其中,农业领域中大量使用的含磷农药会污染土壤和水体,对生态系统产生负面影响。
医药领域中大量使用的含磷药物也会排放到水体中,对水质产生污染。
同时,在含磷有机化合物的废弃物处理过程中,也会产生环境污染。
结论含磷有机化合物在生命体系和人类社会中具有重要的作用。
含磷有机化合物的分类

含磷有机化合物的分类含磷有机化合物是指在分子中存在磷元素的有机化合物,它们在生命体系中发挥着重要的作用,是一类十分重要的有机化合物。
根据它们的结构特点和功能性质,可以将含磷有机化合物分为多个不同的类别。
一、膦类化合物膦类化合物是含有P-C键的一类有机磷化合物,通常以R3P表示。
其中R可以是任何一个有机基团,如甲基、乙基、苯基等。
膦类化合物广泛存在于自然界和人工合成体系中,并具有重要的应用价值。
1. 三甲基膦三甲基膦是最常见的一种膦类化合物,其分子式为(CH3)3P。
它具有无色液体或白色晶体等多种形态,在催化剂、医药和农药等领域都有广泛应用。
2. 三苯基膦三苯基膦是另一种常见的膦类化合物,其分子式为(C6H5)3P。
它具有白色晶体或无色液体等形态,在金属催化反应和聚合反应中具有重要作用。
二、磷酸酯类化合物磷酸酯类化合物是一类含有P-O-C键的有机磷化合物,通常以ROPO (R为有机基团)表示。
它们广泛存在于生命体系中,如DNA、RNA、ATP等都是磷酸酯类化合物。
1. 二甲基磷酸二甲酯二甲基磷酸二甲酯是最常见的一种磷酸酯类化合物,其分子式为(CH3O)2POCH3。
它具有无色液体或白色晶体等形态,在医药和农药等领域具有广泛应用。
2. 三乙基磷酸三乙酯三乙基磷酸三乙酯是另一种常见的磷酸酯类化合物,其分子式为(C2H5O)3PO。
它具有无色液体或白色晶体等形态,在某些聚合反应和油漆添加剂中具有重要作用。
三、亚胺类化合物亚胺类化合物是一类含有P-N键的有机磷化合物,通常以R2PNR2表示。
其中R可以是任何一个有机基团,如甲基、乙基、苯基等。
亚胺类化合物广泛存在于自然界和人工合成体系中,并具有重要的应用价值。
1. 二甲基亚胺二甲基亚胺是最常见的一种亚胺类化合物,其分子式为(CH3)2PN (CH3)2。
它具有无色液体或白色晶体等形态,在催化剂和聚合反应中都有广泛应用。
2. 三苯基亚胺三苯基亚胺是另一种常见的亚胺类化合物,其分子式为(C6H5)3PN。
磷化工教学课件-第5章-磷化合物

(水量不足)
三氯氧磷
PCl5 + 4H2O = H3PO4 + 5HCl
(水过量)
6PCl5 + P4O10 = 10POCl3
五氯化磷生产工艺: 1.间歇法 2.连续法
PCl5 + CH3COOH = CH3COCl + HCl+ POCl3 PCl5 + SO2 = SOCl2 + POCl3 PCl5 + NH4Cl —— (NPCl2)n
PH3的性质 1、 PH3是无色剧毒、有大蒜气味的气体,着火点是423K,火焰为浅 蓝色。若制得的磷化氢中含有痕量的联膦(P2H2),则在常温时可自 动燃烧生成H3PO4。
2、PH3的水溶性小(与氨相比),且水溶液的碱性弱得多。
Kbo=1×10-25 PH3 +H2O
PH3 ·H2O
PH4++OH-
将赤磷和液体溴作为原料,用三溴化磷作溶剂,进行反应,制 得三溴化磷。
应用: 转化醇为溴化物 合成烯烃 合成磷酰胺的反应
(3)三碘化磷 熔点:61°C(lit.) 密度:4.18g/mL at 25°C(lit.)加热至 600k分解出碘单质。遇水迅速发生水解。
2PI3+3H2O=P2O3+3HI 3P2O3+3H2O=3H3PO3 该反应应用于氢碘酸的制备。
③反应罐应预热至150℃,否则反应太慢或不反应,导致黄磷大 量积聚,放料后遇空气即将引起燃烧。搅拌要有效,不得中断, 这样可使反应完全,防止黄磷积聚。即使如此,反应罐上仍应 装有防爆膜。 ④五硫化二磷在高温下极易自燃起火,从反应罐放入中间槽冷 却时,温度已超过300℃,必须通二氧化碳气体保护,以防自 燃。 ⑤黄磷计量罐有热水封住磷面,计量罐应有特殊设计,应使黄 磷放到一定高度时与反应管内磷面平衡;操作时也要注意,保 证放熔磷时水不进入反应管,以免五硫化二磷遇水分解,产生 大量硫化氢气体,使体积猛增而发生爆炸。硫化氢剧毒,易燃 易爆,如大量逸出后,燃烧爆炸的危险性更大。
磷及其化合物

四、磷酸盐
钾、钠、 铵盐均易溶于水。
溶解性:1、从阳离子来看,无论是酸式盐还是正盐,
2、从阴离子来看,磷酸二氢盐易溶,其余
难溶。如Ca(H2PO4)2、Ba(H2PO4)2易溶于水,
Ca3(PO4)2、Ba3(PO4)2、CaHPO4、BaHPO4
难溶与水。
Ca3(PO4)2+4H3PO4==3Ca(H2PO4)2
●
o
●
o o
●
●
6、三磷酸钠(Na5P3O10)是用Na2HPO4和NaH2PO4 溶液在623K左右反应制得。这一反应的化学方程式是 ____________。 三磷酸钠是三磷酸的钠盐,三磷酸可看作是三个磷酸 分子脱去两分子水而生成的。磷酸根离子的结构式为
O P O O O 3-
,若三磷酸根P3O105-中只有磷氧 键,它的结构可表示为________。
答案: 二元酸 H3PO3+I2+H2O====H3PO4+2HI 2H3PO3+AgNO3====Ag+2H3PO4+NO↑
作业
1、0.31g磷和一定量的Cl2反应后,磷全部转化为PClx。 把生成的PClx溶于水得500mL溶液。其中的氯元素全 部以Cl-形式存在。取10mL溶液加入足量的AgNO3溶 液,生成0.15g沉淀(溶液中其它成分不与AgNO3溶液 反应),试求x的值。
MnO2
MnO2
(1)因H+与OH-作用,使反应向右进行。
(2)因5Ca2++3PO43-+F-==Ca5(PO4)3F↓, 而防止龋齿。 (3)多进含Ca2+或PO43-的食品,可促进 牙齿矿化。
9、亚磷酸H3PO3是一种无色晶体,有大蒜气味和 强吸湿性。 (1)在亚磷酸溶液中加入过量的NaOH溶液,生 成的主要产物是Na2HPO3,这一事实说明亚磷酸 是几元酸。推断它的电离方程式和结构式。 (2)亚磷酸具有强还原性,当它与碘水混合后, 可以看到碘水的棕黄色褪去,经检验有磷酸生成, 写出有关方程式。 (3)在亚磷酸溶液中加入AgNO3溶液后,有黑 色沉淀生成和无色气体产生,试管口有红棕色气 体产生。写出有关方程式。
2020高中化学磷及其化合物
C、含氧酸及其盐的缩合
说明:
①、含氧酸缩合的必要条件:必须有羟基,才能脱水,否则,不能缩合。 比如,稀的HClO4不能缩合,因为质子完全解离。稀的H2SO4也不能缩合, 但是算式硫酸氢盐可缩合。 ②、酸越弱,越易缩合,缩合产物越多越稳定。
磷酸经强热时就发生脱水作用,生成焦磷酸、三磷酸等多磷酸或
五、磷的成键特征
1、离子型:P3-,第三周期,半径大,易变形,因此完全意 义上的离子化合物极少,且只能存在于干态,遇水水解。
2、共价型:由于磷的半径大,难以形成 p-p 键,但可形成 p-d 键。
3、形成配合物:主要作为配位原子,但 PF5 采用 sp3d 杂化, 有空的 d 轨道,易与 F- 结合形成 PF6-,sp3d2 杂化,后者配 位能力弱。
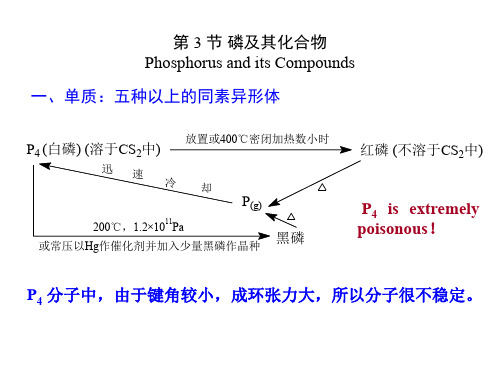
P4 分子中,由于键角较小,成环张力大,所以分子很不稳定。
1、磷单质的结构(P4)
白磷
分子晶体 熔点 44.15 ℃ 沸点 280.35 ℃ 密度 1.8g·cm-3
红磷
成对等边三角 形连成的链状 的巨大分子
黑磷
片层结构 网状结构 有导电性
许多磷的化合物结构与正四面体P4有关 ; 磷是亲氧元素,磷氧四面体PO4结构单元很稳定,许多 P(V)含氧化合物都是以磷氧四面体为结构基础的
2、单质与碱的作用 当单质中原子与原 子间是单键时,易 在碱溶液中发生歧 化反应。
特殊
二、氧化物:P2O3、 P2O5
P4O6
P4O10
P原子有空的3d轨道可以利用,故 P 与端基 O 之间可以形成 反馈键,p-d键,但与配位化合物中的方向正好相反。
三、含氧酸和含氧酸盐 1、PO43- 的结构:正四面体
第 3 节 磷及其化合物 Phosphorus and its Compounds
高三化学磷知识点总结

高三化学磷知识点总结磷是一种非金属元素,化学符号为P,原子序数为15。
它在生物体中扮演着至关重要的角色,同时也广泛用于工业制造和农业生产。
以下是关于高三化学磷知识点的总结。
一、磷的性质和常见化合物1. 磷的物理性质:磷是一种具有两种常见形态的元素:红磷和白磷。
红磷是暗红色的固体,具有难燃的性质。
白磷是黄白色或淡黄褐色的固体,具有可燃的性质。
2. 磷的化学性质:磷易与氧气反应,生成氧化磷。
红磷在空气中缓慢氧化,白磷在空气中燃烧,并生成白磷酸。
磷也能与其他元素形成多种化合物,如磷化氢、磷酸等。
3. 磷的常见化合物:a. 磷化氢(化学式:PH3):磷化氢是一种无色易燃气体,有刺激性的气味。
其用途广泛,如用作燃料、杀虫剂、还原剂等。
b. 磷酸(化学式:H3PO4):磷酸是一种无色透明的液体,具有强酸性。
它广泛应用于农业、食品工业和医药工业中,如做肥料、食品添加剂和制药原料等。
二、磷的化合物合成和应用1. 磷的制取:磷的主要制取方法有两种:从磷矿石中提取和通过化学反应合成。
磷矿石中的磷酸钙可以经过煅烧得到无水磷酸钙,再与煤焦反应制得磷酸钙。
另外,磷还通过化学反应合成磷化氢、磷酸和其他化合物。
2. 磷的应用:a. 农业方面:磷是植物必需的养分之一,被广泛用作农业肥料,在促进植物生长和提高农作物产量方面发挥着重要作用。
b. 工业方面:磷在化工和冶金行业中被广泛应用,用于制造肥料、农药、洗涤剂、清洁剂、火柴等。
此外,磷也是合成高能化合物(如三聚磷酸盐)的重要原料。
c. 医药方面:磷酸和磷酸盐是制药工业中的重要原料,广泛用于制造抗生素、酶、维生素等药物。
三、磷在生物体中的重要性1. 磷在DNA和RNA中的作用:磷是DNA和RNA的组成部分之一,它们是生物体内储存和传递遗传信息的分子。
磷的存在使得DNA和RNA能够稳定存在并编码生物的遗传信息。
2. 磷在能量代谢中的作用:磷是ATP(三磷酸腺苷)和ADP(二磷酸腺苷)的组成部分,这些物质在细胞中储存和释放能量。
磷 化学式

磷化学式磷,化学符号为P,原子序数为15,是元素周期表中的一种非金属元素。
磷在自然界中以磷酸盐的形式广泛存在,主要存在于磷酸盐矿石、骨骼和植物中。
磷是生物体中重要的元素之一,对生命活动起着重要的作用。
磷的化学式为P,表示磷元素的原子组成。
磷是第15族元素,原子结构中有5个价电子,因此磷可以形成多种化合价的化合物。
常见的磷化合物有磷酸盐、磷酸、亚磷酸、磷酸酯等。
磷酸盐是磷的一种重要化合物,由磷酸根离子(PO4)3-和金属离子组成。
磷酸盐广泛存在于自然界中,是构成生物体骨骼和牙齿的主要成分。
磷酸盐还是植物生长所需的营养物质之一,对植物的生长发育起着重要作用。
磷酸是磷氧化反应的产物之一,化学式为H3PO4。
磷酸是一种无色的液体,呈酸性,溶于水中,可以与金属反应产生相应的磷酸盐。
磷酸在工业生产中也有广泛的应用,用于制造肥料、洗涤剂、食品添加剂等。
磷酸还是制备其他磷化合物的重要原料。
亚磷酸是磷的氧化物之一,化学式为H3PO3。
亚磷酸是一种无色的液体,呈酸性,可以溶于水。
亚磷酸在化学工业中有一定的应用,可以用于制备农药、医药和染料等。
磷酸酯是磷酸与醇反应生成的产物,化学式为ROPO3H2,其中R 为有机基团。
磷酸酯是一类重要的有机磷化合物,在生物体中广泛存在,具有重要的生物活性。
磷酸酯在生物化学中发挥着重要的作用,参与到能量代谢、信号传递和遗传物质的合成等生命过程中。
除了上述常见的磷化合物外,磷还可以形成硫化物、氮化物等化合物。
磷化合物具有多样的化学性质和应用价值,在农业、医药、化工等领域有着广泛的应用。
磷化合物的研究和应用对于人类社会的发展和生活水平的提高起着重要的作用。
磷是一种重要的化学元素,具有丰富的化学性质和广泛的应用价值。
磷化合物是磷的重要衍生物,包括磷酸盐、磷酸、亚磷酸、磷酸酯等。
这些磷化合物在生物体中发挥着重要的作用,对生命活动具有重要的影响。
磷化合物的研究和应用对于人类社会的发展和进步具有重要意义。
磷及其化合物

磷的卤化物
三氯化磷,分子式:PCl3。一种无色透明液体,沸点 76℃,在潮湿空气中能水解成亚磷酸和氯化氢,发生 白烟而变质,须密封贮藏。 PCl3 + 3H2O → H3PO3 + 3 HCl 遇乙醇和水起水解反应, 遇氧能生成三氯氧磷。 2PCl3 + O2 → 2 POCl3 在水存在下,可与甲醇反应生成亚磷酸二甲酯。 反应分两步进行: 1.PCl3 + 3H2O → H3PO3 + 3HCl 2.H3PO3 + 2CH3OH → HOP(OCH3)2 + 2H2O 总反应为 PCl3 + 2CH3OH + H2O → HOP(OCH3)2 + 3HCl
磷的含氧酸
磷的含氧酸
磷酸(英语:phosphoric acid)或称为正磷酸 (orthophosphoric acid),化学式H3PO4,是 一种常见的无机酸,不易挥发,不易分解,几乎 没有氧化性。具有酸的通性,是三元中强酸,其 酸性比盐酸、硫酸、硝酸弱,但比醋酸、硼酸等 强。由五氧化二磷溶于热水中即可得到。正磷酸 工业上用硫酸处理磷灰石即得。用硝酸使磷氧化, 可以得到较纯的磷酸;一般是83%-98%的稠厚 溶液,如果再浓缩,可以得到无色晶体。磷酸在 空气中容易潮解;加热会逐渐失水得到焦磷酸, 进一步失水得到偏磷酸。磷酸容易自行结合成多 种化合物如焦磷酸(pyrophosphoric acid)或三 聚磷酸(triphosphoric acid)等。
磷的卤化物
五氯化磷(化学式:PCl5)是一种无机化 合物。它是最重要的磷氯化物之一,其它的 还有三氯化磷和三氯氧磷。它是一种无色、 具有吸湿性的固体,主要用作氯化剂,在不 同条件下可有不同的结构。 固态时五氯化磷的结构氯化铯型晶体结构, 两个离子分别为四面体和八面体结构,阳离 子中的磷原子为sp3杂化,阴离子中的磷为 sp3d2杂化。气态和液态的五氯化磷为单分 子结构,分子呈三角双锥形。
常见含磷元素的化合物

常见含磷元素的化合物含磷元素的化合物,听上去是不是有点生涩?这个话题一点也不无聊,咱们可以轻松聊聊。
磷这个家伙,在化学界可是个大明星,虽然它在自然界中并不常见,但它的角色可大了!要说含磷化合物,最常见的就是磷酸盐了。
嘿,想想那些可口的薯片,知道为什么那么美味吗?因为里面可能就有磷酸盐,这玩意儿不仅能调味,还能让食品更持久。
除了磷酸盐,咱们还得提提三聚氰胺磷酸盐。
乍一听,感觉像是某种魔法药水。
它常常被用作阻燃剂,能让材料在高温下保持稳定。
就好像给你的手机穿上了一层隐形的铠甲,保护它不受伤害。
想象一下,买了个新手机,结果没几天就被意外摔坏,那心情,简直像被五雷轰顶。
可是,三聚氰胺磷酸盐的存在,就像是个贴心的小伙伴,时刻守护着你的爱机。
再说说DNA中的磷酸,嘿,生物界的奥秘就在这里。
磷酸是DNA结构中不可或缺的一部分,简直就是生命的基石。
没有它,咱们也就不存在了,想想多神奇!就像咱们生活中的每一个人,都是家庭的支柱,缺了谁都不行。
磷酸和糖分子相结合,形成了DNA的“骨架”,这就好比是搭积木,没有坚固的底座,哪儿能搭得高呢?再往下聊,咱们不得不提到农药中的含磷化合物,像是草甘膦。
对农民朋友来说,这可是致富的法宝,能够有效防治各种害虫。
试想一下,田里长满了杂草,连根都看不到,农民心里那种着急,恨不得把天都掀了。
草甘膦一喷,杂草就乖乖退场,农田又焕发生机。
可是,使用这些化合物的时候,也得小心翼翼,过量了可不是什么好事,就像贪吃零食,一不小心就要吃成小胖子。
有趣的是,磷在地球上的存在状态也很特别。
它在土壤中以磷酸盐的形式存在,这可是植物生长的重要营养元素。
缺少了磷,植物就像没了灵魂,叶子发黄、果实干瘪。
农民们都知道,给土壤添加磷肥,就能让庄稼茁壮成长,收成大丰收,想想那金黄的麦田,真是让人心里乐开花。
再来聊聊磷化合物在工业上的应用。
比如说,清洁剂中的磷酸盐,能够有效去除水垢、油污,洗得干干净净。
每次洗碗的时候,看到那闪闪发亮的盘子,心里是不是都觉得特别有成就感?很多洗衣粉中也添加了磷酸盐,能让衣服更加洁白如新,穿上身的那一刻,心里乐滋滋的。
有机磷化物
C3H7
CH3
4. 膦的制备: 实验室常用PCl3来合成。
1) 格氏反应:
Et2O PCl3 + 3 C6H5MgBr
(C6H5)3P + 3 MgClBr
若控制反应物的摩尔数, 可得到苯基亚膦酰氯:
MgBr + PCl3
PCl2
PCl2 H2O OH-
P(OH)2 HNO3
O P(OH)2
(C6H5)3P+ CH3Br-
溴化甲基三苯磷
而(C6H5)3N则不会发生上述反应。
溴化甲基三苯磷对热、水解等稳定,但遇强碱易失a-H:
(C6H5)3P+ CH3Br- C6H5Li
(C6H5)3P CH2 + C6H5 + LiBr
亚甲基膦烷
亚甲基膦烷又称叶立德. 是黄色结晶,对水和空气敏感,加热 分解。是德国科学家维蒂希(Witting)发现, 并应用于有机合成。
苯基亚膦酸
苯膦酸
2) F-C反应: 由苯与三卤化磷在AlCl3催化下反应。
+ PCl3 AlCl3
PCl2
苯亚膦酰氯可以分步引入不同的烃基:
PCl2 1) C2H5MgBr 2) CH3MgBr
P C2H5 CH3
5. 重要的化学反应 通过对膦的结构分析可知, 膦应具有以下两个特性:
(1) 具有强的亲核性(孤电子对); (2) 倾向于转化五价膦(3d0).
R
磷酸
膦酸
次膦酸
OR RO P O
OR
磷酸酯
OR RPO
OR
膦酸酯
OR RPO
R
次膦酸酯
2. 命名: 目前尚无统一命名法。 1) 膦、膦酸、亚膦酸及膦酸的命名:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③磷酸比硝酸稳定,不易分解 。
制法:高纯度磷酸制法: 4P(白磷) + 5O2 =点=燃 2P2O5
P2O5 + 3H2O热=水= 2H3PO4 工业制法:Ca3(PO4)2 + 3H2SO4 =△= 2H3PO4 + 3CaSO4↓
3、磷酸盐
(1)种类:一种正盐 、两种酸式盐 (三种)
(2)转化关系:
+ OH-
+ OH-
H3PO4 + H+
H2PO4- + H+
(3)三种盐的溶解规律:
HPO42-
+ OH- + H+ PO43-
① 除K+ 、Na+ 、NH4+ 外, 其余的正盐和一氢盐均不溶于水。 ② 所有的二氢盐均易溶于水。
(4)常见的磷肥:①普钙 (过磷酸钙) ②重钙 (重过磷酸钙)
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4 ( 普钙 ) Ca3(PO4)2 + 2H3PO4 = 3Ca(H2PO4)2 ( 重钙 )
注意: 普钙和重钙在施用时不可与碱性物质混用
H2PO4- + 2OH- = PO43- + 2H2O
五、磷的化合物
1、五氧化二磷(P2O5) 物性:白色固体 ,有强烈的吸水性 、脱水性,作干燥剂。 化性:P2O5 + H2O(冷水) = 2HPO3 (剧毒)
P2O5 + 3H2O(热水)= 2H3PO4(无毒) 2、磷酸(H3PO4) 物性:无色透明晶体,有吸湿性,与水以任意比互溶。
化性:①是一种三元中强酸 (电离不完全 )
一、磷的存在
1 、磷有两种同素异形体: 白磷和红磷 2 、自然界中磷的存在: 化合态;主要以Ca3(PO4)2存在于磷矿石中 原因: ①磷在空气中易被氧化
②磷单质比N2活泼
二、磷的分子结构
白磷的分子结构:P4 (正四面体,键角为60°) 红磷的分子结构复杂(不作要求)
60°
109°28′
三、白磷、红磷的物理性质
加热到416℃ ( 升华后冷却 )
四、磷的化学性质
两种磷在。
O2 P2O3 P2O5
H3PO3(二元酸) 冷水 HPO3 (剧毒) 热水 H3PO4(无毒)
P + Cl2 PCl3(液体) 白色烟雾
PCl5 (固体)
HNO3 H3PO4 + NO2↑+ H2O
色、态
白磷
白色蜡状
红磷
红棕色粉末
溶解性 不溶于水,溶于CS2
毒性
剧毒
着火点 40℃ , 易自燃
不溶于水和CS2 无毒 240℃
保存 密封,保存于冷水中 密封,防止吸湿
用途
制高纯度磷酸
制安全火柴、火药
分子结构 相互转化
P4 正四面体 键角60° 结构复杂 (不作要求)
白磷 隔绝空气加热到260℃ 红磷
