6.2.1盐的分类
各种PH值磷酸盐缓冲液配制

各种PH值的磷酸盐缓冲液配制2014-06-27 10:33:48 来源:生物秀知道浏览次数:24342磷酸盐取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。
磷酸盐(pH2.0)甲液:取磷酸16.6ml,加水至1000ml,摇匀。
乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。
取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。
磷酸盐缓冲液(pH2.5)取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。
磷酸盐缓冲液(pH5.0)取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。
磷酸盐缓冲液(pH5.8)取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。
磷酸盐缓冲液(pH6.5)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH6.6)取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。
磷酸盐缓冲液(含胰酶)(pH6.8)取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。
磷酸盐缓冲液(pH6.8)取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
磷酸盐缓冲液(pH7.0)取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。
磷酸盐缓冲液(pH7.2)取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。
磷酸盐缓冲液(pH7.3)取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶解成1000ml,调节pH值至7.3,即得。
6.2.1 盐的分类和性质(3)

6.2.1 盐的分类和性质(3)【前知回顾】1分子是保持物质的一种微粒,原子是中的最小微粒。
2.从分子、原子的角度认识化学反应是化学研究的基本方法,如图是某密闭容器中物质变化过程的微观示意图(“●”表示氧原子,“○”表示氢原子):A B C请回答:①图A中的物质是:____________(填“混合物”或“单质”或“化合物”);②变化Ⅰ的过程中,没有发生变化的最小微粒是____________(填微粒名称);③下列关于变化Ⅱ的说法中,正确的是____________(填写序号);A.分子的化学性质没有改变B.分子变小了C.分子间的距离变小了D.分子的种类发生了改变④从变化Ⅱ的微观过程可分析出,该变化过程属于____________变化。
【新知检测】3~6题为单项选择题,每题只有1个正确选项3.属于盐的是()A.H2SO4B.CaCO3C.NaOHD.MgO4.水溶液呈碱性且遇酸有气泡的物质是()A.碳酸钙B.氢氧化钠C.碳酸钠D.氯化钠5.能用稀硫酸一次性鉴别的一组是()A. NaCl、Na2SO4、BaCl2B.C、CuO、FeC.Na2CO3、K2CO3、NaClD.BaCl2、Ba(NO3)2、Na2CO36.现有碳酸钾、碳酸钙、硫酸铜三种白色的固体粉末,用最经济、简便、现象明显的方法鉴别,应选用试剂中的()A.蒸馏水B.紫色石蕊试液C.稀盐酸D.烧碱溶液7.分离CaCl2、KCl的固体混合物,可选用的一组试剂是()A.水、硝酸银、盐酸B.水、碳酸钠、盐酸C.水、碳酸钾、硫酸D.水、碳酸钾、盐酸8~9题为不定项选择题,每题有1-2个正确选项8.鉴别盐酸和硫酸,可加入下列试剂中的()A.氯化钡溶液B.硝酸银溶液C.碳酸钠溶液D.石蕊试剂9.向无色溶液中滴入氯化钡溶液后,有白色沉淀生成,则该溶液可能是()A.硝酸银B.硫酸钠C.氯化钠D.硝酸钙10.物质的性质决定其用途。
有关物质的用途正确的是()A.烧碱用于治疗胃酸过多B.食盐水用于清洗伤口C.氯气用作水的消毒剂D.氦气用作火箭燃料11.向稀盐酸中滴加硝酸银溶液,看到的现象是__________________,反应的化学方程式是___________________________。
常见的盐

农业
生活 交通 人的生理活动
(3)氯化钠的存在: 氯化钠在自然界中分布很广,如:海水、盐湖、盐井和盐矿 中蕴藏着丰富的氯化钠。
讨论:1、如何从海水中提取氯化钠呢?
将海水蒸发,除去其中的水分就可以得到粗盐。 2、粗盐中含常有泥沙等不溶性杂质,如何除去?也常含有 氯化镁、氯化钙等可溶性杂质又该如何除去? 向盐溶液中先加入足量的氢氧化钠溶液,以除去其中的镁离 子。再加足量的纯碱溶液以除去其中的钙离子,最后加入适 量的盐酸溶液,以除去其中的氢氧化钠溶液和纯碱溶液。 3、如何确定盐酸的量是适量的?
Cl-
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 不
SO42-
溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 溶 溶 微
CO32-
溶、挥 溶 溶 溶 不 不 微 一 不 不 不 一 不 不
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
碳酸钠 氢氧化钙三种无色溶液,这种试剂是_____。
2、复分解反应的条件: NaOH+HCl=NaCl+H2O CaCO3+2HCl=CaCL2+H2O+CO2↑
Ca(OH)2+Na2CO3=CaCO3↓+H2O
有水生成 复分解反应的条件: 或有气体生成 生成物中必须有 或有沉淀生成 复分解反应有以下几种:
(1)品尝味道,有碱味的是酱油,有酸味的是黑醋。
(2)各取少量,分别向其中加入少量纯碱(或小苏打)粉末, 冒气泡的是黑醋,无气泡产生的是酱油。
(3)在两个玻璃杯中分别放入废旧电池的锌皮两小片或擦去 氧化膜后的铝导线两小段,再分别倒入特测液少许,有气泡产 生的原溶液是黑醋,无现象的原溶液是酱油。
6.2盐的分类

SO4
CaSO4 Na2SO4 K2SO4 (NH4)2SO4
NO3
Ca(NO3)2 NaNO3 KNO3 NH4NO3
CO3
CaCO3 Na2CO3 K2CO3 (NH4)2CO3
HCO3
Ca(HCO3)2 NaHCO3 KHCO3 NH4HCO3
NH4
前四列盐的化学式在酸根组成上与第五列有什么不同?
新课讲授
四、焰色反应
金属或它们的化合物在灼烧时,使火焰呈特殊的颜 色,在化学上叫做焰色反应。
新课讲授
钠元素焰色反应的颜色: 黄色
钾元素焰色反应的颜色: (透过蓝色钴玻璃)
紫色
[巩固性练习四]:
总结
完成诊断性练习
布置作业
新课讲授
二、盐的分类 1、按酸根部分是否有氢元素可分为: 酸根无氢元素 正盐
酸根有氢元素
酸式盐
[形成性练习二]:
Cl Ca Na K NH4
CaCl2 NaCl KCl NH4Cl
SO4
CaSO4 Na2SO4 K2SO4 (NH4)2SO4
NO3
Ca(NO3)2 NaNO3 KNO3 NH4NO3
[形成性练习一]:
1、CuSO4 和 Na2CO3是否属于盐? 2、那么CuSO4 · 2O和 Na2CO3· 2O 5H 10H 是否属于盐?分析判断
新课讲授
2、硫酸铜晶体CuSO4 · 2O和碳酸钠晶体 5H
Na2CO3· 2O是含有结晶水的盐。 10H
[巩固性练习一 ]
答案交流
Cl
Ca Na K
表格一中第一横行的盐在组成上有什么共同点?
新课讲授
3、按正价部分不同可分为: (初中阶段常见) 钠盐 钾盐 钙盐 铵盐 例如:NaCl 例如:KNO3 例如:CaCO3 例如:NH4NO3
盐 -九年级第二学期化学知识精讲

6.2(1) 盐知识精讲一说起“盐”,大家往往首先想到的是家里的食盐。
其实食盐只是盐类物质的一种,我们化学上所讲的盐是指组成里含有金属离子和酸根离子的化合物。
【课前复习】※会做了,学习新课有保障1.根据氯化钠的溶解度曲线,可以看出氯化钠的溶解度变化有何特点?2.将难溶于液体的固体与液体分离可采用__________的操作,在该操作中要注意一__________,二__________,三__________。
3.金属和盐的反应需要哪些条件?属于哪种反应类型?4.实验室制二氧化碳的原料是__________和__________,反应原理是_________________________________________________________________________ __________________。
答案:1.氯化钠的溶解度曲线比较平缓,说明氯化钠的溶解度受温度影响变化不大。
2.过滤;贴;低;靠。
3.金属和盐的反应需要两个条件才能发生,一是盐必须可溶,能配成溶液;二是金属的活动性必须比盐中金属元素的活动性强,即在金属活动顺序表中,排在前面的金属才能置换排在它后面的金属,金属和盐的反应属于置换反应。
4.原料是大理石(或石灰石)和稀盐酸,反应原理为CaCO3+2HCl CaCl2+H2O+CO2↑。
※先看书,再来做一做1.举例说明氯化钠的重要用途。
2.粗盐提纯的过程可分为哪几步?3.复分解反应是指_____________________________________________________。
4.复分解反应的发生条件是_____________________________________________。
【学习目标】1.了解氯化钠、碳酸钠、碳酸氢钠和碳酸钙等盐在生活生产中的广泛用途。
2.掌握复分解反应发生的条件,会判断两物质间能否发生复分解反应。
3.了解碳酸盐的一般性质,即能与盐酸反应放出二氧化碳气体。
火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的测定

火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的测定
6.1分析步骤
按4.2.1步骤进行,用盐酸选择溶解法分别测定水泥和掺入水泥的火山灰质混合材料或粉煤灰中的不溶渣的含量。
6.2结果的计算
6.2.1盐酸选择溶解后不溶渣含量的计算
盐酸选择溶解后火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥的不溶渣含量(R11)掺入水泥的火山灰质混合材料或粉煤灰中的不溶渣的含量(R2)以及硅酸盐水泥(P·I )中不溶渣的含量(R3)均按式(3)计算。
6.2.2火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的计算
火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中火山灰质或粉煤灰组分含量的计算 P 10001.1201.111⨯--=R R --------------------------------(23)
式中:
P —火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中火山灰质混合材料或粉煤灰组分的质量百分数,%;
R2——盐酸溶液选择溶解后火山灰质混合材料或粉煤灰组分的质量百分数,%;
1.07——校正系数。
6.3火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中石膏组分含量的测定
火山灰质硅酸盐水泥或粉煤灰硅酸盐水泥中组分含量的测定按第一章进行。
食用盐国家标准GB5462000
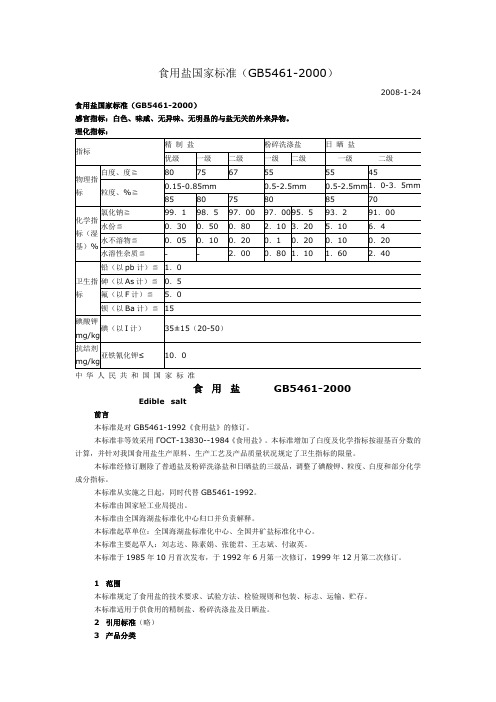
食用盐国家标准(GB5461-2000)2008-1-24 食用盐国家标准(GB5461-2000)感官指标:白色、味咸、无异味、无明显的与盐无关的外来异物。
理化指标:中华人民共和国国家标准食用盐GB5461-2000Edible salt前言本标准是对GB5461-1992《食用盐》的修订。
本标准非等效采用ΓOCT-13830--1984《食用盐》。
本标准增加了白度及化学指标按湿基百分数的计算,并针对我国食用盐生产原料、生产工艺及产品质量状况规定了卫生指标的限量。
本标准经修订删除了普通盐及粉碎洗涤盐和日晒盐的三级品,调整了碘酸钾、粒度、白度和部分化学成分指标。
本标准从实施之日起,同时代替GB5461-1992。
本标准由国家轻工业局提出。
本标准由全国海湖盐标准化中心归口并负责解释。
本标准起草单位:全国海湖盐标准化中心、全国井矿盐标准化中心。
本标准主要起草人:刘志达、陈素娟、张能君、王志斌、付淑英。
本标准于1985年10月首次发布,于1992年6月第一次修订,1999年12月第二次修订。
1 范围本标准规定了食用盐的技术要求、试验方法、检验规则和包装、标志、运输、贮存。
本标准适用于供食用的精制盐、粉碎洗涤盐及日晒盐。
2 引用标准(略)3 产品分类食用盐为晶体氯化钠,用于食用。
食用盐按其生产和加工方法可分为:精制盐、粉碎洗涤盐、日晒盐。
按其等级可分为:优级、一级、二级。
分子式:NaC1分子量:58.444 技术要求4.1 感官指标:白色、味咸、无异味、无明显的与盐无关的外来异物。
4.2 理化指标应符合表一规定:5 试验方法本方法所用试剂和水,在没有注明其他要求时,均指分析纯试剂和GB/T6682中规定的三级水。
试验中所需要标准溶液、杂质标准溶液、制剂和制品,在没有注明其他要求时,均按GB/T601、GB/T602、GB/T603之规定。
5.1 粒度的测定按GB/T13025.1规定执行5.2 白度的测定按GB/T13025.2规定执行5.3 水分含量的测定按GB/T13025.3规定执行5.4 水不溶物含量的测定按GB/T13025.4规定执行5.5 氯离子含量的测定按GB/T13025.5规定执行5.6 钙离子含量的测定按GB/T13025.6规定执行5.7 镁离子含量的测定按GB/T13025.6规定执行5.8 硫酸根离子含量的测定按GB/T13025.8规定执行5.9 碘离子含量的测定按GB/T13025.7规定执行5.10 铅离子限量的测定按GB/T13025.9规定执行5.11 砷离子限量的测定按GB/T13025.13规定执行5.12 钡离子限量的测定按GB/T13025.12规定执行5.13 氟离子限量的测定按GB/T13025.11规定执行5.14 亚铁氰化钾限量的测定按GB/T13025.10规定执行5.15 氯化钠及水溶性杂质成分的计算和检验结果的检查由上述各项检验结果得出食用盐样品所含单项离子的百份含量,然后按表2中所注顺序号计算化合物成分。
6.2(1)盐的组成和命名 食盐

4、化学性质 、 不能使指示剂变色, 不能使指示剂变色,呈中性 NaCl + AgNO3→ AgCl↓+NaNO3
检验盐酸盐的方法
滴加硝酸银溶液和稀硝 白色沉淀不消失。 酸,白色沉淀不消失。
下列盐可以统称为什么盐? 下列盐可以统称为什么盐?
钠盐
NaCl Na2SO4 NaNO3 Na2CO3
硫酸盐
K2SO4 Na2SO4 BaSO4 CuSO4
思考与讨论:H2CO3 思考与讨论 Na2CO3 Na被 取代 正盐 中的氢全部被Na取代 取代---正盐 正盐的酸根不含氢 H2CO3中的氢部分被 取代,碳酸 中的氢部分被Na取代 取代, 失去部分氢原子而形成的---酸式盐 失去部分氢原子而形成的 酸式盐 • 酸式盐的酸根含氢 • 碱式盐:Cu2(OH)2CO3 碱式盐: )
判断以下方程式是否正确
CuSO4 + 2NaOH→ Cu(OH)2 ↓ + Na2SO4 BaCO3 + Ca(OH)2→ CaCO3↓ + Ba(OH)2 难溶 可溶性的盐和碱才可能发生反应
二、盐的溶解性
盐:K、Na、 NH4、 NO3盐全溶 、 、 盐酸盐除AgCl不溶,其余全溶 不溶, 盐酸盐除 不溶 硫酸盐除BaSO4不溶,CaSO4、 不溶, 硫酸盐除 Ag2SO4 微溶,其余全溶 微溶, 碳酸盐K、 碳酸盐 、Na 、NH4、溶,其余不 溶
判断以下物质的溶解性
Ba(NO3)2 NH4Cl BaSO4 AgCl Ba(OH)2 Ag2CO3 Na2SO4
三、氯化钠
1、化学式:NaCl 、化学式: 俗名: 俗名:食盐 2、用途:人体中维持正常的生理功 、用途: 杀菌,制氢气、氯气、 能,杀菌,制氢气、氯气、 氢氧化钠、 氢氧化钠、纯碱
食品中EDTA盐的测定(食品安全国家标准)

食品安全国家标准食品中乙二胺四乙酸盐的测定1 范围本标准规定了固相萃取柱净化、液相色谱法测定食品中乙二胺四乙酸盐含量。
本标准适用于果酱、果脯、腌渍的蔬菜罐头、除番茄沙司外的蔬菜泥(酱)、坚果与籽类罐头、八宝粥罐头、复合调味料、饮料中乙二胺四乙酸二钠和复合调味料中乙二胺四乙酸二钠钙的测定。
2 原理试样用水提取,提取液加入三氯化铁衍生,经混合型阴离子(PXA)固相萃取柱净化,液相色谱检测,外标法定量。
复合调味料测出乙二胺四乙酸盐的三氯化铁衍生物总量后,不加三氯化铁测定乙二胺四乙酸二钠钙含量,根据两者结果确定乙二胺四乙酸二钠的含量。
3 试剂和材料注:除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682-2008规定的三级水。
3.1试剂3.1.1甲醇:色谱纯。
3.1.2盐酸:纯度36%~38%。
3.1.3磷酸:纯度不小于85%。
3.1.4甲酸:纯度不小于98%。
3.1.5四丁基溴化铵:纯度不小于99%。
3.1.6乙酸钠:纯度不小于99%。
3.1.7三氯化铁:纯度不小于99%。
3.2 试剂配制3.2.1三氯化铁溶液:称取0.54 g三氯化铁(3.1.7),溶于90 mL水中,加入0.10 mL盐酸(3.1.2),转移到100 mL容量瓶中,用水定容至刻度,混匀。
3.2.2 5%甲酸甲醇水溶液溶液:取5mL甲酸、20mL甲醇用水定容至100mL。
3.2.3四丁基溴化铵-乙酸钠混合溶液:称取6.45 g四丁基溴化铵(3.1.5)、2.46 g乙酸钠(3.1.6),加1000 mL水超声溶解,加入磷酸调节pH至4.0。
3.3 标准品3.3.1乙二胺四乙酸二钠(C10H14N2O8Na2·2H2O)标准品:CAS登录号6381-92-6,纯度不小于99%。
3.3.2乙二胺四乙酸二钠钙(C10H14N2O8Na2Ca)标准品:CAS登录号62-33-9,纯度不小于99%。
3.4 标准溶液配制3.4.1乙二胺四乙酸二钠标准溶液:准确称取适量的乙二胺四乙酸二钠(3.3.1)标准品,用水溶解并定容至100 mL棕色容量瓶中,得浓度为10 mg/ mL的标准储备溶液,此溶液转移至储液瓶中4 ℃下储存。
1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐质量规范-2023最新

1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐质量规范1范围本文件规定了1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐质量规范的要求、试验方法、检验规则、标志、包装、运输、贮存和保质期。
本文件适用于1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐的生产、检验、采购活动。
分子式:C8H17N3·HCl相对分子量:191.70(按2019年国际相对原子质量)结构式:2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T191包装储运图示标志GB/T601化学试剂标准滴定溶液的制备GB/T603化学试剂试验方法中所用制剂及制品的制备GB/T6679固体化工产品采样通则GB/T6682—2008分析实验室用水规格和试验方法GB/T8170数值修约规则与极限数值的表示和判定JJF1070定量包装商品净含量计量检验规则JJG701熔点测定仪检定规程《定量包装商品计量监督管理办法》国家质量监督检验检疫总局令第75号(2005)3术语和定义本文件没有需要界定的术语和定义。
4要求4.1感官要求感官要求应符合表1的规定。
表1感官要求项目要求性状结晶或结晶性粉末色泽白色杂质无肉眼可见外来杂质4.2理化指标理化指标应符合表2的规定。
表2理化指标项目指标水分/%≤0.5熔点/℃108~114炽灼残渣/%≤0.1含量/%98.0~102.04.3净含量应符合国家质量监督检验检疫总局第75号令《定量包装商品计量监督管理办法》的规定。
5试验方法5.1一般规定除非另有说明,仅使用确认为分析纯的试剂和符合GB/T6682—2008规定的三级水。
试验中所用标准滴定溶液、制剂及制品,在没有注明其他要求时,均按GB/T601和GB/T603的规定制备与标定。
5.2感官要求将供试品平铺于无色透明的PE袋内,置于白色A4纸或其他白色背景上,在光线充足的环境下,从上至下目测检验。
食品添加剂ε-聚赖氨酸盐酸盐标准

食品添加剂ε-聚赖氨酸盐酸盐1 范围本标准规定了食品添加剂ε-聚赖氨酸盐酸盐的基本要求、技术要求、检验方法、检验规则、标志、包装、贮存和运输以及质量承诺。
本标准适用于以葡萄糖、酵母抽提物为主要原料,由淀粉酶产色链霉菌(Streptomyces diastatochromogenes)受控发酵后经分离提纯所制得的食品添加剂ε-聚赖氨酸盐酸盐。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191 包装储运图示标志GB/T 601 化学试剂标准滴定溶液的制备GB/T 602 化学试剂杂质测定用标准溶液的制备GB/T 603 化学试剂试验方法中所用制剂及制品的制备GB 4789.2 食品安全国家标准食品微生物学检验菌落总数测定GB 4806 食品安全国家标准(所有部分)GB 5009.3—2016 食品安全国家标准食品中水分的测定GB 5009.4 食品安全国家标准食品中灰分的测定GB 5009.11 食品安全国家标准食品中总砷及无机砷的测定GB 5009.12 食品安全国家标准食品中铅的测定GB/T 6682—2008 分析实验室用水规格和试验方法GB/T 9724 化学试剂pH值测定通则GB/T 20880 食用葡萄糖GB/T 23530—2009 酵母抽提物GB 29924 食品安全国家标准食品添加剂标识通则JJF 1070 定量包装商品净含量计量检验规则定量包装商品计量监督管理办法(国家质量监督检验检疫总局令第75号)3 分子式、结构式和相对分子质量3.1 分子式C6H14N2O Cl [C6H12N2O•HCl]n C6H14N2O2Cl,n为23~33。
3.2 结构式T/ZZB 1625—202023.3 相对分子质量4133.8-5780.2 Da(按2016年国际相对原子质量)。
《金属热处理生产过程安全卫生要求》编制说明

(3)删除6.1.4。(修改理由:不宜实施。)
——6.2剩余物料
删除6.2.1中的氰盐、钡盐。(修改理由:有剧毒,不宜采用。)
因新标准5.2.2的内容包括了工作场地空气中的有害物质的最高容许浓度,所以删除6.2.2和表6的内容。
——7.2 燃料炉
(1)将原标准中“7.2煤气炉和重油炉”,改为“7.2 燃料炉”。
(2)将“7.2.1”内容改为:“ 燃料管道应设总阀门,每台设备上应设分阀门” 。
(3)原标准7.2.3中的内容是关于噪音、气体排放和气体混合均匀性的要求,与“第7章生产装置”要求的关联度不大,所以将其删除。
⑵ 对引用标准进行了重新排序:标准号由小到大排列.
6.2 热处理生产中的危险、有害因素
⑴ 表1 的修改:
在“毒性物质”中增加了“甲苯、二甲苯、甲酰胺、三乙醇胺”;
将“高压电”中的“高频设备和中频设备”改为“感应设备”;
将“炽热物体及腐蚀性物质”中“1高温炉”改为“1加热炉”,将“4 激光束”改为“4激光束、电子束、等离子束、电弧、火焰;
⑶ 将5.1.3的内容改为:“5.1.3 地面强度应满足生产组织、物料储运等的承载要求,地面材料应满足耐热、耐蚀、耐冲击等要求。”(修改理由:原标准中所述地面强度参数在实际中检测困难,实用性差。)
⑷ 将原标准中“5.1.4 厂房要有足够的高度,并合理设置天窗。”改为“5.1.4 厂房要有足够的高度,
热处理厂房建设和作业环境;
生产物料和剩余物料;
生产装置;
热处理工艺作业;
安全、卫生防护技术措施以及管理措施等。
真空制盐概述

7、包装、标志、运输、贮存 7.1食用盐的大包装必须使用内衬聚乙烯膜的纸箱,编织袋、每件重 量为25kg或50kg。包装应附合格证,或合格标签、并注明:生产企 业名称、地址、产品名称、数量、批号、检验员姓名,<代号>。 7.2食用盐小包装,可使用聚苯乙烯塑料袋、纸盒、塑料瓶,每件重 1000g、500g、250g或250g以下,小包装上必须标清GB7718规定的 要素,贴有加碘盐防伪标志。 7.3食用盐运输工具必须清洁、干燥、运输途中器具捆扎牢固,确保 完好无损。禁止与能导致盐质污染的货物混装。由于运输造成破损和 质量下降,应由有关责任方负责。 7.4食用盐贮存中应妥善保管,存方仓库要通风,防止雨淋,受潮, 堆放的食用盐上有遮蔽,下有隔板。禁止与能导致盐污染的货物共贮。
指标 白度,度≧
精制盐 优级 80 一级 75 二级 67
粉碎洗涤盐 一级 55 0.5~2.5 mm 75 97.00 0.80 0.20 2.00 97.00 2.10 0.10 0.80 80 95.50 3.20 0.20 1.10 1.0 0.5 5.0 15.0 35±15(20~50) 10.0 二级 一级 55
日晒盐 二级 45 1.0~3.5 mm 70 91.00 6.40 0.20 2.40
物理指标
粒度,% ≧ 85 氯化钠 ≧ ≦ ≦ ≦ ≦ ≦ ≦
0.15~0.85 mm 80 98.50 0.50 0.10 —
0.5~2.5 mm 85 93.20 5.10 0.10 1.60
99.10 0.30 0.05 —
化学指标指标 (湿基)%
水分 水不溶物 水溶性杂质 铅(以Pb计)
卫生指标
砷(以As计) 氟(以F计)
6.2.1盐的分类

所有含有钠元素的盐统称为钠盐 例如:KCl 可以称为钾盐 又可成为盐酸盐
K2CO3 可以成为钾盐 又可成为碳酸盐 所有含有钾元素的盐统称为钾盐
练习:
盐酸盐 碳酸盐 硝酸盐 硫酸盐
钠盐
钾盐
铵盐
NaCl
KCl
NH4Cl
6.2.1 盐及分类
一、盐的定义
1、由金属元素(或铵根)和酸根组成的化合物
例如:NaCl Na2CO3 Mg(NO3)2
2、盐是酸碱中和反应的产物
HCl+NaOH
NaCl+H2O
NH4Cl
3、盐可以看成酸中的氢被金属元素取代后的产物
HCl——NaCl MgCl2
H2SO4——Na2SO4 MgSO4
实验:碳酸钠溶液、碳酸钾溶液、氯化钾溶液的 焰色反应
资料库:几种焰色反应的颜色
金属元 钠
钾
钙
铜
素
颜色 黄
紫
砖红 绿
如:NaCl Na2SO4 Na2CO3 NH4Cl 等 (2)酸中的部分氢被金属取代的盐称为酸式盐
如:NaHSO4
NaHCO3 NH4HCO3等
一元酸有酸式盐吗?为什么?
(3)碱式盐 Cu2(OH)2CO3等
4、根据盐的组成中是否含有氧元素,可以 分为含氧酸盐和无氧酸盐
如: Na2SO4 Na2CO3 NaHCO3等
NaCl KCl NH4Cl等
试试:读出这些盐的名称
三、盐的命名
无氧酸盐称为:从右向左读做:某化某
如: NaCl KCl NH4Cl 氯化钠 氯化钾 氯化铵
含氧酸盐称为:从右向左读做:某酸某
食用盐国家标准GB5462000

食用盐国家标准(GB5461-2000)2008-1-24 食用盐国家标准(GB5461-2000)感官指标:白色、味咸、无异味、无明显的与盐无关的外来异物。
理化指标:中华人民共和国国家标准食用盐GB5461-2000Edible salt前言本标准是对GB5461-1992《食用盐》的修订。
本标准非等效采用ΓOCT-13830--1984《食用盐》。
本标准增加了白度及化学指标按湿基百分数的计算,并针对我国食用盐生产原料、生产工艺及产品质量状况规定了卫生指标的限量。
本标准经修订删除了普通盐及粉碎洗涤盐和日晒盐的三级品,调整了碘酸钾、粒度、白度和部分化学成分指标。
本标准从实施之日起,同时代替GB5461-1992。
本标准由国家轻工业局提出。
本标准由全国海湖盐标准化中心归口并负责解释。
本标准起草单位:全国海湖盐标准化中心、全国井矿盐标准化中心。
本标准主要起草人:刘志达、陈素娟、张能君、王志斌、付淑英。
本标准于1985年10月首次发布,于1992年6月第一次修订,1999年12月第二次修订。
1 范围本标准规定了食用盐的技术要求、试验方法、检验规则和包装、标志、运输、贮存。
本标准适用于供食用的精制盐、粉碎洗涤盐及日晒盐。
2 引用标准(略)3 产品分类食用盐为晶体氯化钠,用于食用。
食用盐按其生产和加工方法可分为:精制盐、粉碎洗涤盐、日晒盐。
按其等级可分为:优级、一级、二级。
分子式:NaC1分子量:58.444 技术要求4.1 感官指标:白色、味咸、无异味、无明显的与盐无关的外来异物。
4.2 理化指标应符合表一规定:5 试验方法本方法所用试剂和水,在没有注明其他要求时,均指分析纯试剂和GB/T6682中规定的三级水。
试验中所需要标准溶液、杂质标准溶液、制剂和制品,在没有注明其他要求时,均按GB/T601、GB/T602、GB/T603之规定。
5.1 粒度的测定按GB/T13025.1规定执行5.2 白度的测定按GB/T13025.2规定执行5.3 水分含量的测定按GB/T13025.3规定执行5.4 水不溶物含量的测定按GB/T13025.4规定执行5.5 氯离子含量的测定按GB/T13025.5规定执行5.6 钙离子含量的测定按GB/T13025.6规定执行5.7 镁离子含量的测定按GB/T13025.6规定执行5.8 硫酸根离子含量的测定按GB/T13025.8规定执行5.9 碘离子含量的测定按GB/T13025.7规定执行5.10 铅离子限量的测定按GB/T13025.9规定执行5.11 砷离子限量的测定按GB/T13025.13规定执行5.12 钡离子限量的测定按GB/T13025.12规定执行5.13 氟离子限量的测定按GB/T13025.11规定执行5.14 亚铁氰化钾限量的测定按GB/T13025.10规定执行5.15 氯化钠及水溶性杂质成分的计算和检验结果的检查由上述各项检验结果得出食用盐样品所含单项离子的百份含量,然后按表2中所注顺序号计算化合物成分。
工业浓盐水处理技术规范-最新国标

目次1 2 3 4 5 6 7范围 (1)规范性引用文件 (1)术语和定义 (1)基本规定 (3)总体设计 (3)工艺设计 (4)6.1设计思路 (4)6.2浓盐水中有机物的分离或去除 (4)6.3低盐高有机水溶液终端处理 (4)6.4纯净盐溶液的处理或回用 (5)处理技术 (5)7.1调节与均质 (5)7.2化学软化和沉淀(澄清) (5)7.3气浮 (6)7.4生物处理 (6)7.5高级氧化 (6)7.6活性炭吸附 (6)7.7介质过滤 (7)7.8超滤 (7)7.9纳滤 (7)7.10反渗透 (7)7.11电渗析 (8)7.12蒸发 (8)7.13双极膜电渗析 (9)7.14电解 (9)7.15污泥处理与处置 (10)I7.16加药系统 (10)8浓盐水管道选型 (11)9防腐蚀及材料选择 (11)10监测控制 (11)附录A(资料性)水质全分析报告(格式) (13)附录B(资料性)工业盐理化指标要求 (14)附录C(资料性)设备及管道防腐蚀技术要求 (15)II工业浓盐水处理技术规范1范围本文件规定了工业浓盐水处理的基本规定、总体设计、处理技术、浓盐水管道选型、防腐蚀及材料选择、监测控制等技术要求。
本文件适用于工业浓盐水的处理回用。
2规范性引用文件下列文件中的内容通过文中的规范性引用而构成本文件必不可少的条款。
其中,注日期的引用文件,仅该日期对应的版本适用于本文件;不注日期的引用文件,其最新版本(包括所有的修订单)适用于本文件。
GB12348工业企业厂界环境噪声排放标准GB50011建筑抗震设计规范GB50013室外给水设计标准GB50014室外排水设计规范GB50016建筑设计防火规范GB50019采暖通风与空气调节设计规范GB50087建筑灭火器配置设计规范GB50191构筑物抗震设计规范GB50268给水排水管道工程施工及验收规范GB50335城镇污水再生利用工程设计规范GB50974消防给水及消火栓系统技术规范GB7231工业管道的基本识别色、识别符号和安全标识GB/T18919城市污水再生利用分类GB/T19249反渗透水处理设备GB/T19493环境污染防治设备术语GB/T19923城市污水再生利用工业用水水质GB/T20103膜分离技术术语GB/T31962污水排入城镇下水道水质标准GB/T50087工业企业噪声控制设计规范GB/T5462工业盐GB/T6009工业无水硫酸钠GB/T XXXX高盐水浓缩电渗析器3术语和定义GB50013、GB50014、GB/T19493及GB/T20103界定的以及下列术语和定义适用于本文件。
高一化学知识点总汇电子版

高一化学知识点总汇电子版化学是一门研究物质组成、性质和变化规律的学科,是高中学生不可或缺的一门科学课程之一。
下面将为大家提供高一化学知识点的电子版总汇,帮助大家系统化地复习与学习化学知识。
1. 原子结构与元素周期表1.1 原子结构1.1.1 原子的组成和结构1.1.2 元素的原子序数、质量数和核电荷的关系1.1.3 同位素的概念和应用1.2 元素周期表1.2.1 元素周期表的基本构造1.2.2 元素周期表的分类和周期性规律1.2.3 周期表结构与元素的性质2. 化学键与化合物2.1 化学键2.1.1 离子键的形成和特征2.1.2 共价键的形成和特征2.1.3 金属键的形成和特征2.2 化合物2.2.1 离子化合物和共价化合物的特点和区别 2.2.2 首位元素和内过渡元素的化合物特性比较3. 化学方程式与化学反应3.1 化学方程式的书写与平衡3.1.1 化学方程式的配平方法3.1.2 实质和表面的氧化反应与还原反应3.2 化学反应的类型3.2.1 酸碱中和反应3.2.2 氧化还原反应3.2.3 金属活动性与金属取代反应4. 气体与溶液4.1 气体4.1.1 气体分子的运动规律和理想气体状态方程 4.1.2 气体溶液的表达方式和相对湿度4.2 溶液4.2.1 溶解度和饱和溶液4.2.2 酸碱中和反应的判断方法5. 反应速率与化学平衡5.1 反应速率5.1.1 反应速率的定义和计算方法5.1.2 影响反应速率的因素5.2 化学平衡5.2.1 平衡常数和平衡反应的热力学条件5.2.2 Le Chatelier原理与平衡位置的调节5.2.3 浓度与物质的溶解度和相互作用的关系6. 酸碱与盐6.1 酸碱6.1.1 酸碱的定义和性质6.1.2 酸碱的浓度和酸碱度的计算6.1.3 酸碱溶液的中和反应和PH计算 6.2 盐6.2.1 盐的定义和性质6.2.2 盐的形成和命名规则7. 有机化学基础7.1 烃7.1.1 烃的分类和分子结构7.1.2 烃的常见官能团和化学反应7.2 醇和酚7.2.1 醇和酚的分类和分子结构7.2.2 醇的氧化反应和酚的酸碱性差异以上为高一化学知识点的电子版总汇,详细介绍了原子结构与元素周期表、化学键与化合物、化学方程式与化学反应、气体与溶液、反应速率与化学平衡、酸碱与盐以及有机化学基础等内容。
DB33- 612-2006 地理标志产品 萧山萝卜干

DB33- 612-2006 地理标志产品萧山萝卜干前言本标准的正文及附录A和附录B为强制性条款。
本标准按照《地理标志产品爱护规定》和GB/T 19907-2005而制定。
本标准的附录A和附录B为规范性附录;附录C为资料性附录。
本标准由浙江省质量技术监督局提出并归口。
本标准起草单位:杭州市质量技术监督局萧山分局、杭州市萧山区农业局、杭州市萧山区卫生监督所。
地理标志产品萧山萝卜干1 范畴本标准规定了萧山萝卜干的地理标志产品爱护范畴、术语和定义、要求、试验方法、检验规则、标志、标签、包装、运输、贮存。
本标准适用于国家质量监督检验检疫行政主管部门按照《地理标志产品爱护规定》批准爱护的萧山萝卜干。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓舞按照本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191 包装储运图示标志GB 317 白砂糖GB 2760 食品添加剂使用卫生标准GB 4285 农药安全使用标准GB/T 4789.3 食品卫生微生物学检验大肠菌群测定GB/T 4789.4 食品卫生微生物学检验沙门氏菌检验GB/T 4789.5 食品卫生微生物学检验志贺氏菌检验GB/T 4789.10 食品卫生微生物学检验金黄色葡萄球菌检验GB/T 5009.3 食品中水分的测定GB/T 5009.11 食品中总砷及无机砷的测定GB/T 5009.12 食品中铅的测定GB/T 5009.33 食品中亚硝酸盐与硝酸盐的测定GB/T 5009.54 酱腌菜卫生标准的分析方法GB 5461 食用盐GB 7718 预包装食品标签通则GB/T 8321(所有部分)农药合理使用准则GB/T 8967 谷氨酸钠(99%味精)GB l4881 食品企业通用卫生规范GB 17924 原产地域产品通用要求NY/T 496 肥料合理使用准则通则国家质量监督检验检疫总局第75号令《定量包装商品计量监督治理方法》3 地理标志产品爱护范畴限于国家质量监督检验检疫行政主管部门按照《地理标志产品爱护规定》批准爱护的范畴,即现浙江省杭州市萧山区坎山镇、南阳镇、宁围镇、新街镇、瓜沥镇、党山镇、益农镇、党湾镇、新湾镇、义蓬镇、河庄镇、靖江镇、衙前镇等13个镇现辖行政区域及红垦农场、红山农场、钞票江农场现辖区域和东部围垦地区以及浙江省杭州市滨江区浦沿、长河、西兴街道现辖行政区域。
注射用水的检测方法
1目的:2范围:3参考及相关文件:4仪器:5试剂:6规程:6.1性状:本品按HS-QC-GM015《性状检查法》进行,为无色的澄明液体;无臭,无味。
6.2 检查6.2.1 pH值:本品按HS-QC-GM013 《pH值测定法》进行,应为5.0~7.0。
6.2.2氯化物、硫酸盐与钙盐:取本品,分置三支试管中,每管各50ml。
第一管中加硝酸5滴与硝酸银试液1ml,第二管中加氯化钡试液2ml,第三管中加草酸铵试液2ml,均不得发生浑浊。
6.2.3硝酸盐:取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml 与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
6.2.4亚硝酸盐:取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml及盐酸奈乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钠0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,摇匀,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0.000002%)。
6.2.5 氨:取本品50ml,置比色管中,加碱性碘化汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.0 ml,加无氨水48ml与碱性碘化汞钾试液2ml制成的对照液比较,不得更深(0.00002%)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
复习引入5min 【复习】帮助老师解决问题,并且用化学方程式表示
1、精炼石油时,我们用什么来中和过量的硫酸?
2、中和由酸雨引起的土壤酸性时,我们用什么试剂?
【问题】以上反应属于什么反应?
通过联系生活中的
事物,让学生感受到
化学运用于生活中,
通过化学方程式的
书写,为认识盐的组
成埋下伏笔
盐的组成、分类及命名
8min 【过渡】中和反应是酸跟盐反应生成盐和水的反应。
那么其
中的盐跟我们生活中的盐有什么不同?那么,盐是由什么组
成的呢?(举例)
【板书】盐:由金属元素(或铵根)和酸根组成的化合物
【介绍】一、盐的分类方法
1、根据所含的酸根
2、根据所含的金属元素
3、根据盐的组成,又可分为正盐、酸式盐、碱式盐
4、根据盐的组成中是否含有氧元素,可以分为含氧酸盐和
无氧酸盐
二、盐的命名
1无氧酸盐称为:从右向左读做:某化某
含氧酸盐称为:从右向左读做:某酸某
通过举例,培养学生
分析和归纳的能力
通过教师的介绍,培
养学生记忆和理解
的能力
盐的溶解性规律
8min 【过渡】食盐,纯碱,碳酸钙的溶解性如何?那么硝酸钙的
如何判断?
【阅读】溶解性表
【问题】1min记住:若不能。
在30S内找出常见盐的溶解
性规律
【归纳】钾钠铵盐全都溶
硝酸盐类个个溶
盐酸盐除氯化银
硫酸盐除硫酸钡
其他盐类都不溶
通过观察、分析和归
纳,培养学生的思维
能力。
焰色反应5min 【过渡】炒菜时,不慎将食盐或食醋溅到煤气火焰上,有什
么现象?
【讲述】金属或金属化合物在灼烧时,使火焰呈特殊颜色叫
焰色反应
【实验】用碳酸钠,碳酸钾,氯化钾进行实验
归纳金属元素的焰色反应
通过实验。
增加学
生的学习兴趣并
且知道实验的操
作,及颜色反应的
应用。
