中国药科大学有机化学-羧酸
中国药科大学有机化学课件—第十三章 羧酸衍生物

羰基的亲电性(与亲核试剂的反应活性)次序:
O O O O O
R C X O R C O R ' R C C R R C N H ( R ) 2
共轭作用
诱 导 作 用
O R C X R O C X
O R C L
R O C O R C NH2 OR'
(贡献较小) O R C O R C NH2 OR' 羰基的亲电 能力减小
(二) 羧酸衍生物的命名 1 酰卤的命名:
B r O C H C H C H C B r 3 2 2 B r o m o b u t y r y l b r o m i d e H O O C C O C l
在命名时可作为酰基的卤化物,在酰基后加卤素的名称即可。
4 C h l o r o c a r b o n y l b e z i o c a c i d
酰胺
X O C
酰卤
O
R
酸酐
OR' C L( X 、 O 、 N )
碳-杂原子键具 某些双键性质
O + RCL
O RCL
O
RCL
+
O H C N H H H 2C 3N 2 C N : 1 3 7 . 6
O H C O C H H H 3C 3O 1 4 3 . 0 p p m 1 4 7 . 4 p p m C O :1 3 3 . 4
第十三章
羧酸衍生物
主要内容
第一节
第二节
羧酸衍生物的结构和命名
羧酸衍生物的物理性质
第三节
第四节 第五节 第六节 第七节
羧酸及其衍生物的化学反应
羧酸衍生物的制备 乙酰乙酸乙酯 丙二酸二乙酯在合成上的应用 碳酸及原酸衍生物
《有机化学~羧酸》课件

羧酸可作ቤተ መጻሕፍቲ ባይዱ酸,产生质子,也可以作为酸盐,失去质子与碱反应。
反应机理
羧酸的反应机理涉及酸碱中和、质子转移、共振和氢键等复杂的化学过程。
羧酸与金属离子的络合作用
由于羧酸中的羧基可以与金属离子形成络合物,这种络合作用对催化、药物和材料科学具有重要意义。了解羧 酸与金属离子的相互作用可以拓展其应用领域。
羧酸可发生一系列典型的化学反应,如
酯化、酰化、酰氯化、缩合和加成反应,
形成各种有机化合物。
3
pH反应
由于羧酸中的羧基,它们在溶液中呈酸 性,可以与碱发生中和反应,产生盐和 水。
羧酸的产生和应用领域
羧酸可以通过多种方法合成,例如氧化、酸催化和酯水解等。由于其特殊的结构和性质,羧酸在许多不同的领 域中具有广泛的应用。
羧基结构
羧基由碳、氧和氢构成,形成一个含氧的酸基团。
分子结构
羧酸通过共价键连接碳原子,形成一个含有羧基的 有机分子。
羧酸的命名方法
为了准确命名羧酸,有一套特定的系统命名法。羧酸的命名方法基于其分子结构和官能团,使其易于辨识和描 述。
IUPAC命名法
羧酸根据IUPAC规则进行命名,包括根据碳链长 度、取代基、官能团等因素进行命名。
《有机化学~羧酸》PPT课 件
这个PPT课件将为您介绍有机化学中的羧酸相关知识,包括定义、命名方法、 物理性质、化学性质等内容,帮助您深入了解这个有趣的化合物。
羧酸的基本结构
羧酸由羧基(-COOH)与其他基团组成,具有特殊的分子结构,这种结构使羧酸具有独特的性质和反应。了解 羧酸的基本结构对理解其特点非常重要。
常见名称
一些羧酸有常用的名称,可以根据它们的特定 结构或应用而命名。
大学有机化学课件--羧酸

COOH bP 249 0C
PCL5
160 0C
升华
PCl5 SOCl2
O
3CH3CCl H3PO3
52 0C
200 0C 分解
蒸出
O
C Cl POCl3 HCl
197 0C
107 0C
蒸出
O
R C OH SOCl2
O
R C Cl SO2 HCl
21
3、成酰胺和成腈的反应
O
R COH +NH3
O
R CO NH4
CN
丙二酸二乙酯的制备参:P53
30
第五节:二元羧酸
思考题:
(P18)
1、为什么二元羧酸的 K1> K2? 2、为什么顺丁烯二酸的 K顺1 > K反1,
而 K顺2<K反2?
31
二元羧酸的热分解反应(p20)
O
乙二酸 HOOCCOOH
HCOH + CO2
失羧
丙二酸 HOOCCH2COOH
CH3COOH+ CO2
6
二、光谱性质
IR
单体
VC=O
1770~1750cm-1
VO H
~3550cm-1
VC—O
NMR:
=
1320~1210cm-1
O R—CH2—C—O—H δ: 2-2.6 10-12
二缔合体 1725~1700cm-1 3400~2500cm-1
7
第三节 羧酸的结构与酸性
一、结构
O HC
OH
0.124nm 0.131nm
4.05
CH2CH2CH2COOH Cl
4.52
10
d、诱导效应具有加和性
羧酸.PPT
•10
三、几种常见的羧酸
名称
结构简 式 俗名
甲酸 HCOOH 蚁酸
色态
无色液体
溶解性
与水、乙醇、乙 醚、甘油等互溶
苯甲酸
安息香酸 白色针状晶体 微溶于水,易溶 于乙醇和乙醚
乙二酸
HOOC— COOH
草酸
无色透明晶 体
能溶于水 和乙醇
•.
•11
1 .甲酸(HCOOH) ——俗称蚁酸
根据其结构可推断出甲酸具有些什么性质?
可能存在H——易取代
•.
•5
1 .酸性
受羰基影响,羟基上 的氢变得活泼
R—COOH
R—COO- + H+
使紫色的石蕊溶液变红
Байду номын сангаас
具 有
与活泼金属(如Na、Mg等)反应放出氢气
酸 的
与金属氧化物(如Na2O、CaO等)
通 与碱(如NaOH、KOH等)发生中和反应
性 与部分盐(如碳酸盐等)反应
例如:
2RCOOH
A.新制生石灰
B.银氨溶液
C.浓溴水
D.新制Cu(OH)2
解析:可用新制Cu(OH)2来鉴别四种溶液。其实验现象 是:向四种溶液中加入新制Cu(OH)2,仅乙酸、甲酸 使Cu(OH)2溶解而溶液不浑浊,再将两组溶液分别加 热时,乙醛、甲酸能产生砖红色沉淀,从而将它们
区别开来。
答案:D
•.
•15
+ Na2CO3
→ 2RCOONa •.
+
CO2↑ + H2O•6
不同衍生物中的羟基的活泼性
羟基中氢 物质 结构简式 原子的活
泼性
酸性
与金属 与NaOH 钠反应 反应
第十一章 羧酸衍生物

选作母体化合物的优先次序如下:
RCOOH > RSO3H > (RCO) 2O > RCOOR′>
RCOX > RCONHR′> RCN > RCHO > RCOR′> ROH > ArOH > HNRR′> ROR′
2-氯甲酰基苯甲酸
3-甲酰基苯甲酰胺
第二节
物理性质
第三节
化学性质
一、水解、醇解和氨(胺)解反应
邻苯二甲酸酐
phthalic anhydride
乙(酸)丙(酸)酐 acetic propanoic anhydride
(4)酰胺的命名
• 酰胺的命名是在酰基名称后加上“胺”字。 • 当 N 上有取代基时,该取代基用斜体的“N ” 标出。
苯甲酰胺
benzamide
N-甲基苯甲酰胺 N-methylbenzamide
苯甲酰氯 benzyl chloride
4-甲基戊酰溴 4-methylpentanoyl
bromide
(2) 酯的命名
• 由生成酯的酸和醇的名称决定,称为某酸某酯。
内酯命名用内酯代替原来酸的 “酸” 并标明羟基
的位置。
乙酸乙酯 ethyl benzoate
苯甲酸乙酯
ethyl benzoate
3-甲基苯甲酸乙酯 ethyl 3-methylbenzoate
有机化学 Organic Chemistry
主讲 陈明
中国药科大学
Chapter 11 羧酸衍生物
Derivatives of Carboxylic Acids
• 羧酸分子中羧基发生变化所生成的化合物称为羧酸衍生 物。主要有酰卤(acylhalide)、酸酐(anhydride)、 酯(ester)、酰胺(amide)、和腈(nitrile)。
中国药科大学有机化学-取代羧酸

种离解方式。所以氨基酸又叫两性化合物。
氨基酸中的羧基和氨基可以相互作用形成内盐, 内盐中既有正离子部分又有负离子部分,所以又
H R C COOH NH2
+ OH H
H R C COO COOH NH2 3
叫偶极离子(或两性离子)。例如:
H R C COO NH3
CH2COOR
(R')H
比较容易出错的是把起始的卤代物在哪一头记混, 需要特别注意下,卤素在酯上。
三 酚酸
水杨酸
COOH OH
四 氨基酸
氨基酸蛋白质内容一章不单独讲,要求的内 容全部合并到本章。
基本氨基酸
要求掌握的部分如下:
两性和内盐
等电点
酸性、中性和碱性氨基酸的等电点范围
比较重要的反应
两性和内盐
4-甲基丁内酰胺 不对! 4-戊内酰胺
五 羰基酸
受热脱羧
O H3CH2C CCOOH O H3CH2C CH + CO2
稀H2SO4
O H3CC CH2COOH
CH3COCH3 + CO2
脱羧引出的反应非常重要,尤其是β-酮酸(酯) 的脱羧。详见碳负离子。
L-Phenylalanine
取代羧酸
Substituted Carboxylic Acids
1
氨基酸
OH I O COOH COOH CH3CCH2COOH NH2 OH COOH HOOC 羰基酸
卤代酸
酚酸 羟基酸
命名
Cl
ω -氯戊酸 5-氯戊酸 (ω -末位) COOH
OH COOH
OH COOH
吸电子羧基增加了碳卤键的极性
大学有机化学羧酸

Blanc规则:在有机反应中有成环可能时, 一般易形成五元环或六元环,这称为Blanc (布朗克)规则。
4. α-H的卤代反应
-H活性:羧酸小于醛酮。 PCl3、PBr3 或红磷 (P)等催化。
芳香酸在发生取代反应时,发生在间位上 ——羧基为间位定位基。
5. 羧酸的还原
羧酸很难被还原,只能用强还原剂LiAlH4才 能将其还原为相应的伯醇。
ClCH2COOH > BrCH2COOH > ICH2COOH > CH3COOH
pKa值 2.86
2.89
3.16
4.76
供电子诱导效应使酸性减弱;
CH3COOH > CH3CH2COOH > (CH3)3CCOOH
pKa值 4.76
4.87
5.05
吸电子诱导效应使酸性增强;
Cl3CCOOH> Cl2CHCOOH > ClCH2COOH
饱和羧酸C数>10,在中文数后+“碳”。
HOCH2CH2CHCH2COOH Cl
5-羟基-3-氯戊酸
BrCH2CH CCH2CH2COOH 4-乙基-6-溴-4-己烯酸
C2 H5
COOH
环己基甲酸
HOOC
COOH 反-1,4-环己烷二甲酸
CH2CH2COOH
3-苯基丙酸
§1.2 羧基的结构
一元羧酸常以二聚体形式存在(分子间氢键)
OO R C O C R + H2O
2
C O O H+ (CH3CO)2O
(
C O )2O + CH 3COOH
乙酐(脱水剂)
某些二元酸不需要任何脱水剂,加热就能脱水 生成环状(五元或六元)酸酐。
中国药科大学有机化学试题库

名词解释(用结构式或反应式表示):第二章烷烃和环烷烃甲基乙基正丙基异丙基正丁基仲丁基异丁基叔丁基甲基游离基乙基游离基正丙基游离基异丙基游离基叔丁基游离基3-甲基戊烷2,3,4-三甲基癸烷异己烷4-异丙基十一烷新戊基反-1-甲基-4-叔丁基环己烷环戊基甲基二环[3.3.0]辛烷第三章立体化学基础对映体非对映体内消旋体外消旋体对称中心对称面手性碳原子手性分子第四章卤代烷甲基碳正离子乙基碳正离子二级碳正离子三级碳正离子叔丁基碳正离子格氏试剂瓦尔登(Walden)转化S N2反应中间体E2反应中间体扎衣采夫(Saytzeff)规则二碘二溴甲烷1-氯-2-苯基乙烷(S)-2-碘己烷新戊基氯乙基溴化镁第五章醇和醚氯化亚砜欧芬脑尔(Oppenauer)氧化卢卡斯(Lucas)试剂沙瑞特(Sarret)试剂琼斯(Jones)试剂(S)-1-苯基-2-丙烯醇(1S,2R)-2-氯环己醇2,3-二巯基丙醇丙烯基烯丙基醚3-甲氧基戊烷苯甲硫醚第六章烯烃丙烯基烯丙基烯丙基游离基烯丙基碳正离子 NBS 2-丁烯基叔丁基碳正离子异丁烯亲电加成反应过氧化物效应马氏 (Markovnikov’s) 规则 2,4,4-三甲基-2-戊烯顺-3,4-二甲基-3-己烯E-3-甲基-4-异己基-3-癸烯(2-)反,(4-)顺-2,4-己二烯第七章炔烃和二烯烃林德拉(Lindlar)试剂狄尔斯-阿尔特(Diels-Alder)反应 1,4-己二炔环丙基乙炔 3,3-二甲基-2-己炔 3-乙基-2-戊烯-4-炔互变异构第八章芳烃苯基苄基苄基游离基苄基碳正离子联苯傅瑞德尔-克拉夫茨 (Friedel-Crafts)反应克来门森(Cemmensen)还原3,5-二硝基苯磺酸2,10-二甲基蒽2-氨基-5-溴-3-硝基苯甲酸Z-1-苯基-2-乙基-3-甲基-1-丁烯1,2-二苯乙烷2-氨基-5-羟基苯甲醛2,6-二甲基萘9-硝基菲第九章羰基化合物碘仿碘仿反应羟醛缩合反应(aldol condensation)西佛碱(Schiff’s base)杜伦(Tollens)试剂斐林Fecheling试剂克来门森(Cemmensen)还原乌尔夫-凯惜钠-黄鸣龙(Wolff- Kishner-Huang Minglong)还原法 DMSO 麦尔外因-彭杜尔夫(Meerwein-Ponndorf)还原氢化锂铝硼氢化钠康尼查罗(Cannizzaro)反应交叉康尼查罗(Cannizzaro)反应魏悌希(Witting)反应磷叶立德(phosphorus ylide)达尔森(Darzen)反应盖特曼-柯赫(Gettermann-Koch)反应麦克尔加成(Michael addition)丙酮苯腙苯甲醛肟环己酮缩二乙醇乙烯酮(4E)-4-甲基-5-苯基-4-己烯-3-酮(2S,3S)-2,3-二溴丁醛(用Fisher投影式表示)第十章酚和醌苦味酸水杨酸β-萘酚克莱森(Claisen)重排傅瑞斯(Fries)重排柯尔柏一施密特(Kolbe-R.Schmitt)反应瑞穆尔—梯曼(Reimer-Timann )反应对苯醌邻苯醌第十一章羧酸和取代羧酸氯化亚砜酯化反应(esterification)赫尔-乌尔哈-泽林斯基(Hell-Volhard-Zelinsky)反应克脑文格尔(Knoevenagel)反应交酯雷福尔马茨基(Reformatsky)反应反-4-羟基环已烷羧酸(优势构象)(2S,3R)-2-羟基-3-苯基丁酸(Z,E,E)-9,11,13-十八碳三烯酸(R)-2-苯氧基丁酸第十二章羧酸衍生物罗森孟德(Rosenmund)反应克莱森缩合反应(Claisen condensation)交叉酯缩合(crossed ester condensation)狄克曼(Dieckmann)缩合霍夫曼重排(Hofmann rearrangement)光气脲硫脲胍胍基脒基 3-甲基戊二腈邻乙酰氧基苯乙酸苯酯 2-对羟基苯丙烯酸甲酯三乙酸甘油酯 2.5-环已二烯基甲酰氯 3-甲基邻苯二甲酸酐3-戊酮酸乙酯N-甲基-δ-戊内酰胺第十三章含氮化合物联苯胺重排(benzidine rearrangement)加布瑞尔(Gabriel)合成法霍夫曼(Hofmann)消除桑德迈尔(Sandmeyer )反应 席曼(Schiemann )反应 偶氮苯 重氮甲烷 卡宾(碳烯) (R )-仲丁胺 二乙胺 双-(2-氯乙基)-胺 乙二胺 N-甲基-N-乙基环已胺 2-氨基乙醇 1-萘甲胺 4-联苯胺(S )-2-氨基-3-(3,4-二羟基苯基)丙酸第十四章 杂环化合物“缺π”芳杂环 “多π”芳杂环 斯克劳普(Z.H.Shraup)合成 α-甲基噻吩 5-甲基恶唑 N-甲基四氢吡咯 3-甲基吲哚 5-硝基-8-羟基喹啉 5, 6-苯并异喹啉 2, 6-二甲基嘌呤 吡啶并[2, 3-d]嘧啶 3-吲哚乙酸 8-溴异喹啉 2-甲基-5-苯基吡嗪 5-硝基-2-呋喃甲醛 4,6-二甲基-2-吡喃酮第十六章 氨基酸、多肽、蛋白质和酶的化学(简介)α-氨基酸 内盐(偶极离子) 等电点 二肽 肽键第十七章 糖类D -葡萄糖 差向异构体 D -吡喃葡萄糖 端基异构体 苷 糖脎 还原糖 非还原糖第十九章 类脂异戊二烯 “异戊二烯规则” 单萜 二萜 樟脑(α-莰酮) 甾烷 雌甾烷 雄甾烷 孕甾烷 胆烷胆甾烷 正系(5β型) 别系(5α型)选择题Ⅰ:1. 下面四个同分异构体中哪一种沸点最高?(A) 己烷 (B) 2-甲基戊烷(C) 2,3-二甲基丁烷 (D) 2,2-二甲基丁烷2. 下列环烷烃中加氢开环最容易的是:(A) 环丙烷 (B) 环丁烷(C) 环戊烷 (D) 环己烷3. 光照下,烷烃卤代反应的机理是通过哪一种中间体进行的?(A) 碳正离子 (B) 自由基(C) 碳正离子 (D) 协同反应,无中间体4. 1-甲基-4-异丙基环己烷有几种异构体?(A) 2种 (B) 3种 (C) 4种 (D) 5种5. 在下列哪种条件下能发生甲烷氯化反应?(A) 甲烷与氯气在室温下混合(B) 先将氯气用光照射再迅速与甲烷混合(C) 甲烷用光照射,在黑暗中与氯气混合(D) 甲烷与氯气均在黑暗中混合6. 下列一对化合物是什么异构体?(A) 非对映体 (B) 构型异构体(C) 对映体 (D) 构造异构体7. 与 相互关系是:(A) 对映体 (B) 非对映体(C) 构型异构体 (D) 构造异构体8. 下列化合物中哪些可能有顺反异构体?(A) CHCl =CHCl (B) CH 2=CCl 2(C) 1-戊烯 (D) 2-甲基-2-丁烯9.构造式为CH 3CHClCH =CHCH 3 的立体异构体数目是:(A) 2种 (B) 4种 (C) 3种 (D) 1种10.下列化合物中哪些可能有E ,Z 异构体?(A) 2-甲基-2-丁烯 (B) 2,3-二甲基-2-丁烯(C) 2-甲基-1-丁烯 (D) 2-戊烯11.实验室中常用Br 2的CCl 4溶液鉴定烯键,其反应历程是:(A) 亲电加成反应 (B) 自由基加成(C) 协同反应 (D) 亲电取代反应12.(CH 3)2C =CH 2 + HCl :(A) (CH 3)2CHCH 2Cl (B) (CH 3)2CClCH 3H CH 3CH 3H H CH 3CH 3CH 3CH 3H CH H CH 3(C) CH 3CH 2CH 2CH 2Cl (D) CH 3CHClCH 2CH 313. CF 3CH =CH 2 + HCl :(A) CF 3CHClCH 3 (B) CF 3CH 2CH 2Cl(C) CF 3CHClCH 3 与 CF 3CH 2CH 2Cl 相差不多 (D) 不能反应14.CH 3CH =CH 2 + Cl 2 + H 2O :(A) CH 3CHClCH 2Cl + CH 3CHClCH 2OH (B) CH 3CHOHCH 2Cl + CH 3CHClCH 2Cl (C) CH 3CHClCH 3 + CH 3CHClCH 2OH (D) CH 3CHClCH 2Cl15.某烯烃经臭氧化和还原水解后只得 CH 3COCH 3,该烯烃为:(A) (CH 3)2C =CHCH 3 (B) CH 3CH =CH 2(C) (CH 3)2C =C(CH 3)2 (D) (CH 3)2C =CH 216.CH 3CH =CHCH 2CH =CHCF 3 + Br 2 (1 mol) 主要产物为:(A) CH 3CHBrCHBrCH 2CH =CHCF 3 (B) CH 3CH =CHCH 2CHBrCHBrCF 3(C) CH 3CHBrCH =CHCH 2CHBrCF 3 (D) CH 3CHBrCH =CHCHBrCH 2CF 317.异戊二烯经臭氧化,在锌存在下水解,可得到哪一种产物?(A) HCHO + OHCCH 2CHO (B) HCHO + HOOCCH 2COOH(C) HCHO + CH 3COCHO (D) CH 3COCHO + CO 2 + H 2O18.下列化合物中哪一个能与顺丁烯二酸酐反应,生成固体产物?(A) 萘 (B) CH 3CH 2CH =CH 2 (C) (D) 对二甲苯 19.二氯丙烷可能的异构体数目有多少?(A) 2 (B) 4 (C) 6 (D) 520.下列化合物进行S N 2反应时,哪个反应速率最快?21. 下列化合物进行S N 1反应时,哪一个反应速率最快?22.在NaOH 水溶液中,(CH 3)3CX(I),(CH 3)2CHX(II),CH 3CH 2CH 2X(III),CH 2=CHX(IV)各卤代烃的反应活性次序为:(A) I>II>III>IV (B) I>II>IV>III(C) IV>I>II>III (D) III>II>I>IV23.(CH 3)3CBr 与乙醇钠在乙醇溶液中反应主要产物是:(A) (CH 3)3COCH 2CH 3 (B) (CH 3)2C =CH 2(C) CH 3CH =CHCH 3 (D) CH 3CH 2OCH 2CH 324.下列哪个化合物能生成稳定的格氏试剂?(A) CH 3CHClCH 2OH (B) CH 3CH 2CH 2Br(C) HC ≡CCH 2Cl (D) CH 3CONHCH 2CH 2Cl25.合成格氏试剂一般在下列哪一溶剂中反应?(A) 醇 (B) 醚 (C) 酯 (D) 石油醚26.(CH 3)2CHCH 2Cl 与(CH 3)3CCl 是什么异构体?(A) 碳架异构 (B) 位置异构(C) 官能团异构 (D) 互变异构27.(R )-2-氯丁烷 与(S )-2-氯丁烷的哪种性质不同?(A) 熔点 (B) 沸点(C) 折射率 (D) 比旋光度28.与 一对化合物的相互关系是:(A) 对映异构体 (B) 非对映异构体(C) 相同化合物 (D) 不同的化合物29. :CH 2C 3CH CH 2(A)I Br (C)Cl (B)F (D) (A) CH 3CH 2CH 2CH 2Br (B) CH 32CH Br CH 3(C) CH 3CH 2CBr 3CH 3(D) CH 3C CH 2Br CH 332C 2H 5CH 3H Br CH 32H 5H CH 3CH 2C CH 3CH 2CH 3+NaOH (A) CH 3CH 2C CH 3CHCH 3(B) CH 3CH 2C CH 2CH 3CH 2(C) CH 3CH 2C CH 2CH 3CH 3(D) CH 3CH 230.沸点升高的顺序是: (A) I,II,III,IV (B) IV ,III,II,I (C) I,II,IV ,III (D) III,IV ,II,I 31.环氧乙烷 + NH 3 ───> 产物是: (A) (B) NH(CH 2CH 2OH)2 (C) N(CH 2CH 2OH)3 (D) 全都有 32.ClCH 2CH 2CH 2OH + PBr 3 ──> 主要产物为: (A) BrCH 2CH 2CH 2OH (B) CH 2=CHCH 2OH(C) ClCH 2CH =CH 2 (D) ClCH 2CH 2CH 2Br33.乙醇与二甲醚是什么异构体?(A) 碳干异构 (B) 位置异构 (C) 官能团异构 (D) 互变异构34.Williamson 合成法是合成哪一种化合物的主要方法?(A) 酮 (B) 卤代烃 (C) 混合醚 (D) 简单醚35.下列化合物HOH(I),CH 3OH(II),(CH 3)2CHOH(III),(CH 3)3COH(IV)的酸性大小顺序是:(A) I>II>III>IV (B) I>III>II>IV (C) I>II>IV>III (D) I>IV>II>III36.为了合成烯烃(CH 3)2C =CH 2,最好选用下列何种醇?37.为了合成烯烃CH 3CH 2CH 2CH =CH 2,应采用何种醇?38. 下列反应应用何种试剂完成?(A) LiAlH 4 (B) NaBH (C) Na + EtOH (D) Pt/H 239. 用Grignard 试剂合成 ,不能使用的方法是什么?40.冠醚可以和金属正离子形成络合物,并随着环的大小不同而与不同的金属离子络合,18-冠-6最容易络合的离子是:(A) Li + (B) Na + (C) K + (D) Mg 2+41.分子式为C 5H 10的开链烯烃异构体数目应为:(A) 5种 (B) 4种(C) 6种 (D) 7种42.1,2- 二甲基环丁烷的立体异构体数目有:(A) 2种 (B) 4种(C) 6种 (D) 3种43.下列化合物有对映异构的应是:( IV)( III )( II )( I )CHOCH 3CH 2OCH 32OCH 3CHOCH 3CH 2OCH 32OH CHOH CH 2OCH 32OH CHOH CH 2OH 2OH CH 2CH 22CH 3CH 2CHCH 3(C)(CH 3)2CHCH 2OH (A)CH 3CH 2CH 2CH 2OH (D)(CH 3)3COH (B)CH 3CH 2CH 2CHCH 3(CH 3)2CHCHCH 3(C)(D)CH 3CH 2CH 2CH 2CH 2OH C OH CH 2CH 3(CH 3)2(A)(B)COOH CH 2OH (A) C 6H 5COCH 3CH 3CH 2MgBr (B) CH 3CH 2CCH 3C 6H 5MgBr (C) C 6H 5CCH 2CH 3CH 3MgI (D) C 6H 5MgBr CH 3CHO ++++C 6H 5CCH 3CH 2CH 3CH 3COCH 3 CH 3CHOHCH 2CH 3CH 3CHOHCH 2CH 3CH 3CHOHCH 2CH 3(4)(3)(2)(1)(A) (1) (2) (B) (1) (3) (C) (2) (4) (D) (3)(4)44.下列化合物有对映异构的应是:45. 上述构型的正确命名是: (A )(1)R (2)R (3)S (B )(1)R (2)S (3)S(C )(1)S (2)S (3)S (D )(1)R (2)R (3)R46. H O H M eC H 2O H H O H 化合物的构型正确命名是: (A) 2R , 3R (B) 2R , 3S (C) 2S , 3R (D) 2S , 3S47.用来表示下列药物假麻黄碱的投影式应是:48.薄荷醇 理论上所具有的立体异构体数目应为:(A) 8种 (B) 16种 (C) 2种 (D) 4种49.2,3-二甲基丁烷沿C2-C3旋转时最稳定的构象是:50.1,2-二甲基环丙烷有几个立体异构体? (A) 无立体异构体 (B) 二个,一对对映体(C) 三个,一对对映体和一个内消旋体 (D) 四个,二对对映体 C C C Me Me Me H O 2O 2Br Br N N O 2Br Br BrN CH 3CHDC 2H 5 (1)(2)(3)(4)(A) (1),(2) (B) (1),(3) (C) (1),(4) (D) (2),(4)HNH 2CH 3Br CH 2OH 3H Cl CH 2NH 22NHCH 3Br (1)(2)(3)(D)(C)(B)(A)NHMe OH Ph H H NHMe H Ph HO Me Me H Ph HO MeHN Me OH Ph H H NHMe Me H OH H Ph OH (D)(C)(B)(A)CH 3H H 3C CH 3CH 3CH 3CH 3HH CH 3CH 3CH 3CH 3CH 3CH 3CH 3H CH 3CH 3CH 351.判断下述四种联苯取代物中哪个是手性分子:52.BrCH 2CH 2Br 的优势构象是:(A) 全重叠构象 (B) 部分重叠构象(C) 邻交叉构象 (D) 对交叉构象53.下列构象的稳定性顺序为:_.54.在下列化合物中,属于手性分子的是:55.在下列化合物中, (R )-2-碘己烷的对映体是:(D)(C)(B)(A)___CH 3C C 4H 9 nI C 2H 5C n C 3H 7I C 2H 5C C 3H 7 n I H _CH 3C n C 4H 9I 56.下列化合物中, 与(R )-2-甲基丁酸不相同的化合物是:57.下列各组投影式中, 两个投影式相同的组是:(D)(C)(B)(A)I I HO 2C CO 2H Br Br I Cl I Br I I HO 2C CO 2H I I (A) (a)>(b)>(c)>(d) (B) (b)>(a)>(d)>(c)(C) (c)>(b)>(a)>(d) (D) (d)>(a)>(b)>(c) (b)(d)(c)(a)H Br C 2H 5H 3C Br H Br Br H H CH 32H 52H 5H 3CH 32H 5Br H Br H (D)(C)(B)(A)6H 5C CH 3H 23C COOH Br 6H 5C H H CH 6H 5CH 2CH 3H 2(D)(C)(B)(A)C CH 3HOOC 2CH 3COOH CH 3CH 23H CH 32CH 3C CH 3CH 3CH 258.下列化合物中, 无光学活性的是:59. α, β-不饱和羰基化合物与共轭二烯反应得环己烯类化合物,这叫什么反应? (A) Hofmann 反应 (B) Sandmeyer 反应 (C) Diels-Alder 反应 (D) Perkin 反应60. 异戊二烯经臭氧化,在锌存在下水解,可得到哪一种产物?(A) HCHO + OHCCH 2CHO (B) HCHO + HOOCCH 2COOH (C) HCHO + CH 3COCHO (D) CH 3COCHO + CO 2 + H 2O61. 下列化合物中哪一个能与顺丁烯二酸酐反应,生成固体产物?(A) 萘 (B) CH 3CH 2CH =CH 2 (C) (D) 对二甲苯62.丁二烯与溴化氢进行加成反应构成什么中间体?68.一个天然醇C 6H 12O 比旋光度[ ]25 = +69.5°,催化氢化后吸收一分子氢 得到一个新的醇,比旋光度为0,则该天然醇结构是:64.下列试剂中,哪一个可用来区别顺和 反-1,2-环戊二醇?(A) 丙酮 (B) 臭氧 (C) 异丙氧基铝 (D) 氢化铝锂 65.哪一种化合物不能用于干燥甲醇?(A) 无水氯化钙 (B) 氧化钙 (C) 甲醇镁 (D) 无水硫酸钠 66.为检查司机是否酒后驾车采用呼吸分析仪,其中装有K 2Cr 2O 7 +H 2SO 4,如果司机血液中含乙醇量超过标准,则该分析仪显示绿色,其原理是:(A) 乙醇被氧化 (B) 乙醇被吸收 (C) 乙醇被脱水 (D) 乙醇被还原67.碳数相同的化合物乙醇(I),乙硫醇(II),二甲醚(III)的沸点次序是:(A) II>I>III (B) I>II>III (C) I>III>II (D) II>III>I 68.(C)(A)(D)(B)CHO CHO CH 3COOH H 2N COOH H CH 32CH 2NH 2H H C 2H 5HOCH 2CH 3C 2H 5Br H 2OH OH H 2NH 2COOH C 6H 5Cl COOH 6H 5Cl CH 3(D)(C)(B)(A)C C C CH 3C 2H 5Br Br C C C C H H Cl H C C C Cl Cl I Br C C C Cl Cl I I CH 2C 3CH CH 2CH 3CH CH CH 2(C)CH 2CH 2CH CH 2(D)CH 3CH CH CH 2(B)(A)CH 3CH CH CH 2+++_ (D)(B)OH CH 3CH 3CH 2CH CH 2OH CH CH 2(C)(A)CH 2CH CH 2CH 3CH 2CH OH OH下列有机溶剂,具有最大火灾危险的是:(A)乙醇 (B)二乙醚 (C)四氯化碳 (D)煤油69.下列化合物碱性大小的顺序为:① CH 3O - ② (CH 3)2CHO - ③ CH 3CH 2O - ④ (CH 3)3CO -(A) ① > ③ > ② > ④ (B) ④ > ② > ③ > ①(C) ④ > ③ > ① > ② (D) ① > ② > ③ > ④ 70.氧化 为 的氧化剂应是:(A) ① ② (B) ① ③ (C) ① ④ (D) ② ④71.下列醇的酸性大小顺序为:① CH 3CH 2OH ② CH3CHOHCH 3 ③ PhCH 2OH ④ (CH 3)3C ─OH(A) ③ > ① > ② > ④ (B) ① > ② > ③ > ④(C) ③ > ② > ① > ④ (D) ① > ③ > ② > ④ 72.能使不饱和伯醇氧化成不饱和醛的氧化剂应是 :① KMnO 4/H + ② CrO 3/H +③ CrO 3/吡啶 ④ 新鲜 MnO 2(A) ③④ (B) ①④ (C) ①③ (D) ②③ 73.欲从 制备, 应选用哪种反应条件? (A) CH 3OH/CH 3ONa (B) CH 3OH/H + (C) CH 3OH/H 2O (D) CH 3OCH 3 74.在碱性条件下, 可发生分子内S N 反应而生成环醚的是下列哪个卤代醇:75.?(A) (C) 官能团异构体 (D) 价键异构体76.C 3H 6O 有几种稳定的同分异构体?(A) 3种 (B) 4种 (C) 5种 (D) 6种77.下面反应的主要产物是:(A) (B)(C) (D)OH O PhCO 3H KM n O 4/H +CrO 3/ MnO 2②③ ④吡啶新鲜 ① CH 2CH 3CH C H 3C H C H 2O C H 3 OH 22Br 2Br 2(B)(A)2Br 2(D)(C)CH 3CH C CH 3CH 3CH 3CH 2C CH 3OSO 3H CH 3CH 3CH 2C CH 33O C CH 33CH 2CH 3CH 3CH 2C 3CH 2CH 3CH 2C CH 3OH 350%H 2SO 478. 下面反应的主要产物是:79. 下述反应能用来制备伯醇的是:(A) 甲醛与格氏试剂加成, 然后水解 (B) 乙醛与格氏试剂加成, 然后水解(C) 丙酮与格氏试剂加成, 然后水解(D) 苯甲腈与格氏试剂加成, 然后水解 80.下面哪种试剂只能将烯丙位、苯甲位的伯醇、仲醇氧化成相应的醛和酮:(A) 过氧酸 (B) 琼斯试剂 (C) 新制的MnO 2 (D) 费兹纳-莫发特试剂 81.RMgX 与下列哪种化合物反应, 再水解, 可在碳链中增长两个碳:(A) (B)(C) (D)82. 下列哪一种化合物不能用以制取醛酮的衍生物?(A) 羟胺盐酸盐 (B) 2,4-二硝基苯(C) 氨基脲 (D) 苯肼83.下列哪个化合物不能起卤仿反应?(A) CH 3CH(OH)CH 2CH 2CH 3 (B) C 6H 5COCH 3(C) CH 3CH 2CH 2OH (D) CH 3CHO 84.下列哪个化合物可以起卤仿反应?(A) CH 3CH 2CH 2OH (B) C 6H 5CH 2CH 2OH(C) CH 3COCH 2CH 2COCH 3 (D) HCHO 85乙醛和过量甲醛在NaOH 作用下主要生成:86. 用格氏试剂制备1-苯基-2-丙醇,最好采用哪种方案?(A) CH 3CHO + C 6H 5CH 2MgBr (B) C 6H 5CH 2CH 2MgBr + HCHO(C) C 6H 5MgBr + CH 3CH 2CHO (D) C 6H 5MgBr + CH 3COCH 387在稀碱作用下,下列哪组反应不能进行羟醛缩合反应?(A) HCHO + CH 3CHO (B) CH 3CH 2CHO + ArCHO(C) HCHO + (CH 3)3CCHO (D) ArCH 2CHO + (CH 3)3CCHO 88.下列四个反应,哪一个不能用来制备醛:(A) RMgX + (① HC(OEt)3,② H +/H 2O) (B) RCH 2OH + CrO 3/H 2SO 4 蒸馏(C) RCH =CHR + (① O 3,②H 2O/Zn) (D) RCOCl + H 2/Pt89.Clemmensen 还原是用Zn(Hg)/HCl 进行还原,其作用是使 :(A) 羰基成醇 (B) 羰基成亚甲基 (C) 酯成醇 (D) 酯成烃 90.Aldol(醛醇、醇醛、羟醛)缩合是用稀酸或稀碱催化,从反应活性中心看,它们是: DMF RCl C 6H 5SO 2Cl CH CH 2C 2H 5C OH CH 3CH 3C CH 2C OH CH 3C 2H 5(D)C CH 2CH Cl C 2H 5CH 3(C)C 2H 5C CH 2CH Cl (B)(A)Cl CH 2CH C CH 3C 2H 5 吡啶CH 3CH 2OH CH 3CH 2X O C 2H 5COC 2H 5O (A) (HOCH 2)3CCHO (B) C(CH 2OH)4 (C) CH 3CH CHCHO (D) CH 3CHCH 2CHO(A) 一个羧酸酯出羰基,一个醛出α-C(B) 一个羧酸酯出羰基,一个酮出α-C(C) 两个羧酸酯,一个出羰基,一个α-C(D) 两个醛或酮,一个出羰基,一个α-C 91.黄鸣龙还原是指:(A) Na 或Li 还原苯环成为非共轭二烯(B) Na + ROH 使羧酸酯还原成醇(C) Na 使酮双分子还原(D) NH 2NH 2/KOH/高沸点溶剂,还原羰基成亚甲基 92下列四个反应,不能用于制备酮的是: 93. 下列四个试剂,不跟CH 3CH 2COCH 2CH 3反应的是:(A) RMgX (B) NaHSO 3饱和水溶液(C) PCl 5 (D) LiAlH 494.完成下面的转变,需要哪组试剂? ? CH 3CH =CH(CH 2)2CH =O ───→ HOOCCH 2CH 2CH =O(A)KMnO 4 (B)(1)EtOH/干HCl (2)KMnO 4 (3)H 3O +(C)K 2Cr 2O 7 (D)HNO395.下面的氧化反应,用何种氧化剂较好?(A) K 2Cr 2O 7/H + (B) CrO 3·吡啶 (C) Ag(NH 3)2+ (D) 稀、冷KMnO 496.Tollens 试剂的组成是:(A) CrO 3·吡啶 (B) Cu(OH)2·酒石酸钾(C) Ag(NH 3)2+·OH - (D) 新鲜 MnO 297.还原 C =O 为 CH 2 的试剂应是:(A) Na/EtOH (B) H 2N-NH 2/HCl(C) Sn/HCl (D) Zn-Hg/HCl98.下面化合物羰基活性最强的是:(A) ClCH 2CH 2CHO (B) CH 3CH 2CHO(C) CH 3CHClCHO (D) CH 3CHBrCHO99.Tollens 试剂的组成是:(A) CrO 3·吡啶 (B) Cu(OH)2·酒石酸钾(C) Ag(NH 3)2+·OH - (D) 新鲜 MnO 2 100.还原 C =O 为 CH 2 的试剂应是:(A) Na/EtOH (B) H 2N-NH 2/HCl(C) Sn/HCl (D) Zn-Hg/HCl101下面化合物羰基活性最差的是:(A) PhCHO (B) CH 3CHO(C) PhCOCH 3 (D) CH 3COCH 3102下面化合物羰基活性最强的是:(A) ClCH 2CH 2CHO (B) CH 3CH 2CHO (A) R 2CHOH,CrO 3/H 2SO 4 (B) RCOCHR'CO 2C 2H 5,①OH -,(2)H 3O +/ (C) ArH,RCONH2/AlCl 3 (D) R 2C =CR 2,①O 3,②H 3O +/Zn CH O CO 2H(C) CH 3CHClCHO (D) CH 3CHBrCHO103.的产物是:104 C 6H 5OCH 3(I),C 6H 5COCH 3(II),C 6H 6(III),C 6H 5Cl(IV)四种化合物硝化反应速率次序为:(A) I>III>II>IV (B) I>III>IV>II(C) IV>I>II>III (D) I>IV>II>III105硝化反应的主要产物是:106苯乙烯用热KMnO 4氧化,得到什么产物?107 苯乙烯用冷KMnO 4氧化,得到什么产物?108 苯乙烯催化加氢,在室温低压下得到什么产物?(A) 无变化 (B) 乙苯 (C) 甲苯 (D) 乙基环己烷 109苯乙烯催化加氢,高温高压下得到什么产物?(A) 乙苯 (B) 甲苯 (C) 环己烷+乙烷 (D) 乙基环己烷110C 6H 6 + (CH 3)2CHCH 2Cl ? (A) PhCH 2CH(CH 3)2 (B) PhC(CH 3)3(C) PhCH(CH 3)CH 2CH 3 (D) Ph(CH 2)3CH 3111傅-克反应烷基易发生重排,为了得到正烷基苯,最可靠的方法是:(A) 使用AlCl 3作催化剂 (B) 使反应在较高温度下进行(C) 通过酰基化反应,再还原 (D) 使用硝基苯作溶剂112用KMnO 4氧化的产物是:(A) PhCHCH 2COCMe 3(B) PhCH CH C(OH)CMe 3Et (C) PhCHCH 2CHCMe 3(D) PhCH 2CH 2C(OH)CMe 3(2)H 3+(1)EtMgBr PhCH CHCOCMe 3NO 2(C)(D)(B)(A)O 2N NO 2NO 2NO 2NO 2NO 2NO 2NO 2(C)(D)(B)(A)CH 2COOH CH OH CH 2OH CO 2H CH 2CHO (C)(D)(B)(A)CH 2COOH CH OH CH 2OH CO 2H CH 2CHO AlCl 3CH 3C(CH 3)3113由 ───→ 最好的路线是:(A) 先硝化,再磺化,最后卤代 (B) 先磺化,再硝化,最后卤代(C) 先卤代,再磺化,最后硝化 (D) 先卤代,再硝化,最后磺化选择题Ⅰ答案: 1A 2A 3B 4A 5B 6B 7D 8A 9B 10D 11A 12B 13B 14B 15C 16A17C 18C 19D 20A 21C 22A 23B 24B 25B 26A 27D 28A 29A 30A 31D32D 33C 34C 35A 36B 37A 38A 39D 40C 41C 42D 43C 44A 45B 46D47D 48A 49C 50C 51A 52D 53C 54A 55B 56D 57A 58A 59C 60C 61C62A 65A 66A 67B 68B 69B 70B 71A 72C 73A 74A 75C 76D 77A 78B79A 80C 81C 82B 83C 84C 85B 86A 87C 88D 89B 90D 91D 92C 93B94B 95C 96C 97D 98C 99C 100D 101C 102C 103A 104B 105D 106C107B 108B 109D 110B 111C 112A 113C选择题Ⅱ:151.下列哪一种化合物不能用以制取醛酮的衍生物?(A) 羟胺盐酸盐 (B) 2,4-二硝基苯(C) 氨基脲 (D) 苯肼152.下列哪个化合物不能起卤仿反应?(A) CH 3CH(OH)CH 2CH 2CH 3 (B) C 6H 5COCH 3(C) CH 3CH 2CH 2OH (D) CH 3CHO153.下列哪个化合物可以起卤仿反应?(A) CH 3CH 2CH 2OH (B) C 6H 5CH 2CH 2OH(C) CH 3COCH 2CH 2COCH 3 (D) HCHO154.乙醛和过量甲醛在NaOH 作用下主要生成:主要产物是: (A) (B) 155. (C) (D)156. 用格氏试剂制备1-苯基-2-丙醇,最好采用哪种方案? (A) CH 3CHO + C 6H 5CH 2MgBr (B) C 6H 5CH 2CH 2MgBr + HCHO(C) C 6H 5MgBr + CH 3CH 2CHO (D) C 6H 5MgBr + CH 3COCH 3157.:(A) C 6H 5CH 2OH C 6H 5COOH (B) C 5CHOHCH 2COOCOCH 3(C) C 6H 5CH =CHCOOCOCH 3 (D) C 6H 5CH =CHCOOH158.在稀碱作用下,下列哪组反应不能进行羟醛缩合反应?(A) HCHO + CH 3CHO (B) CH 3CH 2CHO + ArCHO(C) HCHO + (CH 3)3CCHO (D) ArCH 2CHO + (CH 3)3CCHO159.COOH C(CH 3)3CH 3COOH COOH COOH CHO C(CH 3)3(D)(C)(B)(A)Cl O 2N NO 23H(A) (HOCH 2)3CCHO (B) C(CH 2OH)4 (C) CH 3CH CHCHO (D) CH 3CHCH 2CHO OH C O CH 3(C 6H 5)2C CH 3 C C 6H 5O C CH 3C 6H 5OH (CH 3)2C C 6H 5CH 3C C 6H 5(CH 3)2C C(C 6H 5)2,H +H 2O C 6H 5CCH 3O C 6H 5CHO +(CH 3CO)2O 3三聚氰胺甲醛树脂常用于制造贴面板,合成原料是:(A) 三聚氰胺与甲醛 (B) 三聚异氰酸与甲胺(C) 尿素与甲醛 (D) 尿素 + 丙二酸酯160.有些醛类化合物可被一些弱氧化剂氧化.Fehling 试剂指的是:(A) AgNO 3和NH 3(H 2O)生成的溶液(B) CuSO 4溶液与NaOH 和酒石酸钾钠生成的溶液(C) CuSO 4溶液与NaOH 和柠檬酸生成的溶液(D) CuSO 4与NH 3水的溶液161.氢化铝锂和硼氢化钠都是常用的氢化金属络合物,当用它们还原醛或酮时,分子中的四个氢原子都能进行反应,这类反应的特点是:(A) 能产生氢正离子 (B) 能产生氢负离子(C) 能产生氢自由基 (D) 铝或硼提供电子162.下列四个反应,哪一个不能用来制备醛:(A) RMgX + (① HC(OEt)3,② H +/H 2O) (B) RCH 2OH + CrO 3/H 2SO 4 蒸馏(C) RCH =CHR + (① O 3,②H 2O/Zn) (D) RCOCl + H 2/Pt163.Clemmensen 还原是用Zn(Hg)/HCl 进行还原,其作用是使 :(A) 羰基成醇 (B) 羰基成亚甲基 (C) 酯成醇 (D) 酯成烃164.Aldol(醛醇、醇醛、羟醛)缩合是用稀酸或稀碱催化,从反应活性中心看,它们是:(A) 一个羧酸酯出羰基,一个醛出α-C(B) 一个羧酸酯出羰基,一个酮出α-C(C) 两个羧酸酯,一个出羰基,一个α-C(D) 两个醛或酮,一个出羰基,一个α-C165.黄鸣龙还原是指:(A) Na 或Li 还原苯环成为非共轭二烯(B) Na + ROH 使羧酸酯还原成醇(C) Na 使酮双分子还原(D) NH 2NH 2/KOH/高沸点溶剂,还原羰基成亚甲基166.下列四个反应,不能用于制备酮的是:167. 根据关键一步确定有机反应属于哪种类型:(A) 亲电反应 (B) 亲核反应 (C) 自由基反应 (D) 周环反应请用A ~D 字母代号判别下列反应:168. CH 3(CH 2)5CHO CH 32)5CH 2OH 应选用什么试剂:(A) Fe + HOAc (B) NH 2NH 2/KOH/二缩乙二醇/ (C) ①Mg(Hg) ②H 2O (D) Na + EtOH169.在下列化合物中,能被2,4-二硝基苯肼鉴别出的是:(A) 丁酮 (B) 丁醇 (C) 丁胺 (D) 丁腈 170.下面反应属于何种缩合反应?(A) Claisen 缩合 (B) Perkin 缩合(C) Dieckmann 缩合 (D) 半缩醛171.下面四个化合物中,能给出银镜反应的是:(A) R 2CHOH,CrO 3/H 2SO 4 (B) RCOCHR'CO 2C 2H 5,①OH -,(2)H 3O +/ (C) ArH,RCONH2/AlCl 3 (D) R 2C =CR 2,①O 3,②H 3O +/Zn HCN (CH 3)2C CH 2COCH 3(CH 3)2C CHCOCH O OOH H O H OCH 3CH O( I ) ( II )( III )( IV )H +O OH H OH CH O(A)Ⅱ (B)Ⅱ,Ⅲ和Ⅳ (C)Ⅰ (D)Ⅱ和Ⅲ172.完成下面的转变,需要哪组试剂??CH 3CH =CH(CH 2)2CH =O ───→ HOOCCH 2CH 2CH =O(A)KMnO 4 (B)(1)EtOH/干HCl (2)KMnO 4 (3)H 3O +(C)K 2Cr 2O 7 (D)HNO3173.下面的氧化反应,用何种氧化剂较好?(A) K 2Cr 2O 7/H + (B) CrO 3·吡啶 (C) Ag(NH 3)2+ (D) 稀、冷KMnO 4174.Tollens 试剂的组成是:(A) CrO 3·吡啶 (B) Cu(OH)2·酒石酸钾 (C) Ag(NH 3)2+·OH - (D) 新鲜 MnO 2175.还原 C =O 为 CH 2 的试剂应是:(A) Na/EtOH (B) H 2N-NH 2/HCl(C) Sn/HCl (D) Zn-Hg/HCl176.下面化合物羰基活性最差的是:(A) PhCHO (B) CH 3CHO(C) PhCOCH 3 (D) CH 3COCH 3177.下面化合物羰基活性最强的是:(A) ClCH 2CH 2CHO (B) CH 3CH 2CHO(C) CH 3CHClCHO (D) CH 3CHBrCHO 178.羟胺与醛酮发生亲核加成的产物是:(A) 腙 (B) 西佛碱 (C) 肟 (D) 缩氨脲179.的产物是:180. 用Mg 将丙酮还原制备频哪醇时, 应选用哪个溶剂?(A) H 2O (B) C 2H 5OH(C)苯 (D)(CH 3)2CH ─OH181.下列化合物中, 哪个化合物有多于1组的等性原子?182.下列哪个化合物的红外光谱不可能出现羟基吸收峰。
中国药科大学有机化学考点

命名—多官能团化合物的命名官能团优先级次序◦―COOH > ― SO3H > -CN > ―C=O(醛) > -CO(酮) > ―OH > ―C=C― > ―C≡C― > ―NH2 > ―OR > ―R > ―X > ―NO2 > ―NO—常见取代基的缩写◦-Ar、-Ph、-Bz……—多取代苯衍生物的命名—萘衍生物的命名—联苯的命名—醌的命名基本概念—大π共轭体系、芳香性、芳烃的分类、Hückle规则、苯衍生物取代基的定位效应—卤代烃的分类、胞二卤代烃、亲核取代反应、瓦尔登转化、底物、离去基团、亲核试剂、亲核性、碱性、—消除反应、扎依采夫规则、E2消除的立体选择性—影响取代与消除反应竞争的因素—常见溶剂的分类◦非极性、极性(质子、非质子极性)—醇的分类、醇的酸性变化规律、醇的取代与消除活性规律、硫醇的酸性、偕二醇—[釒羊]盐、冠醚、PTC(相转移催化剂)—亲核加成反应、半缩醛、缩醛、缩酮—羟胺、肼、苯肼、氨基脲、肟、腙、苯腙、缩胺脲、西佛碱、烯胺、羰基试剂(2,4-二硝基苯肼)—膦叶立德—卤仿反应、羟醛缩合—α,β-不饱和醛酮、醌人名反应—Friedel-Craft烷基化与酰基化—Oppenauer氧化、Meerwein-Ponndorf还原—Williamson醚合成—Wittig反应—Clemmensen还原、Wolff-Kishner-黄鸣龙还原—Cannizzaro反应—Michael加成—Gattermann-Koch反应特殊化合物与试剂—格氏试剂、有机锂试剂—Lucas试剂—Sarret试剂、Jones试剂—Tollen试剂、Fehling试剂—四氢铝锂(氢化铝锂)—DMF、DMSO—频那醇—THF、二氧六环—二缩乙二醇物理性质—卤代烃的密度—醇、醚的沸点、水溶性规律反应机理—亲核取代:SN1/SN2—消除:E1/E2—频那醇重排—羰基的亲核加成—羟醛缩合化学反应—芳香烃◦苯环的亲电取代–硝化、卤代、磺化、傅-克反应–亲电取代的定位规则◦烷基苯侧链的反应–α-卤代、侧链氧化◦稠环芳烃的反应–萘的亲电取代、氧化、还原–蒽与菲9,10位的反应—卤代烃◦亲核取代–形成醇、醚、腈、硫醇、硫醚、硝酸酯的反应–水解、醇解、氨解、卤素交换反应–亲核取代的反应机理,反应动力学、立体化学◦消除反应–反应条件:强碱、低极性溶剂–区域选择性:扎依采夫规则–E2消除的立体选择性:反式共平面◦SN1-SN2/E1-E2之间的竞争◦还原反应(合成时尽量避免)◦与活泼金属的反应、格氏试剂及其应用—醇◦羟基氢的酸性,酸性变化规律◦成酯反应◦亲核取代–与HX反应–条件:酸催化–机理:多SN1,伯醇SN2–反应活性:叔> 仲> 伯< MeOH–Lucas试剂–与PX3/5的反应,与SOCl2的反应(立体化学)–分子间脱水成醚◦消除反应——形成烯烃–反应条件:浓H2SO4或Al2O3–反应机理:E1–活性:烯丙型> 叔> 仲> 伯–区域选择性:扎依采夫规则◦频那醇重排–先生成较稳定的碳正离子–电子云密度较高的烃基更易发生迁移,芳基> 脂肪烃基◦氧化–强氧化剂–选择性氧化剂:Sarret、Jones、MnO2、Oppenauer、HIO4—醚◦醚键的断裂–亲核取代–注意取代历程与断键方向◦环氧化合物的开环反应–酸催化、碱催化历程–酸催化、碱催化下不同的立体选择性–相似的立体选择性:反式开环—醛酮醌◦亲核加成–羰基化合物的活性:电性效应与位阻效应HCHO > RCHO > RCOMe > RCOR’脂肪醛酮> 芳香醛酮–亲核试剂:HCN、NaHSO3、ROH、氨衍生物、金属有机化合物、膦叶立德(Wittig 反应)–反应用途、条件、反应范围……◦α-H的反应–α-卤代–酸催化、碱催化的不同,卤仿反应及其应用–卤仿反应反应范围:甲基醛酮,α-甲基仲醇–羟醛缩合:酸或碱催化,延长碳链–机理:碳负离子-亲核进攻–反应范围:有α-H的醛酮,醛易酮难–分子内缩合:成环–交叉缩合◦氧化:强氧化剂、Tollen、Fehling、Ag2O◦还原到亚甲基–酸性条件:Clemmensen还原–碱性条件:Wolff-Kishner-黄鸣龙还原◦还原到羟基:不同还原条件的选择性–催化氢化,羰基与C=C双键的反应活性–LiAlH4、NaBH4–Meerwein-Ponndorf还原–金属还原,单分子还原,偶联还原–Cannizzaro反应,反应条件,季戊四醇的制备◦α,β-不饱和醛酮的反应–C=C双键对羰基亲核加成的影响–1,2-与1,4-加成–高活性底物、亲核试剂倾向1,2-,反之1,4-–羰基对C=C双键亲电加成的影响–加HX:1,4-加成–加X2、X2/H2O:1,2-加成–Diels-Alder反应◦醌的反应:与α,β-不饱和醛酮类似—卤代烃、醇、醚、醛酮之间的相互转化化合物的常用制备方法—卤代烃◦烯烃、芳烃侧链的α-卤代◦芳环的亲电卤代◦烯、炔与HX、X2的加成◦醇的亲核取代◦卤素交换反应:制备RI—醇◦烯烃水合、卤烃水解◦格氏试剂法—醚◦醇分子间脱水:制备对称简单醚◦Williamson合成法—醛酮醌◦炔的水合或硼氢化-氧化◦烯的臭氧氧化◦胞卤代烃水解◦醇氧化◦芳烃侧链氧化◦傅-克酰基化◦Gattermann-Koch反应:制备苯甲醛类化合物◦醌的制备:酚氧化。
有机化学羧酸ppt课件

•羧酸概述与结构特点•羧酸制备方法及反应机理•羧酸衍生物及其性质研究•羧酸及其衍生物在有机合成中应用目•实验部分:羧酸和它们衍生物性质实验•课程总结与拓展延伸录01羧酸概述与结构特点羧酸定义及分类定义分类结构特点与命名规则结构特点命名规则羧酸的命名通常以烃基为基础,将“酸”字加在烃基名称之后。
例如,甲酸、乙酸、苯甲酸等。
物理性质与化学性质物理性质化学性质02羧酸制备方法及反应机理伯醇氧化醛氧化烯烃臭氧化030201氧化法制备羧酸羧化反应及其机理探讨卤代烃的羧化烯烃的羧化芳烃的羧化其他制备方法简介酯的水解酯在酸性或碱性条件下,可发生水解反应生成羧酸和醇。
酰胺的水解酰胺在酸性或碱性条件下,可发生水解反应生成羧酸和胺。
腈的水解腈在酸性条件下,可发生水解反应生成羧酸和氨。
03羧酸衍生物及其性质研究酯酯是由羧酸与醇反应形成的一类衍生物,具有广泛的生物活性和化学应用。
酯类化合物在自然界中广泛存在,如油脂、蜡等。
酰卤酰卤是一类由羧酸与卤素反应形成的衍生物,具有较强的反应活性。
常见的酰卤有酰氯、酰溴等。
酰胺酰胺是由羧酸与胺反应形成的一类衍生物,具有良好的稳定性和广泛的应用。
酰胺类化合物在生物医药、农药等领域有重要应用。
酰卤、酯、酰胺等衍生物介绍各衍生物间相互转化关系探讨酯向酰胺的转化酰卤向酯的转化酯可以通过还原反应生成相应的酰胺。
这一转化在有机合成中具有一定的应用价值。
酰胺向羧酸的转化衍生物在合成中应用实例分析酰卤在合成中的应用01酯在合成中的应用02酰胺在合成中的应用0304羧酸及其衍生物在有机合成中应用酯化反应在有机合成中作用酯化反应的定义和机理01酯化反应在有机合成中的应用02酯化反应的实例031 2 3酰胺化反应的定义和机理酰胺化反应在有机合成中的应用酰胺化反应的实例酰胺化反应在有机合成中作用其他类型反应在有机合成中应用羧酸的还原反应羧酸的脱羧反应羧酸及其衍生物的其他反应05实验部分:羧酸和它们衍生物性质实验实验目的和原理步骤一步骤二步骤三步骤四注意事项一注意事项二清洗实验器具,整理实验报告注意事项三注意实验过程中的温度变化,避免发生危险注意事项四实验结束后要及时清洗实验器具,保持实验室整洁结果分析一通过红外光谱、核磁共振等手段对合成产物进结果分析二对比不同羧酸衍生物的物理和化学性质,探究其结果分析三讨论一讨论二讨论三实验结果分析和讨论06课程总结与拓展延伸羧酸分子中的羰基和羟基的结构特点,以及它们对羧酸物理和化学性质的影响。
中国药科大学有机化学课件—第十一章 羧酸和取代羧酸

为吸电子基团, 当A为吸电子基团,如:A=COOH, CN, C=O, 为吸电子基团 , , , NO2, CX3, C6H5等时。失羧反应极易进行。 失羧反应极易进行。
芳香羧酸脱羧的几点说明
(1)羧基邻对位有给电子基团的芳香羧酸,在强酸作用 )羧基邻对位有给电子基团的芳香羧酸, 下按负离子机理脱羧。 下按负离子机理脱羧。 中加热即可脱羧。 (2)强的芳香酸不需要催化剂,在H2O中加热即可脱羧。 )强的芳香酸不需要催化剂, 中加热即可脱羧
实 例
O O H H
COOH OH
COOH
O
OH
邻位
诱导吸电子作用大、 诱导吸电子作用大、 共轭给电子作用大、 共轭给电子作用大、 氢键效应吸电子作用大。 氢键效应吸电子作用大。
间位
பைடு நூலகம்对位
诱导吸电子作用中、 诱导吸电子作用小、 诱导吸电子作用中、 诱导吸电子作用小、 共轭给电子作用小。 共轭给电子作用大。 共轭给电子作用大。
COOH NO2 NO2
O2N
H2O
O2N NO2
NO2 + CO2
做催化剂。 (3)一般芳香羧酸脱羧需要用石灰或 做催化剂。 )一般芳香羧酸脱羧需要用石灰或Cu做催化剂
(六) 二元羧酸受热后的反应 六
失羧 (-CO2) 失羰 (-CO)
酸、 酸、α酸、α-羰 羰 受热 羰反应
酸 失
柏
乙二酸、丙二酸(失羧) 乙二酸、丙二酸(失羧) 丁二酸、戊二酸(失水) 丁二酸、戊二酸(失水) 二酸、 二酸、 二酸 ~160℃ ℃ ~300℃ ℃
酯化反应的机制
*1 加成 消除机制 加成--消除机制
双分子反应一 步活化能较高
+
O CH3C-OH
中国药科大学有机化学羧酸衍生物PPT课件

三 还原反应
1 氢化锂铝还原 L=X、OR’、OCOR’
32
2 Rosenmund reduction 3 Bouveault-Blanc reduction
33
4 腈的加氢还原
四 酰胺的特殊反应
(一) 酸碱性 (二) 霍夫曼降解 (三) 脱水反应
34
(一) 酸碱性
碱性
基本没有碱性
弱酸性
+R 'O R C O O+R 'O H
R OH
O
O
N a O H
C H 3 C H 2C 1 8 O C 2 H 5
C H 3 C H 2C O N a
酰氧断裂
+ C2H518OH 15
反应总结:
1.断键方式?
酰氧断裂—因为反应中心是酯基的碳氧双键
2.影响反应的因素:
位阻—因为反应经过了拥挤的四面体中间体
O RCO H - +R 'O H
复习:
皂化反应
H +
R C O O H +H O R ' R C O O R '+ H 2 O
可逆反应如何取得高产率?——进行控制 碱性条件下的反应更容易控制,因为多步反应最 终以不可逆的酸碱反应结束。
14
机理:
O
O
C+ R OR'
OH-
慢
R
C OH OR'
O
快C
O
乙二醇二乙酸酯
O H 2C O C C 15H 31
O H C O C C 15H 31
O H 2C O C C 15H 31
丙三醇三软脂酸酯
大学有机化学课件--羧酸

pKa
3.97
3.97
4.02
15
总目录
C.取代基在邻、间、对位,影响不同
O O-
CH
O
COOH
COOH
pKa 2.98
-I、环
OH
4.08
-I(+C受阻)
OH
4.57
+C>-I
16
总目录
思考
1.按酸性由强至弱排序:
COOH
COOH
CH3 NO2
NO2
COOH
H3C
CH3
NO2
17
总目录
二、羰基的反应
50
总目录
由苯和乙烯合成
+ CH2=CH2 HBr
干醚 CH3CH2Br Mg
+ CH3CH2MgBr CH3CHO H3O KMnO4CH3COCH2CH3
+ Br2 Fe
Br Mg 干醚
MgBr
CH3COCH2CH3
MgBr
H+3O
产物
51
2
总目录
第一节 羧酸的分类和命名
RH
RCOOH 烃中的氢被羧基取代
一、分类
• 根据R的种类分:1)脂肪酸、芳香酸; 2)不饱和酸、饱和酸等。
• 根据羧基的数目分:一元、二元、三元、多 元酸。
3
总目录
二、系统命名法:酸结尾(为母体)
CH3 CH3CHCH2CHCH2COOH
CH3
3,5-二甲基己酸
总目录
2. 二元酸的热分解反应(特征反应)
⑴ 1,2-、1,3-二元酸受热脱羧,得一元酸
COOH COOH
COOH CH2 COOH
大学化学高分子有机化学-第十二章 羧酸

BrCH2(CH2)9COOH
ω -溴十一酸 ω -bromoundecanoic acid
3. 芳香族羧酸的系统命名
COOH OH
邻羟基苯甲酸(水杨酸) 2-hydroxybenzoic acid(salicylic acid)
COOH
NO2
对硝基苯甲酸 4-nitrobenzoic acid
H+
CH3COOC2H5 + H2O
产率: 67% 97%
酯化反应是可逆的,一般只有三分之二的转化率。 提高酯化率的方法: ①使原料之一过量; ②不断移走产物(如除去水)。
成酯的方式有酰氧断裂和烷氧断裂两种方式。
O R C
O R C O
酰氧断裂
OH + H
OR'
H
+
O R C OR' + H2O
CH2CH Cl
CHCH2COOH
CH3CHCHCH2COOH H3C CH3
3,4-二甲基戊酸 3,4-dimethylpentanoic acid
5-氯-3-戊烯酸
5-chloro-3-pentenoic acid
CH3(CH2)7CH
CH(CH2)7COOH
CH3C CHCOOH CH3
9-十八碳烯酸(油酸) 9-octadecenoic acid(oleic acid)
c. a. b.
c. a. b. CH3CH2COOH
a.1.1
c.11.65
b.2.3
§12-3 羧酸的化学性质
羧基是由羰基和羟基组合而成的。
·
sp2杂化
O R C O H
p-共轭
有机化学课件--羧酸

RCOOH + NaHCO 3
RCOONa + H 2O + CO 2
RCOONa + HCl
OH + NaHCO3
RCOOH + NaCl
2019/1/18
羧酸与NaHCO3的反应可以用来与酚类相互区别 有机化学课件
2. 羧酸盐 1) 羧酸盐是固体 2)分子量不太大的羧酸的钠盐和钾盐能溶于水 3)长链羧酸的盐具有去污作用。
RCNH2
PhCOOH + PhNH2
PhCONHPh (84%)
CH3CON(CH3)2
CH3COOH + (CH3)2NH
DCC/THF 0C
o
2019/1/18
有机化学课件
4 . 成酸酐
羧酸加热失水。脱水剂:醋酸酐或P2O5等。
O R R C C O OH OH
P2O5
O R R C C O + H2O O
有机化学课件
二、物理性质
1、状态 C1~ C3是具有强烈酸味和刺激性的水状液体。 C4~ C9是具有腐臭酸味的油状液体。 ≥C10是无味的蜡状固体。 2、沸点
CH3CH2OH HCOOH CH3CH2CH2OH CH3COOH 46 101 60 97 60 118
分 子 量: 46 沸点(0C): 78
第十四章
羧
2019/1/18
酸
有机化学课件
主要内容
第一节 羧酸的命名、物理性质 第二节 酸性 第三节 羧酸的化学反应 第四节 羧酸的制备方法 第五节 羟基酸
2019/1/18
有机化学课件
含有羧基的化合物叫羧酸。羧酸是许多有机化合 物氧化的最后产物,广泛存在于自然界中。 羧酸的分类 根据羧基所连烃基分类 脂肪族羧酸 脂环族羧酸 芳香族羧酸 杂环族羧酸
人民军医版-有机化学-第章-羧酸衍生物PPT课件
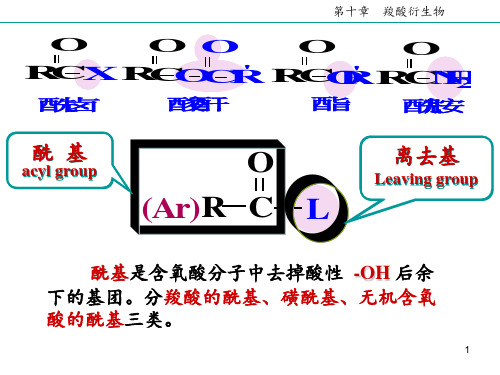
O
OO
O
O
RCX RCOCR ' RCO R ' RCN H 2
酰 卤
酸 酐
酯
酰 胺
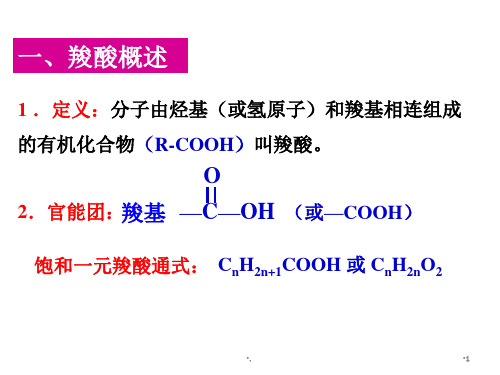
酰基
acyl group
O (Ar)R C L
离去基
Leaving group
酰基是含氧酸分子中去掉酸性 -OH 后余 下的基团。分羧酸的酰基、磺酰基、无机含氧 酸的酰基三类。
.
1
第十章 羧酸衍生物
R
C
+ L: (H-L)
Nu
O
R C Cl
O
O
R C O CR
O
R C OR'
O
R C NH2
H :OH H :OR
O
R C OH
O
H Cl O
H :NH2
R C OR H O C R
H :NHR H :NR2
O
R C NHR H O R '
O
水解醇解氨解 R C OH H N H 2
反应结果是离去基团 L 被亲核试剂 Nu 所取代,故这类反应 称为酰基的亲核取代反应, 也称为酰化反应或酰基转移反应。
.
19
第十章 羧酸衍生物 第二节 羧酸衍生物的性质
O C H 3C C l+2 N H 3
O C H 3C N H 2+ N H 4 + C l-
乙酰胺
OO C H 3C O C C H 3 +
H O
H
N H 2N aO H H 2O H O
NCO+ O C H 3 C H 3C O -
醋 氨 酚 , 退 热 净
O
CH 2 C O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
饱和酸
COOH
4-甲基-3-乙基戊酸
不饱和酸
H3 C H CH3 CH2COOH
(E)-3-甲基-3-戊烯酸 (顺)-3-甲基-3-戊烯酸
脂环酸
COOH
环己酸 环戊基甲酸 环戊烷羧酸
COOH
(1R,3R)-1,3-环己烷二羧酸
COOH
芳香酸——苯甲酸衍生物
H3C COOH
对甲基苯甲酸
COOH OH
芳香酸:(请复习参考酚的酸性) 1.芳环上有吸电子基时,ArCOOH酸性增加。
O2N COOH
>
H3C
COOH
2.芳环上有斥电子基时,ArCOOH酸性减弱。
COOH
>
COOH
3.考虑位置,不要求邻位效应
H3CO COOH
>
>
COOH
H3CO
COOH
场效应
直接通过空间和溶剂分子传递的电子效应。场效应是 一种长距离的极性相互作用,是作用距离超过两个C—C 键长时的极性效应。
O
HOOC(CH2)5COOH
+
H2O
+
CO2
四 制法
(一)氧化法 (复习,自己总结) 1 醇的直接氧化 2 醛的氧化 直接氧化 自身氧化还原 3 环己酮的氧化 4 双三键的氧化 5 甲基酮及其变体的氧化——卤仿反应 注意,该反应生成物特征,比反应物减少一 个碳
(二)腈水解法
RCN + H2O
CH2CN
COOH H3C CH COOH
CH3CH2COOH + CO2
2. C4-C5 脱水成环酐—五、六元环的稳定性
COOH COOH 乙酸酐 O C C O
O
3. C6-C7 :脱羧又脱水,生成环状酮
CH3 CHCH2COOH CH2CH2COOH
Ba(OH)2
H3C O + H2O + CO2
Ba(OH)2
诱导效应的特性在取代酸中得到了充分反映 如:距离效应
如:加和效应
复习:
+I效应强弱次序: (CH3)3C> (CH3)2CH>CH3CH2>CH3>H
-I效应强弱次序: NO2>CN>F>Cl>Br> 炔基> 羰基> COOR>OR>OH>C6H5 > 烯基>H
强调:羟基、烷氧基等集团在无共轭的情况 下只考虑原子的电负性,吸电子。请不要和 苯环等存在p-π共轭下的给电子效应弄混!
羧酸
carboxylic acid
Penicillin-G
一 分类和命名
二 结构和物理性质
三 化学反应
羧酸衍生物的形成反应,酯化反应机理;
β-羰基酸的脱羧反应;二元酸受热时的变 化规律
四 制法
羧酸的制备方法;
一、分类和命名
(一)分类
1.根据烃基结构分类
饱和羧酸 脂肪族羧酸 羧酸 脂环族羧酸 芳香族羧酸
c
COOH
b
COOH
e
OH
a
COOH -Cl
d
COOH
NO2
NO2
CH3
(二)羟基的取代—羧酸衍生物的生成
1 酯化反应
RCOOH + HO R'
O C6H5 C OH + H OCH3
18
H+
+
RCOOR' + H2O
O C6H5 C OCH3 + H2O
18
H
失水的是羧酸的羟基氢。该断裂方式称为酰氧断裂 (Acyl-oxygen cleavage ),不会发生构型翻转。
脱水剂 O O C O C
分子内酸酐
O H H COOH COOH 乙酸酐 H O H O
顺 丁 烯 二 酸 酐
O
O
O
混合酐
C2H5 C2H5 O P2O5
H3C H3C O O
O
CH3COOH + CH3CH2COOH
?
H3C C2H5 O
CH3COONa + CH3CH2COCl
O
类似方法也可以制酯
H CH3COOH + HO C (CH2)5CH3 CH3 H
H
(CH2)5CH3 + H O 2 H3CCOO C CH3
亲核加成-消除反应机理(伯、仲醇):
O H OR' C H OH
O R C OH
H+
O H R C OH
(1)
HOR'
R
四面体构型(2) (典型)!
O H R C OR'
(4)
O OH
不饱和羧酸
O
OH
CH3
COOH
COOH
2.根据羧基数目分类
一元酸 羧酸 二元酸 多元酸
COOH
HOOC COOH
OH HOOCCH2CCH2COOH COOH
(二)命名
1. 俗名
COOH
CH3COOH
HCOOH
COOH
酪酸 安息香酸
俗称 蚁酸 醋酸
2 系统命名
与醛相同。即选择含羧基的最长碳链为主链, 并从羧基碳原子开始,用阿拉伯数字标明主 链碳原子的位次,羧基的位次不用标出,因 为其总在 1 位。简单的羧酸习惯上也常用 希腊字母标位,即以与羧基直接相连的碳原 子位置为 α ,依次为 β 、 γ 、δ ……等,最 末端碳原子可用 ω 表示。O
H+/OHH2O
H2SO4
RCOOH
CH2COOH
105℃
RCOOH
RCN
伯卤 RCl 代烷
生成物比卤烃多一个碳(回忆卤仿反应) 限制:
环上的 卤素无 COOH X 法取代
?
NaCN取 X 代的条件 RR COOH 易消除 R R
R R
(三)格氏试剂法
R- Mg+X + CO2 (Ar) H3O+
碳正离子机理(叔醇)
该历程源于在酸性介质中碳正离子易生成。
OH (CH3)3COH H
+
_ (CH3)3C OH2
H2O
(CH3)3C
O C R'
+
OH C OC(CH3)3
_
R'
H+
O R' C OC(CH3)3 + H+
酰基正离子机理 (不要求)
2 生成酰卤
O 3 R C OH + PCl3
简单的用相应的酸来命名
乙酰基
复杂的用取代的甲酰基来命名
O C
H3C
对甲基苯基甲酰基
二 结构和物理性质
结构
碳原子为sp2杂化 未参与杂化的p轨道与氧上的p轨道形成一个π键
O O
H
碳氧双键和单 键键长有平均 化趋势,但是 并未完全平均 化。
羟基氧原子上占有未共用电子对的p轨道可与羰基 的π键发生p -π共轭 。该共轭对羧酸根的性质 影响很大。
PhCOONa + PhCH2Cl PhCOOCH2Ph
4 生成酰胺
RCOOH
NH3
RCOONH4
O R C NH2 + H2O
RCOOH
HNR'2
RCOONH2R'2
O R C NR'2 + H2O
加热虽然是可逆反应,但可以蒸去水控制反应平衡
CH3COOH + H2N
OH O CH3C H N
扑热息痛
Cl Cl
H O C
O Cl Cl 氯和羧基间隔超 C 但是,氯对酸性 O 过3个碳,诱导效 O 依然有一定影响 应可以忽略。
强
H
弱
因为较近的距离产生的静电引力导致了羧基氢不易电 离。场效应可以发生在多种基团,比如书例的二酸。
和多种碱性物质成盐
CH3COOH + NaHCO3 CH3COONa + H2O + CO2
O R C OH + PCl5
O 3 R C Cl + H3PO3
O R C Cl + POCl3 + HCl
O R C OH + SOCl2
O R C Cl + SO2 + HCl
第三种方法的产物纯、易分离,因而产率高。是 合成酰卤的好方法。
3 生成酸酐
单一酐
COOH 2
乙酰氯、乙酸酐、 P2O5
OH
(三)羧基的还原反应
LiAlH4能顺利地将羧酸还原为伯醇,并且分子中的 双键不受影响。但NaBH4还原性能比LiAlH4弱,不 能用来还原羧酸。
H3CO OCH3 (1) LiAlH4 COOH
CHCH2COOH
H3CO (2) H3O+
① LiAlH4 / Et2O
OCH3
CH2OH
CH2 CHCH2CH2OH
CH2
②H3O+
回忆:醛酮的LiAlH4还原也是两步反应,第二步也 要水解。
(四)α-氢的反应
Hell-Volhard-Zelinsky Reaction
CH3CH2CH2COOH + Br2
红P 或PBr3
CH3CH2CHCOOH + HBr Br
少量红磷催化下发生此反应。反应历程(不要求 )生成酰卤,酰卤卤素的吸电子能力增加了α-氢 的活性。请和生成酰卤的条件区分开! 另,少量碘、硫等也能催化反应,略。
b.p—form dimer by hydrogen bond
O H3C C O H
H O O C CH3
Solubility in water
