有机化学复习要点2012-2013
高中化学高考复习有机化学必记知识点(共48条)

高中化学有机化学必记知识点1、常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、在水中的溶解度:碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但高于65℃任意比互溶。
3、有机物的密度:所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
4、能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物。
能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、CCl4、氯仿、液态烷烃等。
5、能使酸性高锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
6、碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
8、属于取代反应范畴的有:卤代、硝化、磺化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
9、能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(CH2=CHCOOH)及其酯(CH3CH=CHCOOCH3)、油酸甘油酯等。
10、能发生水解的物质:金属碳化物(CaC2)、卤代烃(CH3CH2Br)、醇钠(CH3CH2ONa)、酚钠(C6H5ONa)、羧酸盐(CH3COONa)、酯类(CH3COOCH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)((C6H10O5)n)、蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。
有机化学复习

有机化学复习总结有机化学复习课1.有机化合物的命名2.基本概念与化学性质比较3.完成反应式。
4.有机化合物的分离与鉴别。
5.有机化合物的合成6.有机化合物的结构推导。
1.有机化合物的命名习惯命名法:掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。
系统命名法:基本方法是:选择主要官能团→确定主链位次→排列取代基列出顺序→写出化合物全称。
次序规则:次序规则是各种取代基按照优先顺序排列的规则(1)原子:原子序数大的排在前面,同位素质量数大的优先。
几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H(2)饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推。
常见的烃基优先次序为:(CH3)3C->(CH3)2CH->CH3CH2->CH3-(3)不饱和基团:可看作是与两个或三个相同的原子相连。
不饱和烃基的优先次序为: -C≡CH>-CH=CH2>(CH3)2CH-★次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名★烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出。
★按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基>丁基>丙基>乙基>甲基。
★要点:1. 最低系列——当碳链以不同方向编号,得到两种或两种以上不同的编号序列时,则顺次逐项比较各序列的不同位次,首先遇到位次最小者,定为“最低系列”。
2. 优先基团后列出——当主碳链上有多个取代基,在命名时这些基团的列出顺序遵循“较优基团后列出”的原则,较优基团的确定依据是“次序规则”。
3. 分子中同时含双、叁键化合物(1) 双、叁键处于不同位次——取双、叁键具有最小位次的编号。
大学有机化学复习总结(全)-大学有机化学

大学有机化学复习总结(全)-大学有机化学有机化学是一门非常重要的学科,它涉及到许多领域,如药物研发、材料科学等。
在大学有机化学课程中,我们需要掌握许多基本概念和理论知识,以便更好地理解这门学科。
我们需要了解有机化合物的基本结构。
有机化合物由碳原子和氢原子组成,它们可以通过共价键连接在一起。
有机化合物还可以含有氧、氮、硫等元素。
在学习有机化学时,我们需要掌握不同类型的有机化合物,如烷烃、烯烃、炔烃、芳香烃等。
我们需要了解有机化学中的一些基本反应类型。
例如,加成反应是指两个或多个分子结合在一起形成一个新的分子。
消除反应是指一个分子中的一个键被破坏,同时形成两个新的键。
取代反应是指一个分子中的一个原子被另一个原子或基团所取代。
这些反应类型在有机合成中非常重要,因为它们可以帮助我们设计和构建新的有机化合物。
接下来,我们需要了解有机化学中的一些高级概念和理论。
例如,共轭体系是指一个分子中的π电子云分布在不同的平面上。
这种体系在药物研发中非常常见,因为它们可以影响药物的生物活性和稳定性。
另外,我们还需要了解一些高级的合成方法和技术,如催化反应、高通量筛选等。
我们需要进行有机化学实验来加深对这门学科的理解。
在实验中,我们可以观察到许多有趣的现象和结果,例如产物的颜色、形态等。
这些实验可以帮助我们更好地理解有机化学的理论知识,并且提高我们的实验技能。
大学有机化学是一门非常重要的学科,它涉及到许多领域。
在学习这门学科时,我们需要掌握许多基本概念和理论知识,并且进行相关的实验来加深对这门学科的理解。
希望这篇文章能够帮助你更好地理解大学有机化学这门课程。
大学有机化学期末复习总结

有机化学期末复习总结一、有机化合物的命名命名是学习有机化学的“语言”,因此,要求学习者必须掌握.有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式.1、俗名及缩写:要求掌握一些常用俗名所代表的化合物的结构式,如:木醇、甘醇、甘油、石炭酸、蚁酸、水杨醛、水杨酸、氯仿、草酸、苦味酸、肉桂酸、苯酐、甘氨酸、丙氨酸、谷氨酸、巴豆醛、葡萄糖、果糖等.还应熟悉一些常见的缩写及商品名称所代表的化合物,如:RNA、DNA、阿司匹林、福尔马林、尼古丁等.2、习惯命名法:要求掌握“正、异、新”、“伯、仲、叔、季”等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等.3、系统命名法:系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原则.其中烃类的命名是基础,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视.要牢记命名中所遵循的“次序规则”.4、次序规则:次序规则是各种取代基按照优先顺序排列的规则1原子:原子序数大的排在前面,同位素质量数大的优先.几种常见原子的优先次序为:I>Br>Cl>S>P>O>N>C>H2饱和基团:如果第一个原子序数相同,则比较第二个原子的原子序数,依次类推.常见的烃基优先次序为:CH33C->CH32CH->CH3CH2->C H3-3不饱和基团:可看作是与两个或三个相同的原子相连.不饱和烃基的优先次序为: -C≡CH>-CH=CH2>CH32CH-次序规则主要应用于烷烃的系统命名和烯烃中几何异构体的命名烷烃的系统命名:如果在主链上连有几个不同的取代基,则取代基按照“次序规则”一次列出,优先基团后列出.按照次序规则,烷基的优先次序为:叔丁基>异丁基>异丙基 >丁基>丙基>乙基>甲基.(1)、几何异构体的命名:烯烃几何异构体的命名包括顺、反和Z、E两种方法.简单的化合物可以用顺反表示,也可以用Z、E表示.用顺反表示时,相同的原子或基团在双键碳原子同侧的为顺式,反之为反式.如果双键碳原子上所连四个基团都不相同时,不能用顺反表示,只能用Z、E表示.按照“次序规则”比较两对基团的优先顺序,较优基团在双键碳原子同侧的为Z型,反之为E型.必须注意,顺、反和Z、E是两种不同的表示方法,不存在必然的内在联系.有的化合物可以用顺反表示,也可以用Z、E表示,顺式的不一定是Z型,反式的不一定是E型.例如:CH3-CH2BrC=C 反式,Z型H CH2-CH3CH3-CH2CH3C=C 反式,E型H CH2-CH3脂环化合物也存在顺反异构体,两个取代基在环平面的同侧为顺式,反之为反式.双官能团化合物的命名:双官能团和多官能团化合物的命名关键是确定母体.常见的有以下几种情况:①当卤素和硝基与其它官能团并存时,把卤素和硝基作为取代基,其它官能团为母体.②当双键与羟基、羰基、羧基并存时,不以烯烃为母体,而是以醇、醛、酮、羧酸为母体.③当羟基与羰基并存时,以醛、酮为母体.④当羰基与羧基并存时,以羧酸为母体.⑤当双键与三键并存时,应选择既含有双键又含有三键的最长碳链为主链,编号时给双键或三键以尽可能低的数字,如果双键与三键的位次数相同,则应给双键以最低编号.官能团的优先顺序:-COOH羧基>-SO3H磺酸基 > -COOR酯基>-COX卤基甲酰基 > -CONH2氨基甲酰基 > -CN 氰基> -CHO醛基> -CO- 羰基> -OH醇羟基> -OH 酚羟基 >-SH 巯基> -NH2氨基 > -O- 醚基> 双键 > 叁键4、杂环化合物的命名由于大部分杂环母核是由外文名称音译而来,所以,一般采用音译法.要注意取代基的编号.二、有机化合物的基本反应1、加成反应:根据反应历程不同分为亲电加成、亲核加成和游离基加成.(1)、亲电加成:由亲电试剂的进攻而进行的加成反应.要求掌握不对称烯烃进行亲电加成反应时所遵循的马氏规则,即试剂中带正电核的部分加到含氢较多的双键碳原子上,而负性部分加到含氢较少的双键碳原子上.烯烃加卤素、卤化氢、硫酸、次卤酸、水,炔烃加卤素、卤化氢、水以及共轭双烯的1,2和1,4加成都是亲电加成反应.烯烃进行亲电加成反应时,双键上电子云密度越大,反应越容易进行.2、亲核加成:由亲核试剂进攻而进行的加成反应.要掌握亲核试剂的概念、亲核加成反应的历程简单加成及加成─消除、不同结构的羰基化合物进行亲核加成反应的活性顺序及影响反应活性的因素.羰基化合物与氰氢酸、亚硫酸氢钠、醇、格氏试剂、氨及氨衍生物的加成都是亲核加成反应. 羰基化合物进行亲核加成反应的活性顺序为:HCHO>CH3CHO>RCHO>C6H5CHO>CH3COCH3>RCOCH3>C6H5COCH3>C6H5COC6H53、自由基加成:由自由基引发而进行的加成反应.烯烃在过氧化物存在下与溴化氢进行的加成是自由基加成.不对称烯烃与溴化氢进行自由基加成时得到反马氏规则的产物,即氢加到含氢较少的双键碳原子上.加成反应除上述三种类型之外,还有不饱和烃的催化氢化,共轭二烯的双烯合成等.2、消除反应从一个化合物分子中脱去较小分子如H2O、HX、NH3而形成双键或三键的反应叫消除反应.卤代烃脱卤化氢和醇脱水是重要的消除反应.1、卤代烃脱卤化氢:卤代烃的消除反应是在强碱性条件下进行.不同结构的卤代烃进行消除反应的活性顺序为:三级>二级>一级.要掌握卤代烃进行消除反应时所遵循的查依采夫规则,当卤代烃中不只含有一个β碳时,消除时脱去含氢少的β碳上的氢原子,或者说总是生成双键碳上连有烃基较多的烯烃,亦即仲卤代烷和伯卤代烷发生消去反应时, 主要生成双键上连接烃基最多的烯烃.要注意,卤代烃的消除和水解是竞争反应.2、醇的消除:醇的消除反应在强酸性条件下进行,消除方向也遵循查依采夫规则.要掌握不同结构的醇进行消除反应的活性顺序:叔醇>仲醇>伯醇.3、取代反应根据反应历程的不同可分为亲电取代、亲核取代、游离基取代.⑴、亲电取代:由于亲电试剂的进攻而引发的取代反应称亲电取代反应.苯环上的卤化、硝化、磺化、付氏烷基化和酰基化以及重氮盐的偶合反应等,都是亲电取代反应,萘环和芳香杂环上也能发生亲电取代反应.要注意苯环上有致钝基团时不能进行付氏反应,苯环上进行烷基化时会发生异构化现象.掌握萘环上进行亲电取代反应的规律,第一个取代基主要进入α位,第二个取代基是进入同环还是异环由原取代基的定位效应决定.掌握五员、六员芳香杂环化合物的亲电取代反应以及它们与苯环比较进行亲电取代反应活性的差异,呋喃、噻吩、吡咯进行亲电取代反应的活性比苯大,而吡啶比苯小.⑵、亲核取代由亲核试剂的进攻而引起的取代反应称亲核取代反应.卤代烃的水解、醇解、氰解、氨解,醇与氢卤酸的反应,醚键的断裂,羧酸衍生物的水解、醇解、氨解等都是亲核取代反应.卤代烃的亲核取代反应可按两种历程进行,单分子历程SN 1和双分子历程SN2,伯卤代烃易按SN2历程反应,叔卤代烃一般按SN1历程反应,仲卤代烃则两者兼而有之.要在理解反应历程的基础上掌握不同卤代烃进行亲核取代反应的活性,SN1反应支链越多活性越强,反应速率越快,SN2反应支链越多,反应活性越弱,反应速率越慢.如:下列化合物按SN1历程反应的活性由大到小排序为:CH33CI > CH33CBr > CH32CHBr. 要注意,在碱性条件下卤代烃的取代和消除是互相竞争的反应,叔卤代烃容易发生消除,伯卤代烃易发生取代,强极性溶剂如水有利于取代,而弱极性溶剂如醇和强碱如醇钠有利于消除,高温有利于消除.⑶、自由基取代:由自由基的引发而进行的取代称自由基取代.烷烃的卤代,烯烃和烷基苯的α卤代是自由基取代反应.反应条件是高温、光照或过氧化物存在.自由基的稳定性和中心碳原子上所连的烷基数目有关,烷基越多,稳定性越大.自由基的稳定次序为:三级>二级>一级>·CH34、氧化还原反应包括氧化反应和还原反应两种类型.⑴、氧化反应烯、炔、芳烃侧链以及醇、酚、醛、酮等都易发生氧化反应要掌握几种常用的氧化剂,如高锰酸钾、重铬酸钾的硫酸溶液、氧气空气、臭氧以及托伦试剂、斐林试剂、次卤酸钠等.掌握氧化反应在实际中的应用,如臭氧氧化可用来推测烯烃的结构,托伦试剂和斐林试剂的氧化可用来鉴别醛和酮等.⑵、还原反应 不饱和烃的催化氢化、醛、酮、羧酸及酯还原为醇,硝基苯还原为苯胺等都是还原反应.要掌握几种常用的还原剂,如H 2/Ni 、 Na+C 2H 5OH 、Fe+HCl 、NaBH 4、、 、LiAlH 4、异丙醇/异丙醇铝等,注意后面三种是提供负氢离子的还原剂,只对羰基选择加氢,与双键、三键不发生作用.还要掌握羰基还原为亚甲基的两种方法,注意,进行克莱门森还原时反应物分子中不能存在对酸敏感的基团,如醇羟基、双键等,用伍尔夫─吉日聂尔还原及黄鸣龙改进法时,反应物分子中不能带有对碱敏感的基团,如卤素等.5、缩合反应 主要包括羟醛缩合和酯缩合.1羟醛缩合 含有α氢的醛在稀碱条件下生成β—羟基醛,此化合物不稳定受热容易脱水,生成α、β不饱和醛.因此,此反应常用来增长碳链制备α、β不饱和醛.要求掌握羟醛缩合的反应条件.2克莱森酯缩合 含有α氢的酯在强碱条件下发生克莱森酯缩合,两分子酯之间脱去一分子醇生成β酮酸酯.要掌握反应条件及在实际中的应用,有机合成中广泛应用的乙酰乙酸乙酯就是通过此反应制备的.除了上述五种类型的反应之外,还要求掌握重氮化反应、芳香重氮盐的取代反应、脱羧反应等,注意反应条件、产物及其在实际中的应用.三、有机化合物的转化及合成方法要求掌握有机化合物各类官能团之间的转化关系、增长和缩短碳的方法,在此基础上设计简单有机化合物的合成路线.熟练掌握苯进行付氏烷基化、酰基化、炔化物的烃化、羟醛缩合、格氏试剂法等都可以增长碳链;炔化物的烃化、格氏试剂法及芳香重氮盐等在有机合成中应用非常广泛.1、炔化物的烃化具有炔氢的炔烃与氨基钠作用得炔钠,炔钠与伯卤代烃反应得到烷基取代得炔烃.此反应可增长碳链,制备高级炔烃.2、格氏试剂法格氏试剂在有机合成中应用极为广泛,它与环氧乙烷、醛、酮、酯反应可用来制备不同结构的醇等.这些反应既可增长碳链,又可形成所需的官能团.3、重氮盐取代法芳香重氮盐的重氮基可被氢原子、卤素、羟基、氰基取代,由于苯环上原有取代基定位效应的影响而使某些基团不能直接引入苯环时,可采用重氮盐取代的方法.要注意被不同基团取代时的反应条件.四、有机化学的知识点1、两类定位基:邻对位定位基:使新进入的取代基主要进入它的邻位和对位邻位和对位异构体之和大于60%;同时一般使苯环活化卤素等例外.例如—O-,—NCH32,—NH2,—OH,OCH3,—NHCOCH3,—OCOCH3,—R,—XCl,Br ,I,—C6H5等.间位定位基:使新进入的取代基主要进入它的间位间位异构体大于40%;同时使苯环钝化.例如—NCH33,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CO NH2,—NH3等.2、两类电子基:吸电子基:使电子云密度减小的基团,如-COOH,-COOR,-NO2,-X,-HSO3,-CHO,-CO-R等.供电子基:使电子云密度增大的基团,如-R,-OH,-OR,-NH2,-NHCOR等.3、相同C原子有机物的熔沸点:支链越多沸点越低,对称性越高,熔点越高,如下列化合物沸点由低到高排列为:正戊烷 < 3,3-二甲基戊烷 < 2-甲基己烷 <正庚烷 < 2-甲基庚烷.五、有机化合物的鉴别烯烃、二烯、炔烃及三、四元的脂环烃:溴的四氯化碳溶液,溴腿色含有炔氢的炔烃:硝酸银或氯化亚铜的氨溶液,生成炔化银白色沉淀或炔化亚铜红色沉淀.卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀.醇:与金属钠反应放出氢气鉴别6个碳原子以下的醇;用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化.酚或烯醇类化合物:用三氯化铁溶液产生颜色.苯酚与溴水生成三溴苯酚白色沉淀.羰基化合物:2,4-二硝基苯肼,产生黄色或橙红色沉淀;区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮和芳香醛不能;鉴别甲基酮和具—CH—结构的醇用碘的氢氧化钠溶液,有CH3OH生成黄色的碘仿沉淀.甲酸:用托伦试剂,甲酸能生成银镜,而其他酸不能.胺:区别伯、仲、叔胺有两仲方法1.用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应.2.用NaNO2+HCl:脂肪胺:伯胺放出氮气,仲胺生成黄色油状物,叔胺不反应.芳香胺:伯胺生成重氮盐,仲胺生成黄色油状物,叔胺生成绿色固体.糖:葡萄糖与果糖:用溴水,葡萄糖能使溴水腿色,而果糖不能.麦芽糖与蔗糖:用托伦试剂或斐林试剂,麦芽糖可生成银镜或砖红色沉淀,而蔗糖不能.。
有机化学基础知识点总复习资料

有机化学基础知识点总复习资料有机化学是研究有机化合物及其反应的一门学科。
它是化学中非常重要的一个分支,不仅与生物化学、药物化学等领域密切相关,也在工业生产中得到广泛应用。
以下是有机化学基础知识点的总复习资料。
1. 有机化合物的结构:有机化合物是由碳元素与氢元素及其他元素组成的化合物。
碳元素的四个电子外壳能级使其能够与其他元素形成共价键,从而构成复杂的化合物结构。
有机化合物的基本结构有直链、支链、环状和立体异构等。
2. 功能团:功能团是有机化合物中特定结构的部分,可以决定化合物的性质和反应。
常见的功能团有羟基、羰基、胺基、酮基、酰基等。
不同的功能团会导致有机化合物具有不同的化学性质。
3. 同分异构体:同分异构体是指分子式相同但结构不同的有机化合物。
同分异构体的存在使得有机化合物的种类非常丰富。
常见的同分异构体有结构异构体、空间异构体和性质异构体等。
4. 有机化合物的命名:有机化合物命名有系统命名和常用命名两种方法。
系统命名是根据化合物的结构和功能团来命名,常用命名则是使用常见的化合物名来命名。
常见的命名方法包括IUPAC命名法和功能团命名法。
5. 有机化合物的物理性质:有机化合物的物理性质包括熔点、沸点、溶解度等。
这些性质受到分子间力的影响,如氢键、分子间作用力等。
不同的分子结构和功能团会导致有机化合物具有不同的物理性质。
6. 有机化合物的化学性质:有机化合物的化学性质主要表现为它们能够发生反应,并在反应中产生新的化合物。
常见的有机化学反应包括酯化、醇酸酸解、氧化还原反应等。
不同的功能团和结构会决定有机化合物的反应性质。
7. 反应机理:反应机理是研究有机化合物反应过程的重要内容。
它是通过观察反应速率、催化剂和中间体等信息,来推测反应的步骤和反应物之间的作用方式。
反应机理对于理解有机反应的本质和预测反应结果非常重要。
8. 烯烃的反应:烯烃是一类含有双键的有机化合物,它们具有丰富的反应性质。
烯烃的常见反应包括加成反应、聚合反应、环加成反应等。
有机化学考研复习知识点总结

有机化学考研复习知识点总结●一、有机化合物命名●1、系统命名法●饱和碳原子和氢原子的分类:碳原子(伯、仲、叔、季),氢原子(伯、仲、叔)●烃基的名称:常用烃基的名称及缩写,如:甲基(Me-)、乙基(Et-)、正丁基(n-Bu-)、苯基(Ph-)、芳基(Ar-)等。
●系统命名法原则及各类有机化合物的命名:选择含特征官能团的最长碳链作主链,从靠近官能团的一端开始编号,取代基命名时排序按“次序规则”。
●2、顺、反异构体命名●顺、反命名法:两个相同基团在双键同侧的为顺式,异侧的为反式。
●Z、E命名法:按‘次序规则’,优先基团在双键同侧的为Z型,异侧的为E型。
●3、含手性碳原子的手性分子命名● R、S命名法:手性碳原子(C*)构型的确定,先将连在手性碳原子上的四个原子或基团按“次序规则”排序,将次序最低的基团远离观察者,其余三个基团的次序由大到小为顺时针排列时,记为‘R构型’,逆时针排列记为‘S构型’。
●4、多官能团化合物的命名●当化合物中含有多个官能团时,应选取其中的一个作为母体官能团,其余的官能团作为取代基(个别有例外)。
●一些母体官能团按以下出现的先后顺序进行选择:—COOH,—SO3H,—COOR,—COCl,—CONH2,—CN,—CHO,-C=O,—OH,—SH,—NH2,—C≡C—,—C=C—,—OR,—R,—X,—NO2。
●例如:CH3COCH2CH2CH2CH2OH 6-羟基-2-己酮;CH2=CHCH2CH2C≡CH1-己烯-5-炔。
●5、一些常用见化合物的习惯名称(俗名)或名称缩写●如:氯仿、季戊四醇、肉桂醛、苦味酸;THF、NBS、TNT、DMSO、DMF等。
●二、有机化合物结构●1、同分异构●异构体类型:构造异构(碳链、官能团位置、官能团);立体异构(构象、顺反、对映)。
●异构体书写:常见或结构较为简单化合物的同分异构体。
如写分子式为C5H10、C5H12的同分异构体等。
●互变异构现象:酮式—烯醇式结构的互变异构、糖类链状与环状结构互变异构等。
2013年有机化学专题复习

2013年有机化学专题复习一、有机分子中常见的价键结构二、官能团——决定有机物分子化学性质的原子或原子团官能团与有机物性质的关系:1.碳碳双键结构()(1)加成反应:与H 2、X 2、HX 、H 2O 等; 主要现象:烯烃使溴的四氯化碳溶液褪色(2)氧化反应:①能燃烧; ②被酸性KMnO 4氧化,使KMnO 4酸性溶液褪色(3)加聚反应: 碳碳双键中的一个碳碳键断开后首尾连接,形成长碳链2.碳碳三键结构()(1)加成反应:(与H 2、X 2、HX 、H 2O 等), 主要现象:烯烃使溴的四氯化碳溶液褪色(2)氧化反应:①能燃烧; ②被酸性KMnO 4氧化,使KMnO 4酸性溶液褪色3.(1)取代反应:①在铁为催化剂下,与溴取代, ②浓硫酸下,硝化反应(2)在催化剂下,与氢气加成4.卤原子结构(-X )(1)水解反应(取代):条件——NaOH 的水溶液,加热(2)消去反应,条件:NaOH 的醇溶液,加热;连卤原子碳的邻位碳至少有一个氢5.醇-OH(1)与活泼金属(Al 之前)的反应:如:2R -OH+2Na→2RONa + H 2↑(2)氧化反应:①燃烧 ②催化氧化,条件:催化剂,连接-OH 的碳至少连一个氢(3)消去反应:条件:浓H 2SO 4作催化剂,加热,连羟基碳的邻位碳至少有一个氢(4)酯化反应:条件:浓H 2SO 4作催化剂,加热6.酚-OH(1)弱酸性:①与活泼金属反应放H 2②与NaOH :O H ONa NaOH OH 2+→+322NaHCO OH CO O H ONa +→++ (酸性:H 2CO 3>酚-OH>HCO 3-)(2)取代反应:苯酚与浓溴水反应生成三溴苯酚白色沉淀。
(3)与FeCl 3的显色反应:苯酚溶液遇FeCl 3显紫色。
7.醛基()(1)与H 2加成反应:R -CHO +H 2 RCH 2OH (制得醇)—C —H O ‖—C ≡C — —C =C — ︱ ︱ X — —N — | H — —O — ︱ —C — ︱ 催化剂 △(2)氧化反应:①催化氧化:2R -CHO +O 22 RCOOH (制得羧酸)②银镜反应:与银氨溶液反应 试管内壁产生光亮如镜的银③被新制Cu(OH)2氧化。
有机化学基础复习提纲

有机化学基础复习提纲一、烯烃和炔烃:-C — -C C —1、氧化反应CnH 2n+()O 2nCO 2+nH 2OCnH 2n-2+()O 2nCO 2+(n -1)H 2O②能使溴水和酸性KMnO 4溶液褪色。
2、加成反应:可与H 2 、HX 、 H 2O 、 HCN 加成。
完成下列反应: RCH=CHR /+XRCH CHR /+X 2RCH CHR /+2X与HX 加成时,H 加在含H 较多的C 上。
即马氏规则。
3、加聚反应: nCH 2=CH 2nCH 2=CH-CH=CH 2CH CH + HClnCH 2=CHCl4、结构特点及实验室制取制CH2=CH2的反应原理:同类反应:RCH 2CH 2OHRCH=CH 2 + H 2O制CH CH 的反应原理:同类反应:ZnC 2+2H 2O Zn(OH)2+C 2H 2↑ Mg 2C 3+4H 2O2Mg(OH)2+C 3H 4↑(复分解反应原理,元素化合价不变)原子空间结构特点:与碳碳双键碳直接相连的原子与双键碳在同一个平面上;与碳碳三键直接相连的原子与三键碳在同一条直线上。
5、特殊物质:1,3-丁二烯: CH 2=CH —CH=CH 2 异戊二烯: CH 2=C —CH=CH 2二、苯及其同系物通式:CnH 2n -6 (n ≥6)苯:C 6H 6 正六边形,与苯环直接相连的原子与苯环碳在同一平面内。
性质:1、取代反应:A 、溴代反应:液溴、Fe 作催化剂(或FeBr 3作催化剂)+ Br 2B 、硝化反应:浓HNO 3 浓H 2SO 4 水浴加热+ HNO 3 +3HNO 3注:发生在邻、对位上的取代。
C 、磺化反应:浓硫酸、水浴加热 +H 2SO 4(浓)X 2发生取代反应时,若光照条件则发生在侧链上,若催化条件则发生在苯环上。
+Cl +HCl+Cl 2+HCl2、加成反应(只与H 2 、Cl 2加成) +3H 23、氧化反应:A 、燃烧生成CO 2和H 2OB 、苯不能使酸性KMnO 4溶液褪色,苯的同系物能使KMnO 4/H +褪色,但不能使溴水褪色。
有机化学_复习提纲

有机物复习提纲一、烃:(一)代表物:甲烷、乙烯、乙炔、苯、甲苯。
(二)分子式、电子式、结构式、结构简式。
(三)分子结构。
(四)物理性质。
(五)化学性质:1、氧化反应:(1)与氧气反应:都能燃烧,但现象不同:甲烷:没有烟→乙烯:火焰明亮、黑烟→乙炔:火焰明亮、浓烈的黑烟→苯:火焰明亮、浓烈的黑烟。
(2)与酸性高锰酸钾反应:甲烷、苯不能反应。
乙烯、乙炔、甲苯能反应。
2、取代反应:(1)甲烷与氯气发生的取代(五种产物,其中两种为气体,另三种为液体)。
化学方程式:(2)苯:①与液溴发生取代反应,生成密度比水大、不溶于水的溴苯。
化学方程式:注意:苯不与溴水反应,但能发生萃取②硝化反应(与浓硝酸、浓硫酸,加热),生成无色、有毒、密度比水大、不溶于水的硝基苯。
化学方程式:(3)甲苯:与浓硝酸、浓硫酸发生硝化反应生成三硝基甲苯(淡黄色不溶于水的晶体,又叫TNT或黄色炸药,所以甲苯、硝酸都是制取工业用炸药的原料)。
化学方程式:3、加成反应:①乙烯可以加溴、氢气、氯化氢、水。
化学方程式:②乙炔可以加溴、氢气、氯化氢。
化学方程式:③苯可以加氢气。
化学方程式:(六)用途:1、甲烷:燃料,合成氨。
2、乙烯:制塑料、催熟果实。
3、乙炔:氧炔焰用于焊接与切割金属。
4、苯、甲苯:合成原料,有机溶剂。
(七)实验室制法:1、乙烯:乙醇与浓硫酸共热到170℃(浓硫酸的作用:催化剂和脱水剂),反应类型:消去。
化学方程式:注意:温度计的球泡要插入液面以下。
2、乙炔:电石(CaC2)与水反应(所以乙炔俗称为电石气),化学方程式:,反应类型:复分解。
注意事项:1、电石中常含有硫化钙、磷化钙等杂质,所以制得的乙炔常有特殊的臭味(硫化氢、磷化氢),去除方法:用氢氧化钠溶液。
2、实际操作中常用饱和食盐水代替水,用块状电石代替粉末状电石,这是为了减慢反应速率以得到平稳的乙炔气流。
3、常在导管口附近塞少量棉花,这是为了防止电石与水剧烈反应生成的泡沫进入导管。
《有机化学》理论知识要点归纳

《有机化学》理论知识要点归纳一.有关“吸电子基和给(推)电子基”问题从极性、诱导效应、共轭效应等方面考虑,一般情况下,电子云密度大的为给电子基,极性大的为吸电子基。
例如碳碳双键、苯基等为给电子基,卤素原子、-CN 、硝基等为吸电子基。
取代基如果是像-NO 2(-SO 3H 、-COOH 、-CHO )这样的,就是与碳相连的元素的原子比氧的电负性弱(就是该元素原子得电子的能力没有氧强的时候,该元素原子的电负性比氧弱)而且还连有氧的时候,就是吸电子基,因为氧把那些元素原子的电子云向氧的一方吸引,使得那些元素把苯环上的电子向它们吸引,导致苯环的电子密度降低,因为苯上的取代反应都是自由基反应,自由基有单电子,苯环的电子密度降低自然使苯不容易放出氢自由基(就是氢原子),使得苯环钝化。
卤素具有吸电子的诱导效应,从而降低碳正离子的稳定性。
这一效应在苯环上各个住置受到进攻时都有体现,但在卤素的邻、对位受到进攻时更为显著。
二.有机反应试剂的分类1.自由基试剂:自由基:由共价键均裂所产生的带有独电子的中性基团。
自由基试剂:能产生自由基的试剂是自由基试剂。
例如:CH 4CH 3 Cl+ HClh νCl 2(氯自由基)2Cl 光或热R O O R2 RO常见的自由基试剂:X 2、过氧化物(R -O -O -R )、偶氮化物(R -N =N -R )等,高温、光照等条件也可引发自由基反应。
因自由基带有未共用电子,所以性质活泼,可引发自由基型反应。
2.亲电试剂在反应过程中,如果试剂从有机化合物中与它反应的那个原子获得电子对,并与之共有形成化学键,这种试剂称做亲电试剂。
亲电试剂是缺电子的试剂。
例如:RCH 2Cl + AlCl 3R +CH 2AlCl 4-亲电试剂常见的亲电试剂有:①正离子,如H +,C +,Cl +、Br +、I +,NO 2+等;②可接收孤对电子的分子,如如AlCl 3、FeCl 3、ZnCl 2、SnCl 4、SbCl 3、BF 3等Lewis 酸;③羰基碳原子等。
有机化学精讲资料(复习攻略)

第一部分命名一、通用规则1.选取含官能团在内的最长碳链作为主链。
若存在两条或两条以上等长的最长碳链,选择取代基数目最多的一条作主链。
2.用天干(甲乙丙丁戊己庚辛壬癸)代表主链碳原子数,写在母体名称之前,如甲烷,乙烯,丙炔,丁醇,戊酸等3.从距离官能团最近的一端开始,对主链进行编号(卤烃除外,X视为取代基)。
若有两种或两种以上编号方法,以及对于不含有官能团的烷烃,以取代基所在位次之和最小为原则,进行编号。
4.将各取代基的位次和名称写在母体名称之前。
以阿拉伯数字标明取代基位次,并以“-”与基名相连,如2-甲基;相同的取代基合并写出,位次按由小到大次序列出,并以“,”隔开,同时在基名前以汉字标明该取代基总数,如2,2,4-三甲基;不同取代基按“次序规则”(见附录)进行排列,较优基团后列出;不同取代基之间以“-”连接,最后一个基名与母体名称间无“-”,如2-甲基-3-乙基辛烷5.对于存在官能团位次异构的化合物,需要在取代基与主体名称之间以“-取代基位次-”的形式标明取代基位置,其中取代基位次以阿拉伯数字写出,双键、三键位次以成键C原子中较小位次为准,如2-甲基-3-戊醇,2-甲基-2-丁烯6.含有多个同种官能团时,按由小到大的次序依次列出官能团位次,并以“,”隔开,同时在母体名称前以汉字表明官能团总数,如1,3-丁二烯,2,4-庚二酮,对苯二酚,乙二酸,丙三醇*7.多官能团化合物命名时,按下式所列的优先级次序,以优先级较高的官能团作母体,优先级较低的官能团作取代基(—X和—NO2只能作取代基)—COOH>—COOR>—CN>—CHO>—C=O>—OH(醇)>—OH(酚)>—NH2>醚)>—R碳链编号时以母体官能团位次最低为原则,如3-戊烯-1-炔,4-戊酮醛二、特殊化合物命名及位次规则1.螺环化合物根据组成环的碳原子总数命名为“某烷”,加上词头“螺”。
有机化学复习总结

有机化学复习总结有机化学复习总结⼀、试剂的分类与试剂的酸碱性(free 在⾃由基反应中能够产⽣⾃由基的试剂叫⾃由基引发剂1、⾃由(游离)基引发剂,产⽣⾃由基的过程叫链引发。
如:radical initiator)或⾼温hv 或⾼温hv BrCl2Br2Cl22均裂均裂是⾃由基引发剂,此外,过氧化氢、过氧化苯甲酰、偶氮⼆异丁氰、过硫酸铵等也是BrCl、22常⽤的⾃由基引发剂。
少量的⾃由基引发剂就可引发反应,使反应进⾏下去。
简单地说,对电⼦具有亲合⼒的试剂就叫亲电试剂(electrophilic reagent)2、亲电试剂轨道或d轨道,能够接受电⼦对的中性分⼦,亲电试剂⼀般都是带正电荷的试剂或具有空的p+、BFAlCl等,都是亲电试剂。
、HCH、如:HCl、Br、RCH、CO、NO、SO、3323323,++++++SO因此,路易斯酸就是Lewis acid)在反应过程中,能够接受电⼦对试剂,就是路易斯酸(亲电试剂或亲电试剂的催化剂。
对电⼦没有亲合⼒,但对带正电荷或部分正电荷的碳原⼦具有亲合⼒的试剂叫3、亲核试剂。
亲核试剂⼀般是带负电荷的试剂或是带有未共⽤电⼦对的中nucleophilic reagent亲核试剂()----------、、、CN、NH、RCHRO、RS、PhO、H、ORCOO、XHS性分⼦,如:OH、222等,都是亲核试剂。
、NH、RNHROH、ROR23,因此,路易斯碱也是在反应过程中,能够给出电⼦对试剂,就是路易斯碱(Lewis base)亲核试剂。
4、试剂的分类标准Br→CH OCH 在离⼦型反应中,亲电试剂和亲核试剂是⼀对对⽴的⽭盾。
如:CHONa + CH3333-++-是亲核试剂。
这个反应究竟是亲和BrO是亲电试剂,⽽的反应中,+ NaBrNa和CHCH33反应还是亲核反应呢?⼀般规定,是以在反应是最先与碳原⼦形成共价键的试剂为判断标准。
--是亲核试剂,因此该反应属于亲CH在上述反应中,是O最先与碳原⼦形成共价键,OCH33核反应,更具体地说是亲核取代反应。
有机化学实验复习要点

有机化学实验复习要点有机化学实验复习要点实验一熔点的测定(萘)1. 所用仪器:b型管,温度计,毛细管,酒精灯2. 操作步骤:⑴封管,要求封的紧密,光滑。
⑵装样:装样2-3毫米高,注意擦净管外的样品,装实,为装实要将样品研细。
⑶温度计与毛细管的固定,样品应在温度计水银球的中间,注意乳胶圈不要浸在传热介质中。
⑷向b型管中加导热物质(传热介质),注意传热介质液面应在b型管上叉口处。
⑸装仪器,注意十字夹(铁拳)、活夹(铁夹)的使用,十字夹缺口向上。
塞子缺口、温度计刻度应朝前方,便于观察温度的变化。
同时注意固定b型管的位置,不要夹在b型管的两个岔口之间。
加热的位置。
⑹粗测:找出熔点范围。
⑺精测:加热速度,开始升温5-6度/分,当低于熔点10-15度时,调整加热速度,以1-2度/分为宜,越接近熔点,升温越慢。
⑻读数,记下初熔和全熔的温度值,该化合物的熔程即:初熔——全熔,温度的读数应保留小数点后一位,如81.5;81.0。
⑼重测时应注意:热浴应冷却到样品近似熔点以下30度左右;再次放熔点管时,要擦去温度计上的液体石蜡;熔点管不能重复使用,因为有些物质受热会分解,有的可能转变成具有不同熔点的其它结晶形式。
3. 存在的问题:(1)样品量(2-3毫米),多数加的过多。
(2)样品管的长度要和b型管匹配,有的过长或短。
(3)橡皮圈不要浸到传热介质中,有的没入其中。
(4)温度计、样品管的位置有人放的不对。
(5)传热介质的量有放的过多。
实验二苯甲酸的重结晶1. 所用仪器:布氏漏斗、吸滤瓶、循环真空泵。
2. 操作步骤即重结晶的过程:①溶剂的选择:苯甲酸的重结晶用水。
②饱和溶液的制备:注意溶剂的量(应了解该化合物的溶解度),千万不能制成过饱和溶液,以防热过滤时损失。
苯甲酸3克,水加大约120毫升。
③脱色:用活性炭脱色,应注意沸腾时不能加入活性炭,活性炭应加粗品的1%-5%。
④热过滤:目的除去不溶性的杂质。
热过滤时注意保温、滤纸的折法。
有机化学复习知识要点

编辑ppt
②苯酚在苯环上发生取代反应(卤代,硝 化,磺化)的位置:邻位或对位。
③酚与醛发生缩聚反应的位置:邻位或对 位。
检验:遇浓溴水产生白色浑浊或遇FeCl3 溶液显紫色;
编辑ppt
7、醛基:
氧化与还原 R-CH2OH H2 R-CHO O2 R-COOH 检验 ①银镜反应; ②与新制的Cu(OH)2悬浊液共热。
(3)氧化
延伸:
2. C=C
3.苯环;取代,(卤化、磺化、硝化)
加成。
编辑ppt
苯环有关反应的延伸:
(1)引入氨基:
先引入-NO2 还原 NH3;还原剂:Fe+HCl
(2)引入羟基:
先引入-X 水解 -ONa 酸化 -OH
(3)引入烃基:+RCl 酸性KMnO4 -R
(4)引入羧基:
先引入-R 酸性KMnO4 -COOH
编辑ppt
4. R-X :
水解:
2R-X+NaOH
R-OH+NaX
醇解:
R-CH2-CH2-X+NaOH R-CH=H2+NaX+H2O
编辑ppt
5.醇羟基:
2R-OH+2Na 2R-ONa + H2 2R-OH+HX 加热 R-X+H2O R-CH2OH O2催化剂 RCHO O2催化剂 R-COOH R-OH+ 2R1-COOH 浓硫酸,加热R1-CO-OR+H2O R-OH+HO-NO2 浓硫酸,加热R-ONO2+H2O R-CH2-CH2OH 浓硫酸,加热R-CH=CH2+H2O 多个羟基遇Cu(OH) 2溶液呈绛蓝色
(2)引入─OH: ①卤代烃水解; ②醛或酮加氢还原; ③C═C与H2O加成。
有机化学复习总结

2、α—氢反应
1)羟醛缩合(具有α—氢的醛,稀碱催化, 生成β-羟基醛或α,β-不饱和醛) 注意:碳链的连接方式:α—C与羰基碳
交叉羟醛缩合 :
一种具有α—氢的醛而另一种 没有α—氢的醛之间可以进行羟醛缩合
2)α—氢卤代
生成卤代醛酮 ,如丙酮+Cl2/CH3COOH
甲基醛酮(CH3CO—R)与I2-NaOH溶液反应生成 黄色沉淀,用于鉴别;特别注意部分醇也可以反应)
2、生成羧酸衍生物:4类羧酸衍生物的制备
3、α—氢卤代:Cl2 / P 4、脱羧反应:
NaOH-CaO条件下脱羧 β-二羧酸的脱羧反应 (包括β-羰基羧酸的脱羧反应)
5、甲酸:银镜反应; 草酸:被KMnO4氧化(KMnO4退色)
四、制备:
1、醇氧化;
2、卤代烃与氰化钠作用后的产物水解 3、Grignard试剂与CO2作用
3、α —氢反应: 卤代(500℃) :制备卤代烃
二、烯烃的来源与制备 1、石油裂化气 2、卤代烃脱卤化氢 (NaOH—醇,加热: 查衣采夫规则) 3、醇脱水(酸催化:查衣采夫规则) 二烯烃和炔烃 一、二烯的化学性质
1、1,4-加成和1,2-加成(两种产物); 制备卤代烃
2、双烯合成( 共轭二烯与顺酐反应,生成沉淀: 鉴别双烯 二、炔烃的化学性质 1、加成反应:
3、与金属镁反应(Grignard试剂生成)
Grignard试剂的应用:重要
乙烯型卤代烃(特别不活泼, 不容易发生取代反应)
第九章:醇、酚 醇 一、命名 二、物理性质:分子间氢键,沸点较高
三、化学性质:
1、酸碱性(Na反应,放出气体; 与浓硫酸反应:可用于鉴别) 2、与HX反应生成卤代烃(HCl-ZnCl2;HBrH2SO4;HI;PCl3;PCl5。用HCl-ZnCl2鉴别伯、 仲、叔醇)
有机化学知识点总结超全完整版

有机化学主要考点第一部分 烃一、烷烃。
通式C n H n 2+2能发生取代反应,例如CH 4+Cl 2 光 CH 3Cl +HCl 。
(条件:C12、Br 2、光照) 二、烯烃。
通式:C n H n 2 二烯烃通式为C n H 22-n 官能团: C=C (碳碳双键)、CH 2=CH 2六个原子共面。
性质:①氧化反应:烯烃能使KM n O 4(H +)的紫红色褪去。
②加成反应:烯烃能使溴的四氯化碳红棕色褪去。
(或溴水)CH 2=CH 2+B 2r →③加聚反应:烯烃能发生加聚反应。
例如:n CH 2=CH 2催化剂[2-CH 2]n三、炔烃。
通式:C n H 22-n HC ≡CH 四个原子共直线,官能团:-C ≡C-性质:与烯烃的性质类似,比如能发生 ①氧化反应 ②加成反应 ③加聚反应 四、芳香烃。
苯和苯的同系物的通式:C n H 62-n (n ≥6) 分子中12个原子共平面。
苯的性质:①取代反应 +B 2r (l ))(Fe 催 –B r +HB r (B 2r 的水溶液不发生此反应)+HO-NO 242SO H 浓 -NO 2+H 20 (也叫硝化反应)②加成反应: +3H苯的同系物的性质,比如甲苯3CH ①氧代反应:能使KMn O 4(H+)溶液褪色②取代反应33HONO220第二部分 烃的衍生物一、卤代烃。
(官能团-B r )性质:①取代反应(水解反应)C 2H 5-B r 2H 5-OH+HB r 或C 2H 5B r +N a 2H 5OH +N a B r 。
②消去反应:C 2H 5 B r + N a 2H 4(CH 2= CH 2)+ N a B r +H 2O或写成:C 2H 5 B 2=CH 2 +HB r二、醇。
官能团:-OH 饱和一元醇的通式:C n H 22+n O 。
饱和x 元醇的通式:C n H 22+n O x 性质:①(催化)氧化反应:2CH 3CH 2OH +O 23CHO +2H 2O (醇的特征:“-CH 2OH ”)②消去反应:C 2H 52= CH 2 +H 2O③酯化反应:C 2H 5OH+CH 3COOH 42SO H 浓 +H 2O C 2H 5OOCCH 3(先写水,避免漏掉) ④与N a 反应。
有机化学复习要点

有机化学复习要点有机化学是研究有机物(含碳的化合物)的合成、结构、性质和反应的科学。
下面是有机化学复习的重点要点:1.有机化合物的分类:根据碳的连接方式,有机化合物可分为链状、环状和支链状化合物。
根据它们的官能团,化合物可以被进一步分类为醇、酮、酯、醛、酸、胺等等。
2.有机化合物的命名:有机化合物的命名是有机化学的基础。
在命名时,需要确定主链、编号碳原子、标记官能团和提供适当的前缀和后缀。
3.有机化合物的构造:有机化合物的构造表示确定其分子的原子结构,包括原子的类型、化学键的类型(单键、双键、三键)和宇称等。
4.共价键的极性:共价键是由两个原子之间共享电子形成的,极性共价键指电子不均匀地共享。
这导致一侧带有部分正电荷,而另一侧带有部分负电荷,形成极性分子。
5.引入官能团:官能团是有机化合物中特定原子或原子组合的集合,确定化合物的性质和反应。
常见官能团有羟基(-OH)、醛基(-CHO)、酮基(-C=O)、羧基(-COOH)、胺基(-NH2)等等。
6.有机反应的基本原理:有机反应是有机化学的核心,包括加成反应、消除反应和取代反应。
加成反应是指在化合物中添加一个原子或基团;消除反应是指分子中的两个基团消除,形成一个双键或三键;取代反应是指一个基团被替换成另一个基团。
7.重要的有机反应:有机化学有许多重要的反应,其中一些包括酯化、醇酸化、加氢、亲电取代、亲核取代、还原和氧化等等。
了解这些反应及其机理对于理解有机化学非常重要。
8.常见的有机化学术语:在有机化学中,有许多常见的术语和概念,例如:轴手性、对映体、立体异构体、环状化合物等等。
了解这些术语可以帮助理解和解决有机化学问题。
9.溶剂的选择:在有机化学实验中,溶剂的选择非常重要。
常见的有机溶剂包括乙醇、丙酮、乙醚、二甲基甲酰胺等等,选择合适的溶剂可以促进反应的进行。
10.立体化学:立体化学涉及分子和化合物的空间构型和对称性。
手性和立体异构体是立体化学的重要概念,影响分子的性质和化学反应。
有机化学复习要点
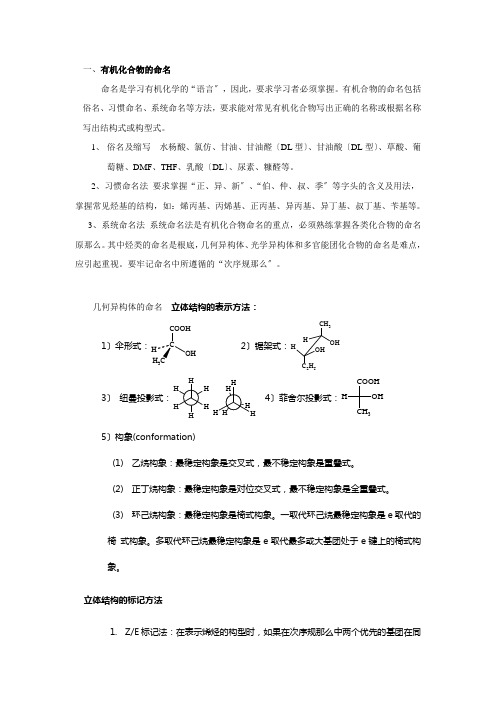
一、有机化合物的命名命名是学习有机化学的“语言〞,因此,要求学习者必须掌握。
有机合物的命名包括俗名、习惯命名、系统命名等方法,要求能对常见有机化合物写出正确的名称或根据名称写出结构式或构型式。
1、 俗名及缩写 水杨酸、氯仿、甘油、甘油醛〔DL 型〕、甘油酸〔DL 型〕、草酸、葡萄糖、DMF 、THF 、乳酸〔DL 〕、尿素、糠醛等。
2、习惯命名法 要求掌握“正、异、新〞、“伯、仲、叔、季〞等字头的含义及用法,掌握常见烃基的结构,如:烯丙基、丙烯基、正丙基、异丙基、异丁基、叔丁基、苄基等。
3、系统命名法 系统命名法是有机化合物命名的重点,必须熟练掌握各类化合物的命名原那么。
其中烃类的命名是根底,几何异构体、光学异构体和多官能团化合物的命名是难点,应引起重视。
要牢记命名中所遵循的“次序规那么〞。
几何异构体的命名 立体结构的表示方法:1〕伞形式:C COOH OH 3 2〕锯架式:CH 3OH H H OHC 2H 53〕纽曼投影式: 4〕菲舍尔投影式:COOH CH 3OH H5〕构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法1. Z/E 标记法:在表示烯烃的构型时,如果在次序规那么中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3C C H C 2H 5CH 3C C H 2H 5Cl (Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,那么为顺式;在相反侧,那么为反式。
CH 3C C H CH 3H CH 3C C H H CH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规那么排序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Free Radical Initiation(自由基引发
反马氏加)
Anti-Markovnikov Addition
Indirect Hydration 间接水合
• Oxymercuration-Demercuration(羟汞化
-脱汞反应)
– Markovnikov product formed(马氏加成) – Anti addition of H-OH(反式) – No rearrangements(没有重排)
• •
• •
•
•
用中文或英文系统命名法命名下列化合物或根据名 称写出结构式。注意R,S以及Z,E命名(本题共6小 题,每小题2分,共12分) 简略回答问题。(本题共8小题,每小题3分,共24 分) 完成反应写出主要产物。(本题共12小题,每小题 2分,共24分) 用化学方法区别各组化合物。(本题共2小题,每 小题6分,共12分) 推测化合物的结构。(本题共2小题,每小题6分, 共12分) 以指定原料合成化合物(本题共4小题,每小题4分, 共16分)
• The color quickly disappears as the bromine
adds to the double bond.(颜色快速消失的是溴加
到双键上。)
• “Decolorizing bromine” is the chemical test
for the presence of a double bond. (“脱色溴”是
丙酮 无水
R
I
+
NaX C=C X
C=C C X
烯丙型卤
C=C (CH2)n X
孤立型
乙烯型卤
RC H2 Br
室温下, 立即作用 生 成
RC H2 C l R2C H X 或 R3C X
后生成
X
卤苯型 也不反应
与AgNO3 作用(鉴定不同卤代烃)
卤代烃与AgNO3 的醇溶液反应制得硝酸酯和AgX沉淀
命名 烷烃、环烷烃、烯烃、炔烃、二烯烃命名,注 意顺反和ZE构型 手性化合物的命名, 桥环化合物
比较两个手性化合物的关系 Fischer Projections 投影式
7-5 Preparation of RX
• Free radical halogenation (Chapter 4自由基卤化)
Alkene Synthesis Overview
• • • •
E2 dehydrohalogenation (-HX) E1 dehydrohalogenation (-HX) Dehalogenation of vicinal dibromides (-X2) Dehydration of alcohols (-H2O)
all strong nucleophiles are basic.
7
Trends in Nuc. Strength
• Of a conjugate acid-base pair, the base is • • • •
stronger: OH- > H2O, NH2- > NH3 Decreases left to right on Periodic Table. More electronegative atoms less likely to form new bond: OH- > F-, NH3 > H2O 同一周期,从左到右亲核性降低 Increases down Periodic Table, as size and polarizability increase: I- > Br- > Cl同一族从上到下亲核性增大
Uses for SN2 Reactions
• Synthesis of other classes of compounds. • Halogen exchange reaction.卤素交换反应
Nucleophile R-X + I
-
-
Product R-I R-OH R-OR' R-SH R-SR' R-NH3+X R- N3 R-CN R-COO-R'
CH3
室温
不反应
用于不同结构卤代烃的鉴别
Homework
7-31,7-37,7-39,7-40
Structure for C6H7N?
• If you prefer to use a formula, the element of
unsaturation is
N4+1-
N1-N3 2
N4 是四价原子的数目,N1是一价原子的 数目,N3是三价原子的数目。
Homework 8-2,8-24
Reaction of C=C Hydrohalogenation using HCl, HBr, HI 与卤化氢加成 (顺式) Hydration using H2O, H2SO4 水合(顺 式) Halogenation using Cl2 , Br2 卤素加成 (反式) Halohydrination using HOCl, HOBr 与次卤酸加成 (反式) Oxymercuration using Hg(OAc)2 , H2 O 羟汞化 Hydroboration 硼氢化
– Anti-Markovnikov product formed(反马氏
加成)
• Hydroboration(硼氢化反应)
– Syn addition of H-OH ( 顺式加成 )
Predict the product when the given alkene reacts with borane in THF, followed by oxidation with basic hydrogen peroxide.
R R C H R C
R 被氧化为 R C OH 被氧化为 R C O O
H
H 此反应用于烯烃的 被氧化为 结构和碳碳双键的 HO C
halide. • Product is Markovnikov and anti.
9-10 Hydrogenation
• • • •
Alkene + H2 Alkane Catalyst required, usually Pt, Pd, or Ni. Finely divided metal, heterogeneous Syn addition
H
C
N
CH3 CH3
O C
H3C CH3 ace ton e dime thylform amide
(DMF)
n-C6H13
128
n-C6H13 C I
128
n-C6H13
128
I +
H H3C
I C I CH3 H
I C H CH3
SN2反应的立体化学特征为中心C
原子的构型反转。
小结: 1、烷基结构的影响 SN1反应的活性: 叔卤代烷 > 仲卤代烷 > 伯卤代烷 > CH3X 2、卤原子(离去基团)的影响 卤代烷的反应活性顺序: RI > RBr > RCl > RF
– produces mixtures, not good lab synthesis – unless: all H’s are equivalent, or – halogenation is highly selective.
• Free radical allylic halogenation(自由基烯丙基卤化)
Predict the Product
syn addition
Test for Unsaturation(测试的不饱
和度)
• Add Br2 in CCl4 (dark, red-brown color) to an
alkene in the presence of light.(在光的存在下
添加溴四氯化碳(黑,红棕色)到烯烃。)
R X + AgNO3
C2H5OH
R O NO2 + AgX
硝酸酯
加热 白色
R-Cl AgNO3 C2H5OH R-I
R-Br
室温较慢 浅黄色
室温立即 黄色
加热 BrCH2CH2CH=CHCH2 CH3 C Br CH3 CH3CHCH=CHCH3 Br CH3CH2C=CHCH2 Br AgNO3 C2H5OH
反应活性:
不饱和烃:
H2C CHCOOH < H2C CHBr < H2C CH2 < CH3CH CH2 < (CH3)2C CH2 < (CH3)2C CHCH3 < (CH3)2C C(CH3)2
烷基具有供电子作用,增加了双键上的 电子云密度,利于亲电加成反应的进行; 羧基具有吸电子作用,降低了双键上的 电子云密度,不利于亲电加成反应的进行。
Simmons-Smith
Best method for preparing cyclopropanes.
Epoxide Stereochemistry
Since there is no opportunity for rotation around the double-bonded carbons, cis or trans stereochemistry is maintained.
化学测试是否存在一个双键)
• If a halogen is added in the presence of water,
a halohydrin is formed.(如果一个卤素添加有水的
存在,形成卤代醇类。)
9-9 Formation of Halohydrin 卤代醇
