专题 有关化学平衡的活塞问题
16.活塞类化学平衡专题
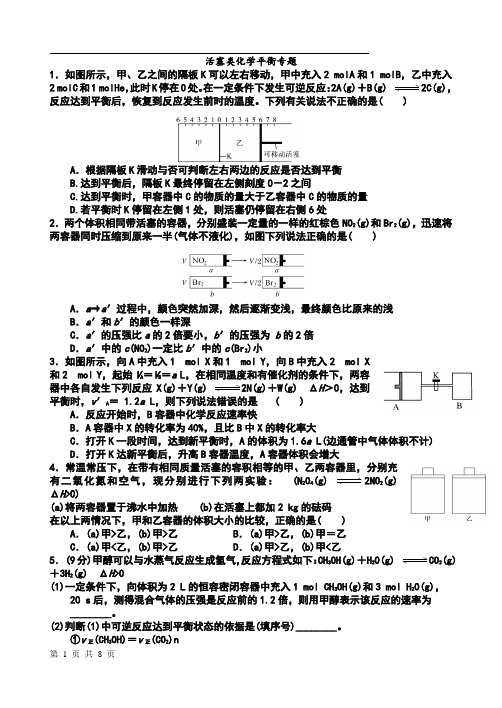
活塞类化学平衡专题1.如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 molA和1 molB,乙中充入2 molC和1 molHe,此时K停在0处。
在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度。
下列有关说法不正确的是( )A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡B.达到平衡后,隔板K最终停留在左侧刻度0-2之间C.达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处2.两个体积相同带活塞的容器,分别盛装一定量的一样的红棕色NO2(g)和Br2(g),迅速将两容器同时压缩到原来一半(气体不液化),如图下列说法正确的是( )A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅B.a′和b′的颜色一样深C.a′的压强比a的2倍要小,b′的压强为b的2倍D.a′中的c(NO2)一定比b′中的c(Br2)小3.如图所示,向A中充入1 mol X和1 mol Y,向B中充入2 mol X和2 mol Y,起始V A=V B=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g) 2N(g)+W(g) ΔH>0,达到平衡时,v′A= 1.2a L,则下列说法错误的是( )A.反应开始时,B容器中化学反应速率快B.A容器中X的转化率为40%,且比B中X的转化率大C.打开K一段时间,达到新平衡时,A的体积为1.6a L(边通管中气体体积不计)D.打开K达新平衡后,升高B容器温度,A容器体积会增大4.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验: (N2O4(g) 2NO2(g)ΔH>0)(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )A.(a)甲>乙,(b)甲>乙B.(a)甲>乙,(b)甲=乙C.(a)甲<乙,(b)甲>乙D.(a)甲>乙,(b)甲<乙5. (9分)甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH>0(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。
高中化学等效平衡专题练习

高中化学等效平衡专题练习1.在恒定压力下,一个可变容积的密闭中发生如下反应:2NH3(g) + CO2(g) → CO(NH2)2(g) + H2O(g)。
开始时放入2mol NH3和1mol CO2,达到平衡后生成a mol H2O。
若开始时放入x mol NH3、2mol CO2和1mol H2O(g),达到平衡后H2O的物质的量是3a mol,则x为多少?答案:3mol。
2.在一个密闭中,加入3mol A和1mol B,在一定条件下发生反应3A(g) + B(g) → 2C(g) + D(g),达到平衡时,测得C的浓度为XXX。
若保持中压强和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是哪个?答案:3mol A+1mol B+2mol C+1mol D。
3.在一定条件下,向一个带活塞的密闭中充入2mol SO2和1mol O2,发生下列反应:2SO2(g) + O2(g) → 2SO3(g)。
达到平衡后改变下述条件,SO3气体平衡浓度不改变的是哪个?答案:保持温度和内压强不变,充入1mol SO2(g)。
4.在一个固定容积的密闭中,加入mmol A和nmol B,发生下列反应:mA + nB → pC。
平衡时C的浓度是XXX。
若体积和温度不变,起始时放入amol A、bmol B、cmol C,若要平衡后C的浓度仍为w mol/L,则a、b、c应满足的关系是什么?答案:a:b:c=m:n:p,且(ap/m)+c=p。
5.在一个VL密闭中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2 + O2 → 2SO3.平衡时SO3为a mol。
在相同温度下按下列配比在VL密闭中放入起始物质,平衡时关于SO3的正确叙述是什么?(未提供答案)1.A放入0.2mol SO2、0.1mol O2、0.1mol SO3,达到平衡时SO3必小于a mol。
化学平衡练习题及答案

化学平衡练习题一、是非题,下列各题的叙述是否正确,对的画√错的画×1、 对于理想气体反应,等温等容下添加惰性组分时平衡不移动。
( )2、指定状态下的 ∆r G 或∑μνB OB B 就是定温定压下G ~ξ 曲线上某一点切线的斜率。
( ) 3、化学反应达到平衡时,反应的摩尔吉布斯函数∆r G m =0。
( )4、恒T 、p 、W ˊ=0下,化学反应的平衡条件为:0r m B B G νμ∆=∑= 。
( )5、某一反应在等温等压且无非体积功的条件下∆r m G > 0 ,则该反应不能正向进行。
( )6、理想气体化学反应()()()A g B g C g →+,在恒温下增大总压时,反应物转化率将增大.( )7、对理想气体反应:0 = ∑νB B ,在定温定压下当∑νB 〉0时,随着惰性气体的加入而平衡向右移动。
( )8、由∆r G =-RT ln K ,因为K 是平衡常数,所以∆r G 是化学反应达到平衡时的摩尔吉布斯函数变化值。
( )9、等温等压且不涉及非体积功条件下,一切吸热且熵减小的反应,均不能自动发生。
( )10、 对于B B 0ν≠∑的理想气体反应,等温等压下添加惰性组分时平衡不移动。
( )11、标准平衡常数变了,平衡一定会移动。
反之,平衡移动了,标准平衡常数一定会改变。
( )12、对理想液态混合物中的反应,标准平衡常数K (T )≈B eq B B )χ(ν∏K x .( )13、任何一个化学反应都可以用标准摩尔吉布斯函数来判断反应的方向。
( )14、某反应的平衡常数是一个不变的常数。
( )15、在一定温度和压力下,某反应的∆r G> 0,所以要选用合适的催化剂,使反应得以进行.( )二、选择题1、温度升高时,固体氧化物的分解压力(分解反应是吸热反应):( )。
(1)降低;(2)增大;(3)恒定;(4)无法确定。
2、 HgO (s)的标准摩尔生成吉布斯函数 ∆f G 为— 58。
等效平衡专题

等效平衡专题例1:如图所示,在一定温度下,把2体积N 2和6体积H 2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应:N 2(g)+3H 2(g) 2NH 3(g), (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。
据此回答下列问题:(1)保持上述反应温度不变,设a 、b 、c 分别代表初始加入的N 2、H 2和NH 3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:①若a=1,c=2,则b=_________。
在此情况下,反应起始时将向_________(填“正” 或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c 的取值范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是________ _。
例2:在一个固定容积的密闭容器中,保持一定的温度进行以下反应:H 2(g )+ Br 2 (g ) 2HBr (g )。
已知加入1mol H 2和2mol Br 2时,达到平衡后生成a mol HBr (见下表已知项),在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号A ~C 的状态,填写下表中的空白。
练习:1、将1mol SO 2和1mol O 2通入密闭容器中,在一定条件下反应达到平衡,平衡体系中有SO 3 0.3mol ,此时若移走0.5mol O 2和0.5 mol SO 2,则反应达到新平衡时SO 3的物质的量为( )A 0.3molB 0.15molC 小于0.15molD 大于0.15mol ,小于0.3mol2、在一容积可变的密闭容器中,通入1mol X 和3 mol Y ,在一定条件下发生如下反应X (g) + 3 Y (g) 2 Z (g),到达平衡后,Y 的转化率为a %,然后再向容器中通入2 molZ ,保持在恒温恒压下反应,当达到新的平衡时,Y 的转化率为b %。
化学平衡习题集(含答案)

化学平衡习题集1.如图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。
在恒温恒压下发生如下反应:A2+3B2 2AB3。
当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率是A.20% B.40%C.60%D.无法确定2.可逆反应a A(s)+b B(g) c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是:A.达到平衡后,加入催化剂则C%增大B.达到平衡后,若升高温度,平衡向右移动C.化学方程式中b < c +d D.达平衡后,增加A的量,有利于平衡向右移动3.一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H22NH3。
已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为..c mol·L-1的是A。
1.0体积的N2和3。
0体积的H2 B。
2。
0体积的N2、6。
0体积的H2和4.0体积的NH3C. 4。
0体积的NH3和1.0体积的H2 D。
2.0体积的NH34.根据下列有关图象,说法正确的是A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0B.由图Ⅱ知,反应在t6时,NH3体积分数最大C.由图Ⅱ知,t3时采取降低反应温度的措施D .图Ⅲ在10L 容器、850℃时反应,由图知,到4min 时,反应放出51.6kJ 的热量 5.已知某可逆反应mA (g )+ nB(g ) pC (g ),在密闭容器中进行,下图表示在不同反应时间t 、温度T 和压强P 与反应物B 在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( )A 、T 1〈T 2、P 1>P 2、m+n 〉p ,⊿H <0;B 、T 1>T 2、P 1〈P 2、m+n 〉p,⊿H >0;C 、T 1〉T 2、P 1〈P 2、m+n<p ,⊿H >0;D 、T 1<T 2、P 1>P 2、m+n 〈p,⊿H 〈0; 6.可逆反应2NH 3N 2+3H 2在密闭容器中进行,达到平衡状态的标志是( )①单位时间内生成n mol N 2的同时生成2n mol NH 3 ②单位时间内生成n mol N 2的同时生成3n mol H 2 ③用NH 3、N 2、H 2的物质的量浓度变化表示的反应速率之比为2∶1∶3 ④各气体的浓度不再改变 ⑤混合气体的平均相对分子质量不再改变 A 。
化学平衡经典试题(附答案)

化学平衡经典试题(附答案)1.恒温、恒压下,a mol A 和b mol B 在一个容积可变的容器中发生如下反应:A(g)+2B(g)2C(g),一段时间后达到平衡,生成n mol C .则下列说法中正确的是 ( )A .物质A 、B 的转化率之比为a ∶bB .起始时刻和达到平衡后容器中的压强比为(a +b)∶(a +b -n2)C .若起始时放入2a mol A 和2b mol B ,则达到平衡时生成2n mol CD .当v 正(A)=2v 逆(B)时,可确定反应达到平衡解析:生成n mol C 时参加反应的A 、B 的物质的量分别为n/2 mol 、n mol ,转化率之比为n 2a ∶n b =b2a ;恒温、恒压过程成倍地增大反应物的量,则平衡时C 的量也成倍地增加;反应速率之比等于化学计量数之比,当2v 正(A)=v 逆(B)时,可确定反应达到平衡. 答案:C2.在一个容积为VL 的密闭容器中放入:2L A(气)和lL B(气),在一定条件下发生下列反应:3A(气)+B(气)nC(气)+2D(气)达到平衡后,A 物质的量浓度减少12,混合气体的平均摩尔质量增大18,则该反应的化学方程中n 的值是 ( )A .1B .2C .3D .4 3.(2011四川)可逆反应①X(g)+2Y(g)2Z(g) 、②2M (g )N (g )+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。
反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是A. 反应①的正反应是吸热反应B. 达平衡(I )时体系的压强与反应开始时体系的压强之比为14:15 C . 达平衡(I )时,X 的转化率为115 D. 在平衡(I )和平衡(II )中M 的体积分数相等4.反应mA (固)+nB (气) pC (气)+Q 在一定温度下B 的体积分数(B %)与压强变化的关系如图2-11所示,下列叙述中正确的是( )①m+n >P ;②x 点表示该反应的正反应速率大于逆反应速率;③n >p ;④x 点比y 点时的反应速率慢。
高考化学第三节平衡专题1

高考化学第三节平衡专题12020.031,一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO 2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是()A.保持温度和容器体积不变,充入1molSO2(g)B.保持温度和容器内压强不变,充入1molAr(g)C.保持温度和容器内压强不变,充入1molO2(g)D.保持温度和容器内压强不变,充入1molSO3(g)2,某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:。
若维持温度和压强不变,当达到平衡时,容器的体积为V,此时气体C的体积占40%,则下列判断正确的是()A. 原混合气体的体积为1.1VB. 原混合气体的体积为0.9VC. 反应达到平衡时,气体A消耗了0.2VD. 反应达到平衡时,气体B消耗了0.2V3,下列事实不能用勒夏特列原理解释的是:()A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;C.在实验室里,可用碳酸钙粉末和稀硫酸制得二氧化碳气体;D.实验室用排饱和食盐水的方法收集氯气。
4,把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:5达到平衡,此时生3A(气)+B(气) 2C(气)+xD(气)经min2,测定D的平均反应速率为0.1mol/L•min,下列说法中错误的成C为mol是()A.x = 2B. B的转化率为20%C. 平衡时A的浓度为0.8mol/LD. 恒温达平衡时容器内压强为开始时的85%5,一定条件下,可逆反应A 2(g) + B2(g) 2 C(g)达到平衡时,各物质的平衡浓度为:c(A2)= 0.5mol/L;c(B2)= 0.1mol/L; c(C)= 1.6mol/L。
若用a、b、c分别表示A2、B2、C的初始浓度(mol/L),则:(1)a、b应满足的关系是;(2)a的取值范围是。
化学反应速率和化学平衡问题探讨

化学反应速率化学平衡问题讨论题型一:根据化学计量数之比,计算反应速率【例1】反应4NH 3(g)+5O 2(g) 4NO(g)+6H 2O(g)在10L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol ,则此反应的平均速率)(X v (反应物的消耗速率或产物的生成速率)可表示为( )A .)mol/(L 0.010)(NH 3s v ⋅=B .)mol/(L 0.001)(O 2s v ⋅=C .)mol/(L 0.001(NO)s v ⋅=D .)mol/(L 0.045O)(H 2s v ⋅=【点拨】 正确答案是C 。
【规律总结】遇到这一类题目,一定要充分利用化学反应中各物质的反应速率之比等于它们的化学计量数之比这一规律进行计算。
题型二:以图象形式给出条件,计算反应速率【例2】某温度时,在2L 容器中,X 、Y 、Z 三种物质的物质的量随时间变化的曲线如图所示。
由图中数据分析:该反应的化学方程式为_________________。
反应开始至2min ,用Z 表示的平均反应速率为____________。
【点拨】由图可知,X 、Y 的物质的量随反应的进行而减小,Z 的物质的量随反应的进行而增大,则X 和Y 为反应物,Z 为生成物。
∵mol 0.3mol 0.7mol 1.0(X)=-=∆nmol 10.mol 90.mol 1.0(Y )=-=∆nmol 20.mol 0mol 2.0(Z)=-=∆n∴反应方程式为:3X+Y =2Z 。
min)mol/(L 0.05min2L 2mol 0.2)(⋅=÷=Z v 题型三:根据已知的浓度、温度等条件,比较反应速率的大小【例3】把下列四种X 溶液分别加入四个盛有10mL 2mol/L 盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是()A.10℃20mL 3mol/L的X溶液B.20℃30mL 2mol/L的X溶液C.20℃10mL 4mol/L的X溶液D.10℃10mL 2mol/L的X溶液本题若没有看清楚题目实质,仅仅从选项的表面看X浓度的大小及反应温度的高低来判断反应速率的快慢,则会错选C。
化学平衡难点突破

化学平衡难点突破化学平衡是中学化学的重点和难点,也是高考考查学生能力的重要载体。
突破化学平衡移动方向的判断和平衡时有关量的分析是提高学生解题能力的关键。
一、运用勒夏特列原理来判断平衡移动的方向对于气体物质参加的可逆反应,当气体物质的浓度改变不是同倍数地改变时,可以用改变物质浓度的方法判断平衡移动的方向;当气体物质的浓度改变相同的倍数时,则用压强改变影响平衡移动的方法。
例题1.有两只密闭容器A和B,A容器有一个移动的活塞,能使容器内保持恒压,B容器保持恒容,起始时向这两只容器中分别充入等量的体积比为1:2的SO2和O2的混合气体,并使A和B的容积相等。
在保持400℃的条件下,使之发生反应:2SO2(g)+O2(g) 2SO3(g)。
问题1、比较A与B容器中二氧化硫的转化率。
分析:A容器是一个等压变化,其压强始终等于大所压,B容器是一个等容变化,由于生成三氧化硫的反应是一个气体物质的量减小的反应,所以B容器中气体压强比A容器中的压强相对来说要小些。
因此,我们分析B容器的平衡变化时,可以认为B中的变化是在A容器达平衡后,减小压强,平衡向逆反应即气体体积增大的方向移动,所以A中二氧化硫的转化率比B中的高。
问题2、当向达到上述平衡后的两容器中通入数量不多的等量氩气,则A、B容器中化学平衡移动方向如何?分析:向A中充入氩气,活塞向外移,保持气体压强与外界大气压相同,但对原平衡体系来说,相当于减小了其压强,因为原平衡混合气体的压强与氩气的压强之和等于大气压,所以平衡向逆反应方向移动。
向B中充入氩气,原平衡体系的压强看似增大了,但由于原平衡体系中各物质的浓度没有改变,所以平衡不移动,或者说原平衡体系所分占的压强不变,所以平衡不移动。
例题2、某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。
保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡向正反应方向移动的是A、均减半B、均加倍C、均增加1 molD、均减少1 mol分析:这是一道等温、等压变化题,若同等倍数地改变物质的浓度(或物质的量),平衡不移动,即反应的转化率不变。
有活塞的化学平衡问题的分析与解答

有活塞的化学平衡问题的分析与解答作者:顾小兵来源:《化学教与学》2010年第03期有活塞的化学平衡问题是高中化学学习的难点之一,解决的方法是根据题目所给条件,从化学平衡基本原理入手,用等效平衡模式进行分析,注重始终态的研究。
下面以两个习题为例,探究解题思路。
例1:(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。
在一定条件下发生可逆反应:2A(g)+B(g)?葑2C(g);反应达到平衡后,再恢复到原温度。
回答下列问题:(1)可根据现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为mol,乙中C的转化率 50%(填、=),此时,乙中可移动活塞F最终停留在右侧刻度处(填6、=6)。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于 ;若K最终停留在左侧刻度靠近2处,则乙中可移动活塞F最终停留在右侧的刻度不小于。
(Ⅱ)若一开始就将K、F固定,其他条件均不变,则达到平衡时:(1)甲、乙中C的物质的量的分数是甲乙(填、=);(2)测得甲中A的转化率为b,则乙中C的转化率为;(3)假设乙、甲容器中的压强比用d表示,则d的取值范围为。
分析:此题是一道化学平衡的综合题,包括等效平衡、恒温恒压、恒温恒容下稀有气体的充入对恒温恒压、恒温恒容下平衡的影响,能力要求较高。
(Ⅰ)为恒温恒压状态解:(1)根据平衡时各组分的浓度不再发生变化,可推出活塞K、F不再移动来判断甲、乙都已达到平衡。
(2)求a的范围,用极值的思路。
若不发生反应,活塞不动,a=0;若A、B完全转化,生成2 mol C,容器的体积变为原来的2/3,活塞左移,a=2,所以A的取值范围为0(3)隔板K最终停留在左侧刻度1处,则平衡时甲中气体总的物质的量为2.5 mol,根据差量得到生成C 1 mol。
化学平衡之隔板、活塞训练题 -完整获奖版
《化学平衡之隔板、活塞训练题》1、如图所示,甲、乙之间的隔板K 可以左右移动,甲中充入2molA 和1molB ,乙中充入2molC 和1molHe ,此时K 停在0处。
在一定条件下发生可逆反应:2A(g)+B(g)2C(g),反应达到平衡后,恢复到反应发生前时的温度。
下列有关说法不正确...的是 A .根据隔板K 滑动与否可判断左右两边的反应是否达到平衡B .达到平衡后,隔板K 最终停留在左侧刻度0~2之间C .到达平衡时,甲容器中C 的物质的量大于乙容器中C 的物质的量D .若平衡时K 停留在左侧1处,则活塞仍停留在右侧6处(分步计算)2、如图所示,当关闭K 时,向A 、 B 中各充入2molX 、2molY ,起始时,V(A)= aL ,V(B)=。
在相同温度和催化剂存在的条件下,两容器中各自发生反应3X(g)+3Y(g)2Z(g)+2W(g);△H<0。
达到平衡(Ⅰ)时,V(B)=。
请回答:⑴.B 中X 的转化率α(X )为 _____________________ ; ⑵.A 、B 中X 的转化率的比较:A _ _(选填“大于” “小于” “等于”)B ;⑶.打开K ,过一段时间重新达到平衡状态(Ⅱ)时,B 的体积为 ____(用a 的代数式表示,连通管中气体体积不计)。
3、 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。
4、 其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X 和2mol Y ,起始时容器体积均为V L ,发生如下反应并达到平衡(X 、Y 状态未知):2X(?)+Y(?)aZ(g)。
此时Ⅰ中X 、Y 、Z 的物质的量之比为1:3:2,则下列说法一定正确的是5、 A .若X 、Y 均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ6、 B .若X 、Y 不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ7、 C .若X 为固态,Y 为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同8、 D .平衡时Ⅰ容器的体积小于V L9、 右图A 、B 是等体积容器,K 是开关,活塞可以左右移动。
三个极其相似的活塞平衡问题

一个活塞平衡问题三个相似题型1. 如图,向A 中充入1molX 和1molY ,向B 中充入2molX 和2molY ,起始时V(A)=V(B)=a L 。
在相同温度和有催化剂存在的条件下,两容器中各自发生反应:X(g)+Y(g)Z(g)+2W(g),达到平衡时V(A)=1.2a L 。
求:(1)A 中X 的转化率为 ;(2)打开A 、B 间活塞,一段时间后又达到平衡时,X 的转化率为 ,A 的体积为 L 。
(连通管中气体体积忽略不计)2.如图所示,向A 中充入1 mol X 和1 mol Y ,向B 中充入2 molX 和2 mol Y ,起始V A =V B =a L ,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g) 2N(g)+W(g) ΔH >0,达到平衡时,v ′A = 1.2a L ,则下列说法错误的是 ( )A .反应开始时,B 容器中化学反应速率快B .A 容器中X 的转化率为40%,且比B 中X 的转化率大C .打开K 一段时间,达到新平衡时,A 的体积为1.6a L(边通管中气体体积不计)D .打开K 达新平衡后,升高B 容器温度,A 容器体积会增3.下图中P 是可自由平行滑动的活塞,关闭K ,在相同温度时,向A容器中充入1 mol CH 3OH(g)和2 mol H 2O(g),向B 容器中充入1.2 molCH 3OH(g)和2.4 mol H 2O(g),两容器分别发生上述反应。
已知起始时容器A 和B 的体积均为a L 。
试回答:①反应达到平衡时容器B 的体积为1.5a L ,容器B 中CH 3OH 的转化率为________;A 、B 两容器中H 2O(g)的体积百分含量的大小关系为:B________A(填“>”“<”或“=”)。
②若打开K ,一段时间后重新达到平衡,容器B 的体积为________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
高中物理课件17-6 气体实验定律应用之活塞类问题

第6节 气体实验定律应用之活塞类问题
一、单活塞问题 3.非平衡态活塞问题 【原型题 6】如图所示,足够长的圆柱形汽缸竖直放置,其横截面积为 S=1×10-3m2,汽缸内有 质量为 m=2kg 的活塞,活塞与汽缸壁封闭良好,不计摩擦.开始时活塞被销子 K 销于如图示 位置,离缸底高度 L1=12cm,此时汽缸内被封闭气体的压强 p1=1.5×105Pa,温度 T1=300K, 外界大气压 p0=1.0×105Pa,g=10m/s2.
一、单活塞问题 1.不规则活塞受力问题 【原型题 1】如图所示,汽缸截面积为 S,图甲中活塞质量为 m,活塞横截面为梯形,上表面是 水平的,下表面与右侧竖直方向的夹角为α;图乙中活塞质量为 m,活塞上、下面均是水平的, 当活塞上放一质量为 M 的重物时处于静止.设外部大气压为 p0,若活塞与缸壁之间无摩擦.重 力加速度为 g,求两气缸中理想气体的压强.
(1)玻璃管转动的角速度ω; (2)若整个过程中气体从外界吸收的热量为 Q,求玻璃管对活塞做的功.
第6节 气体实验定律应用之活塞类问题
一、单活塞问题 4.稳态活塞连接体问题 【原型题 8】如图所示,汽缸内封闭一定质量的某种理想气体,活塞通过滑轮和一重物连接并 保持平衡,已知活塞距缸口 h=50cm,活塞面积 S=10cm2,封闭气体的体积为 V1=1500cm3, 温度为 0℃,大气压强 p0=1.0×105Pa,重物重力 G=50N,活塞重力及一切摩擦不计.缓慢升高 环境温度,封闭气体吸收了 Q=60J 的热量,使活塞刚好升到缸口.整个过程中重物未触地,求:
第6节 气体实验定律应用之活塞类问题
专题 有关化学平衡的活塞问题

专题有关化学平衡的活塞问题1.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图2的说法中正确的是()A.P3>P4,y轴表示B的百分含量B.P3<P4,y轴表示B的体积分数C.P3<P4,y轴表示混合气体的密度D.P3>P4,y轴表示混合气体的平均摩尔质量2.图中表示外界条件(t、p)的变化对下列反应的影响:L(s)+G(g)2R(g)△H > 0y 轴表示的是()A、平衡时,混合气中R的百分含量B、G的转化率C、平衡时,混合气中G的百分含量D、L的转化率3.在容积固定的2L密闭容器中充入X、Y各2mol,发生可逆反应X(g)+2Y(g) 2Z(g)并达平衡。
以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如下图,则图中阴影部分的面积表示()A.X的浓度的减少B.Y的物质的量的减少C.Z的浓度的增加D.X的物质的量的减少4. 在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L此反应符合下面图像,下列叙述是正确的是A. 正反应吸热,L是气体B. 正反应吸热,L是固体C. 正反应放热,L是气体D. 正反应放热,L是固体或液体5. 氯酸钾和亚硫酸氢钾能发生氧化还原反应:Cl 3O -+HSO 3-→SO 42-+Cl -+H +(未配平)。
已知该反应的速率随c (H +)的增大而加快。
下列为用ClO 3-在单位时间内物质的量浓度变化表示的该反应V-t 图。
下列说法中不正确的是A .反应开始时速率增大可能是c (H +)所致B .纵座标为V(H +)的V -t 曲线与图中曲线完全重合C .后期反应速率下降的主要原因是反应物浓度减小D .图中阴影部分“面积”可以表示t 1-t 2时间为n (Cl -)增加 6.反应A 2+ B 22AB在不同条件下,产物AB 的生成情况,如图所示,a 为500℃,b为300℃时情况,c 为300℃时从时间t 3开始向容器中加压的情况,则下列叙述正确的是 A .A 2、B 2、AB 均为气体,正反应放热B .AB 为气体,A 2、B 2中最少有一种为非气体,正反应放热C .AB 为气体,A 2、B 2中最少有一种为非气体,正反应吸热D .AB 为固体,A 2、B 2中最少有一种为非气体,正反应吸热7.有两只密闭容器A 和B ,A 能保持恒压,B 能保持恒容。
高二化学平衡专题------活塞类

化学平衡专题练习-------活塞类1.如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2 molA和1 molB,乙中充入2 molC和1 molHe,此时K停在0处。
在一定条件下发生可逆反应:2A(g)+B(g) 2C(g),反应达到平衡后,恢复到反应发生前时的温度。
下列有关说法不正确的是( )A.根据隔板K滑动与否可判断左右两边的反应是否达到平衡B.达到平衡后,隔板K最终停留在左侧刻度0-2之间C.达到平衡时,甲容器中C的物质的量大于乙容器中C的物质的量D.若平衡时K停留在左侧1处,则活塞仍停留在右侧6处2.两个体积相同带活塞的容器,分别盛装一定量的一样的红棕色NO2(g)和Br2(g),迅速将两容器同时压缩到原来一半(气体不液化),如图下列说法正确的是( )A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅B.a′和b′的颜色一样深C.a′的压强比a的2倍要小,b′的压强为b的2倍D.a′中的c(NO2)一定比b′中的c(Br2)小3.如图所示,向A中充入1 mol X和1 mol Y,向B中充入2 mol X和2 mol Y,起始V A=V B=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g) 2N(g)+W(g) ΔH>0,达到平衡时,v′A= 1.2a L,则下列说法错误的是( )A.反应开始时,B容器中化学反应速率快B.A容器中X的转化率为40%,且比B中X的转化率大C.打开K一段时间,达到新平衡时,A的体积为1.6a L(边通管中气体体积不计)D.打开K达新平衡后,升高B容器温度,A容器体积会增大4.常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两实验: (N2O4(g) 2NO2(g) ΔH>0)(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码在以上两情况下,甲和乙容器的体积大小的比较,正确的是( )A.(a)甲>乙,(b)甲>乙B.(a)甲>乙,(b)甲=乙C.(a)甲<乙,(b)甲>乙D.(a)甲>乙,(b)甲<乙小题冲关5.【2017年经典习题荟萃】 (9分)甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH>0(1)一定条件下,向体积为2 L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),20 s后,测得混合气体的压强是反应前的1.2倍,则用甲醇表示该反应的速率为________。
活塞类化学平衡问题的解题技巧

活塞类化学平衡问题的解题技巧佚名【期刊名称】《《高中数理化》》【年(卷),期】2019(000)006【总页数】1页(P62)【正文语种】中文活塞类化学平衡问题属于高中化学学习过程中的难点,解决此问题的方法就是根据题目条件,基于化学平衡基本原理,使用等效平衡模式进行分析,并且重视始态、终态的研究.本文对活塞类化学平衡问题的解题技巧进行分析.例如图1所示,甲乙之间隔板K和活塞F都能够左右移动,在甲中充入2 mol A 与1 mol B,在乙中充入2 mol C与1 mol He,这时候K在0处.在一定条件下会出现可逆反应:2A(g)+B(g)2C(g).在反应达到平衡后就会恢复到原来的温度. 图1(1)①能够以______现象判断甲乙都已经平衡.②在平衡的时候,假如隔板K最终停留到0刻度左侧的a地方,那么a的取值范围是______.③如果实现平衡,假如隔板K最终会停留到左侧刻度1的地方,那么甲中C的物质的量为______mol,乙中C的转化率为______50%(填“>”“<”“=”),这时乙中可移动活塞F最终会停留到右侧刻度的哪个地方?④如果都实现平衡,假如隔板K最终会停在左侧刻度与0接近的地方,乙中可移动活塞F最终会停留到右侧刻度不大于______的地方.(2)如果一开始就固定K和F,其他条件都不发生变化,那么平衡时:①甲和乙中C的物质的量分数为甲______乙(填“>”“<”“=”).②测量得到甲中A的转化率为b,则乙中C的转化率为______.③假如乙和甲容器中的压强比为d,那么d的取值范围为______.分析本题属于化学平衡综合题,主要考查充入稀有气体对恒温恒容、恒温恒压条件下平衡的影响,对学生解题能力要求比较高.(1)为恒温、恒压状态.①根据平衡时各组分浓度不改变,推算出隔板K和活塞F不再移动时,甲和乙都已经平衡;②求a的取值范围,可以使用极限法.如果不发生反应,那么隔板不动,a为0.如果A和B完全转化,生成2 mol C,甲的体积就是原来的隔板向左移动,a为2,那么a的取值范围是0<a<2;③隔板K最终在左侧刻度1的地方停留,那么平衡时甲的总物质的量为2.5 mol,以差量法得出生成1 mol C.以等效平衡原理分析,如果乙中有2 mol C,那么就要和甲中的平衡状态一样,C的转化率就是50%.充入1 mol He,活塞就会向右移动,压强减小.平衡向左移动,提高C的转化率,则C的转化率在50%以上.此时乙容器中气体总物质的量在3.5 mol以上,那么活塞F最终会在右侧刻度大于6的地方停留.④如果达到平衡状态,假如隔板K最终会在左侧刻度接近于0的地方停留,表示甲中气体的物质的量接近3 mol,那么乙中气体的物质的量接近4 mol,此时活塞F就会停留在右侧刻度接近于8的地方.(2)为恒温、恒容状态.①首先创建中间状态,固定K和F,将甲中充入2 mol A与1 mol B,乙中充入2mol C.因为容积一样,以等效平衡原理分析,两个容器平衡状态一样.这时充入1 mol He对平衡是不会有影响的,那么甲、乙中C的物质的量分数一样.②甲中A的转化率为b,则平衡时C的物质的量为2b,那么平衡时乙中C的物质的量为2b,C的转化率为③如果两个容器中都是A与B,那么乙中气体的物质的量为4 mol,甲中气体的物质的量为3 mol,这时d为如果两个容器中都为C,那么乙中气体的物质的量为3 mol,甲中气体的物质的量为2 mol,这时d为所以d的取值范围为在高考中,活塞类化学平衡问题是热点也是难点,是考生最害怕的题目,通过以上例题的分析,解题过程中如果将此种类型问题转变成恒温、恒容或者恒温、恒压的等效问题,就不难解决了.。
10化学平衡综合问题分析

化学平衡综合问题知识目标1.有关活塞平衡的问题此类问题关键要考虑到活塞两边的压强相等,再根据化学反应平衡,观察平衡移动的方向。
要保持两边的压强相等,可以是在同温的条件下,两边的气体物质的量相等;也有可能是在温度不同时,两边保持平衡,要具体问题具体分析。
通过下面几个例题的学习,总结此类问题的分析方法。
第一种类型:判断反应的方向或物质的用量范围例1:如图,一定温度下,把2体积N2和6体积H2通入一个带有活塞的体积可变的容器内,活塞的一端与大气相通。
容器中发生以下反应:N2+3H22NH3。
当反应达到平衡时,测得混合物的体积为7体积。
请回答以下问题:(1)保持上述反应温度不变,设a、b、c分别代表初始时的N2、H2和NH3的体积,反应达到平衡时,混合气体中各物质的百分含量与上述平衡相同。
①若a=1, c=2则b= 。
在此情况下,反应起始时将向方向移动。
若规定起始时反应向逆反应方向进行,则此情况下c的取值范围是。
(2)在上述装置中,若控制反应达到平衡时混合气体的体积是6.5体积,则可采取的措施是,原因是。
(1)①3;逆②1<c≤4 (2)降低温度;降低温度平衡向正反应方向移动,气体的总分子数减少例2:如图,一恒容密闭容器中有一可滑动密封隔板起始时A、B、C各4.0mol,D为6.5mol F为2.0mol,设E为x molx在一定温度范围内变化时,可调节反应器温度使两侧达平衡,且隔板位于正中央。
(1)x=4.5时,右侧反应起始向____________方向移动,欲使起始反应维持该方向,则x最大值应小于____________。
正反应7.0(2)x=4.5和5.0时,达平衡时A物质的量是否相等?_____ ___,不相等理由是_________ ________________________________。
,因为这两种情况是在不同温度下达到化学平衡的,平衡状态不同,故物质的量也不同。
练习1:在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。
高中化学之活塞进中进行的可逆反应问题解析

高中化学之活塞进中进行的可逆反应问题解析
活塞中进行的可逆反应
活塞中进行的可逆反应,压缩体积,各气体物质的浓度都升高了,但同时平衡又发生了移动,又引起了各物质浓度再次发生变化,那么,对于某种物质的浓度到底是增大了还是减小了呢?对于这类问题,先记住结论:压缩活塞,最终各气体物质浓度均增大,拉伸活塞,最终各气体物质浓度均减小。
举例如下图:
具体解析过程如下图:
解析完毕
那么相反的,如果拉伸了活塞,同样的原理,混合气体颜色变浅了。
其他选项我没有解释,大家看看这道题应该选哪一项呢?
学生对这些知识总是容易混淆,掌握不了,专门整理出来,方便学生记忆,使用。
希望更多的同学能用上,大家觉得有问题的地方,请及时评论指出,觉得不错的,也请评论,点赞,转发,收藏,留下您的足迹。
您的评论是对我最大的支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题有关化学平衡的活塞问题1.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图2的说法中正确的是()A.P3>P4,y轴表示B的百分含量B.P3<P4,y轴表示B的体积分数C.P3<P4,y轴表示混合气体的密度D.P3>P4,y轴表示混合气体的平均摩尔质量2.图中表示外界条件(t、p)的变化对下列反应的影响:L(s)+G(g)2R(g)△H > 0y 轴表示的是()A、平衡时,混合气中R的百分含量B、G的转化率C、平衡时,混合气中G的百分含量D、L的转化率3.在容积固定的2L密闭容器中充入X、Y各2mol,发生可逆反应X(g)+2Y(g) 2Z(g)并达平衡。
以Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如下图,则图中阴影部分的面积表示()A.X的浓度的减少B.Y的物质的量的减少C.Z的浓度的增加D.X的物质的量的减少4. 在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L此反应符合下面图像,下列叙述是正确的是A. 正反应吸热,L是气体B. 正反应吸热,L是固体C. 正反应放热,L是气体D. 正反应放热,L是固体或液体5. 氯酸钾和亚硫酸氢钾能发生氧化还原反应:Cl 3O -+HSO 3-→SO 42-+Cl -+H +(未配平)。
已知该反应的速率随c (H +)的增大而加快。
下列为用ClO 3-在单位时间内物质的量浓度变化表示的该反应V-t 图。
下列说法中不正确的是A .反应开始时速率增大可能是c (H +)所致B .纵座标为V(H +)的V -t 曲线与图中曲线完全重合C .后期反应速率下降的主要原因是反应物浓度减小D .图中阴影部分“面积”可以表示t 1-t 2时间为n (Cl -)增加 6.反应A 2+ B 22AB在不同条件下,产物AB 的生成情况,如图所示,a 为500℃,b为300℃时情况,c 为300℃时从时间t 3开始向容器中加压的情况,则下列叙述正确的是 A .A 2、B 2、AB 均为气体,正反应放热B .AB 为气体,A 2、B 2中最少有一种为非气体,正反应放热C .AB 为气体,A 2、B 2中最少有一种为非气体,正反应吸热D .AB 为固体,A 2、B 2中最少有一种为非气体,正反应吸热7.有两只密闭容器A 和B ,A 能保持恒压,B 能保持恒容。
起始时向容积相等的A 、B 中分别通入体积比为2∶1的等量的SO 2和O 2,使之发生反应:2SO 2+O 22SO 3,并达到平衡。
则(填>、=、<;左、右;增大、减小、不变)。
⑴达到平衡所需要的时间:t(A) t(B),SO 2的转化率:a(A) a (B) ⑵起始时两容器中的反应速率:v (A) v (B),反应过程中的反应速率: v (A) v (B)。
⑶达到平衡时,在两容器中分别通入等量的Ar 气。
A 中的化学平衡向 反应方向移动,B 中的化学反应速率 。
⑷达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A 容器中SO 2的质量分数 ,B 容器中SO 2的质量分数 。
AB%O t 1 t 2 t 3 时间b ca8.在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g) x C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:(1)x值等于________________;(2)A的转化率为________;(3)生成D的反应速率为____________;(4)如果增大反应体系的压强,则平衡体系中C的质量分数________(增大、减小、不变)(5)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各4 /3mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入物质mol。
9.在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol。
A、C、D各为0.50mol,B的物质的量为x,当x的物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置。
达到平衡后,测得M的转化率为75%,填写空白:2M(g)+3N(s)2P(g)A(g)+4B(g)2C(g)+D(g)(1)达到平衡后,反应器左室气体总的物质的量为mol。
(2)若要使右室反应开始时v正> v逆,x的取值范围。
(3)若要使右室反应开始时v正<v逆,x的取值范围。
10.(℃)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。
在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。
回答下列问题:(1)可根据现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为mol,乙中C的转化率50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度处(填下列序号:①<6 ②>6 ③=6)(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大于;若K最终停留在左侧刻度靠近2处,则乙中F最终停留在右侧的刻度不小于。
(℃)若一开始就将K、F固定,其它条件均不变,则达到平衡时:(1)甲、乙中C的物质的量是(填:“甲>乙”或“甲<乙”或“甲=乙” );(2)测得甲中A的转化率为b,则乙中C的转化率为;(3)假设乙、甲两容器中的压强比用d表示,则d的取值范围是。
11. 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图10-1)。
容器中发生如下反应:N2+3H2 2NH3;△H<0。
反应达到平衡后,测得混合气体为7体积。
据此回答下列问题:⑴保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。
那么:①a=1,c=2,则b== 。
在此情况下,反应起始时将向方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是。
⑵在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是,原因是。
12. 如图10-2所示,容器温度保持不变,容器被分隔成AB两部分,A容积固定不变,B 有可移动的活塞。
现在A中充入2mol SO2和1mol O2,在B中充入2mol SO3和1molN2,在相同条件下发生可逆反应:2SO3(g )2SO2(g)+O2(g)根据要求填空:⑴固定活塞位置在3处不动,达到平衡时,设A中压强为P(A),B中压强为P(B),则P(A)与P(B)的关系为(填“<”、“=”、“>”);⑵若要使A中与B中平衡状态相同,应移动活塞到处;⑶若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol ,则x与y之间的关系为x y(填“<”、“=”、“>”),理由是:13. t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)x c(g),2min时反应达到平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。
请填写下列空白:⑴从反应开始到平衡状态,生成C的平均速率为:;⑵x== ;⑶若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)== mol;⑷保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是。
A. 均减半B. 均加倍C. 均增加0.4molD. 均减少0.4mol⑸如果上述反应在相同温度和容积的容器中进行,起始加入3molA和3molB,达到平衡时A 的体积分数为a%,其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是(填字母)。
A. 2mol CB. 1molA、3molB和4molCC. 1molB和4molCD. 6molA和2molB14.(1996年全国·31)在一个容积固定的反应器中,有一个可左右滑动的密封隔板,两侧分别进行如下图所示的可逆反应。
各物质起始加入的量如下:A 、B 和C 均为4.0mol ,D 为6.5mol ,F 为2.0mol ,设E 为x mol 。
当x 在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于正中位置。
请填写以下空白:⑴若x =4.5,则右侧反应在起始时向 (填“正反应”或“逆反应”)方向进行。
欲使起始反应维持向该方向进行,则x 的最大值应小于 。
⑵若x 分别为4.5和5.0,则在这两种情况下,当反应达到平衡时,A 的物质的量是否相等? (填“相等”“不相等”或“不能确定”)。
其理由是:A(g) + B(g)=2C(g)D(g)+2E(g)2F(g)V 正 V 逆参考答案7.(1)< > (2)= > (3)左不变(4)不变降低8.(1)2 (2)60% (3)0.2 mol·L-1· min-1 (4)不变(5)B 4/39.(1)3.5mol (2)2.0<x<3.0(3)1.5<x<2.010.(℃)(1)K、F不再移动(2)0<a<2 (3)1 >②(4)8 4(℃)(1)甲=乙(2)1-b (3)43<d<3211.⑴① 3 逆②1<c ≤4 。
⑵降低温度,降低温度平衡向正反应方向移动,气体总分子数减少。
12.⑴<;⑵右边刻度3 ;⑶<,B在3处时,A、B平衡状态相同。
当活塞由3处移到5处时,B与A比较,B相当于A降低了压强,平衡向正反应方向移动,B中SO3减少。
13.⑴0.2mol·L-1·min-1⑵4 ⑶0.8+0.2a ⑷ D ⑸ACD14.⑴正反应7.0⑵不相等两种情况是在两个不同温度....下建立的化学平衡,平衡状态不同,所以物质的量也不同。
