高二有机化学基础复习
高二有机化学知识点

高二有机化学知识点高二学年是化学学科中有机化学的重要阶段。
有机化学是化学中的重要分支,研究含有碳元素的化合物及其反应性质。
下面我将从基础概念、官能团、反应类型等几个方面介绍高二有机化学的知识点。
一、基础概念1. 碳氢化合物:有机化学的研究对象主要是碳氢化合物。
碳氢化合物是由碳和氢组成的化合物,是有机化学的基础。
根据碳原子间的连接方式,碳氢化合物可分为链状、环状和支链状三类。
2. 键的性质:有机化学中的化学键主要包括共价键、极性共价键、离子键等。
共价键是最常见的键类型,通过共用电子来连接原子;极性共价键在键中存在电子密度不均,分为极性共价键和非极性共价键;离子键是通过静电力将带电离子连接在一起的键。
3. 电离能和亲电性:电离能是指分解1摩尔物质所需的能量,是物质进行化学反应的基本性质;亲电性指的是物质与电子对的亲合能力,是指物质在化学反应中对电子对的亲和力。
二、官能团1. 羧酸和醛酮:羧酸和醛酮是有机化学中常见的官能团。
羧酸分子中含有一个羧基(-COOH),醛酮分子中含有一个醛基(-CHO)。
它们在有机合成、药物合成和化妆品中具有重要地位。
2. 醇和醚:醇分子中含有一个或多个羟基(-OH),醚分子中含有一个或多个氧原子连在碳原子上。
醇和醚在有机物的溶解性、酸碱性质和物理性质等方面有着不同的表现。
3. 酯和酰氯:酯是由醇和羧酸反应生成的产物,它们的分子中含有一个羧酸酯基(-COOR)。
酰氯是由羧酸和氯化物反应生成的产物,它们的分子中含有一个酰氯基(-COCl)。
三、反应类型1. 取代反应:取代反应是指有机物中的一个基团被另一个基团替代的反应。
取代反应的机理可以分为亲电取代、自由基取代和核子取代三类。
2. 加成反应:加成反应是指两个或多个物质结合形成一个新的化合物的反应。
加成反应的常见类型有加成反应、酮醇互变反应和加成聚合反应等。
3. 消除反应:消除反应是指有机物中的两个官能团脱去一个小分子(如水、醇等)形成一个新的化合物的反应。
高二有机化学常考知识点

高二有机化学常考知识点有机化学是高中化学课程的重要一部分,也是高考化学的核心内容之一。
在高二阶段,掌握有机化学的常考知识点对于学生提高化学成绩、备战高考至关重要。
本文将着重介绍高二有机化学的常考知识点,以帮助学生巩固和扩充相关知识。
一、有机化学的基本概念1. 有机物的特点:有机物主要由碳和氢构成,部分含有氧、氮、硫等元素。
其特点是分子结构多样,化学性质活泼,可燃且难溶于水。
2. 有机化合物的分类:有机化合物可分为烷烃、烯烃、炔烃、醇、醚、醛、酮、羧酸、酯等多种类别。
二、碳链的命名和结构1. 烷烃的命名:烷烃按照碳原子数目,可以分为甲烷、乙烷、丙烷、丁烷等。
其命名规则是以“烷”结尾,前缀表示碳原子数。
2. 烯烃和炔烃的命名:烯烃和炔烃的命名方法类似,以“烯”和“炔”结尾,前缀也表示碳原子数。
3. 醇、醚、醛、酮、羧酸、酯的命名:这些有机化合物的命名涉及官能团和前缀的使用方法,需要根据具体结构进行命名。
三、有机化合物的结构与性质1. 烷烃的性质:烷烃是饱和烃的代表,化学性质较为稳定,主要反应包括燃烧、卤代反应、裂解等。
2. 烯烃和炔烃的性质:烯烃和炔烃由于含有不饱和键,化学性质活泼。
主要反应包括加成反应、聚合反应等。
3. 醇的性质:醇具有活泼的羟基官能团,可溶于水,可以发生酸碱反应、脱水反应等。
4. 醚的性质:醚的两个碳原子之间有氧原子相连,具有较高的沸点,可以发生酸催化的开环反应。
5. 醛和酮的性质:醛和酮是含有羰基的有机化合物,具有一定的活泼性。
可发生还原、缩合等反应。
6. 羧酸的性质:羧酸含有羧基,可发生酸碱反应、酯化反应和脱羧反应等。
7. 酯的性质:酯是醇和羧酸反应得到的产物,具有芳香气味,可发生水解和酸催化的开环反应等。
四、立体化学1. 手性和对映体:手性是有机化合物分子具有非对称碳原子或轴手性,导致分子存在对映体。
2. 光学活性:具有手性的有机化合物具有旋光性,可使偏振光发生旋转。
旋光性分为左旋和右旋两种。
_有机化学基础 综合复习2 核心突破卷(十一)高二化学人教版选修5有机化学基础

2021年人教选修5核心突破(十一)(命题范围:《有机化学基础》综合内容)一、选择题(本题包括15小题,每小题4分,共60分。
每小题只有一个选项符合题意)1.化学与材料、生活和环境密切相关。
下列有关说法中错误的是()A.新型材料聚酯纤维、光导纤维都是由有机高分子化合物制得的B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性C.开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量D.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料2.下列有关物质的表达式正确的是()A.乙炔分子的比例模型示意图:B.溴乙烷的电子式:C.乙醇的结构简式:CH3CH2OH D.1,3-丁二烯的分子式:C4H83.下列有关有机物的说法中正确的是()A.乙醇能被氧化成乙酸,两者都能与金属钠反应B.纤维素、淀粉、蛋白质、油脂都是天然高分子化合物C.1mol乙醇与1mol乙酸在浓硫酸做催化剂和加热的作用下,可合成1mol乙酸乙酯D.有机化合物中碳原子都是以最外层的4个电子与其它4个原子形成4个共价键4.有关天然产物水解的叙述不正确的是()A.油脂酸性水解可得到高级脂肪酸和丙三醇B.油脂的碱性水解反应是皂化反应,可制得肥皂C.蛋白质水解的最终产物均为氨基酸D.纤维素水解与淀粉水解得到的最终产物不同5.下列有机物:①C(CH3)3-C(CH3)3②C(CH3)4③CH3-O-C(CH3)3④C(CH3)3-CO-CH3,在核磁共振谱图中只有一个波峰的是()A.①②B.③④C.①③D.②④6.某聚合物具有如下结构片段:下列关于其单体的说法错误的是()A.能使酸性KMnO4溶液褪色B.与NaOH溶液共热可生一种钠盐C.能催化加氢生成2-甲基丙酸甲酯D.可形成顺反异构体7.下列说法正确的是()A.丙烷是直链烃,所以分子中3个碳原子在一条直线上B.丙烯所有原子均在同一平面上C.所有碳原子一定在同一平面上D.至少有16个原子共平面8.某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种,则这种烃可能是()①分子中含有7个碳原子的芳香烃②分子中含有4个碳原子的烷烃③分子中含有12个氢原子的烷烃④分子中含有8个碳原子的烷烃A.①②B.②③C.③④D.②④9.某甲酸溶液中含有甲醛,用下列方法可以证明的是()A.加入足量的新制氢氧化铜并加热煮沸,有砖红色的沉淀B.加入过量的氢氧化钠充分反应后的溶液能发生银镜反应C.将试液进行酯化反应后的混合液能发生银镜反应D.加入足量氢氧化钠后,蒸馏出的气体通入新制的氢氧化铜悬浊液加热有砖红色沉淀10.下列有关卤代烃的说法中正确的是( )A .在浓硫酸作用下可水解成相应的醇B .滴加AgNO 3溶液可产生白色沉淀C .该卤代烃发生消去反应只能生成一种烯烃D .该卤代烃经过消去、加成、消去只能生成一种烯烃11.有机物甲可氧化生成羧酸,也可还原生成醇,由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C 2H 4O 2。
高中-《有机化学基础》复习提纲

《有机化学基础》复习提纲一、有机物组成的表示方法例:写出乙酸的分子式、电子式、结构式、最简式?二、几个概念1、官能团:是决定有机物化学特性的原子或原子团。
例:指出右边有机物所含官能团,预测其性质。
2、基:例: 写出氨基的电子式和丁基的结构简式?3、同系物的概念:例如:CH3CH2OH和丙三醇,甲苯和苯乙烯,互为同系物?4、同分异构体的类别——官能团异构——官能团结合在不同的碳原子上——支链多少与大小的改变例如:写出C7H8O(含有苯环)的同分异构体?三、典型有机物的命名例如:四、有机物的物理性质1.沸点(1)同类物质:碳原子个数不同时,随分子中碳原子数的增多,分子间作用力增大,沸点逐渐升高;碳原子个数相同时,支链越多,沸点越低。
(2)不同类物质:碳原子个数相同时,其沸点的变化规律一般为:羧酸>醇>醛>烷。
2.水溶性(1)溶于水(或互溶)的常见有机化合物有:低级的醇、醛、羧酸等。
(2)不溶水(或难溶水)的常见有机化合物有:烃、卤代烃(包括溴苯、四氯化碳等),酯(包括油脂)、高级脂肪酸、硝基苯。
(3)苯酚的溶水性大小受温度影响,650C以上能与水互溶,650C以下在水中溶解度不大。
3.密度(1)密度比水小(在水溶液上层)的有机化合物有:烃(汽油、苯、苯的同系物)、一氯化烷、酯、油脂、高级脂肪酸等。
(2)密度比水大(在水溶液下层)的有机化合物有:溴苯、硝基苯、苯酚、四氯化碳、溴乙烷等。
五、有机物的化学性质(烃及其衍生物官能团转化图)糖、油脂和蛋白质的结构性质六、有机化学的反应类型1.取代反应(1)卤代反应——烷烃、苯,苯的同系物,苯酚、醇、饱和卤代烃等.(2)硝化反应——苯、苯的同系物、苯酚注意:硝化反应一般情况指苯环上...的氢原子被硝基取代的反应.(3)水解反应——卤代烃、酯、油脂、糖、蛋白质.水解条件应区分清楚.如:卤代烃——强碱的水溶液;糖——强酸溶液;酯——无机酸或碱(碱性条件水解反应趋于完全);油脂——无机酸或碱(碱性条件水解反应趋于完全)、高温水蒸气;蛋白质——酸、碱、酶(4)酯化反应——醇、酸(包括有机羧酸和无机含氧酸)2.加成反应:分子中含有等可能加成3.消去反应注意:卤代烃和醇发生消去反应的实验条件不同,但结构条件同。
有机化学基础复习题

高二化学有机化学基础模块试题质量检测一、选择题1.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是A .纤维素、脂肪B .蛋白质、高级烃C .淀粉、油脂D 蛋白质、硬化油2.北京奥运会火炬“祥云”燃烧系统内装环保型燃料——丙烷。
下列关于丙烷说法不正确的是A .分子中的碳原子不在同一条直线上B .光照下能够发生取代反应C .比丁烷更容易液化D .是石油分馏的一种产品3.常温常压下为气体的有机物是①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤甲酸 ⑥甲酸甲酯A .①②B .②④⑤C .③⑤⑥D .①④4.下列物质中,在一定条件下既能发生水解反应,又能发生银镜反应的是A .蔗糖B .葡萄糖 c .麦芽糖 D .乙酸甲酯5.下列有机物中加入溴水,充分振荡后静置,观察到水层变为无色,有机溶液层为橙黄色,该有机物是A .苯B .1-己烯C .1,3-丁二烯D .乙醛6.能在KOH 的醇溶液中发生消去反应的是7.下列实验能成功的是A .将乙酸和乙醇混合加热制乙酸乙酯B .苯和浓溴水反应制溴苯C .32CH CH Br 中滴加3AgNO 溶液观察是否有浅黄色沉淀,判断卤代烃的类型D .用4CuSO 溶液和过量NaOH 溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀8.鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌作用。
已知角鲨烯分子有30个碳原子,其中有6个碳碳双键,且不含环状结构,则其分子式为A .3060C HB .3056C H C .3052C HD .3050C H9.下列化学用语正确的是( )A.聚丙烯的结构简式:B.丙烷分子的比例模型:C.四氯化碳分子的电子式:D.2-乙基-1,3-丁二烯分子的键线式:10.有机物的天然提取和人工合成往往得到的是}昆合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是A .分离、提纯→确定化学式→确定实验式→确定结构式B .分离、提纯→确定实验式→确定化学式→确定结构式C .分离、提纯→确定结构式→确定实验式→确定化学式D .确定化学式→确定实验式→确定结构式→分离、提纯11.对于玻璃器皿上粘有的一些水洗不掉的残留物,其洗涤方法正确的是①残留在试管内壁上的碘,用酒精洗涤。
高二化学有机知识点总结(12篇)

高二化学有机知识点总结(12篇)篇1:高二化学知识点总结1.制硝基苯(―NO2,60℃)、制苯磺酸(―SO3H,80℃)、制酚醛树脂(沸水浴)、银镜反应、醛与新制的Cu(OH)2悬浊液反应(热水浴)、酯的水解、二糖水解(如蔗糖水解)、淀粉水解(沸水浴)。
2.常用新制Cu(OH)2、溴水、酸性高锰酸钾溶液、银氨溶液、NaOH 溶液、FeCl3溶液。
3.Cu(OH)2共热产生红色沉淀的):醛类(RCHO)、葡萄糖、麦芽糖、甲酸(HCOOH)、甲酸盐(HCOONa)、甲酸酯(HCOOCH3)等。
14X(卤原子:氯原子等)、―OH(羟基)、―CHO(醛基)、―COOH(羧基)、―COO―(酯基)、―CO―(羰基)、―OC=C(碳碳双键)、―C≡C―(碳碳叁键)、―NH2(氨基)、―NH―CO―(肽键)、―NO2(硝基)。
1、电解池:把电能转化为化学能的装置。
(1)电解池的构成条件①外加直流电源;②与电源相连的两个电极;③电解质溶液或熔化的电解质。
(2)电极名称和电极材料①电极名称阳极:接电源正极的为阳极,发生x氧化xx反应;阴极:接电源负极的为阴极,发生xx还原xx反应。
②电极材料惰性电极:C、Pt、Au等,仅导电,不参与反应;活性电极:Fe、Cu、Ag等,既可以导电,又可以参与电极反应。
2、离子放电顺序(1)阳极:①活性材料作电极时:金属在阳极失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电。
②惰性材料作电极(Pt、Au、石墨等)时:溶液中阴离子的放电顺序(由易到难)是:S2->I->Br->Cl->OH->含氧酸根离子。
(2)阴极:无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。
3、阳离子在阴极上的放电顺序是:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+1.纯碱、苏打:Na2CO32.小苏打:NaHCO33.大苏打:Na2S2O34.石膏(生石膏):CaSO4・2H2O5.熟石膏:2CaSO4・.H2O6.莹石:CaF27.重晶石:BaSO4(无毒)8.碳铵:NH4HCO39.石灰石、大理石:CaCO310.生石灰:CaO11.食盐:NaCl12.熟石灰、消石灰:Ca(OH)213.芒硝:Na2SO4・7H2O(缓泻剂)14.烧碱、火碱、苛性钠:NaOH15.绿矾:FaSO4・7H2O16.干冰:CO217.明矾:KAl(SO4)2・12H2O18.漂:Ca(ClO)2、CaCl2(混合物)19.泻盐:MgSO4・7H2O20.胆矾、蓝矾:CuSO4・5H2O21.双氧水:H2O223.石英:SiO224.刚玉:Al2O325.水玻璃、泡花碱:Na2SiO326.铁红、铁矿:Fe2O327.磁铁矿:Fe3O428.黄铁矿、硫铁矿:FeS229.铜绿、孔雀石:Cu2(OH)2CO330.菱铁矿:FeCO331.赤铜矿:Cu2O32.波尔多液:Ca(OH)2和CuSO433.玻璃的主要成分:Na2SiO3、CaSiO3、SiO234.天然气、沼气、坑气(主要成分):CH435.水煤气:CO和H236.王水:浓HNO3、浓HCl按体积比1:3混合而成。
高二有机化学知识点归纳

高二有机化学知识点归纳一、有机化合物的分类1、按碳骨架分类(1)链状化合物:这类有机化合物分子中的碳原子相互连接成链状。
(2)环状化合物:又可分为脂环化合物和芳香化合物。
脂环化合物分子中含有碳环,但不含苯环;芳香化合物分子中含有苯环。
2、按官能团分类官能团是决定有机化合物特性的原子或原子团。
常见的官能团有:碳碳双键(>C=C<)、碳碳三键(—C≡C—)、羟基(—OH)、醛基(—CHO)、羧基(—COOH)、酯基(—COO—)、醚键(—O—)、氨基(—NH2)等。
二、烃1、甲烷(1)甲烷的分子结构:甲烷分子是正四面体结构,碳原子位于正四面体的中心,四个氢原子位于正四面体的四个顶点。
(2)甲烷的化学性质①稳定性:通常情况下,甲烷性质稳定,与强酸、强碱、强氧化剂等都不反应。
②燃烧反应:CH4 + 2O2 点燃→ CO2 + 2H2O③取代反应:在光照条件下,甲烷与氯气发生取代反应,生成一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳。
2、乙烯(1)乙烯的分子结构:乙烯分子中含有碳碳双键,其结构简式为CH2=CH2。
(2)乙烯的化学性质①氧化反应a 燃烧:C2H4 + 3O2 点燃→ 2CO2 + 2H2Ob 使酸性高锰酸钾溶液褪色②加成反应:乙烯能与氢气、氯气、水等发生加成反应。
③加聚反应:nCH2=CH2 催化剂→ CH2—CH2n3、苯(1)苯的分子结构:苯分子是平面正六边形结构,碳碳之间的化学键是一种介于单键和双键之间的独特的键。
(2)苯的化学性质①稳定性:苯性质稳定,不能使酸性高锰酸钾溶液褪色。
②燃烧反应:2C6H6 + 15O2 点燃→ 12CO2 + 6H2O③取代反应:苯能与液溴、浓硝酸等发生取代反应。
三、烃的衍生物1、乙醇(1)乙醇的分子结构:乙醇的结构简式为 C2H5OH,官能团为羟基(—OH)。
(2)乙醇的化学性质①与钠反应:2C2H5OH +2Na → 2C2H5ONa +H2↑②氧化反应a 燃烧:C2H5OH + 3O2 点燃→ 2CO2 + 3H2Ob 催化氧化:2C2H5OH +O2 Cu/Ag→ 2CH3CHO + 2H2O③酯化反应:乙醇与乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯。
高二有机化学知识点归纳

高二有机化学知识点归纳有机化学是高中化学的重要组成部分,对于高二的同学来说,掌握好这部分知识至关重要。
以下是对高二有机化学知识点的详细归纳。
一、有机化合物的分类1、按照碳骨架分类链状化合物:这类化合物中的碳原子相互连接成链状。
环状化合物:又分为脂环化合物(如环己烷)和芳香族化合物(如苯)。
2、按照官能团分类烃:仅由碳和氢两种元素组成的有机化合物。
包括烷烃、烯烃、炔烃、芳香烃等。
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物。
常见的官能团有卤素原子(X)、羟基(OH)、醛基(CHO)、羧基(COOH)、酯基(COO)等。
二、有机化合物的结构特点1、碳原子的成键特点碳原子最外层有 4 个电子,可以形成 4 个共价键。
碳原子之间可以通过单键、双键或三键结合。
碳原子不仅可以与氢原子结合,还可以与其他原子(如氧、氮、硫等)结合。
2、同分异构体概念:具有相同分子式,但结构不同的化合物。
分类:包括碳链异构、位置异构、官能团异构等。
三、烷烃1、通式:CnH2n+2(n≥1)2、物理性质随着碳原子数的增加,烷烃的状态由气态逐渐变为液态、固态。
熔沸点逐渐升高,相对密度逐渐增大。
3、化学性质稳定性:通常情况下,烷烃性质稳定,不与强酸、强碱、强氧化剂等反应。
氧化反应:能在空气中燃烧,生成二氧化碳和水。
取代反应:在光照条件下,能与卤素单质发生取代反应。
四、烯烃1、通式:CnH2n(n≥2)2、化学性质加成反应:能与氢气、卤素单质、卤化氢、水等发生加成反应。
氧化反应:能使酸性高锰酸钾溶液褪色。
加聚反应:由小分子烯烃通过加成聚合生成高分子化合物。
五、炔烃1、通式:CnH2n-2(n≥2)2、化学性质加成反应:与烯烃类似。
氧化反应:能使酸性高锰酸钾溶液褪色。
六、芳香烃1、苯结构:平面正六边形,所有原子共平面,碳碳键是介于单键和双键之间的独特的键。
物理性质:无色、有特殊气味的液体,不溶于水,密度比水小。
高二化学选修《有机化学》复习提纲
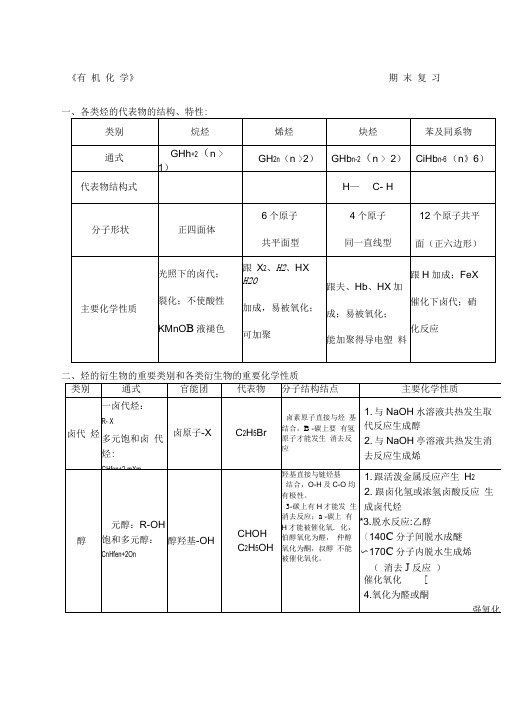
《有机化学》期末复习一、各类烃的代表物的结构、特性:二、烃的衍生物的重要类别和各类衍生物的重要化学性质三、重要的有机反应及类型1取代反应(1) 酯化反应(2) 水解反应aOH卜CHCI+H2O ? C 2H OH+HCI CH 3COOC I+HO H+CH 3COOH+HOH(3)(4)(5)2. 加成反应CH~CH^ CH 2+KBr+HO CH,—C —H + H 3 —*CH 3CH 2OH ,氧化反应 ''(2) 醇、醛的催化氧化:CH 3CHO + 2Cu(OH> + NaO^-CHCOONa + Cd + 3HO (4)被强氧化剂氧化:烯、炔、醇、醛、酚、苯的同系物等被酸性高锰酸钾氧化(1) 能与H 加成的反应:(烯、炔、苯环、醛基、酮)6. 聚合反应7. 中和反应CH )—C —OH T HaOH —- CH,—C —(Th +四、重要的反应.,1. 能使溴水(Br 2/H 2O )褪色的物质CH,—CH —CHj(烯烃与 X 2、H 2O HX H 2)CLCH, CH=CH a + Htl 3 乙醇HO C HOH170绡 尸严LH OHCHjoHCH f +HbO CHkCH-CHBr+KOHCH, C-0H4.(1)燃烧反应:2C 2Hb +5Q 4CG+2HO?2CH a CHOH+O2CH 3CHO+22OAg 550 °CI2CHj —C —Oil2CHCHO+O(3)被弱氧化剂氧化:CHCHO + 2Ag(NH)2OHIICHj —C —ONH*+ 2 AgJ +3NH + H 2O①通过加成反应使之褪色:含有…、-CW 的不饱和化合物②通过取代反应使之褪色:酚类(注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀[三溴苯酚]。
)③通过氧化反应使之褪色:含有-CH 0(醛基)的有机物(有水参加反应)(注意:纯净的只含有一CH(醛基)的有机物不能使溴的四氯化碳溶液褪色)2. 能使酸性高锰酸钾溶液KMn OH+褪色的物质含有…」、-y、-0H (较慢)、-CH0的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物(与苯不反应)3.与Na反应的有机物:-OH、-COOH与NaOH反应的有机物:酚羟基、-COOH加热时能与卤代烃、酯反应(取代反应)与NaCO反应的有机物:酚羟基反应生成酚钠和NaHCO -COOH反应放出CO 气体。
高二化学选修5《有机化学基础》知识点整理

高二化学选修5《有机化学基础》知识点整理班级姓名学号一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(....-.29.8....CCl....℃.)....2.F.2.,沸点为..3.Cl..,.沸点为...-.24.2.....CH....℃.).氟里昂(氯乙烯(...HCHO....,沸点为....℃.).甲醛(....-.21..℃.)...2.==CHCl....-.13.9....CH......,沸点为氯乙烷(....℃.).一溴甲烷(CH3Br,沸点为3.6℃)....12.3....CH..2.C.l.,沸点为..3.CH四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)甲乙醚(CH3OC2H5,沸点为10.8℃)环氧乙烷(,沸点为13.5℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
有机化学基础知识点总复习

有机化学基础知识点总复习一、协议关键信息1、有机化学的基本概念有机化合物的定义与特点:____________________________官能团的概念与常见官能团:____________________________同系物、同分异构体的定义与判断:____________________________2、烃类化合物烷烃的结构、性质与命名:____________________________烯烃的结构、性质与加成反应:____________________________炔烃的结构、性质与化学性质:____________________________芳香烃的结构、性质与苯的同系物:____________________________3、烃的衍生物卤代烃的性质与卤代烃的取代反应:____________________________醇的结构、性质与醇的氧化反应:____________________________酚的结构、性质与酚的酸性:____________________________醛的结构、性质与醛的氧化还原反应:____________________________羧酸的结构、性质与羧酸的酯化反应:____________________________酯的结构、性质与酯的水解反应:____________________________4、有机化学反应类型取代反应的特点与常见实例:____________________________加成反应的特点与常见实例:____________________________消去反应的条件与常见实例:____________________________氧化反应与还原反应的判断与常见反应:____________________________聚合反应的分类与常见聚合反应:____________________________5、有机化合物的合成合成路线的设计原则:____________________________官能团的引入与转化方法:____________________________有机合成中的保护与去保护策略:____________________________6、有机化合物的结构鉴定红外光谱、核磁共振氢谱的原理与应用:____________________________有机化合物结构推断的方法与思路:____________________________二、协议内容11 有机化学的基本概念111 有机化合物是指含碳的化合物,但一些简单的含碳化合物如一氧化碳、二氧化碳、碳酸盐等通常被归类为无机化合物。
有机化学基础复习提纲

有机化学基础复习提纲一、烯烃和炔烃:-C — -C C —1、氧化反应CnH 2n+()O 2nCO 2+nH 2OCnH 2n-2+()O 2nCO 2+(n -1)H 2O②能使溴水和酸性KMnO 4溶液褪色。
2、加成反应:可与H 2 、HX 、 H 2O 、 HCN 加成。
完成下列反应: RCH=CHR /+XRCH CHR /+X 2RCH CHR /+2X与HX 加成时,H 加在含H 较多的C 上。
即马氏规则。
3、加聚反应: nCH 2=CH 2nCH 2=CH-CH=CH 2CH CH + HClnCH 2=CHCl4、结构特点及实验室制取制CH2=CH2的反应原理:同类反应:RCH 2CH 2OHRCH=CH 2 + H 2O制CH CH 的反应原理:同类反应:ZnC 2+2H 2O Zn(OH)2+C 2H 2↑ Mg 2C 3+4H 2O2Mg(OH)2+C 3H 4↑(复分解反应原理,元素化合价不变)原子空间结构特点:与碳碳双键碳直接相连的原子与双键碳在同一个平面上;与碳碳三键直接相连的原子与三键碳在同一条直线上。
5、特殊物质:1,3-丁二烯: CH 2=CH —CH=CH 2 异戊二烯: CH 2=C —CH=CH 2二、苯及其同系物通式:CnH 2n -6 (n ≥6)苯:C 6H 6 正六边形,与苯环直接相连的原子与苯环碳在同一平面内。
性质:1、取代反应:A 、溴代反应:液溴、Fe 作催化剂(或FeBr 3作催化剂)+ Br 2B 、硝化反应:浓HNO 3 浓H 2SO 4 水浴加热+ HNO 3 +3HNO 3注:发生在邻、对位上的取代。
C 、磺化反应:浓硫酸、水浴加热 +H 2SO 4(浓)X 2发生取代反应时,若光照条件则发生在侧链上,若催化条件则发生在苯环上。
+Cl +HCl+Cl 2+HCl2、加成反应(只与H 2 、Cl 2加成) +3H 23、氧化反应:A 、燃烧生成CO 2和H 2OB 、苯不能使酸性KMnO 4溶液褪色,苯的同系物能使KMnO 4/H +褪色,但不能使溴水褪色。
高二《有机化学基础》知识总结

1、常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但高于65℃任意比互溶。
3、所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
4、能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物。
能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、CCl4、氯仿、液态烷烃等。
5、能使酸性高锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
6、碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
8、属于取代反应范畴的有:卤代、硝化、磺化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
9、能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(CH2=CHCOOH)及其酯(CH3CH=CHCOOCH3)、油酸甘油酯等。
10、能发生水解的物质:金属碳化物(CaC2)、卤代烃(CH3CH2Br)、醇钠(CH3CH2ONa)、酚钠(C6H5ONa)、羧酸盐(CH3COONa)、酯类(CH3COOCH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)(—C6H10O5—n)、蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。
11、能与活泼金属反应置换出氢气的物质:醇、酚、羧酸。
高二化学知识点大全有机物

高二化学知识点大全有机物在高中化学中,有机物是化学知识中的一个重要部分。
有机物主要由碳元素构成,可以分为多个类型,如碳氢化合物、醇类、酮类等等。
下面将介绍一些高二化学中的有机物知识点。
一、碳氢化合物(烃类)碳氢化合物是由碳和氢元素构成的化合物,是有机化合物的基础。
根据碳原子之间的连接方式,碳氢化合物可以分为脂肪烃、环烃和烯烃等几种类型。
1. 脂肪烃:由碳原子形成直链或支链结构。
常见的脂肪烃有甲烷、乙烷、丙烷等。
脂肪烃是石油和天然气的主要组成部分,也是常见的燃料。
2. 环烃:由碳原子形成环状结构。
常见的环烃有环己烷、环丁烷等。
环烃在化学工业中广泛应用,如用于合成塑料和橡胶等。
3. 烯烃:含有至少一个碳-碳双键的烃类化合物。
例如乙烯是一种重要的烯烃,广泛应用于化学工业中。
二、醇类醇类是由氧原子连接到一个或多个碳原子上的有机化合物,通式为R-OH。
醇可以分为一元醇、二元醇、三元醇等多个类型。
1. 一元醇:醇分子中只有一个羟基(-OH)存在。
例如乙醇、甲醇等。
2. 二元醇:醇分子中有两个羟基存在。
例如乙二醇。
三、酮类酮类是由碳原子形成一个羰基(C=O)的有机化合物。
酮类的通式为R1-CO-R2,其中R1和R2可以是不同的有机基团。
四、醛类醛类是由碳原子形成一个羰基(C=O)和一个氢原子的有机化合物。
醛类的通式为R-CHO,其中R可以是不同的有机基团。
五、有机酸有机酸是由碳原子形成羧基(-COOH)的有机化合物。
常见的有机酸包括甲酸、乙酸等。
六、酯类酯类是由醇和有机酸反应生成的化合物。
酯类的通式为R-COO-R',其中R和R'可以是不同的有机基团。
七、氨基酸氨基酸是由一个氨基和一个羧基(-COOH)组成的化合物。
氨基酸是生物体内合成蛋白质的基本单位。
以上是一些高二化学中的有机物知识点介绍,有机物在日常生活中广泛存在,了解有机物的性质和应用对于学生学习化学和理解化学现象非常重要。
希望本文能为您提供有机物方面的基础知识,以便更好地理解和应用化学知识。
高中化学总复习之知识讲解—有机化学基本概念(基础)-

高考总复习有机化学基本概念【考纲要求】1、了解有机物的分类。
2、了解官能团、同系物等有机化学基本概念。
认识一些重要的官能团,能辨别其名称和结构。
3、了解有机化合物的习惯命名法,掌握常见简单有机物的系统命名法。
【考点梳理】考点一.有机物分类1、按碳的骨架分类要点诠释:①官能团是中性基团,不带电荷。
②官能团决定有机物的主要化学性质,但相同的官能团连接的方式和位置不同,化学性质也有所不同。
③分子中含有两种或两种以上的官能团时,该分子可能具有多方面的性质,若多种官能团之间互相影响,又可能表现出特殊性质,如羟基与链烃相连时形成的是醇,而直接与苯环相连时形成的是酚。
考点二.基本概念 1、有机物①定义:含碳化合物。
例外:CO 、CO 2、H 2CO 3及其盐、氢氰酸(HCN )及其盐、硫氰酸(HSCN ) 、氰酸(HCNO )及其盐、金属碳化物等归为无机物。
②特性:种类繁多(2000多万种);容易燃烧;容易碳化;受热易分解;化学反应慢、复杂;一般难溶于水。
2、烃:烃是只含C 、H 两种元素的有机物。
如甲烷、乙烯、苯等。
3、芳香化合物:是指含有苯环或其他芳香环的化合物。
4、芳香烃:是指含有苯环或其他芳香环的烃。
芳香烃属于芳香化合物。
5、脂环化合物:是指碳原子之间连接成环状且不是芳香环的化合物,如环己烯、环己烷等。
注意:脂环化合物与芳香化合物的主要区别在于是否含有苯环等芳香环。
6、脂肪烃:指链状烃和脂环烃。
7、醇和酚二者的官能团均为羟基(—OH ),区别在于羟基是否与苯环直接相连。
羟基与苯环直接相连的有机物属于酚;羟基与链烃基、脂环烷基、苯环侧链相连形成的有机物均为醇。
如:为酚类,而为醇类。
CH 2OH考点三.同系物1、同系物的概念:结构相似,分子组成相差若干个CH2原子团的物质。
2、判断依据:官能团的种类、数目相同,分子组成相差若干个CH2原子团。
要点诠释:(1)同系物必须结构相似,即组成元素相同,官能团种类、个数及连接方式相同。
高二有机化学知识点总结

高二有机化学知识点总结有机化学是高中化学中的重要内容之一,它研究的是碳元素以及其在化合物中的特性和反应。
在高二阶段,我们学习了许多有机化学的基本知识和反应类型。
下面是对高二有机化学知识点的总结。
一、有机化合物的结构与命名1. 有机化合物的结构:有机化合物由碳、氢和其他元素如氧、氮、硫等构成。
它们的基本结构有直链烷烃、环烷烃、烯烃、炔烃等。
碳原子是四价的,可以形成共价键。
2. 有机化合物的命名:有机化合物的命名使用国际命名法(IUPAC命名法)。
按照此规则,命名步骤包括确定主链、编号、命名取代基等。
二、有机化合物的性质1. 燃烧性质:大多数有机化合物可以燃烧。
它们在氧气中燃烧时,产生二氧化碳和水,并释放出能量。
2. 溶解性质:有机化合物通常可以溶解于有机溶剂中,如醇、醚等。
这是因为它们之间可以形成分子间力,如氢键、范德华力等。
三、有机化学反应类型1. 加成反应:加成反应是指有机化合物中的两个分子相互作用,形成一个新的分子。
例如,醇与酸发生酯化反应,醇中的-OH基与酸中的-COOH基结合,生成酯。
2. 消除反应:消除反应是指有机化合物中的一个分子分解成两个或更多小分子。
例如,醇在酸性条件下可以脱水生成烯烃。
3. 取代反应:取代反应是指有机分子中的一个原子或原子团被另一种原子或原子团替代。
例如,卤代烃与氢氧化钠反应生成醇。
4. 氧化还原反应:氧化还原反应是指有机化合物中的电子的转移。
例如,醇经过氧化反应可以生成醛或酮。
四、官能团的反应1. 醇的反应:醇可以发生酯化、氧化、脱水等反应。
2. 酮的反应:酮可以进行氧化、羟醛反应等。
3. 羧酸的反应:羧酸可以发生酯化、脱羧等反应。
4. 醛的反应:醛可以进行还原、缩醛等反应。
五、重要的有机化合物1. 烷烃:烷烃是由碳和氢构成的碳氢化合物,分为饱和烷烃和不饱和烯烃、炔烃。
2. 醇:醇是含有-OH官能团的有机化合物,根据-OH所连接的碳原子数目不同,可以分为一元醇、二元醇等。
高中二年级化学有机化学基础

高中二年级化学有机化学基础在高中化学课程中,有机化学是一个非常重要的分支。
它研究碳及其化合物,包括碳氢化合物和含氧、氮、硫等杂原子的有机化合物。
有机化学的基础知识是我们进一步学习并理解有机化合物性质和化学反应机制的基础。
下面,我将从有机化学的结构、命名规则以及有机反应中的重要概念等方面展开介绍。
一、有机化学的结构有机化学的核心是研究碳的化学性质及其化合物的性质。
碳原子有四个价电子,可以形成共价键,而且碳原子容易形成稳定的共价键,这使得碳原子能够形成很多不同的化学物质。
碳与其他原子(如氢、氧、氮等)形成不同的键构成了有机化合物,这些键的特性决定了有机化合物的性质。
有机化合物的基本结构由碳骨架和官能团组成。
碳骨架是由多个碳原子连成的链状、环状或支链状结构,这种结构决定了有机化合物的物理性质和化学性质。
而官能团则是有机化合物中决定其化学性质的部分,如羟基、酮基、酯基等。
二、有机化学的命名规则有机化合物的命名规则是为了统一和准确地表示化合物的结构和性质。
有机化合物的命名采用系统命名法,根据化合物的结构和功能基团来进行命名。
系统命名法有一定的规则和步骤,主要分为三个方面:基础名称、功能基团和位置编号。
基础名称是根据碳骨架的长度和结构来确定的。
一般来说,碳骨架的长度决定了有机化合物的前缀和中缀,而碳骨架的结构则决定了有机化合物的后缀。
功能基团是有机化合物中决定其化学性质的部分,也是命名中的重要元素。
根据有机化合物中的官能团不同,可以添加相应的前缀或后缀来表示。
例如,羢基、醇基、酸基等。
位置编号是用来指示官能团在碳骨架中的位置的。
在命名中,需要确定官能团在碳骨架中的位置,并使用适当的编号来表示。
三、有机反应中的重要概念有机反应是研究有机化合物之间的化学反应及其反应机理的。
了解有机反应的重要概念有助于我们理解有机化学的性质和应用。
1. 亲核试剂和电子受体:亲核试剂具有孤立电子对,它们能够与电子不足的原子或离子形成共价键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8. 烃基
完整版课件ppt
8
二、有机物的物理性质
1. 溶沸点
气态:碳数≤4的各类烃(包括新戊烷)、CH3Cl、甲醛 液态:碳数(5~16)的各类烃,低级烃的衍生物。
烷烃随Mr增加,溶沸点增大;支链越多,溶沸点越低。
关于火炬燃料丙烷问题。
2. 溶解性
亲水基团:羟基、羧基、醛基、酮羰基等。
与浓硫酸、浓硝酸共热制TNT;
酸性高锰酸钾氧化苯环侧链。
完整版课件ppt
11
烃燃烧现象对比
1. CH4燃烧:淡蓝色火焰。 2. C2H4燃烧:火焰明亮,并伴有黑烟。 3. C2H2燃烧:火焰明亮,并伴有浓烈黑烟。
完整版课件ppt
12
烃的衍生物性质
1. 乙醇的化学性质 1. 燃烧 2. 催化氧化 3. 与金属钠取代反应 4. 在浓硫酸作用下脱水
普通高中课程标准实验教科书 有机化学基础
有机化学基础复习
1
一、基本概念
1. 分子式、结构式、结构简式、实验式、键线式 2. 同系物、同分异构 3. 官能团 4. 分类 5. 命名 6. 有机反应类型 7. 高分子、单体
完整版课件ppt
2
官能团 能决定有机物化学特性的原子或原子团。
官能团符号 官能团名称 官能团符号 官能团名称
消去反应: 成醚反应: 5. 酯化反应 6. 醇与HX共热
2. 苯酚的化学性质
1. 酸性 酸性大小:H2CO3>苯酚>HCO3- 与金属钠取代反应:
与NaOH中和反应
2. 与浓溴水取代反应:定量分析
3. 与FeCl3显色反应:检验 3. 溴乙烷的性质
1. 碱性水溶液中水解
2. 碱醇条件下消去
完整版课件ppt
9. 1. 盐析:饱和(NH4)2SO4溶液,分离提纯蛋白质
消去反应 氧化反应
卤代烃消去HX、醇消去H2O
燃烧,醇→醛→羧酸,苯环侧链、 碳碳(叁)双键、 醇酚、醛基被酸性高锰酸钾氧化,氨基→硝基
还原反应
碳碳双(叁)键、苯环、醛酮羰基与H2加成
聚合 反应
加聚反应 缩聚反应
含有碳碳双(叁)键物质通过加成方式聚合
含有双官能团(羧基和醇羟基、羧基和氨基、苯酚和 甲醛)通过脱去小分子方式聚合
13
烃的衍生物性质
4. 乙醛的化学性质
1. 羰基加成反应 与含有活泼H有机物加成反应。
2. 醛基还原性
检验醛基: 与新制Cu(OH)2共热;银镜反应。 能使酸性高锰酸钾溶液、溴水褪色。
5. 乙酸的化学性质
1. 酸的通性
2. 酯化反应 酯化机理:醇去氢、酸去羟基
6. 乙酸乙酯的化学性质
水解反应:酸性条件、碱性条件
完整版课件ppt
5
有机化合物分类
有机化合物
是否含碳、氢以外的元素
烃
碳骨架形状
烃的衍生物
官能团类别
链烃 脂肪烃
环烃
卤代烃 醇
官能团类别
酚 烷烃 烯烃 炔烃 脂环烃 芳香烃
醛 羧酸 酯 酮
环烷烃
饱和烃:烷烃、环烷烃
不饱和烃:烯烃、炔烃、芳香烃
完整版课件ppt
6
基本概念例题
1. 由下列五种基团:-OH、-CH3、-COOH、-C6H5 (苯基)、-CHO,两种不同的集团两两组合,形成的有 机化合物的水溶液能使紫色石蕊试液变红的有
完整版课件ppt
7
基本概念例题
4. 下列物质中属于纯净物的是( A ) A. 丙三醇、氯仿、乙醇钠 B. 苯、汽油、无水酒精 D. 福尔马林、白酒、醋 D. 甘油、冰醋酸、煤
5. 春蚕到死丝方尽,蜡炬成灰泪始干。“丝”和“泪”分别是 蛋白质、高级烃
6. 食用油和石蜡油分别指 高级脂肪酸甘油酯、烃类
CH3COOH、C6H5COOH、OHC-COOH、HCOOH
H2CO3非有机物; C6H5OH酸性太弱,不能使得紫色石蕊试液变色。
2. 下列物质中,一定是同系物的是( C )
A. C2H4和C4H8
B. CH3Cl和CH2Cl2
C. C4H10和C7H16
D. 硬脂酸和油酸
3. 降冰片烯属于 环烃、不饱和烃 。
完整版课件ppt
14
糖类、油脂、蛋白质
糖类(多羟基醛酮)
分类
实例
葡萄糖 单糖
CH2OH(CHOH)4CHO多羟基醛
果糖 多羟基酮
蔗糖
麦芽糖
二糖 无还原性; 水解产物:葡萄糖+果糖
还原性; 水解产物:葡萄糖
多糖
淀粉(C6H10O5)n
纤维素(C6H10O5)n
天然高分子化合物,水解产物葡萄糖
完整版课件ppt
CH3C2H5
3,3,4-三甲基己烷
CH3—CH2—C CH2 C2H5
CH3—CH—CH—CH3 CH3 OH
HO— —CH3
2-乙基-1-丁烯
3-三甲基-2-丁醇 4-甲基苯酚 对甲基苯酚
完整版课件ppt
4
反应类型
反应类型
实例
取代反应
卤代、硝化、磺化、水解、酯化、成醚等
加成反应
碳碳双(叁)键、苯环、醛酮羰基与H2加成; 醛酮羰基与含有活泼H物质的加成
CC —C≡C —
— -X -OH
碳碳双键 碳碳叁键
苯环 卤原子
=
=
-CHO O
R—C —R’ -COOH
O (H)R—C—O—R’
-NH2
醇羟基
-NO2
酚羟基
-SO3H
完整版课件ppt
醛基 酮羰基 羧基 酯基 氨基 硝基 磺酸基
3
有机化合物的命名
类别 烷烃 烯烃 醇 酚
有机物Biblioteka 系统命名CH3 CH3—CH2—C—CH—CH3
完整版课件ppt
10
烃的性质
类别 代表物 烷烃 甲烷
烯烃 炔烃
乙烯
苯 芳香烃
甲苯
化学性质
光照条件下与纯卤素单质取代反应
能使溴的CCl4溶液褪色(加成); 能使酸性高锰酸钾溶液褪色(氧化);
能发生加聚反应。
铁粉存在下与液溴发生取代反应;
与浓硫酸、浓硝酸共热发生硝化反应;
与浓硫酸共热发生磺化反应;
与H2加成反应。
特殊:苯酚在>65℃时与水互溶;
新制Cu(OH)2溶于多羟基化合物中呈绛蓝色。 3. 密度
密度小于水:烃、酯
密度大于水:CCl4、溴乙烷、溴苯、硝基苯
完整版课件ppt
9
三、有机物的化学性质
(一)烃 1. 烷烃 2. 烯(炔)烃 3. 苯及其同系物 4. 石油和煤
(二)烃的衍生物 1. 醇酚 2. 卤代烃 3. 醛酮 4. 羧酸、酯 5. 糖类、油脂、蛋白质
15
糖类、油脂、蛋白质
7. 葡萄糖的化学性质
1. 羟基性质: 多羟基能使新制Cu(OH)2溶液呈现绛蓝色。 2. 醛基性质
8. 油脂(高级脂肪酸甘油酯)
1. 油脂氢化: 制人造奶油
2. 油脂皂化反应: 制肥皂;纯碱洗涤油污。
硬脂酸:C17H35COOH、软脂酸:C15H31COOH、油酸:C17H33COOH
