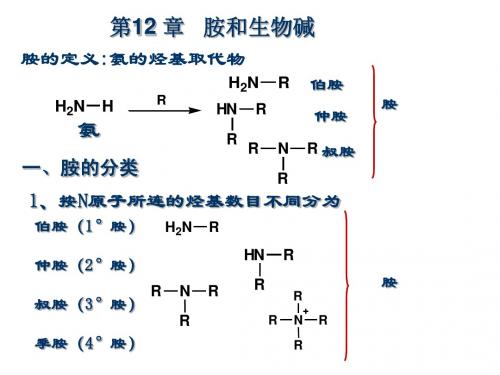
有机胺分类
胺的分类与性质

胺的分类与性质胺是一类具有重要化学性质和广泛应用的有机化合物。
根据分子中氮原子周围的取代基不同,胺可以分为三个主要类别:一级胺、二级胺和三级胺。
本文将对这三类胺的分类、性质和应用进行详细介绍。
一、一级胺一级胺是指胺分子中氮原子周围只有一个碳原子的化合物。
一级胺通常具有较强的氨基性,可以与酸发生中和反应形成相应的盐。
此外,一级胺还具有亲核取代、缩合反应和氧化反应等多种化学性质。
1. 亲核取代反应:一级胺具有亲核性,可以与电荷正电的化合物如卤代烷、酰卤等发生亲核取代反应。
该反应可以生成新的有机化合物,具有重要的合成应用。
2. 缩合反应:一级胺可以与酸醛或酮类发生缩合反应,形成相应的亚胺或酰胺。
这种反应常用于合成具有生物活性的药物分子。
3. 氧化反应:一级胺可以通过氧化反应转化为相应的亚胺、亚胺氧化物或者酰胺。
这些产物在药物合成和有机合成领域具有重要的应用。
二、二级胺二级胺是指胺分子中氮原子周围有两个碳原子的化合物。
与一级胺相比,二级胺的氨基性较弱,但仍然可以进行许多重要的反应和应用。
1. 应用于药物合成:二级胺可以作为药物分子的结构骨架,具有调节生物活性的作用。
常见的药物分子中常含有二级胺结构。
2. 作为溶剂:由于二级胺在水中溶解度较高,因此常用作各类溶剂的组成部分,如有机合成反应中的溶剂。
三、三级胺三级胺是指胺分子中氮原子周围有三个碳原子的化合物。
与一级胺和二级胺相比,三级胺的氨基性最弱。
1. 缓冲剂:由于三级胺具有较弱的酸性或碱性,可以作为缓冲剂使用。
在许多生物学和化学实验中,三级胺常常用于调节溶液的pH值。
2. 催化剂:一些特殊的三级胺化合物可以作为催化剂参与有机合成反应,促进反应的进行。
3. 表面活性剂:一些具有特殊结构的三级胺化合物可以作为表面活性剂使用,用于调节液体表面张力和增加分散性。
结论:胺是一类重要的有机化合物,根据氮原子周围的取代基不同,可分为一级胺、二级胺和三级胺。
每类胺都具有不同的化学性质和应用。
本科五年制 基础 有机化学第12章 胺
N
N
N
N
OH
ONa
无偶联 能力
② 酚或胺:
OH
OH -
偶联慢
NH 2
H+
O-
偶联快
NH 3+
H+ OH-
能偶联
不能偶联
偶联的条件为:低温、弱酸或弱碱。
思考题
重氮盐稳定存在的条件是什么?为什么? 为什么重氮盐被羟基取代要强酸条件,而偶 联反应要弱酸、弱碱?
生物碱 (Alkaloid) 一、生物碱的概念及临床应用
胺
脂肪胺 芳香胺 R-NH2 Ar-NH2
3、根据分子中氨基的数目分类
胺 一元胺 多元胺
CH3CH2NH2 H2NCH2CH2NH2
注:芳香胺为N原子 直接连在芳香环上 的胺,如果不是直 接连在芳香环上, 即使有芳香环也不 属于芳香胺。
4、季铵盐和季铵碱
氢氧化铵或铵盐分子中四个氢原子完全被烃基取代而 成的化合物分别称为季铵碱或季铵盐。
MDMA
2-(2-氯苯基)-2-(甲氨基)环己酮 氯胺酮(K粉)
苯丙胺为中枢神经兴奋剂, 是国家严格管制的精神类药品。 甲基苯丙胺俗称“冰毒”, 属于联合国规定的苯丙胺类毒品。 MDMA 属于致幻剂类毒品,是“摇头丸”的主要成分。 氯胺酮俗称K粉。临床上用作麻醉剂或麻醉诱导剂, 有精神 依赖性,其致幻作用是导致被滥用的主要原因。
R R' N H OH2 "R
R R' H OH 2 H OH 2
< <
N
<
H OH 2 R N H OH 2 H OH 2
H OH2 H2O H N H OH2 H OH2
有机化学-胺
胺和酰胺
第一节 胺
一 二 三 四
胺的 定义
胺的 分类
胺的 命名
胺的 性质
一、胺的定义
氨分子中的氢原子被烃基
定义
所取代的化合物称为胺。 所取代的化合物称为胺。
N
H H H H
N
H CH3 H
N
CH3 CH3
二、胺的分类 胺
按烃基种类 脂肪胺 芳香胺 芳脂胺 按烃基数目 伯胺 仲胺 叔胺 按氨基数目 一元胺 二元胺 三元胺
归纳总结
1
什么是胺、芳香胺、伯胺? 什么是胺、芳香胺、伯胺? 命名胺类应注意什么? 命名胺类应注意什么? 伯胺、仲胺、叔胺的官能团 伯胺、仲胺、 是什么?在性质上有何不同? 是什么?在性质上有何不同? 比较氨、甲胺、 比较氨、甲胺、苯胺的碱性 大小,并用结构理论解释。 大小,并用结构理论解释。
2
3
四、胺的性质
(一)碱性
RNH2 + H2O
+ RNH 3 +
OH
脂肪胺 ﹥ 氨 ﹥ 芳香胺 CH3NH2 pKb
3.34
NH3
4.75 9. 40
NH2
四、胺的性质
苯胺是油状液体,不溶于水, 苯胺是油状液体,不溶于水,可溶于 盐酸中,加入NaOH重新游离出来。 重新游离出来。 盐酸中,加入 重新游离出来
哪些胺是简单胺? 哪些胺是简单胺?
三、胺的命名
CH3 NH2
N H2
苯胺
甲胺
CH3
NH
二甲胺
CH3
NH
二苯胺
CH3
N CH3
三甲胺
CH3
N
三苯胺
三、胺的命名
2. 氮原子上连接脂肪烃基的芳香仲胺和 叔胺,常在脂肪烃基之前冠以“ ” 叔胺,常在脂肪烃基之前冠以“N-”。
有机化学11酰胺

出现黄色 油状物
出现绿色 晶体
b.芳 香族 重氮 盐在 有机 合成 中有 广泛 应用
芳香3O胺
对位占据,则进邻位
绿色晶体
重氮盐是一个非常活泼的化合物,可发生多种 反应,生成多种化合物,在有机合成上基为活化苯环的邻对位定位基,苯胺与溴 水作用,立即生成2,4,6-三溴苯胺白色沉淀。
(3)芳胺:phNH2 > ph2NH > ph3N
( 4)取代胺:对取代芳胺,苯环上连供
电子基时,碱性略有增强;取代基 为吸电子基,碱性减弱,如 (F3C)3N 几乎无碱性。
2、烷基化反应
胺 + 卤代烃 RNH2 伯胺
R’X SN2 R’X
铵盐 RR’2N 叔胺
R’X
RNHR’ 仲胺
RR’3N+X季铵盐
§2.3 酰胺的化学性质
1、酰胺的酸碱性 •氨,胺显碱性 •酰胺中性
•酰亚胺显弱酸性
O NH O + NaOH
O N Na O + H2O
2、水解
3、与亚硝酸反应
酰胺与亚硝酸作用生成相应的羧酸,并 放出氮气。
O R-C-NH2 + HONO O R-C-OH + N2↑ + H2O
难水解酰胺可用此法水解。N-取代酰胺无此反应。
NH3 HCl H2O H2O H2O H2O
RCOOH
RCOONH 4
RCONH
RCN
§2.4 碳酸的酰胺
尿素
尿素又称脲,是碳酸的二酰胺。有酰胺的 一般化学性质。但因两个氨基连在一个羰基上, 所以它又表现出某些特殊的性质。
工业上生产尿素
1、水解反应
尿素在酸、碱或尿素酶的作用下易水解成氨。 —— 氮肥
有机化学胺类和酰胺的性质和反应

有机化学胺类和酰胺的性质和反应有机化学中,氨基基团(-NH2)是常见的官能团之一。
氨基基团可以连接到碳骨架上的不同位置,形成胺类和酰胺。
本文将详细描述胺类和酰胺的性质和反应。
一、胺类的性质和反应1. 胺类的命名与分类胺类按照氨基基团的数量和位置可以分为一级胺、二级胺和三级胺。
一级胺指的是一个碳原子与一个氢原子通过一个键连接,二级胺指的是一个碳原子与两个氢原子通过一个或两个键连接,三级胺指的是一个碳原子与三个氢原子通过一个或两个键连接。
胺类的命名通常使用它们在有机分子中的名称,例如甲胺、乙胺等。
如果一个有机分子中含有多个氨基基团,将其位置和数量用前缀表示,如乙二胺表示乙醇胺。
2. 胺类的物理性质由于氨基基团的电子给予性质,胺类通常呈碱性。
一级胺和二级胺可形成氢键,使它们的沸点和溶解度较高。
与醇类相比,胺类的沸点和溶解度较低,主要是由于胺分子之间较弱的分子间作用力。
3. 胺类的化学性质和反应(1)胺的碱性反应由于氨基基团的弱碱性,胺类可以与酸反应,形成盐。
例如,乙胺与盐酸反应生成乙胺盐酸盐(C2H5NH3Cl)。
(2)胺的氧化反应一级胺在氧化剂的存在下可被氧化为亚硝胺。
例如,乙胺与亚硝酸反应生成亚硝基乙胺(C2H5NHOH)。
(3)胺的磷酸化反应胺类可与磷酰氯反应生成相应的磷酰胺。
例如,乙胺与磷酰氯反应生成乙基磷酰胺(C2H5NHP=OCl)。
(4)胺的取代反应胺类可发生取代反应,取代活泼氢原子的官能团可进一步反应。
例如,氯化乙酰与胺反应生成N-乙酰基乙胺(C2H5NHCOCH3)。
二、酰胺的性质和反应1. 酰胺的命名与分类酰胺是由酰基与胺基形成的化合物,通常按照胺基的数量和位置进行分类。
一级酰胺指的是一个碳原子与一个氨基基团通过一个键连接,二级酰胺指的是一个碳原子与两个氨基基团通过一个或两个键连接,三级酰胺指的是一个碳原子与三个氨基基团通过一个或两个键连接。
2. 酰胺的物理性质酰胺通常具有较高的沸点和溶解度,与醇类和胺类相比,酰胺分子之间的分子间作用力更强。
有机化学 第十七章 胺

邻苯二甲酰亚胺氮上的氢受到两个拉电子基团
影响呈现酸性(pKa8. 3),用K0H处理很容易生成相 应的钾盐。
该法除合成伯胺外,还用于合成α-氨基酸(参
阅第二十一章)。
三、硝基化合物还原 通过硝基化合物还原制备胺类是极为重要的方
法,因芳香硝基化合物很容易由芳烃硝化得到,因 此该法主要用于合成芳香伯胺。还原主要有催化氢 化和化学还原两种方式。
二、盖布瑞尔(Gabriel)合成 由卤代烃直接氨解制备伯胺时常会有仲、叔胺
生成,盖布瑞尔[S. Gabriel(1851—1924)出生于 德国,在Berlin大学获博士学位,而后在该校任化 学教授,主要在胺及氨基酸合成方面作出了贡献。] 提供了一个由卤代烃制备纯伯胺的好方法。邻苯二 甲酰亚胺的钾盐与卤代烃发生亲核取代反应,生成 N-取代亚胺后水解或肼解可获得高产率伯胺。
ቤተ መጻሕፍቲ ባይዱ
工业上由油脂水解得到高级脂肪酸(14.4节), 把该酸转化为酰胺,进而脱水生成腈,催化氢化可 得到长链伯胺(参看15. 3节)
2.酰胺还原
酰胺在醚中用LiAlH4处理可把羰基还原为亚甲 基获得较高产率的胺。氮上无取代基的酰胺可得到
伯胺,N-取代酰胺可得到仲、叔胺。
3.肟的还原 醛、酮与羟氨反应生成肟,肟是不饱和含氮化
17.4 胺的化学反应 由于胺中氮上具有孤对电子,使得它能在化学反
应中提供电子,体现了胺的一系列化学性质,如碱性、 亲核反应及氨基致活芳环上的亲电取代反应等。 一、碱性与成盐
1.碱性 按路易斯(Lewis)酸碱概念讲,反应中接受质子 或提供电子对的化合物为碱。由于胺中孤对电子的存 在,能从水中接受质子,故呈碱性。
七、曼尼希(Mannich)反应 具有α氢的酮与甲醛(或其他简单脂肪醛)及
有机化学之胺类化合物

注意: 1、重氮化反应是胺先溶于过量的酸,再滴加亚硝酸钠溶液 2、酸常用盐酸或硫酸,酸要过量,通常胺:盐酸=1:2.5 3、 低温,0-5℃ 4、亚硝酸的量一般不超过芳胺的量
芳香重氮盐是一个非常活泼的化合物,可发生多种反应. 1)被卤素或氰基取代(桑德迈尔Sandmeyer反应)
N NX
+ -
CuX HCl
-
X + N2 (X=Cl 、Br)
CuCN N NX KCN
+
CN + N2
2)被氢原子取代
N2+ClH3PO2 H2O + N2
次磷酸水溶液、乙醇或甲醛。
N2+HSO4CH3CH2OH + N2
3)被羟基取代 (重氮盐的水解)
N2+HSO4 H+ H2O OH + N2
2 脂肪仲胺和芳香仲胺与亚硝酸反应都得到N-亚硝基胺
•磺酰化:
磺酰基取代胺氮原子上氢的反应,反应在氢氧化钠或氢氧化
钾溶液中进行。
磺酰基:(Ar)R O S O
磺酰化剂:苯磺酰氯或对甲苯磺酰氯
SO2Cl 苯磺酰氯
CH 3
SO2Cl
对甲基苯磺酰氯 ( T sCl )
RNH2 +
SO2Cl
SO2NHR
兴斯堡(Hinsberg)反应 鉴别一级、二级、三级胺
NH 2 O
M nO2 H2SO4, 10 ℃
O 苯胺黑 O
7) 芳香胺芳环上的亲电取代反应 -NH2基是较强的邻、对位定位基,使芳环的亲电取代 反应高度活化 1.卤代
NH2 Br2,H2O Br NH2 Br
(白色)
Br
反应定量完成,可以用于苯胺的定量分析 氨基被钝化后,可停留在一取代阶段
《有机化合物的分类和命名》胺类命名方法

《有机化合物的分类和命名》胺类命名方法在有机化学的广阔领域中,胺类化合物是一类非常重要的有机化合物。
它们在生命活动、医药、化工等众多领域都有着广泛的应用。
而正确地对胺类化合物进行命名,是我们理解和研究它们性质、结构以及进行相关化学反应的重要基础。
胺可以看作是氨(NH₃)分子中的氢原子被烃基取代后的产物。
根据胺分子中氮原子上所连接的烃基种类和数目不同,胺可以分为不同的类型,常见的有伯胺(RNH₂)、仲胺(R₂NH)和叔胺(R₃N)。
这里的 R 代表烃基。
在对胺类化合物进行命名时,我们通常遵循一定的规则和方法。
对于简单的脂肪胺,我们通常以胺作为母体,烃基作为取代基来命名。
例如,甲胺(CH₃NH₂)、乙胺(CH₃CH₂NH₂)等。
当胺分子中含有两个或两个以上相同的烃基时,可以在烃基名称前面加上二、三等数字来表示其数目。
比如,二甲胺((CH₃)₂NH)、二乙胺((CH₃CH₂)₂NH)。
当胺分子中的烃基不同时,我们按照次序规则,将较优基团后列出,并在前面加上“N”,表示该基团连在氮原子上。
例如,甲乙胺(CH₃CH₂NHCH₃)。
对于比较复杂的脂肪胺,我们则将氨基作为取代基来命名。
比如,2-氨基戊烷(CH₃CH₂CH(NH₂)CH₂CH₃)。
对于芳香胺,当芳环上连有其他取代基时,通常以苯胺作为母体来命名。
例如,对硝基苯胺(pNO₂C₆H₄NH₂)、邻氯苯胺(oClC₆H₄NH₂)。
如果芳香胺的氮原子上同时连有脂肪烃基,命名时通常以芳香胺为母体,在脂肪烃基名称前面加上“N”。
比如,N甲基苯胺(C₆H₅NHCH₃)。
当胺分子中同时含有芳香烃基和脂肪烃基时,通常将芳香烃基作为母体,脂肪烃基作为取代基。
例如,苄胺(C₆H₅CH₂NH₂)。
除了上述常见的胺类化合物,还有一些特殊类型的胺,其命名方法也有一定的特殊性。
季铵盐和季铵碱是一类重要的含氮化合物。
季铵盐的命名是将其看作铵盐,负离子在前,正离子在后。
例如,氯化四甲基铵((CH₃)₄N⁺Cl⁻)。
《有机化学》胺

仲胺所生成的苯磺酰胺分子中的氮不连氢 原子,因不能溶于碱性溶液而沉淀析出
18
RNH2 +
SO2Cl
NaOH [
SO2NHR
] SO2NR Na+
溶于水的盐
R2NH +
SO2Cl
SO2 NR2
NaOH 不反应
R3N +
SO2Cl
不反应
19
4.与亚硝酸反应
不同种类的胺与亚硝酸反应的产物各不相同, 所以常用此类反应进行鉴别和合成。 由于亚硝酸不稳定,在反应过程中通常由亚硝 酸钠与强酸作用制得。 (1) 伯胺与亚硝酸的反应
甲胺
二乙胺
甲乙胺
NH2
CH2NH2
NH2
苯胺
苄胺
-萘胺
5
当氮原子上同时连有芳香烃基和脂肪烃基时, 则以芳香胺作为母体,脂肪烃基作为取代基写 在母体名称前,并冠以“N” 字:
NHCH3
CH3 N
CH3
CH3 N
CH2CH3
N-甲基苯胺 N,N-二甲基苯胺 N-甲基-N-乙基苯胺
季铵类化合物的命名与无机铵盐和氢氧化铵的命名 相似。例如:
(2)季铵碱或季铵盐
(CH3)4N+OH-
(CH3)4N+ Cl-
一元胺(含一个氨基)、二元胺(含两个氨基) 和多元胺(含两个以上的氨基)。
CH3CH2CH2NH2
H2N CH2CH2 NH2
一元胺
二元胺
4
(二) 命名 简单胺的命名是以胺为母体。
CH3NH2 CH3CH2NHCH2CH3 H3CNHCH2CH3
H2N
SO3H
CH3CH CO2H H NCH3
有机化学中的胺类化合物

有机化学中的胺类化合物胺类化合物是有机化学中一类重要的化合物,其分子中含有氮原子和碳氢键。
胺类化合物广泛存在于自然界中,也是许多生物活性分子和药物的重要组成部分。
本文将详细介绍胺类化合物的分类、性质以及在实际应用中的重要作用。
一、胺类化合物的分类胺类化合物根据氮原子的取代情况可以分为三类:一级胺、二级胺和三级胺。
1. 一级胺:在一级胺中,氮原子连接着一个碳原子和两个氢原子,它们的一般分子结构可以表示为R-NH₂,其中R代表有机基团。
一级胺可进一步细分为脂肪胺、芳香胺和脂肪芳香胺。
2. 二级胺:二级胺中,氮原子连接着两个碳原子,它们的一般分子结构可以表示为R₂NH。
与一级胺类似,二级胺也可以分为脂肪二胺、芳香二胺和脂肪芳香二胺。
3. 三级胺:三级胺中,氮原子连接着三个碳原子,它们的一般分子结构可以表示为R₃N。
同样地,三级胺也可以分为脂肪三胺、芳香三胺和脂肪芳香三胺。
二、胺类化合物的性质胺类化合物具有许多独特的性质和化学反应。
1. 亲碱性:由于氮原子上的孤电子对,胺类化合物表现出亲碱性。
它们可以与酸反应,形成胺盐,并释放出质子。
2. 氢键形成:胺类化合物中的氮原子可以与氢原子形成氢键。
这种氢键对于化合物的结构和性质具有重要的影响。
3. 氧化性和还原性:胺类化合物可以发生氧化和还原反应。
一级胺可以氧化为亚硝胺和亚胺,而二级胺可以氧化为亚胺。
而对于一些具有还原性的试剂,胺类化合物也可以被还原成相应的胺。
三、胺类化合物的应用由于胺类化合物具有多样的结构和性质,它们在各个领域中都有广泛的应用。
1. 药物化学:许多重要的药物中含有胺类结构。
如肌肉松弛剂中的氨曲南、抗生素中的青霉素以及抗抑郁药物中的丙咪嗪等等。
通过合理设计和合成胺类结构,可以开发出更安全和更有效的药物。
2. 高分子化学:胺类化合物在高分子材料的合成中扮演着重要的角色。
例如,聚胺和多胺可以与多酸反应形成聚离子复合物,从而改变材料的性质和用途。
3. 农业化学:胺类化合物在农业领域中也有广泛的应用。
医学、药学专业用有机化学 胺

例如: CH3CH2CHCH2CH3 NH2
CH3 CH3CH2CHCH2CHC2H5
NH2
3-氨基戊烷
3-甲基-5-氨基庚烷
3.多元胺的命名 类似于多元醇。 例如:
H2NCH2CH2NH2
乙二胺
CH3CH2CHCH2CHCH3 NH2 NH2
2,4-己二胺
NH2 NH2
邻苯二胺
第一节 胺
4.季铵盐和季铵碱的命名 类似于铵盐和碱。 例如:
胺
第一节 胺
一、胺的分类和命名
(一)胺的分类
1.根据氮原子所连的烃基的种类不同 可分为脂肪胺和芳香胺。 例如: 脂肪胺(RNH2)
芳香胺(ArNH2)
NH2
NHCH3
第一节 胺
2.根据氮原子上所连的烃基的数目不同 可分为伯胺、仲胺和叔胺。 Nhomakorabea分类
伯胺、仲胺和叔胺
结构通式
官能团
官能团名称
伯胺(1°胺) 仲胺(2°胺) 叔胺(3°胺)
氢氧化四甲铵
氯化四甲铵
二、胺的性质
脂肪胺中的甲胺、乙胺和二甲胺在常温下为气体,其他低级胺为液体,高 级胺为固体。胺和氨一样是极性分子,伯胺、仲胺都形成分子间氢键而相互缔 合。因此沸点较相应的烷烃高,但比相应的醇和羧酸低。低级胺能与水分子形 成氢键而易溶于水,随着分子量的增加,溶解性降低。芳胺一般微溶或难溶于 水。
R NH2 R
NH R' R
N R" R'
NH2 NH N
氨基 亚氨基 次氨基
3.当NH4+的4个氢原子被烃基取代时称为季铵 R4N+OH-(季铵碱)。
分为R4N+X-(季铵盐) 和
第一节 胺
【有机化学】胺

分子结构中含有碳氮键(C-N)的一类化合物。 广泛分布于自然界中,与日常生活及生命过程密 切相关,在生命科学中占有及其重要的地位 。
1
含氮有机物
硝基化合物 腈
肟 酰胺
胺 Amines 重氮和偶氮化合物 Diazonium Salts & Azo compounds
2
第一节 胺
一、胺的结构、分类和命名 NH3分子中的氢原子被烃基所取代的衍生物。
17
3.与苯磺酰氯反应(兴斯堡反应 Hinsberg )
苯磺酰氯如同酰氯一样能与伯胺、仲胺反应,生 成难溶于水的苯磺酰胺。 苯磺酰氯可用来鉴别伯、仲、叔三种胺。
伯胺所生成的苯磺酰胺
因氮原子上还连一个活 泼的氢原子,它在碱性溶 液中能生成可溶性的盐
叔胺因分子中氮原子 上不连氢原子,所以 与苯磺酰氯不反应
1.5
423.0
3.0
2
329.0
9.0
3
357.0
5.0
5
304.0
3.0
8
286.0
197.0
15
239.0
1842.0
24
286.0
2820.0
24
贮存蔬菜中亚硝酸盐含量的变化(mg/Kg)
贮存时间
亚硝酸盐含量
新鲜
0.00
2天
0.42
4天
1.10
6 天(开始腐烂) 6.70
8 天(完全腐烂) 146.0
H+
R NH2 + HNO2
R OH + H2O + N2
用于伯胺的定量分析 产物复杂,无制备意义
低温条件下,芳香伯胺在强酸性溶液中与亚硝酸 反应,生成芳香重氮盐,该反应称为重氮化反应
有机化学之胺类化合物

sp3 N H3C
112.9 H
o
三甲铵(俗名胆碱)
105.9
o
R1 R2 N R3 N
R1 R2
H
脂肪胺:
R3
1.氮原子为SP3杂化,分子呈棱椎状,键角略小于109.5°
2.一对弧对电子占据一个SP3杂化轨道,在棱椎的顶点,压缩了
其它三个键, 孤电子对使胺具有亲核性、碱性.
3.如果氮原子连有三个不同基团,理论上似应有手性,存在对映
R NH3Cl
+ NaOH
RNH2 + Cl + H2O
胺的碱性强弱 A、碱性强度:脂肪胺 > 氨 > 芳香胺
CH3NH2
PKb
(CH3)2NH 3.27
(CH3)3N 4.21 CH3 8.92
NH3 4.76 NH2
NH2 9.37
3.38 O2N
NH2 13.0
B、脂肪胺 •在气态时碱性: (CH3)3N > (CH3)2NH > CH3NH2 > NH3 •在水溶液中碱性: (CH3)2NH > CH3NH2 > (CH3)3N > NH3 原因: •气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大。 •在水溶液中,碱性的强弱决定于电子效应、溶剂化效应等。 溶剂化效应——铵正离子与水的溶剂化作用(胺的氮原子上的氢与水形成氢 键的作用)。胺的氮原子上的氢越多,溶剂化作用越大,铵正离子越稳定, 胺的碱性越强。
• 物理性质
1 存在状态:常温下,甲胺、二甲胺、三甲胺为气体,其余低 级脂肪胺为液体。十二胺以上为固体。
2 胺有不愉快难闻的气味,低级胺有臭鱼腥味 3 除叔胺外, 10 胺、20胺能形成分子间氢键。(N-H· · · N)弱于 (O-H· · · O)。其沸点高于分子量相近的非极性化合物,低于醇。
有机化学基础知识点整理胺和胺类化合物

有机化学基础知识点整理胺和胺类化合物胺和胺类化合物是有机化学中的重要概念和研究对象。
它们在生物体内起着重要的作用,并广泛应用于药物、染料、材料等领域。
本文将对胺和胺类化合物的基础知识点进行整理,包括定义、命名、性质等方面。
一、胺的定义和分类胺是一类含有氮原子的有机化合物,它的一般分子结构可以表示为R-NH2,其中R表示有机基团。
根据胺分子中氮原子所连接的碳原子数目,胺可以分为三类:1. 一级胺:氮原子连接一个碳原子(R-NH2)。
2. 二级胺:氮原子连接两个碳原子(R-NHR')。
3. 三级胺:氮原子连接三个碳原子(R-NR'2)。
二、命名和命名规则胺的命名按照系统命名法进行,主要有以下几点规则:1. 一级胺的命名:根据碳原子与氮原子的连接关系,在有机基团前加上“氨基-”前缀,例如甲胺(CH3NH2)。
2. 二级胺的命名:根据碳原子与氮原子的连接关系,在有机基团前加上“N-”前缀,并在有机基团前加上“N-”前缀以表示其连接的碳原子数目,例如N-甲基乙胺(CH3NHC2H5)。
3. 三级胺的命名:类似二级胺的命名规则,在有机基团前加上“N,N-”前缀来表示其连接的碳原子数目,例如N,N-二甲基乙胺(CH3)2NC2H5)。
三、胺的性质1. 水溶性:一般来说,胺的水溶性随着胺基数目的增加而增加。
一级胺通常是可溶于水的,但随着碳链的增长,溶解度逐渐降低。
2. 氮氢键的极性:胺分子中的氮氢键是极性键,可以被酸或酸性条件下的电子受体所攻击,形成胺盐。
这种形成胺盐的反应常用于胺的分离和制备。
3. 氨基反应性:胺分子中的氮原子具有一定的碱性,可以与酸性物质反应,形成胺盐,例如胺与酸的中和反应。
4. 非氨基反应性:胺分子中的碳原子可以进行一系列的有机反应,如取代反应、亲核加成反应等。
四、应用领域1. 药物领域:胺类化合物被广泛用于药物的合成和设计。
许多药物中含有胺基团,通过调节胺基团的结构和取代基的引入可以改变药物的活性、溶解度和代谢途径等。
有机化学基础知识点整理胺的分类与性质

有机化学基础知识点整理胺的分类与性质胺是一类含有氨基(-NH2)基团的有机化合物,在有机化学中有着重要的地位。
本文将对胺的分类和性质进行整理,以帮助读者更好地理解和应用有机化学中的胺类化合物。
一、胺的分类胺可以分为三类:一级胺、二级胺和三级胺。
分类根据胺分子中氨基的数量来进行区分。
1. 一级胺:一级胺分子中含有一个氨基(-NH2)基团。
例如,乙胺(CH3CH2NH2)就是一级胺的例子。
2. 二级胺:二级胺分子中含有两个氨基(-NH2)基团。
例如,二甲胺(CH3NHCH3)就是一个典型的二级胺。
3. 三级胺:三级胺分子中含有三个氨基(-NH2)基团。
例如,三乙胺((CH3CH2)3N)就是一种常见的三级胺。
二、胺的性质1. 碱性:胺是碱性物质,因为它们可以接受质子(H+),生成相应的盐(如胺盐)。
这是由于胺分子中的氨基具有碱性,并且能够与酸反应形成盐类。
2. 水溶性:较短的一级和二级胺在水中具有较好的溶解性。
但是,随着分子量的增加,水溶性会降低。
3. 气味:一些低分子量的一级和二级胺具有刺激性的氨臭味。
例如,甲胺(CH3NH2)的气味类似于氨水。
4. 反应性:胺具有与其他化合物发生多种反应的特性,如取代反应、酰化反应、胺化反应等。
这些反应使得胺在有机合成中具有广泛的应用。
三、应用举例1. 生物学应用:胺在生物学中有重要的应用,例如作为生物碱、神经递质和抗组胺药物等。
2. 有机合成:胺在有机合成中广泛应用,可用于合成氨基酸、药物、染料等有机化合物。
3. 金属提取剂:一些胺类化合物在金属提取过程中具有重要的作用。
总结:通过对有机化学基础知识点整理的胺的分类与性质的讨论,我们了解到胺是有机化学中的重要化合物,具有碱性、水溶性和多种反应性。
其在生物学、有机合成和金属提取等领域都有广泛应用。
对于有机化学学习者来说,掌握胺的分类和性质是理解和应用胺类化合物的基础。
有机化学中的胺性质和反应

有机化学中的胺性质和反应胺是有机化合物中含有氮原子的一类化合物。
它们的结构形式为R-NH2,其中R代表一个有机基团。
胺分为三类:一级胺、二级胺和三级胺,根据氮原子与有机基团的连接数量不同进行分类。
胺具有多种性质和反应,对于化学研究和应用具有重要意义。
一、胺的性质1. 氨基特性:胺分子中的氮原子可供给电子对给予亲电试剂。
由于氮原子上的空轨道与孤对电子共振,形成一个带正电的亲电中心,使胺表现出亲电性质。
2. 氢键形成:胺分子中的氢与氮之间形成氢键。
氮原子上的孤对电子可与溶剂中的质子结合形成氢键,使胺分子在溶液中形成聚集态。
3. 碱性:胺分子中的氮原子带有孤对电子,使其具有碱性。
一级胺、二级胺和三级胺的碱性依次降低。
4. 氧化性:胺分子中的氮原子可被氧气氧化为氮氧化物,如N2O、NO等。
氧化性随着胺分子中氮原子上孤对电子的减少而减弱。
二、胺的反应1. 氨基取代反应:一级胺可通过与亲电试剂发生氨基取代反应。
亲电试剂将胺分子中的氨基取代为其他基团,形成新的有机化合物。
例如,一级胺与酸酐反应生成酰胺,与卤代烷反应生成胺盐。
2. 胺氧化反应:胺分子的氮原子能够被氧气或氧化剂氧化,生成相应的氮氧化物。
例如,一级胺与氧气反应生成亚硝胺,进一步氧化可生成互作用较强的亚硝酸。
此外,一氧化氮、二氧化氮等氮氧化物也可通过胺的氧化反应制备。
3. 烷基化反应:二级胺和三级胺可发生烷基化反应。
烷基卤化物与胺反应,发生亲电取代,生成相应的烷基胺。
此反应在有机合成中常用于引入烷基基团。
4. 脱水反应:胺分子中的氢可以与酸类或醛酮类化合物中的氧发生脱水反应,生成亲水胺。
脱水反应常用于制备二胺、脲、胺酮等有机化合物。
总结:胺在有机化学中具有重要的性质和反应。
它们既可以表现出亲电性质,参与氨基取代反应,也可以通过氧化反应生成氮氧化物。
此外,胺还可发生烷基化和脱水等反应。
了解胺的性质和反应有助于理解和应用于有机化学的领域中。
通过进一步的研究和发展,有机化学家们可以利用这些性质和反应来合成新颖的化合物,推动有机化学的发展和应用。
有机化学中的胺与胺衍生物

有机化学中的胺与胺衍生物胺和胺衍生物在有机化学中扮演着重要的角色。
胺是指含有一个或多个氨基(-NH2)官能团的有机物,而胺衍生物则是由胺基官能团和其他官能团组成的化合物。
1. 胺的分类胺可以分为三类:一级胺、二级胺和三级胺。
一级胺是指含有一个氨基和两个有机基团的化合物;二级胺含有两个氨基和一个有机基团;三级胺含有三个氨基和没有氢原子的有机基团。
2. 胺的制备胺的制备方法主要有两种:一是通过氨和卤代烷类发生取代反应制备;二是通过亲核取代反应合成。
此外,还可以通过胺的重排反应或通过还原醛、酮和酸的亲核加成来制备胺。
3. 胺的物化性质胺具有氨的性质,可形成氮氢键,以及独特的碱性。
一级胺和二级胺可形成氮氢键,而三级胺则不具有此性质。
胺还可与酸反应生成相应的盐。
4. 胺的化学反应胺在有机化学反应中表现出多种多样的特性。
例如,胺能够与醛、酮等羰基化合物进行亲核加成反应,生成相应的胺衍生物。
此外,胺还可参与亲电取代、烃化等反应。
5. 胺衍生物的应用胺衍生物在药物合成、染料制备、农药研发等领域具有重要的应用价值。
许多药物中都含有胺基结构,例如氨基酸、生物碱等。
胺衍生物还用于合成有机染料,其中许多染料颜料的颜色来源于胺基基团。
农药中也存在许多胺衍生物,用于控制害虫和病虫害。
6. 胺的重要性胺及其衍生物在有机化学中具有重要的地位。
它们不仅可以作为反应底物,还可以作为反应催化剂或配体参与各种重要有机合成反应。
胺也是许多重要化学品和生物分子的构建块,对于我们理解生命的基本单位和化学反应机理至关重要。
综上所述,胺及其衍生物在有机化学中扮演着不可忽视的角色。
它们的分类、制备方法、物化性质、化学反应和应用都具有一定的特点和重要性。
深入了解和研究胺的性质和反应机理对于推动有机化学的发展和应用具有重要意义。
胺的分类和结构范文

胺的分类和结构范文胺是一种含有氮原子的有机化合物,它可以被看作是水分子中的一个或多个氢原子被烃基或芳香基所取代的产物。
根据氨的取代情况,胺可以分为三类:脂肪胺、芳香胺和芳杂胺。
脂肪胺是指胺中烃基取代了氨基的化合物。
它们可以进一步分为三个亚类:一级胺、二级胺和三级胺。
一级胺的分子中有一个烃基取代了氨基,二级胺有两个烃基取代氨基,三级胺有三个烃基取代了氨基。
例如,甲胺(CH3NH2)是一级芳胺,二甲胺(CH3NHCH3)是二级芳胺,三甲胺(CH3N(CH3)2)是三级芳胺。
芳香胺是指具有芳香环的胺类化合物。
它们能够进一步分为两个亚类:一级芳香胺和二级芳香胺。
一级芳香胺指的是含有一个芳香基和一个氨基的化合物。
典型的一级芳香胺包括苯胺(C6H5NH2),邻苯二胺(C6H4(NH2)2)等。
二级芳香胺是指含有两个芳香基和一个氨基的化合物。
二硝基苯胺(C6H4(NH2)2)是一个例子。
芳杂胺是指芳香胺中一个或多个氢原子被杂原子如硫、氧、或另一个碳原子所取代的化合物。
如苯氨(C6H5AX)中的杂原子可以是硫(乙基巯基苯胺,C6H5SCH2CH2NH2)、氧(乙基氧基苯胺,C6H5OCH2CH2NH2)等。
这类化合物的结构使它们具有特殊的化学和生物活性。
胺的结构可以通过多种方法确定。
最常见的方法是利用光谱技术,如红外光谱、核磁共振谱和质谱等。
这些技术可以提供有关分子键和官能团的信息,从而确定胺分子的结构。
总结起来,胺是一类含有氮原子的有机化合物,根据氮原子和杂原子的取代情况,胺可以分为脂肪胺、芳香胺和芳杂胺。
了解胺的分类和结构对于理解它们的性质和反应机制具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机胺一般是指有机类物质与氨发生化学反应生成的有机类物质。分为七大类,脂肪胺类、醇胺类、
酰胺类、脂环胺类、芳香胺类、萘系胺类、其它胺类等。具体如表中所述。
脂肪胺类
一甲胺
一丙胺
2-丙烯胺
叔丁胺
癸胺
二甲胺
二丙胺
环丙胺
二异丁胺
十二胺
三甲胺
三丙胺
正丁胺
己胺
十六胺
一乙胺
异丙胺
二正丁胺
2-乙基己胺
十八胺
二乙胺
二甲基甲酰胺(DMF)
二甲基乙酰胺(DMAC)
脂环胺类
三亚乙基二胺
二亚乙基三胺
六亚甲基四胺
六亚甲基亚胺
三亚乙基二胺
环乙烯亚胺
吗啉
哌嗪
环己胺
芳香胺类
苯胺
二苯胺
联苯胺
邻苯二胺
间苯二胺
对苯二胺
邻甲基苯胺
间甲基苯胺
对甲基苯胺
2,3-二甲基苯胺
2,4-二甲基苯胺
2,5-二甲基苯胺
2,6-二甲基苯胺
3,4-二甲基苯胺
N,N-二乙基苯胺
N,N-二甲基苯胺
邻溴苯胺
间溴苯胺
对溴苯胺
2,4,5-三氯苯胺
2,4,6-三氯苯胺
2,4-二溴苯胺
2,5-二溴苯胺
2,6-二溴苯胺
邻氟苯胺
间氟苯胺
对氟苯胺
2,4-二氟苯胺
3,4-二氟苯胺
2,3,4-三氟苯胺
邻硝基苯胺
间硝基苯胺
对硝基苯胺
2,4-二硝基苯胺
3-氯-4-氟苯胺
邻硝基对甲苯胺
二异丙胺
异丁胺
己胺
仲丁胺
三辛胺
1,5-二甲基己胺
乙二胺
1,2-丙二胺
1,4-丁二胺
1,10-癸二胺
醇胺类
一乙醇胺
二乙醇胺
三乙醇胺
3-丙醇胺
一异丙醇胺
二异丙醇胺
三异丙醇胺
N,N-二甲基乙醇胺
N,N-二乙基乙醇胺
酰胺类
甲酰胺
乙酰胺
丙酰胺
丁酰胺
异丁酰胺
丙烯酰胺
聚丙烯酰胺
己内酰胺
萘系胺类
1-萘胺
2-萘胺
S酸(劳伦酸)
克拉夫酸
周位酸
吐氏酸
J酸
R酸
H酸
K酸
邻苯二甲酰亚胺
牛磺酸
萘二胺
乙撑双硬脂酰胺(EBS)
其它胺类
聚乙烯亚胺
羟胺
3,5-二甲基苯胺
2,4,6-三甲基苯胺
邻乙基苯胺
N-丁基苯胺
2,6-二乙基苯胺
N-甲酰苯胺
对丁基苯胺
N-乙酰苯胺
3-甲氧基苯胺
邻氯苯胺
间氯苯胺
对氯苯胺
邻乙氧基苯胺
间乙氧基苯胺
对乙氧基苯胺
N-甲基苯胺
2,3-二氯苯胺
2,4-二氯苯胺
2,6-二氯苯胺
3,4-二氯苯胺
3,5-二氯苯胺
2,5-二氯苯胺
N-乙基苯胺
