《二氧化碳和一氧化碳》第二课时课件1
合集下载
《二氧化碳和一氧化碳》PPT精品课件(第2课时)

+ 4
+ 2
每个CO2 分子比每个 CO 分子多一个氧原子,由于分子构成不同,可以推测它们的性质有很大的不同。
二、一氧化碳
1.可燃性
二、一氧化碳
现象
分析
纯净的一氧化碳在空气里燃烧,发出蓝色的火焰,并生成能使澄清的石灰水变浑浊的气体。
一氧化碳在空气里能够燃烧生成二氧化碳。
不纯的一氧化碳燃烧时,可能发生爆炸
不反应
不能燃烧也不支持燃烧
无还原性
无毒
有毒
CO2+Ca(OH)2=CaCO3↓+H2O
二、一氧化碳
CO2
CO
正面作用
负面作用
1.干冰人工降雨和食品保藏
2.灭火
“温室效应”
1.做气体燃料
2.做还原剂(冶金)
易造成煤气中毒
排放造成空气污染
二、一氧化碳
⒉CO的化学性质:
⒈CO的物理性质:
⑴CO具有可燃性。
2. CO密度比空气略小。
收集CO的方法:
收集 CO只能用排水法。
二、一氧化碳
比较 CO 和 CO2 的物理性质
性 质
气体
色、态、味
密 度
溶 解 性
CO
CO2
无色无味的气体
无色无味的气体
比空气略小
比空气大
难溶于水
可溶于水
相 同
不相同
不相同
二、一氧化碳
〈探讨〉CO和CO2 的物理性质不同的原因?
故点燃前,一定要验纯
二、一氧化碳
煤炉里的煤在燃烧过程中,发生了哪些化学反应?
二、一氧化碳
2.还原性:一氧化碳还原氧化铜
二、一氧化碳
实验步骤: 1、通:加热前,先通CO排出玻璃管内的空气 2、点:点燃酒精灯加热 3、撤:还原结束,撤走加热CuO的酒精灯 4、通:继续通CO至试管冷却
+ 2
每个CO2 分子比每个 CO 分子多一个氧原子,由于分子构成不同,可以推测它们的性质有很大的不同。
二、一氧化碳
1.可燃性
二、一氧化碳
现象
分析
纯净的一氧化碳在空气里燃烧,发出蓝色的火焰,并生成能使澄清的石灰水变浑浊的气体。
一氧化碳在空气里能够燃烧生成二氧化碳。
不纯的一氧化碳燃烧时,可能发生爆炸
不反应
不能燃烧也不支持燃烧
无还原性
无毒
有毒
CO2+Ca(OH)2=CaCO3↓+H2O
二、一氧化碳
CO2
CO
正面作用
负面作用
1.干冰人工降雨和食品保藏
2.灭火
“温室效应”
1.做气体燃料
2.做还原剂(冶金)
易造成煤气中毒
排放造成空气污染
二、一氧化碳
⒉CO的化学性质:
⒈CO的物理性质:
⑴CO具有可燃性。
2. CO密度比空气略小。
收集CO的方法:
收集 CO只能用排水法。
二、一氧化碳
比较 CO 和 CO2 的物理性质
性 质
气体
色、态、味
密 度
溶 解 性
CO
CO2
无色无味的气体
无色无味的气体
比空气略小
比空气大
难溶于水
可溶于水
相 同
不相同
不相同
二、一氧化碳
〈探讨〉CO和CO2 的物理性质不同的原因?
故点燃前,一定要验纯
二、一氧化碳
煤炉里的煤在燃烧过程中,发生了哪些化学反应?
二、一氧化碳
2.还原性:一氧化碳还原氧化铜
二、一氧化碳
实验步骤: 1、通:加热前,先通CO排出玻璃管内的空气 2、点:点燃酒精灯加热 3、撤:还原结束,撤走加热CuO的酒精灯 4、通:继续通CO至试管冷却
课题3 二氧化碳和一氧化碳第2课时优秀课件

CO化学性质
2.一氧化碳的毒性
(1)一氧化碳是煤气的主要成分,俗称煤气。一氧化 碳有毒,而且有剧毒。 〔2〕中毒原因
一氧化碳极易与血液中的血红蛋白结合,从而使血红 蛋白不能再与氧气结合,造成生物体内缺氧,严重时会危 及生命。
〔3〕如果发生一氧化碳中毒,轻度的应呼吸大量新 鲜空气,严重的要立即到医院进行治疗。
〔1〕黑色粉末变为红色;〔2〕澄清石灰水变浑浊。 CO + CuO △ Cu + CO2
【思考与交流】
实验结束时,是先熄灭酒精灯,还是先停止通入CO气
体?为什么?
co
C
cuo
A
澄清的
石灰水 B
应先熄灭酒精灯,待玻璃管冷却后再停止通入 一氧化碳气体。
原因分析:假设先停止通入CO,灼热的铜会和玻 璃管中的氧气反响,重新生成黑色的氧化铜。
二氧化碳
一般不能燃烧,也不能支 持燃烧 ,不能供给呼吸
一氧化碳
有可燃性 点燃
2CO + O2 === 2CO2
跟水反应
跟石灰水 反应
还原性或 氧化性
跟水反响 CO2 + H2O == H2CO3
不能跟水反响
能与澄清石灰水反响 C02+Ca(0H)2==CaC03↓+H20
不能与澄清石灰水反响
在一定条件下具有氧化性 高温
CO2
CO2
随堂训练
3.以下表达中不符合实验设计意图的是〔 B 〕
A.说明一氧化碳具有复原性 B.说明生成物二氧化碳的密度比空气大 C.说明一氧化碳和氧化铜的反响需要加热 D.可以防止有毒的一氧化碳气体对空气的污染
随堂训练
4.以下对一氧化碳的认识中,错误的选项是C〔 〕
课题3二氧化碳和一氧化碳(第二课时)
2、CO化学性质
CO 具有还原性
操作:
将纯净的 CO 通过灼热的CuO,再将生成的气体 通入澄清的石灰水中。并对尾气处理。
⑴黑色的CuO粉逐渐变成红色。 现象: ⑵产生的气体使澄清石灰水变浑浊。
结论:
⑴ CO具有还原性;CO + CuO
△
Cu + CO2
⑵ CO2 + Ca(OH)2 CaCO3↓+ H2O ⑶此套装置中增添了尾气处理装置。
CO2
高温
C + 2CuO
2CO
2Cu+CO2
CO
2CO + O2
点燃 2CO2 CO + CuO Cu + CO2
H2
2H2 + O2
点燃
2H2O
H2 + CuO
Cu + H2O
【小复习3】除杂质
CO CO2
CO
怎样除去CO中的CO2
石灰水
CO
怎样除去CO2 中的CO CO 2
CuO
CO2
【练习与思考】
A
B
C
收集CO的方法: 收集 CO只能用排水法。
⒉CO化学性质 操作: ⑴点燃纯净的CO。 ⑵在火焰上方罩一内壁涂有石 灰水的烧杯。 现象:⑴CO燃烧,产生蓝色火焰,放出热量。 ⑵澄清石灰水变浑浊。 点燃 结论:⑴CO具有可燃性。 2CO + O2 2CO2 ⑵CO燃烧的产物是CO2。 CO2 + Ca(OH)2 CaCO3↓+ H2O
物 质 有利的一面(用途) 不利的一面 示例:
H2
可用作高能燃料
使用不当容易引起爆炸
O2
广泛用于支持燃烧; 造成食物的腐烂; 供动植物呼吸 钢铁的锈蚀 可用于民用或工业 燃料 植物的光合作用; 灭火;人工降雨
《二氧化碳和一氧化碳》(共26张)PPT课件

有一种物质, 农民伯伯说它是植物的粮食; 消防官兵赞美它是灭火的先锋; 建筑师称它是粉刷匠; 而环境学家却指责它是导致 温室效应的罪魁祸首。
它是什么?
一、二氧化碳的性质
1.二氧化碳的性质 物理性质:无色无味的气体,可 溶于水,密度大于空气
探究实验1 倾倒二氧化碳的实验
探索问题 1.烧杯内的蜡烛为什么会熄灭? 说明二氧化碳有什么性质? 2.为什么下层蜡烛先熄灭,上层 后熄灭? 3.据此实验说明二氧化碳有什么 性质?
知识点二、一氧化碳的性质 【典例2】下列叙述中不符合实验 设计意图的是( B ) A.说明一氧化碳具有还原性 B.说明生成物二氧化碳的密度比空气大 C.说明一氧化碳和氧化铜的反应需要加热 D.可以防止有毒的一氧化碳气体对空气的污染
2.还原性(一氧化碳还原氧化铜) 仔细观察如图实验,你观察到什么现象?
1.可燃性
注意:点燃CO和空气的混合气也能发生 爆炸!要注意安全!在点燃CO之前也要 先检验CO的纯度。也是用爆鸣法检验。
点燃
2CO+O高2温= 2CO2 C+CO2 = 2CO
点燃
C+O2 = CO2
3.一氧化碳的毒性
一氧化碳有剧毒。这是因为一氧化碳吸进 肺里很容易跟血液里的血红蛋白结合,使血红 蛋白不能很好地跟氧气结合,造成生物体缺氧。 如果吸入较多的一氧化碳,会因缺少氧气而死 亡。
阳光的能量不易散失,从而使全球变
暖,这种现象叫“温室效应”。
③防治措施
②危害 a、两极冰川融化,海平面上升。 b、气候反常,海洋风暴增多 。 c、土地干旱,沙漠化面积增大。
a、尽量减少使用化石燃料
b、利用太阳能、风能等清洁燃料
c、大力植树造林,严禁乱砍滥伐
它是什么?
一、二氧化碳的性质
1.二氧化碳的性质 物理性质:无色无味的气体,可 溶于水,密度大于空气
探究实验1 倾倒二氧化碳的实验
探索问题 1.烧杯内的蜡烛为什么会熄灭? 说明二氧化碳有什么性质? 2.为什么下层蜡烛先熄灭,上层 后熄灭? 3.据此实验说明二氧化碳有什么 性质?
知识点二、一氧化碳的性质 【典例2】下列叙述中不符合实验 设计意图的是( B ) A.说明一氧化碳具有还原性 B.说明生成物二氧化碳的密度比空气大 C.说明一氧化碳和氧化铜的反应需要加热 D.可以防止有毒的一氧化碳气体对空气的污染
2.还原性(一氧化碳还原氧化铜) 仔细观察如图实验,你观察到什么现象?
1.可燃性
注意:点燃CO和空气的混合气也能发生 爆炸!要注意安全!在点燃CO之前也要 先检验CO的纯度。也是用爆鸣法检验。
点燃
2CO+O高2温= 2CO2 C+CO2 = 2CO
点燃
C+O2 = CO2
3.一氧化碳的毒性
一氧化碳有剧毒。这是因为一氧化碳吸进 肺里很容易跟血液里的血红蛋白结合,使血红 蛋白不能很好地跟氧气结合,造成生物体缺氧。 如果吸入较多的一氧化碳,会因缺少氧气而死 亡。
阳光的能量不易散失,从而使全球变
暖,这种现象叫“温室效应”。
③防治措施
②危害 a、两极冰川融化,海平面上升。 b、气候反常,海洋风暴增多 。 c、土地干旱,沙漠化面积增大。
a、尽量减少使用化石燃料
b、利用太阳能、风能等清洁燃料
c、大力植树造林,严禁乱砍滥伐
最新二氧化碳与一氧化碳课件PPT

边的酒精灯。
注意:在点燃或加热任何可燃性气体之前,都必须 先验纯。
注意事项
1、先通入Co一会,是为了防止玻璃管内的空 气没有排尽,加热时发生爆炸 2、继续通入到玻璃管冷却为止,是为了防止 生成的铜重新被氧化为氧化铜 “Co早出晚归,酒精灯迟到早退”,或者“先通 后点防爆炸,先熄后停防氧化” 注:此实验最好在通风橱中进行;防止没除 净的Co使人中毒
点燃
原理: CO2 + 2Mg == 2MgO + C
(2)二氧化碳与碳的反应:
原注:理(:1)燃烧C不O一定2 需+要C氧气高=参温=加;2CO
既是氧化反应, 又是还原反应
(2)二氧化碳在特殊条件下也能支持燃烧。
(3)上述两反应中二氧化碳是氧化剂,镁、碳是还原剂。
(三)二氧化碳的用途 纯碱
沫灭火机
防止一氧化碳中毒的简单方法是:
就是注意室内通风,如果发生一氧化碳中毒, 轻度的应呼吸大量新鲜空气,严重的要立即到医院 进行治疗。
1、实验室为什么先通一氧化碳, 然后加热氧化铜?
排尽装置内的空气,避免一氧化碳与空 气混合加热时发生爆炸。 2、为什么停止加热后还要继续通入一氧 化碳直到玻璃管冷却? 防止生成的铜被氧化成氧化铜。 3、实验装置尾部加了一盏燃着的酒精灯, 目的是什么?
2. 还原性(一氧化碳还原氧化铜)
仔细观察如图实验,你观察到什么现象?
(1)黑色的氧化铜变成了红色的铜; (2)澄清的石灰水变浑浊。
未反应完的尾气一氧化碳最简单的处理方法 是用酒精灯点燃处理,避免散逸到大气中,而污 染环境。也可循环利用作燃料,也可收集起来。
拓展延伸
为了节能减排,可以将CO还原氧化铜的实验 装置进行改进。改进后的优点有哪些?
注意:在点燃或加热任何可燃性气体之前,都必须 先验纯。
注意事项
1、先通入Co一会,是为了防止玻璃管内的空 气没有排尽,加热时发生爆炸 2、继续通入到玻璃管冷却为止,是为了防止 生成的铜重新被氧化为氧化铜 “Co早出晚归,酒精灯迟到早退”,或者“先通 后点防爆炸,先熄后停防氧化” 注:此实验最好在通风橱中进行;防止没除 净的Co使人中毒
点燃
原理: CO2 + 2Mg == 2MgO + C
(2)二氧化碳与碳的反应:
原注:理(:1)燃烧C不O一定2 需+要C氧气高=参温=加;2CO
既是氧化反应, 又是还原反应
(2)二氧化碳在特殊条件下也能支持燃烧。
(3)上述两反应中二氧化碳是氧化剂,镁、碳是还原剂。
(三)二氧化碳的用途 纯碱
沫灭火机
防止一氧化碳中毒的简单方法是:
就是注意室内通风,如果发生一氧化碳中毒, 轻度的应呼吸大量新鲜空气,严重的要立即到医院 进行治疗。
1、实验室为什么先通一氧化碳, 然后加热氧化铜?
排尽装置内的空气,避免一氧化碳与空 气混合加热时发生爆炸。 2、为什么停止加热后还要继续通入一氧 化碳直到玻璃管冷却? 防止生成的铜被氧化成氧化铜。 3、实验装置尾部加了一盏燃着的酒精灯, 目的是什么?
2. 还原性(一氧化碳还原氧化铜)
仔细观察如图实验,你观察到什么现象?
(1)黑色的氧化铜变成了红色的铜; (2)澄清的石灰水变浑浊。
未反应完的尾气一氧化碳最简单的处理方法 是用酒精灯点燃处理,避免散逸到大气中,而污 染环境。也可循环利用作燃料,也可收集起来。
拓展延伸
为了节能减排,可以将CO还原氧化铜的实验 装置进行改进。改进后的优点有哪些?
《二氧化碳和一氧化碳》碳和碳的氧化物PPT课件(第2课时)

14
4.一氧化碳是一种_无__色、_无___味、__难__溶于水的气体;在化学性质 方面,CO有_可__燃___性和_还__原__性。一氧化碳中混有一定量的氧气或空 气,点火可能_爆__炸__。因此,在点燃前必须先_检__验__纯___度__。
15
THANK YOU
二氧化碳和一氧化碳
第2课时
-.
新课导入
你听说过煤气中毒吗?
2
新课讲解
二、一氧化碳
1.比较二氧化碳和一氧化碳的物理性质
颜色、状态
CO2 无色无味气体
密度
比空气大
溶解性
能溶于水
CO 无色无味气体
略小于空气 难溶于水
3
2.一氧化碳的化学性质
(1)可燃性
2CO+O2 点燃 2CO2 (化合反应)
导入 讲解
6
注意: (1)CO有毒,为防止污染空气,尾气要点燃处理。 (2)实验开始时,要先通CO后加热(排净空气,防止 爆炸);结束时,要先停止加热冷却后停止通气(防止生 成的Cu重新被氧化)。
7
(1)在什么条件下容易发生煤气中毒?
含碳物质在氧气不充足的条件下燃烧容易发生煤气中毒。
(2)有人用煤炉取暖,又担心煤气中毒,于是在临睡前在
2.除去二氧化碳中混有的少量一氧化碳,下
D 列采用的方法合理的是( )
A.将混合气体通过灼热的焦炭 B.把混合气体点燃 C.把混合气体通过澄清石灰水 D.将混合气体通过灼热的氧化铜
13
D 3.对下列实验现象描述不正确的是( )
A.木炭在氧气中燃烧,发出白光 B.硫在氧气中燃烧发出明亮的蓝紫色火焰 C.一氧化碳在空气中燃烧发出蓝色火焰 D.白磷在空气中燃烧发出淡蓝色火焰
小结
4.一氧化碳是一种_无__色、_无___味、__难__溶于水的气体;在化学性质 方面,CO有_可__燃___性和_还__原__性。一氧化碳中混有一定量的氧气或空 气,点火可能_爆__炸__。因此,在点燃前必须先_检__验__纯___度__。
15
THANK YOU
二氧化碳和一氧化碳
第2课时
-.
新课导入
你听说过煤气中毒吗?
2
新课讲解
二、一氧化碳
1.比较二氧化碳和一氧化碳的物理性质
颜色、状态
CO2 无色无味气体
密度
比空气大
溶解性
能溶于水
CO 无色无味气体
略小于空气 难溶于水
3
2.一氧化碳的化学性质
(1)可燃性
2CO+O2 点燃 2CO2 (化合反应)
导入 讲解
6
注意: (1)CO有毒,为防止污染空气,尾气要点燃处理。 (2)实验开始时,要先通CO后加热(排净空气,防止 爆炸);结束时,要先停止加热冷却后停止通气(防止生 成的Cu重新被氧化)。
7
(1)在什么条件下容易发生煤气中毒?
含碳物质在氧气不充足的条件下燃烧容易发生煤气中毒。
(2)有人用煤炉取暖,又担心煤气中毒,于是在临睡前在
2.除去二氧化碳中混有的少量一氧化碳,下
D 列采用的方法合理的是( )
A.将混合气体通过灼热的焦炭 B.把混合气体点燃 C.把混合气体通过澄清石灰水 D.将混合气体通过灼热的氧化铜
13
D 3.对下列实验现象描述不正确的是( )
A.木炭在氧气中燃烧,发出白光 B.硫在氧气中燃烧发出明亮的蓝紫色火焰 C.一氧化碳在空气中燃烧发出蓝色火焰 D.白磷在空气中燃烧发出淡蓝色火焰
小结
二氧化碳和一氧化碳(第2课时)课件九年级化学人教版上册(完整版)2

6 CO 和 CO2 相同的是( C ) A. 物理性质相同 B. 化学性质相同 C. 组成元素相同 D. 相对分子质量相同
7 你能说出几种鉴别 CO 和 CO2 气体的方法? ①分别通入澄清石灰水,观察澄清石灰水是否变浑浊; ②分别通入紫色石蕊溶液,观察溶液是否变红; ③用燃着的木条分别伸入,观察火焰是否熄灭; ④分别通入灼热的氧化铜,观察是否有红色的铜生成。
2 地球大气中 CO2 的含量不断增加的后果主要是( B ) A. 破坏臭氧层 B. 导致温室效应增强 C. 产生酸雨 D. 毒害农作物
3 检验久未开启的菜窖内 CO2 浓度大小的正确方法是( D ) A. 带入一个盛满澄清石灰水的试管 B. 带入一杯水 C. 带入一个接通电源的手电筒 D. 带入一个点燃的油灯
CO 的化学性质
新闻报道:某媒体以《九女子一氧化碳中毒身亡》为题报道了某民 宅内,10 名 20 多岁的女青年因长 时 间 使用燃气热水器,导致一氧化碳 中毒,造成九死一伤的惨剧。每年冬天,北方地区都会发生多起煤气中 毒事故。这究竟是什么原因呢?
讨论
(1) 从分子组成看,一氧化碳与二氧化碳有哪些异同?
A. CO2 可使害虫窒息死亡,从而防止病虫害 B. CO2 可产生温室效应,从而提高室温 C. CO2 能灭火,施用后可防止火灾 D. 施用 CO2 可促进植物的光合作用
探究新知
CO 的物理性质
CO 与 CO2 物理性质的比较
颜色
CO2 无色
CO 无色
状态
气态
气态
气味
无味
无味
密度(与空气比较) 1.997 g/L(比空气大) 1.250 g/L(比空气稍小)
4 由于大气中 CO2 的含量上升,导致温室效应增强,使全 球变暖。为了减少 CO2 的含量,下列措施可行的是( BC )
《二氧化碳和一氧化碳》第二课时课件1

2CO + O2 == 2CO2
高温
C +CO2 == 2CO
点燃
2C + O2 == 2CO
点燃
C + O2 == CO2
空气
•
9、要学生做的事,教职员躬亲共做;要学生学的知识,教职员躬亲共学;要学生守的规则,教职员躬亲共守。21.9.1321.9.13Monday, September 13, 2021
3CO + Fe2O3 高=温= 2Fe + 3CO2
冶金工 业上利用 一氧化碳 的还原性 来炼铁
点燃
2CO + O2 == 2CO2 CO + CuO == Cu + CO2
点燃
2C + O2 == 2CO
高温
C +CO2 == 2CO
CO 高温
C +CO2 == 2CO
2
点燃
C
C + O2 == CO2
第六单元 碳和碳的氧化物 (第二课时)
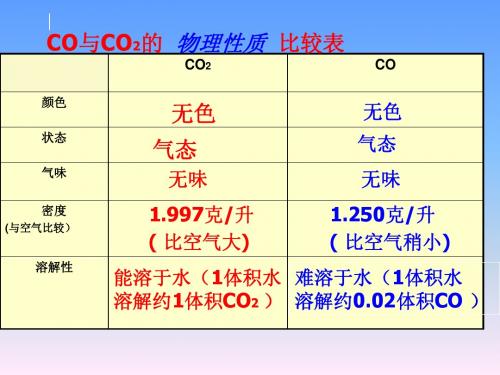
一 、 CO 与 CO2 的 部 分 性 质 比 较
(通常状况下)
色味态
CO2
CO
无色、无味、气体 无色、无味、气体
密度
(与空气比较)
比空气大
比空气稍小
溶解性
能溶于水(1体积水 难溶于水(1体积水
溶解约1体积CO2 ) 溶解约0.02体积CO )
一氧化碳、二氧化碳都是碳的氧化物,为什么
得氧
CO
1.b处燃着的酒精灯的作用是什么?
2.实验开始时,是先点燃a处酒精灯,还是先通入 CO气体?为什么?
3.实验结束时,是先熄灭a处酒精灯,还是先停止通 入CO气体?为什么?
高温
C +CO2 == 2CO
点燃
2C + O2 == 2CO
点燃
C + O2 == CO2
空气
•
9、要学生做的事,教职员躬亲共做;要学生学的知识,教职员躬亲共学;要学生守的规则,教职员躬亲共守。21.9.1321.9.13Monday, September 13, 2021
3CO + Fe2O3 高=温= 2Fe + 3CO2
冶金工 业上利用 一氧化碳 的还原性 来炼铁
点燃
2CO + O2 == 2CO2 CO + CuO == Cu + CO2
点燃
2C + O2 == 2CO
高温
C +CO2 == 2CO
CO 高温
C +CO2 == 2CO
2
点燃
C
C + O2 == CO2
第六单元 碳和碳的氧化物 (第二课时)
一 、 CO 与 CO2 的 部 分 性 质 比 较
(通常状况下)
色味态
CO2
CO
无色、无味、气体 无色、无味、气体
密度
(与空气比较)
比空气大
比空气稍小
溶解性
能溶于水(1体积水 难溶于水(1体积水
溶解约1体积CO2 ) 溶解约0.02体积CO )
一氧化碳、二氧化碳都是碳的氧化物,为什么
得氧
CO
1.b处燃着的酒精灯的作用是什么?
2.实验开始时,是先点燃a处酒精灯,还是先通入 CO气体?为什么?
3.实验结束时,是先熄灭a处酒精灯,还是先停止通 入CO气体?为什么?
九年级化学《二氧化碳和一氧化碳(第2课时)》课件

一氧化碳还
原 氧 (huán yuán)
化铜的微观
解释,从而
从微观上揭
示了一氧化
碳还原(huán yuán) 性的机理。
CO+CuO △ Cu+CO2
第十五页,共二十二页。
一氧化碳(yīyǎnghuàtàn)
一氧化碳 的还 (yīyǎnghuàtàn) 原性
从实验可以 (kěyǐ)看到黑色 的氧化铜变 成了红色的 铜,澄清的 石灰水变浑 浊。
第六单元(dānyuán) 物
碳和碳的氧化
课题3 二氧化碳 和一氧化 (èr yǎng huà tàn) 碳
(第2课时)
第一页,共二十二页。
一氧化碳(yīyǎnghuàtàn)
物理性质(wùlǐ xìngzhì)
化学性质(huàxué xìngzhì)
课堂练习
第二页,共二十二页。
一、CO的物理性质(wùlǐ
通风 排 (tōng fēng) 气
第十三页,共二十二页。
3.CO具有(jùyǒu)
还原性
C
co
cuo
A
澄清的
石灰水 B
CO +CuO Cu + CO2
CO还原性试验(shìyàn)
第十四页,共二十二页。
一氧化碳(yīyǎnghuàtàn)
一氧化碳 的还 (yīyǎnghuàtàn)
原性
右图演示了
第二十二页,共二十二页。
第三页,共二十二页。
1.有人用炉火取暖(qǔnuǎn),为防止煤气中毒, 在火炉上放一盆水,这样做行吗?
答:不行,因为(yīn wèi)一氧化碳难溶于水。
2.有人(yǒu rén)说他身强力壮,不会煤气中毒,
等 到一闻到煤气味就把火炉搬出去,这样
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
失氧
CO + CuO = Cu + CO2
得氧
CO
1.b处燃着的酒精灯的作用是什么?
2.实验开始时,是先点燃a处酒精灯,还是先通入 CO气体?为什么?
3.实验结束时,是先熄灭a处酒精灯,还是先停止通 入CO气体?为什么?
4.如果将CO还原氧化铜的实验装置稍作改进(如图2 所示),与图1相比,其有何优点?
一氧化碳、二氧化碳对人体健康都有影响,它们都有毒吗?
一氧化碳对人体健康的影响 空气中一氧化碳的体积分数/% 0.02 0.08 对人体健康的影响 2 h~3 h 可出现中毒症状 2 h 可昏迷
煤气厂为什么在家用煤气(含一氧化碳)中掺入微量
ห้องสมุดไป่ตู้
具有难闻气味的气体?如发生煤气泄漏应该怎么办?
3.还原性
点燃
CO2
点燃 高温
C
C + O2 == CO2 C + 2CuO == 2Cu + CO2↑
物 质 物 理 性 质 色态味 密度 水溶性
一氧化碳
无色无味气体 比空气稍小 难溶于水 2CO+O2
点燃
二氧化碳
无色无味气体 比空气大 能溶于水
可燃性
化 学 性 质
2CO2
在一般情况下,既不能燃烧也 不能支持燃烧
+2 +4
CO
CO2
不同
元素组成 分子构成 相同 碳元素化合价
1.可燃性
2 CO + O2 == 2 CO2
点燃
在火焰上方,分别罩冷而干 燥的烧杯和内壁沾有澄清石灰水 的烧杯,观察到什么现象?
煤炉里煤层上方的蓝色火焰,就是一氧化碳在燃烧。
CO是怎么产生的?煤炉中可能发生哪些化学反应?
2CO + O2 == 2CO2
点燃
C +CO2 == 2CO
2C + O2 == 2CO C + O2 == CO2
点燃 点燃
高温
空气
2.毒性
一氧化碳与血红蛋白的结合力要比氧与血红蛋 白的结合力大200~300倍,因此,一氧化碳一经吸 入,即与氧争夺血红蛋白,造成机体急性缺氧。由 于中枢神经系统对缺氧最敏感,中毒时先感觉疲倦 乏力,很快失去行动能力。
图1
图2
请写出CO在高温下还原氧化铁的化学方程式
3CO + Fe2O3 == 2Fe + 3CO2
冶金工
高温
业上利用
一氧化碳
的还原性
来炼铁
2CO + O2 == 2CO2 CO + CuO == Cu + CO2 2C + O2 == 2CO C +CO2 == 2CO
高温
点燃 高温 C +CO2 == 2CO
第六单元
碳和碳的氧化物
(第二课时)
一 、 CO 与 CO2 的 部 分 性 质 比 较
(通常状况下)
CO2
色味态 密度
(与空气比较)
CO
无色、无味、气体 比空气稍小 难溶于水(1体积水
溶解约0.02体积CO )
无色、无味、气体 比空气大 能溶于水(1体积水
溶解约1体积CO2 )
溶解性
一氧化碳、二氧化碳都是碳的氧化物,为什么 其性质上存在差异?
决定
决定 反映
反映
还原性
与水反应 与石灰水反应 毒性 主要用途
相互转化
CO+Cu===Cu+CO2 CO2+H2O==H2CO3 CO2+Ca(OH)2==CaCO3↓+ H2O 剧毒 燃料 冶炼金属 2CO+O2 ===2CO2
点燃
△
无毒 灭火、温室肥料、化工原料等 CO2+ C === 2CO
高温
“课堂训练1--《二氧化碳和一氧化碳》第二课时”
