大学《物理化学(药学专)》试题库及答案
药学物化试题及答案

药学物化试题及答案一、选择题(每题2分,共20分)1. 药物的溶解性主要取决于药物的()。
A. 化学结构B. 物理性质C. 制剂工艺D. 生产厂家答案:A2. 下列哪种药物属于非极性药物?()A. 阿司匹林B. 硫酸镁C. 盐酸普鲁卡因D. 地塞米松答案:D3. 药物的生物利用度主要受哪些因素影响?()A. 药物的溶解性B. 药物的稳定性C. 药物的剂型D. 所有以上因素答案:D4. 药物的稳定性主要受哪些因素影响?()A. 温度B. pH值C. 光照D. 所有以上因素答案:D5. 下列哪种药物属于酸性药物?()A. 阿莫西林B. 硫酸钠C. 盐酸氨溴索D. 氢氧化铝答案:C6. 药物的溶解速率主要受哪些因素影响?()A. 药物的溶解性B. 药物的粒径C. 药物的晶型D. 所有以上因素答案:D7. 药物的渗透性主要取决于()。
A. 药物的分子量B. 药物的脂溶性C. 药物的极性D. 药物的分子结构答案:B8. 下列哪种药物属于碱性药物?()A. 硫酸阿托品B. 盐酸普鲁卡因C. 氢氧化铝D. 硫酸镁答案:C9. 药物的生物等效性是指()。
A. 药物的疗效相同B. 药物的安全性相同C. 药物的体内过程相同D. 药物的剂型相同答案:C10. 药物的稳定性试验通常包括哪些内容?()A. 加速试验B. 长期试验C. 影响因素试验D. 所有以上因素答案:D二、填空题(每空1分,共20分)1. 药物的溶解性是指药物在溶剂中的最大浓度。
答案:溶解2. 药物的溶解速率是指单位时间内药物的质量。
答案:溶解3. 药物的生物利用度是指药物进入的量与给药量的比例。
答案:体循环4. 药物的稳定性是指药物在储存和使用过程中的保持程度。
答案:化学性质5. 药物的渗透性是指药物通过的能力。
答案:生物膜6. 药物的生物等效性试验通常包括试验和试验。
答案:药动学;药效学7. 药物的稳定性试验中,加速试验通常在条件下进行。
答案:高温高湿8. 药物的溶解性受的影响较大。
药用物理学试题及答案

药用物理学试题及答案一、选择题(每题2分,共10分)1. 以下哪个选项不是药物的物理性质?A. 溶解度B. 熔点C. 毒性D. 密度答案:C2. 药物的渗透压是指:A. 药物分子通过半透膜的速率B. 药物分子在溶液中的浓度C. 药物分子在溶液中产生的压强D. 药物分子在溶液中的扩散速度答案:C3. 药物的稳定性与以下哪个因素无关?A. 温度B. 湿度C. 药物的化学结构D. 药物的包装材料答案:D4. 药物的生物利用度是指:A. 药物在体内的分布情况B. 药物在体内的代谢速率C. 药物在体内的吸收程度D. 药物在体内的排泄速度答案:C5. 药物的释放速率与以下哪个因素有关?A. 药物的溶解度B. 药物的粒径C. 药物的化学结构D. 以上都是答案:D二、填空题(每题2分,共10分)1. 药物的______是指在一定条件下,单位体积溶剂中溶解的最大药物量。
答案:溶解度2. 药物的______是指药物从制剂中释放并被机体吸收进入血液循环的过程。
答案:生物利用度3. 药物的______是指药物在体内经过代谢后,其活性成分或代谢产物排出体外的过程。
答案:排泄4. 药物的______是指药物在一定条件下,从固态转变为液态的过程。
答案:熔点5. 药物的______是指药物在体内达到最大效应所需的时间。
答案:起效时间三、简答题(每题5分,共20分)1. 简述药物的物理稳定性对药物疗效的影响。
答案:药物的物理稳定性直接影响药物的疗效。
不稳定的药物可能会在储存或使用过程中发生降解、结晶、变色等物理变化,导致药物浓度下降或活性成分失活,从而影响治疗效果。
2. 描述药物的溶解度对药物吸收的影响。
答案:药物的溶解度是影响药物吸收的重要因素。
溶解度高的药物更容易在胃肠道中溶解,从而增加药物分子与吸收表面的接触面积,提高药物的吸收率和生物利用度。
3. 阐述药物的释放速率对药物疗效的影响。
答案:药物的释放速率决定了药物在体内达到有效浓度的速度。
物化考卷A-答案中国药科大学

中国药科大学物理化学期末试卷(A卷)2008-2009学年第二学期(药学理科基地班)专业班级学号姓名核分人:一、选择题(每小题2分,共20分)( )vap m21221112(-)A. nB. lnC. =D. =constantH T TV pW RT lnV p RT THS pVTγ∆==∆∆2. 涉及焓的下列说法中正确的是( )A. 单质的焓值均等于零B. 在绝热可逆过程中焓变为零C. 在等温过程中焓变为零D. 化学反应中系统的焓变不一定大于内能变化3. 水溶液中的反应:422N H O C N C O(N H)→,测得不同起始尝试下的反应半衰期如下:起始浓度/mol⋅L-10.05 0.10 0.20t1/2/hr 37.03 19.15 9.49则此反应的反应级数是:()A. 1 级B. 2级C. 3级D. 0级4.蒽在光的作用下可以聚合为二蒽,二蒽在加热时会发生分解反应,达到化学平衡。
已知热分解反应的温度系数约为0.28(即每升高1K温度速率常数增加值)。
当达到光化学平衡时,每增加10K的温度,二的产量变化是多少?( )A.增加35.7% B.减少35.7% C.增加28% D.减少28%5. 298K时测定水-丙醇的蒸气压,当x丙醇=0.1时,测得平衡气相中总蒸气压为p总=4786Pa,y丙醇=0.3677,已知p水*=3173Pa,p丙醇*=2906Pa,则水的活度系数为:( )A. 0.954B. 1.06C. 0.943D. 1.006.在一密闭体系中,AgNO 3(s)加热部分分解达到以下平衡:2 AgNO 3(s) →Ag 2O(s)+2NO 2(g)+1/2O 2(g)此平衡系统自由度f 为A. f =1B. f =2C. f =3D. f =47. 在唐南(Donnan )平衡中,判断平衡的条件是: ( ) A. 膜两边的小离子浓度相等 B. 膜两边的总电荷相等C. 膜两边的小离子化学势相等D. 膜两边的小分子电解质化学势相等8.300K 时玻璃毛细管和不锈钢毛细管半径相同,水在毛细管中的升高高度相同,当水的温度降到274K 时,它们的升高高度分别为h 玻璃和h 不锈钢,则有: ( )A h 玻璃 = h 不锈钢B h 玻璃 > h 不锈钢C h 玻璃 < h 不锈钢D 无法确定9.如右图,实线为恒温线,虚线为恒容线,点划线为绝热线,星线为恒压线。
中国药科大学 物理化学 期末试卷A卷含答案

中国药科大学物理化学期末试卷(A卷)2006-2007学年第二学期(药学理科基地班)标准答案一、选择题(每小题2分,共20分)d U=-S d T-p d V可适用下列哪一个过程( A )A 理想气体真空膨胀过程B 电解粗铜制备高纯度铜C 298K、101325Pa的水蒸发过程D N2 + 3H2→2NH3未达平衡2. 对于符合方程 p(Vm-b)=RT(b是大于零的常数)的气体,恒压条件下压缩体积一倍时,体系的ΔU( A )A. 大于0B. 小于0C. 等于0D. 不确定3.设一气体由状态A经过恒温可逆膨胀至状态B后,由状态B恒压可逆压缩至状态C,再由状态C绝热可逆压缩回到状态A,形成一循环。
如图所示,循环ABCA所围的面积用①表示,BC下方的面积用②表示,CA下方的面积用③表示。
则B→C过程的热可用下面哪种形式表示: ( D )A ①+ ②+ ③B ③−②C − (②+ ③)D ②+ ③4对反应CO(g)+H2O(g)=H2(g)+CO2(g),下列式子正确的是: ( B )A BC D5 在400 K时,液体A 的蒸气压为4×104 Pa,液体B 的蒸气压为6×104 Pa,两者组成理想液体混合物,平衡时溶液中 A 的物质的量分数为 0.6,则气相中 B的物质的量分数为:( C )A 0.60B 0.40C 0.50D 0.316 如图所示,当物系点在通过A点的一条直线上变动时,则物系的特点是: ( A )A B和C的百分含量之比不变B A的百分含量不变C B的百分含量不变D C的百分含量不变7. 对于AgI,下列溶液中溶解度最大的是:( D )A 纯水B 0.01mol/L的AgNO3溶液C 0.01mol/L的NaNO3溶液 D 0.01mol/L的Ca(NO3)2溶液8 对于光化学反应的描述,不正确的是?( B )A. 其反应速度基本不受温度影响 B 正常情况下,量子效率Ф<1C Δr G m< 0的反应才能自发进行D 反应速率与反应物浓度无关9.关于电池和极化作用,下列说法不正确的是:( B )A. 电极发生极化作用时,阳极电势一定升高,阴极电势一定降低。
13药学本科物理化学复习题含部分答案

13药学专业物理化学复习题一、选择题和O2在绝热钢瓶中生成水,A. △H=0B.△U=0C.△S=0D.△G=0答:钢瓶的体积固定,与外界没有功和热的交换,则△U=0和O2混合气体的绝热可逆压缩,A. △U=0B. △F=0C.△S=0D.△G=03.某体系进行不可逆循环过程的熵变为A.△S(体)>0,△S(环)=0B. △S(体)=0,△S(环)>0C. △S(体)=0,△S(环)=0D. △S(体)>0,△S(环)>0 答:体系进行不可逆循环时,体系回到原状态,而熵是状态函数,所以△S体=0。
因为是不可逆过程,故△S环>0。
4A.蒸汽压B.汽化热C.熵D.吉布斯自由能E.内能F.体积6.在α、β两相中都含有A和B两种物质,当达到相平衡时,下列哪种情况是正确的?A. μαA=μαBB.μαA=μβAC.μαA=μβB7.纯物质在其三相点时的自由度为A . 4 B. 3 C. 2 D. 1 E. 08.任何一个化学变化,影响平衡常数数值的因素是A.反应物浓度B.催化剂C.反应产物浓度D.温度9.某一反应在一定条件下的转化率为%,当有催化剂存在时,其转化率应当( )% 。
A.大于B.小于C.等于10.一级反应的半衰期与反应物的最初浓度A无关 B. 成正比 C. 成反比 D.平方根成反比11.零级反应是直线关系。
A. C—t —t C—t12.光化学反应A+hν=产物,其速率与A.反应物A的浓度无关B.反应物A的浓度有关C.反应物A的浓度和hν有关13.对于有过量KI存在的AgI溶胶,下列哪种电解质的聚沉能力最强?A.K3[Fe(CN)6]14.宜作油包水型(w/o)乳化液的乳化剂的HLB值的范围是A.2~6 B。
8~12 C。
14~1815.加入表面活性物质,使液体的表面张力A.增加 B. 降低 C. 不变,但使表面稳定 D. 不一定16.已知一个系统过程的熵变为10J/K,则该过程为A.自发过程 B. 平衡过程 C. 非自发过程 D. 无法判断17.电池反应达平衡时,电池电动势E有A. E>0B. E<0C. E=E0D. E=018.对大多数液体,其表面张力随温度升高而A.增大B.减小C.不变D. 不确定19.一定温度下,一定量PCl5(g)在一密闭容器中达到分解平衡。
药用物理化学试题及答案

定吸附量。
46.的实验中用到的光学仪器是(阿贝折射仪),因为(可以从折射率的测定得到溶液的浓度
值,进而获得吸附量值)。
47.测定表面张力时,要求控制气泡逸出速度不超过(每分钟 20 个),这是为了(准确读取
48.测定表面张力时,对毛细管的要求是(必须先洗干净毛细管),否则(气泡逸出速度不能
控制,无法准确读取最大压差)。
√
40.测定中和热,关键是测温必须十分准确,而通电时间不必准确。
×
1
41.溶液的凝固点降低值与溶液的浓度成正比。
√
42.凝固点降低常数的数值决定于溶剂的种类。
√
43 稀溶液的依数性只取定于溶质分子的数目。
√
44 凝固点是指在一定压力下,固液两相平衡共存的温度。
√
45 光密度具有加和性,它等于各个组分的光度之和。
√
35.用氧弹量热计测量物质的燃烧热,过程中要保证体系与环境之间没有热交换。 ×
36.用氧弹量热计测量物质的燃烧热,所得温差必须经过作图校正。
√
37.中和热测定中,采用电热法求仪器常数,其误差较小。
×
38 测定中和热时求仪器常数,采用电热法是唯一可行的方法。
×
39.测定中和热,记录通电时间必须十分准确。
√
23 步冷曲线上水平线的长度与析出物的数量成正比。
√
24.步冷曲线上水平线的长度与析出物的组成成正比。
×
25.测定丙酮碘化反应的反应级数,实验上采用的是孤立变量法。
√
26.测定丙酮碘化反应的反应级数,实验上采用的是尝试法。
×
27.测定丙酮碘化反应的反应级数,不能采用分光光度法。
×
28 分光光度法是测定反应级数的采通用方法。
药学本科(物理化学)试题
B、相图由相律推导得出; C、相图由实验结果绘制得出,与相律无关 ; D、相图决定相律 。 6、在101.325kPa下,-10℃时过冷水结成冰是一个自发过程,该过程 中() A △S=0,△G=0 B △S>0△G<0 C △S<0,△G<0 D △S>0,△G>0 7、熵增原理只适用与( )体系。 A、 敞开。B、封闭。C、孤立。D、循环
1、解释人工降雨的工作原理。(5分)
2、指出下列个系统的主分数和自由度数。 (5分) (1) 在抽空的容器中,NH4Cl(s) 分解成NH3(g) 和HCl(g),并 达到分解平衡 (2) 在抽空的容器中CaCO3(s)达到分解平衡 (3) C(s)和CO(g)、CO2(g)、O2(g)在700℃混合并达到平衡
3、(1)写出下列相图中的三相线的状态。(2)画出P点的步冷曲线。 (6分)
4.如何得到强电解质的无限稀释摩尔电导,如何得到弱电解质的无限 稀释摩尔电导。
(写出有关的公式和原理)(4分)
得分 阅卷人
四、计算题:(30分) 1、 1mol苯在其沸点353.4K时蒸发成气体
(视为理想气体),蒸发热为 394.97KJ.Kg-1。试计算此过程的Q、W、 △U、△H、△S及△G。(本题5分)
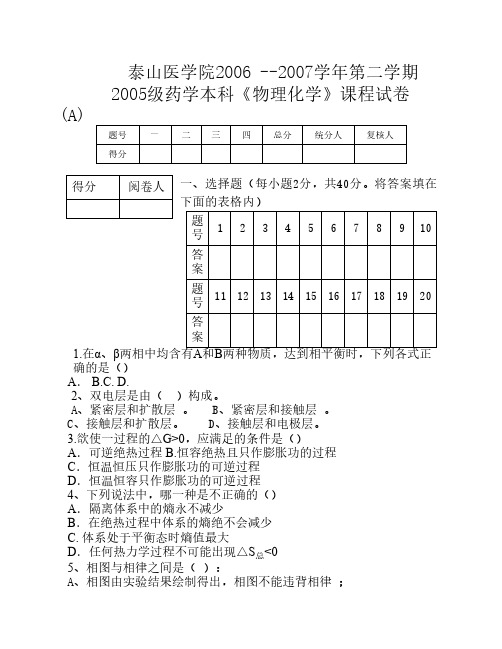
泰山医学院2006 --2007学年第二学期 2005级药学本科《物理化学》课程试卷 (A)
题号 一 二 三 四 总分 统分人 复核人
得分
得分
阅卷人 一、选择题(每小题2分,共40分。将答案填在 下面的表格内)
题 号
1
2
3
4
5
6
7
8
9 10
答 案
题 号
11
12
中国药科大学《物理化学》习题及答案

2C2H2(g) + 3H2O(g) = CH3COCH3(g) + CO2(g) + 2H2(g)
ө
△fGm
(kJ·mol-1)
209.2
-228.59
-154.62
-394.38
ө
计算 25℃时的标准平衡常数 K 。
3.
已知
298.2K
ө
时下列反应的△rHm
的 Δ r Gθm ,并说明在此条件下,哪种晶型更加稳定?
4. 在 25℃和标准状态下,已知 CaCO3(s)、CaO(s)和 CO2(g) 的标准摩尔生成吉布斯能分 别-1128.76 kJ·mol-1、-604.2 kJ·mol-1 和-394.38 kJ·mol-1,求:
的 Δ r Gθm 。
移动。
6. 445℃时,Ag2O(s)分解压力为 20974kPa,该分解反应 Ag2O(s) = 2Ag(s)+½O2(g)的
Δ r Gθm =
kJ·mol-1。
五、计算题
1. 合成氨时所用的氢气和氮气的比例是 3∶1,在 673K、1013.25kPa 下,平衡混合物中氨 的物质的量分数为 0.0385,求 N2 (g)+3H2 (g)= 2NH3 (g)的标准平衡常数。
() () () () () () () ()
三、选择题(选1个答案)
1. 在等温等压不做非体积功的情况下,下列哪个过程肯定能自发进行?
A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S>0
D.△H<0,△S<0
第 3 页 共 20 页
药学专业中的物理化学课后习题答案

第五章 化学平衡三.思考题参考答案1.反应达到平衡时,宏观和微观特征有何区别?答:反应到达平衡时,宏观上反应物和生成物的数量不再随时间而变化,好像反应停止了。
而微观上,反应仍在不断的进行,反应物分子变为生成物分子,而生成物分子又不断变成反应物分子,只是正、逆反应的速率恰好相等,使反应物和生成物的数量不再随时间而改变。
2.为什么化学反应通常不能进行到底?答: 严格讲,反应物与产物处于同一系统的反应都是可逆的,不能进行到底。
只有逆反应与正反应相比小到可以忽略不计的反应,可以粗略地认为可以进行到底。
这主要是由于存在混合Gibbs 自由能的缘故,反应物与产物混合,会使系统的Gibbs 自由能降低。
如果没有混合Gibbs 自由能,在Gibbs 自由能对反应进度的变化曲线上,应该是一根不断下降的直线,不会出现最低点。
如果将反应在van ’t Hoff 平衡箱中进行,反应物与生成物的压力都保持不变,反应物与生成物也不发生混合,反应物反应掉一个分子,向平衡箱中补充一个分子。
生成一个生成物分子,则从平衡箱中移走一个分子,这样才能使反应进行完全。
3.什么是复相化学反应?其平衡常数有何特征?答:有气相和凝聚相(液相、固体)共同参与的反应称为复相化学反应。
对凝聚相,只考虑是纯态的情况,纯态的化学势就是它的标准态化学势,所以复相化学反应的标准平衡常数只与气态物质的压力有关。
4.什么是物质的解离压?答:在一定温度下,某纯的固体物质发生解离反应,如果只产生一种气体,达到平衡时,这气体的压力就称为该固体在该温度时的解离压。
如果产生的气体不止一种,达到平衡时,所有气体压力的总和称为该固体在该温度时的解离压。
显然物质的解离压在定温下有定值。
5.什么是标准摩尔生成Gibbs 自由能?答:因为Gibbs 自由能的绝对值不知道,所以只能用相对值,需要规定一个共同的相对标准。
即将标准压力下稳定单质(包括纯的理想气体,纯的固体或液体)的生成Gibbs 自由能看作零,在标准压力下,反应温度时,由稳定单质生成计量系数B 1ν=的物质B 时,标准摩尔Gibbs 自由能的变化值称为物质B 的标准摩尔生成Gibbs 自由能,用符号f m (B,,)G P T ∆ 表示。
药学类专业物理化学复习题集

例6:80oC时,N2O5气相分解的速率常数为1.39min-1, 活化能为103.3kJ·mol-1,求(1)65oC时的速率常数k及 t1/2;(2) 65oC时当N2O5分解掉99%所需要的时间。
,该反应为一级反应。 解: (1) 从速率常数的单位可知 ln k2 Ea 1 1 ( ) k1 R T1 T2
ln
p2 sub H m (T2 T1 ) , p1 R T1T2
8.314 273.2 293.2 12.30103 1 sub H m ln J · mol 293.2 273.2 3.27 103 44.12kJ · mol1
z =2 ΔrGm= -ZFE=-296500Cmol-1 0.372V=-71.80kJmol-1
E r S m zF T
2 10-4 V K -1
1 2 96500 C mol p
38.6J K -1 mol-1
E r H m zF T C mol1 E 2 96500 T p [298.15K 2 10-4 V K -1 0.372V]
60.29kJ mol-1
Qr=TrSm=298.15K38.6JK-1mol -1 =11.508kJmol -1
例3: 298K时将电导率为0.141 S m 装入电导池,测得其电阻为
1
525Ω,再换用0.1mol dm NH3.H2O溶液,测得其电阻为2030Ω。 3
求: (1)电导池常数K(l/A); (2) NH3.H2O溶液的电导率; (3) NH3.H2O溶液的摩尔电导率和( 导率 解:(1)K(l/A)=κR = 0.141*525=74.03m
山东第一医科大学药学专升本物理化学

课程练习第一章热力学第一定律练习题一、判断题(说法对否):1.1.当系统的状态一定时,所有的状态函数都有一定的数值。
当系统的状态发生变化时,所有的状态函数的数值也随之发生变化。
2.2.体积是广度性质的状态函数;在有过剩NaCl(s) 存在的饱和水溶液中,当温度、压力一定时;系统的体积与系统中水和NaCl的总量成正比。
3.3.在101.325kPa、100℃下有lmol的水和水蒸气共存的系统,该系统的状态完全确定。
4.一定量的理想气体,当热力学能与温度确定之后,则所有的状态函数也完全确定。
5.系统温度升高则一定从环境吸热,系统温度不变就不与环境换热。
6.从同一始态经不同的过程到达同一终态,则Q和W的值一般不同,Q + W 的值一般也不相同。
7.因Q P= ΔH,Q V= ΔU,所以Q P与Q V都是状态函数。
8.封闭系统在压力恒定的过程中吸收的热等于该系统的焓。
9.对于一定量的理想气体,当温度一定时热力学能与焓的值一定,其差值也一定。
10.在101.325kPa下,1mol l00℃的水恒温蒸发为100℃的水蒸气。
若水蒸气可视为理想气体,那么由于过程等温,所以该过程ΔU = 0。
11.1mol,80.1℃、101.325kPa的液态苯向真空蒸发为80.1℃、101.325kPa 的气态苯。
已知该过程的焓变为30.87kJ,所以此过程的Q = 30.87kJ。
12.1mol水在l01.325kPa下由25℃升温至120℃,其ΔH= ∑C P,m d T。
13.因焓是温度、压力的函数,即H = f(T,p),所以在恒温、恒压下发生相变时,由于d T = 0,d p = 0,故可得ΔH = 0。
14.因Q p = ΔH,Q V = ΔU,所以Q p - Q V = ΔH - ΔU = Δ(p V) = -W。
15.卡诺循环是可逆循环,当系统经一个卡诺循环后,不仅系统复原了,环境也会复原。
16.一个系统经历了一个无限小的过程,则此过程是可逆过程。
物理化学习题解答(中药)

《物理化学习题集》诸论习题解答1.装氧的钢筒体积为20升,温度在15℃时压力为100kPa ,,经使用后,压力降低到25kPa 。
问共使用了多少千克氧?解:M mRT nRT pV == kgg M RT V p p m 22110005.205.2032288314.820)25100()(-⨯==⨯⨯⨯-=-=2.87mg 理想气体样品在60.8kPa 压力下,体积增至二倍,绝对温度增至三倍,求最终压力。
解:因为MV mRT p =故112212T V V T p p = 所以kPa p T V V T p 2.918.6023111222=⨯==3.干燥空气中主要成分(体积百分数)为:氮(1)78.03%;氧(2)20.99%;氩(3)0.93%;二氧化碳(4)0.03%。
如果总压力为101.3kPa ,求各气体的分压。
解:用理想气体方程可以知道,在温度相同时,气体的体积分数即为压力分数和摩尔分数,所以根据分压定律有:kPap y p N N 04.793.1017803.022=⨯==同理:O 2、Ar 、CO 2的分压分别为21.26kPa 、0.9421kPa 、0.03039kPa4.某化合物具有下列的重量百分组成:C 14.3%,H 1.2%,Cl 84.5%,将1克该物质在120℃及100 kPa 压力下,完全气化为蒸气,体积为0.194L 。
通过计算写出该化合物的分子式。
解: mol RT pV n 310937.5393314.8194.0100-⨯=⨯⨯==14.168005937.011-⋅===mol g n M碳原子数为 212/143.04.168=⨯=CN氢原子数为 21/012.04.168=⨯=H N氯原子数为 45.35/845.04.168=⨯=C l N 所以分子式为C 2H 2Cl 45.CO 2气体在40℃时的摩尔体积为0.381dm 3·mol -1。
南开大学22春“药学”《物理化学》作业考核题库高频考点版(参考答案)试题号1

南开大学22春“药学”《物理化学》作业考核题库高频考点版(参考答案)一.综合考核(共50题)1.25℃及标准压力下,NaCl(s)与其水溶液平衡共存,体系的组分数、相数和自由度分别为()。
A.K=1,Φ=2,f=1B.K=2,Φ=2,f=1C.K=2,Φ=2,f=0D.K=4,Φ=2,f=1参考答案:C2.相变过程熵变变等于相变焓除以相变温度。
()A.错误B.正确参考答案:A3.某绝热封闭体系在接受了环境所作的功之后,温度()。
A.一定升高B.一定降低C.一定不变D.随接受功多少而定参考答案:A4.25℃时,将11.2升O₂与11.2升N₂混合成11.2升的混合气体,该过程:()。
A.∆S>0,∆GB.∆SC.∆S=0,∆G=0D.∆S=0,∆G<0参考答案:C电池对外做电功时,其电功可表示为W'=-zEF。
()A.错误B.正确参考答案:A6.今有298K,p的N₂(状态Ⅰ)和323K,p的N₂(状态Ⅱ)各一瓶,问哪瓶N₂的化学势大?()A.μ(Ⅰ)>μ(Ⅱ)B.μ(Ⅰ)C.μ(Ⅰ)=μ(Ⅱ)D.不可比较参考答案:B7.零级反应速率常数的量纲是()。
A.(浓度)-1·(时间)-1B.(浓度)·(时间)1C.(浓度)-2·(时间)-1D.(浓度)2·(时间)-1参考答案:B8.100℃、101325Pa的1mol水与100℃大热源接触,使其向真空容器中蒸发成100℃、101325Pa的水蒸气,为判断过程的方向可用()。
A.∆UB.∆S体C.∆AD.∆G参考答案:C9.胶束的出现标志着()。
A.表面活性剂的溶解度已达到饱和状态B.表面活性剂分子间的作用超过它与溶剂的作用参考答案:C10.下列哪些是容量性质状态函数?()A.温度B.考压力C.气体常数RD.体积参考答案:D11.实际气体经过某条件下节流膨胀,温度降低,则该条件下其焦耳-汤姆逊系数()。
天津大学智慧树知到“药学”《物理化学》网课测试题答案2

天津大学智慧树知到“药学”《物理化学》网课测试题答案(图片大小可自由调整)第1卷一.综合考核(共15题)1.布朗运动属于溶胶的:()A.聚沉性质B.电学性质C.动力学性质D.光学性质2.玻璃毛细管插入某液体中,管内液面上升,说明该液体与毛细管的接触角:()A.>90°B.>180°C.D.<90°3.当真实气体的压缩因子Z()1时,该气体比理想气体难于压缩。
A、小于B、大于C、等于D、小于等于4.封闭系统经历一个恒压过程,系统与环境交换的热:()A、等于过程的热力学能变B、等于热力学能C、等于过程的焓变D、等于焓5.关于亨利系数,下列说法中正确的是:()A、其值与温度、浓度和压力有关B、其值与温度、溶质性质和浓度有关C、其值与温度、溶剂性质和浓度有关D、其值与温度、溶质和溶剂性质及浓度的标度有关6.冰的熔点随压力的升高而:()A、升高B、降低C、不变D、先升高后降低7.25℃时氮气、氢气、氧气和二氧化碳在水中的亨利系数分别为8.68 GPa、7.2 GPa、4.40 GPa和0.166 GPa。
则25℃、101.325 kPa下的上述气体,在水中溶解度最小的是:()A、氮气B、氢气C、氧气D、二氧化碳8.液体在能被其完全润湿的毛细管中上升的高度反比于:()A、大气压力B、毛细管半径C、液体的表面张力D、液体粘度9.下列对恒沸混合物的描述中,不正确的是:()A.恒沸混合物沸点随外压的改变而改变B.恒沸混合物与化合物一样,具有确定的组成C.恒沸混合物不具有确定的组成D.平衡时,恒沸混合物气相和液相的组成相同10.500 K下,抽空密闭容器中的氧化银固体部分分解成Ag(s)和氧气,此平衡体系的自由度数F等于:()A、-1B、0C、1D、211.固体表面的吸附中,化学吸附:()A、一定是单分子层吸附B、可以是多分子层吸附C、一定是多分子层吸附D、易于达到吸附平衡12.A、B两液体的混合物在T-x图上出现最低点,则该混合物对拉乌尔定律产生:()A.最大负偏差B.最大正偏差C.一般负偏差D.一般正偏差13.丁达尔效应的实质是胶体粒子对光的()。
物理化学(药学专)——考试题库及答案

关于零级动力学的特点,以下叙述正确的是:收藏A.反应物浓度的对数lnC与时间t成直线关系B.反应物的消耗速度与其浓度成正比C.反应物的消耗速度与其浓度无关D.半衰期与初始浓度成反比回答错误!正确答案:C关于可逆过程的特点,以下叙述错误的是:收藏A.体系复原时环境不一定也复原B.为一理想过程C.过程进行的非常缓慢D.由一连串非常接近平衡的状态构成回答错误!正确答案:A一封闭体系,从A态出发,经一循环过程回到A态,则下列何者为零()收藏A.Q+WB.WC.QD.Q-W回答错误!正确答案:D对于难溶性固体药物,当其粒径小到一定程度时,随着粒径的减小,则其溶解度收藏A.减小B.不变C.增大D.无法判断回答错误!正确答案:C下面说法不正确的是:收藏A.弯曲液面的附加压力指向曲率中心B.生成的新鲜液面都有表面张力C.弯曲液面的表面张力的方向指向曲率中心D.平面液面没有附加压力回答错误!正确答案:C关于化学反应速度的描述正确的是:收藏A.该反应的反应速度只能用反应物的速度表示B.各个反应物的反应速度一定相等C.反应物的计量系数越大,其消耗速度就越大D.该反应的反应速度只能用产物的反应速度来表示回答错误!正确答案:C化学反应的等压热效应和等容热效应,以下叙述错误的是:收藏A.通过实验只能测得等容热效应B.在敞口容器中进行的反应对应的是等压热效应C.没有气体参与和生成的反应,二者相等D.等压热效应也可以根据实验直接测得回答错误!正确答案:D某化学反应的速率常数k的单位是mol/(L.S),该反应级数是:收藏A.二级B.无法确定C.零级D.一级回答错误!正确答案:C关于表面活性剂的亲水亲油平衡值HLB的叙述错误的是收藏A.HLB值越大表面活性剂亲油性越强B.HLB值越大表面活性剂亲水性越强C.HLB值越小亲水性越小D.HLB值越小亲油性越大回答错误!正确答案:A关于一级反应的特点,以下叙述错误的是:收藏A.C与t成直线关系B.反应速率常数k的单位是时间的倒数C.反应速度与反应物浓度的一次方成正比D.半衰期与反应物的初始浓度没有关系回答错误!正确答案:A有一自发原电池,已知其温度系数为负值,则该电池反应的ΔH是收藏A.<0B.>0C.无法判断D.=0回答错误!正确答案:A在一定温度压力条件下,某一化学反应,判断其反应方向时用收藏A.不能确定B.ΔrSmC.ΔrHmD.ΔrGm回答错误!正确答案:D关于溶胶的ξ电位,下列说法不正确的是收藏A.随着外加电解质的加入,ξ电位由大变小,直至为零。
物理化学(药学专) 2020年 郑州大学机考资料及答案

已知某药物在水溶液中的分解速度常数在333K和283K时分别为5.484×10-2s-1和1.080×10-4s-1,求反应活化能。
化学变化的热效应计算方法有哪些?答:1.用盖斯定律求算2.用标准摩尔生成焓求算3.用标准摩尔燃烧焓求反应热4.从键能估算。
1mol甲苯在其沸点383.2K时蒸发为气体,求该过程中的Q,W,ΔU,ΔH,ΔS,ΔG,ΔF。
已知该温度下甲苯的汽化热为362kJ·kg-1。
人工降雨的原理是什么?答:根据不同云层的物理特性,选择合适时机,用飞机、火箭弹等向云中播散干冰、碘化银、盐粉等催化剂,促使云层将水或增加降雨量。
将5g氨气通入1L水中,在常温常压与其蒸气共存,试用相律分析此体系的自由度。
如何制备大分子溶液?等边三角形坐标体系的三个定理是什么?精馏的原理是什么?已知某药物在水溶液中的分解速度常数在333K和283K时分别为5.484×10-2s -1和1.080×10-4s-1,求反应活化能。
答:反应活化能97.63kjmol 1.67*103mol.dm-3.s-1化学变化的热效应计算方法有哪些?答:盖斯定律求算,标准摩尔生成含求算,燃烧热求算,键能估算。
1mol甲苯在其沸点383.2K时蒸发为气体,求该过程中的Q,W,ΔU,ΔH,ΔS,ΔG,ΔF。
已知该温度下甲苯的汽化热为362kJ·kg-1。
人工降雨的原理是什么?答:人工降雨运用云和降水物理学原理通过向云中撒播降雨剂(盐粉,干冰或碘化银等),使云滴或冰晶增大到一定程度降落到地面形成降水。
判断过程方向和限度的三大判据答:一:水总是自发的有高处往低处流,有趋向于最低能量的状态的倾向。
二:吸热反应也可以自发进行三:有趋向最大混乱度的倾向。
胶体是热力学不稳定体系,为什么会相对长期地稳定存在?答:胶体的表面积比较大,表面能比较高,有自动拒接在一起降低其表面能的趋势,及具有易于聚沉的不稳定性,所以说胶体是热力学不稳定的体系。
药学本科《物理化学》考试(含答案)

药学本科《物理化学》上学期参考试卷及答案一、是非题1.熵增加的过程都是自发过程。
( )2.根据热力学第一定律,因为能量不能无中生有,所以一个系统若要对外作功,必须从外界吸收热量。
( )3.气体经绝热自由膨胀后,因Q=0,W=0,所以∆U=0,气体的温度不变。
( )4.若一个过程是可逆过程,则该过程中的每一步都是可逆的。
( )5.在298K 下,氢气的标准燃烧焓就是水的标准生成焓。
( )6.任何化学反应的Q p 总是大于Q v 。
( )7.不作非体积功的等容过程的热只由系统的始、终态决定。
( )8.反应A+B = C+D 达平衡时,各物质的化学势一定相等。
( )9.计算绝热不可逆过程的熵变,可以在相同的始、终态间设计一条绝热可逆途径来计算。
( )10.理想气体向真空膨胀Q=0,所以∆S=0。
( )11.对于纯组分,化学势等于其摩尔吉布斯能。
( )12.热是由于温差而传递的能量形式,它总是倾向于从含热较多的高温物体流向含热较少的低温物体。
( )13.恒容条件下,一定量的理想气体,温度升高时,热力学能将增加。
( )14.一个已达平衡的化学反应,只有当标准平衡常数改变时,平衡才会移动。
( )15.任意体系经一循环过程则其∆U ,∆H ,∆S ,∆G ,∆A 均为零。
( )16.相图中的点都是代表系统状态的点。
( )17.根据二元液系的p-x 图可以准确地判断该系统的液相是否为理想液体混合物。
( )18.任何一个化学反应都可以用r m G θ∆来判断其反应进行的方向。
19.在等温、等压、只作体积功的条件下,反应的∆G m <0时,若其数值越小,反应自发进行的趋势也越强,反应进行得越快。
( )20.恒沸物的组成不变。
( )二、单选题1. 对实际气体的节流膨胀过程,有( )A. △H = 0B. △S = 0C. △G = 0D. △U = 02. 下列纯物质两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B. 熔点将随压力增加而升高C.蒸气压将随温度升高而加大D. 升华温度将随压力增大而升高3. NH 4HS(s) 和任意量的 NH 3(g) 及 H 2S(g) 达平衡时有( )A. K = 2,φ= 2,f = 2B. K = 1,φ= 2,f = 1C. K = 2,φ= 3,f = 2D. K = 3,φ= 2,f = 34.使一过程的△G=0应满足的条件是 ( )A.可逆绝热过程B.等容绝热且只做膨胀功的过程C.等温等压且只做膨胀功的可逆过程D.等温等容且只做膨胀功的可逆过程5.对于理想气体,下列关系式中哪个不正确?( ) A. 0)(=∂∂V T U B. ()0T U V ∂=∂ C.0)(=∂∂T P H D. 0)(=∂∂T PU 6.在298K 时反应C 6H 5COOH (l )+7.5O 2(g )=7CO 2(g )+3H 2O (l ),设各气体皆为理想气体,则等压反应热∆H 与等容反应热∆U 之差等于(KJ ⋅mol -1)( )。
南开大学智慧树知到“药学”《物理化学》网课测试题答案2

南开大学智慧树知到“药学”《物理化学》网课测试题答案(图片大小可自由调整)第1卷一.综合考核(共15题)1.平衡常数值改变了,平衡一定会移动﹔反之,平衡移动了,平衡常数也一定改变。
()A.正确B.错误2.一对平行反应A→B和A→C,反应速率常数分别为k₁和k₂,A的初始浓度为cA0,则某一时刻产物B 和C的浓度有以下关系()。
A.cB:cC=k₁:k₂B.cB+cC=cA0{1-exp[-(k₁+k₂)t]}C.cB=cA0[1-exp(-k₁t)]=cA0[1-exp(-k₂t)]3.在等温等压下,当反应的DrGm=5kJ/mol·1时,该反应能否进行?()A.能正向自发进行B.能逆向自发进行C.不能判断D.不能进行4.极性大的溶剂有利于反应物极性大、产物极性小的反应。
()A.错误B.正确5.关于表面活性剂的CMC,下列说法正确的是()。
A.低于CMC时,活性剂分子主要以单体形式存在B.高于CMC时,溶液中没有以单分子形态存在的活性剂分子C.CMC附近,溶液的表面张力有显著变化D.CMC附近,溶液的电导率有显著变化6.如果产物的极性小于反应物极性,则反应在极性溶剂中的反应速率比在非极性中的大。
()A.正确B.错误7.水的冰点即为水的三相点。
()A.正确B.错误8.对于韦斯顿标准电池,可以用万用表或对消法测量其真实输出压力。
()A.错误B.正确9.法拉第(Faraday)常数F表示()。
A.1mol电子的电量B.1mol电子的质量C.1mol电子的数量10.下列哪些是容量性质状态函数?()A.温度B.考压力C.气体常数RD.体积11.实际气体经过某条件下节流膨胀,温度降低,则该条件下其焦耳-汤姆逊系数()。
A.等于零B.大于零C.小于零D.不确定12.体系由初态A经不同的不可逆途径到达终态B时,其熵变dS应如何?()A.各不相同B.都相同C.不等于经可逆途径的熵变D.不一定相同13.封闭体系循环变化过程熵变大于或等于热温商。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.下面说法不正确的是:A弯曲液面的表面张力
2.用超显微镜可以观察到:C胶粒的带电
3.化学反应的等压热效应和等容热效应,以下叙述错误的是:B等压热效应
4.对于难溶性固体药物,当其粒径小到一定程度时,随着粒径的减小,则其溶
解度D增大
5.关于化学变化,以下叙述错误的是:D大于0 正向自发
6.对于稀溶液,有关原盐效应的叙述错误的是:D对于同种速率也小
7.关于化学反应的说法正确的是:B对于基元反应
8.某一封闭体系,从始态到终态的ΔG<0,则:B此过程正向
9.夏季有时久旱无雨,甚至天空有乌云仍不下雨。
从表面化学的观点来看其原
因是D形成无运动
10.分散系静置时,成半固体状态,振摇时成流体,这属于A触变型
11.蛋白质等电点的定义是 D PH值
12.关于表面活性剂的亲水亲油平衡值HLB的叙述错误的是D亲油性越强
13.关于可逆过程的特点,以下叙述错误的是:D体系复原
14.将水银滴在玻璃板上,平衡时其接触角A90-180度之间
15.定温下,某种电解质溶液的浓度由1mol/L增大到2mol/L时,其摩尔电导率
C 减小
16.理想气体反应:2A+B=C是吸热反应,当反应达到平衡时,可采用下列哪
组条件,使平衡向右移动(即提高反应物的转化率)D升高温度和增大总压
17.pH计中的玻璃电极属于D离子选择性电击
18.在一定温度压力条件下,某一化学反应,判断其反应方向时用 D Gm
19.关于一级反应的特点,以下叙述错误的是: C 呈直线关系
20.关于溶胶的ξ电位,下列说法不正确的是D电位是粒子表面
21.关于化学反应速度的描述正确的是:A越大越大
22.标准氢电极的电极电势等于零是指:D在任一温度时
23.定温定压下,溶质分配地溶入两种互不相溶溶剂中,当溶质在两种溶剂中的
分子大小相同,溶质在两相的浓度比是: A 常数
24.下列措施不一定使溶胶发生凝结的是A加大分子
25.有一自发原电池,已知其温度系数为负值,则该电池反应的ΔH是A<0
26.可逆电池中发生失电子反应的电极是:D负极
27.关于零级动力学的特点,以下叙述正确的是:C 无关
28.关于功的叙述,以下错误的是:D 功市状态函数
29.化学电池不可逆放电时,其吉布斯自由能降低与所做功的关系C大于
30.溶胶和大分子溶液的本质区别是A热力学稳定性不同
31.一封闭体系,从A态出发,经一循环过程回到A态,则下列何者为零()C
Q-W
32.吉布斯吸附等温式中吸附量Γ的意义为C表面超量
33.可逆电池中盐桥的作用是C液接电势
34.既是胶体相对稳定存在的因素,又是胶体遭破坏的因素D胶粒的布朗运动
35.某化学反应的速率常数k的单位是mol/(L.S),该反应级数是:B零级
36.某化学反应的半衰期与反应物的初始浓度没有关系,则该反应为D一级
37.关于胶体分散体系的特点,以下不正确的是C在显微镜下鞥看到
38.水蒸气蒸馏时,馏出物中包含高沸点液体和水,则C因其在低温下
39.朗格缪尔吸附等温式C对单分子层
40.沸点组成图上有最低恒沸点的溶液精馏,如最低恒沸物为C,组成在A和C
之间的溶液,精馏后只能得到:B纯A和最低
41.关于状态函数的特征,以下叙述错误的是:B状态函数的改变值
42.在一定温度下,平衡体系CaCO3(s) =CaO(s) +CO2 (g)的组分数、相数
及自由度数分别为() D 230
43.
44.
判断题全是错
45.弱电解质的电离度和电离常数可用电导法测定。
X
46.体系状态发生变化后,至少有一个状态函数要发生变化。
X
47.电池图式中,左边为负极,发生失电子反应。
48.电池图式中,左边为负极,发生失电子反应。
49.每一种离子的极限摩尔电导率都是常数。
50.两电极间的电势差就是电动势。
51.体系的表面能是体系能量的构成部分,所以在温度压力不变的情况下,表面
能只与体系的数量有关,与体系存在形式无关
52.对沸点-组成图上有最高恒沸点的溶液进行精馏,最后可以将A和B两组分
完全分离开来。
53.由性质相似易相溶的原理知,表面活性物质的增溶作用即溶解作用。
54.独立组分数指确定体系所需的最少组分数。
55.溶胀是大分子物质特有的现象。
56.加浮石防止暴沸的原理是浮石多孔内有较大气泡,加热时不致形成过热液体。
57.在一定温度压力下,某反应的ΔG>0,所以要选用合适催化剂使反应能够进
行
58.在一定温度压力条件下,某化学反应已达平衡若各平衡组分的量变了,其平
衡常数也随之而变。
59.理想气体的内能和焓只是温度的函数,与体系的体积和压力无关。
60.对于大分子电解质,由于存在唐南平衡,将影响渗透压。
所以用渗透压法测
定大分子电解质的相对分子质量时,必须消除唐南平衡效应的影响。
61.一级反应的半衰期、1/3衰期、1/5衰期等皆与起始浓度无关,其速率常数k
又不变,故在恒温下反应时,它们都相同。
62.吉布斯能判据主要用于等温等压非体积功为零的封闭体系。
63.化学变化的热效应可以采用赫斯定律来求。
64.某一反应的平衡常数是一各不变的常数
65.高分子溶液是热力学稳定体系
66.表面活性剂的水溶液在临界胶束浓度(CMC)时,其物理性质(表面张力、
电导率、渗透率、去污能力、密度等)都将发生突变。
67.若大分子吸收一定量的溶剂后未溶解,不形成溶液,这种称为有限溶胀。
68.对于可逆电池,温度系数大于零,则电池从环境吸热
69.通过测定患者某组织的蛋白质电泳图可初步判断该组织是否有病变。
70.用渗透压法测出大分子的平均相对分子质量为数均相对分子质量
71.可逆电池的标准电动势是两电极标准电极电势之差。
72.蛋白质电泳是在一定pH的缓冲液中进行的,所选用的缓冲溶液的pH值应
小于或大于所有组分蛋白质的等电点,使各组分蛋白质都带同种电荷,以保证电泳时各组分蛋白质朝同一方向移动,并使各种大离子有较大差距,以便获得较好的分离效果。
73.水蒸气蒸馏可以保证高沸点液体不致因温度过高而分解。
74.离子独立运动定律适用于所有电解质水溶液。
75.电导滴定可用于酸碱中和、沉淀反应等,当溶液浑浊或有颜色而不便使用指
示剂时,此方法将更有效。
76.自发过程就是不可逆过程。
77.任意循环过程必定是可逆过程。
78.同样大小的同种液滴和液泡,所产生的附加压力相等。
79.大分子化合物是不同聚合度的同系物的混合物,所以其相对分子质量只能是
平均值,平均方法不同,得到不同的平均相对分子质量。
80.比表面能与表面张力数值相等,所以二者的物理意义亦相同
81.胶核表面至扩散层终端的电位差称为热力学电位
82.无论是物理吸附还是化学吸附,吸附过程中皆放出热量
83.反应式中反应物的计量系数等于其反应级数
84.电池反应的可逆反应热效应Qr等于体系的ΔrHm。
85.因为ΔH=Qp,而H是状态函数,所以热也是状态函数。
86.熵判据适合于孤立体系。
87.在有机溶剂中的蔗糖水解反应,其半衰期与起始浓度成反比,在水中的水解
反应,其半衰期与起始浓度无关。
两实验事实无误,却相互矛盾。
化学动力学无法解释这种实验现象。
88.一个化学反应,其向右进行的趋势很大(ΔG负值大)则其反应速率也很大
89.一级反应的半衰期与起始浓度无关。
90.如果一个反应的ΔU=0,则此反应的活化能Ea=0.
91.放热化学反应的平衡常数必随温度升高而降低。
92.对于同一宏观反应:aA+bB
93.分配定律适合于任何浓度的溶液。
94.
95.
96.
97.
98.
99.
100.
101.
102.
103.
104. 105. 106. 107. 108. 109. 110. 111.。
