ch3b
《有机化学》理解练习册

上海交通大学网络教育学院医学院分院有机化学课程练习册第一章绪论一、是非题1.有机化合物是含碳的化合物。
()2.有机化合物只含碳氢两种元素。
()3.有机化合物的官能团也称为功能团。
()4.sp3杂化轨道的形状是四面体形。
()5.sp杂化轨道的形状是直线形。
()6.sp2杂化轨道的形状是平面三角形。
()7.化合物CH3-CH=CH2中双键的稳定性大于单键。
()二、选择题1. 有机化合物的共价键发生均裂时产生()A. 自由基B. 正离子C. 负离子D. 产生自由基和正碳离子2. 有机化合物的共价键发生异裂时产生()A. 自由基B. 产生自由基和负碳离子C. 正碳离子或负碳离子D. 产生自由基和正碳离子三、填空题1. 下列化合物中的主要官能团CH 3CH CH 3CH 2NH 2CH 3BrCH 3CHCH 2CH 3COOH CH 3CHOCH 3OCH 32. 按共价键断裂方式不同,有机反应分为 和 两种类型。
3. 游离基反应中,反应物的共价键发生 裂;离子型反应中,反应物的共价键发生 裂。
第二章 链烃一、是非题CH 3CHCH 2CHCH 3CH 32CH 3(CH 3)2CHCH 2CHCH 2CH 3和是同一化合物。
1.( )32. 甲烷与氯气光照下的反应属于游离基取代反应。
( )3. 乙烷只有交叉式和重叠式两种构象异构体。
( )4. 碳碳双键中的两条共价键都是π键。
( )5. 烯烃加溴的反应属于亲电加成反应。
( )6. 共轭体系就是 π-π 共轭体系。
( )二、选择题CH 3CHCH 2CHCH 3CH 3CH 31.的一氯代产物有 ( )A. 1种B.2种C.3种D.4种2. 含有伯、仲、叔、季碳原子的化合物 ( )CH 3CH 2CH CCH 3CH 3CH 33CH 3CH 2C CH 33CH 3CH 3CH 2CHCH 2CH 3CH 3CH 3C CH 3CH 33A.C.B.D.3. 既有sp 3杂化碳原子,又有sp 2杂化碳原子的化合物是 ( ) A. CH 3CH 2CH 3B. CH 3C ≡CHC. CH 2=CH 2D. CH 3CH=CH 24. 室温下能与硝酸银的氨溶液作用生成白色沉淀的是 ( ) A. CH 3CH 2CH 3B. CH 3C ≡CHC. CH 3CH=CH 2D. CH 3CH=CHCH 35. 烯烃与溴水加成反应可产生的现象是 ( ) A. 沉淀 B. 气泡 C. 褪色 D. 无变化6. 在2-甲基戊烷分子中,叔碳原子的编号为 ( ) A. 1 B. 2 C. 3 D. 4 三、填空题1. 烯烃的官能团为 ,炔烃的官能团为 。
高中化学:第二章卤代烃知识点(精选)

第二章 卤代烃一.卤代烃的结构特点:卤素原子是卤代烃的官能团。
C —X 之间的共用电子对偏向X , 形成一个极性较强的共价键,分子中C —X 键易断裂。
二.卤代烃的物理性质(1)溶解性:不溶于水,易溶于大多数有机溶剂。
(2)状态、密度:CH 3Cl 常温下呈气态,C 2H 5Br 、CH 2Cl 2、CHCl 3、CCl 4常温下呈液态且密度> 1 g/cm 3。
(一氯代烃的密度都小于水)三.卤代烃的化学性质(以CH 3CH 2Br 为例) 1.取代反应①条件:强碱的水溶液,加热 ②化学方程式为:2.消去反应(1)实质:从分子中相邻的两个碳原子上脱去一个卤化氢分子,从而形成不饱和化合物。
例如: CH 3CH 2Cl :+NaOH ――→醇△NaCl +CH 2===CH↑+H 2O(2)卤代烃的消去反应规律①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Br 。
②有邻位碳原子,但邻位碳原子上不存在氢原子的卤代烃也不能发生消去反应。
例如:。
③有两个相邻碳原子,且碳原子上均带有氢原子时,发生消去反应可能生成不同的产物。
例:CH 3—CH===CH —CH 3+NaCl +H 2O(3)二元卤代烃发生消去反应时要比一元卤代烃困难些。
有些二元卤代烃发生消去反应后可在有机物中引入三键。
例如:CH 3—CH 2—CHCl 2+2NaOH ――→醇△CH 3—C≡CH+2NaCl +2H 2O 四.消去反应与水解反应的比较反应类型 反应条件 键的变化卤代烃的结构特点 主要生成物水解反应 NaOH 水溶液 C —X 与H —O 键断裂C —O 与H —X 键生成 含C —X 即可 醇消去反应 NaOH 醇溶液 C —X 与C —H 键断裂(或—C≡C—) 与H —X键生成与X 相连的C 的邻位C 上有H 烯烃或炔烃特别提醒 (1)通过卤代烃的水解反应可在碳链上引入羟基;通过卤代烃的消去反应可在碳链上引入碳碳双键或碳碳三键。
第八章-卤代烃解读

还原试剂:
LiAlH4、NaBH4 、Zn/HCl、HI、催化氢解、 Na + NH3等
氢化铝锂遇水会分解,反应要在无水条件下进行。
LiAlH4 + 4H2O LiOH + Al(OH)3 + 4H2 硼氢化钠:比较温和的还原试剂(不还原酯,羧基,氰基)在水和 醇中不会分解
R X
NaBH4
R
H
R-X一般为1°RX,(仲、叔卤代烷与醇钠反应时,主要发生消 除反应生成烯烃) 醚:对称和不对称 3.与氰化钠反应
R X + NaCN R CN + NaX 反应后分子中增加了一个碳原子,是有机合成中增长碳链的 方法之一。
C2H5OH
CN可进一步转化为–COOH,-CONH2等基团。
4.与氨及胺的反应
P236
CH3(CH2)6CH2X
Cl CH CH3
LiAlH4 THF
LiAlD 4 THF
CH3(CH2)6CH3 + AlH3 + LiX
D CH CH3
反应历程:
提供负氢
反应活性:
烷基相同时活性为RI > RBr > RCl,氟代烷不反应。 烷基不同时,伯卤代烷 > 仲卤代烷 > 叔卤代烷。
RCH
CH2+ NaOH
C2H5OH
X H 消除反应的活性: 3°RX > 2°RX 方向:
CH3CHCHCH2
H Br H
CH3
Δ
>
RCH
CH2 + NaX + H2O
1°RX
CH2CH3
CH3CH2CH CH2
KOH C2H5OH
有机化学期末三套考试卷及答案详解

1.有机化学期末试卷命名下列各化合物或写出结构式(1分/题,共10分)1.(H3C)2HC,C (CH 3)3C=C ”/XH甲基叔丁基醚二.试填入主要原料,试剂或产物(必要时,指出立体结构) 式。
(2分/每空,共48分)2. 3- 乙基-6-溴-2-己烯-1-醇3.4.5.6.7.8.9.10.邻羟基苯甲醛苯乙酰胺对氨基苯磺酸,完成下列各反应CH 二 CHBr9.CH 3COCI7.CH2CI ANaOHH 2OCl8.CH 3O +出0OHCISN 1历程2. CH 2CIKCN/EtOH ------------- A+ c 〔2 咼温、咼压「① O 3 _ ② H 2O Zn 粉 _____________________________3.J CH = CH 2HBr Mg__________ 醚① CH S COCH S ._______________ d ② HQ, H +6.1, B 2H 6”2, H 2O 2, OH -'1, Hg(OAc)2,H 2O-THF T 2, NaBH 4 "OBr 2 NaOHNaNO 2 H 3PO 2 -- ►〔 ) -------------- ► ( ) ---------- ------- \H 2SO 4l丿三.选择题。
(2分/每题,共14分)1. 与NaOH 水溶液的反应活性最强的是()(A). CH 3CH 2COCH 2Br (B). CH s CH z CyCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2Br CH 32. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:()(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是()(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) P-O 2NC 6H 4OH(E) C 6H 5OH(F) P-CH 3C 6H 4OHC, (2R, 3S, 4S)-2,4-二氯-3-戊醇JC CH3O+ CH 2=CH_C_CH 3C 2H 5ONa C z H s ONa10.Zn EtOH*HNO 3 H 2SO 4Fe,HCI (CH 3CO) 2O4.下列化合物具有旋光活性得是:COOH2.由指定原料及不超过四个碳原子的化合物和必要的试剂合成:3. 由指定原料及不超过四个碳原子的化合物和必要的试剂合成:CH CH4. 由苯、丙酮和不超过 4个碳原子的化合物及必要的试剂合成:5.下列化合物不发生碘仿反应的是 A C 6H5COCH C 、 CH s CHCOC t CH()B 、C 2H 5OHD 、CHCOC 2CH 6.与HNO 作用没有Nz 生成的是( A 、H2NCONH B C 、C 6H5NHCHD)、CHCH( NH 2) COOH、C 6H5NH 7.能与托伦试剂反应产生银镜的是( A CCbCOOH BC 、 CH 2CICOOH D)、CHCOOH 、HCOOH四.鉴别下列化合物(共6分) 苯胺、苄胺、苄醇和苄溴 五•从指定的原料合成下列化合物。
高中化学卤代烃
醇 △
CH2=CH2↑+ NaBr+H2O
消去反应:有机化合物在一定条件下,从一个分子中 脱去一个小分子(如H2O、HBr等),而形成不饱和 (含双键或三键)化合物的反应,叫做消去反应。
总结:
溴乙烷
NaOH(水) 乙醇(取代反应) NaOH(醇) 乙烯(消去反应)
(二)卤代烃的化学性质
思考:下列卤代烃是否能发生水解反应、消去反应? 若能,请写出反应方程式。
涂改液溅到皮肤上,用后一定要洗手。 2、有啄吮手指习惯的小同学不要接触或使用涂改液。
三、氟氯烃对大气的污染
CCl2F2 光 CClF2 + Cl
O3
光 光
O2 + O
Cl+O3= ClO+O2
ClO+O= Cl+O2
总反应: 2O3=3O2
*一个Cl可以带走100,000个O3。
第二章 第3节 卤代烃
氯乙烷
CH3CH2Cl
CH3Cl CH2BrCH2Br CH2=CHCl
Br
一氯甲烷 1,2-二溴乙烷 氯乙烯 溴苯
结构母体
烷烃
烯烃
苯
组成元素
碳 、氢 、卤素
第3节 卤代烃
一、卤代烃简介 1.定义
烃分子中的氢原子被卤素原子取代后所生成的一类 烃的衍生物称为卤代烃。
表示方法: R-X
(4)同分异构体中随支链增多沸点降低,密度减小。
(5)一氯代烃的密度比水小,溴代烃、碘代烃密度比水大
二、卤代烃的性质 (一)溴乙烷
1、溴乙烷分子组成和结构:
分子式 结构式 结构简式 官能团
C2H5Br
HH H-C-C-Br
第五章 卤代烃

按卤素连 接的碳原 子分类
(CH3)2CHCH2Cl
CH3CH2CHCH3
(CH3)3C-I
伯卤代烃 一级卤代烃
仲卤代烃 二级卤代烃
叔卤代烃 三级卤代烃
2
按烃基的 结构分类
CH3CH2X
饱和卤代烃
CH2=CHCH2X
不饱和卤代烃
X
CH2X
芳香卤代烃
其它分类方法: (一)乙烯型卤代烃 卤素连在双键碳上
4. 毒性
R-X无色,有不愉快的气味,蒸气有毒。
含偶数碳原子的一氟代烷有剧毒。
8
§5―3卤代烷的化学性质 一、亲核取代反应
Nu: C X C Nu + X
C X
+ -
亲核取代反应:有机化合物分子中的原子或原子团被亲核试 剂取代的反应。 离去基团
R–X + Nu:(Nu-)
底物
R–Nu + X产物
亲核试剂
Nu:亲核试剂,富有电子,包括负离子和有未成对电子的中性分子
9
亲核试剂:H2O/HO—,ROH,RC=CNa,NaCN/醇,RCOOM,
NaNO3,NaSH,KI/丙酮,NH3,NH2R,NHR2,NR3,R-M,NaSCN 常见亲核基团Nu∶HO-,RO-,RC=C—,CN—,RCOO—,NO3— HS—,I — ,- NH2,-NHR,-NR2, R—,SCN—
C H3(C H2)2C H2Li
+ LiBr
与Grignard试剂相似,且更为活泼,易于被空气氧化, 遇水、酸、醇、氨等含活泼氢的化合物则分解,因此在制 备和使用时,通常用N2或H2保护。
30
3. 二烃基铜锂
2 RLi + CuX
有机化学练习题(大学)(十三)-卤代烃

第五章 卤代烃一 选择题1.下列哪些特性与S N 2反应符合? 反应速率只取决于亲核试剂的浓度(I),亲核试剂从被置换基团的反面进攻(II),反应过程中键的形成和键的破裂同时发生(III)。
.(A) I ,II (B) II ,III (C) 全部符合 (D) I ,III2.S N 1反应的特征是:生成碳正离子中间体(I),立体化学发生构型转化(II),反应速率受反应物浓度影响,与亲核试剂浓度无关(III),在亲核试剂的亲核性强时易发生(IV)。
(A) I ,II (B) III ,IV (C) I ,III (D) I ,IV3.下列化合物进行S N 1反应时,哪一个反应速率最快?4.在NaOH 水溶液中,(CH 3)3CX(I),(CH 3)2CHX(II),CH 3CH 2CH 2X(III),CH 2=CHX(IV)各卤代烃的反应活性次序为:(A) I>II>III>IV (B) I>II>IV>III (C) IV>I>II>III (D) III>II>I>IV5. (CH 3)3CBr 与乙醇钠在乙醇溶液中反应主要产物是:(A) (CH 3)3COCH 2CH 3 (B) (CH 3)2C =CH 2 (C) CH 3CH =CHCH 3 (D) CH 3CH 2OCH 2CH 36.下列哪个化合物能生成稳定的格氏试剂?(A) CH 3CHClCH 2OH (B) CH 3CH 2CH 2Br (C) HC ≡CCH 2Cl (D) CH 3CONHCH 2CH 2Cl7.实验室合成格氏试剂时,除CH 3I 之外,最常用的卤代物是:(A) RI (B) RBr (C) RCl (D) RF8.实验室合成甲基格氏试剂,常用CH 3MgI 而不用CH 3MgBr,原因是:(A) CH 3I 价廉 (B) CH 3Br 太不活泼 (C) CH 3Br 在常温下是气体,使用不便 (D) CH 3Br 不9.合成格氏试剂一般在下列哪一溶剂中反应?(A) 醇 (B) 醚 (C) 酯 (D) 石油醚10.用下列何种试剂还原卤代烃必须在无水介质中进行?(A) NaBH 4 (B) LiAlH 4 (C) Zn + HCl (D) HI11.下列四个卤代烃,R 是相同的烃基,其中卤原子最容易成为负离子离去的是:(A) R ─I (B) R ─Br (C) R ─Cl (D) R ─F12.下列四个氯代烃,最容易发生S N 2的是:(A) CH 3CH 2CH 2CH 2Cl (B) (CH 3)2CHCH 2Cl (C) CH 3CH 2CH(Cl)CH 3 (D) (CH 3)3CCl13. 用KOH/C 2H 5OH 处理(CH 3)2CHCHClCH 2CH 3,主要产物可能是:(A)反-4-甲基-2-戊烯 (B)顺-4-甲基-2-戊烯 (C)2-甲基-2-戊烯 (D)反-2-甲基-2-戊烯14.下列描述S N 2反应性质的说法,哪一项是错误的?(A)通常动力学上呈二级反应,对反应物和亲核试剂浓度各呈一级(B)进攻试剂亲核能力对反应速率有显著影响(C)反应物离去基离去能力对反应速率有显著影响 (D)叔卤代烃比仲卤代烃反应快。
烃的衍生物的化学方程式

烃的衍生物的化学方程式 姓名 班次一、溴乙烷与卤代烃1、溴乙烷与氢氧化钠水溶液共热:CH 3CH 2Br +NaOH CH 3CH 2OH +NaBr2、溴甲烷与氢氧化钠水溶液共热CH 3Br +NaOH CH 3OH +NaBr3、溴丙烷与氢氧化钠水溶液共热:CH 3CH 2CH 2Br +NaOH CH 3CH 2CH 2OH +NaBr4、2—溴丙烷与氢氧化钠水溶液共热:(CH 3)2CHBr +NaOH (CH 3)2CHOH +NaBr5、1,2—二溴乙烷与氢氧化钠水溶液共热:BrCH 2CH 2Br +2NaOH HOCH 2CH 2OH +2NaBr6、溴乙烷与氢氧化钠的乙醇溶液共热:CH 3CH 2Br +NaOH CH 2=CH 2↑+NaBr +H 2O7、1—溴丙烷与氢氧化钠的乙醇溶液共热:CH 3CH 2CH 2Br +NaOH CH 3CH=CH 2↑+NaBr +H 2O8、2—溴丁烷与氢氧化钠的乙醇溶液共热:CH 3CHBrCH 2CH 3+NaOH CH 3CH 2CH=CH 2↑+NaBr +H 2O9、2—溴丁烷与氢氧化钠的乙醇溶液共热:CH 3CHBrCH 2CH 3+NaOH CH 3CH=CHCH 3↑+NaBr +H 2O10、2,3—二溴丁烷与氢氧化钠的乙醇溶液共热:CH 3CHBrCHBrCH 3+2NaOH CH 2=CH —CH=CH 2+2NaBr +2H 2O加热乙醇 加热乙醇 加热乙醇 加热乙醇 加热乙醇加热加热加热加热加热二、乙醇与醇类1、乙醇与钠的反应:2CH 3CH 2OH +2Na 2CH 3CH 2ONa +H 2↑2、甲醇与钠的反应:2CH 3OH +2Na2CH 3ONa +H 2↑3、2—丙醇与钠的反应:2(CH 3)2CHOH +2Na 2(CH 3)2CHONa +H 2↑4、乙二醇与钠的反应:HOCH 2CH 2OH +2Na NaOCHCH 2ONa +H 2↑5、乙醇与钙的反应:2CH 3CH 2OH +Ca(CH 3CH 2O)2Ca +H 2↑6、乙醇与溴化氢共热:CH 3CH 2OH +HBr CH 3CH 2Br +H 2O7、甲醇与溴化氢共热:CH 3OH +HBr CH 3Br +H 2O8、2—丙醇与溴化氢共热:(CH 3)2CHOH +HBr (CH 3)2CHBr +H 2O9、 乙二醇醇与溴化氢共热:HOCH 2CH 2OH +2HBr BrCH 2CH 2Br +2H 2O10、乙醇分子间脱水:2CH 3CH 2OH CH 3CH 2OCH 2CH 3+H 2O11、乙醇分子间脱水:2CH 3OHCH 3OCH 3+H 2O12、2—丙醇分子间脱水:2(CH 3)2CHOH (CH 3)2CHOCH(CH 3)2+H 2O13、甲醇与乙醇分子间脱水:CH 3CH 2OH +CH 3OH CH 3OCH 2CH 3+H 2O14、乙醇燃烧:CH 3CH 2OH +3O 22CO 2+3H 2O15、乙醇使酸性高锰酸钾溶液褪色: 5CH 3CH 2OH +4KMnO 4+6H 2SO 45CH 3COOH +2K 2SO 4+4MnSO 4+11H 2O16、用酸性重铬酸钾溶液检验酒后驾车: 3CH 3CH 2OH +2K 2Cr 2O 7+8H 2SO 43CH 3COOH +2K 2SO 4+2Cr 2(SO 4)3+11H 2O17、 乙醇的催化氧化:2CH 3CH 2OH +O 22CH 3CHO +2H 2O18、甲醇的催化氧化:2CH 3OH +O 22HCHO +2H 2O19、2—丙醇的催化氧:2(CH 3)2CHOH +O 22CH 3COCH 3+2H 2O加热催化剂加热催化剂 加热催化剂点燃 140℃浓硫酸140℃浓硫酸140℃浓硫酸 140℃浓硫酸加热加热加热加热20、乙二醇的催化氧化:HOCH2CH2OH+O2OHCCHO+2H2O21、乙醇与浓硫酸共热170℃:CH3CH2OH CH2=CH2↑+H2O22、丙醇与浓硫酸共热:CH3CH2CH2OH CH3CH=CH2↑+H2O23、2—丙醇与浓硫酸共热:(CH3)2CHOH CH3CH=CH2↑+H2O24、1,4—丁二醇与浓硫酸共热:HOCH2CH2CH2CH2OH CH2=CH-CH=CH2↑+H2O25、乙醇与乙酸和浓硫酸共热:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O26、甲醇与乙酸和浓硫酸共热:CH3COOH+CH3OH CH3COOCH3+H2O27、甲酸、乙醇与浓硫酸共热:HCOOH+CH3CH2OH HCOOCH2CH3+H2O28、乙酸、2—丙醇与浓硫酸共热:CH3COOH+(CH3)2CHOH CH3COOCH(CH3)2+H2O29、乙二酸与足量的乙醇与浓硫酸共热:3031、乙二酸与乙二醇和浓硫酸共热:32、3HOCH2CH22O33、334、1,4—丁二酸与乙二醇和浓硫酸共热:加热浓硫酸加热浓硫酸加热浓硫酸加热浓硫酸170℃浓硫酸170℃浓硫酸170℃浓硫酸170℃浓硫酸加热催化剂+2H2O+2H2O1、苯酚燃烧:C 6H 6O +7O 26CO 2+3H 2O2、苯酚与氢氧化钠溶液反应:C 6H 5OH +NaOHC 6H 5ONa +H 2O3、苯酚钠溶液中通入二氧化碳气体: C 6H 5O -+CO 2+H 2O ===C 6H 5OH +HCO 3-4、苯酚钠溶液与氯化铝溶液混合:3C 6H 5O -+Al 3++3H 2O ===3C 6H 5OH +Al(OH)3↓5、苯酚溶液中加入浓溴水: OH OH Br — —Br +3Br 2 ↓+3HBr Br6、苯酚溶液中加入氯化铁溶液6C 6H 5OH +FeCl 3H 3[Fe(C 6H 5O)6]+3HCl 7、苯酚在一定条件下与氢气反应: —OH +3H 2OH8、酚醛树脂的制备:8、苯酚与乙醛的缩聚:加热催化剂点燃 OH +nHCHO 催化剂nOHCH 2+nH 2OCH 3OH+nCH 3CHO 催化剂n OHCH+nH 2O1、乙醛的燃烧:2C 2H 4O +5O 24CO 2+4H 2O2、丙醛的燃烧:C 3H 6O +4O 23CO 2+3H 2O3、乙醛与溴水反应:CH 3CHO +Br 2+H 2O CH 3COOH +2HBr4、乙醛与银氨溶液反应: CH 3CHO +2[Ag(NH 3)2]OH CH 3COONH 4+H 2O +2Ag +3NH 3↑5、甲醛与少量的银氨溶液反应: HCHO +2[Ag(NH 3)2]OHHCOONH 4+H 2O +2Ag +3NH 3↑6、甲醛与过量的银氨溶液反应: HCHO +4[Ag(NH 3)2]OH CO 2↑+3H 2O +4Ag +8NH 3↑7、丙醛与银氨溶液反应: CH 3CH 2CHO +2[Ag(NH 3)2]OH CH 3CH 2COONH 4+H 2O +2Ag +3NH 3↑8、乙二醛与银氨溶液反应: OHCCHO +2[Ag(NH 3)2]OHH 4NOOC —COONH 4+2H 2O +4Ag +6NH 3↑9、乙醛与新制的氢氧化铜反应:CH 3CHO +2Cu(OH)2 CH 3COOH +Cu 2O↓+2H 2O10、甲醛与少量的新制的氢氧化铜反应:HCHO +2Cu(OH)2HCOOH +Cu 2O↓+2H 2O11、甲醛与过量的新制的氢氧化铜反应:HCHO +4Cu(OH)2 CO 2↑+2Cu 2O↓+5H 2O12、乙醛与新制的氢氧化铜反应:CH 3CH 2CHO +2Cu(OH)2CH 3CH 2COOH +Cu 2O ↓+2H 2O13、乙二醛与新制的氢氧化铜反应:OHCCHO +4Cu(OH)2HOOC —COOH +2Cu 2O↓+4H 2O14、乙醛的催化氧化: 2CH 3CHO +O 22CH 3COOH15、甲醛的催化氧化:HCHO +O 22HCOOH16、丙醛的催化氧化:2CH 3CH 2CHO +O 22CH 3CH 2COOH催化剂催化剂催化剂加热加热加热加热加热加热加热加热 加热加热点燃 点燃17、乙二醛的催化氧化:OHCCHO +O 2HOOC —COOH18、乙醛与氢气反应:CH 3CHO +H 2CH 3CH 2OH19、乙醛与氢气反应:HCHO +H 2CH 3OH20、丙醛与氢气反应:CH 3CH 2CHO +H 2CH 3CH 2CH 2OH 21、乙二醛与氢气反应:OHC —CHO +2H 2HOCH 2CH 2OH五、丙酮与酮类1、丙酮燃烧:C 3H 6O +4O 23CO 2+3H 2O2、丙酮与氢气反应:CH 3COCH 3+H 2(CH 3)2CHOH点燃 加热催化剂 加热催化剂 加热催化剂加热催化剂 加热 催化剂催化剂1、乙酸与钠反应:2CH 3COOH +2Na 2CH 3COONa +H 2↑2、乙酸与氧化镁反应:2CH 3COOH +MgO (CH 3COO)2Mg +H 2O3、乙酸与氢氧化钠反应:CH 3COOH +NaOH CH 3COONa +H 2O4、乙酸与碳酸钙反应:2CH 3COOH +CaCO 3(CH 3COO)2Ca +CO 2↑+H 2O5、乙酸与碳酸氢钠反应:CH 3COOH +NaHCO 3CH 3COONa +CO 2↑+H 2O6、乙酸与乙醇和浓硫酸共热: CH 3COOH +CH 3CH 2OHCH 3COOCH 2CH 3+H 2O7、甲酸与乙醇和浓硫酸共热: HCOOH +CH 3CH 2OHHCOOCH 2CH 3+H 2O8、乙酸和甲醇与浓硫酸共热: CH 3COOH +CH 3OHCH 3COOCH 3+H 2O9、乙酸与2—丙醇和浓硫酸共热: CH 3COOH +(CH 3)2CHOHCH 3COOCH(CH 3)2+H 2O9、乙二酸与足量的乙醇与浓硫酸共热:10 11、乙二酸与乙二醇和浓硫酸共热:12、对苯二甲酸与乙二醇的缩聚:13、1,6—己二酸与1,6—己二胺的缩聚:加热浓硫酸加热浓硫酸 加热浓硫酸 加热浓硫酸 COOH COOH +2CH 3CH 2OH COOCH 2CH 3 COOCH 2CH 3 浓H 2SO 4 加热+2H 2O CH 2OH CH 2OH +2CH 3COOH CH 2OOCCH 3 CH 2OOCCH 3 浓H 2SO 4加热 +2H 2O CH 2OH CH 2OH COOH COOH 浓H 2SO 4 加热 +2H 2O COOCH 2 COOCH 2 + 催化剂 nHOOC — —COOH + nHOCH 2CH 2OH +(2n -1)H 2O HO —OC — —CO O CH 2CH 2O — [ ]n H nHOOC(CH 2)6COOH +nH 2N(CH 2)6NH 2 催化剂—OC(CH 2)6CONH(CH 2)6NH — +(2n -1)H 2O HO [ ]n H1、乙酸乙酯的燃烧:C 4H 8O 2+5O 24CO 2+4H 2O2、甲酸甲酯与银氨溶液反应:HCOOCH 3+2[Ag(NH 3)2]OH H 4NOOC —COOCH 3+H 2O +2Ag +3NH 3↑3、甲酸甲酯与新制的氢氧化铜反应:HCOOCH 3+2Cu(OH)2HOOC —COOCH 3+Cu 2O ↓+2H 2O4、乙酸乙酯在酸性条件下的水解反应: CH 3COOCH 2CH 3+H 2OCH 3COOH +CH 3CH 2OH5、甲酸甲酯在酸性条件下的水解反应: HCOOCH 2CH 3+H 2OHCOOH +CH 3CH 2OH6、乙酸甲酯在酸性条件下的水解反应: CH 3COOCH 3+H 2OCH 3COOH +CH 3OH7、丙酸乙酯在酸性条件下的水解反应: CH 3CH 2COOCH 2CH 3+H 2OCH 3CHCOOH +CH 3CH 2OH8、乙酸乙酯与氢氧化钠溶液共热:CH 3COOCH 2CH 3+NaOH CH 3COONa +CH 3CH 2OH9、甲酸乙酯与氢氧化钠溶液共热:HCOOCH 2CH 3+NaOH HCOONa +CH 3CH 2OH10、乙酸甲酯与氢氧化钠溶液共热:CH 3COOCH 3+NaOH CH 3COONa +CH 3OH11、丙酸乙酯与氢氧化钠溶液共热:CH 3CH 2COOCH 2CH 3+NaOH CH 3CHCOONa +CH 3CH 2OH加热加热加热加热 加热稀硫酸加热稀硫酸 加热稀硫酸 加热稀硫酸加热加热点燃考点名称:有机物的推断•(1)有机物推断的一般方法:①找已知条件最多的,信息量最大的。
高二化学《有机化学基础》知识点整理5

时遁市安宁阳光实验学校高二化学选修5《有机化学基础》知识点整理学号一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。
(它们都能与水形成氢键)。
(3)具有特殊溶解性的:①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物,所以常用乙醇来溶解植物色素或其中的药用成分,也常用乙醇作为反应的溶剂,使参加反应的有机物和无机物均能溶解,增大接触面积,提高反应速率。
例如,在油脂的皂化反应中,加入乙醇既能溶解NaOH,又能溶解油脂,让它们在均相(同一溶剂的溶液)中充分接触,加快反应速率,提高反应限度。
②苯酚:室温下,在水中的溶解度是9.3g(属可溶),易溶于乙醇等有机溶剂,当温度高于65℃时,能与水混溶,冷却后分层,上层为苯酚的水溶液,下层为水的苯酚溶液,振荡后形成乳浊液。
苯酚易溶于碱溶液和纯碱溶液,这是因为生成了易溶性的钠盐。
③乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
④有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
但在稀轻金属盐(包括铵盐)溶液中,蛋白质的溶解度反而增大。
⑤线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑥氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度(1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂)(2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(.....CH..3.Cl..,.沸点为...-.24.2....℃.).氟里昂(....CCl...2.F.2.,沸点为....-.29.8....℃.).氯乙烯(....CH..2.==CHCl......,沸点为....-.13.9....℃.).甲醛(...HCHO....,沸点为....-.21..℃.).氯乙烷(....CH..3.CH..2.C.l.,沸点为....12.3....℃)..一溴甲烷(CH3Br,沸点为3.6℃)四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)甲乙醚(CH3OC2H5,沸点为10.8℃)环氧乙烷(,沸点为13.5℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
《有机化学》(第四版)第七章卤代烃(习题答案)

第七章卤代烃相转移催化反应邻基效应思考题P235 习题用普通命名法命名下列各化合物,并指出它们属于伯、仲、叔卤代烷中的哪一种。
(1) (CH3)3CCH2Cl (2) CH3CH2CHFCH3 (3) CH2=CHCH2Br解:(1) 新戊基氯 (伯卤代烷) (2) 仲丁基氟(仲卤代烷) (3) 烯丙基氯(伯卤代烷)习题用系统命名法命名下列各化合物,或写出结构式。
(1)CH3CHCHCH2CHCH3CH3CH3Cl2,3-二甲基-5-氯己烷 (2)CH3CHCH2C CHCH33Cl2-甲基-3,3,5-三氯己烷(3) BrCH2CH2CHCH2CH2CH3C2H53-乙基 -1-溴己烷 (4) CH3CH2CHCH2CH3CH2Cl3-氯甲基戊烷(5) Cl1-环戊基-2-氯乙烷或 氯乙基环戊烷 (6)CH3Cl1-甲基-1-氯环己烷(7) CH3CH3CH2Cl1,1-二甲基-2-氯甲基环戊烷 (8)Cl1-氯双环[2.2.1]庚烷(9)CH 3CH CH 2CH 2BrCH 3异戊基溴 (10)CH 3CH 2CH 2CH 3H Br(R)-2-溴戊烷P236 习题 命名下列各化合物:(1) Cl 2CHCH=CH 23,3-二氯-1-丙烯(2) CH 3CHCH=CHCH 3Cl4-氯-2-戊烯(3)CH 3Br1-甲基-4-溴-2-环戊烯(4)BrCl 1-氯-4-溴苯(5)CH=CHCH 2CH 2Br 1-苯-4-溴-1-丁烯(6)CH 2CH=CH 2ClBr2-氯-4-溴烯丙基苯3-(2-氯-4-溴苯基)-1-丙烯P236 习题 写出下列各化合物的构造式或结构式:(1)4-溴-1-丁烯-3-炔CH 2=CH C CBr(2) 反-1,2-二氯-1,2-二苯乙烯C=C ClPhPh(3)对氯叔丁苯ClC(CH 3)3(4) -溴 代乙苯CHCH 3P239 习题 试预测下列各对化合物哪一个沸点较高。
有机化学期末考试试题及答案(三本院校)

**大学科学技术学院2007 /2008 学年第2 学期考核试卷课号:EK1G03A 课程名称:有机化学A 试卷编号:A班级:学号:姓名:阅卷教师:成绩:1.2。
3.4。
5.6。
苯乙酰胺7。
邻羟基苯甲醛8。
对氨基苯磺酸9.3-乙基-6-溴-2-己烯—1-醇10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分)1。
2.3。
4.5.6.7.8.+9.10.11。
12.三. 选择题.(每题2分,共14分)1。
下列物质发生S N1反应的相对速度最快的是()A B C2. 对CH3Br进行亲核取代时,以下离子亲核性最强的是:()3。
下列化合物中酸性最强的是()(A) CH3CCH (B)H2O (C)CH3CH2OH (D) p—O2NC6H4OH(E)C6H5OH (F)p—CH3C6H4OH4。
指出下列化合物的相对关系()A,相同,B,对映异构,C,非对映体,D,没关系5。
下列化合物不发生碘仿反应的是( )A、 C6H5COCH3B、C2H3OHC、 CH3CH2COCH2CH3D、CH3COCH2CH36。
下列反应的转化过程经历了()A、亲电取代B、亲核加成C、正碳离子重排D、反式消除7。
能与托伦试剂反应产生银镜的是()A、CCl3COOHB、CH3COOHC、 CH2ClCOOHD、HCOOH四.鉴别下列化合物(共5分)、、、五.从指定的原料合成下列化合物。
(任选3题,每题5分,共15分)1. 由溴代环己烷及不超过四个碳原子的化合物和必要试剂合成:2.由指定原料及不超过四个碳原子的化合物和必要的试剂合成:3.由指定原料及不超过四个碳原子的化合物和必要的试剂合成:4. 由苯、丙酮和不超过4个碳原子的化合物及必要的试剂合成:5. 由指定的原料及必要的有机试剂合成:六.推断结构.(8分)2-(N,N-二乙基氨基)-1-苯丙酮是医治厌食症的药物,可以通过以下路线合成,写出英文字母所代表的中间体或试剂:A卷参考答案及评分标准特别说明:鉴于以下原因,只要给出合理答案即可给分,(1)命名可采用俗名、商品名、中文名、英文名、系统名等,结构可采用分子式、键线式、电子式、纽曼投影式、Fisher投影式等;(2)对合成同一个目标化合物来说,通常可以有多种反应原料、反应条件、反应步骤达到同样的结果,不同的路线对于生产和科研来说重要性很大,但是对于本科基础教学来说不做要求;(3)化合物鉴别方案可以依据其物理化学性质不同而可以采用多种分析测试手段,不同方案之间存有难易之分.一.命名下列各化合物或写出结构式(每题1分,共10分)1.(Z)-或顺—2,2,5-三甲基-3-己烯2.4-环丙基苯甲酸3. (S)-环氧丙烷4. 3,3—二甲基环己基甲醛5. α-萘酚6。
有机化学(第三版马祥志主编)课后习题答案

第一章 绪论习题参考答案1. 某化合物的分子量为60,含碳40.1%、含氮6.7%、含氧53.2%,确定该化合物的分子式。
解:① 由各元素的百分含量,根据下列计算求得实验式1:2:133.3:7.6:34.3162.53:17.6:121.40== 该化合物实验式为:CH 2O② 由分子量计算出该化合物的分子式216121260=+⨯+该化合物的分子式应为实验式的2倍,即:C 2H 4O 22. 在C —H 、C —O 、O —H 、C —Br 、C —N 等共价键中,极性最强的是哪一个? 解:由表1-4可以查得上述共价键极性最强的是O —H 键。
3. 将共价键⑴ C —H ⑵ N —H ⑶ F —H ⑷ O —H 按极性由大到小的顺序进行排列。
解:根据电负性顺序F > O > N > C ,可推知共价键的极性顺序为: F —H > O —H > N —H > C —H4. 化合物CH 3Cl 、CH 4、CHBr 3、HCl 、CH 3OCH 3中,哪个是非极性分子?解:CH 4分子为高度对称的正四面体空间结构,4个C —H 的向量之和为零,因此是非极性分子。
5. 指出下列化合物所含官能团的名称和该化合物所属类型。
CH 3OH(2)碳碳三键,炔烃 羟基 ,酚(4)COOH酮基 ,酮 羧基 ,羧酸(6) CH 3CH 2CHCH 3OH (1) CH 3CH 2C CH(3) CH 3COCH 3(5) CH 3CH 2CHO醛基,醛羟基,醇(7) CH3CH2NH2氨基,胺6. 甲醚(CH3OCH3)分子中,两个O—C键的夹角为111.7°。
甲醚是否为极性分子?若是,用表示偶极矩的方向。
37. 什么叫诱导效应?什么叫共轭效应?各举一例说明之。
(研读教材第11~12页有关内容)8. 有机化学中的离子型反应与无机化学中的离子反应有何区别?解:无机化学中的离子反应是指有离子参加的反应,反应物中必须有离子。
溴甲烷 产品标准

溴甲烷产品标准溴甲烷(CH3Br)是一种无色、易挥发的有机化合物,具有强烈的刺激性气味。
它是一种重要的有机溶剂和熏蒸剂,广泛应用于农业、工业和医药等领域。
为了确保溴甲烷产品的质量和安全性,制定了一系列的产品标准。
一、产品规格溴甲烷的产品规格通常包括以下方面:1.化学组成:溴甲烷的化学组成应符合规定的要求,一般应含有99.0%以上的溴甲烷。
2.外观:溴甲烷应为无色或浅黄色透明液体,无悬浮物、机械杂质和分层现象。
3.气味:溴甲烷应具有强烈的刺激性气味,无异味。
4.密度:溴甲烷的密度应符合规定的要求,一般应在1.400-1.425g/cm³之间。
5.沸点:溴甲烷的沸点应符合规定的要求,一般应在54-56℃之间。
6.折射率:溴甲烷的折射率应符合规定的要求,一般应在1.4180-1.4220之间。
二、产品质量要求除了产品规格外,溴甲烷的产品质量要求还包括以下方面:1.纯度:溴甲烷的纯度应不低于99.0%。
2.水份:溴甲烷中水份的含量不得超过0.5%。
3.游离溴:溴甲烷中游离溴的含量不得超过0.5%。
4.稳定性和贮存性:溴甲烷应能在常温下稳定贮存,不出现分层、沉淀等现象。
5.安全性:溴甲烷应符合安全性的要求,不得对人体和环境造成危害。
三、产品检验方法为了确保溴甲烷产品的质量和安全性,需要进行严格的检验。
以下是溴甲烷产品的检验方法:1.外观检验:观察溴甲烷的外观,应无悬浮物、机械杂质和分层现象,颜色应为无色或浅黄色透明液体。
2.气味检验:通过嗅觉感官检验溴甲烷的气味,应具有强烈的刺激性气味,无异味。
3.密度检验:采用密度计法测定溴甲烷的密度,应符合规定的要求。
4.沸点检验:采用沸点仪法测定溴甲烷的沸点,应符合规定的要求。
5.折射率检验:采用折射仪法测定溴甲烷的折射率,应符合规定的要求。
6.纯度检验:采用色谱法、红外光谱法等方法测定溴甲烷的纯度,应不低于99.0%。
7.水份检验:采用干燥法等方法测定溴甲烷中水份的含量,不得超过0.5%。
溴甲烷中毒

溴甲烷中毒文章目录*一、溴甲烷中毒的概述*二、溴甲烷中毒的原因*三、溴甲烷中毒的主症*四、溴甲烷中毒的急救措施*五、溴甲烷中毒的护理知识*六、如何预防溴甲烷中毒溴甲烷中毒的概述溴甲烷(CH3Br)为无色、无臭、易挥发,可经过呼吸道、皮肤及消化道进入人体。
它能干扰细胞代谢,造成神经系统、肺、肾、肝及心血管系统的损害。
溴甲烷中毒的原因挥发性高,空气中可达较高浓度。
接触者以呼吸道吸入为主。
皮肤占染有溴甲烷液体也可经皮吸收,特别是液态溴甲烷污染衣物、手套、鞋袜而不及时去除使皮肤接触时间长,吸收量较多。
液态溴甲烷有致冷作用,对皮肤、粘膜有冷刺激,故很少有经胃肠道进入人体者。
溴甲烷中毒的主症急性中毒吸入高浓度溴甲烷可因呼吸抑制而猝死。
多数病例均有20分钟到48小时潜伏期,长者可达3~5日。
轻度中毒有头晕、头痛、全身乏力、嗜睡、食欲减退、恶心、呕吐、日吃、发音不清、酒醉状、步态不稳、视物模糊、复视等,亦可有轻度肾损害。
重度中毒表现为上述症状加重,出现脑水肿,呈昏迷、抽搐甚至癫痫持续状态,中枢性呼吸衰竭,小脑性共济失调,精神症状如淡漠、谵妄、躁狂、幻觉、妄想、定向障碍、行为异常;部分病例可有多发性周围神经病变、肺水肿、心律失常、肾衰竭。
慢性中毒全身乏力、倦怠、头晕、头痛、记忆力减退、视力模糊,较重者可有性格改变、幻觉等,亦可伴有周围神经炎及植物神经功能紊乱。
皮肤损害皮肤接触溴甲烷液体可有红斑、水疱性皮炎等。
溴甲烷中毒的急救措施现场急救迅速将中毒者拖离现场和堵泄漏处理(同氯化苦中毒现场急救),应充分注意施救者或抢险者的自身保护。
受害者脱离现场后即应脱除污染衣物,吸新鲜空气。
皮肤污染处先用肥皂水清洗,其后再用清水淋浇;有水疱处消毒后用无菌针刺破清除水疱液,然后再用消毒的碳酸氢钠液冲洗创面,再涂消毒的鱼肝油包敷;眼部污染用2%碳酸氢钠液流水冲洗。
急诊观察处理经口误服者应予催吐,并选用2%~4%碳酸氢钠液洗胃。
凡接触溴甲烷后出现眼及呼吸道刺激症状及(或)有头昏、乏力、恶心、呕吐等症状,或者是皮肤污染溴甲烷局部出现水疱者,均应留诊观察至少48小时,同时应注意作进一步的清洗排毒处理。
有机化学方程式(70个)

有机化学基础反应方程式汇总1. 甲烷(烷烃通式:C n H 2n +2)甲烷的制取:CH 3CaO △2CO 3+CH 4↑(1)氧化反应甲烷的燃烧:CH 4+2O 2 点燃CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应CH 4+Cl 光照3Cl(一氯甲烷)+HClCH 3Cl+Cl 光照2Cl 2(二氯甲烷)+HClCH 2Cl 2+Cl 光照3(三氯甲烷)+HCl (CHCl 3又叫氯仿)CHCl 3+Cl 光照4(四氯化碳)+HCl(3)分解反应甲烷分解:CH 高温22. 乙烯(烯烃通式:C n H 2n )乙烯的制取:CH 3CH 2浓硫酸170℃2=CH 2↑+H 2O(消去反应)(1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 点燃2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2Br —CH 2Br与氢气加成:CH 2=CH 2+H 2催化剂CH 3CH 3 与氯化氢加成:CH 2=CH 2+HCl 催化剂CH 3CH 2Cl 与水加成:CH 2=CH 2+H 2O催化剂CH 3CH 2OH(3)聚合反应 乙烯加聚,生成聚乙烯:n CH 2=CH 2催化剂 [CH 2—CH 2 ] n 适当拓展:CH 3CH =CH 2+Cl 3׀ Cl CH -׀ ClCH 2 CH 3CH =CH 2+H 2催化剂CH 3CH 2CH 3 CH 3CH =CH 2+HCl 催化剂CH 3CH 2CH 2Cl 或CH 3׀ ClCHCH 3 CH 3CH =CH 2+H 2O 催化剂CH 3CH 2CH 2OH 或CH 3׀ OHCHCH 3 n CH 2=CH -CH 3催化剂 [CH 2—׀ CH 3CH ] n (聚丙烯) 3. 乙炔(炔烃通式:C n H 2n-2)乙炔的制取:CaC 2+2H 2 CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 点燃2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
大学有机化学期末考试题含三套试卷和参考答案)
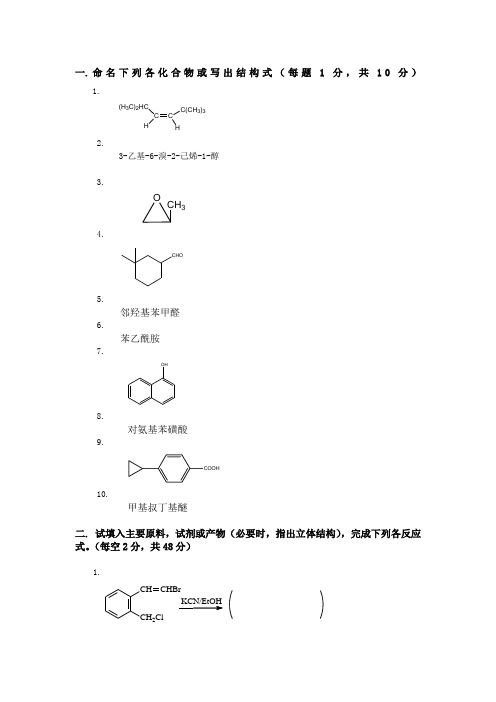
一. 命名下列各化合物或写出结构式(每题1分,共10分)1.C H C(CH3)3(H3C)2HCH2.3-乙基-6-溴-2-己烯-1-醇3.OCH34.CHO5.邻羟基苯甲醛6.苯乙酰胺7.OH8.对氨基苯磺酸9.COOH10.甲基叔丁基醚二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。
(每空2分,共48分)1.CH CH2ClCHBrKCN/EtOH2.3.4.+CO2CH35.46.OOOO7.CH2ClCl8.3+H2O-SN1历程+ 9.C2H5ONaOCH3O+ CH2=CH C CH3O10.+C12高温高压、CH = C H2HBrMgCH3COC1BrBrZn EtOH11.C O CH 3+Cl 2H +12.Fe,HClH 2SO 43CH 3(CH 3CO)2OBr2NaOH24NaNO H PO (2)三. 选择题。
(每题2分,共14分)1. 与NaOH 水溶液的反应活性最强的是( )(A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2Br32. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( )(A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH -3. 下列化合物中酸性最强的是( )(A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH(E) C 6H 5OH (F)p-CH 3C 6H 4OH4. 下列化合物具有旋光活性得是:( )A,CH 3CH 3B,C, (2R, 3S, 4S)-2,4-二氯-3-戊醇5. 下列化合物不发生碘仿反应的是( ) A 、 C 6H 5COCH 3 B 、C 2H 5OH C 、 CH 3CH 2COCH 2CH 3 D 、CH 3COCH 2CH 36. 与HNO2作用没有N2生成的是( )A、H2NCONH2B、CH3CH(NH2)COOHC、C6H5NHCH3D、C6H5NH27. 能与托伦试剂反应产生银镜的是( )A、CCl3COOH B、CH3COOHC、 CH2ClCOOH D、HCOOH四. 鉴别下列化合物(共6分)苯胺、苄胺、苄醇和苄溴五. 从指定的原料合成下列化合物。
甲基上溴的机理

甲基上溴的机理
摘要:
一、甲基上溴的定义与背景
二、甲基上溴的合成方法
三、甲基上溴的反应机理
四、甲基上溴的应用领域
五、甲基上溴的发展前景与挑战
正文:
甲基上溴(Methyl Bromide)是一种有机化合物,分子式为CH3Br,具有刺激性气味。
它是一种重要的工业原料,广泛应用于化工、医药、农业等领域。
近年来,甲基上溴在不对称催化和有机合成的应用研究中受到了广泛关注。
甲基上溴的合成方法主要有以下几种:
1.甲醇与溴化氢反应
2.乙烯与溴反应
3.烷基卤化物与氢溴酸反应
甲基上溴的反应机理涉及亲核取代、消除、加成等过程。
其中,亲核取代反应是甲基上溴的主要反应类型,通过该反应,甲基上溴可与醇、硫醇、胺等化合物发生反应,生成新的化合物。
甲基上溴在以下领域中具有广泛的应用:
1.医药:作为合成药物的中间体,如抗疟疾药物青蒿素等。
2.农业:作为杀虫剂、杀菌剂,用于粮食储藏、水果保鲜等。
3.化工:用于合成染料、涂料、塑料等。
尽管甲基上溴在许多领域具有广泛的应用,但它同时也是一种臭氧层破坏物质,对环境和人类健康造成潜在威胁。
因此,研究绿色、环保的甲基上溴替代品已成为当前的研究热点。
总之,甲基上溴作为一种重要的有机化合物,在不对称催化和有机合成领域具有巨大的潜力。
然而,其对环境和人类健康的潜在危害也使得绿色、环保的替代品研究迫在眉睫。
卤代烃的分类、命名及同分异构;卤代烷烃的化学性质;卤代烯烃和

cis-1-bromo-2-methylcyclopropane trans-1-bromo-2-methylcyclopropane
H H Br CH3
顺-1-甲基-2-溴环己烷 (1R,2S)-1-甲基-2-溴环己烷
(1S,2R)-1-bromo-2-methylcyclohexane
7
卤代烯烃:
KOH C2H5OH
CH3 CH3CH C(CH3)2 + CH3CH2C
29%
28
CH2
71%
消除反应常和亲核取代反应的互相竞争: 体积大的碱,有利于消除反应。
CH3CHCH3+ C2H5ONa Br
C2H5OH 55 ℃
(CH3)2CHOC2H5+ CH3CH CH2
21% 79%
溶剂:水有利于取代反应,醇有利于消除反应。
30
溶剂乙醚的作用:和生成的有机镁化合物络合,成为稳
定的溶剂化物。
C2H5 O· · C2H5
R Mg X
· ·O
C2H5 C2H5
苯、四氢呋喃、其他醚类也可以也可以作为溶剂。
一卤代烷生成格氏试剂的活性顺序是: RI > RBr > RCl > RF
通常用一溴代烷制备格氏试剂。
31
Grignard试剂的性质:
CH2
CHCHCH2Cl CH3
3-甲基-4-氯-1-丁烯 4-chloro-3-methylbut-1-ene
卤代芳烃:
Cl CH3
邻氯甲苯
2-chlorotoluene 1-chloro-2-methylbenzene
CH CH3
CH2Cl
2-苯基-1-氯丙烷
溴甲烷用途范文

溴甲烷用途范文溴甲烷是一种无色无味的液体化合物,化学式为CH3Br。
它是一种有机卤化物,由甲烷分子中的一个氢原子被溴原子取代而成。
溴甲烷的用途非常广泛,主要应用于农业、医药、化学工业和研究领域。
首先,在农业领域,溴甲烷被广泛用作害虫防治剂。
在农田中,一些昆虫和寄生虫会对农作物造成严重的危害,而溴甲烷可以用作一种杀虫剂和杀螨剂,通过熏蒸的方式,将农田中的昆虫和寄生虫消灭,从而保护农作物的生长和收获。
溴甲烷还可以用于保护和保存牛肉、猪肉等肉制品,防止它们被昆虫和害虫污染。
其次,在医药领域,溴甲烷也具有重要的应用。
它可以作为麻醉剂,用于手术、疼痛缓解和医学研究。
溴甲烷可以通过吸入进入人体,使人体处于无痛无感觉的状态,从而进行手术和治疗。
此外,溴甲烷还可以用作皮肤外科手术中的冷冻剂,用于去除皮肤上的疣和胎记等。
在这方面,溴甲烷的低沸点和挥发性使其成为一种理想的医用化合物。
此外,在化学工业中,溴甲烷也有广泛的用途。
它可以用作有机合成化学品的中间体,如溴化物、氯化物和碘化物等。
这些化学品在制造、冶金和电子行业中都有应用。
溴甲烷还可以用作制冷剂和消毒剂,具有阻燃和消毒的作用。
它被广泛用于火灾灭火剂和泡沫灭火剂中,能够有效地抑制火势的蔓延和扩散。
最后,在研究领域,溴甲烷也被用于科学实验和分析化学。
它可以用作萃取剂,用于从化合物混合物中分离和提取化合物。
溴甲烷还可以用作溶剂,用于溶解固体和液体物质,以便于实验操作和分析。
此外,溴甲烷还用于有机合成反应的催化剂,可以加速和促进反应的进行。
总而言之,溴甲烷是一种多功能的有机化合物,在农业、医药、化学工业和研究领域都有广泛的应用。
它的防治害虫、杀菌、火灾灭火和溶剂特性使其成为一种重要的化学品和工业原料。
然而,溴甲烷也是一种有毒的化合物,需要正确使用和处理,以避免对人类和环境造成伤害和污染。
卤代烷的亲核取代反应

Li
CH2=C Li CH3
CuX CH2=C Li CH3
CH2=C
2
CuLi
CH3 (80%)
CH3
CH2=C CH3
CH3
本章小结和教学要求:
掌握:1、卤代烃命名; 2、卤代烷亲核取代 SN1、SN2反应机制及特点; 3、卤代烃消除及扎依切夫规则, E1、E2反应特点; 4、理解取代、消除竞争性及各种因素影响; 正碳 离子的结构、稳定性、反应活性影响; 5、格氏试剂的生成和性质;
Reaction Progress
2、 SN2机制
双分子亲核取代 (SKIP)
CH3OH + Br-
CH3Br + OH-
反应速率 n=K[CH3Br][OH-]
OH- +
Br H
慢
OH
Br
快
OH H
+ B r-
H
双分子反应
SN2机制的特点: (1) 双分子反应,速率与卤代烷及亲核试剂的浓度有关。 (2) 反应一步完成,旧键断裂和新键的形成同时进行。 (3) 反应中,中心碳原子构型转化 —瓦尔登转化。
SN2速率: 卤代甲烷>伯卤代烷>仲卤代烷>叔卤代烷
OH H
Br
原因:速率决定于过渡态形成。
试剂从中心碳另一侧进攻,烃基越多, 越不利于试剂的进攻,反应速率越小。
(2)亲核试剂
1)对SN1影响不大。因亲核试剂不参与第一步反应。
2)亲核试剂给电子能力强即亲核性强,则SN2速率就大;
亲核试剂体积越大,背面进攻位阻大, SN2速率越小。
制备格氏试剂的卤代烷活性:RI > RBr > RCl
MgBr Br + Mg Cl O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MX KX 0
X φf (t )
7
多自由度系统振动 / 多自由度系统的自由振动
首先讨论正定系统的主振动
正定系统: MX KX 0
主振动: X φa sin( t ) 将常数 a 并入φ 中
X R
0
n
M 正定,K 正定
φ [1 2 n ]T
k1n 2 m1n k 2 n 2 m2 n k nn 2 mnn
0
2n a1 2( n1) an1 2 an 0 频率方程
解出 n 个值,按升序排列为:
2 2 0 12 2 n
或特征多项式
i :第 i 阶固有频率
k11 i2 m11 k 21 i2 m21 k n1 i2 mn1
2013年7月5日 《振动力学》
k12 i2 m12 k 22 i2 m22 k n 2 i2 mn 2
k1n i2 m1n 1(i ) 0 (i ) 2 k 2 n i m2 n 2 0 (i ) 2 k nn i mnn n 0
X φsin( t )
(K M ) 0 φ
2
φ 有非零解的充分必要条件:
k11 2 m11 k 21 2 m21 k n1 2 mn1 2013年7月5日
《振动力学》
K 2M 0
特征方程
k12 2 m12 k 22 2 m22 k n 2 2 mn 2
( K i2 M ) (i ) 0 φ n n n n
φ(i ) [1(i ) n(i ) ]T
n 个方程
奇次方程组
当 i不是特征多项式重根时,上式 n 个方程只有一个不独立 设最后一个方程不独立,把它划去,并且把含有 (i ) 的某个元 φ (i ) 素(例如 n )的项全部移到等号右端
作用力方程: 固有振动方程:
(自由振动方程)
MX KX P (t )
MX KX 0
X Rn
和单自由度系统一样,自 由振动时系统将以固有频 率为振动频率
同步振动:系统在各个坐标上除了运动幅值不相同外,随时 间变化的规律都相同的运动
运动规律的时间函数
X φ f (t )
( FM
2
多自由度系统振动 / 多自由度系统的自由振动
采用位移方程求解固有频率
位移方程: FMX X FP (t )
主振动: X φsin( t ) 代入,得: (FM I ) 0 φ 特征方程:
X R
n
F K 1 柔度矩阵
自由振动的位移方程: FMX X 0
φ 特征向量(模态)
φ(i )
1(i ) φ(i ) R n1 n(i )
i
一一对应
i 1~ n
i、φ(i ) 代入: ( K i2 M ) (i ) 0 φ
2013年7月5日 《振动力学》
第i 阶模态特征值 问题
13
多自由度系统振动 / 多自由度系统的自由振动
主振动: 代入,得: 解释:
X φsin( t )
(FM I ) 0 φ
φ [1 2 n ]T
特征值
1/ 2
?
(K M ) 0 φ
2
Kφ Mφ
2
1
2
Iφ K 1 Mφ 1 I) 0 φ
10
1/ 2
2013年7月5日 《振动力学》
14
多自由度系统振动 / 多自由度系统的自由振动
( K i2 M ) (i ) 0 φ n n n n
φ(i ) [1(i ) n(i ) ]T
n 个方程
奇次方程组
当 i不是特征多项式重根时,上式 n 个方程只有一个不独立 设最后一个方程不独立,把它划去,并且把含有 (i ) 的某个元 φ (i ) 素(例如 n )的项全部移到等号右端
0
0
6
多自由度系统振动 / 多自由度系统的自由振动
(t ) φT Kφ f T 2 f (t ) φ Mφ
a、b、 为常数
(1)正定系统
0
(t ) 2 f (t ) 0 f
f (t ) a sin(t ), f (t ) at b,
(t ) φT Kφ 令: 2 f M 正定,K 正定或半正定 (常数) 0 T f (t ) φ Mφ 对于非零列向量φ : 0
φ Mφ 0 φT Kφ 0 φT Kφ 0 T φ Mφ
T
2013年7月5日 《振动力学》
t 的函数
与t 无关
φT Mφ 0 对于正定系统: T φ Kφ 0 φT Mφ 0 对于半正定系统: T φ Kφ 0
12
多自由度系统振动 / 多自由度系统的自由振动
• 多自由度系统的模态(主振型)
正定系统: MX KX 0
主振动: X φa sin( t ) 特征值问题: ( K 2 M ) 0 φ
X Rn
0
φ Rn
振动的形状
特征值(固有频率)
n 自由度系统:
φ [1 2 n ]T
特征值
1/ 2
FM I 0
特征根按降序排列: 1 2 n 0
i 1/ i2
2013年7月5日 《振动力学》 11
多自由度系统振动 / 多自由度系统的自由振动
例:三自由度系统
m 0 0 M 0 m 0 0 0 m
(k11 i2 m11 )1(i ) (k 1,n1i2 m1,n1 )n(i)1 (k1n i2 m1n )n(i ) n -1个方程 非奇次方程组 (k 2 (i ) 2 (i ) 2 (i ) n 1,1 i mn 1,1 )1 ( k n 1, n 1 i mn 1, n 1 )n 1 (k n 1, n i mn 1, n )n
k1n 2 m1n k 2 n 2 m2 n k nn 2 mnn
0
8
多自由度系统振动 / 多自由度系统的自由振动
k11 2 m11 k 21 2 m21 k n1 2 mn1
k12 2 m12 k 22 2 m22 k n 2 2 mn 2
2013年7月5日 《振动力学》
1 :基频
9
固有频率仅取决于系统本身的刚度、质量等物理参数
多自由度系统振动 / 多自由度系统的自由振动
采用位移方程求解固有频率 位移方程:
FMX X FP (t )
X Rn
F K 1 柔度矩阵
自由振动的位移方程: FMX X 0
为使计算简单,令: n( i ) 1
2013年7月5日 《振动力学》
φ
(i )
(i ) 1
(i ) 2
(i ) n 1
1
T
16
多自由度系统振动 / 多自由度系统的自由振动
例:三自由度系统
m 0 0 M 0 m 0 0 0 m
x1 2k m k m
x1 2k
m
x2 k
m
x3
2k m
k
(K 2 M ) 0 φ
3k m 2 k 0
3 1 0
3k K k 0
k 2k k
0 k 3k
k 2k m 2 k
1
1 k 2 0 2 3k m 3 0
2013年7月5日 《振动力学》
3
多自由度系统振动 / 多自由度系统的自由振动
三自由度系统
振动形式1
振动形式2
振动形式3
同步振动:系统在各个坐标上除了运动幅值不相同外,随时 间变化的规律都相同的运动
2013年7月5日 《振动力学》 4
多自由度系统振动 / 多自由度系统的自由振动
• 多自由度系统的固有频率
φ(i ) [1(i ) n(i ) ]T
当 i不是特征多项式的重根时,上式的 n 个方程中有且只有 一个不独立 设最后一个方程不独立,把它划去,并且把含有 (i ) 的某个元 φ (i ) 素(例如 n )的项全部移到等号右端
(k11 i2 m11 )1(i ) (k 1,n1i2 m1,n1 )n(i)1 (k1n i2 m1n )n(i ) (k 2 (i ) 2 (i ) 2 (i ) n 1,1 i mn 1,1 )1 ( k n 1, n 1 i mn 1, n 1 )n 1 (k n 1, n i mn 1, n )n
2013年7月5日 《振动力学》 2
多自由度系统振动 / 多自由度系统的自由振动
• 多自由度系统的固有频率
作用力方程: 固有振动方程:
(自由振动方程)
MX KX P (t )
MX KX 0
X Rn
和单自由度系统一样,自 由振动时系统将以固有频 率为振动频率
在考虑系统的固有振动时,最感兴趣的是系统的同步振动, 即系统在各个坐标上除了运动幅值不相同外,随时间变化的 规律都相同的运动
主振动
0 0
只可能出现形如 X φa sin( t )的同步运动 系统在各个坐标上都是按相同频率及初相位in( t )的同步运动 也可能出现形如 X φ(at b) 的同步运动(不发生弹性变形 )
