中山大学2000(B)《物理化学》考研试题及答案
中山大学1999—2000考研《无机化学》真题含答案

中山大学1999—2000考研《无机化学》真题(含答案)考试科目:无机化学;专业:无机化学、分析化学、有机化学、物理化学;研究方向:以上各专业所有方向(考生注意:全部答案必须写在答卷纸(簿)上,写在试题上无效,答案要注明题号,不用抄题。
)一.选择题(共10分)。
(请标明题次,并把所选答案前的字母写在答卷纸上)1. 根据“酸碱质子理论”,都属于“两性电解质”的是A.HAc,H2O,HPO42-;B.HF,F-,HSO4-;C.HCO3-,CO32-,HS-;D.OH-,H2PO4- ,NH4+2.在相同温度下,2H2(g)+S2(g)=2H2S(g) KP12Br2(g)+2H2S(g)=4HBr(g)+S2(g) KP2H2(g)+Br2(g)=2HBr(g) KP3则KP2=A.KP1*KP3B.2KP3*KP1C.KP1/(KP3)2 D(KP3)2/KP13. 下列电对中Φθ,最小的是A.Ag+/Ag;B.AgBr/Ag;C.Ag(NH3)2+/Ag;D.Ag(CN)2-/Ag4. 某反应速度常数K的量纲为dm3.mol-1.s-1,该反应是A.一级反应;B. 三级反应;C. 二级反应;D.1/2级反应5. 下列卤化物中,共价性最强的是A. LiI;B. BeI2C.LiClD.MgI26. 单键键能正确的大小顺序是A.O-----O>S-S>Se-SeB.O-O>S-S>Se-SeC. O-O>S-S>Se-SeD. O-O>S-S>Se-Se7 以Cr2O3为原料制备铬酸盐,应选的试剂是A.Cl2;B.H2O2;C.KOH和KClOD.浓HNO38. 下列盐中,属于正盐的是A.NaH2PO2B.NaH2PO3C.Na2HPO4D.NaH2PO49. 既能溶于Na2S溶液,又能溶于Na2S2溶液的硫化物是A.ZnSB.As2S3C.CuSD.HgS10. 下列含氧酸Ka1变化顺序不正确的是A. HBrO4>HClO3>HClOB. H3SO4>H2P2O7>H3AsO4C. H2SO4>H2SeO4>H6TeH6D. HClO3>HIO3>H5IO6二、填空题(共28分)(请按空格上的序号在答卷纸上写出相应的答案)1. 写出下列化合物水解的主要产物:NCl3: (1)__________________; PCl3:(2)_________________2.硼烷分子中所含的缺电子多中心键类型包括:(3)______________________ (4)_________________________ 和 (5)_______________________3、在298K,反应CaCO3(s)=CaO(s)+CO32-(g)的ΔHθ=178.3KJ·mol-1 ΔSθ=160.4J·mol-1·k-1,则正反应可自发进行的温度是(6)______________________.4、 CH4,NH3,NO2,H2O分子中,键角由大到小的顺序是(7)____________________原子轨道dx2-y2的角度分布图是(8)_____________________该图的物理意义是表示(9)______________________;(10)、--_________________; (11)___________________;5、 MO法中,原子轨道有效组合成分子轨道必须满足的原则是:(12) ________________;(13)__________________;和(14)__________________;“谰系收缩”是指(15)_____________________________________________________;8、实验测定,H2(g)+I2(g)=2HI(g)的反应机理是:(1)I2(g)=I(g)+I(g) (平衡常数K) (快步骤)(2)H2(g)+I(g)+I(g)-->2HI(g) (慢步骤)则该反应的速率方程式是(16)________________________;反应级数是(17)___________________________化学反应2Ag(s)+2H++2I-=2AgI(g)+H2(g)设计为原电池,其表达式是(18)__________ H2[PtCl6]名称(19)_____________________________;10、六硝基合钴(III)酸钠二钾的化学式是(20)_______________11、配合物[Fe(CN)6]4-、[Os(CN)6]4-、[FeF6]4-和[Ru(CN)6]4-的晶体场稳定花能由大到小的顺序是(21)_____________________12、O3(g)分子含有的化学键包括(22)__________________; 它是一种(23)_________磁性物质。
中山大学物理化学考研试题及复习资料

物理化学经典习题一、填空题1.硫酸与水可形成三种水合盐:H 2SO 4·H 2O 、H 2SO 4·2H 2O 、H 2SO 4 ·4H 2O 。
常压下将一定量的H 2SO 4溶于水中,当达三相平衡时,能与冰、 H 2SO 4水溶液平衡共存的硫酸水合盐的分子中含水分子的数目是 。
2.Na +、H +的还原电极电势分别为 –2.71V 和 –0.83V ,但用Hg 作阴极电解 NaCl 溶液时,阴极产物是Na –Hg 齐,而不是H 2,这个现象的解释是 。
3.在稀亚砷酸溶液中通入过量的硫化氢制备硫化砷溶液。
其胶团结构式为 。
注明紧密层、扩散层、胶核、胶粒、胶团。
4.在两个具有0.001mAgNO 3溶液的容器之间是一个AgCl 多孔塞,在多孔塞两端放两个电极,接通直流电源后,溶液将向 极方向流动。
5. 反应 A ⎯→⎯1k B (Ⅰ) ; A ⎯→⎯2k D (Ⅱ)。
已知反应(Ⅰ)的活化能大于反应(Ⅱ)的活化能,加入适当催化剂 改变获得B 和D 的比例。
6.等温等压(298K 及p ø)条件下,某一化学反应在不做非体积功条件下进行,放热40.0 kJ·mol -1,若该反应通过可逆电池来完成,吸热4.00 kJ·mol -1,则该化学反应的熵变为 。
7.若稀溶液表面张力γ 与溶质浓度c 的关系为 γ0 – γ = A + B ln c (γ0为纯溶剂表面张力, A 、B 为常数), 则溶质在溶液表面的吸附量Γ 与浓度c 的关系为 。
8.298.2K 、101.325kPa 下,反应 H 2(g) +21O 2(g) ═ H 2O(l) 的 (∆r G m – ∆r F m )/J·mol -1为 。
二、问答题1.为什么热和功的转化是不可逆的?2.在绝热钢筒中进行一化学反应:H 2(g) + 21O 2(g) ═ H 2O(g),在反应自发进行。
中山大学物理化学试题

考试科目: 物理化学;专业: 高分子化学与物理研究方向: 本专业的各研究方向;专业: 高分子化学与物理一. (共30分) 填空与问答题(1):1.在绝热钢弹中, 发生一个放热的分子数增加的化学反应, 则( )。
(2分)(a) Q > 0, W > 0, ∆U > 0 (b) Q = 0, W = 0, ∆U > 0(c) Q = 0, W = 0, ∆U = 0 (d) Q < 0, W > 0, ∆U < 02. 1 mol单原子理想气体始态为273K, 一个标准大气压, 经下列过程: (a) 恒容升温1K;(b) 恒温压缩至体积的一半; (c) 恒压升温10 K; (d) 绝热可逆压缩至体积的一半。
上述四过程中, 终态压力最大的是过程______, 终态压力最小的是过程______, 终态温度最高的是过程______, 终态温度最低的是过程______。
(2分)3.实际气体经节流膨胀后,下述哪一组结论是正确的Æ ( ) (2分)(a) Q < 0, ∆H = 0, ∆p < 0 (b) Q = 0, ∆H = 0, ∆T < 0(c) Q = 0, ∆H < 0, ∆p < 0 (d) Q = 0, ∆H = 0, ∆p < 04.理想气体从状态I经自由膨胀到达状态II, 可用哪个热力学判据来判断该过程的自发性( )。
(2分)(a)∆F (b) ∆G (c)∆S (d)∆U5. 分子配分函数的定义为( ), 其适用条件为( )。
(2分)6.热力学函数与分子配分函数的关系式对于定域子体系和离定域子体系都相同的是( )。
(2分)(a) G, F, S (b) U, H, S (c) U, H, C v (d) H, G, C v7.有四种含不同溶质相同浓度m = 1 mol⋅ kg-1的水溶液, 分别测定其沸点, 沸点升得最高的是( )。
中山大学化学考研真题(含答案)

中山大学1999—2000考研《无机化学》真题(含答案)考试科目:无机化学专业:无机化学、分析化学、有机化学、物理化学研究方向:以上各专业所有方向(考生注意:全部答案必须写在答卷纸(簿)上,写在试题上无效,答案要注明题号,不用抄题。
)一.选择题(共10分)。
(请标明题次,并把所选答案前的字母写在答卷纸上)1. 根据“酸碱质子理论”,都属于“两性电解质”的是A.HAc,H2O,HPO42-;B.HF,F-,HSO4-;C.HCO3-,CO32-,HS-;D.OH-,H2PO4- ,NH4+2.在相同温度下,2H2(g)+S2(g)=2H2S(g) KP12Br2(g)+2H2S(g)=4HBr(g)+S2(g) KP2H2(g)+Br2(g)=2HBr(g) KP3则KP2=A.KP1*KP3B.2KP3*KP1C.KP1/(KP3)2 D(KP3)2/KP13. 下列电对中Φθ,最小的是A.Ag+/Ag;B.AgBr/Ag;C.Ag(NH3)2+/Ag;D.Ag(CN)2-/Ag4. 某反应速度常数K的量纲为dm3.mol-1.s-1,该反应是A.一级反应;B. 三级反应;C. 二级反应;D.1/2级反应5. 下列卤化物中,共价性最强的是A. LiI;B. BeI2C.LiClD.MgI26. 单键键能正确的大小顺序是A.O-----O>S-S>Se-SeB.O-O>S-S>Se-SeC. O-O>S-S>Se-SeD. O-O>S-S>Se-Se7 以Cr2O3为原料制备铬酸盐,应选的试剂是A.Cl2;B.H2O2;C.KOH和KClOD.浓HNO38. 下列盐中,属于正盐的是A.NaH2PO2B.NaH2PO3C.Na2HPO4D.NaH2PO49. 既能溶于Na2S溶液,又能溶于Na2S2溶液的硫化物是A.ZnSB.As2S3C.CuSD.HgS10. 下列含氧酸Ka1变化顺序不正确的是A. HBrO4>HClO3>HClOB. H3SO4>H2P2O7>H3AsO4C. H2SO4>H2SeO4>H6TeH6D. HClO3>HIO3>H5IO6二、填空题(共28分)(请按空格上的序号在答卷纸上写出相应的答案)1. 写出下列化合物水解的主要产物:NCl3: (1)__________________; PCl3:(2)_________________2.硼烷分子中所含的缺电子多中心键类型包括:(3)______________________ (4)_________________________ 和(5)_______________________3、在298K,反应CaCO3(s)=CaO(s)+CO32-(g)的ΔHθ=178.3KJ·mol-1 ΔSθ=160.4J·mol-1·k-1,则正反应可自发进行的温度是(6)______________________.4、CH4,NH3,NO2,H2O分子中,键角由大到小的顺序是(7)____________________原子轨道dx2-y2的角度分布图是(8)_____________________该图的物理意义是表示(9)______________________;(10)、--_________________; (11)___________________;5、MO法中,原子轨道有效组合成分子轨道必须满足的原则是:(12)________________;(13)__________________;和(14)__________________;“谰系收缩”是指(15)_____________________________________________________;8、实验测定,H2(g)+I2(g)=2HI(g)的反应机理是:(1)I2(g)=I(g)+I(g) (平衡常数K) (快步骤)(2)H2(g)+I(g)+I(g)-->2HI(g) (慢步骤)则该反应的速率方程式是(16)________________________;反应级数是(17)___________________________化学反应2Ag(s)+2H++2I-=2AgI(g)+H2(g)设计为原电池,其表达式是(18)__________ H2[PtCl6]名称(19)_____________________________;10、六硝基合钴(III)酸钠二钾的化学式是(20)_______________11、配合物[Fe(CN)6]4-、[Os(CN)6]4-、[FeF6]4-和[Ru(CN)6]4-的晶体场稳定花能由大到小的顺序是(21)_____________________12、O3(g)分子含有的化学键包括(22)__________________; 它是一种(23)_________磁性物质。
最新中大化学考研资料精选2000物化

中山大学二OOO年攻读硕士学位研究生入学考试试题考试科目: 物理化学专业: 高分子化学与物理研究方向: 本专业的各研究方向专业: 高分子化学与物理I一. (共30分) 填空与问答题(1):1.在绝热钢弹中, 发生一个放热的分子数增加的化学反应, 则( )。
(2分)(a) Q > 0, W > 0, ∆U > 0 (b) Q = 0, W = 0, ∆U > 0(c) Q = 0, W = 0, ∆U = 0 (d) Q < 0, W > 0, ∆U < 02. 1 mol单原子理想气体始态为273K, 一个标准大气压, 经下列过程: (a) 恒容升温1K;(b) 恒温压缩至体积的一半; (c) 恒压升温10 K; (d) 绝热可逆压缩至体积的一半。
上述四过程中, 终态压力最大的是过程______, 终态压力最小的是过程______, 终态温度最高的是过程______, 终态温度最低的是过程______。
(2分)3.实际气体经节流膨胀后,下述哪一组结论是正确的Æ ( ) (2分)(a) Q < 0, ∆H = 0, ∆p < 0 (b) Q = 0, ∆H = 0, ∆T < 0(c) Q = 0, ∆H < 0, ∆p < 0 (d) Q = 0, ∆H = 0, ∆p < 04.理想气体从状态I经自由膨胀到达状态II, 可用哪个热力学判据来判断该过程的自发性( )。
(2分)(a)∆F (b) ∆G (c)∆S (d)∆U5. 分子配分函数的定义为( ), 其适用条件为( )。
(2分)6.热力学函数与分子配分函数的关系式对于定域子体系和离定域子体系都相同的是( )。
(2分)(a) G, F, S (b) U, H, S (c) U, H, C v (d) H, G, C v7.有四种含不同溶质相同浓度m = 1 mol⋅ kg-1的水溶液, 分别测定其沸点, 沸点升得最高的是( )。
物理化学考试卷(正式题)-2013-04-26-推荐下载

5
B、压力是体系微观粒子一种运动行为的统计平均值
A、液相摩尔体积与气相摩尔体积相等 B、液相与气相之间的界面消失
C、蒸发焓为零
D、气、液、固三相平衡共存
答案
13
考试时间: 2013 年 4 月 26 日
B、状态方程式即体系状态函数之间的关系式
D、体系的状态即是流动体系稳定态
对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料电试力卷保相护互装作置用调与试相技互术关,系电通,力1根保过据护管生高线产中0不工资仅艺料可高试以中卷解资配决料置吊试技顶卷术层要是配求指置,机不对组规电在范气进高设行中备继资进电料行保试空护卷载高问与中题带资2负料2,荷试而下卷且高总可中体保资配障料置2试时32卷,3各调需类控要管试在路验最习;大题对限到设度位备内。进来在行确管调保路整机敷使组设其高过在中程正资1常料中工试,况卷要下安加与全强过,看度并25工且52作尽22下可护都能1关可地于以缩管正小路常故高工障中作高资;中料对资试于料卷继试连电卷接保破管护坏口进范处行围理整,高核或中对者资定对料值某试,些卷审异弯核常扁与高度校中固对资定图料盒纸试位,卷置编工.写况保复进护杂行层设自防备动腐与处跨装理接置,地高尤线中其弯资要曲料避半试免径卷错标调误高试高等方中,案资要,料求编试技5写、卷术重电保交要气护底设设装。备备置管4高调、动线中试电作敷资高气,设料中课并技3试资件且、术卷料中拒管试试调绝路包验卷试动敷含方技作设线案术,技槽以来术、及避管系免架统不等启必多动要项方高方案中式;资,对料为整试解套卷决启突高动然中过停语程机文中。电高因气中此课资,件料电中试力管卷高壁电中薄气资、设料接备试口进卷不行保严调护等试装问工置题作调,并试合且技理进术利行,用过要管关求线运电敷行力设高保技中护术资装。料置线试做缆卷到敷技准设术确原指灵则导活:。。在对对分于于线调差盒试动处过保,程护当中装不高置同中高电资中压料资回试料路卷试交技卷叉术调时问试,题技应,术采作是用为指金调发属试电隔人机板员一进,变行需压隔要器开在组处事在理前发;掌生同握内一图部线纸故槽资障内料时,、,强设需电备要回制进路造行须厂外同家部时出电切具源断高高习中中题资资电料料源试试,卷卷线试切缆验除敷报从设告而完与采毕相用,关高要技中进术资行资料检料试查,卷和并主检且要测了保处解护理现装。场置设。备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。
中山大学化学(B)真题

中山大学化学(B)真题第一部分:分析化学(含仪器分析)(共75分)一、选择题(共20分,每题l分)1、下面有关准确度与精密度的关系表述正确的是( )。
(A)精密度高则准确度高(B)准确度高则要求精密度一定要高(C)准确度与精密度没关系(D)准确度高不要求精密度要高2、欲配制pH=4^-5的缓冲溶液,应选择的缓冲对是( )。
(A) NH3(K b=1、8*10-5)和NH4C1 (B) KHCO3(Ka2=5、6*10-11)和K2CO3(C) Na2HPO4和KH2PO4(Ka=6、3 * 10-8) (D) HAc(Ka=1、8 * 10-5)和NaAc3、用0、02 mol/L KMnO4溶液滴定0、1 mol/L Fe2+溶液(1)和用0、002 mol/L KMnO4溶液滴定0、01 mol/L Fe2+溶液(2),上述两种情况下其滴定突跃将是( )。
(A)一样大(B) (1)>(2) (C) (2)>(1) (D)缺电位值,无法判断4、某溶液含Ca2+, Mg2+及少量A13+, Fe 3+,今加入三乙醇胺,调至pH=10、0,以铬黑T为指示剂,用EDTA滴定,此时测定的是( )。
(A)Mg2+量(C)Ca2+、Mg2+总量(B)Ca2+量(D)Mg 2+, A13+和Fe3+总量5、下列溶液用酸碱滴定法能准确滴定的是( )。
(A) 0、1 mol/L HF (pKa=3、18)(C) 0、1 mol/L NaAc [pKa(HAc)=4、74](B)0、1 mol/L HCN (pKa=9、21)(D)0、1 mol/L NH4C1 [pKn困H3)=4、75]6、关于以K2Cr04为指示剂的莫尔法,下列说法正确的是( )。
(A)本法可测定Cl- 和Br—,但不能测定I一或SCN—(B)滴定应在弱酸性介质中进行(C)指示剂K2Cr04的量越少越好(D)莫尔法的选择性较强7、对于相似元素Li+, Na+, K+的分离常用( )。
化学资源

一、网址类,主要包括一些虫友推荐的学化学常用的网址,也包括一些学校的网络课程资源:最全的化学网站厦门大学理科化学系列网络课程建立一个类似hao123的化学网址之家,建设完善中.....分享科研动态与无机化学资源网博士最应该去的10大优秀网站物质性质查询网站汇总图谱数据库一个可以查化学实验常用数据的网站(学化学的错过了可惜)很不错的化学门户网站比较全的化学化工资源北京化工大学物理化学网上精品课推荐可以搜索下载原版外文书的几个网站推荐一个网页:很多期刊的链接一个不错的综述网站二、书刊类,中英文的,包括教材和辅导书,工具书等:1、物理化学:傅献彩《物理化学》(第五版)电子书+课件《物理化学》—傅献彩全上下册《物理化学》天大第二版+第四版分享胡英版《物理化学》《物理化学词典》分享《表面活性剂物理化学》《表面物理化学》W.Adamson和Alice P. Gast合著的中文翻译版《吸附、比表面积与孔隙率》中英文的共同分享《界面及胶体化学》一共六本《表面活性剂作用原理》《计算物理化学》天津大学《物理化学》第四版习题解答【经典物化教材配套解答】《物理化学教学与学习指南》—胡英院士《物理化学》(第四版)配套习题解答《物理化学重点热点导引与解题训练》(傅玉普编写)《物理化学学习指导》沈文霞等编《物理化学解题思路和方法》《物理化学解题指导》—黄绿书《Algebraic Theory of Molecules (Topics in Physical Chemistry Series)》《Instant Notes in Physical Chemistry》《Physical Chemistry-8th By Peter Atkins》djvu格式Springer新书《Physical Chemistry in Depth》《Physicochemical calculations》2、无机化学《21世纪的无机化学》《高等无机化学》《高等无机化学》[美]F.A.科顿著《高等无机化学》中国科学技术大学—郑化桂《高等无机化学》华东理工的《高等无机化学》[英]R.B.赫斯洛普K.琼斯著《无机化学》武汉大学、吉林大学第三版下载经典版本《无机化学》【北师大等校合编第四版】上下册全电子版《无机化学》经典习题答案两套【北师、华师、南师&武大、吉大】《无机化学习题》中科大张祖德【附答案】《无机化学》英文原版书籍免费下载《Advanced Inorganic Chemistry》Third Edition《Advances in Inorganic Chemistry》Volume 61Inorganic Chemistry 1962-2008《Inorganic synthesis》(无机合成经典书籍)《N4-Macrocyclic Metal Complexes》Springer book 《Nomenclature of Inorganic Chemistry: Recommendations》3、手册词典:《常用化学反应速查手册》《化学化工实验师手册》珍藏版下载《兰氏化学手册》(电子版,可检索)《物理化学词典》分享《无机化合物合成手册》全三卷(新增链接)《现代化学试剂手册》全六册《现代化学手册》书籍分享《蓄电池手册》《中国大百科全书-化学》《Encyclopedia of Chemical Physics and Physical Chemistry》pdf 《Handbook of Inorganic Electrochromic Materials》《Handbook of Surface and Colloid Chemistry》3rd EdCRC《Handbook of Chemistry and Physics》89th EditionCRC《Handbook of Chemistry and Physics 》(2007)4、合辑类:史上最全化学类资源和丛书化学资源大放送,如果您认为对你有用,那就给点支持,资源有点长83本经典英文化学书籍免费下载光化学、电致、光致发光书籍及ChemicalReview专刊中英文经典《Advanced Organic Chemistry》书籍大全—8本书籍共享【亲自整理30多本】5、其它中文书籍:《第十三届亚洲化学大会论文摘要集》《最为详尽的实验室无水无氧操作》《现代仪器分析方法》华东理工大学《化学热力学基础》《化学动力学基础》《基础元素化学》PDF下载格林伍德经典《元素化学》,英文版+中文版,识货的进!《量子化学》陈光巨,黄元河主编高清晰版《量子化学》中文译本[美]IRAN.LEVINE《量子化学—基本原理和从头计算法题解》两本电子书共享《普通化学原理(第二版)》《生物化学技术原理及其应用》第三版《海洋涂料与涂装技术》武汉科大《有机化学基础实验》pdf《计算机在化学中的应用》《群论基础及其化学作用》《分子对称性群》《化学哲学》National geographic《爱情是化学作用》(英文版)分享最新一期《科学美国人》好东西不容错过自然-化学(Natural Chemistry)电子杂志(每月更新,配图)6、其它英文书籍:《Adaptronics and Smart Structures》《Adaption of Simulated Annealing to Chemical Optimization Problems》《Advanced Chemistry of Monolayers at Interfaces》Volume 14《Anion Receptor Chemistry》《Bioinorganic Vanadium Chemistry》《Boronic Acids》—Google口碑不错,科研助手:硼酸《Careers in Science and Engineering A Student Planning》做科研不读后悔的书《Characterization and Chemical Modification of the Silica Surface》《Chemically Reacting Flow: Theory and Practice》《Chemistry and Chemical Reactivity》6th Ed《Chemistry of Heterocyclic Compounds》Volumes1-42Chemistry: The Impure Science《Container Molecules (Monographs in Supramolecular Chemistry)》《Controlled Assembly and Modification of Inorganic Systems》吴新涛院士《Cyanide in Water and Soil: Chemistry, Risk, and Management》《Data Analysis for Chemistry》《Electrochemical Sensor Analysi》Volume 49全书下载《Encyclopedia of the Elements》《Formulation Technology: Emulsions, Suspensions, Solid Forms》《Future of Glycerol: New Usages for a Versatile Raw Material》(RSC新书) 《High Pressure Chemistry: Synthetic, Mechanistic, and Supercritical Applications》《High Pressure Effects in Biophysics and Enzymology》《High Pressure Geochemistry & Mineral Physics》Volume 9《Hydrogen Energy: Challenges and Prospects》(RSC Energy Series) 《Inorganic Synthesis》《Nitrides with Nonpolar Surfaces: Growth, Properties, and Devices》《Particles in water: properties and processes》《Polyoxometalate Chemistry: From Topology via Self-Assembly to Applications》《Practical Skills in Chemistry》《Photoacoustic Infrared Spectroscopy》《Reactive Hydrocarbons in the Atmosphere》《The Mathematics of Diffusion》《The Public Image Of Chemistry》《Why Carbon Fuels Will Dominate the 21st Century Energy Economy》《Write Like a Chemist: A Guide and Resource》三、课件类:中科大物理化学课件天津大学物理化学第五版课件PPT物理化学之电解质理论印永嘉第四版的简明物理化学教程PPT物理化学课件PDF版本-华东理工国家精品课程大学物理化学全套课件《表面活性剂应用大全》分享《界面化学课件》北京大学无机化学课件PPT无机合成与制备化学PPT《高等无机化学》吉林大学无机研究生课件朱文祥《配位化学》—2009年春季学期在中科院任教时用的课件《配位化学》课件《配位化学》课件—哈尔滨工程大学《配位化学》讲义—超分子的基础之一南京大学《配位化学》课件有机化合物的命名超级经典课件《表面现象与分散系统》课件结构化学课件五大化学课件(整理版)化学信息学经典课件美国顶级化学家Laisheng Wang 课件四、考试资源类:武汉大学物理化学历年真题(2000-2007)09年中科院物理化学(甲)清晰版中科院2008年物理化学试题(甲)物理化学经典题目物理化学考研课件pdf格式厦门大学2005年物理化学课考研重点笔记扬州大学物理化学考研吉林大学物化习题集物理化学考研复习指南(pdf版)下载物化急感,助你学物化物理化学思考题答案——傅献彩物理化学习题及答案北航物理化学本科生基础考试题南开大学2000年分析化学考研试题综合化学—中山大学2006年硕士研究生入学考试试题1995复旦大学有机试题及答案无机化学精品教案和习题全国第五届化学实验竞赛笔试试题及答案五、视频资源类,包括仪器操作和教学视频等:物理化学实验常用仪器操作教学视频无机几个基本实验视频操作石油大学的物理化学视频教程化学实验基本仪器操作视频清华大学朱文涛教授物理化学视频下载大学化学化工基本实验操作视频指南(非常齐全)麻省理工学院MIT【化学热力学&动力学】全套视频课程迅雷下载六、其它资源,主要是一些包含上面两种以上的资源,致使不好分类的:我的namipan空间有大量珍贵资源,欢迎大家取用科技英语写作(南开大学化学院)最权威的Plackett-Burman实验问答实验室的化学安全与注意事项+实验室常用溶液配制化学实验室仪器操作规程无机化学网上课程收集(几十个学校,课件和视频免费看和下载)中科院的一个FTP电负性元素周期表元素周期表的小软件真空手套箱资料实验室最危险的17种物质实验室安全知识和健康保护实验室安全知识和健康保护课件实验室致癌物质和诱发畸变物质实验安全血的教训四氟乙烯的毒性和致癌性2009化综类中文期刊目录化学词汇中英对照=非常全纯物质化学性质查询软件、粒径分布计算oringin说明书Mestrec4999使用教程湖北大学版化学专业英语命名攻略各种玻璃及常用仪器图(包括一些分子结构图)共379幅(无重复。
中山大学研究生入学考试物理化学试题及答案完整版

中山大学研究生入学考试物理化学试题及答案Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】中山大学一九九九年攻读硕士学位研究生入学考试试题及答案考试科目: 物理化学(含结构化学)专业:无机、分析、有机、物理化学和环境化学研究方向: 上述专业的各研究方向I一. (共30分) 填空与问答题(1):(请按顺序把相应的答案写在答卷纸内, 注明题号, 不用抄题。
)1. 下列四个偏微商中哪个不是化学势(2分)(A) ( U/ n B)S, p, nc (B) ( H/ n B)S, p, nc(C) ( F/ n B)T, p, nc (A) ( G/ n B)T, p, nc2. 用熵判据来判别变化的方向和平衡条件时, 体系必须是( ), 除了考虑( ) 的熵变外, 还要考虑( )的熵变。
(2分)3. 热力学函数与分子配分函数的关系式对于定域子体系和离定域子体系都相同的是()。
(2分)(A) G, F, S (B) U, H, S (C) U, H, C v (D) H, G, C v4. 玻尔兹曼分布定律表达式为( ), 其适用条件为()。
(2分)5. 分子配分函数的定义为( ), 其适用条件为()。
(2分)6. CaCO3(s), CaO(s), BaCO3(s), BaO(s) 及CO2(g) 构成的一个平衡物系, 其组分数为( )。
(2分)(A) 2 (B) 3 (C) 4 (D) 57. 某地区的大气压为 104Pa, 如将下表中的四种固态物质在该地区加热, 问那种物质将发生升华。
(2分)8. 理想气体反应平衡常数K x与K c的关系是( )。
(2分)(A) K x = K c (RT) B (B) K x = K c P B(C) K x = K c (RT/P)- B (D) K x = K c (V/ n B) B9. 在光的作用下, O2可转变为O3, 当 1mol O3生成时, 吸收了 1023个光子, 则反应之总量子效率为( )。
中山大学“现代化学实验与技术”物理化学实验习题答案

-6.4535
2032.2
Y=-6.4535+2032.2X
100%
-5.6243
1701.0
Y=-5.6243+1701.0X
a-w图
综上所述,得出
9.The concentration of hemoglobin in blood samples is determined by HB-photomerers, which are UV-visspectrometers. 0.020 ± 0.001 mLwhole blood is diluted in 5.000 ± 0.005 mLof a reagent that breaks the red blood cells and reacts with the free hemoglobin to formcyanmethemoglobin. The concentration of this compound is measured by the absorption of a sample at 540 nm.
151.792 2.618 3.26 3.53 3.44 3.14 2.770 2.309 1.802 1.332
201.538 2.183 2.71 2.91 2.87 2.67 2.370 2.008 1.610 1.200
251.323 1.860 2.18 2.35 2.40 2.24 2.037 1.748 1.424 1.096
图7 质量分数为30%时的ln -1/T关系图 图8质量分数为40%时的ln -1/T关系图
图9 质量分数为50%时的ln -1/T关系图 图10质量分数为60%时的ln -1/T关系图
图11 质量分数为700%时的ln -1/T关系图 图12 质量分数为80%时的ln -1/T关系图
物理化学模拟试题及答案(3)

第七章电化学选择题1.离子独立运动定律适用于(A) 强电解质溶液 (B) 弱电解质溶液(C) 无限稀电解质溶液 (D) 理想稀溶液答案C2. 电解质水溶液属离子导体。
其离子来源于(A) 电流通过溶液, 引起电解质电离(B) 偶极水分子的作用, 引起电解质离解(C) 溶液中粒子的热运动, 引起电解质分子的分裂(D) 电解质分子之间的静电作用引起分子电离答案:B3. 在电导测量实验中, 应该采用的电源是(A) 直流电源(B) 交流电源(C) 直流电源或交流电源(D) 测固体电导用直流电源, 测溶液电导用交流电源答案:D4. 德拜-休克尔为了推导出"极限定律",作了一些基本假定。
下列假定不在他们的假定之列的是(A) 溶液中导电的是离子而不是分子(B) 任何浓度的强电解质都是完全电离的(C) 离子之间以静电力相互作用, 其间的吸引能大于它们的热运动能(D) 在稀溶液中离子是刚性的圆球形点电荷, 不极化答案:A5. 电解质水溶液的离子平均活度系数受多种因素的影响, 当温度一定时, 其主要的影响因素是(A) 离子的本性 (B) 电解质的强弱(C) 共存的它种离子的性质 (D) 离子浓度及离子电荷数答案:D6. 采用电导法测定HAc的电离平衡常数时, 应用了惠斯登电桥。
作为电桥平衡点的示零仪器,不能选用(A)通用示波器 (B)耳机 (C)交流毫伏表 (D)直流检流计答案:D7. 电位滴定法是广泛使用的一种电分析方法。
在下列方法中能够用来确定电位滴定终点的是(A) 测量溶液电阻的变化 (B) 测量电极电位的突跃变化(C) 选用合适的指示电极 (D) 测定溶液pH值的突跃变化答案:B8. 离子的迁移数是指正负两种离子在作电迁移运动时各自的导电份额或导电的百分数, 因此, 离子的运动速度直接影响离子的迁移数。
它们的关系是(A) 无论什么离子,它们的运动速度愈大,• 迁移的电量就愈多,迁移数也愈大(B) 同一种离子的运动速度是一定的, 故它在不同的电解质溶液中, 迁移数相同(C) 在只含某种电解质的溶液中, 离子运动的速度愈大, 迁移数就愈大(D) 在任何电解质溶液中, 离子运动的速度愈大, 迁移数就愈大答案:C9. 采用对消法(或称补偿法)测定电池电动势时, 需要选用一个标准电池。
物理化学考试卷(正式题)-2013-04-26

中山大学考试试卷考试科目:物理化学考试时间:2013年4月26 日年级:2008级专业:学生姓名:学号:本卷考试时间2小时。
考试形式:闭卷。
一、选择题(本题包括30小题,每小题1分,共30分。
每小题只有一个....选项符合题意。
请您将答案填入以下表格中。
)1、爆炸反应体系属于()。
A、开放体系B、封闭体系C、孤立体系D、绝热体系2、由理想气体分子运动论得出的结果,每一气体分子的平均平动能是()。
A、kT/2B、kTC、3kT/2D、RT/23、下述说法中,哪一种是错误的?A、压力是宏观量B、压力是体系微观粒子一种运动行为的统计平均值C、压力是体系微观粒子碰撞器壁时动量改变量的量度D、压力是体系微观粒子相互碰撞时动能改变量的量度4、下述说法中,哪一种是错误的?A、体系的状态即是平衡态B、状态方程式即体系状态函数之间的关系式C、体系的状态与状态图上实点一一对应D、体系的状态即是流动体系稳定态5、下列对某种物质临界点性质的描述,哪一种是错误的?A、液相摩尔体积与气相摩尔体积相等B、液相与气相之间的界面消失C 、蒸发焓为零D 、气、液、固三相平衡共存 6、封闭体系的恒容热容C V 应等于( )。
A 、U T V T V V U C ⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫⎝⎛∂∂-= B 、UT V T V V U C ⎪⎭⎫⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂= C 、U V V T V U T C ⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫⎝⎛∂∂= D 、UV V V T U T C ⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂-= 7、使公式∆H =Q p 成立的条件是( )。
A 、开放体系,只做体积功,p 体=p 外=常数B 、封闭体系,可做任何功,p 体=p 外=常数C 、封闭体系,只做有用功,p 体=p 外=常数D 、封闭体系,只做体积功,p 体=p 外=常数E 、封闭体系,只做体积功,p 始= p 终=p 外=常数 8、下述说法中,哪一个正确?A 、水的生成热即是氢气的燃烧热B 、水蒸气的生成热即是氢气的燃烧热C 、水的生成热即是氧气的燃烧热D 、水蒸气的生成热即是氧气的燃烧热 9、某绝热体系在接受了环境所做的功之后,其温度( )。
中山大学2000(B)《物理化学》考研试题及答案

中山大学2000(B)《物理化学》考研试题及答案中山大学二ooo年攻读硕士学位研究生入学考试试题考试科目:物理化学;专业:高分子化学与物理;研究方向:本专业的各研究方向i一.(共30分)填空与问答题(1):1.在边界层钢弹中,出现一个吸热的分子数减少的化学反应,则()。
(2分后)(a)q>0,w>0,?u>0(b)q=0,w=0,?u>0(c)q=0,w=0,?u=0(d)q<0,w>0,?u<02.1mol单原子理想气体始态为273k,一个标准大气压,经下列过程:(a)恒容升温1k;(b)恒温压缩至体积的一半;(c)恒压升温10k;(d)绝热可逆压缩至体积的一半。
上述四过程中,终态压力最大的是过程______,终态压力最小的是过程______,终态温度最高的是过程______,终态温度最低的是过程______。
(2分)3.实际气体经节流收缩后,下列哪一组结论就是恰当的?()(2分后)(a)q<0,?h=0,?p<0(b)q=0,?h=0,?t<0(c)q=0,?h<0,?p<0(d)q=0,?h=0,?p<04.理想气体从状态i经自由膨胀到达状态ii,可用哪个热力学判据来判断该过程的自发性()。
(2分)(a)?f(b)?g(c)?s(d)?u5.分子配分函数的定义为(),其适用于条件为()。
(2分后)6.热力学函数与分子配分函数的关系式对于定域子体系和离定域子体系都相同的是()。
(2分)(a)g,f,s(b)u,h,s(c)u,h,cv(d)h,g,cv7.存有四种不含相同溶质相同浓度m=1mol?kg?1的水溶液,分别测量其沸点,沸点升得最低的就是()。
(2分后)(a)al2(so4)3(b)mgso4(c)k2so4(d)c6h5so3h8.ca(co3)2(s)、baco3(s)、bao(s)和co2(g)构成的多相平衡体系的组分数为______,相数为______,自由度数为______。
中山大学研究生入学考试物理化学试题及答案

中⼭⼤学研究⽣⼊学考试物理化学试题及答案中⼭⼤学研究⽣⼊学考试物理化学试题及答案Prepared on 21 November 2021中⼭⼤学⼀九九九年攻读硕⼠学位研究⽣⼊学考试试题及答案考试科⽬: 物理化学(含结构化学)专业:⽆机、分析、有机、物理化学和环境化学研究⽅向: 上述专业的各研究⽅向I⼀. (共30分) 填空与问答题(1):(请按顺序把相应的答案写在答卷纸内, 注明题号, 不⽤抄题。
)1. 下列四个偏微商中哪个不是化学势(2分)(A) ( U/ n B)S, p, nc (B) ( H/ n B)S, p, nc(C) ( F/ n B)T, p, nc (A) ( G/ n B)T, p, nc2. ⽤熵判据来判别变化的⽅向和平衡条件时, 体系必须是( ), 除了考虑( ) 的熵变外, 还要考虑( )的熵变。
(2分)3. 热⼒学函数与分⼦配分函数的关系式对于定域⼦体系和离定域⼦体系都相同的是()。
(2分)(A) G, F, S (B) U, H, S (C) U, H, C v (D) H, G, C v4. 玻尔兹曼分布定律表达式为( ), 其适⽤条件为()。
(2分)5. 分⼦配分函数的定义为( ), 其适⽤条件为()。
(2分)6. CaCO3(s), CaO(s), BaCO3(s), BaO(s) 及CO2(g) 构成的⼀个平衡物系, 其组分数为( )。
(2分)(A) 2 (B) 3 (C) 4 (D) 57. 某地区的⼤⽓压为 104Pa, 如将下表中的四种固态物质在该地区加热, 问那种物质将发⽣升华。
(2分)8. 理想⽓体反应平衡常数K x与K c的关系是( )。
(2分)(A) K x = K c (RT) B (B) K x = K c P B(C) K x = K c (RT/P)- B (D) K x = K c (V/ n B) B9. 在光的作⽤下, O2可转变为O3, 当 1mol O3⽣成时, 吸收了 1023个光⼦, 则反应之总量⼦效率为( )。
中山大学00物理化学(含结构化学)a

中山大学二OOO年攻读硕士学位研究生入学考试试题考试科目:物理化学(含结构化学)I一. (共30分) 填空与问答题(1):1. 在绝热钢弹中, 发生一个放热的分子数增加的化学反应, 则( )。
(2分)(a) Q > 0, W > 0, ∆U > 0 (b) Q = 0, W = 0, ∆U > 0(c) Q = 0, W = 0, ∆U = 0 (d) Q < 0, W > 0, ∆U < 02. 1 mol单原子理想气体始态为273K, 一个标准大气压, 经下列过程: (a) 恒容升温1K; (b) 恒温压缩至体积的一半; (c) 恒压升温10 K; (d) 绝热可逆压缩至体积的一半。
上述四过程中, 终态压力最大的是过程______, 终态压力最小的是过程______, 终态温度最高的是过程______,终态温度最低的是过程______。
(2分)3. 实际气体经节流膨胀后,下述哪一组结论是正确的? ( ) (2分)(a) Q < 0, ∆H = 0, ∆p < 0 (b) Q = 0, ∆H = 0, ∆T < 0(c) Q = 0, ∆H < 0, ∆p < 0 (d) Q = 0, ∆H = 0, ∆p < 04. 理想气体从状态I经自由膨胀到达状态II, 可用哪个热力学判据来判断该过程的自发性( )。
(2分)(a)∆F (b) ∆G (c)∆S (d)∆U5. 分子配分函数的定义为( ), 其适用条件为( )。
(2分)6. 热力学函数与分子配分函数的关系式对于定域子体系和离定域子体系都相同的是( )。
(2分)(a) G, F, S (b) U, H, S (c) U, H, C v (d) H, G, C v7. 有四种含不同溶质相同浓度m = 1 mol⋅ kg-1的水溶液, 分别测定其沸点, 沸点升得最高的是( )。
2000物化答案
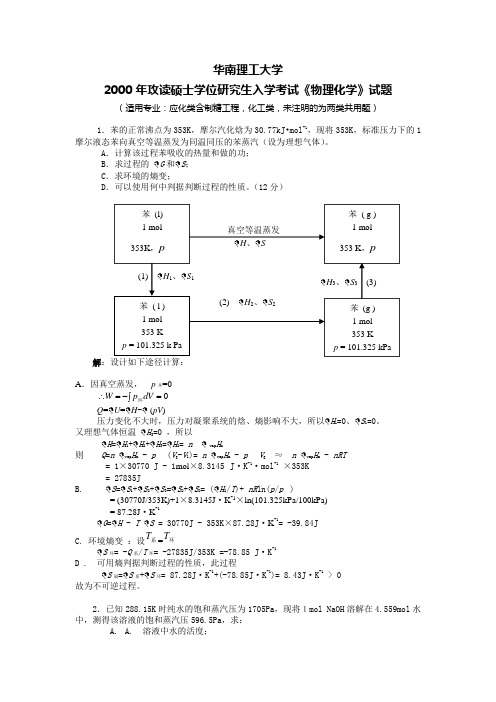
华南理工大学2000年攻读硕士学位研究生入学考试《物理化学》试题(适用专业:应化类含制糖工程,化工类,未注明的为两类共用题)1.苯的正常沸点为353K ,摩尔汽化焓为30.77kJ •mol -1,现将353K ,标准压力下的1摩尔液态苯向真空等温蒸发为同温同压的苯蒸汽(设为理想气体)。
A .计算该过程苯吸收的热量和做的功;B .求过程的 G 和 S ;C .求环境的熵变;D .可以使用何中判据判断过程的性质。
(12分)解A .因真空蒸发, p 环=0⎰=-=∴0dV p W 环 Q = U = H - (pV )压力变化不大时,压力对凝聚系统的焓、熵影响不大,所以 H 1=0、 S 1=0。
又理想气体恒温 H 3=0 ,所以H = H 1+ H 2+ H 3= H 2= n vap H m则 Q =n vap H m - p (V g -V l )= n vap H m - p V g ≈ n vap H m - nRT= 1×30770 J - 1mol ×8.3145 J ·K -1·mol -1×353K = 27835JB. S = S 1+ S 2+ S 3= S 2+ S 2= ( H 2/T )+ nR ln(p /p )= (30770J/353K)+1×8.3145J ·K -1×ln(101.325kPa/100kPa)= 87.28J ·K -1G = H - T S = 30770J - 353K ×87.28J ·K -1= -39.84J C. 环境熵变 :设系T =环TS 环= -Q 系/T 环= -27835J/353K =-78.85 J ·K -1D . 可用熵判据判断过程的性质,此过程S 隔= S 系+ S 环= 87.28J ·K -1+(-78.85J ·K -1)= 8.43J ·K -1> 0 故为不可逆过程。
中山大学1998年研究生入学考试《物理化学(高分子)》试题及答案

3.试设计一个电池,使其中进行下述反应 2+ 3+ Fe (aFe2+) + Ag+(aAg+) = Ag(s) + Fe (aFe3+) (1)写出电池的表示式; Ø (2)计算上述电池反应在 298K,反应进度 ξ 为 1mol 时的平衡常数 Ka ; -1 (3)若将过量磨细的银粉加到浓度为 0.05mol.kg 的 Fe(N03)3 入溶液 中,当反应达到平衡后,Ag+离子的浓度为多少?(设活度系数均为. 已知:ΨAg+,Ag = 0.7991V , ΨFe3+,Fe2+ = 0.771V
2.N2 的转动常数 B=h/8π I=5.96×10 S ,计算下列 温度时,J=1 和 J=0 转动能级上的分子数之比 (1) 200K; (2)T→∞; (3) T→0 -34 已知: 普朗克常数 h=6.626×10 J.S -23 -1 玻兹曼常数 k=1.381×10 J.K 。
2
Hale Waihona Puke 10 -1)若μB =μ B(T) +RTln(P*BXB/P ) = μ*B(T,P) + RTlnXB □ Ø 或 μB=μ B(T,P) + RTln(m/m ),式中 P*B 为纯 B 的蒸汽压。在 上图所表示的 a, b, c, d, e, f, g, h, 诸多状态中,μ*B(T,P)所 □ 对应的状态是( ),μ B(T,P) 所对应的状态是( 6. KNO3, KCl, H2O (1)体系的独立组分数为( );KNO3, NaCl, H2O(1)体系的独立组分数为( )。 7.三乙胺-水二元系的步冷曲线如下 图所示,图中 x 是三乙胺的物质 的量分数(摩尔分数。 该体系所形成化合物的分子 式是( )。
中山大学物化试题和答案

考试科目:物理化学(不含结构化学)专业:无机、分析、有机、物理化学和环境化学研究方向:上述专业的各研究方向;专业: 无机、分析、有机、物理化学和环境化学已知经下列数据:波兹曼常数k=1.381 10-23 J·K-1, 法拉第常数F=96485 C, 标准压力 p0=101325 PaI一、选择、填空与问答题(一)(共34分)1.某体系由状态I变到状态II,经历两条不同的途径,其热、功、内能变化、焓变化分别为Q1、W1、ΔU1、ΔH1和Q2、W2、ΔU2、ΔH2. 试指出下列表达式中,___________是正确的,因为_______________________________;____________是不正确的,因为________________________.A.Q1= Q2,W1=W2; (B) ΔU1=ΔU2,ΔH1=ΔH2;C.Q1+W1= Q2+W2; (D)ΔU1+ΔH2 =ΔU2+ΔH1. (2分)2.下列关系式中,请指出哪几个是正确的,哪几个是不正确的? (1.5分)A.Δc H 0m(石墨,s)=Δf H 0m(CO2,g)B.Δc H 0m(H2,g)= Δf H 0m(H2O,g)C.Δc H 0m(N2,g)=Δf H 0m(2NO2,g)D.Δc H 0m(SO2,g)=0E.Δf H 0m(C2H5OH,g)= Δf H 0m(C2H5OH,l)+ Δvap H 0m(C2H5OH)3.水的正常冰点为0℃,今有下列过程:对于上述过程,有:ΔU___Q p, ΔH___ Q p, ΔS____ΔH/T, ΔF___0, ΔG___0, ΔS___0.请填 >、=、<. (3分)4. CHCl3溶于水、水溶于CHCl3中的部分互溶溶液与其蒸气达到平衡. 该体系的组分数为____,相数为____,自由度数为____. (1.5分)5.粒子的配分函数q是(A) 一个粒子的; (B) 对一个粒子的玻尔兹曼因子取和;C.粒子的简并度和玻尔兹曼因子取和;D.对一个粒子的所有可能状态的玻尔兹曼因子取和. (1.5分)6.某分子的两个能级是ε1=6.1×10-21J,ε2=8.4×10-21J,相应的简并度分别是g1=3,g2=5.由这些分子组成近独立粒子体系,在300 K时,这两个能级上的粒子数之比为_____.(2分)7.在温度T时,纯液体A的饱和蒸气压为p*A,化学势为μ*A,且已知纯A的正常凝固点为T*f. 当A中溶入少量与A不形成固态溶液的溶质时形成了稀溶液,上述三物理量分别为p A、μA、T f,则A.p*A< p A,μ*A<μA,T*f< T f;B.p*A> p A,μ*A<μA,T*f< T f;C.p*A< p A,μ*A<μA,T*f> T f;D.p*A> p A,μ*A>μA,T*f> T f. (2分)8.已知 FeO(s) + C(s) = CO(g) + Fe(s) 反应的Δr H 0m为正,Δr S 0m为正.假定Δr H 0m、Δr S 0m不随温度而变化,则下列说法中哪一种是正确的? (1.5分)A.低温下是自发过程,高温下是非自发过程;B.高温下是自发过程,低温下是非自发过程;C.任何温度下均为非自发过程;D.任何温度下均为自发过程.9.能量零点选择不同,则配分函数的值______;内能的值_____;熵的值_____;恒容热容的值_____. 请填相同或不同. (2分)10.对于同一电解质的水溶液,当其浓度逐渐增加时,以下何种性质将随之增加.(A) 在稀溶液范围内的电导率; (B) 摩尔电导率;C.电解质的离子平均活度系数; (D) 离子淌度. (1.5分)11.当一反应物的初始浓度为0.04 mol∙dm-3时,反应的半衰期为360 s,初始浓度为0.024 mol∙ dm-3时,半衰期为600 s,则此反应为 (2分)A.0级反应; (B) 1.5级反应; (C) 2级反应; (D) 1级反应.12.一个化学体系吸收了光子之后,将引起下列哪种过程?(A) 引起化学反应; (B) 产生荧光;(C) 发生无辐射跃迁; (D) 过程不能确定. (1分)13.液体在毛细管中上升的高度与下列哪一个因素无关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中山大学二OOO年攻读硕士学位研究生入学考试试题考试科目: 物理化学;专业: 高分子化学与物理;研究方向: 本专业的各研究方向I一. (共30分) 填空与问答题(1):1.在绝热钢弹中, 发生一个放热的分子数增加的化学反应, 则( )。
(2分)(a) Q > 0, W > 0, ∆U > 0 (b) Q = 0, W = 0, ∆U > 0(c) Q = 0, W = 0, ∆U = 0 (d) Q < 0, W > 0, ∆U < 02. 1 mol单原子理想气体始态为273K, 一个标准大气压, 经下列过程: (a) 恒容升温1K; (b) 恒温压缩至体积的一半; (c) 恒压升温10 K; (d) 绝热可逆压缩至体积的一半。
上述四过程中, 终态压力最大的是过程______, 终态压力最小的是过程______, 终态温度最高的是过程______, 终态温度最低的是过程______。
(2分)3.实际气体经节流膨胀后,下述哪一组结论是正确的Æ ( ) (2分)(a) Q < 0, ∆H = 0, ∆p < 0 (b) Q = 0, ∆H = 0, ∆T < 0(c) Q = 0, ∆H < 0, ∆p < 0 (d) Q = 0, ∆H = 0, ∆p < 04.理想气体从状态I经自由膨胀到达状态II, 可用哪个热力学判据来判断该过程的自发性( )。
(2分)(a)∆F (b) ∆G (c)∆S (d)∆U5. 分子配分函数的定义为( ), 其适用条件为( )。
(2分)6.热力学函数与分子配分函数的关系式对于定域子体系和离定域子体系都相同的是( )。
(2分)(a) G, F, S (b) U, H, S (c) U, H, C v (d) H, G, C v7.有四种含不同溶质相同浓度m = 1 mol⋅ kg-1的水溶液, 分别测定其沸点, 沸点升得最高的是( )。
(2分)(a) Al2(SO4)3(b) MgSO4(c) K2SO4 (d) C6H5SO3H8. Ca(CO3)2 (s)、BaCO3 (s)、BaO(s)和CO2 (g)构成的多相平衡体系的组分数为______, 相数为______, 自由度数为______。
(2分)9. PCl5(g)分解反应, 在473 K平衡时有48.5%分解, 在573K平衡时有97%分解, 此反应的∆r H∅________0。
(请填>, < 或=) (2分)m10.分解反应A(s) = B(g) + 2C(g), 反应平衡常数K∅p和离解压p离的关系式为_____ _____。
(2分)11. 298K时, 有浓度均为0.001 mol⋅ kg-1的电解质溶液, 其离子平均活度系数∅±最大的是( )。
(2分)(a) CuSO4 (b) CaCl2 (c) LaCl3 (d) NaCl12.半衰期为10天的某放射性元素净重8 g, 40天后其净重为( )。
(2分)(a) 4 g (b) 2 g (c) 1 g (d) 0.5 g13.已知的HI光分解反应机理如下, 则该反应的反应物消耗的量子产率为( )。
HI + hν∅ H + IH + HI ∅ H2 + II + I + M ∅ I2 + M(a) 1 (b) 2 (c) 10 (d) 106 (2分)14.水能完全润湿洁净玻璃, 而水银则不能。
现将一根玻璃毛细管插入水中, 管内液面将______, 若在管内液面处加热, 则液面将______; 当玻璃毛细管插入水银中时, 管内液面将______, 若在管内液面处加热, 则液面将______。
(请填上升、下降或不变) (2分)15.某溶胶在下列电解质作用下的聚沉值的相对值分别是NaNO3为300, Na2SO4为148, MgCl2为12.5, AlCl3为0.17, 则该溶胶带______电荷。
(2分)二. (共42分) 计算题(1):1. 1 mol水, 373 K, 标准大气压p∅下等温向真空容器蒸发, 使终态压力为0.52p∅ , 已知水在p∅下的汽化热为40.66 kJ⋅ mol-1, 求该过程的∆U、∆H、∆S、∆G和∆F 各为多少Æ (共10分)2.液体A和B形成理想溶液。
现有一含A的物质的量分数为0.4的蒸汽相, 放在一个带活塞的汽缸内, 恒温下将蒸汽缓慢压缩。
已知p*A和p*B分别为0.42p∅和1.22p∅ , 计算(a) 当溶液开始凝聚出来时的蒸汽总压(b) 该溶液在正常沸点T b时的组成(共6分)3. H2O- FeSO4-(NH4)2SO4的三组分体系相图如下, 请标出各区相态, x代表体系状态点。
现从x 点出发制取复盐E(FeSO4⋅7H2O), 请在相图上表示出采取的步骤,并作简要说明。
(共6分)H2O- FeSO4 -(NH4)2SO4三组分体系相图4. 298 K时, 反应N2O4 (g) = 2NO2 (g) 的平衡常数K∅p = 0.155 (共6分)(a) 求总压为一个标准大气压力p∅时N2O4的离解度(b) 求总压为0.52p∅时N2O4的离解度(c) 求总压为p∅, 离解前N2O4和N2 (惰性气体)物质的量为1:1时N2O4的离解度5.电池Ag + AgAc(s)∅ Cu(Ac)2 (0.1 mol⋅ kg-1) ∅ Cu(s)的E1 (298K) = - 0.372 V, E2 (308K) = - 0.374 V, 在温度区间内, E随T的变化是均匀的。
(a) 写出该电池的电极反应和电池反应(b) 计算该电池在298K时的∆r G m、∆r S m和∆r H m。
(共6分)6.在一恒容均相反应体系中, 某化合物分解50%所经过的时间与起始压力成反比, 试推断其反应级数。
在不同压力和温度下, 测得分解反应的半衰期为:(a) 计算两种温度时的k值, 用(mol⋅ dm-3)-1⋅s-1表示。
(b) 求反应的活化能。
(c) 求967K时阿累尼乌斯公式中的指前因子。
(共6分)7.以As2O3和H2S为原料制备As2S3溶胶时, 若H2S过量, 则制得的As2S3溶胶胶团结构为( ) 。
(2分)II三. (共10分) 填空题(2)1.在定温定压下, 溶剂A和溶质B形成一定浓度的稀溶液, 采用不同浓度的话, 则( )。
(2分)(a) 溶液中A和B的活度不变(b) 溶液中A和B的标准化学势不变(c) 溶液中A和B的活度系数不变(d) 溶液中A和B的化学势值不变2.A和B形成完全互溶的二组分溶液在x B = 0.6 处平衡蒸汽压有最高值, 将x B = 0.4 的溶液进行蒸馏, 塔顶将得到_________。
(2分)3.气相反应CO + 2H2 = CH3OH 的∆r G∅m = [- 90.625 + 0.211 T/K] kJ⋅ mol-1, 若要使平衡常数K∅p >1, 温度应为________。
(2分)4.直径为12 10-2 m的球形肥皂泡所受的附加压力为( )。
(2分)(已知表面张力为0.025 N⋅ m- 1)(a) 5 Pa (b) 10 Pa (c) 15 Pa (d) 20 Pa5.在简单硬球碰撞理论中, 有效碰撞的定义为( )。
(2分)(a) 互撞分子的总动能超过其阈能E C(b) 互撞分子的相对动能超过其阈能E C(c) 互撞分子的相对平动能在联心线上的分量超过其阈能E C(d) 互撞分子的内部动能超过其阈能E C四. (共18分) 计算题(2)1.在298.15 K时, ∅下, 有一含Zn2+和Cd2+的浓度均为0.1 mol⋅ 1kg-1的溶液, 用电解沉积的方法把它们分离, 已知ϕ∅Zn2+, Zn = - 0.763 V, ϕ∅Cd2+, Cd = - 0.403 V。
试问:(a) 哪种金属首先在阴极析出Æ 用铂作阴极, H2气在铂上的超电势为0.6 V。
(b) 第二种金属开始析出时, 前一种金属的浓度为多少Æ 设活度系数均为1。
(6分)2.在298 K时某有机羧酸在0.2 mol⋅ 1kg-1的HCl溶液中异构化为内酯的反应为1- 1对峙反应。
当羧酸的起始浓度为18.23(单位可任意选定)时, 内酯的浓度随时间的变化如下, 试计算该反应在298 K时的平衡常数和正、逆反应的速率常数。
(8分)3.在298 K时, 水-空气表面张力γ= 7.172 10-2 N⋅ m-1, (∅γ /∅T)P, A = - 1.572 10-4 N⋅ m-1⋅K-1, 在T, p∅可逆地增加2 cm2表面, 求体系所作的功W和熵变∆S。
(4分)中山大学二OOO年攻读硕士学位研究生入学考试试题答案考试科目: 物理化学专业: 高分子化学与物理研究方向: 本专业的各研究方向I一. 填空与问答题(1):1. [答] (c)2. [答] (d), (c), (d), (b)3. [答] (d)4. [答] (c)5. [答] q = ∑g j exp(-∆εj /kT) 处于热力学平衡态近独立粒子体系中的单个分子6. [答] (c)7. [答] (a)8. [答] (3), (5), (0)9. [答] ( > ) 10. [答] K∅p = (4/27)(p3离/ p∅3) 11. [答] (d)12. [答] (d ) 13. [答] (b) 14. [答] 上升, 下降; 下降, 上升。
15. [答] 负二. 计算题(1)1. [答] ∆H = 40.66 kJ (2分) ∆U = 37.56 kJ (2分)∆S = 114.8 J⋅ K- 1 (2分) ∆G = - 2160 J (2分)∆F = - 5260 J (2分)2. [答] (a) 液体刚凝聚时呈现二相平衡, 气相中的总压与液相组成的关系为:p = p A + p B = p*A x A + p*B x B = 0.4⨯p∅x A + 1.2⨯p∅ (1 -x A)= 1.2⨯p∅- 0.8⨯p∅x Ay A = p A/p = p*A x A/p 0.4 = 0.4⨯p∅x A/(1.2⨯p∅- 0.8⨯p∅x A)x A = 0.6667 可得p = 6.755⨯ 104 Pa (3分)(b) 正常沸点时: p = p∅p∅ =1.2⨯p∅- 0.8⨯p∅x’Ax’A= 0.25 x’B = 0.75 (3分)3. [答] 在x体系中加入FeSO4后, 物系沿xB线移动, 在靠近EO线处, 取一点y, 向y体系中加入水, 物系沿yA线移动, 进入EDF区, 当物系点到达z点时就有FeSO4⋅H2O固体析出, 过滤可得复盐E。
