2012届高考化学基础理论物质结构元素周期律第一轮针对复习题(含答案)
高考化学一轮复习化学基本理论题组练习(含答案)

高考化学一轮复习化学基本理论题组练习(含答案)化学性质是通过化学变化表现出的性质。
如还原性、氧化性、酸性、碱性、可燃性、热稳定性。
以下是化学基本理论题组练习,请考生练习。
题组一元素周期律及其应用1.能说明元素X原子的得电子能力强于元素Y原子的得电子能力的事实是)。
A.元素周期表中元素X位于元素Y的上一周期B.元素X的含氧酸的酸性强于元素Y的含氧酸的酸性C.分别加热H2X、HY至500 ,只有HY发生分解D.元素X与Y同主族,相同温度时其单质与铜反应分别生成Cu2X和CuY解析原子的得电子能力越强,元素的非金属性越强,非金属性强弱可通过非金属单质与氢气反应的难易、氢化物的稳定性、最高价氧化物对应水化物的酸性强弱来比较,C正确。
A选项中没有强调同一主族,B选项中的含氧酸没有强调最高价态,D选项中X单质将Cu氧化为+1价,Y单质将Cu氧化为+2价,则Y的非金属性强于X。
答案 C2.根据元素周期律判断,下列递变规律不正确的是)。
A.Na、Mg、Al的金属性依次减弱B.HCl、HBr、HI的稳定性依次增强C.HClO4、H2SO4、H3PO4的酸性依次减弱D.Li、Na、K与水反应的剧烈程度依次增大解析 Cl、Br、I是卤族元素,非金属性依次减弱,其气态氢化物的稳定性也依次减弱。
答案 B3.2019上海化学,6)今年是门捷列夫诞辰180周年。
下列事实不能用元素周期律解释的只有)。
A.碱性:KOHNaOHB.相对原子质量:ArH2SO4 D.元素的金属性:MgAl解析根据元素周期律,可知同周期元素从左往右金属性逐渐减弱,非金属性逐渐增强,则Cl、S元素最高价氧化物对应水化物酸性:HClO4H2SO4,元素的金属性:MgAl,C、D能解释;同主族元素从上往下金属性逐渐增强,非金属性逐渐减弱,则最高价氧化物对应水化物碱性KOHNaOH,A能解释;因Ar、K相对原子质量测量标准不同,相对原子质量ArK不能用元素周期律解释。
2012年元素周期律高考题

1 、(2012全国)元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫的离子半径,X元素为A AlB PC ArD K2、(2012天津)下列叙述正确的是()A.C60与12C互为同位素B.不同元素的原子构成的分子只含极性共价键C.23592U和23892U是中子数不同质子数相同的同种核素D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构3、(2012上海)元素周期表中铋元素的数据见右图,下列说法正确的是A.Bi元素的质量数是209B.Bi元素的相对原子质量是209.0C.Bi原子的相对原子质量是209.0D.Bi原子最外层有5个能量相同的电子4、(2012山东)下列关于原子结构、元素性质的说法正确的是A.非金属元素组成的化合物中只含共价键B.IA族金属元素是同周期中金属性最强的元素C.同种元素的原子均有相同的质子数和中子数D.VIIA族元素的阴离子性还原性越强,其最高价氧化物对应水化物的酸性越强5、(2012江苏)短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W 与X属于同一主族。
下列叙述正确的是A.元素X 的简单气态氢化物的热稳定性比W 的强B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱C.化合物YX、ZX2、WX3中化学键的类型相同D.原子半径的大小顺序:r Y >r Z >r W >r X6、(2012浙江)X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。
下列说法正确的是A.原子半径:Z>Y>XB.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰27、(2012辽宁)短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。
高中化学必修一第四章物质结构元素周期律考点专题训练(带答案)

高中化学必修一第四章物质结构元素周期律考点专题训练单选题1、下列物质的分子中既含有极性键,又含有非极性键的是A.CO2B.H2OC.H2O2D.H2答案:CA.CO2(O=C=O)中只含极性键,A错误;B.H2O(H—O—H)分子中只有极性键,B错误;C.H2O2分子的结构式为H—O—O—H,既有极性键,又有非极性键,C正确;D.H2分子中只有非极性键,D错误;故选C。
2、下列比较中正确的是A.离子的还原性:S2->Cl->Br->F-B.热稳定性:HF>HCl>H2SC.酸性:HClO>H2SO4>H3PO4D.碱性:Al(OH)3>Mg(OH)2>Ca(OH)2答案:BA.元素的非金属性F>Cl>S>Br,非金属性越强其单质的氧化性越强,对应的离子还原性越弱,则离子还原性:S2->Br->Cl->F-,故A错误;B.元素的非金属性F>Cl>S,气态氢化物稳定性HF>HCl>H2S,故B正确;C.非金属性Cl>S>P,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,即酸性:HClO4>H2SO4>H3PO4,HClO不是最高价的含氧酸,是弱酸,其酸性比硫酸弱,故C错误;D.金属性:Ca>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,即酸性:Al(OH)3<Mg(OH)2<Ca(OH)2,故D错误;故选:B。
3、M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z。
下列说法中不正确的是A.M形成+2价正离子B.Z的熔点较高C.Z可表示为M2Y D.Z不一定溶于水答案:CA.M元素的1个原子失去2个电子,故形成+2价正离子,A正确;B.Z属于离子化合物,熔沸点较高,B正确;C.M元素的1个原子失去2个电子转移到Y元素的2个原子中去,故Z可表示为MY2,C错误;D.Z不一定溶于水,如氟化钙不溶于水,D正确;答案选C。
高考化学元素周期律综合经典题及答案
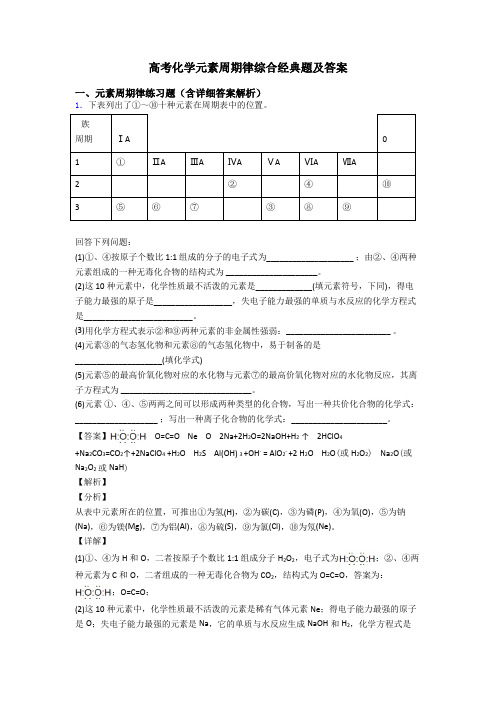
高考化学元素周期律综合经典题及答案一、元素周期律练习题(含详细答案解析)1.下表列出了①~⑩十种元素在周期表中的位置。
族周期ⅠA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②④⑩3⑤⑥⑦③⑧⑨回答下列问题:(1)①、④按原子个数比1:1 组成的分子的电子式为____________________ ;由②、④两种元素组成的一种无毒化合物的结构式为 _____________________。
(2)这10种元素中,化学性质最不活泼的元素是_____________(填元素符号,下同),得电子能力最强的原子是__________________,失电子能力最强的单质与水反应的化学方程式是_________________________。
(3)用化学方程式表示②和⑨两种元素的非金属性强弱:________________________ 。
(4)元素③的气态氢化物和元素⑧的气态氢化物中,易于制备的是____________________(填化学式)(5)元素⑤的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应,其离子方程式为 ______________________________。
(6)元素①、④、⑤两两之间可以形成两种类型的化合物,写出一种共价化合物的化学式:___________________ ;写出一种离子化合物的化学式:______________________。
【答案】 O=C=O Ne O 2Na+2H2O=2NaOH+H2↑ 2HClO4+Na2CO3=CO2↑+2NaClO4 +H2O H2S Al(OH) 3 +OH- = AlO2- +2 H2O H2O(或H2O2) Na2O(或Na2O2或NaH)【解析】【分析】从表中元素所在的位置,可推出①为氢(H),②为碳(C),③为磷(P),④为氧(O),⑤为钠(Na),⑥为镁(Mg),⑦为铝(Al),⑧为硫(S),⑨为氯(Cl),⑩为氖(Ne)。
2012届高考化学第一轮复习课时复习题(含参考答案)

2012届高考化学第一轮复习课时复习题(含参考答案)2012届高考化学第一轮复习课时练:第17讲元素周期律一、单项选择题1.关于元素周期表的下列说法中正确的是()A.同一短周期元素A、B,若A的核电荷数比B大,则B单质的还原性应比A单质强B.第n主族的元素,其最高化合价必为+n价C.同主族元素的气态氢化物,其相对分子质量越大,热稳定性一定越高D.同主族元素,原子半径越大,其单质的氧化性越强解析:由O、F无正价,知B项错,由热稳定性,HF>HI,而HI相对分子质量大,知C项错。
由氧化性F2>Cl2>Br2>I2知D项错。
答案:A2.X、Y、Z三种元素原子的核电荷数在10~18之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4。
则下列判断正确的是() A.非金属性:XB.含氧酸的酸性:H3ZO4>H2YO4>HXO4C.气态氢化物稳定性:按X、Y、Z顺序增加D.元素最低化合价的绝对值:按X、Y、Z顺序变大解析:由题意知X、Y、Z属于第三周期的非金属元素,其排列方式从左到右为:Z、Y、X,故A项错误;含氧酸酸性HXO4>H2YO4>H3ZO4则X、Y、Z依次为第ⅦA、ⅥA、ⅤA族元素,B项错误;气态氢化物稳定性按Z、Y、X顺序增加,C项错误。
答案:D3.(2010年高考上海化学)几种短周期元素的原子半径及主要化合价如下表:元素代号XYZW原子半径/pm1601437066主要化合价+2+3+5、+3、-3-2下列叙述正确的是()A.X、Y元素的金属性XB.一定条件下,Z单质与W的常见单质直接生成ZW2C.Y的最高价氧化物对应的水化物能溶于稀氨水D.一定条件下,W单质可以将Z单质从其氢化物中置换出来解析:本题是对元素推断及其化学性质的考查。
由元素的化合价和原子半径可以推知四种元素分别为Mg、Al、N、O,金属性Mg>Al,A错;N2与O2化合时生成的是NO,B错;Al2O3只能溶于强酸和强碱,而氨水是弱碱,C错;NH3在纯氧气中燃烧可以得到N2,D正确。
高考化学元素周期律综合经典题附答案解析

高考化学元素周期律综合经典题附答案解析一、元素周期律练习题(含详细答案解析)1.已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大.B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素中原子半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍.请回答下列问题:(1)画出F的原子结构示意图_____。
(2)B、C、E对应简单离子的半径由大到小的顺序为_____(用具体微粒符号表示)。
(3)A的气态氢化物与其最高价氧化物对应水化物反应,生成的化合物属于_____(填“离子化合物”或“共价化合物”)。
(4)加热条件下,B单质与C单质的反应产物的电子式为______。
(5)D元素最高价氧化物对应水化物与C元素最高价氧化物对应水化物的溶液反应的化学方程式为______。
【答案】 S2- > O2-> Na+离子化合物Al(OH)3 + NaOH = NaAlO2 + 2H2O【解析】【分析】A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大,B和E同主族,D 是地壳中含量最多的金属元素,则D为Al元素;E、F原子序数均大于Al,处于第三周期,而E元素原子的最外层电子数是电子层数的2倍,最外层电子数为6,故E为S元素,F为Cl;B和E同主族,则B为O元素;A、B在元素周期表中处于相邻的位置,A为N元素;C元素原子在同周期主族元素中原子半径最大,处于IA族,原子序数介于氧、铝之间,故C为Na,以此分析解答。
【详解】(1)根据上述分析可知:F为Cl元素,原子结构示意图为,故答案:。
(2)根据上述分析可知:B为O元素,C为Na元素,E为S元素,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2- > O2-> Na+,故答案为:S2- > O2-> Na+;(3)根据上述分析可知:A为N元素,A的气态氢化物、最高价氧化物对应水化物分别为氨气、硝酸,二者反应生成硝酸铵,属于离子化合物,故答案为:离子化合物;(4)根据上述分析可知:B为O元素,C为Na元素,加热条件下氧气与钠的反应生成Na2O2,含有离子键、共价键,所以电子式为:,故答案:;(5)根据上述分析可知:D为Al元素,C为Na元素。
高考化学元素周期律综合试题及答案.docx

高考化学元素周期律综合试题及答案一、元素周期律练习题(含详细答案解析)1.元素周期表是打开物质世界奧秘之门的一把金钥匙,1869年,门捷列夫发现了元素周期律并发表了元素周期表。
下图为元素周期表的一部分,回答下列问题。
(1).上述元素中化学性质最稳定的是________(填元素符号,下同 ) ,非金属性最强的是_____。
(2)c 的最高价氧化物对应水化物的化学式为__________。
(3)h 元素的原子结构示意图为 __________,写出 h 单质的一种用途 :__________。
(4)b、 d、 f 三种元素原子半径由大到小的顺序是__________(用元素符号表示 )。
(5)a、 g、 j 的氢氧化物中碱性最强的是__________(填化学式 ),写出其溶液与g 的氧化物反应的离子方程式 :___________________________________ 。
【答案】 Ar F HNO3制光电池2 3-2-2 Mg>C>O KOH AlO+2OH =2AlO+H O【解析】【分析】由元素周期表可知, a 为 Li、 b 为 C、 c 为 N、 d 为 O、 e 为 F、f 为 Mg 、 g 为 Al、 h 为 Si、 i 为 Ar、 j 为 K。
【详解】(1) 0 族元素的化学性质最稳定,故上述元素中化学性质最稳定的是Ar; F 元素的非金属性最强;(2) c 为 N,其最高价氧化物对应的水化物为HNO3;(3) h 为 Si,核电荷数为14,原子的核外电子数也是14, Si 的原子结构示意图为;Si 单质的一种用途是可以制光电池;(4) b 为 C、d 为 O、 f 为 Mg,当电子层数相同时,核电荷数越大原子半径越小;电子层数越多原子半径越大,故b、 d、 f 三种元素原子半径由大到小的顺序是Mg>C>O;(5) a 为 Li、 g 为 Al、 j 为 K, K 的金属性最强,金属性越强,最高价氧化物对应的水化物的碱性越强,故a、 g、j 的氢氧化物中碱性最强的是KOH; g 的氧化物为Al2O3, Al2O3与KOH溶液反应的离子方程式为Al2 O3 +2OH-=2AlO2- +H2O 。
2012届高三化学一轮复习 物质结构 元素周期律(高考真题+模拟新题)精品资料

E单元物质结构元素周期律E1 原子结构4.E1 [2011·海南化学卷] 131 53I是常规核裂变产物之一,可以通过测定大气或水中131 53I的含量变化来监测核电站是否发生放射性物质泄漏。
下列有关131 53I的叙述中错误的是( )A.131 53I的化学性质与127 53I相同B.131 53I的原子序数为53uC.131 53I的原子核外电子数为78D.131 53I的原子核内中子数多于质子数4.E1 【解析】 C 131 53I与127 53I互为同位素,化学性质相同,故A对;131 53I的质子数为53,质量数为131,中子数=131-53=78,故B对、D对;核外电子数应为53,故C错。
2.E1 [2011·江苏化学卷] 下列有关化学用语表示正确的是( )A.N2的电子式:N⋮⋮NB.S2-的结构示意图:C.质子数为53、中子数为78的碘原子:131 53ID.邻羟基苯甲酸的结构简式:OHCOOH2.E1 【解析】 C N原子最外层为5个电子,N2的电子式为N⋮⋮N,A错;S2-的最外层为8,B错;根据质量数=中子数+质子数,碘原子的质量数为53+78=131,C对;邻羟基苯甲酸的结构简式为COOHOH,D错。
2.E1E2 [2011·天津卷] 以下有关原子结构及元素周期律的叙述正确的是( )A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强D.同主族元素从上到下,单质的熔点逐渐降低2.E1E2 【解析】 B 同为铯元素的同位素,137Cs和133Cs的质子数相等,A错;第ⅦA 元素从上到下,元素的非金属性减弱,其氢化物的稳定性减弱,C错;如果同主族元素形成的晶体属于分子晶体(如第ⅦA族),由于随着相对分子质量的增加,分子间作用力增强,故单质的熔点升高,D错。
最新高考化学一轮物质结构和元素周期律专题测试卷4

高考化学一轮物质结构和元素周期律专题测试卷4(带答案)专题二基本理论第1讲物质结构和元素周期律(45分钟100分)一、选择题(本题包括7小题,每小题6分,共42分)1.(2013•海南高考)重水(D2O)是重要的核工业原料,下列说法错误的是()A.氘(D)原子核外有1个电子B.1H与D互称同位素C.H2O与D2O互称同素异形体D.1 O与 O的相对分子质量相同2.下列对非金属元素(除稀有气体元素外)的相关判断正确的是()①非金属元素都是主族元素②单质在反应中都只能作氧化剂③氢化物常温下都是气态,所以都叫气态氢化物④氧化物常温下都可以与水反应生成酸⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价A.②⑤B.①③⑤C.②③④D.①⑤3.(2012•大纲版全国卷)元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。
X元素为()A.Al B.P C.Ar D.K4.(2013•南平质检)如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是()A.离子半径:N>ZB.氢化物的稳定性:M<NC.失电子能力:Y>ZD.单质的氧化性:N<X5.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲与丙同主族,丁元素原子最外层电子数是其电子层数的2倍。
下列说法正确的是()A.简单离子半径:甲<乙<丙<丁B.单质的还原性:乙<甲<丙<丁C.乙、丙、丁的最高价氧化物对应的水化物能两两相互反应D.甲、乙、丙、丁的单质一定条件下都能和氧气直接化合6.(2013•龙岩质检)下列关于原子结构、元素周期表和元素周期律的说法正确的是()A.核外电子排布相同的简单离子一定是同周期元素B.位于金属与非金属的交界处的铝、硅元素,属于过渡元素C.由水溶液的酸性:H2SO3>H2CO3,可推断出元素的非金属性:S>CD.Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH>Ba(OH)27.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。
高考化学第一轮复习-元素周期律常见题型解题思路附答案详解

高考化学第一轮复习-元素周期律常见题型解题思路附答案详解1、《考试大纲》对物质结构、元素周期律方面的要求为:以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
这部分内容每年都会有试题,可以是选择题,也可以有关结合物质结构的元素化合物推断题。
2、《考试大纲》中有关物质结构部分的内容还有:(1)理解离子键、共价键的涵义。
理解极性键和非极性键。
了解极性分子和非极性分子。
了解分子间作用力,初步了解氢键。
能用有关原理解释一些实际问题。
(2)了解几种晶体类型(离子晶体、原子晶体、分子晶体和金属晶体)及其性质,了解各类晶体内部微粒间的相互作用。
能够根据晶体的性质判断晶体类型等。
(3)能对原子、分子、化学键等微观结构进行三维空间想像,重视理论联系实际、用物质结构理论解释一些具体问题。
高考试题中常常是结合元素化合物内容进行综合考查。
题型上看可以是选的择题、简答题、填空题等。
3、要注意,这部分内容也属于最重要基础知识之一,可以联系到各部分内容中,编制成多种不同的题型进行考查。
【例1】致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。
人们曾采用过乙醚、NH3、CH3C1等作致冷剂,但它们不是有毒,就是易燃。
于是科学家根据元素性质韵递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:(1)氢化物的易燃性:第二周期_________ >_________>H20、HF;第三周期SiH4>PH3>H2S>HCl(2)化合物的毒性:PH3>NH3;H2S__________H20;CS2_______02;CCl4>CF4(选填>或<、=)。
于是科学家们开始把注意力集中在含F、C1的化合物上。
高考化学元素周期律的综合复习及答案

高考化学元素周期律的综合复习及答案一、元素周期律练习题(含详细答案解析)1.有四种短周期元素,它们的结构、性质等信息如下表所述:元素结构、性质等信息A 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂B B与A同周期,其最高价氧化物的水化物呈两性C元素的气态氢化物极易溶于水,可用作制冷剂D 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂请根据表中信息填写:(1)A原子的核外电子排布式________________.(2)B元素在周期表中的位置____________________;离子半径:B________A(填“大于”或“小于”).(3)C原子的电子排布图是_______________________,其原子核外有___个未成对电子,能量最高的电子为___轨道上的电子,其轨道呈___________形.(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为_______________________________,与D的氢化物的水化物反应的化学方程式为_____________________________.【答案】1s22s22p63s1第三周期第ⅢA族小于 3 2p 哑铃 Al(OH)3+NaOH═NaAlO2+2H2O 3HCl+Al(OH)3═AlCl3+3H2O【解析】【分析】A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,所以A为Na元素;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al元素;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl元素,据此回答;【详解】(1)A为钠元素,A原子的核外电子排布式1s22s22p63s1;答案为:1s22s22p63s1;(2)B为铝元素,B元素在周期表中的位置第三周期第ⅢA族,电子层数相同的离子,核电荷数越大,离子半径越小,所以铝离子半径小于钠离子;答案为:第3周期第ⅢA族;小于;(3)C为氮元素,C原子的基态原子的电子排布图是,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃;答案为:;3;2p;哑铃;(4)B为铝元素,A为Na元素,B的最高价氧化物对应的水化物与A的最高价氧化物的水化物反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O;D的氢化物HCl,氯化氢与氢氧化铝反应的离子方程式为:3HCl+Al(OH)3═AlCl3+3H2O;答案为:Al(OH)3+NaOH═NaAlO2+2H2O;3HCl+Al(OH)3═AlCl3+3H2O。
高考化学复习《元素周期律》专项综合练习附答案解析

高考化学复习《元素周期律》专项综合练习附答案解析一、元素周期律练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:族ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期1①2②③④3⑤⑥⑦⑧⑨(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号....回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式...回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式...回答)。
(5)②和③按原子数1:2形成的化合物的电子式...为____________,该晶体气化的过程中克服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
【答案】第3周期IVA族 F NaOH H-F 分子间作用力共价化合物原子 Al(OH)3+NaOH=NaAlO2+2H2O【解析】【分析】根据元素①~⑨在表中的位置可知分别是H、C、O、F、Na、Mg、Al、Si、Cl。
据此解答。
【详解】(1)半导体材料应在金属与非金属交界处寻找,根据上述元素周期表的部分结构,半导体材料是晶体硅,位于第三周期第IVA族;(2)同周期从左向右原子半径减小,同主族从上到下原子半径增大,因此原子半径大小顺序是Mg>O>F,即原子半径最小的是F;(3)同周期从左向右金属性减弱,金属性越强,其最高价氧化物的水化物的碱性越强,即NaOH>Mg(OH)2>Al(OH)3,碱性最强的是NaOH;(4)同周期从左向右非金属性增强,其氢化物的稳定性增强,因此氢化物的稳定性:HF>H 2O >CH 4,最稳定的氢化物是HF ,其结构式为H -F ; (5)②和③按原子数1:2形成的化合物是CO 2,其电子式为:,CO 2属于分子晶体,熔化时克服分子间作用力;(6)③和⑧构成的化合物是SiO 2,属于共价化合物,其晶体为原子晶体;(7)⑤是钠元素,其最高价氧化物的水化物是NaOH ,⑦是Al ,其最高价氧化物的水化物是Al (OH )3,Al (OH )3表现两性,与碱反应的化学方程式为Al (OH )3+NaOH =NaAlO 2+2H 2O 。
高一化学第一章《物质结构元素周期律》测试题(带答案)

高一化学第一章《物质结构元素周期律》测试题(带答案)work Information Technology Company.2020YEAR高一化学第一章《物质结构元素周期律》测试题2016.03.20第一部分选择题(共48分)一、选择题(共10小题,每小题3分,共48分。
)1.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,Kurt Wuthrich等人为此获得2002年诺贝尔化学奖。
下面有关13C、15N的叙述正确的是A.13C与15N具有相同的中子数 B.13C与15N互为同素异形体C.13C与15N互为同位素 D. 13C的中子数与15N的核外电子数相同2.在周期表中金属和非金属的分界线附近能找到A.制农药的元素B.制催化剂的元素C.做半导体的元素D.制耐高温合金材料的元素3.下列关于元素周期表的说法正确的是A.能生成碱的金属元素都在ⅠA族B.稀有气体元素原子的最外层电子数均为8C.第二周期ⅣA族元素的原子核电荷数和中子数一定为6D.原子序数为14的元素位于元素周期表的第3周期ⅣA族4.下列各项表达正确的是A.氯化氢分子的电子式: B.S2-的结构示意图:+16288的结构式::N≡N:C .四氯化碳的电子式: D.N25.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中正确的是A.硒的原子序数为34 B.硒的氢化物比HBr稳定C.硒的非金属性比硫强 D.硒的最高价氧化物的水化物显碱性6.某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是A.R的最高价氧化物为ROB.R的气态氢化物能燃烧3C.R一定是第VIIA族元素 D.R的气态氢化物易溶于水显碱性7.下列关于ⅦA族元素的叙述正确的是A.ⅦA族元素是同周期中原子半径最大的元素B.ⅦA族元素是同周期中非金属性最弱的元素C.ⅦA族元素的最高正价都是+7价D.ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数8.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是A.X可能是第二周期非金属元素 B.Y可能与X同主族C.X可能是第三周期金属元素 D.Y一定是金属元素9.已知A的原子序数是x,B2-与A3+具有相同的电子层结构,则B元素的原子序数为A.x-5 B.x+5 C.x+1 D.x-110.短周期元素的离子a W2+、b X+、c Y2-、d Z- 都具有相同的电子层结构,下列推断正确的是A.原子半径:W>X>Z>Y B.热稳定性: H2Y>HZC.离子半径:W2+>Y2- D.碱性:XOH>W(OH)211.下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是A.6和8 B.19和16 C.12和17 D.10和8 12.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据。
完整版)高中化学物质结构元素周期律练习题及答案

完整版)高中化学物质结构元素周期律练习题及答案1.某粒子含有6个电子和7个中子,且呈电中性,其化学符号可能是Al。
2.Cl-的半径最小。
3.40K和40Ca属于同位素关系。
4.制催化剂的材料最容易在金属元素和非金属元素交界处找到。
5.C、N、O原子半径依次增大的递变规律不正确。
6.NH3、NH+4、NH2-具有相同的质子数和电子数。
7.X元素的原子序数小于Y元素,但X元素的离子半径大于Y元素。
8.碱性:NaOH>Mg(OH)2>Al(OH)3的化合物性质比较不正确。
9.原子半径:X>Y>Z是正确的。
10.铊是超导材料的组成元素之一,铊在周期表中位于第五周期,不是与铝同族元素,元素符号是Tl,Tl3+的氧化能力比Al3+弱是不正确的。
11.含有共价键的化合物不一定是共价化合物,这个说法是错误的。
12.正确的说法是:B.非金属元素呈现的最低负化合价,其绝对值等于该元素原子的最外层电子数。
13.正确的说法是:B.R一定是ⅣA族元素。
14.正确的说法是:D.碱金属元素是指ⅠA族的所有元素。
15.不可能的原子序数之差是D.6.16.错误的说法是:C.Y最高价氧化物的化学式为YOm。
17.正确的说法是:D.Y元素的非金属性比W元素的非金属性强。
18.正确的顺序是:C.B、A、D、C、E。
19.(1) NH4Cl。
(2) HCl。
(3) Cl2.(4) Cl2.5.由极性键和非极性键构成的物质是混合物。
6.由离子键和极性键构成的物质是离子共价化合物。
7.由离子键和非极性键构成的物质是离子性分子化合物。
20.X为S,Y为P,Z为Cl,元素符号为SPCl。
21.(1) ①He、②B、③C、④N、⑤O、⑥F、⑦Ne、⑧Ar、⑨Kr,化学性质最不活泼的是⑧元素。
2) NaOH。
3) ③C、②B、①He。
4) HF,2HF + B(OH)3 → H3BO3 + 2HF,所得溶液的pH<7.5) KrF2,火焰呈绿色。
22.(1) R的化合价为+5,n值为3.2) 7个,ⅦA族。
2012年高考化学 高考试题+模拟新题分类汇编专题5 物质结构 元素周期律

E单元物质结构元素周期律E1 原子结构9.E1、E2、E3、E5[2012·浙江卷] X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。
下列说法正确的是( )A.原子半径:Z>Y>XB.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1∶29.B [解析] 根据题意,推测X、Y、Z分别是H、O、F,则原子半径Y>Z>X,A错误;Z与X形成的化合物HF的沸点高于其他同族元素的氢化物,因为HF分子间存在氢键,B正确;CaO2与水反应时既作氧化剂又作还原剂,C错误;CaH2、CaO2和CaF2中阳离子和阴离子个数比分别为1∶2、1∶1、1∶2。
3.E3E1[2012·天津卷] 下列叙述正确的是( )A.乙酸与丙二酸互为同系物B.不同元素的原子构成的分子只含极性共价键C.23592U和23892U是中子数不同质子数相同的同种核素D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构3.D [解析] 乙酸分子中只含一个—COOH,而丙二酸分子中含有两个—COOH,二者结构不同且分子组成上也不相差n个“CH2”,因此二者不属于同系物,A项错误;由不同元素的原子构成的H2O2分子中含有非极性键,B项错误;235 92U与238 92U是质子数相同中子数不同的不同核素,二者互为同位素,C项错误;D项正确。
10.E1[2012·全国卷] 元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。
X元素为( )A.Al B.PC.Ar D.K10.D [解析] 本题考查微粒结构与大小比较。
X形成的离子与钙离子核外电子排布相同,则与负二价硫离子的核外电子排布也相同,根据“核外电子排布相同的离子,质子数大的半径反而小”可知X的质子数大于硫的质子数,选项中只有K元素符合题意。
2012年高考化学试题分类解析汇编:物质结构元素周期律(精)

1. : 2012 •江苏化学卷12 ]短周期元素 X 、Y 、Z 、W 的原子序数依次增大, X 原子最外层 电子数是其内层电子总数的 3倍,Y 原子最外层只有 2个,Z 单质可制成半导体材料, W 与 X 属于同一主族。
下列叙述正确的是 A.元素X 的简单气态氢化物的热稳定性比 W 强B •元素W 的最高价氧化物对应水化物的酸性逐渐比Z 弱C 化合物YX ZX2、WX3中化学键类型相同 D.原子半径的大小顺序: rY > rZ > rW > rXAD 解析:该题以 周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对 表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题考查了金属性、 非金属性比较的几个方面: 以及化学键类型、同周期与不同周期原子半径的大小比较。
最后推出的元素为:X:O;Y:Mg ;Z:Si ; W:S 。
2.: 2012 •海南化学卷19-1][选修3――物质结构与性质] (6分)下列有关元素锗及其化合物的叙述中正确的是 A. 锗的第一电离能高于碳而电负性低于碳 B. 四氯化锗与四氯化碳分子都是四面体构型 C. 二氧化锗与二氧化碳都是非极性的气体化合物 D. 锗和碳都存在具有原子晶体结构的单质 【答案】BD【解析】锗是金属而碳是非金属元素,第一电离能要低于碳,故 族元素,四氯化锗与四氯化碳都是分子晶体,其分子构型相同,故 的氧化物不可能为气体化合物, 故C 错;锗和碳是同主族元素, 故D 正确。
3. :2012 •福建理综化学卷 8]短周期元素 R 、T 、Q 、W 在元素周期表中的相对位置如右 下图所示,其中T 所处的周期序数与族序数相等。
下列判断不正确的是 A. 最简单气态氢化物的热稳定性: R>QB.最高价氧化物对应水化物的酸性:Q<WC. 原子半径:T>Q>RD. 含T 的盐溶液一定显酸性D 解析:根据元素所处的位置,可猜测 T 、Q 、W 为第三周期的元素, 其中T 所处的周期序数与族序数相等,贝UT 为Al , Q 为Si, W 为S, R为N 元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2012届高考化学基础理论物质结构元素周期律第一轮针对复习题(含答案)专题四基础理论物质结构元素周期律一、选择题 1.最近美国在阿富汗战场上又使用了贫铀弹,贫铀弹的主要成分是低放射性的铀238,它与制造原子弹的铀235属于 ( ) A.同位素 B.同种原子 C.同分异构体 D.同素异形体 2.下列各组物质发生状态变化时,所克服的微粒间的相互作用,属于同种类型的是 ( ) A.钠和硫的熔化 B.食盐和石蜡的熔化 C.碘和干冰的升华 D.二氧化硅和氧化钠的熔化3.136C-NMR(核磁共振)可以用于含碳化合物的结构分析。
136C表示的碳原子 ( ) A.核外有13个电子,其中6个能参与成键 B.核内有6个质子,核外有7个电子 C.质量数为13,原子序数为6,核内有7个中子 D.质量数为13,原子序数为6,核外有7个电子 4.已知短周期元素的离子aA2+、bB+、cC3-、dD-一都具有相同的电子层结构,则下列叙述正确的是 ( ) A.原子半径A>B>C>D B.原子序数a>b>c>d C.离子半径C3->D一>B+>A2+ D.单质的还原性A>B>D>C 5.已知自然界氧的同位素160、17O、18O,氢的同位素有H、D,从水分子的原子组成来看。
自然界的水一共有 ( ) A.3种 B.6种 C.9种 D.12种 6.据报道,某些建筑材料会产生放射性同位素氡22286Rn,从而对人体产生伤害。
该同位素原子的中子数与质子数之差是 ( ) A.136 B.50 C.86 D.222 7.物质的量均为a mol的氦气与氢气.一定具有相同的 ( ) A质子数 B.中于数 C.体积 D.质量 8.下列离子化合物中,阴、阳离子所含的电子数不相等的是 ( ) A.Na2O2 B.NaNH2 C.NaF D.Mg(OH)2 9.下列化合物中,阴离子和阳离子的半径之比最大的是 ( ) A.CsI B.NaF C.LiI D.KCl lO.下列所述性质中能证明化合物微粒间一定存在离子键的是 ( ) A.易溶于水 B.具有较高的熔点 C.熔融状态下能导电 D.溶于水能电离出离子 11.与羟基具有相同质子数和电子数的微粒是 ( ) A.OH- B.N C.-NH2 D.CH3+ 12.已知R为ⅡA族元素,L为ШA族元素.它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是 ( ) A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25 13.两种微粒的质子数和电子数均相等,下列关于两种微粒间关系的说法错误的是 ( ) A.它们可能是不同的分子 B.它们可能是不同的离子 C.它们可能互为同位素 D.它们可能是分子和离子 14.已知AB、CD、EF均为1:l型离子化合物,根据下列数据判断它们的熔点由高至低的是 ( ) AB CD EF 离子电荷数 1 1 2 键长(10-10m) 2.31 3.18 2.10 A.CD>AB>EF B.AB>EF>CD C.AB>CD>EF D.EF>AB>CD 15.核电荷数为l―18的元素中,下列叙述正确的是 ( ) A.最外层只有1个电子的元素一定不是非金属元素 B.最外层只有2个电子的元素一定是金属元素 C.原子核外各层电子数相等的元素一定是金属元素 D.核电荷数为17的元素的原子容易获得1个电子 16.某元素X最高价含氧酸的分子量为98,且X的氢化物的分子式不是H2X则下列说法正确的是( ) A.X 的最高价含氧酸的分子式可表示为H3XO4 B.X是第二周期VA族元素C.X是第二周期ⅥA族元素 D.X的最高化合价为+4 17.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有 ( ) A.1对 B.2对 C.3对 D.4对 18.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( ) A.x+2 B.x+4 C.x+8 D.x+18 19.下列关于稀有气体的叙述不正确的是 ( ) A.原子的最外电子层都有8个电子 B.其原子与同周期IA、ⅡA族阳离子具有相同的核外电子排布 C.化学性质非常不活泼 D.原子半径比同周期ⅦA族元素原子的大 20.X是元素X的一种同位素,则元素X在元素周期表中的位置是 ( ) A.第4周期第VA族 B.第4周期第ⅦA族 C.第3周期第ⅦA族 D.第5周期第ⅠA族 21.下列分子结构中,原子的最外层电子不能都满足8电子稳定结构的是 ( ) A.CH4 B.PCl3 C.CO2 D.BF3 22.关于IA族和ⅡA族元素的下列说法中正确的是 ( ) A.在同一周期中,I A族单质的熔点比ⅡA族的高 B.浓度都是0.01mol•L-1时,氢氧化钾溶液的pH比氢氧化钡的小 C.氧化钠的熔点比氧化镁的高 D.加热时,碳酸钠比碳酸镁易分解 23.下列微粒的电子式书写正确的是 ( )24.x、y为短周期元素,x原子K、L、M各电子层的电子数之比为1:4:1,它比y原子多3个电子,下列叙述正确的是 ( ) A.x离子半径大于y离子半径 B.x单质在空气中燃烧可生成两种化合物 C.x、y形成的化合物与浓硫酸共热可在烧瓶中进行 D.电解x、y形成的化合物的水溶液可得到y单质 25.根据中学化学教材所附元素周期表判断,下列叙述不正确的是 ( ) A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 26.根据判断,下列各元素一定属于主族元素的是 ( ) A.X元素能形成+7价的含氧酸及其盐 B.Y元素的原子最外电子层上有2个电子 C.Z元素的阴离子与同一周期稀有气体元素原子的电子层结构相同 D.R元素的氧化物是两性氧化物 27.下列叙述正确的是 ( ) A.同主族元素原子半径越大熔点越高 B.同主族两种短周期元素原子序数之差不可能是4 C.熔融时化学键没有破坏的晶体一定是分子晶体 D.含有离子的晶体一定是离子晶体 28.根据原子序数,下列各组原子能以离子键相结合的是 ( ) A.2与8 B.6与16 C.8与14 D.9与11 29.下列叙述中,正确的是 ( ) A.离子化合物中可能含有共价键 B.共价化合物中可能含有离子键 C.金属离子一定满足最外层2电子或8电子结构 D.共价化合物中各原子都一定满足最外层8电子结构 30.关于晶体的下列说法正确的是 ( ) A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子 C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低 31.在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对延长人类寿命起着重要的作用,已知R元素的原子有四个电子层,其最高价氧化物的分子式为RO3,则R 元素的名称为 A.硫 B.砷 C.硒 D.硅32.13C―NMR(核磁共振)15N―NMR可用于测定蛋白质,核酸等生物大分子的空间结构,Kurt.Wuthrich等人为此获得2002年诺贝尔化学奖,下面有关13C、15N叙述正确的是 ( ) A.13C与15N有相同的中子数 B.13C与C60互为同素异形体 C.15N与14N互为同位素 D. 15N的核外电子数与中子数相同 33.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上电子数比Y元素原子的L电子层上的电子数少2个,则这三种元素所组成的化合物的分子式不可能是 ( ) A.X2YZ4 B.XYZ3 C.X3YZ4 D.X4Y2Z7 34.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。
下列说法不正确的是() A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素 C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键 35.下列指定微粒的个数比为2:1的是() A.Be2+离子中的质子和电子 B.21H原子中的中子和质子 C.NaHCO3晶体中的阳离子和阴离子 D.BaO2(过氧化钡)固体中的阴离子和阳离子二、填空题 1.制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。
人们曾采用过乙醚、NH3、CH3Cl等作制冷剂,但他们不是有毒,就是易燃。
于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的燃性、毒性变化趋势如下:(l)氢化物的易燃性:第二周期 > >H2O、HF;第三周期SiH4>PH3> > (2)化合物的毒性:PH3>NH3 H2S H2O;CS2 CO2 CCl4>CF4(选填>或<)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.9℃,CF4的沸点为-128℃,新制冷剂的沸点范围应介于其间。
经过较长时间反复试验,一种新的制冷剂氟里昂CF2Cl2终于诞生了。
其他类似的还可以是。
(4)然而,这种制冷剂造成了当今的某一环境问题是。
但求助于周期表中元素及其化合物的变化趋势来开发制冷剂的思维方法是值得借鉴的。
(填写字母) ①毒性②沸点③易燃性④水溶性⑤颜色 A.①②③ B.②④⑤ C.②③④ 2.A、B、C、D是短周期元素,A元素的最高价氧化物的水化物与它的气态氢化物反应得到离子化合物,1摩该化合物含有42摩电子,B原子的最外层电子数是次外层的3倍。
C、D两原子的最外层电子数分别是内层电子数的一半。
C元素是植物生长的营养元素之一。
试写出: (1)A、B 元素形成的酸酐的化学式。
(2)D元素的单质与水反应的化学方程式。
(3)A、C元素气态氢化物的稳定性大小 < (用分子式表示)。
3.A、B、C是短周期IA和ⅡA族元素的碳酸盐,它们的质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nc(HCl)。
已知:,mA��mB+mc,na(HCl)=nB(HCl)+nc(Hcl)。
请填空: (1)写出短周期IA和ⅡA族元素形成的所有碳酸盐的名称:。
