中科院考研真题2009物理化学甲
2009~2011年中科院物理化学历年考研真题

2009~2011年中科院物理化学历年考研真题一,计算和简答1,考的很简单,就是那个开尔文公式,涉及到在毛细管中的饱和蒸汽压的计算2,汞胶粒的分散,求分散后吉布斯自由能的改变量3画出kcl-Licl的二元相图,写出相区组成,还有一个问答题4,速率方程的推导,题目给的是乙醛在光的条件下分解,还有量子产率5,通过电导率计算醋酸的解离常数和解离度6题目给出两个电极,一个甘汞电极,另一个未铬(三价和六价),也给出了电极电势,要求判断正负极,写出反应式,同时写出电动势的能斯特方程式7给出Pcl5=Pcl3+cl2的方程式,给出了解离度,通过计算说明增加反应体积和氮气后的解离度的变化8麦克斯韦方程式的推导二,判断题和简答题,太多了,说说我还记得的几个点吧判断题涉及到片偏摩尔量的定义,热二定律的叙述,泡沫,高温低压实际气体接近理想气体选择题涉及到,热机效率,拉乌尔定律,麦克斯韦关系式和尤拉公式,又迁移数求离子电导率,电解时正负离子迁移方向与电流方向的关系,流动法测半衰期的基本概念,热力学基本方程,范特霍夫等温方程还有,热力学第二定律定义表述--判断题在高温低温热源工作的可逆热机工作效率最高。
--判断题火车效率问题,北方的冬天,北方的夏天,南方的冬天,南方的夏天节流膨胀问题甲酸,乙酸,丙酸,丁酸吸附问题(吸附问题考了好几道选择题)2010中科院物理化学考研真题一、判断题(10分)1、极化分为浓差极化和电化学极化,对应的超电势是浓差超电势和电化学超电势。
二、选择题1、唐南平衡产生的原因2、理想气体跟一个物体接触吸热膨胀,则:判断S体系和S体系+S环境的符号3、分子碰撞次数的公式三、问答题(80分)1、统计热力学的题:给了转动惯量I的值还给了一个记不大清了(大家根据这个猜想一下吧,我这章没怎么看。
)2、一个直径为1mm的毛细管,插入水中10cm,向管中吹气使之产生气泡,还需水高度为16cm的压强,求气泡的表面张力3、在863k时磷、液态磷、气态磷三相平衡,900k时黑磷(s)、红磷(s)、液态磷三相平衡,他们的密度分别是x、y、z(记不清了),画出相图,并用克拉贝龙方程解释4、理想气体进行可逆过程,PT=常数,由2*101.325变化至4*101.325求:dU、dH,w2009年中科院物理化学考研试题试卷题型和08一样:15个判断;16--28为选择(25-28为多选);后面是大题目8道都是基础加基础将大题目说一下:1.用开尔文公式说明:液体喷雾干燥和毛细管凝聚2.用Cv=U/T和U的配分函数推导单原子理想气体的Cv=3/2R3.用电导率和摩尔电导率计算硫酸钙的活度积4.用粒子沉降公式计算粒子个数5.用速率常数计算平衡常数,正逆反应活化能,焓变,一级反应的时间6.水的电解,根据电流,氢气.氧气的体积,以及空气压和水的饱和蒸汽压计算产生1立方米氢气和氧气的时间7.PVm=RT+aP推导恒温可逆过程的热,功,内能变,焓变8.相图二相体系的,AB在400分解xB=0.4和AB2,AB2在600分解AB和B,A(500)B(800),低共熔300(xB=0.1)画图,再就是xB=0。
中科院2003-2009物化试题

中国科学院研究生院2007年招收攻读硕士学位研究生入学统一考试试题科目名称:物理化学(甲)考生须知:1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用无字典存储和编程功能的电子计算器。
下列一些基本常数供解题时参考:普朗克常数h = 6.626 × 10-34 J·S;玻兹曼常数k B = 1.381× 10-23 J·K-1;摩尔气体常数R = 8.314 J·mol-1·K-1;法拉第常数F = 96500 C·mol-1一、是非题(每小题1分,共15分)(判断下列各题是否正确,正确用“√”表示,错误用“×”表示)1、气体的压力是在单位时间内撞击在单位表面上的分子所发生的动量的变化。
2、公式PVγ=常数,适用于理想气体的绝热可逆变化。
3、一定量的某实际气体,向真空中绝热膨胀以后,系统的P和V的乘积变小,温度降低,则此过程的ΔU < 0,ΔS > 0 。
4、将低沸点的A和高沸点的B两种纯液体组成液态完全互溶的气液平衡体系。
在一定温度下,将液体B加入体系中时,测得体系的压力增大,说明此系统具有最大正偏差。
5、水的三相点就是水的冰点。
6、溶剂服从拉乌尔定律、溶质服从亨利定律的溶液,称为理想稀溶液。
7、当反应A(s)→B(s)+D(g)达到化学平衡时,系统的自由度f = 3。
8、在合成氨反应中,惰性气体的存在不影响平衡常数,但影响平衡组成。
9、能量零点选择不同,则内能的值也不同。
10、无论是定位系统或非定位系统,最概然分布的公式是一样的。
11、对任一种有液接的浓差电池,加盐桥比不加盐桥的电动势大。
12、反应A + B = 2 C + 2 D 不可能是基元反应。
13、在同一温度下的同一基元反应,随着不同浓度单位,k (速率常数)有不同数值,从)exp()exp(RTH R S h T k k m r m r B θθ≠≠Δ−Δ=看,主要是因所取的标准态不同所引起的。
中科院中科大试卷及答案

中国科学院――中国科学技术大学2000年招收攻读硕士学位研究生入学考试试卷科目:物理化学一、 选择、真空题(共20分)1.(2分)从统计热力学观点看,功的微观本质是____________:热的微观本质是_____________。
2.(2分)有理想气体反应达化学平衡A (g )+B (g )=3C (g ),在等温下维持体系总压不变,向体系中加入惰性气体,平衡____移动;若将气体置于钢筒内加入惰性气体后平衡____移动。
3.(4分)离子迁移数(t 1)与温度、浓度都有关,对BaCl 2水溶液来说,随着溶液浓度的增大,t (Ba 2+)应______ ,t (Cl -)应___;当温度升高时,t (Ba 2+)应____,t (Cl -)应____(填入增大或减小)。
4.(2分)I 2分子的振动能级间隔为0.43J 2010-⨯。
在25℃时,某一能级i 与其较低能级上分子数的比值1/i i N N -=________________5.(2分)298K 时正丁醇水溶液表面张力对正丁醇浓度作图。
其斜率为-0.103-11N m mol kg -⋅⋅⋅。
正丁醇在浓度为0.1mol 1kg -⋅时的表面超量Γ为:_____________6.(5分)混合等体积的0.08-3mol dm KI ⋅和0.1-33mol dm AgNO ⋅溶液所得溶胶。
(1)试写出胶团结构式:_______________ (2)指明电泳方向:_____________________(3)比较4242MgSO ,Na SO ,CaCl 电解质对溶胶的聚沉能力:________。
7.(3分)用渗透压测大分子化合物的摩尔质量属于____均摩尔质量;用光散射法得到的摩尔质量属于____均摩尔质量;沉降速度法得到____均摩尔质量。
(A )质均(B )数均(C )Z 均(D )平均二、 计算题(共80分)1.(9分)已知1mol 氢气的物态方程为:P (V -b )=R T ( b 为大于0的常数),若该气体经一个绝热的自由膨胀过程由始态(T 1,V 1)到达终态体积V 2,求:(1) 终态的温度T 2; (2) 过程的∆U 、∆H 、S ∆(3) 计算说明该气体经节流膨胀后,温度如何变化?2.(8分)在308.15K 乙醇(1)和氯仿(2)组成二组分溶液,该溶液的蒸气压p 与液相组成x 气相组成y 之间的关系,由实验测得列表如下:假定蒸气为理想气体,当乙醇在溶液中的摩尔分数为0.6时: (1) 以纯液为标准态,计算乙醇和氯仿的活度及活度系数; (2) 以极稀溶液为标准态,计算氯仿的活度和活度系数。
2009年物理化学(甲)

中科院2009年物理化学试题一.是非题(每小题1分,共15分)1. 某气体状态方程为p=f(V)T,f(V)只是体积的函数,恒温下该气体的熵随体积V的增加而增加。
2. 在恒温恒压下不做非体积功的情况下,ΔH>0, Δ>0的过程不一定能自发进行。
3. 已知X 和Y可构成固溶体。
在X中,若加入Y则系统熔点升高,则Y在固溶体中的含量比液相中的含量低4. 稀溶液的依数性是指在指定溶液的种类和数量后,其性质仅决定与所含溶质分子的数目,而与溶质的本性无关5. 在非理想液态混合物中,正规混合物的非理想性是完全由混合热效应引起的。
6. 多孔硅胶据具有强烈的吸水性能,这表明自由水分子的化学势比干硅胶表面水分子的化学势低。
7. 在一定温度下,分子的平动,振动,转动的能级间隔顺序为,振动>转动>平动。
8. 原电池的电动势等于组成电池的个相同的各个界面上所产生的电势能的代数和。
9. 工业上用电解食盐水制造NaOH的反应为:2NaCl+2H2O→ 2NaOH+H2(g)+Cl(g),阴极反应为:2NaCl-2e→2Na+ +Cl2(g)10. 碰撞理论中的Ec与阿伦活化能Ea在数值上必须相等,碰撞才是有效的。
11. 假设晶体上的被吸附的气体分子间无相互作用,则可把该气体系统视为定域的独立子体系。
12. 在统热中,零点能(基态分子的能量)的选择可影响吉布斯函数G的值13. 绝大多数的液态物质的表面张力随温度升高而趋于最大值14. 反应级数只能是0或正整数15. 正常人体中,血液的糖分远高于尿中的糖分,是由于肾的渗透功能阻止血液中的糖分进入尿液。
二.选择题(1-24 单选,每个2分,25-28多选,每个3分) 1. 在同一温度下,某气体无知的Cpm 与Cvm 的关系为 A Cpm<Cvm B Cpm>Cvm C Cpm=Cvm D 无法比较2. 基尔霍夫定律,由T1下的ΔH1,计算T2下的ΔH2 A 只能直接用于反应物和产物都为气体达到化学反应过程 B 能直接用于任何化学反应过程C 只能直接用于等压过程中无相变,无其他化学反应的过程D 只能由于均相体系在等压下的化学反应过程 3. 下列函数中,哪一个为广度性质A 若L=(T, P, n1, n2……),则λL=0(λ为常数)B 若L=(T, P, n1, n2……),则L=L (T, P , λn1, λn2……)(λ为常数)C 若L=(T, P, n1, n2……),则λL=L (T, P , λn1, λn2……)(λ为常数)D 若L=(T, P, n1, n2……),则λ2L=L (T, P , n1, n2……)(λ为常数) 4. 一个纯物质的膨胀系数2111()1p V a m K V T V-∆==∙∙∆(T 为绝对温度),则该物质CpA 与体积V 无关B 与压力p 无关C 与温度T 无关D 与V,p ,T 有关5. H 2O(l, 373K, p0) H 2O(g, 373K, p0),判断该过程能否发生,可用作判据的是 A ΔHB ΔGC ΔUD ΔS (体系)+ΔS(环境)6. 在一个简单(单组分,单向,各项同性)封闭体系中,恒压只做体积功的条件下,内能随温度升高作何变化? A()U p T ∆∆>0 B ()U p T ∆∆<0 C()U pT∆∆=0D 具体体系情况而定 7 偏摩尔熵等于下列哪个式子四个选项很相似,D 大致是,,,[(/)/]p nB T p ncG T n -∂∂∂∂ 。
中国科学院研究生院2008年物理化学甲考研真题

7.在一定的温度压力下,某反应的 r G >0,故要寻找合适的催化剂可以使反应向正向 进行。 8. H U pV 适用于封闭体系的恒压过程。
9.在恒压下,理想气体的体积随温度的变化率 (V / T) p R / p。
10.1mol 单原子理想气体从体积 V1 恒温自由膨胀到体积 V2 ,则 S R ln(V2 / V1 ) 。 11.在密封容器中,水、水蒸气和冰三相呈平衡时,此系统的组分数为 3,自由度为 0。 12.松弛法能测定很高的反应速率,数学处理也较简单,但因只能应用于高反应速率的 测定而有一定的局限性。
(B)粒子在能级 i 上的存在有无限制; (D)粒子是彼此可以区别的。
11.CO 和 N 2 的质量、转动特征温度的数值基本相同,若电子均处于基本非简并的最低
能级,且设振动对熵的贡献可忽略,则: (A) S m (CO) Sm ( N 2 ) ;(B) Sm (CO) Sm ( N 2 ) ;(C) S m (CO) Sm ( N 2 ) ;(D)不能确定。
4.25°C 时,对于由 1mol 苯和 1mol 甲苯组成的理想溶液,下列各式中不正确的是:
(A) H mix 0 ;(B) Smix 11.53 J K 1 ;(C) Gmix 0 ;(D) Gmix 3437.6 J
5.乙醇比水易挥发,如将少量乙醇溶于水中形成稀溶液,下列说法中正确的是:
(A)溶液的饱和蒸气压必低于同温度下纯水的饱和蒸气压; (B)溶液的沸点高于相同压力下纯水的沸点; (C)溶液的沸点必定低于相同压力下纯水的沸点; (D)溶液的沸点等于相同压力下纯水的沸点。
6.对于化学反应 K 与 T 的关系中,正确的是:
(A)若 r H m 0 ,T 增加, K 增加; (C)若 r H m 0 ,T 变而 K 不变;
中科院1999-2013考研真题物理化学(甲)真题及答案

(
g
)
→
H2O(l
)
∆r
H
○ m,3
=
−285.8
kJimol-1
求反应
2C(石墨)
+
2H
2
(
g
)
+
O2
(
g
)
→
CH3COOH(l
)
的摩尔焓变
∆
r
H
○ m
=?
2. (10 分) 试用麦克斯韦(Maxwell)关系式证明理想气体的内能与体积无关,而仅是温度的函数,
即:
⎛ ⎜⎝
∂U ∂V
⎞ ⎟⎠T
= 0 ;而范德华(van
∆
g l
H
○ m
。
5. (9 分)
硝基苯和水组成完全不互溶二组分混合液。在 p ○ 下,其沸腾温度为 99℃。已知 99℃
时水的蒸汽压为 97.709kPa。水与硝基苯的摩尔质量分别为:
M水 = 18.016×10−3 kgimol−1 与 M硝基苯 = 123.11×10−3 kgimol−1 。若将硝基苯进行
[B] [(As2S3 )m inHS− , (n − x)H+ ]x− ixH+
[C] [(As2S3 )m inH+ , (n − x)HS− ]x− ixHS−
[D] [(As2S3 )m inHS− , (n − x)H+ ]x+ ixH+
计算题部分 1. (9 分)
温度与压力分别为 298.15K、 p ○ 时,已知下列反应的热效应:
-2-
考研——物理化学——1999
设有某气体 A,其分子的最低能级是非简并的,取分子的基态作为能量零点,相邻能级 的能量为 E,其统计权重为 2,忽略更高能级。 (1) 写出 A 分子的总配分函数的表达式;
中国科学院中科大年物化试题

中国科学院——中国科学技术大学2003年招收攻读硕士学位研究生入学考试试题试题名称:物理化学一、选择题(共5题,10分)1.(2分)理想气体在恒定外压p 下,从10dm3膨胀到16dm3,同时吸热126J,计算此气体的△U.( )(A)-284J (B)842J (C)-482J (D)482J2.(2分)下列宏观过程:()(1)p ,273K下冰融化为水;(2)电流通过金属发热;(3)往车胎内打气(4)水在101325Pa,375K下蒸发可看作可逆过程的是:(A)(1),(4)(B)(2),(3)(C)(1),(3)(D)(2),(4)3.(2分)298K时两个级数相同的反应Ⅰ,Ⅱ,活化能EI =E∏,若速率常数k1=10k∏,则两反应之活化熵相差:( )(A)0.6J·K-1·mol-1(B)10 J·K-1·mol-1(C)19 J·K-1·mol-1(D)190 J·K-1·mol-14.(2分)有人在不同pH的条件下,测定出牛的血清蛋白在水溶液中的电泳速度,结果如下:()pH 4.20 4.56 5.20 5.65 6.30 7.00泳速/(μm2/s·V)0.50 0.18 -0.25 -0.65 -0.90 -1.25由实验数据可知:(A)该蛋白质的等电点pH>7.00 (B)该蛋白质的等电点pH<4.20(C)该蛋白质的等电点pH<7.00 (D)从上述实验数据不能确定等电点范围5.(2分)吸附理论主要用来描述:()(A)均相催化(B)多相催化(C)酸碱催化(D)酶催化二、填空题6.(2分)理想气体等温(T=300K)膨胀过程中从热源吸热600J,所做的功仅是变到相同终态时最大功的1/10,则体系的熵变△S = J·K-1。
7.(2分)在300K时,48.98dm3的理想气体从100kPa变到500KPa,体系的吉布斯自由能变化为kJ.8.(2分)从微观角度面言,熵具有统计意义,它是体系的一种量度。
国科大-中科院2016年《物理化学(甲)》考研真题

中国科学院大学
2016年招收攻读硕士学位研究生入学统一考试试题
科目名称:物理化学(甲)
考生须知:
1.本试卷满分为150分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3.可以使用不带储存及编程功能的计算器。
下列一些基本常数供解题时参考:
普朗克常数h=6.626x10-34J·s; 波兹曼常数k B=l.38IxI0-23J-K-1;
摩尔气体常数R=8.314J·mor1-K1; 法拉第常数F=96500C·mor1
一、是非题(每小题1分,共15分)(判断下列各题是否正确,正确用",,/ "表
2.对一飞来立了赞酰归严霄黜砌忙因此
3.气体压力增大时,分子间距减小,因此压力增高,粘度增大。
4.能级和简并度的概念是从经典力学引入到统计热力学中来的。
5.若视水蒸气为理想气体,在373K,lOOkPa条件下,100g液体水汽化做功为1.72kJ。
13.胶粒的Br o wn运动时分散介质分子以不同大小和方向的力对胶体粒子不断撞击而产生的,因此B r o wn运动的本质就是分子的热运动。
中科院1999-2013考研真题物理化学(甲)真题及答案

8. (6 分) 下列电池
Pt, H2 ( p1) HCl(m) H2 ( p2 ), Pt
设氢气符合状态方程: pVm = RT + α p ,式中α = 1.481×10−5 m3 imol−1 ,且与温度、
压力无关,当氢气的压力 p1 = 20.0 × p ○ 、 p2 = p ○ 时:
(1) 写出电极反应和电池反应; (2) 计算电池在温度为 293.15K 时的电动势;
[B] [(As2S3 )m inHS− , (n − x)H+ ]x− ixH+
[C] [(As2S3 )m inH+ , (n − x)HS− ]x− ixHS−
[D] [(As2S3 )m inHS− , (n − x)H+ ]x+ ixH+
计算题部分 1. (9 分)
温度与压力分别为 298.15K、 p ○ 时,已知下列反应的热效应:
d
ln
K
○ p
=
∆
r
H
○ m
dT
RT 2
ln
K
○ p
=
−
∆r
H
○ m
RT
+ C,
C 为常数
ln 0.36 = − 61500 + C, C=15.15 8.314× 457.4
ln
K
○ p
=
−
∆r
H
○ m
RT
+15.15=15.15 − 7397.2 T
当
T=500K
时,
ln
K
○ p
=
0.3562
,
3167)
= 1.774
中科院2012年研究生入学考试物理化学试卷(甲+乙)

(A) 0.8571
(B) 0.1273
(C) 0.9353
(D) 0.0647
科目名称: 物理化学(甲)
第2页 共7 页
7.浓度都是 0.001 mol·kg-1 的不同溶质的水溶液,下列哪个溶液的沸点最低: (A) KNO3 (B) HAc (C) Na2SO4 (D) 蔗糖
8.电化学体系中达到相平衡的条件是该组分在: (A) 两相的电势相等 (C) 两相的电化学势相等 9.分配定律适用下列哪个体系: (A) I2 溶解在水与 CCl4 中 (C) Na2SO4 溶解在水与苯中 (B) Na2CO3 溶解在 CCl4 与苯中 (D) Br2 溶解在乙醇与水中 (B) 两相的化学势相等 (D) 两相的电极电势相等
误用“”表示)
1.理想气体的标准平衡常数与经验平衡常数的关系为 K p K p2.在标准压力 p下,某物质的标准摩尔生成 Gibbs 自由能等于由最稳定的单 质生成 1 mol 该物质时的标准 Gibbs 自由能变化值,用符号 f G m 表示。 3.一种分布就是一种微观状态,而且只是一种微观状态。 4.配分函数的析因子性质适用于任何独立粒子体系。 5.转动配分函数计算式中的对称数是对粒子等同性的修正。 6.卡诺循环过程热温商之和为零是因为它是由可逆过程组成的循环。 7.就溶剂极性对反应速率的影响来说,如果生成物的极性比反应物大,则在 极性溶剂中反应速率会变小; 反之, 如果反应物的极性比生成物的极性大, 则在极性溶剂中的反应速率必变大。 8.对于基元反应,其反应级数和反应的分子数是相同的。 9.表面能和表面张力的单位不同,但二者量纲相同、且描述的是体系的同一 个性质。 10. (H n i ) S,p,n 是化学势。
j i
11.醋酸的极限摩尔电导率数值是根据 Kohlrausch 经验公式外推得到的。 12.不论是否两相平衡,只要能使混合物分成组成不同的两个部分,两者之 间皆可用杠杆规则进行物料衡算。
中国科学院大学 考研《物理化学(甲)》考试大纲

中国科学院大学考研《物理化学(甲)》考试大纲本《物理化学》(甲)考试大纲适用于报考中国科学院大学化学类专业的硕士研究生入学考试。
《物理化学》是大学本科化学专业的一门重要基础理论课。
它是从物质的物理现象和化学现象的联系入手探求化学变化基本规律的一门科学。
物理化学课程的主要内容包括化学热力学(统计热力学)、化学动力学、电化学、界面化学与胶体化学等。
要求考生熟练掌握物理化学的基本概念、基本原理及计算方法,并具有综合运用所学知识分析和解决实际问题的能力。
一、考试内容(一)气体1、气体分子动理论2、摩尔气体常数3、理想气体状态图4、分子运动的速率分布5、分子平动能的分布6、气体分子在重力场中的分布7、分子的碰撞频率与平均自由程8、实际气体9、气液间的转变—实际气体的等温线和液化过程10、压缩因子图—实际气体的有关计算(二)热力学第一定律1、热力学概论2、热平衡和热力学第零定律-温度的概念3、热力学的一些基本概念4、热力学第一定律5、准静态过程与可逆过程6、焓7、热容8、热力学第一定律对理想气体的应用9、Carnot循环10、Joule-Thomson效应-实际气体的DU和DH11、热化学12、赫斯定律13、几种热效应14、反应焓变和温度的关系—Kirchhoff定律15、绝热反应—非等温反应(三)热力学第二定律1、自发过程的共同特征—不可逆性2、热力学第二定律3、Carnot定理4、熵的概念5、Clausius不等式与熵增加原理6、热力学基本方程与T-S图7、熵变的计算8、熵和能量退降9、热力学第二定律的本质和熵统计意义10、Helmholtz自由能和Gibbs自由能11、变化的方向和平衡条件12、DG的计算示例13、几个热力学函数间的关系14、热力学第三定律与规定熵(四)多组分体系热力学及其在溶液中的应用1、多组分系统的组成表示法2、偏摩尔量3、化学势4、气体混合物中各组分的化学势5、稀溶液中的两个经验定律6、理想液态混合物7、理想稀溶液中任一组分的化学势8、稀溶液的依数性9、活度与活度因子10、分配定律—溶质在两互不相溶液相中的分配(五)相平衡1、多相体系平衡的一般条件2、相律3、单组分体系的相平衡4、二组分体系的相图及其应用5、三组分体系的相图及其应用(六)化学平衡1、化学反应的平衡条件和化学反应的亲和势2、化学反应的平衡常数与等温方程式3、平衡常数的表示式4、复相化学平衡5、标准摩尔生成吉布斯自由能6、温度、压力及惰性气体对化学平衡的影响7、同时化学平衡8、反应的耦合9、近似计算(七)统计热力学基础1、概论2、玻兹曼统计3、配分函数4、各配分函数的求法及其对热力学函数的贡献5、分子的全配分函数6、用配分函数计算和反应的平衡常数(八)电解质溶液1、电化学的基本概念与电解定律2、离子的电迁移和迁移数3、电解质溶液的电导4、电解质的平均活度和平均活度因子5、强电解质溶液理论简介(九)可逆电池的电动势及其应用1、可逆电池和可逆电极2、电动势的测定3、可逆电池的书写方法及电动势的取号4、可逆电池的热力学5、电动势产生的机理6、电极电势和电池的电动势7、电动势测定的应用(十)电解与极化作用1、分解电压2、极化作用3、电解时电极上的竞争反应4、金属的电化学腐蚀、防腐与金属的钝化5、化学电源(十一)化学反应动力学基础1、化学反应速率表示法和速率方程2、具有简单级数的反应3、几种典型的复杂反应4、温度对反应速率的影响5、链反应6、碰撞理论7、过渡态理论8、单分子反应理论9、在溶液中进行的反应10、光化学反应11、催化反应动力学(十二)表面物理化学1、表面吉布斯自由能和表面X力2、弯曲表面下的附加压力和蒸气压3、溶液的表面吸附4、液-液界面的性质5、L-B膜及生物膜6、液-固界面现象7、表面活性剂及其作用8、固体表面的吸附9、气-固相表面催化反应(十三)胶体分散系统和大分子溶液1、胶体和胶体的基本特性2、溶胶的制备和净化3、溶胶的动力性质4、溶胶的光学性质5、溶胶的电学性质6、双电层理论和x电位7、溶胶的稳定性和聚沉作用8、乳状液9、凝胶10、大分子溶液11、Donnan平衡和聚电解质溶液的渗透压二、考试要求(一)气体了解气体分子运动公式的推导过程,建立微观的运动模型。
中科院2009年有机化学试题和答案
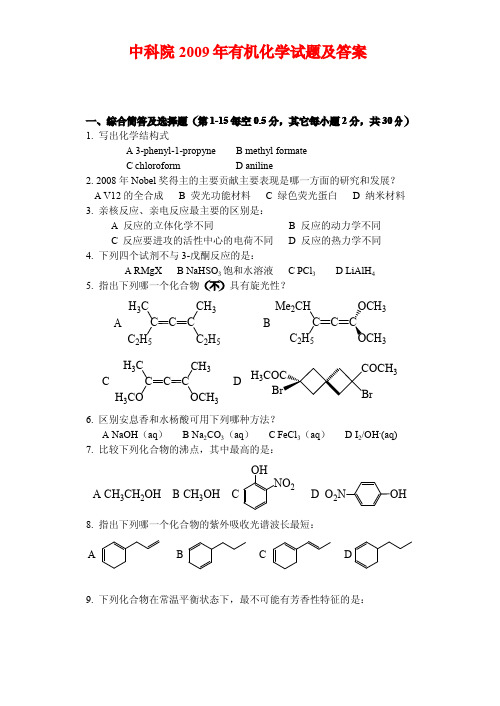
D 苯胺 5. B 10. D
6. C 11. B
2A
1. N
+
CuLi
H 2B H3C
PhCH2 4.
3. OHC
CH2OCH3
Ο
CH3
5. Ο Br 7. O
Ο 6. O
8. MeO Ο
Η 9A H
H 9B H Ph 11A HD H 12. OH
Ο 14A
三、 1. 保护酮羰基后将酯基还原。 2. Gomberg-Bachmann 芳基化:
) 下 列 反 应
R-CH2-R'
R' Ο
OH R''O
( 6 分
+ R''OH + CO2↑
4.
中
A
、
Me Et NHNH Et H + Me NHNH Me
+
H2N Me H2N Et + H2N Me + Et
NH2
NH2 Et NH2
B、C
三种产物不能全部得到, 请判断哪一些化合物不能得到, 并写出合适的反应 机理说明此实验结果。
NH2
5. 很典型的逆 Dieckmann 缩合:
O EtOO
CH3 CO2Et
EtO
O-
CH3 CO2Et
EtO
O
CH3 CO2Et
O
OEt CO2Et
EtO H3C
OCO2Et -EtO
H3C
CO2Et
四、推测结构 1. A 的不饱和度=3,吸收 1mol 氢表明含一个双键、一个环和一个羰基 (1745) ; B 的氘交换表明有三个α氢;甲基在 A 中为单峰表明它连在双 键上,氢化后有一个相邻氢,所以 C 中为双峰;Baeyer-Villiger 氧化发生在 取代较多的一侧。各化合物的结构如下:
中科院应化所考博真题2009高等物理化学及答案

中国科学院长春应用化学研究所二ОО九年攻读博士学位研究生入学试题高等物理化学一、选择题(每小题2分,共40分)1. 定温定压下,一定量纯物质由气态变为液态,则系统和环境的熵变为:()A. S∆系> 0,S∆环< 0B. S∆系< 0,S∆环> 0C. S∆系< 0,S∆环﹦0D. S∆系> 0,S∆环﹦02. 一定量组成一定的均相系统,无非体积功且定温时,其吉布斯函数随压力的增大而:()A. 增大B. 减小C. 不变D. 无法确定3. 20℃时,相同浓度(均为0.005 mol·kg-1)的LaCl3、CaCl2和KCl 三种电解质水溶液,离子平均活度因子由大到小的顺序是:()A. LaCl3>CaCl2>KCl B. LaCl3>KCl>CaCl2C. CaCl2>LaCl3>KClD. KCl>CaCl2>LaCl34. Al(NO3)3,Mg(NO3)2和NaNO3对AgI水溶胶的聚沉值分别为0.067 mol·dm-3,2.6 mol·dm-3和140 mol·dm-3,则该AgI溶胶是:()A. 正溶胶B. 胶粒呈电中性C. 负溶胶D. 无法确定5. 某平行反应含有主、副两个反应,主反应的产物为Y,活化能为E;1副反应产物为Z,活化能为E,且1E>2E,则升高温度:()2A. 对生成Y有利B. 对生成Z有利C. 无影响D. 无法确定6. 水平放置的粗细均匀的毛细玻璃管中有一段汞柱,当在玻璃管右端稍稍加热时,管中汞柱将:()A. 向左移动B. 向右移动C. 不移动D. 无法确定7. 与分子运动空间有关的分子运动的配分函数是:()A. 振动配分函数B. 转动配分函数C. 平动配分函数D. 前三个配分函数均与分子运动空间无关8.在下面过程中,系统内能变化不为零的是:()A.不可逆循环过程 B. 可逆循环过程C.纯液体的真空蒸发过程 D. 理想气体的自由膨胀过程9.2mol C2H5OH(l)在正常沸点完全变为蒸气时,一组不变的热力学函数是:()A.内能、焓、系统的熵变 B. 温度、总熵变、吉布斯函数变C.温度、压力、定压热容 D. 内能、温度、吉布斯函数变10.在85℃及101.3kPa压力下,过冷的H2O(g)变为H2O(l)时,应该是()A.ΔS系<0,ΔH>0,ΔG<0 B. ΔG<0,ΔU<0,ΔH<0C.ΔH<0,ΔU>0,ΔS系<011.理想气体在自由膨胀过程中,其值都不为零的一组热力学函数变化是:()A.ΔU、ΔH、ΔS、ΔV B. ΔS、ΔA、ΔV、ΔGC.ΔS、ΔV、ΔT、ΔG12.当发生极化现象时,两电极的电极电动势发生如下变化:()A .E (阳)变大,E (阴)变小 C. 两者都变大C .E (阳)变小,E (阴)变大 D. 两者都变小13.下列说法中不正确的是:( )A.任何液面都存在表面张力B.弯曲液面的表面张力方向指向曲率中心C.平面液体没有附加压力D.弯曲液面的附加压力指向曲率中心14.气体在固体表面发生等温吸附时:( )A .ΔS >0 B. ΔS <0 C. S =0 D. ΔS ≥015.液体在毛细管中上升的高度反比于:( )A .温度 B. 毛细管半径 C. 液体的粘度 D. 大气压力16. 热力学基本方程d G =-S d T +V d p 可运用于下述何种过程:( )A. 298K ,p 的H 2O(l )蒸发过程B. 理想气体向真空膨胀过程C. 电解水制取H 2D. N 2(g)+3H 2(g)→2NH 3(g)未达平衡17. 如果规定标准氢电极的电极电势E {H +│H 2}=1V ,则其他电极的氢标可逆还原电极电势E {离子│电极}值与电池标准电动势cell E 值将有何变化:( )A. E {离子│电极}与cell E 各增加1VB. E {离子│电极}增加1V ,cell E 不变C. E {离子│电极}与cell E 各减小1VD. E {离子│电极}减小1V ,cell E 不变18. 243Al (SO )的化学势为μ,3Al +、24SO +的化学势分别为μ+、μ-。
2009年攻读博士学位研究生考试试题-中国科学院研究生院

2009年招收攻读博士学位研究生入学统一考试试题科目名称:自然地理学考生须知:1.本试卷满分为100分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
一、名词解释(每题4分)1、变质作用2、河流阶地3、冰期与间冰期4、顶级群落二、简答题(每题8分)1、简述大陆与海洋的热力差异。
2、简述土壤的氧化还原反应与表征。
3、简述东亚季风和西南季风的形成及其差别。
三、问答题(任选三题,每题20分)1、试述河流与自然地理各要素的相互影响。
2、试述我国湖泊分布特点及其面临的主要问题。
3、试述自然区划的一般原则与方法。
4、试述生态系统物质循环过程与类型。
科目名称:自然地理学第1页共1页2009年招收攻读博士学位研究生入学统一考试试题科目名称:生态学考生须知:1.本试卷满分为100分,全部考试时间总计180分钟。
2.所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
一、名词解释(每题2分)1、生态位2、捕食食物链3、生物量锥体4、限制因子定律5、Meta种群6、生境破碎化7、底栖生物 8、下行效应二、简答题(每题8分)1、一种生物进入新的栖息地,自然种群的数量变动将会经过哪些过程,直至保持相对稳定或灭亡?2、请简述现代生态学的主要特点。
3、简述水体污染物的主要污染源和重要污染物。
三、问答题(任选三题,每题20分)1、全球气候变化是当今生态学研究中的热点,你认为目前地球气候是在变暖还是变冷?请你预测全球气候变化对湖泊等内陆水体生态系统的可能影响。
2、为什么说,在生态对策理论连续体系(K对策和r对策的生态特征)面前,密度制约因素与非密度制约因素对种群的调节作用是可以统一的?3、阐述湖岸或海岸生态系统的重要性。
4、从生态系统的角度谈谈人口增长对环境的影响。
科目名称:生态学第1页共1页2009年招收攻读博士学位研究生入学统一考试试题科目名称:环境化学考生须知:1.本试卷满分为100分,全部考试时间总计180分钟。
2012中科院物理化学甲真题(回忆版) (1)

本人报的是物理化学专业,专业课有机化学还有物理化学第一大题的条件是在298K下一个标准大气压,求1mol氮气的平动配分函数,平动熵,海姆赫兹函数,以及平动恒容热熔。
第二大题,求氨和氧气反应的一个反应方程式在1073K下的反应平衡常数,题目给了298K 时的相关物质的摩尔生成焓变及熵。
(比较初级,就是计算有些小技巧)第三大题,相图,很简单。
只是让表明各相区都是什么,还有每条曲线,两条三相线代表什么。
基本都是课后的习题变体第四大题,动力学,题目大致为:A,B两种物质,等摩尔参加反应。
反应进行1h后,A 物质有75%参加反应。
当反应进行2h后,求在下列不同情况下A物质在有多少未参加反应。
(1)反应对A是一级反应,对B是零级反应(2)反应对A和B均是一级反应(3)反应对A和B均是零级反应(4)在(3)的情况下A物质完全参加反应需要多长时间。
第五大题:溶液依数性(渗透压,沸点,蒸汽压的计算),题目大意是告诉了你凝固点的降低常数还有沸点升高常数,以及水在25℃的饱和蒸汽压,然后加了一定量(定值,具体我给忘了)的非挥发性溶质。
起凝固点降低了一定值(原题有给定值),试求(1)该溶液的正常沸点为多少?(2)求该溶液的饱和蒸汽压(3)求该溶液(假设为理想溶液)的渗透压第六大题,电化学,考到了公式的推导以及实验的相关原理题目大意:给出了Ag|Agcl|HCl(m)|H2(P)的电池。
(1)写出该电池的电极反应,电化学反应方程式(2)试推导该电池的电动势表达式(3)如何用用电动势法测量氯化银标准电极电势。
需要知道哪些数据第七大题:电化学和热力学综合题目大意:已知某化学反应方程式,在298K,100KP下进行1mol时。
放热40Kj。
在可逆电池中进行时则吸热4KJ.(1)求该反应的熵变(2)求该过程系统和环境的总熵变(3)求该过程可以做的最大功小题的分布比较泛泛。
一般的偏的都有涉及,需要比较牢固的理论知识地基。
特备的注重细节的知识点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国科学院研究生院2009年招收攻读硕士学位研究生入学统一考试试题科目名称:物理化学(甲)考生须知:1. 本试卷满分为150分,全部考试时间总计180分钟。
2. 所有答案必须写在答题纸上,写在试题纸上或草稿纸上一律无效。
3. 可以使用不带储存功能的计算器。
下列一些基本常数供解题时参考:普朗克常数h=6.626×10-34J·S ; 玻兹曼常数k B=1.381×10 -23J·K-1摩尔气体常数R=8.314J·mol-1·K-1 ; 法拉第常数F=96500C·mol-1一、是非题(每小题1分,共15分)(判断下列各题是否正确,正确用“√”表示,错误用“×”表示)1. 某气体状态方程为p=f(V)T,f(V)只是体积的函数,恒温下该气体的熵随体积V的增加而增加。
2. 在恒温恒压不做非体积功的情况下,△H>0,△S>0的过程不一定能自发进行。
3. 已知X和Y可构成固溶体。
在X中随着加入Y可使系统的熔点升高,则Y在固溶体中的含量比Y在液相中的含量低。
4. 稀溶液的依数性是指在指定溶液的种类和数量后,其性质仅取决于所含溶质分子的数目,而与溶质的本性无关。
5. 在非理想液态混合物中,正规混合物的非理想性是完全由混合热效应引起的。
6. 多孔硅胶具有强烈的吸水性能,这表明自由水分子的化学势较吸附于硅胶表面的水分子的化学势为低。
7. 在一定温度下,分子的平动,振动及转动的能级间隔大小顺序为:振动能>转动能> 平动能。
8. 原电池的电动势等于构成电池的各相同的各个界面上所产生的电势差的代数和。
9. 工业上用电解食盐水制造NaOH的反应为:2NaCl+2H2O 电解2NaOH+H2(g)+Cl2(g),阴极反应为:2NaCl+2e- 2Na+ + Cl2(g)。
10. 碰撞理论中的阈能Ec是与阿伦尼乌斯活化能Ea在数值上必须相等,碰撞才是有效的。
11. 假设晶体上被吸附的气体分子间无相互作用,则可把该气体系统视为定阈的独立子系统。
12. 在统计热力学中,零点能(基态分子的能量)的选择可影响Gibbs函数G的值。
13. 绝大多数液态物质的表面张力都是随着温度的升高而逐渐地趋于极大值。
科目名称:物理化学(甲)第1页共6页14. 反应级数只能是0或正整数。
15. 正常人体中,血液的糖分高于尿中的糖分,这是由于肾脏的渗透功能阻止血液中的糖分进入尿 液。
二、选择题(60分)(1-24题为单选题,每小题3分,共48分,25-28题为多选题,每小题3分,共 12分)1. 在同一温度下,某气体物质的摩尔定压热容C p,m 与摩尔定容热容C v,m 之间的关系为:(A)C p,m <C v,m (B)C p,m >C v,m (C)C p,m =C v,m (D)难以比较2. 基尔霍夫定律dT B T T H H C v m p B )(,1221⎰∑+∆=∆,由T 1下的△H 1计算T 2下的△H 2: (A)只能直接用于反应物和产物都为气体的化学反应过程(B)能直接用于任何化学反应过程(C)只能直接应用于等压过程中无相变,无其他功的化学反应过程(D)只能用于均相体系在等压下的反应过程3. 下列各种函数中,那一种是广度性质:(A)若L=L(T,p,n 1,n 2,…),则λL=0(λ为常数)(B)若L=L(T,p,n 1,n 2,…),则L=L(T,p,λn 1,λn 2,…)(C)若L=L(T,p,n 1,n 2,…),则λL=L(T,p,λn 1,λn 2,…)(D)若L=L(T,p,n 1,n 2,…),则λ2L=L(T,p,λn 1,λn 2,…)4. 一个纯物质的膨胀系数111⨯=⎪⎭⎫ ⎝⎛∂∂=VT V V P α m 3·K -1(T 为绝对温度),则该物质的摩尔恒压热容Cp 将:(A)与体积V 无关 (B)与压力p 无关(C)与温度T 无关 (D)与V,T,p 均有关5.H 2O (l,373K ,p 0)蒸发为气体 H 2O (g,373K,p 0),判断该过程能否发生,可用判断的依据是(A) △H (B)△G (C) △U (D)△S (体系)+△S (环境)6.在一个简单(单组分,单向,各项同性)封闭体系中,恒压只做体积功的条件下,内能随温度升高作如何变化? (A) p T U )(△△>0 (B) p TU )(△△<0 (C) p T U )(△△=0 (D) 具体体系情况而定 7.某物质的偏摩尔熵S B 与下列哪个式子相等:科目名称:物理化学(甲) 第2页 共 6页D ,大致是-[]C ,P,,)T /G (n T n B nP ∂∂∂∂8.在一容器内(由体积相等的两部分构成),置入1mol 理想气体。
这1mol 理想气体分子全部处在其中任意一部分的数学概率等于:(A)(1/2)N 0 (B)02N (C) (1/2)N 0 (D)2N 0 9.一气体的化学势为()⎪⎪⎭⎫ ⎝⎛+=P RT T f B B B 0ln o μμ,其标准态为: (A)f B =1的状态 (B)273.15K ,101.325kPa 下该气体的状态(C)温度为T ,压力为P→ 0时,该气体的状态(D)温度为T ,压力为101.325kPa ,该气体假想为理想气体的状态10.物质A 和B 组成的溶液中,n A =0.6.在恒温恒压下,把无限小量的A 或B 或者两者都加入溶液,所引起的偏摩尔体积的无限小改变量之间的关系是:(A)d V A :d V B =3/2 (B)d V A :d V B =-3/2(C)d V A :d V B =-2/3 (D)d V A :d V B =1/311.理想气体B 的化学势可以表示为()⎪⎪⎭⎫ ⎝⎛+=P RT T p B B B 0ln 0μμ,式中p B 0: (A)只与p 有关 (B)只与气体B 的本性有关(C)除了与B 的本性有关外,只是温度的函数(D)是T ,p 的函数12.在313.15K ,100g 水中加入氧气达平衡后,液面上蒸汽压p=39200Pa,已知氧气在水中的henry 系数K=7.61×109 Pa, 313.15K 时,水中溶解氧气质量为(A) 1.53×10?g (B)4.92g (C) 5.724×10?g (D)2.062×10?g13.平衡常数Kθ与温度T 关系为d lnK o /dT = △r H m 0/RT 2,则温度升高时,K o(A)增大 (B)减小 (C)不变 (D)不能判断14.对于理想混合物反应体系,标准反应自由能与平衡常数之间的关系式,下列不正确的是(A) o o m K RT rG ln -=△ (B)o c o m K RT rG ln -=△(C)o po m K RT rG ln -=△ (D)o a o m K RT rG ln -=△ 科目名称:物理化学(甲) 第3页 共 6页15.温度T 时反应H 2O(g)= H 2(g)+21 O 2(g)的平衡常数为K P1,反应CO 2(g)= CO(g)+21 O 2(g)的平衡常数为K P2,同温度下CO(g)+ H 2O(g)= CO 2(g)+ H 2(g)的平衡常数K P3(A)K P1+K P2 (B ) K P1K P2(C) K P1/K P2 (D)K P2/K P116.液态氧相对气态氧的标准自由能为4795 J·mol -1,25度时其饱和蒸汽压为多少kPa:(A)101.3 (B)202.6 (C)303.9 (D)701.617.某药物分解反应为一级反应,37℃时,反应速率常数k 为0.46 h -1,若服用该药物0.16g ,问该药物在胃里停留多长时间方可分解90%?(A)3h (B)5h (C)4.6h (D)6h18.升高温度可以提升反应速率,主要原因是:(A) 增加分子总数 (B)增加活化分子总数(C)降低反应活化能 (D)使反应向吸热方向移动19.直链羧酸通式为CH 3(CH 2)n COOH ,当n 增大时,预计羧酸在极性溶剂如水中的溶解度将 ,在非极性溶剂中的溶解度将 。
(A)减小 增大 (B)增大 减小 (C)减小 减小 (D)增大 增大20.同一体系的p-x 图上最高(或最低)点的组成与T-x 图上的最低(或最高)点的组成的关系是:(A)一定相同 (B)一定不同 (C)不一定相同 (D)上述均不对21.对于二组分溶液,0)/ln (<T A y p ∂∂,即气相中A 组分浓度增加,则总压降低,说明对于组分A,其气相中的浓度与液相中的浓度比:(A)大于1 (B)等于1 (C)小于1 (D)无法确定22.忽略CO 和N 2的振动运动对熵的贡献,则CO 和N 2的摩尔熵的大小关系是:(A) S m (CO)>S m (N 2) (B) S m (CO)<S m (N 2)(C) S m (CO)=S m (N 2) (D)无法确定23.下列对转动配分函数计算式的对称数σ差别理解不对的是:(A)对配分函数的修正 (B)对粒子等同性的修正(C)对量子态等同性的修正 (D)对转动量子数的修正24.当用三角形相图表示X,Y,Z 的三组分系统时,物系点在通过X 点的一条直线上变动时,则此物系的特点是(A)Y 与Z 的百分含量之比不变 (B)X 的百分含量不变(C)Y 的百分含量不变 (D)Z 的百分含量不变25.以下说法不正确的是:(A)热容是体系的宏观性质(B)由理想气体的C p 可以计算它的焓变△H=C p (T 2-T 1)(C)C p ,m 与气体的本性有关且随温度变化(D)理想气体由温度T 1升高到T 2的过程吸热Q=C p (T 2-T 1)(E)对于气体C p ,m > C V ,m26.以下说法中,符合热力学第二定律的是(A )不可能将海洋中蕴藏的能量转化为功(B )体系可以从单一热源吸热并将所吸的热全部转化为功(C )对于在温度T 1,T 2间操作的理想热机,如用水代替理想气体作为工作物质,则热机效率下降(D )实际过程一定是热力学不可逆过程(E )不可能把热从低温物体传到高温物体27.反应CO (g )+ 1/2 O 2(g )= CO 2(g )为放热反应,并在一定条件下达到平衡,根据范特霍夫公式,可以判断当温度升高时:(A )反应向生成产物的方向移动 (B )反应向生成反应物的方向移动(C )正向反应平衡常数增大 (D )逆向反应平衡常数增大(E )反应的焓变增大或减小28.丁达尔现象中散射光的强度I(A )与粒子浓度成正比 (B )与入射光波成反比(C )与入射光波长四次方成反比 (D )与胶粒大小无关(E )与入射光强度的平方成正比三.计算题和简答题(75分)1.(5分)用开尔文方程解释:(1)喷雾干燥加快液体汽化速率 (2)毛细管凝聚现象2.(6分)试由V V T U C )/(∂∂=)和 2,ln []V N q U kT T∂=∂ 出发,推证对单原子理想气体 R C m V 23,= 3.(6分)已知浓度为0.001 mol/L 的Na 2SO 4溶液的电导率为0.026 S·cm 2,当该溶液饱和了CaSO 4以后,电导率上升为0.070 S·cm 2,求CaSO 4的活度积(已知Na +与1/2Ca 2+的摩尔电导率分别为5.0×10-3和6.0×10-3 S·cm 2· mol -1)4.(6分)有一金溶胶,胶粒半径为r=3×10-8 m ,25℃时,在重力场中沉降平衡,在某一高度处单位体积中有166个粒子,计算比该高度低10-4 m 处单位体积中的粒子数为多少(已知金密度193 00kg/m 3,介质密度1000kg/m 3)5.(5分)在300K 和100Kpa 下,用惰性电极电解水以制备氢气。
