22钠的化合物
钠及其化合物PPT

(3) (3)焰色系元指素_____的焰色,物属_理_____变
化。
精选版课件ppt
29
(2006年全国理综I、28).(15分)
在呼吸面具和潜水艇中可用过氧化纳作为供氧剂。请选用适当的化学试剂和实验用品、
用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
2、将Na、Mg、Al各0.3mol分别放入100mL1mol/L的盐酸中,
同温同压下产生的气体体积比是( )C
A、1:2:3
B、6:3:2
C、3:1:1
D、1:1:1
精选版课件ppt
32
练习:
1、某种H2和CO的混合气体,其密度为相同条件下O2密度的
1/2,将3.2g这种混合气充入一盛有足量Na2O2的密闭容器
结构
性质
制取 保存 应用
物理性质 化学性质
精选版课件ppt
2
教材回顾:
一、Na
碱
钠的氧化物
金 二、钠的化合物 NaOH
属
NaCl Na2CO3和NaHCO3
三、碱金属元素
精选版课件ppt
3
一、钠的性质
(一)、钠的物理性质
钠是 银白 色金属,具有金属光泽,质地
,
可以柔用软刀切割,密度
,熔点小
,是热
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
与酸反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+2H2O+O2↑
类别
钠及其化合物的化学方程式和离子方程式

化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O 14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O一、镁1、镁在氧气中燃烧:2Mg+O22MgO2、镁在氯气中燃烧:Mg+Cl2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H+Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O 3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2Cl-+Ag+AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2OMgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2OMg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO2↑+H2O一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al +3Cu 2+2Al 3++3Cu10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓Al 3++3OH-Al(OH)3 ↓冰晶石电解4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl 3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓瑟瑟严冬,窗外雪飘,絮絮自语说了这多,你可懂我了吗?若你知晓,无需说话,只报一声心灵的轻叹,那,便是我的花开春暖。
化学必修1化学方程式

化学必修1化学方程式化学必修1化学方程式一、钠及其化合物1. 钠在空气中燃烧:2Na +O 2点燃Na 2O 22. 钠在氧气中燃烧:4Na +O 22Na 2O3. 钠与水反应:2Na +2H 2O=2NaOH+H 2↑4. 氧化钠与水反应:Na 2O +H2O=2NaOH5. 过氧化钠与水反应:2Na 2O 2+2H 2O=4NaOH+O 2↑6. 氧化钠与盐酸反应:Na 2O +2HCl=2NaCl+H 2O7. 钠与盐酸反应:2Na +2HCl=2NaCl+H 2↑8. 氧化钠与二氧化碳反应:Na 2O +CO 2=Na2CO 3 9. 过氧化钠与二氧化碳反应: 2Na 2O 2+2CO 2=2Na2CO 3+O 2 10. 电解氯化钠(工业制钠):2Na Cl 11. 碳酸钠与水和二氧化碳反应: Na 2CO 3+H 2O +CO 2=2NaHCO3 12.碳酸氢钠遇热分解:△点燃通电2Na+Cl2↑2NaHCO 3 Na 2CO 3+H 2O +CO 2↑ 13.碳酸氢钠与氢氧化钠反应:NaHCO 3+NaOH=Na2CO 3+H 2O 14. 碳酸钠与盐酸反应:Na 2CO 3+2HCl=2NaCl+H 2O +CO 2↑ Na 2CO 3+HCl=NaHCO3;NaHCO 3+HCl=NaCl +H 2O +CO 2↑ 15. 碳酸氢钠与盐酸反应:NaHCO 3+HCl=NaCl +H 2O +CO 2↑16. 碳酸钠与氯化钙反应:Na 2CO 3+C a Cl2=CaCO3↓+2NaCl 17. 候氏治碱法:①NaCl+NH3+CO 2+H 2O=NaHCO3+NH 4Cl;△②HCO 3Na 2CO 3+H 2O +CO 2↑18. 钠与四氯化钛反应:TiCl 4+4Na 700℃~800℃Ti+4NaCl19. 钠与硫酸铜溶液反应:①有水环境下:2Na +2H 2O=2NaOH+H 2↑; NaOH+CuSO4=Cu (OH) 2+Na 2SO 4 ②熔融条件下:Na +CuSO4熔融Cu+Na2SO 420. 钠与硫反应:Na +SNa 2S 二、铝及其化合物的转化关系△研磨1. 高温灼烧氢氧化铝:2Al(OH)3Al 2O 3+3H 2O2. 电解氧化铝:Al 2O 34Al+3O2↑3. 铝与盐酸反应:2Al +6HCl=2AlCl3+3H 2↑4. 铝与氢氧化钠反应:2Al +2NaOH +2H 2O=2NaAlO2+3H 2↑5. 铝与稀硫酸反应:2Al+3H2SO 4=Al 2(SO4) 3+3H 2↑6. 氧化铝与盐酸反应:Al 2O 3+6HCl=2AlCl3+3H 2O7. 氧化铝与氢氧化钠反应:Al 2O 3+2NaOH=2NaAlO2+H 2O 8. 氧化铝与稀硫酸反应:Al 2O 3 +3H2SO 4=Al 2(SO4) 3 +3H 2O9. 氯化铝与氨水反应(实验室制氢氧化铝): AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4Cl 10. 往氯化铝中滴加氢氧化钠至过量:(先有白色沉淀,后沉淀逐渐溶解)①AlCl 3+3NaOH=Al(OH)3↓+3N a Cl ;②Al(OH)3+NaOH = NaAlO2+2H 2O 11. 往氢氧化钠中滴加氯化铝至过量:(先无现象,后有白色沉淀)①AlCl 3+4NaOH = NaAlO2+3NaCl +2H 2O ;②3NaAlO 2+6H 2O+AlCl3 = 4Al(OH)3↓+3N a Cl 12. 偏铝酸钠与盐酸反应:NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 若盐酸过量:NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl ;通电②Al(OH)3↓+HCl=AlCl3+3H 2O 13. 偏铝酸钠与二氧化碳反应:NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3 14. 铝还原氧化铁(焊接铁轨): 2Al+Fe2O 32Fe (铁水)+Al2O 3(铝热反应)三、氯及其化合物的转化关系1. 铁在氯气中燃烧:2Fe +3Cl 2 2FeCl 3(棕褐色烟)点燃2. 铜在氯气中燃烧:Cu +Cl 2 CuCl 2(棕黄色烟)高温点燃3. 氢气在氯气中燃烧:H 2+Cl 2 H 2+Cl 2点燃2HCl (苍白色火焰)光2HCl (会发生爆炸)4. 实验室制氯气(浓盐酸与氧化锰反应): MnO 2+4HCl(浓)△MnCl 2+Cl 2↑+2H 2O5. 工业制氯气(电解饱和食盐水) : 2NaCl+2H 2O通电2NaOH+H 2↑+Cl 2↑(氯碱工业)6. 氯气溶于水:Cl 2+H 2O ? HCl +HClO7. 次氯酸遇光分解:2HClO8. 氯气与氢氧化钠反应:Cl 2+2NaOH = NaCl+NaClO +H 2O (吸收氯气尾气)光照2HCl +O 2↑9. 氯气与氢氧化钙反应:2Cl 2+2Ca(OH)210. 2 Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO3) 2+2HClO 11. 氯气与碘化钾反应:Cl 2+2KI=I2 +2KCl(检验氯气) 四、铁及其化合物的转化关系1. 铁与水反应:气态) +3Fe高温Fe 3O 4+4H 2点燃2. 铁在氧气中燃烧:3Fe +2O 2 Fe 3O 43. 铁和盐酸反应:Fe +2HCl=FeCl2+H 2↑4. 铁和稀硫酸反应: Fe+H2SO 4 = FeSO4+H 2↑5. 铁和氯化铁反应:Fe +2FeCl 3 =3FeCl2 6. 铁和氯化铜反应:Fe +2C u Cl 2=FeCl 2+Cu(制造电路板) 7. 铁在氯气中燃烧:2Fe +3Cl 2 =2FeCl 38. 氯化亚铁和氯气反应:2FeCl 2+Cl 2 = 2FeCl3 9. 氯化亚铁和氢氧化钠反应:(白色沉淀迅速变成灰绿色,最后变成红褐色)①FeCl 2+;②4Fe(OH)2+O 2+2H 2 (氢氧化亚铁被氧化)10. 氯化铁氢氧化钠反应:FeCl 3+3NaOH = Fe(OH)3↓+3NaCl 11. 氢氧化亚铁与盐酸反应: Fe(OH)2+2HCl = FeCl2+2H 2O12. 氢氧化铁与盐酸反应:Fe(OH)3+3HCl = FeCl3+3H 2O 13. 氧化铁与盐酸反应:Fe 2O 3+6HCl = 2FeCl3+3H 2O14. 四氧化三铁与盐酸反应:Fe 3O 4+8HCl =2FeCl 2+FeCl 3+4H 2O15. 氧化亚铁与盐酸反应:FeO +2HCl =FeCl 2+H 2O△16. 一氧化碳还原四氧化三铁:Fe 3O 4+4CO 17. 一氧化碳还原氧化铁: Fe 2O 3 +3CO3Fe +4CO 2 2Fe +3CO 2△18. 高温煅烧氢氧化铁:2Fe(OH)319. 铁在高温条件下与浓硫酸反应:△高温Fe 2O 3+3H 2O2Fe+6H2SO 4(浓) 2(SO 4)3+3SO 2↑+6H 2O△常温下,铝,铁遇浓硫酸,浓硝酸被钝化,表面形成一层致密的氧化膜,阻止反应的进一步进行。
22钠的化合物

钠的化合物班级姓名学号【学习目标】1.通过比较的方法掌握钠的重要化合物如氧化物、碳酸盐的性质2.了解碳酸钠及碳酸氢钠的一些用途【新课】一. 钠的氧化物【复习回顾】写出在不同条件下金属钠和氧气的反应方程式【知识扩充】 Na2O2的性质及用途过氧化钠常用于特殊情况下的供氧(如呼吸面具及潜水艇中),因为过氧化钠能与CO2及H2O等物质发生反应生成O2【归纳整理】氧化钠和过氧化钠性质的比较二.碳酸钠和碳酸氢钠的性质比较1.与酸反应【实验1】在放有等量的Na2CO3和NaHCO3的两支相同大小的试管口各套一个盛有等体积等浓度盐酸的小气球,同时将气球中的盐酸倾倒入试管中,比较气球鼓起的速度。
实验现象:反应方程式:【问题思考】生成等质量的CO2需要消耗的Na2CO3和NaHCO3哪个多?反之,相等质量的Na2CO3和NaHCO3的哪一个生成的CO2多?2.稳定性3.溶液的酸碱性【实验2】用PH试纸测定碳酸钠、碳酸氢钠溶液的PH。
现象与结论:4.与盐溶液反应【实验3】在两支试管中分别加入3mL氯化钙溶液,再分别滴加碳酸钠、碳酸氢钠溶液,观察现象。
现象:涉及反应方程式:5.与碱反应【实验4】在两支试管中分别加入3mL氢氧化钙溶液,再分别滴加碳酸钠、碳酸氢钠溶液,观察想象。
现象:涉及反应方程式:【归纳与总结】碳酸钠和碳酸氢钠的性质比较1.如何除去固体Na2CO3中混有的NaHCO3?2.如何除去NaHCO3溶液中混有的Na2CO3?3.如何检验NaHCO3溶液中混有的Na2CO3?4.如何检验Na2CO3溶液中混有的NaHCO3?三.侯德榜制碱法的原理四.钠的化合物用途【当堂训练】1.关于Na2CO3和NaHCO3下列比较正确的是()①相同温度下,Na2CO3的溶解度比NaHCO3大;②Na2CO3的热稳定性比NaHCO3强③相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液的PH值比NaHCO3溶液的PH值大;④等量Na2CO3和NaHCO3分别和盐酸反应,剧烈程度是Na2CO3强于NaHCO3⑤相同质量的Na2CO3和NaHCO3分别和盐酸反应产生的CO2在相同条件下的体积是NaHCO3大于Na2CO3;⑥相同质量的Na2CO3和NaHCO3分别和盐酸反应产生的CO2在相同条件下的体积是Na2CO3大于NaHCO3;A.①②③④⑤⑥ B.①②③⑤ C.①③④⑤ D.①②③【巩固练习】一、选择题1.碳酸钠具有的用途是 ( )①作发酵粉;②造纸;③制皂;④治疗胃酸过多;⑤纺织。
钠及其化合物的化学方程式和离子方程式

钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧: 2Na + O 2 Na 2O 22、钠在氯气中燃烧: 2Na + Cl 2 2NaCl3、钠常温条件下和氧气反应:4Na + O 22Na 2O4、钠和硫共热: 2Na +S Na 2S5、钠和水反应: 2Na +2H 2O2NaOH +H 2 ↑2Na +2H 2O2Na ++ 2OH -+H 2 ↑6、钠和稀盐酸反应: 2Na + 2HCl2NaCl + H 2 ↑++2Na + 2H2Na + H 2 ↑7、钠投入到硫酸铜溶液中:2Na + CuSO 4 + 2H 2O Na 2SO 4+Cu(OH)2 ↓+ H 2 ↑2Na + Cu 2++ 2H 2O++ Cu(OH)2 ↓+ H 2 ↑2Na 8、向氯化铝溶液中加入少量的钠:6Na +2AlCl 3+ 6H 2O 6NaCl + 2Al(OH)3 ↓+ 3H 2 ↑6Na + 2Al 3++ 6H 2O +6Na + Al(OH)3 ↓+ 3H 2 ↑ 9、向氯化铝溶液中加入足量的钠:4Na +AlCl 3+ 2H 2O NaAlO 2 +3NaCl + 2H 2 ↑4Na + Al 3+ +2H 2O4Na ++ AlO 2 -+ 2H 2 ↑10、钠在高温条件下与四氯化钛反应: 4Na + TiCl 44NaCl + Ti二、氧化钠1、氧化钠和水反应: Na 2O + H 2O=2NaOH++2OH -Na 2O +H 2 O2Na2、氧化钠与二氧化碳反应:Na 2O + CO 2Na 2CO 33、氧化钠与盐酸反应: Na 2O + 2HCl2NaCl +H 2O+++ H 2ONa 2O + 2H2Na4、向硫酸铜溶液中加入氧化钠:Na 2O +CuSO 4+ H 2OCu(OH)2 ↓+ Na 2SO 42++ H 2OCu(OH)2 +Na 2O + Cu ↓+ 2Na5、向氯化铝溶液中加入少量的氧化钠:3Na 2O + 2AlCl 3+3H 2O 2Al(OH)3 ↓+ 6NaCl3Na 2O +2Al3++3H 2 O +2Al(OH)3 ↓+ 6Na===6、向氯化铝溶液中加入足量的氧化钠: 2Na 2O + AlCl 3 NaAlO 2 +3NaCl2Na 2O +Al 3+AlO 2-+ 4Na+三、过氧化钠1、过氧化钠与水反应: 2Na 2O 2 +2H 2 O4NaOH + O 2 ↑2Na 2O 2+ 2H 2O 4Na + +4OH -+ O 2 ↑===2、过氧化钠与二氧化碳反应: 2Na 2O 2+ 2CO 22Na 2CO 3+ O 2 ↑3、过氧化钠与盐酸反应: 2Na 2O 2 +4HCl4NaCl + 2H 2O + O 2 ↑+++ 2H 2O + O 2 ↑2Na 2O 2+ 4H4Na4、向硫酸铜溶液中加入过氧化钠:2Na 2O 2+ 2CuSO 4+ 2H 2O===2Cu(OH) 2 ↓+2Na 2SO 4+ O 2 ↑2Na 2O 2+ 2Cu 2++ 2H 2O++O 2 ↑2Cu(OH)2 ↓+ 4Na5、向氯化铝溶液中加入少量的过氧化钠:6Na 2O 2+ 4AlCl 3+ 6H 2O4Al(OH)3 ↓+ 12NaCl +3O 2 ↑6Na 2O 2+ 3++ 6H 2O++ 3O 2 ↑4Al 4Al(OH)3 ↓+ 12Na6、向氯化铝溶液中加入过量的过氧化钠:2Na 2O 2+ AlCl 3+ 2H 2O NaAlO 2+ 3NaCl +O 2 ↑2Na 2O 2 +Al 3++ 2H 2OAlO 2-+ 4Na ++ O 2 ↑7、过氧化钠与硫酸亚铁溶液反应:+ 4FeSO + 6H+ O4Na 2O 2 42O4Fe(OH)3 ↓+ 4Na 2SO 42 ↑4Na 2O 2+ 2++ 6H 2O 4Fe(OH)3 ++O 2 ↑4Fe ↓+ 8Na四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H 2O2NaAlO 2+ 3H 2 ↑-+ 2H 2O -+3H 2 ↑2Al + 2OH2AlO 22、氯气通入氢氧化钠溶液中:Cl 2+2NaOHNaCl + NaClO + H 2 OCl 2+2OH ---+ H 2OCl + ClO3、氯气通入热的浓氢氧化钠溶液中: 3Cl 2+ 6NaOH 5NaCl + NaClO 3+ 3H 2O--+ ClO 3 -3Cl 2+ 6OH5Cl +3H 2O4、硫和氢氧化钠溶液共热: 3S + 6NaOH2Na 2S + Na 2SO 3+ 3H 2O-2S2-+ SO 32-+ 3H 2O3S +6OH5、硅溶于氢氧化钠溶液中:Si + 2NaOH + H 2ONa 2SiO 3+ 2H 2 ↑-SiO 32-+2H 2 ↑Si + 2OH + H 2O6、氧化铝溶于氢氧化钠溶液中:Al 2O 3+ 2NaOH 2NaAlO 2+ H 2OAl 2O 3+ 2OH-2AlO 2 -+H 2O7、向氢氧化钠溶液中通入少量的二氧化碳:223+H 2O2NaOH + CONa CO -+ CO 2 CO 32-+ H 2O2OH 8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH + CO 2NaHCO 3--OH + CO 2 HCO 39、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH + SO 2Na 2SO 3+ H 2O -+ SO 2 SO 32-+ H 2O2OH 10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH + SO 2NaHSO 3-+ SO 2-OH HSO 311、五氧化二磷与氢氧化钠溶液反应: P 2O 5+ 6NaOH2Na 3PO 4+ 3H 2OP 2O 5+ 6OH-2PO 43 -+ 3H 2O12、二氧化氮和氢氧化钠溶液反应:2NO 2+ 2NaOH NaNO 2+ NaNO 3+ H 2O2NO 2+2OH-NO 2-+NO 3-+H 2 O13、一氧化氮、二氧化氮和氢氧化钠溶液反应: NO + NO 2+ 2NaOH 2NaNO 2+ H 2 ONO + NO 2+2OH-2NO 2-+ H 2 O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH + SiO 2 Na 2SiO 3+ H 2O2OH -+ SiO 2 SiO 32-+ H 2O 15、三氧化硫和氢氧化钠溶液反应:SO 3+ 2NaOH Na 2SO 4+ H 2OSO 3+2OH-SO 42 -+ H 2O16、盐酸和氢氧化钠溶液反应:HCl + NaOHNaCl + H 2O+-H 2OH + OH17、醋酸和氢氧化钠溶液反应:CH 3COOH + NaOHCH 3COONa + H 2O--CH 3COOH + OHCH 3COO + H 2O18、向氢氧化钠溶液中通入少量的硫化氢:H S +2NaOHNa S + 2H O222H 2S + 2OHS 2-+ 2H 2O-19、向氢氧化钠溶液中通入足量的硫化氢:H 2S + NaOHNaHS + H 2O- -H 2S + OHHS + H 2O20、硫酸和氢氧化钠溶液反应:H 2SO 4+ 2NaOHNa 2SO 4+ 2H 2O+-H 2OH +OH21、磷酸溶液氢氧化钠溶液反应 :H 3 PO 4+ 3NaOHNa 3PO 4+ 3H 2OH 3PO 4+ 3OH-PO 43-+ 3H 2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3 + NaOHNaAlO 2+ 2H 2OAl(OH)3--+ OHAlO 2 + 2H 2O 23、向硝酸银溶液中加入氢氧化钠溶液:AgNO 3+ NaOHAgOH ↓+ NaNO 3+-AgOH ↓Ag + OH24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO 4+2NaOH Na 2SO 4+ Cu(OH)2 ↓Cu 2++2OH-Cu(OH)2 ↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl 3+ 3NaOHFe(OH)3 ↓+ 3NaClFe 3 ++ 3OH-Fe(OH)3 ↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl 3+ 3NaOH Al(OH)3 ↓+ 3NaClAl 3++ 3OH-Al(OH)3 ↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl 3+ 4NaOHNaAlO 2+ 3NaCl + 2H 2OAl--3++ 4OHAlO 2 +2H 2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH 4Cl +NaOHNaCl +NH 3 ↑+ H 2O +-NH 3 ↑+ H 2ONH 4 + OH29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH 4HCO 3+ NaOHNaHCO 3+ NH 3 ↑+ H 2O+-NH 3 ↑+ H 2ONH 4 + OH30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH 4HCO 3+ 2NaOHNa 2CO 3+NH 3 ↑+ 2H 2O+-+OH -CO 3 2-+ NH 3↑+ 2H 2ONH 4 +HCO 331、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO 3+ NaOH Na 2CO 3 +H 2 OHCO 3-+ OH-CO 32 -+ H 2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO 3)2 + NaOH CaCO 3 ↓+ NaHCO 3+ H 2OCa 2++HCO 3-+OH-CaCO 3 ↓+ H 2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO 3)2 + 2NaOH CaCO 3 ↓+ Na 2CO 3+ 2H 2 OCa 2++2HCO 3- +2OH-CaCO 3 +CO 3 2-+ 2H 2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO 3)2+2NaOHMg(OH) 2↓+ 2NaHCO 3Mg 2+ +OH -Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO 3)2 +4NaOH Mg(OH) 2 ↓+ Na 2CO 3+2H 2OMg2++ 2HCO 32- +4OH-Mg(OH)2 ↓+ 2CO 3 2-+ 2H 2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl +AgNO 3AgCl ↓+ NaNO 3-+AgCl ↓Cl + Ag2、氯化钠固体和浓硫酸共热 :NaCl +H 2SO 4 Na 2SO 4 + 2HCl ↑3、电解饱和的氯化钠溶液:2NaCl + 2H 2O2NaOH +H 2 ↑+ Cl 2 ↑--+ H 2 ↑+ Cl 2 ↑2Cl + 2H 2O2OH 4、电解氯化钠的熔融液 :2NaCl 2Na + Cl 2 ↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na 2CO 3+ Ca(OH)2 CaCO 3 ↓+ 2NaOHCO 32- +Ca 2 +CaCO 3 ↓2、碳酸钠溶液与氯化钡溶液混合:Na 2CO 3+ BaCl 2 BaCO 3 ↓+ 2NaClCO 32- +Ba 2 +BaCO 3 ↓3、碳酸钠溶液呈碱性: Na 2CO 3+ H 2ONaHCO 3+NaOHCO 32-+H 2OHCO 3-+ OH-4、碳酸钠溶液滴入少量的盐酸:Na 2 CO 3+ HClNaHCO 3+NaClCO 3 +-2-+ H HCO 35、碳酸钠溶液滴入足量的盐酸:Na 2 CO 3+2HCl 2NaCl + CO 2 ↑+ H 2OCO 32-+ 2H+CO 2 ↑+ H 2O6、碳酸钠溶液中加入醋酸:Na 2CO 3+ 2CH 3COOH 2CH 3COONa + CO 2 ↑+ H 2OCO 3 2-+ 2CH 3COOH-+ CO 2 ↑+ H 2O2CH 3COO7、碳酸钠溶液中通入二氧化碳气体: Na 2 CO 3+ CO 2+H 2 O2NaHCO 3CO3 2--+ CO2+ H2O2HCO38、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+H2O2NaHCO32Na++CO32-+ CO2+ H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+ 2AlCl3+ 3H2O 2Al(OH)3 ↓+ 6NaCl+ 3CO2 ↑2 -3++ 3H2O 2Al(OH)3 ↓+ 3CO2↑3CO3 + 2Al10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+ 2FeCl3+3H2O 2Fe(OH)3 ↓+ 6NaCl+3CO2 ↑2 -3++ 3H2O 2Fe(OH)3 ↓+ 3CO2↑3CO3 + 2Fe七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+ NaOHHCO3-+ H2O H2CO3+ OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+ HCl NaCl+ CO2 ↑+ H2OHCO3 -+H+CO2 ↑+ H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+ CH3COOH CH3COONa+ CO2↑+ H2 O-+ CH3COOH -↑+ H2OHCO3 CH3COO + CO24、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+ AlCl3 Al(OH)3 ↓+ 3NaCl+ 3CO2 ↑3HCO3-+ Al3+Al(OH)3↓+ 3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+ FeCl3 Fe(OH)3 ↓+ 3NaCl+ 3CO2 ↑-3+Fe(OH)3↓+ 3CO2↑3HCO3+ Fe6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+ NaOH Na2CO3+ H2OHCO3-+ OH-CO32-+ H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:3+Ca(OH)2 3 2 NaHCO =CaCO ↓+ NaOH+ H O Ca2++ HCO3-+ OH-CaCO3 ↓+ H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+ Ca(OH)2 =CaCO3↓+ Na2 CO3+ 2H2OCa2++2HCO3-+2OH-CaCO3↓+ CO32-+2H2 O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+ CO2↑+ H2O。
22人教版新教材化学必修第一册课件--钠的几种化合物 焰色试验

2.碳酸钠、碳酸氢钠的热稳定性
实验操作
实验现象
化学方程式及结论
刚加热时,澄清石灰水中有气泡 Na2CO3很稳定,受热不易分解 产生,之后无气泡,澄清石灰水⑧
无明显变化
澄清石灰水中有气泡产生,澄清 NaHCO3不稳定,受热易分解,反 石灰水⑨ 变浑浊 ,试管口 应的化学方程式为
处有水珠凝结
⑩
由上表可知,热稳定性:
Na2O2 Na2CO3(组成相当于Na2O2·CO),固体增加的质量等于与CO2等个数 的CO的质量。
自主学习·必备知识
互动探究·关键能力
评价检测·素养提升
Na2O2 2NaOH(组成相当于Na2O2·H2),固体增加的质量等于与H2O等个数 的H2的质量。 ④反应的先后角度 一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,可视为Na2O2先与CO2 反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。
氧化剂又是还原剂。
自主学习·必备知识
互动探究·关键能力
评价检测·素养提升
迁移应用
1.(2021河南南阳高一月考)下列关于钠及其化合物的叙述中正确的是 ( C )
①Na2O是淡黄色物质,Na2O2是白色物质 ②Na2O2可作供氧剂,而Na2O不能 ③钠在常温下不容易被氧化
④Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
自主学习·必备知识
互动探究·关键能力
评价检测·素养提升
解析 Na2O2和Na2O中阴、阳离子的个数比均为1∶2,A正确;Na2O、Na2O2 都易溶于水(与水反应),但Na2O2为淡黄色固体,B错误;Na2O2与水反应时,既作 氧化剂又作还原剂,C错误;Na2O2与足量水反应时,1个Na2O2反应转移1个电子, D错误。
苏教版高中化学必修一知识点(全)

苏教版高中化学必修一知识点(全)苏教版化学必修1知识点总结专题一化学家眼中的物质世界第一单元丰富多彩的化学物质1.物质的分类及转化1.1物质的分类(可按组成、状态、性能等来分类)(碱性氧化物)(酸性氧化物)1.2物质的转化(反应)类型四种基本反应类型化合反应,分解反应,置换反应,复分解反应氧化还原反应和四种基本反应类型的关系MnO2+ 4HCl(浓) =△= MnCl2+ Cl2↑ + 2H2O前者常温下反应,后者微热条件下反应,故物质氧化性:KMnO4 > MnO2(5) 通过与同一物质反应的产物比较:如:2Fe + 3Cl2 = 2FeCl3Fe + S = FeS可得氧化性 Cl2> S离子反应(1)电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
(2)离子方程式:用实际参加反应的离子符号来表示反应的式子。
它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。
(3)离子方程式书写方法:写:写出反应的化学方程式拆:把易溶于水、易电离的物质拆写成离子形式删:将不参加反应的离子从方程式两端删去查:查方程式两端原子个数和电荷数是否相等(4)离子共存问题所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
溶液的颜色如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-2、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等3、结合生成气体或易挥发性物质的离子不能大量共存:如H+和CO32-,HCO3-,SO32-,OH-和NH4+等4、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-,OH-和HCO3-等。
5、发生氧化还原反应:如Fe3+与S2-、I-,Fe2+与NO3-(H+)等6、发生络合反应:如Fe3+与SCN-(5)离子方程式正误判断(六看)一、看反应是否符合事实:主要看反应能否进行或反应产物是否正确二、看能否写出离子方程式:纯固体之间的反应不能写离子方程式三、看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等书写是否符合事实四、看离子配比是否正确五、看原子个数、电荷数是否守恒六、看与量有关的反应表达式是否正确(过量、适量)1.3物质的量1、 物质的量是一个物理量,符号为n ,单位为摩尔(mol)2、 1 mol 粒子的数目是0.012 kg 12C 中所含的碳原子数目,约为6.02×1023个。
钠和化合物的化学方程式和离子方程式

钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOHCO 32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2O H2CO3+NaOHHCO 3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O 8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
常见元素及其重要化合物部分——常用化学反应(或离子)方程式

常见元素及其重要化合物常用的化学反应(或离子)方程式一、钠及其化合物(Na→Na2O、Na2O2→NaOH→Na2CO3、NaHCO3)1、钠在常温下被O2氧化:4Na + O2 === 2Na2O(白色固体)钠在空气(或O2)中燃烧(黄色的火焰):2Na + O2点燃Na2O2(淡黄色固体)2、钠在氯气中燃烧(白烟):2Na + Cl2点燃2NaCl3、钠与单质硫的反应:2Na + S == 2Na2S4、钠与的水反应(浮、熔、游、响、红):2Na + 2H2O == 2NaOH + H2↑;2Na + 2H2O == 2Na+ + 2OH-+ H2 ↑5、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白):2Na2O2 + 2H2O == 4NaOH + O2↑;2Na2O2 + 2H2O == 4Na+ + 4OH-+O2↑6、过氧化钠与CO2的反应:2Na2O2 + 2CO2 == 2Na2CO3 + O2(在呼吸面具和潜水艇中作为氧气来源)7、氢氧化钠与盐酸(或硫酸)的反应:NaOH + HCl == NaCl + H2O;OH- + H+ == H2O2NaOH + H2SO4 == Na2SO4 + 2H2O;OH- + H+ == H2O8、氢氧化钠与CO2(或SO2)的反应:2NaOH(过量) + CO2 == Na2CO3 + H2O;2OH- + CO2 == CO32- + H2ONaOH(少量) + CO2 == NaHCO3;OH- + CO2 == HCO3-2NaOH(过量) + SO2 == Na2SO3 + H2O;2OH- + SO2 == SO32- + H2ONaOH(少量) + SO2 == NaHSO3;OH- + SO2 == HSO3-9、氢氧化钠与某些盐的反应:NaOH + NH4Cl == NaCl + NH3·H2O;OH- + NH4+ == NH3·H2O或NaOH + NH4Cl ∆NaCl + NH3↑+ H2O;OH- + NH4+∆NH3↑+ H2O2NaOH + (NH4)2SO4 == Na2SO4 + 2NH3↑+ 2H2O;OH- + NH4+ == NH3·H2O3NaOH +AlCl3 == 3NaCl + Al(OH)3↓;3OH- + Al3+ == Al(OH)3↓3NaOH +FeCl3 == 3NaCl + Fe(OH)3↓;3OH- + Fe3+ == Fe(OH)3↓2NaOH +CuSO4 == Na2SO4 + Cu(OH)2↓;2OH- + Cu2+ == Cu(OH)2↓10、碳酸钠(俗称:苏打或纯碱)与盐酸的反应:①盐酸中滴加纯碱溶液:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑;CO32- + 2H+ == H2O + CO2↑②纯碱溶液中滴加少量盐酸:Na2CO3 + HCl == NaHCO3 + NaCl;CO32- + H+ == HCO3-11、碳酸钠与CO2的反应:Na2CO3 + CO2 + H2O == 2NaHCO3;CO32- + CO2 + H2O == 2HCO3-12、碳酸氢钠(俗称:小苏打)与盐酸反应:NaHCO3 + HCl == NaCl + H2O + CO2↑;HCO3- + H+ == H2O + CO2↑13、碳酸氢钠受热分解:2NaHCO3∆Na2CO3 + H2O + CO2 ↑14、固体碳酸氢钠和氢氧化钠混合物在密闭容器中加热:NaHCO3 + NaOH ∆Na2CO3 + H2O若是溶液中反应则离子方程式为:HCO3- + OH- = H2O + CO32-15、碳酸氢钠与Ca(OH)2水溶液的反应:2NaHCO3(过量) + Ca(OH)2 == CaCO3↓+ Na2CO3 + 2H2O;2HCO3- + Ca2+ + 2OH- == CaCO3↓+ CO32- + 2H2O二、镁、铝及其化合物:1、镁条在氧气中剧烈燃烧:2Mg + O2点燃2MgO;与氮气反应:3Mg + N2点燃Mg3N2与氯气反应:Mg + Cl2点燃MgCl22、镁条与H2O反应:Mg + 2H2O ∆Mg(OH)2+ H2↑3、镁条与稀盐酸、稀硫酸反应:Mg + 2HCl == MgCl2 + H2↑;Mg + 2H+ == Mg2+ + H2↑4、镁在二氧化碳中燃烧:2Mg + CO2点燃2MgO + C5、氧化镁与H2O缓慢反应:MgO + H2O == Mg(OH)26、氧化镁与稀盐酸反应:MgO + 2HCl == MgCl2 + H2O;MgO + 2H+ == Mg2+ + H2O7、氯化镁与氢氧化钠溶液反应:MgCl2 + 2NaOH == Mg(OH)2↓+ H2O;Mg2+ + H2O8、氢氧化镁与稀盐酸反应:Mg(OH)2 + 2HCl == MgCl2 + 2H2O;Mg(OH)2 + 2H+ == Mg2+ + 2H2O9、碳酸镁与稀盐酸反应:MgCO3 + 2HCl == MgCl2 + H2O + CO2 ↑;2H+ == Mg2+ + H2O + CO2 ↑10、碳酸镁与氢氧化钠溶液反应:MgCO3 +2NaOH == Mg(OH)2+ Na2CO3;MgCO3 + 2OH- == Mg(OH)2 + CO32-11、铝箔在氧气中剧烈燃烧:4Al + 3O2点燃2Al2O312、铝片与稀盐酸反应:2Al + 6HCl == 2AlCl3 + 3H2↑;2Al + 6H+ == 2Al3+ +3H2↑13、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑;2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑14、铝与某些金属氧化物的反应:2Al + Fe2O3高温Al2O3 + 2Fe15、氧化铝溶于稀盐酸:Al2O3 + 6HCl == 2AlCl3 + 3H2O;Al2O3 + 6H+ == 2Al3+ + 3H2O16、氧化铝溶于氢氧化钠溶液:Al2O3 + 2NaOH == 2NaAlO2 + H2O;Al2O3 + 2OH- == 2AlO2- + H2O17、硫酸铝溶液中滴过量氨水:Al2(SO4)3 + 6NH3·H2O == 2Al(OH)3↓+ 3(NH4)2SO4Al3+ + 3NH3·H2O == Al(OH)3↓+ 3NH4+18、①氢氧化铝中加盐酸溶液:Al(OH)3 + 3HCl == AlCl3 + 3H2O;Al(OH)3 + 3H+ == Al3+ + 3H2O②Al(OH)3与NaOH溶液反应:Al(OH)3 + NaOH == NaAlO2 +2H2O;Al(OH)3 + OH- == AlO2- +2H2O19、氢氧化铝受热易分解:2Al(OH)3∆Al2O3 + 3H2O20、偏铝酸钠与稀盐酸反应:NaAlO2 + HCl + H2O ==Al(OH)3↓+ NaCl;AlO2- + H+ + H2O ==Al(OH)3↓三、铁及其化合物:1、铁与非金属反应:3Fe +2O2点燃Fe3O4;2Fe + 3Cl2点燃2FeCl3;Fe + S∆FeS2、铁与水的反应:3Fe + 4H2O (气)高温Fe3O4 + 4H23、铁与稀盐酸、稀硫酸反应:Fe + 2HCl == FeCl2 + H2↑;Fe + 2H+ == Fe2+ + H2↑4、铁与某些盐的反应:Fe + CuSO4 == FeSO4 + Cu;Fe + Cu2+ == Fe2+ + Cu。
钠及其化合物的化学方程式和离子方程式

仅供个人参考钠及其化合物的化学方程式和离子方程式一、钠NaO 、钠在氧气中燃烧:2Na+O12222NaClCl2、钠在氯气中燃烧:2Na+2O4Na+2NaO3、钠常温条件下和氧气反应:22SNaS4、钠和硫共热:2Na+22NaOH+H 、钠和水反应:2Na+2HO↑522+-2Na+2HHO ↑+2Na2OH+22H ↑2NaCl6、钠和稀盐酸反应:2Na++2HCl2++↑2Na+H2Na +2H 2O2HCuSO+7、钠投入到硫酸铜溶液中:2Na NaSO +Cu(OH) ↓+H↑+2222442++O+Cu2H+2Na 2Na+Cu(OH)↓+H ↑222O +6H、向氯化铝溶液中加入少量的钠:6Na↑+2AlCl8↓++6NaCl2Al(OH) 3H23233++O2Al6H+6Na+3HAl(OH)6Na+↓+↑232O 2H+↑2H+AlCl+9、向氯化铝溶液中加入足量的钠:4Na3NaClNaAlO+22323+-+O+4Na+Al2H 2H++4NaAlO↑222TiCl++4NaClTi、钠在高温条件下与四氯化钛反应:4Na104二、氧化钠1、氧化钠和水反应:NaO+HO=2NaOH 22+-2Na+O Na+H2OHO 22 COONaCO +2、氧化钠与二氧化碳反应:Na23222HClO+HO3、氧化钠与盐酸反应:Na+2NaCl22++2H+NaO OH2Na+22OCu(OH) ↓+NaSOH++O、向硫酸铜溶液中加入氧化钠:4NaCuSO 422422不得用于商业用途.仅供个人参考2++H↓+O2Na NaO+CuCu(OH)+222O3H+2AlCl+5、向氯化铝溶液中加入少量的氧化钠:3NaO2Al(OH) ↓+6NaCl 23233+++3HO2Al(OH) ↓+6Na3NaO+2Al ===322NaAlO+AlCl3NaCl 6、向氯化铝溶液中加入足量的氧化钠:2NaO+2233-+++4NaAlO 2NaO+Al22三、过氧化钠+O ↑1、过氧化钠与水反应:2NaO+2HO4NaOH2222-+2NaO+2HO4Na+4OH+O ↑===22222NaCO+O ↑2、过氧化钠与二氧化碳反应:2NaO +2CO2222234NaCl+2HO3、过氧化钠与盐酸反应:2NaO++4HClO ↑2222++↑O2NaO+4H+O4Na+2H 22224、向硫酸铜溶液中加入过氧化钠:2NaO+2CuSO+2HO2Cu(OH) ↓+2NaSO+O ↑===222224422++↑O +2Cu(OH) 2NaO+2Cu↓++2H4NaO222225、向氯化铝溶液中加入少量的过氧化钠:O4Al(OH) ↓+12NaCl+3O ↑6NaO+4AlCl+6H 2322233++↑3O 6NaO+4Al +6HO↓+12Na +4Al(OH)22322O+2H2NaO+O↑AlCl6、向氯化铝溶液中加入过量的过氧化钠:NaAlO+3NaCl+2223223++-O+2H 2NaO+Al O+AlO4Na+↑222227、过氧化钠与硫酸亚铁溶液反应:O4Fe(OH) ↓+4NaSO+O ↑4NaO+4FeSO+6H 234242222++4NaO+4Fe+6H↑O8Na ↓++O4Fe(OH)22223四、氢氧化钠O2NaAlO+3H ↑2H1、铝与氢氧化钠溶液反应:2Al+2NaOH+222--↑+3H+2OH2HO2AlO 2Al+222NaCl+NaClO+Cl+2NaOHHO 2、氯气通入氢氧化钠溶液中:22---OClO ClCl+2OH++H22不得用于商业用途.仅供个人参考6NaOH5NaCl+NaClO+3H3、氯气通入热的浓氢氧化钠溶液中:3Cl+O 223---O3Cl+6OHClO+3H5Cl+2322NaS+NaSO+4、硫和氢氧化钠溶液共热:3S+3H6NaOHO 232222---O+2S3H+3S+6OHSO 23ONaSiO+2H+H ↑5、硅溶于氢氧化钠溶液中:Si+2NaOH22232--↑SiO2H Si+2OH+H+O 2322NaAlO2NaOH+HO 6、氧化铝溶于氢氧化钠溶液中:AlO+2322--O+2OHH2AlOAlO+2322CO2NaOHO +7、向氢氧化钠溶液中通入少量的二氧化碳:NaCO+H23222--CO+2OHCOO+H223NaHCO NaOH+CO8、向氢氧化钠溶液中通入过量的二氧化碳:32--COHCOOH +32O HSO9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO+Na22322--O+SO2OH+SOH232NaHSO、向氢氧化钠溶液中通入过量的二氧化硫:10NaOH+SO 32-+HSO32O-SOOH+O+6NaOH3H2NaPO、五氧化二磷与氢氧化钠溶液反应:11P232543--O+2PO3H+PO6OH25422NaOHNaNO+NaNO+H12、二氧化氮和氢氧化钠溶液反应:2NO+OO2223---NO+HNO2OH2NO++22232NaOHNO+13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NOH2NaNO+O +222--2OH++OH+2NO NONO222不得用于商业用途.仅供个人参考NaSiO+H、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiOO 1422232--OH+2OH+SiOSiO232Na+15、三氧化硫和氢氧化钠溶液反应:SOSO2NaOH+HO 24232--O+SO+2OHSOH 234NaCl16、盐酸和氢氧化钠溶液反应:HCl++NaOHHO 2-+HO+OH H 2NaOHCOOH+O 17、醋酸和氢氧化钠溶液反应:CHCHCOONa+H332--OH+CHCOOH CHCOO+HO3322NaOHS+18、向氢氧化钠溶液中通入少量的硫化氢:HNaS+2HO 2222--2OHHSS+2HO+22NaHS+NaOHH19、向氢氧化钠溶液中通入足量的硫化氢:HS+O 22--OHS+OHHHS+22Na2NaOHSO+2H+20、硫酸和氢氧化钠溶液反应:HSOOHOH H+O24224-+23NaOHPO+O 21、磷酸溶液氢氧化钠溶液反应:HNaPO+3H43243 3--3OHHPO+PO3H+O4234NaOHNaAlO+2HO 22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH) +232+AlO2H Al(OH) +OH 223NaOHAgNO +23、--O向硝酸银溶液中加入氢氧化钠溶液:AgOH ↓+NaNO33+-OH Ag+AgOH↓2NaOH+Cu(OH)+SONa↓:CuSO24、向硫酸铜溶液中加入氢氧化钠溶液42242+-2OH↓Cu(OH) +Cu2不得用于商业用途.仅供个人参考3NaOHFe(OH) ↓+、向氯化铁溶液中加入氢氧化钠溶液:FeCl+3NaCl 25333-+Fe(OH) ↓Fe+3OH 33NaOH:AlCl+↓+3NaCl 26、向氯化铝溶液中加入少量氢氧化钠溶液Al(OH) 333+-3OHAl+↓Al(OH)34NaOH:AlCl+27、向氯化铝溶液中加入足量氢氧化钠溶液O NaAlO+3NaCl+2H3223++Al AlO+2HO--4OH22NaOH+、向氯化铵溶液加入氢氧化钠溶液,加热:NHCl28O NaCl +NH↑+H432+-OH+NH ↑+NH HO423、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热: 29NaHCO+NH ↑+HNHHCO+O NaOH 24333-+NH ↑++OHHONH23430、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:2NaOHNaCO+NH ↑+NHHCO+2HO 2334232--+-O↑+2H+NH+HCO+OHNHCO 23343NaOHNaCO+HO 31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO+23322---OOHHCO++COH 233 32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:CaCO ↓+NaHCO+HO Ca(HCO)+NaOH232332--+CaCOCaHCO++OH ↓+HO23333、向碳酸氢钙溶液中加入过量氢氧化钠溶液:2NaOHCaCO ↓+NaCO+2HO ) Ca(HCO +23232322---+OCO2H+CaCO 2OHCa +2HCO++233334、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:2NaOHMg(OH) ↓+2NaHCO Mg(HCO)+32322-+Mg(OH) ↓+Mg OH 2不得用于商业用途.仅供个人参考35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:4NaOHMg(OH) ↓+NaCO+Mg(HCO) +2HO 222233222---+O2H+Mg(OH) Mg↓++2HCO+4OH2CO2323五、氯化钠AgCl↓+NaNONaCl+AgNO 1、氯化钠溶液与硝酸银溶液混合:33+-AgCl ↓Cl+AgNaSO+2HCl2、氯化钠固体和浓硫酸共热:NaCl+HSO↑42242NaOH+H O↑+Cl ↑3、电解饱和的氯化钠溶液:2NaCl+2H222--↑↑+Cl 2OH+H 2Cl+2H O2222Na+Cl4、电解氯化钠的熔融液:2NaCl↑2六、碳酸钠CaCO 1、碳酸钠溶液与澄清石灰水反应:NaCO+Ca(OH) ↓+2NaOH332222+-CaCO ↓+Ca CO 33BaCl+NaCO ↓+2NaCl 2、碳酸钠溶液与氯化钡溶液混合:BaCO223322-+BaCO+BaCO ↓333、碳酸钠溶液呈碱性:NaCO+HONaHCO+NaOH33222---HCOCO++HOOH 332HCl+:NaCO、碳酸钠溶液滴入少量的盐酸4NaHCO+NaCl 3322-+-H+CO HCO 332HClCO+5O 2NaCl+CO↑+H、碳酸钠溶液滴入足量的盐酸:Na32222-+2HCO +↑+COHO322COOHH COCOONa2CH+↑+2CHCO+6O 、碳酸钠溶液中加入醋酸:Na3233222--COOH+CO2CH O↑+H+COOCO2CH 32323OH+CO 2NaHCO+CO7、碳酸钠溶液中通入二氧化碳气体:Na232232--OH2HCO++CO CO2332不得用于商业用途.仅供个人参考O2NaHCO +CO+H8、向饱和的碳酸钠溶液中通入二氧化碳气体:NaCO323222-+2NaHCOCO ↓+CO+H O2Na+33229、碳酸钠溶液与氯化铝溶液混合:O2Al(OH) ↓+6NaCl+3CO+2AlCl+3H ↑3NaCO23233232+-2Al(OH)O ↓+3CO 3CO2Al+↑+3H 233210、碳酸钠溶液与氯化铁溶液混合:O2Fe(OH) ↓+6NaCl++3H3CO ↑3NaCO+2FeCl23223332+-2Fe(OH) ↓+3CO +3H↑O3CO2Fe+2323七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO+HCO+NaOHHO2332--HCO+HOHCO+OH 2233HCl↑+NaCl+CO HO :NaHCO+2、碳酸氢钠溶液滴入盐酸322-+H HCO+HCO ↑+O322COOH+CHO CHCOONa+CO↑+H3、碳酸氢钠溶液滴入醋酸:NaHCO32323--COOHHCO+CH OCOOCH+CO↑+H 33232AlCl+4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO↑↓+Al(OH)3NaCl+3CO 32333-+Al 3COAl(OH) ↓+↑3HCO +332FeCl +↓+Fe(OH) 3NaCl3CO↑+、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO533323-+Fe3HCO+3CO Fe(OH)↓+↑323NaOH+、碳酸氢钠溶液与氢氧化钠溶液混合:O H+CONaNaHCO63232 2---OHHCO+O+COH 3327、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO+Ca(OH) =CaCO ↓+NaOH+HO23232+--CaCO ↓+HCa+HCO+OHO2338、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO+Ca(OH) =CaCO ↓+NaCO+2HO 23223322---+O2H+2OH+Ca +2HCO↓+CaCOCO2333不得用于商业用途.仅供个人参考NaCO+CO ↑+H2NaHCO9、碳酸氢钠受热分解:O23322不得用于商业用途.仅供个人参考仅供个人用于学习、研究;不得用于商业用途。
钠及其化合物的化学方程式和离子方程式要点

化学方程式一、钠NaO 、钠在氧气中燃烧:2Na+O12222NaClCl2、钠在氯气中燃烧:2Na+2O4Na+O3、钠常温条件下和氧气反应:2Na22SNaS、钠和硫共热:2Na+422NaOH+H2Na+2H O↑5、钠和水反应:22+-OH ↑2Na 2Na +2H+2OH+22H 、钠和稀盐酸反应:62Na+↑2HCl2NaCl+2++↑2Na2Na +2H+H 2O+CuSO2H7、钠投入到硫酸铜溶液中:2NaNaSO +Cu(OH) ↓+H ↑+2242422++OCu2H++2Na 2Na+Cu(OH)↓+H ↑222O+6H6Na+2AlCl↑+6NaCl2Al(OH) ↓+3H 8、向氯化铝溶液中加入少量的钠:23233++O+6H 6Na+2Al 3HAl(OH)6Na+↓+↑232O2H2H3NaClNaAlO++↑AlCl++9、向氯化铝溶液中加入足量的钠:4Na22323++-O+Al2H+4Na 2H++4NaAlO↑222TiCl+4NaClTi4Na+10、钠在高温条件下与四氯化钛反应:4二、氧化钠1、氧化钠和水反应:NaO+HO=2NaOH 22+-+H2OHO2NaO Na+22CO+、氧化钠与二氧化碳反应:NaONaCO 222322HClO+2NaClHO Na+3、氧化钠与盐酸反应:22++2HNaOH2Na++O22.OCu(OH) ↓+NaCuSO+HSO O4、向硫酸铜溶液中加入氧化钠:Na+4422222++↓++H2NaO NaO+CuCu(OH)222O3H2AlCl+5、向氯化铝溶液中加入少量的氧化钠:3NaO2Al(OH) ↓+6NaCl +22333+++3HO2Al(OH) ↓+6Na 2Al 3NaO+===322NaAlO +AlCl3NaCl 、向氯化铝溶液中加入足量的氧化钠:2NaO+62323-++4NaAlO+2NaO+Al22三、过氧化钠↑O1、过氧化钠与水反应:2NaO+2H O4NaOH+2222-+2NaO+2HO4Na+4OH+O ↑===22222NaCO+O ↑2、过氧化钠与二氧化碳反应:2NaO +2CO 2232224NaCl+2H3、过氧化钠与盐酸反应:2NaO+O4HCl+O ↑2222++2NaO+4H↑+O 4Na+2HO 22224、向硫酸铜溶液中加入过氧化钠:2NaO+2CuSO+2HO2Cu(OH) ↓+2NaSO+O ↑===242422222++↑O ↓+O+2Cu+2H4NaO+2Cu(OH)2Na 222225、向氯化铝溶液中加入少量的过氧化钠:O4Al(OH) ↓+12NaCl+3O 6NaO+4AlCl+6H↑2232323++6NaO+4Al +6H↑O↓+12Na+3O4Al(OH) 22232O2H+AlCl+2Na6、向氯化铝溶液中加入过量的过氧化钠:ONaAlO+3NaCl +O ↑2222323+-+O+O+Al2H 2Na O+AlO4Na+↑222227、过氧化钠与硫酸亚铁溶液反应:O4Fe(OH) ↓+4NaSO++4FeSO+6HO ↑4NaO234222422++↑+OO 4Fe(OH) ↓+8Na+4NaO4Fe+6H22322四、氢氧化钠O2NaAlO+3H2H ↑2Al1、铝与氢氧化钠溶液反应:+2NaOH+222--↑3H2AlO+O++2Al2OH2H222NaCl+2NaOH、氯气通入氢氧化钠溶液中:2Cl+NaClO+HOO22.---ClO+2OH+HCl+Cl 226NaOH+3NaClO+3HO 、氯气通入热的浓氢氧化钠溶液中:3Cl5NaCl+232---6OH3Cl+3H5Cl+ClO+O2322NaS+NaSO6NaOH+3HO 4、硫和氢氧化钠溶液共热:3S+223222---O ++SO3S+6OH3H2S 23ONaSiO+2H ↑5、硅溶于氢氧化钠溶液中:Si+2NaOH+H22232--Si+2OH+H O↑+2HSiO 2232NaAlO++OH2NaOHO 6、氧化铝溶于氢氧化钠溶液中:Al2322--OH2AlO+AlO2OH+2322CO+7、向氢氧化钠溶液中通入少量的二氧化碳:NaCO+HO 2NaOH2232 2--CO2OHHOCO++232NaHCOCO 8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+32--HCOOH +CO32O HNa+SOSO+2NaOH9、向氢氧化钠溶液中通入少量的二氧化硫:22322--O +SOH2OH+SO232NaHSO +SONaOH10、向氢氧化钠溶液中通入过量的二氧化硫:32-+SOHSO32O-OH+6NaOH3H2Na+OP11、五氧化二磷与氢氧化钠溶液反应:PO232543--O+2PO3H6OH+OP24252NaOHNaNO+NaNO+12、二氧化氮和氢氧化钠溶液反应:2NO+HOO2322---NO+H+NO+2NO2OH23222NaOHNONOO+2NaNOH13、一氧化氮、二氧化氮和氢氧化钠溶液反应:++222.--O+NO+2OHH2NO NO+222Na14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiOSiO+HO 23222--O+2OH+SiOSiOH223Na15、三氧化硫和氢氧化钠溶液反应:SO+SO2NaOH+HO 24232--O+SOH2OH SO+234NaCl++HNaOHO 16、盐酸和氢氧化钠溶液反应:HCl2-+HO+OH H 2NaOHCOOH+17、醋酸和氢氧化钠溶液反应:CHCHCOONa+HO 332--OHCHCOOH+CHCOO+HO3322NaOH2H+、向氢氧化钠溶液中通入少量的硫化氢:O HS18NaS+222 2--2OHS+H S2H+O22NaHS+H:HS+O NaOH19、向氢氧化钠溶液中通入足量的硫化氢22--O+HHSHS+OH 22NaSO+20、硫酸和氢氧化钠溶液反应:HSO+2NaOH2HOHHO22424-++OH 23NaOH+、磷酸溶液氢氧化钠溶液反应:HPO+NaPO3HO 21423433--3OHPO+H 3HOPO+4423NaOHNaAlO+2H:Al(OH) +O 22、将氢氧化铝溶于氢氧化钠溶液中232--O 2HAlO Al(OH) +OH+232 NaOHAgNO+↓+NaNO 23、向硝酸银溶液中加入氢氧化钠溶液:AgOH 33+-OH Ag+↓AgOH2NaOH:CuSOCu(OH)+SONa↓24、向硫酸铜溶液中加入氢氧化钠溶液+4242.2+-Cu(OH) +2OH↓Cu 23NaOH:FeCl+25 ↓+3NaCl 、向氯化铁溶液中加入氢氧化钠溶液Fe(OH)333+-3OHFe+Fe(OH) ↓33NaOH:AlCl+↓+3NaCl 26、向氯化铝溶液中加入少量氢氧化钠溶液Al(OH) 333+-3OH +Al(OH)↓Al 34NaOH+272H+O 、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl+NaAlO3NaCl3223+--4OH+Al O+AlO2H 22NaOH+O +NaClNH↑+H、向氯化铵溶液加入氢氧化钠溶液,加热:NHCl28432+-OH+NH ONH↑+H 423、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:29NaHCO+NH ↑+HHCO+O NaOH NH23334-+NH OH↑+HONH+24330、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:2NaOHNaCO+NH NHHCO+↑+2HO 2343322---+O2H+OHNH CO↑++NH+HCO23334NaOHNaCO+H31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO+O 23232---OCOH++HCOOH 233 32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:CaCO ↓++) Ca(HCO NaHCONaOH+HO 233232-+-CaCO ↓++Ca+HCOOHHO23333、向碳酸氢钙溶液中加入过量氢氧化钠溶液:2NaOHCaCO ↓+NaCO+Ca(HCO ) +2HO 22333222---+O2H+CO+2OH+Ca +2HCO CaCO233334、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:2NaOHMg(OH) ↓+)Mg(HCO+2NaHCO 3223.2+-Mg(OH) +OH↓Mg 235、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:4NaOHMg(OH) ↓+NaCO+Mg(HCO) +2HO 222332222---+O+↓+Mg2CO+2HCO2H+4OHMg(OH)2332五、氯化钠AgCl↓+NaNONaCl+AgNO 1、氯化钠溶液与硝酸银溶液混合:33+-AgCl ↓Cl+AgNaSO+2HCl2、氯化钠固体和浓硫酸共热:NaCl+HSO↑44222NaOH+HO ↑+Cl ↑3、电解饱和的氯化钠溶液:2NaCl+2H 222--↑Cl H2OH+2Cl+2H O↑+2222Na、电解氯化钠的熔融液4+:2NaClCl ↑2六、碳酸钠CaCO1、碳酸钠溶液与澄清石灰水反应:Na Ca(OH)↓+2NaOHCO+322322+-CaCO ↓CO+Ca 33BaCl+NaCO ↓+2NaCl 2、碳酸钠溶液与氯化钡溶液混合:BaCO223322-+BaCO+BaCO ↓333、碳酸钠溶液呈碱性:NaCO+HONaHCO+NaOH 33222---+HHCO+OCOOH332HCl+:NaNaHCO+NaCl CO4、碳酸钠溶液滴入少量的盐酸332 2-+-HCO+HCO 332HCl+、碳酸钠溶液滴入足量的盐酸:NaO +2NaClCO↑+HCO532222-+2HCO+OH CO↑+322COOHH↑++COONa2CHCO2CHNaCOO +6、碳酸钠溶液中加入醋酸:3322232--COOHCOCOO+2CHCO OH↑++2CH33223.O2NaHCO +CO+H7、碳酸钠溶液中通入二氧化碳气体:NaCO323222--COO+CO+H2HCO3232O+HNaCO+2NaHCO CO8、向饱和的碳酸钠溶液中通入二氧化碳气体:222332+-O+CO2NaHCO↓+2Na+COH23239、碳酸钠溶液与氯化铝溶液混合:O2Al(OH) ↓+6NaCl+2AlCl+3H3CO ↑3NaCO+23323232+-2Al(OH)O ↓+3CO+2Al +3H↑3CO 223310、碳酸钠溶液与氯化铁溶液混合:O2Fe(OH) ↓+6NaCl3H+3CO ↑+3NaCO+2FeCl22323332+-2Fe(OH) ↓+3CO+3H O3CO↑+2Fe 2332七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO+CO+NaOH HOH 2233+HO+HCOOH2323HClO +:NaHCO2、碳酸氢钠溶液滴入盐酸↑+NaCl+CO --HCOH322-+HHCO+HCO ↑+O322COOHCH:NaHCOO COONaCH+CO↑+H+3、碳酸氢钠溶液滴入醋酸32323--COOHCH HCO+OCOCOOCH+↑+H 32332AlCl ↓+Al(OH)3NaCl+3CO3NaHCO+4↑、碳酸氢钠溶液与氯化铝溶液混合:33323-+Al3HCO 3CO Al(OH)↓+↑+332FeCl +↓+Fe(OH)3NaCl3CO3NaHCO+5↑、碳酸氢钠溶液与氯化铁溶液混合:32333-+Fe 3CO Fe(OH)↓+↑+3HCO332NaOHCONa+6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCOO H+32232---OH+HCO OH+CO 3327、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO+Ca(OH) =CaCO ↓+NaOH+HO22332+--CaCO +HCOCa+OH↓+HO233.8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO+Ca(OH) =CaCO ↓+NaCO+2HO 22233322--+-O++2HCO+2OHCaCO↓+CO Ca2H2333NaCO+CO ↑+H9、碳酸氢钠受热分解:2NaHCOO22233一、镁2MgO +O1、镁在氧气中燃烧:2Mg2MgCl Mg+Cl2、镁在氯气中燃烧:22MgN3、镁在氮气中燃烧:3Mg+N 2232MgO+C4、镁在二氧化碳中燃烧:2Mg+CO2MgSSMg5、镁与硫共热:+Mg(OH) +2H+HO ↑6、镁与水共热:Mg222MgCl+H ↑7、镁和盐酸反应:Mg+2HCl 222++↑H2HMg+Mg +2COOH(CHCOO)Mg+H 8、镁和醋酸反应:Mg+2CH↑23322-+MgCOOHH 2CHCOO++2CHMg↑+233MgCl+Mg9、镁和氯化铵溶液反应:+2NHCl2NH ↑+H ↑24322++↑2NH2NHMg+↑+MgH+234 2FeCl+2FeClMgCl 10、将少量的镁投入到氯化铁溶液中:Mg+223232++++2FeMg+Mg2Fe3MgCl+2FeCl2Fe 11、将过量的镁投入到氯化铁溶液中:3Mg+2323++2Fe+3Mg2Fe+3Mg MgSO++CuSOCu 12、镁和硫酸铜溶液反应:Mg4422++CuMg+Mg+Cu MgSO+SO ↑+Mg+2HSO2HO 13、镁和浓硫酸反应:24422Mg(NO14、镁和浓硝酸反应:Mg+) +2NO4HNO ↑+2HO223322++-O2H MgMg+4H+2NO↑++2NO2323Mg(NO) +15、镁和稀硝酸反应:3Mg+8HNO2NO ↑+4HO23232++-O↑+Mg4H++3Mg+8H2NO2NO 23二、氧化镁MgCl++H2HClO 1、氧化镁与盐酸反应:MgO222++O+MgHMgO+2H2COOH(CHCOO)Mg+H2、氧化镁和醋酸反应:MgO+2CHO 23322+-O COOHCOO+MgHMgO+2CH+2CH233MgCl+2NH 3、氧化镁溶于氯化铵溶液中:MgO+2NH Cl↑+HO 24322++O+MgO2NHH Mg↑++2NH243O3MgCl+2Fe(OH)+3H 、氧化镁投入到氯化铁溶液中:43MgO+2FeCl323223++2Fe(OH)O3Mg 3MgO+2Fe3H++32三、氢氧化镁2HClMgCl++2HO 1、氢氧化镁和盐酸反应:Mg(OH) 2222++OMg Mg(OH)+2H2H+22COOH(CHCOO)Mg2CH+2HO +2、氢氧化镁和醋酸反应:Mg(OH) 232232-+O+Mg+Mg(OH) 2CHCOOH2H+2CHCOO2233MgCl+2NH Cl+Mg(OH)、氢氧化镁溶于氯化铵溶液中:3 2NH↑+2HO 222432++O↑+Mg(OH) Mg2NH++2NH2H2342.++2FeCl2Fe(OH)3MgCl4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)332223++2Fe(OH)3Mg+3Mg(OH) +2Fe32OHMgO+5、氢氧化镁受热分解:Mg(OH)22四、氯化镁Mg(NO1、氯化镁溶液与硝酸银溶液反应:MgCl+2AgNO)2AgCl ↓+2233+-↓Cl+AgAgCl2NaCl↓+、氯化镁溶液中加入氢氧化钠溶液:MgCl+2NaOH=Mg(OH)2222-+↓MgMg(OH)+2OH2Cl ↓+2NHOMg(OH) 3、氯化镁溶液加入氨水:MgCl+2NH·H423222++2NHMg(OH)Mg +2NH·H↓+O4223、氯化镁溶液中加入偏铝酸钠溶液:42NaCl ↓+↓++2NaAlO+4H2Al(OH)OMg(OH)MgCl322222-++2AlO+4H OMg↓↓+2Al(OH)Mg(OH)3222MgCl5 、电解氯化镁的熔融液:Mg+Cl ↑22OMgCl+2H6Mg(OH) ↓+H ↑+Cl ↑、电解氯化镁的溶液:222222-+OMg2H↓+Mg(OH) H ↑+Cl ↑+2Cl+2222五、碳酸镁O CO↑+HMgCO+2HClMgCl+1、碳酸镁与盐酸反应:===22322++O ↑+2HMgH+CO MgCO+===223 O ↑+HCOO)Mg+COMgCO2、碳酸镁与醋酸溶液反应:+2CHCOOH(CH===2323322+-HO +CO↑+MgCO+2CHCOOH2CHCOO+Mg===23323OMg(HCO)3、碳酸镁悬浊液通入二氧化碳气体:MgCO+CO+H===233222-+2HCOH+OMg +MgCO+CO ===3232↑↓+3COO3MgCl+2Fe(OH)+4、碳酸镁加入到氯化铁溶液中:3MgCO2FeCl+3H===23322323++↑2Fe(OH)↓++3HO3Mg3CO3MgCO+2Fe+===2332 CO↑+ClMgCl2NH↑++5、碳酸镁加入氯化铵溶液中:MgCO2NH===233242++↑2NH↑+MgMgCO+2NHCO+===2433高温MgO+MgCO6、碳酸镁高温煅烧:CO↑23六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO)+2HClMgCl+2CO↑+2H O ===22223.HO HCO+HCO ===232 Mg(OH)↓+2NaHCO 2、碳酸氢镁与少量-+↑+的氢氧化钠溶液反应:Mg(HCO)+2NaOH===32232-+Mg(OH)↓Mg +2OH===2 3、碳酸氢镁与过量的氢氧化钠溶液反应:O+2H↓++4NaOHMg(OH)NaCO Mg(HCO)===22223322-+--O+Mg(OH)↓+2CO Mg2H+2HCO+4OH===2233 4、碳酸氢镁与澄清石灰水反应:O↓+2H2Ca(OH)Mg(OH)↓+2CaCO Mg(HCO)+===23322222-+-+O 2H↓+2CaCOMg+2HCO+2Ca↓++4OHMg(OH)===2323△MgCO5、碳酸氢镁受热分解:Mg(HCO)↓+CO↑+HO22233一、铝+3O2AlO1、铝在氧气中燃烧:4Al 3222AlCl +2、铝在氯气中燃烧:2Al3Cl32S3S、铝和硫共热:Al2Al+332SO+3H4、铝与稀硫酸反应:2Al Al(SO)+3H ↑4432223++6H++3H ↑2Al2Al22HO2NaAlO+3H 2Al+2NaOH+↑5、铝和氢氧化钠溶液反应:222-↑2AlO2OH++O3H 2Al+222Al6、铝和浓硫酸共热:2Al -2H+6HSO(SO) +3SO ↑+6HO 2423224Al(NO) 、铝和浓硝酸共热:7Al6HNO++3NO ↑+3HO232333++-O6HAl++3H3NO Al↑++3NO223Al(NO) +NO ↑+4HNO、铝和稀硝酸反应:8Al+2HO 2333 3+-+O2H4H+Al+NO+NO Al↑+23+3AgNOAl(NO)、铝和硝酸银溶液反应:Al +3Ag 83333++3Ag+3AgAl+Al+3CuSOAl(SO)3Cu、铝与硫酸铜溶液反应:92Al+3424.32++3Cu2Al+2Al+3Cu2Fe+AlO10、铝和氧化铁高温下反应:2Al+FeO33229Fe +4Al8Al11、铝和四氧化三铁高温共热:+3FeOO32433Cu+、铝和氧化铜高温共热:2Al+Al3CuOO12323Mn+13、铝和二氧化锰高温共热:4Al3MnO+2AlO322二、氧化铝O 3H +Al1、氧化铝与稀硫酸反应:AlO+3HSO(SO)242224333++O+2Al3HOAl+6H223O +HO+2NaAlO2NaOH2、氧化铝与氢氧化钠溶液反应:Al2322--OH+O2OH2AlO+Al2223电解4AlO3O 32Al↑+、电解氧化铝的熔融液:223冰晶石三、氢氧化铝12Al(OH) 3HSOAl(SO) 6HO +、氢氧化铝与稀硫酸反应:+24334223++3H3H AlOAl(OH)++23NaAlO2HO 2Al(OH) NaOH+、氢氧化铝与氢氧化钠溶液反应:+322--OH +Al(OH) O+AlO2H 322AlO+2Al(OH) 3HO3、加热氢氧化铝:2332四、硫酸铝2AlCl+3BaSO )1、硫酸铝溶液与氯化钡溶液混合:Al(SO +3BaCl↓43224322+-BaSO ↓SO+Ba442、硫酸铝的水溶液呈酸性:Al(SO)+6HO2Al(OH) +3HSO 42432233+++3HOAl(OH) Al+3H 323、硫酸铝溶液中加入少量的氢氧化钠溶液:Al(SO) +6NaOH3NaSO+2Al(OH) ↓3224343-+Al(OH)+Al3OH ↓3.4、向硫酸铝溶液中加足量的氢氧化钠溶液:8NaOH2NaAlO+3NaSO+Al(SO) +4HO22242343-+-AlO++4OH2HAlO225、向硫酸铝溶液中加入少量的氢氧化钡溶液:2Al(OH) ↓+3BaSO ) +3Ba(OH)↓Al(SO432432223--++2Al(OH) ↓+3BaSO3Ba +6OH2Al↓+3SO +4436、向硫酸铝溶液中加入足量的氢氧化钡溶液:Ba(AlO) +3BaSO ↓+4HOAl(SO)+4Ba(OH)22423422223--+-+O4H 8OH↓+2AlO2Al++3SO3BaSO+3Ba+24247、向明矾溶液中加入少量的氢氧化钡溶液:2Al(OH) ↓+3BaSO ↓+KSO3Ba(OH) +2KAl(SO) 4243224232-++-3BaSO ↓+2Al(OH) 3Ba↓+6OH+2Al +3SO3448、向明矾溶液中加入足量的氢氧化钡溶液:KAlO+2BaSO ↓+2H KAl(SO) +2Ba(OH)O242422232-+-+-O↓+2H++2Ba2BaSO+4OHAl +2SOAlO2244OH+6NH·9、向硫酸铝溶液中加入氨水:Al(SO) 2Al(OH) ↓+3(NH)SO 2434223343++Al(OH) ↓+3NH3NH·H AlO+432310、向硫酸铝溶液中加入碳酸钠溶液:O2Al(OH) ↓+3NaSO+3CO+) 3NaCO+3H ↑Al(SO232442332223-+2Al(OH) ↓+3CO ↑2Al +3CO+3HO232311、向硫酸铝溶液中加入碳酸氢钠溶液:2Al(OH) ↓+3NaSO+6CO ↑+Al(SO) 6NaHCO232433243-+Al(OH) ↓+Al3CO+3HCO ↑23312、向硫酸铝溶液中加入硫化钠溶液:O2Al(OH) ↓+3NaSO+3HS S (SOAl)+3Na+6H↑22223243423-+2Al(OH) ↓+O6H3S2Al++3H ↑S 232.13、向硫酸铝溶液中加入硫氢化钠溶液:O2Al(OH) ↓+3NaSO+6H+6HS ↑)Al(SO +6NaHS232242343-+Al(OH) ↓+3H3HS+3HOS↑Al +23214、向硫酸铝溶液中加入硅酸钠溶液:O2Al(OH) ↓+3NaSO+3HSiO ↓Al(SO) +3NaSiO+6H3432224332223-+2Al(OH) ↓+2Al3H+3SiOSiO+6H O↓3232315、向硫酸铝溶液中加入偏铝酸钠溶液:O3NaSO+8Al(OH)+12H ↓Al(SO) +6NaAlO342322243-+4Al(OH) +AlO6H↓OAl +322五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO+NaOH +2HOAI(OH) 223+2HO Al(OH) +OH223O+H、偏铝酸钠溶液滴入少量盐酸:NaAlOAl(OH) ↓+--AlONaCl +HCl2232-+OAl(OH)+H+↓HAlO 2234HCl、向偏铝酸钠溶液加入足量盐酸:2H +O NaAlO+3NaCl+AlCl2233+-+4H+AlOOAl+2H22O2Al(OH) ↓+NaCO+CO+3H 4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO3222232--CO2Al(OH) +2AlOCO+3HO↓+32223Al(OH)+5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO+CO2H O+NaHCO 32223--COAlO++2H+OHCOAl(OH) 32322、向偏铝酸钠溶液中加入硫酸铝溶液:63Na (SOAl)+6NaAlOSO+8Al(OH)12HO ↓+32423422 3-+4Al(OH) OAlOAl++6H↓322O+HNaAlO+NHCl7 Al(OH) ↓+NaCl+NH↑、向偏铝酸钠溶液中加入氯化铵溶液:23234+-ONH+↑↓+Al(OH)NHAlO+H24233.8、向偏铝酸钠溶液中加入氯化铁溶液:O3Al(OH) ↓+Fe(OH)+3NaAlO+FeCl6H ↓+3NaCl 323233+-3Al(OH) ↓+Fe(OH) ↓OFe+3AlO+6H 3232。
钠及其化合物的化学方程式和离子方程式要点

钠及其化合物的化学方程式和离子方程式要点化学方程式1,钠1,钠在氧中燃烧:2Na+O22,钠在氯中燃烧:2Na+Cl 2Na2O2氯化钠2 Na2O23,钠在常温下与氧反应:4Na+O24,钠和硫共加热:2Na+S5,钠和水反应:2Na+2H2O 2Na+2H2O 6,钠和稀盐酸反应:2Na+2HCL2Na+2H +Na2S2氢氧化钠+H2 ↓2Na+2OH+H2↓2氯化钠+H2↓2Na+H2↓Na2SO 4+铜(羟基)2 ↓+ H2↓2Na+铜(羟基)2↓ 钠与四氯化钛在高温下反应:4Na+四氯化钛,氧化钠1,氧化钠与水反应:Na2O+H2O = 2NaOH Na2O+H2O 22 Na+2ONa2CO 32氯化钠+H2O 2 2Na+H2O 2++-2,氧化钠与二氧化碳反应:Na2O+CO23,氧化钠与加入少量的氧化钠:Na2O+2 ALC L3+3H2O+3n a2o+2 ALC L3+3H2O = = = 2al(oh)3left+6na 6,向氯化铝溶液中加入足量的氧化钠:2na2o+ALCL 32na2o+al3ii,过氧化钠1,过氧化钠与水反应:2na2o 2+2h2o4 NaOH+O2 =4 过氧化钠与盐酸反应:2na2o 2+4hc L2 Na2O 2+4h+2 na2co 3+O2 =4氯化钠+2h2o+O2 = 4na+2h2o+O2 =+4,向硫酸铜溶液中加入过氧化钠:2na2o 2+2cuso 4+2h2o = = = 2cu(oh)2 left+2na2so 4+O2 = 2na2o 2+2 向氯化铝溶液3 ↓+ 12氯化钠+3O 2 ↓+ 12Na+3O 2 ↓+ 3O 2 ↓+ 12Na+3O 2↓+4 al(OH)中加入少量过氧化钠向氢氧化钠溶液中引入氯气:Cl2+2NaOh-2 NaAlO 2+3 H2↓2 AlO 2+3 H2↓-氯化钠+氯化钠+H2OCl2+2OH-氯离子+ClO+H2O5氯化钠+氯化钠3 氧化铝溶解在氢氧化钠溶液中:Al2O 3+2NaOh Al2O 3+2Oh--Na2 SiO 3+2 H2 = SiO 32+2 H2 =-2 naalo2+H2O 2 alo2+H2O 2na2co 3+H2O 2 co32+H2O 2-256 五氧化二磷与氢氧化钠溶液反应:p2o 5+6NaOHp2o 5+6oh-碳酸氢钠碳酸氢钠na2so 3+H2O SO32+H2O-碳酸氢钠碳酸氢钠2na 3po 4+3H2O-2 po43+3H2O-256 三氧化硫与氢氧化钠溶液反应:SO3+2氢氧化钠SO3+20H 16,盐酸与氢氧化钠溶液反应:盐酸+氢氧化钠++----2 NO2+H2O-Na2SO 3+H2O二氧化硅+H2O硫酸与氢氧化钠溶液反应:H2SO 4+2NaOh+OH+----NaHs+H2O HS+H2O-Na2SO 4+2H2OH2ONa3PO 4+3H2O PO43+3H2O 向硝酸银溶液中加入氢氧化钠溶液:硝酸银+氢氧化钠银+氢氧化钠+-24,向硫酸铜溶液中加入氢氧化钠溶液:硫酸铜4+2氢氧化钠铜2+氢氧化钠+铜(氢氧化物)2铁(氢氧化物)3 8595;+三碱金属铁(氢氧化物)3 在氯化铝溶液中加入少量氢氧化钠溶液:三氯化铝+三乙醇胺Al3+3oh+-27,在氯化铝溶液中加入足量氢氧化钠溶液:三氯化铝+4氢氧化钠Al3+4OH+-28,在氯化铵溶液中加入氢氧化钠溶液,加热:氯化铵+氢氧化钠NH4+oh29 向碳酸氢铵溶液中加入足够量的氢氧化钠溶液共热:nh4hc 3+2NaOHNH4+HCO 3+oh+--na2co 3+NH3↓+2H2O CO32+NH3↓+2H2O-31、将碳酸氢钠溶液与氢氧化钠溶液混合:nah 加入少量氢氧化钠溶液:ca(HCO 3)2+NaOHCa2+HCO 3+oh+---na2co 3+H2O CO32+H2O-CaCO3+碳酸氢钠+H2O CaCO3+H2O 229向碳酸氢钙溶液中加入过量的氢氧化钠溶液:钙(碳酸氢钙)2+2氢氧化钠Ca2+2碳酸氢钙+2OH+--碳酸钙↓+碳酸钠+2H2O碳酸钙+CO32+2H2O-34,向碳酸氢镁溶液中加入少量的氢氧化钠溶液:34 碳酸氢镁与少量氢氧化钠溶液反应:mg(HCO 3)2+2 NaOh = = = mg(oh)2+2 nah co 3+-Mg2+2Oh = = = mg(oh)2 3,碳酸氢镁与过量的氢氧化钠溶液反应: mg(HCO 3)2+4 NaOh = = = mg(oh)2 left+Na2CO 3+2h2o+-| 碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2ca(oh)2 = = = Mg(oh)2+2ca C3+2h2o+-+-Mg 2+2HCO 3+2ca 2+4oh = = = Mg(oh)2+2ca C3+2h2o 5,加热分解碳酸氢镁:Mg2(HCO 3)2△-+铝与稀硫酸的反应:2Al+3H2SO 42 Al+6H+5,铝与氢氧化钠溶液的反应:2Al+2NaOH+2H2O 2Al+2OH+2H2O 6,铝与浓硫酸的共加热:2Al+6H2SO47,铝与浓硝酸的共加热:Al+6H NO3 3Al+6H+3HNO 3 326 铝与稀硝酸的反应:Al+4 HNO 3Al+4h+NO 3+-+--2 naalo 2+3 H2 = 2 alo 2+3 H2 =-Al2(SO4)3+3SO 2859σ+6H2O Al(NO3)3 铝与硫酸铜溶液的反应:2Al+3CuSO 4 Al2(SO4)3+3cu2 Al+3cu 2+2 Al3+3cu+10,铝与氧化铁的高温反应:2Al+Fe2O3 311,铝与四氧化三铁的高温共热:8Al+3Fe3O412,高温共热氧化铝与稀硫酸的反应:al2o 3+3h2so 4al2o 3+6hal2o 3+2Fe4 al2o 3+9Fe al2o 3+3Cu2 al2o 3+3Mnal2o 3(SO4)3+3H2O 2al 3+3H2O+2、氧化铝与氢氧化钠溶液的反应氢氧化铝与稀硫酸反应:2Al (OH) 3+3H2SO 4Al(OH)3+3H+Al2(SO4)3+6H2O Al3 ++ 3H2ONAALO 2+2H2O ALO 2+2H2O-2,氢氧化铝与氢氧化钠溶液反应:Al(OH)3+氢氧化钠Al (OH) 3+OH3,加热氢氧化铝:2A 硫酸铝水溶液呈酸性:Al2(SO4)3+6 H2O 2 al(OH)3+3 h2so 4 ++ Al3+3 H2O al(OH)3+3 H3,硫酸铝溶液中加入少量氢氧化钠溶液:Al2(SO4)3+6 NaOhAl3+3OH+-3 Na2SO 4+2Al(OH)3Al(OH) 在硫酸铝溶液3+8氢氧化钠+4H2O+--2 NaAlO 2+3Na 2SO 4+4H2OAlO 2+2H2O5中加入足量的氢氧化钠溶液:Al2(SO4)3+3Ba(OH)2+。
金属钠及其化合物

相关结论:_____________
•碳酸钠和盐酸反应:⑴稀盐酸加到碳酸钠溶液中的 现象是:
⑵碳酸钠溶液加到稀盐酸中的现象是:
•碳酸氢钠及碳酸钠粉末分别与盐酸反应:离子方程式: ___________、____________ 解释反应快慢不同的原因:
•碳酸氢钠的受热分解:反应原理
①用25 mLNaOH溶液吸收CO2气体,至CO2气体不再溶解; ②小火煮沸溶液1min~2min; ③在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合。 此方案能制得较纯净的Na2CO3(第一步的实验装置如图所示)
(1)将块状大理石加入试管中的正确方法是 _____________。
Na2O2既是氧化剂,又是还原剂
放热反应
过氧化钠具有:强氧化性
3.Na2CO3与NaHCO3比较
化学式
Na2CO3
俗名
稳定性
与H+反应
与OH-反应
N 问:如何区别Na2CO3、 NaHCO3固体、溶液?
水溶性比较
•钠与氧的反应:1、在空气中缓慢氧化 现象:_____________
与CO2反应 与SO2反应
过氧化钠
Na2O2 淡黄色固体
化合价降低,得到2×e-,被还原
-1
2Na2O2+ 2H2O
=4
-2
NaOH+
0
O2 ↑
放热反应
化合价升高,失去2×e- ,被氧化
化合价降低,得到2×e-,被还原
-1
-2 0
2Na2O2+2CO2 = 2Na2CO3+O2
化合价升高,失去2×e- ,被氧化
产物的证明
钠及其化合物的化学方程式和离子方程式

钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O 8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
化合物数据查询表
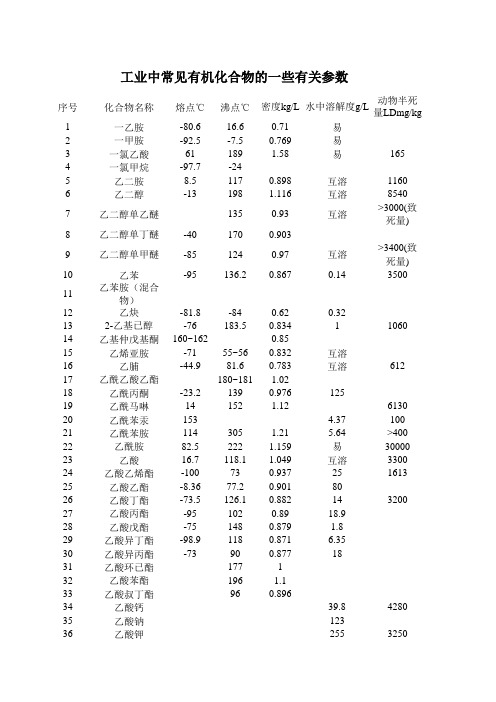
序号化合物名称熔点℃沸点℃密度kg/L水中溶解度g/L动物半死量LDmg/kg1一乙胺-80.616.60.71易2一甲胺-92.5-7.50.769易3一氯乙酸61189 1.58易165 4一氯甲烷-97.7-245乙二胺8.51170.898互溶1160 6乙二醇-13198 1.116互溶85407乙二醇单乙醚1350.93互溶>3000(致死量)8乙二醇单丁醚-401700.9039乙二醇单甲醚-851240.97互溶>3400(致死量)10乙苯-95136.20.8670.143500 11乙苯胺(混合物)12乙炔-81.8-840.620.32132-乙基已醇-76183.50.83411060 14乙基仲戊基酮160~1620.8515乙烯亚胺-7155~560.832互溶16乙脯-44.981.60.783互溶612 17乙酰乙酸乙酯180~181 1.0218乙酰丙酮-23.21390.97612519乙酰马啉14152 1.126130 20乙酰苯汞153 4.37100 21乙酰苯胺114305 1.21 5.64>400 22乙酰胺82.5222 1.159易30000 23乙酸16.7118.1 1.049互溶3300 24乙酸乙烯酯-100730.937251613 25乙酸乙酯-8.3677.20.9018026乙酸丁酯-73.5126.10.882143200 27乙酸丙酯-951020.8918.928乙酸戊酯-751480.879 1.829乙酸异丁酯-98.91180.871 6.3530乙酸异丙酯-73900.8771831乙酸环已酯177132乙酸苯酯196 1.133乙酸叔丁酯960.89634乙酸钙39.84280 35乙酸钠12336乙酸钾2553250工业中常见有机化合物的一些有关参数37乙酸铵易38乙醇-11778.40.789互溶6500 39乙醇胺11172 1.02互溶65040乙醛-12420.80.783互溶1930 41乙醛酸7942乙醚-116350.7146943二乙汞4444二乙铵-4550.30.711互溶64845N,N-二乙基苯胺-38.82160.93514.446N,N-二乙基羟胺47二乙烯三胺五醋酸48二乙醇胺28269 1.092互溶12049二丙酮醇-571690.934000 50二甘醇单乙醚2020.99互溶8590~9740 51二甘醇单丁酯-682310.96互溶52二甘醇单丁醚-68231-0.96互溶5500~6600 53二甲苯0.1354二甲苯胺(混合物)55二甲氧基甲烷440.85633056二甲胺-92.2 6.90.68易240572,5二甲基-1,4二恶烷200582,4-二甲酚26211.5 1.036592,5-二甲酚732120.971602,6二甲酚46203576 613,4二甲酚65225 1.023623,5二甲酚6821963二异丙胺-96.383.40.72250064二异丙醚-86690.7395000~6500(致死量)65二苯醚28259 1.0730.0213990662,6二叔丁基-4-甲基酚70265 1.0480.0004180067N,N二甲基甲酰胺-611530.95互溶4200683,3-二甲基戊二酸10269二甲基亚砜18.5189 1.170N,N-二甲基苯胺21920.961 712,4-二甲基苯胺2180.98722,5-二甲基苯胺15.52170.98734,4二氨基二苯甲烷93231/11742,6-二氨基吡啶121285752,6-二羟基异菸酸>300762,4-二硝基甲苯70300 1.5210.3772,6-二硝基甲苯64~66782,4-二硝基苯酚114 1.683 5.630 79二硫化碳108.646.3 1.263 2.380二硫代磷酸-0,0-二甲酯49.925100811,1-二氯乙烷-97.457.3 1.174 5.5821,2-二氯乙烷-35.983.7 1.25 5.05625,680 83二氯乙酸6194 1.56386.34500 842,2'-二氯二乙醚-50178 1.2210.2112851,4-二氯-2-丁烯丁基3.5158 1.18861,3-二氯-2-丙醇110100 872,2-二氯丙酸钠5004700 88二氯甲烷-96.740.1131600892,4-二氯苯氧乙酸216 1.4160.5720902,4-二氯苯酚45210 1.383 4.5912,3-二氯-1,4-萘醌188440921,4-二恶烷10101 1.033互溶5660 93十六烷82870.7750.994十氢萘(顺)-431940.89795十氢萘(反)-311860.897961,3-丁二烯-100-4.410.6210.7497丁二腈802670.98512845098丁二酸185235 1.5668991,4-丁二醇16230 1.02互溶100丁苯-881830.86101丁胺-104.599.50.74互溶430 1022-丁烯醛-74102.40.858180 1.5 1032-丁酮-83.479.60.80537040 104丁酮肟-29.51520.923100105丁酸-5.5163.70.957562900~3800 106丁酸乙酯-76.8124~1270.882141071-丁醇-89.5117.30.8171603 1082-丁醇-114.799.50.8061256480 109丁醛-97750.8173744.6110三乙胺-114.889.50.728435 111三乙醇胺21.2360 1.12互溶2200 112三甘氨酸2441100~2400 113三甘醇-4287.4 1.125互溶2260 114三甘单乙醚-18.7260 1.0251151,3,5-三甲苯-52.7164.70.865116三甲胺-117 3.50.6621172,2,4-三甲基戊烷-107.41010.70.00561181,1,1-三氟-3-氯丙烷-106.245.1 1.381193,4,5三羟基苯甲酸220 1.69411.6>500120三硝基甲苯81240爆炸 1.640.21121三硝基甲烷25 1.597122三硝基酚122.5>300爆炸0 1231,1,2-三氯乙烷35113.7 1.44 4.5124三氯乙烯-8786.7 1.46 1.1125三氯乙酸57197.5 1.63131261,2,4-三氯苯17213 1.5740.1<10001272,4,5-三氯苯氧乙酸1580.28500128己二胺421961300 2.34 129己二腈-0.52950.9621000 130己二酸153 1.3715131己二酸已二胺盐1905001610 132己二酸钠133己内酰胺69.2262.5 1.2134己烷-94.368.70.660.0131352-己酮-571280.8335136己酸-62040.945115000 137己酸钠1381-己醇-511580.82594000 139木糖140巴豆醛-751040.85155160~300 141孔雀绿142壬酸132540.907>320 143丹宁酸218144水杨酸159256 1.443 1.8400~800 145反丁烯二酸287290,升华 1.6357.25146反丁烯腈-2122.80.826147乌洛托品280148六氯丁二烯-1,3-18.52150.251149六氯环-1,3-丁二烯10236420~620150六氯苯230326 2.0446×10-61250 151丙二酸135.67351521,2 -丙二醇188.2 1.03833740 153丙苯-1011590.8620.017154丙烘醇-171150.97155丙氨酸297166156丙烯脯-8377.40.80678 157丙烯氯-136450.9413700 158丙烯酰胺84.52162050102 159丙烯酸13141.6 1.051互溶33.5 160丙烯酸乙酯-751000.924201000 161丙烯酸丁酯-641450.9 1.63700 162丙烯酸甲酯-7580.50.95860200 163丙烯醇-129970.8250.05764~105164丙酮-9556.20.79互溶3800165丙酮肟61136.30.97166丙酸-921410.992互溶400 167丙酸甲酯-87.50.937168丙醇-126.297.20.804互溶169丙醛-81490.8072001410 170甘油291 1.26互溶171甘三棕榈酸酯65.50.866172甘氨酸233292分解 1.601253173甘露醇166.1 1.52156174戊二酸98303分解 1.4296401751,2-戊二醇218互溶1761,5-戊二醇2390.994177戊烯二聚物150~2600.7830.0151783-戊酮-451020.81647179戊酸-341870.94237600 1801-戊醇-791380.524273000 181甲苯-95110.60.8670.57182甲苯二异氰酸酯21251120581832-甲基-1,3-丁二烯-146340.6851843-甲基丁酸钠1852-甲基-2-丁醇-11.9101.80.509140 1863-甲基-1-丁醇-117.21310.81230 187甲基丙烯酸16163 1.015188甲基丙烯酸甲酯-501010.9361892-甲基-2,4-戊二醇-401980.92 2.244161904-甲基-3-戊烯-2-酮-59130281914-甲基-2-戊酮1440.818 5.41924-甲基-3-戊酮-851190.802202630 1934-甲基-2-戊醇-901320.81172590 194甲基异丁基酮116~1190.801719195甲基戊基基酮1440.818 5.4196甲基呋喃-88.763~65.60.9133197甲基环已酮-1261010.770.014 1985-甲基3-庚酮 1600.85 3500 1993-甲基吲哚952660.50.5 2002-甲基苯乙烯 0.067 2011-甲基苯乙醇 1950 2022-甲基苯乙醇 203 1.013203N-甲基氨基甲酸萘酯142 0.052942041-甲基萘-2224310.250.028205甲酰胺 2.55211 1.133互溶2245 206甲酸8.4101 1.22互溶207甲酸甲酯-80.534.50.917118208甲酸烯丙酯 6300 209甲醇-9864.50.796互溶210四乙铅-136198 1.6538*10-435 211四丙基苯磺酸钠212四甘醇-6327 1.12互溶32800 213四氢呋喃-108.565~660.888214甲氢吡咯 87.5 互溶250 215四氢萘216四氢噻吩二氧化物27.4285 1.256217四氯化碳-2376.7 1.59 1.1617,702,920 2181,2,3,4-四氯苯47.5 2.54 0.00351500 219四聚丙烯220对二甲苯13138.40.860.1982560 221对二氯苯53173.4 1.4580.082560 222对甲苯胺45200 1.0467.4223对甲胺基苯酚硫酸盐260224对甲酚34.8202 1.03824596 225对苯二甲酸425 1.510.0166400 226对苯二胺139.7267 38227对苯二酚1712870.358591189228对苯醌115.7 1.31810130 229对叔丁基甲苯-631930.857 230对叔丁基苯甲酸166 1.142 735 231对氨基酚186.5 11 232对氨基苯甲酸乙酯88~89 233对羟基苯丙氨酸290 0.41 234对硝基甲苯51.3238 1.2860.442 235对硝基苯甲醛242.4 1.550.24 236对硝基酚113.4179 1.47916100 237对氯甲苯 6.5162~166 1.066 238对氯苯甲酸243 1.5410.077 239对氯硝基苯83.5242 1.52 440 240对氯酚43217 1.30627.1400 241仲丁醇-891070.8081254360 242异丁醛-65.961.50.794110 243异丙氧基乙醇 1400.909 244异丙胺-101.234-69互溶820 245异丙醇-89.582.40.785互溶7850 246异辛醇 182~1950.832 247异硫氰酸丙烯酯-100151 1.0152 248异硫氰酸甲酯35119 1.069 249吗啉-4.751281互溶1200 250呋喃-85.6320.964101000 2512-吡咯烷酮24.6245 1.1 7500 252吡啶-41.8115.30.98互溶 253吲哚 5.3254 2.46 254辛烷-56.5125.70.77*10-5 2551-辛醇-171950.8240.34000 256辛酸162370.91 2.5 257间二甲苯-481390.864 258间二硝基苯89.8300~302 1.5710.469 259间甲苯甲酸312 0.131148 260间甲苯胺-322030.99 261间甲酚12202 1.03824.2270262间苯二酚276 1.285840370(致死量)263间氨基酚123164 26420 264间硝基甲苯15.5231 1.1570.498 265间硝基酚97194 1.2813.5 266间氯苯甲酸158 1.4960.4>500 267间氯苯胺-10.4230 1.216268邻乙苯胺-44 0.982 269邻二乙苯 183.5 270邻二甲苯-25144.40.880.175 271邻二氯苯-18179 1.3050.14 272邻甲苯胺-24.4200 1.00415 273邻甲氧基苯酚28205 1.129161000~2000 274邻甲酚31191 1.04131436 275邻苯二甲酸206 1.593 5.43200 276邻苯二甲酸二乙酯-40.5298 1.120.21277邻苯二甲酸烯丙酯-70160 1.12278邻苯二甲酸二丁酯-35340 1.0470.45280279邻苯二甲酸酐130.8284.5 1.527 800~1600 280邻苯二胺103258 41 281邻苯二酚105240 1.371451 282邻苯基苯酚56275 1.20.72700 283邻氨基吡啶56204 200 284邻氨基苯甲酸147 3.5 285邻氨基酚174 1.32817500 286邻硝基甲苯-10.6225 1.1630.65287邻硝基对甲基苯酚36.5125 1.23288邻硝基苯甲酸147.5 1.575 6.8>200 289邻硝基酚45.3215 1.295 2.1 290邻氯苯甲酸147.5 1.544 2.1>500 291邻氯酚7175.6 1.24128.5 292 293谷氨酸225 1.4626.42941,5,9-环十二碳三烯-152310.89295环己胺-181340.819 400~800 296环己烯-103.5830.8110.213 297环己烷 6.581.40.780.055 298环己酮-40.2155.60.948231536 299环己酮肟90206~210 15 300环己醇25.15161.10.962362200~2600 301环氧乙烷-111110.557互溶 302环氧氯丙烷-57116 1.186040 303苹果酸辣140 1.5950.88 304DL-苦杏仁酸118.1 1.36160 305苦味酸168 1.4 306苯 5.590.10.879 1.784600307苯乙烯-30.6145.30.910.31000 308苯乙酮19.6202 1.03 1.961350 309苯乙酸78.5265 1.08116 3101,2,3-苯三酚133 1.453625 3111,3,5-苯三酚222 1.4611.35 312苯丙氨酸271>318 14.2 313苯甲胺 1850.983 314苯甲腈 234 1.015 315苯甲酸122249 1.266 2.71700 316苯甲醇-15206 1.046403100 317苯甲醛-26179 1.05 3.35000 318苯甲醚-37.5153.70.989 1.5 319苯肼19.6243.5 1.098126 320苯胺-5.89184.4 1.02234550321苯基-2,3-环氧丙基醚3.5245 1.11 2.43850322苯酚40.9182 1.05882395 323苯腈-13190.7 1.00510 324苯磺酸 400~3200 325叔丁基酚99236-0.9080.7400~2000 326叔丁醇25.582.80.7881256480 327季戊四醇263.5 55.6 328依地酸240 0.994000 329乳酸16122 1.249 1810 330乳糖170 331庚烷91980.680.03 3322-庚酮-351500.82 4.3 3331-庚醇-341760.8224350 334庚醛-451550.85 255000 335油酸16.33600.89 336柠檬酸1153 1.5421330 337草酸189 1.65395 338草酸二山峰酯-41185 1.076 339草酸钠 34.1 340胱氨酸261 0.11 341顺丁烯二酸133 1.59788 342顺丁烯二酸酐60199.90.934163390 343胆甾醇148360分解 1.067 344亮氨酸3453-氨基-1,2,4-三氮唑153~156 2803464-氨基偶氮苯126>360 347酒石酸171 1.76206348DL-酒石酸100 1.697206 349α-萘胺50300.8 1.131 1.7 350β-萘胺110.2306 1.061 351α-萘酚96.1280 1.0990.71280 352β-萘酚122295 1.21170.7470 3531,4-萘醌128.5 1.422 3.5 354偏二甲肼-5862.50.5 355脲酸 1.8930.065 356烯丙胺 530.76357烯丙基-2,3环氧丙基醚-100153.90.9691411600358烯丙基硫脲78 1.22 359羟乙酸79 1.27 1600~3200 3603-羟基丁醛083 1.103 2200 3612-羟基丙胺 1.41600.962 3628-羟基喹啉75266 1.034 1200 363蛋氨酸281 33.8 364联苯70 2.54 1.180.0075>4000 365联苯胺116~129402 1.250.4 366棕榈酸642390.853 367葡萄糖146 323 368葡糖酸125369D-葡糖酸-δ-内酯155370硬脂酸71.5386.10.8390.34 371硬脂酸钠 372硝基环己烷-34 1.06120250 373硝基苯 5.76213 1.2 1.9 374硫脲182 1.40591.8 375喹啉-19.5237.7 1.09560460 376氯乙醇-67.5128.8 1.202互溶72~95 3772-氯-1,3-丁二烯59.40.9390.5119 378氯化乙基汞192.5 18 379氯化苄-41179 1.102 3807-氯四环素172 0.55130 381氯仿-63.561.2 1.4888.2800 382氯苯-45132 1.1070.491825 383蒽216340 1.250.0019 384愈创木酚28.2205 1.129161000~2000 385缬氨酸298 74.4 386噻吩-38.384 1.064 2.8350 387糖精224 388糠醛-36.5161.7 1.1683125389糠醇-14.6171 1.13 390磷酸三丁酯-80>2890.9730.3971189 391磷酸三对甲苯酯COD值BOD值g/g生物可降解性毒性mg/L g/g2.130.80.375+292.5+0.59-0.30.51+5001.050.01(1.0)0.008+0.851.29~1.5 1.15~0.67(0.91)0.84+>100001.92 1.580.806+2.20.7~1.681.690.12~0.50(1.10)0.655>100001.73+12 0.3780.0480.127+2.95(-2.29)0.78+82255.51.56 1.40.898+6800.1(1.24)671.21.080.63~0.740.583+>100001.070.34~0.880.805+0.80.597+61.54~1.880.86(1.57)0.80+2.20.520.236+1151702.340.31~0.90.132+145~3502.20.67(2.05)0.932+2002.020.260.129+19083115780.710.420.592+0.580.520.75+0.640.320.50+2.08-1.820.875+6500 1.27~1.310.78~0.93(1.88)0.61+63001.820.91(1.07)0.59+0.630.1750.2480.03002.95 1.30.445+2.59~2.79002.540.491.020.01~0.0151.06~1.520.10.095+>100002.110.07~0.588251.860.2~0.582552.080.283.170.980.309+2.64002.15 1.3(0.4)0.653+1.2-0.40.205-2.620~0.820~0.313,+1.50.820.192.270.511.540.02(0.10)0.065,0.02,1.47)2.53~2.630.250.095,8151.47000.980.086,(0.10)0.0921.3300572611535(N)000.0021351.025000.592-0.20.5391.280.30.234-0.7900.10.209-0.38001.050.750.71261.34001.740027000.390.17000.17001.6-1.250.7821.850.643.220.49,(1.96)0.153,2.62 1.250.4478002.280.8(2.12)2.44 1.70.69711500.631.65~1.750.34~1.168751402.6 1.26650,8200(N)2.47 1.87500 2.44 1.160.5061003.08-0.051.660.01~0.170.005>100000.730.0140.0211.60.03~0.50.3123201.840.050.320.0960.3590(N)1.590.190.35000.91~1.130.080.071>100 09365>1001.060.30.2840.97(-0.17)0.1750.03,(1.58)1.921.390.5981.90.51.28-1.022.13-20.8570.04-2.212.80.50.3852.28-2.110.442.030.60.392.650.790.3622.220.850.38002.520.590.2340.31~0.461.580.970.770.57~0.700.782.15(-1.24)(-0.576)0.015~0.026000.380.530.9951.6-1.21.940.021500.831.39~1.870.70.38753 0.86~1.330.231150.971.33 1.10.623411.710.542701.4-10.7052.10~2.200.2(1.5~1.6)19.5(N)1.112~2.071.120.7748100(N)170021.80.075300 1.4~11.510.36~1.33302.40.47~1.500.62527002.2 1.130.39~0.5451.16~1.230.77~0.870.7>100001.960.46~0.640.385~0.550.860.920.680.741.210.7221.680.14~0.242.612.04 1.05~1.040.5152.20~2.73 1.23~1.610.45220 1.7~1.880~1.230.5882958003.240.4260.171.610.570.354410 2.1~2.730.162~1.500.551.70.890.5231002.20.022.4 1.912.46 2.142.6 2.1227511590 602.61 2.22.52~2.95 1.510.5123.1 1.40.2082.70.8(1.8)0.667-2.12.070.10.0290.350.0070.350.15~0.190.7881.510.50.331.50.770.6510.371.650.50.303580 0.315001.6600030003.43-0.47-0.135 1.42~2.560~2.3501.42002.8 1.44~1.630.631.260.1990.1672.4 1.4~1.760.62300.941 1.061.9260.0311.830.480.4580 55 2.50.06~0.19 2.370.26 2.49 8~10 ~100 1.93 26100(N)1.54 41500202.47 1.872.44 1.160.5052.080.182.690.81 2.30~2.40 1.29~2.00 1050631.9(N)0.8(N)1.340~0.020.011310001.160.721.47 3402.46 2.070.912.33 2.89~2.95 1.120.37~0.41>501.282.63 2.53142.52 1.540.6233~551.89 1.150.79432.49 0.6101.54 70.048>202.9101.4200150.24~1.43 162.06 1.40.68 2.38~2.52 1.54~1.760.6233~501.440.85~1.440.878>400 >1002.240.43~0.490.72~1.261.890.690.7731.322.491841.54 0.9300.980.640.6533.020.02420 0017002.611~1.230.3842.120.03~0.040.01930 2.15~2.350.379~1.60.6841.740.061.160.03 55 23762.620.170.312.15~3.070.5 922.12~2.88 1.120.52272 2.53~3.030.5~0.5180.4250.011.52~2.540.470.1852.2440111.95~2.00.96~1.650.8054802.5 1.5~1.550.598350 1.98~2.41 1.620.6211321.810.170.0942.4 1.49~2.262.180.142.33~2.38 1.1~2.00.462642.18000.01 1051.070.64~0.961.070.550.5150.06 1.920.50.326670.384 2.25~2.540.170.740.42 >10000 0.17~0.180.14~0.160.8231550>100000.080.8~0.930.57~0.630.6870.980.42~0.620.6120.8370(N)000.520.30.6770.520.351.2820.890.69481(N)2.36 1.460.62 2.3~2.5 1.59~1.70.6762.5 1.790.732.120.810.382.1 1.130.6 0.5510.37001.990.061400.1750.91.350.70.5920073(N)1.0850~100 0.8~2.870.06~1.100.60.530.350.990.53~0.613 2.69~2.94 1.2~1.662.6 1.20.4471.91000.830.075~0.01130.0151.97~2.31 1.71~1.770.7120.990~0.500001.3350~0.02 125 0.41~0.910.030.033173.210~0.062.06 0.681.110.120.1091.540.770.5780.532 180 2.160.10.045 2.2 1.30.59。
钠及其化合物的化学方程式和离子方程式要点

钠及其化合物的化学方程式和离子方程式要点————————————————————————————————作者: ————————————————————————————————日期:化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+SNa2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2ONaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2OCu(OH)2↓+Na2SO4Na2O+Cu2++H2OCu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠: 2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O↑22Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O 4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOHNaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O 14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOHNa2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O 19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOHNaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOHNa2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOHNaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOHFe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOHNaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOHNaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOHNa2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOHCaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOHCaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2 +2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOHCO 32-+H2OHCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HClNaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2OH2CO3+NaOHHCO 3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HClNaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOHCH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOHNa2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O一、镁1、镁在氧气中燃烧:2Mg+O22MgO2、镁在氯气中燃烧:Mg+Cl2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2OMg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H+Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应: Mg+2NH4ClMgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应: Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO↑+4H2O3Mg+8H++2NO3-Mg2++2NO↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O4、氧化镁投入到氯化铁溶液中: 3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HClMgCl2+2H2OMg(OH)2+2H+Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2 +2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2 +2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中: Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl↓+Mg(NO3)2Cl-+Ag+AgCl↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2OMg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2OMg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液: MgCl2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2OMgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2OMg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO2↑+H2O一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3 +3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO 3Al(NO 3)3 +3NO 2 ↑+3H 2OAl+6H ++3NO 3-Al 3++3N O2 ↑+3H 2O 8、铝和稀硝酸反应:A l+4H NO 3Al(NO 3)3 +NO ↑+2H2O Al+4H ++N O3-Al 3++NO ↑+2H 2O 8、铝和硝酸银溶液反应:Al +3AgNO 3Al(NO 3)3 +3Ag Al+3A g+Al 3++3Ag 9、铝与硫酸铜溶液反应:2Al+3CuSO 4Al 2(SO 4)3 +3Cu 2Al+3Cu2+2A l3++3C u10、铝和氧化铁高温下反应:2Al +F e2O 3Al 2O 3+2F e 11、铝和四氧化三铁高温共热:8Al+3Fe 3O44Al 2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al 2O 3+3Cu13、铝和二氧化锰高温共热:4A l+3MnO 22Al 2O 3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H2SO 4A l2(SO 4)3 +3H 2OA l2O 3+6H +2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2Na Al O2+H2O Al 2O3+2OH-2A lO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(O H)3 +3H 2SO 4Al 2(SO4)3 +6H2O Al(OH)3 +3H+Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al (OH)3 +NaO HNaAlO 2+2H2O Al(OH)3 +OH-A lO 2-+2H2O冰晶石电解3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al 2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al (OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2OAl(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S↑Al3++3HS-+3H2OAl(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO 2-+2H2O Al(OH)3 +OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2OAl(OH)3↓+NaClAlO2-+H++H2OAl(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2OAl(OH)3+NaHCO3AlO2-+CO2+2H2OAl(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3 +6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
过氧化钠的性质

过氧化钠的性质过氧化钠是一种无机化合物,化学式为Na2O2,常见于一些工业中。
它具有一些特殊的性质,下面将详细介绍。
首先,过氧化钠是一种具有强氧化性的化合物。
它可以与许多物质发生氧化反应,产生氧气。
例如,过氧化钠与金属反应时,会释放出大量的氧气。
这就使得过氧化钠在一些特定的工业过程中成为必不可少的物质。
它可以用于制造漂白剂、消毒剂等。
除此之外,过氧化钠还可以用作一种强氧化剂,可以在有机合成反应中起到催化剂的作用。
其次,过氧化钠在水中溶解时会产生氢氧化钠。
这是因为过氧化钠在水中会发生水解反应,生成氢氧化钠和氧气。
这也是为什么过氧化钠在溶液中呈碱性的原因之一。
过氧化钠溶液具有一定的碱性,可以与酸反应产生盐和水。
此外,过氧化钠还具有着较高的热稳定性。
在常温下,它可以稳定存在。
但当过氧化钠受到热的影响时,它会分解释放出氧气。
这种分解反应是放热反应,会产生大量的热量,所以在使用过氧化钠时需要小心防止它过热。
过氧化钠的热稳定性使得它在一些火焰试剂中被广泛应用。
除了以上的特性之外,过氧化钠在储存和运输过程中也需要特殊的注意事项。
由于它具有强氧化性,容易与许多物质反应,尤其是有机物。
所以在储存和运输过程中,需要避免它与可燃物接触,以防止事故的发生。
另外,过氧化钠也会受潮而失去活性,所以需要注意保持其干燥。
总的来说,过氧化钠是一种具有强氧化性的无机化合物。
它在一些特定的工业过程中发挥着重要的作用,例如制造漂白剂、消毒剂等。
它的水解性使其呈碱性溶液,在一些化学反应中起到重要的催化剂作用。
然而,由于其具有强氧化性,储存和运输过程中需要特殊注意。
这些特性使得过氧化钠成为化学领域中一个重要的化合物。
文章长度不足3000字,请继续阅读下一篇。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钠的化合物
班级姓名学号
【学习目标】
1.通过比较的方法掌握钠的重要化合物如氧化物、碳酸盐的性质
2.了解碳酸钠及碳酸氢钠的一些用途
【新课】
一. 钠的氧化物
【复习回顾】写出在不同条件下金属钠和氧气的反应方程式
【知识扩充】 Na2O2的性质及用途
过氧化钠常用于特殊情况下的供氧(如呼吸面具及潜水艇中),因为过氧化钠能与CO2及H2O等物质发生反应生成O2
【归纳整理】氧化钠和过氧化钠性质的比较
二.碳酸钠和碳酸氢钠的性质比较
1.与酸反应
【实验1】在放有等量的Na2CO3和NaHCO3的两支相同大小的试管口各套一个盛有等体积等浓度盐酸的小气球,同时将气球中的盐酸倾倒入试管中,比较气球鼓起的速度。
实验现象:
反应方程式:
【问题思考】生成等质量的CO2需要消耗的Na2CO3和NaHCO3哪个多?反之,相等质量的Na2CO3和NaHCO3的哪一个生成的CO2多?
2.稳定性
3.溶液的酸碱性
【实验2】用PH试纸测定碳酸钠、碳酸氢钠溶液的PH。
现象与结论:
4.与盐溶液反应
【实验3】在两支试管中分别加入3mL氯化钙溶液,再分别滴加碳酸钠、碳酸氢钠溶液,观察现象。
现象:
涉及反应方程式:
5.与碱反应
【实验4】在两支试管中分别加入3mL氢氧化钙溶液,再分别滴加碳酸钠、碳酸氢钠溶液,观察想象。
现象:
涉及反应方程式:
【归纳与总结】碳酸钠和碳酸氢钠的性质比较
1.如何除去固体Na2CO3中混有的NaHCO3?
2.如何除去NaHCO3溶液中混有的Na2CO3?
3.如何检验NaHCO3溶液中混有的Na2CO3?
4.如何检验Na2CO3溶液中混有的NaHCO3?
三.侯德榜制碱法的原理
四.钠的化合物用途
【当堂训练】
1.关于Na2CO3和NaHCO3下列比较正确的是()
①相同温度下,Na2CO3的溶解度比NaHCO3大;②Na2CO3的热稳定性比NaHCO3强
③相同物质的量浓度的Na2CO3和NaHCO3溶液,Na2CO3溶液的PH值比NaHCO3溶液的PH值大;
④等量Na2CO3和NaHCO3分别和盐酸反应,剧烈程度是Na2CO3强于NaHCO3⑤相同质量的Na2CO3
和NaHCO3分别和盐酸反应产生的CO2在相同条件下的体积是NaHCO3大于Na2CO3;⑥相同质
量的Na2CO3和NaHCO3分别和盐酸反应产生的CO2在相同条件下的体积是Na2CO3大于NaHCO3;
A.①②③④⑤⑥ B.①②③⑤ C.①③④⑤ D.①②③
【巩固练习】
一、选择题
1.碳酸钠具有的用途是 ( )
①作发酵粉;②造纸;③制皂;④治疗胃酸过多;⑤纺织。
A.①③④
B.②③⑤
C.①②③④
D.②⑤
2.下列几组物质中,俗名与化学式一致的是()
A.烧碱:Na2CO3
B.小苏打:NaHCO3
C.苏打:Na2SO4·10H2O
D.胆矾:CuSO4
3.下列物质热稳定性最强的是()
A.石灰石
B.纯碱
C.小苏打
D.碳铵
4.下列有关Na2CO3和 NaHCO3的说法正确的是 ( )
A. 在水中溶解度: Na2CO3 < NaHCO3
B. 二者都能与酸反应生成CO2
C. 热稳定性: Na2CO3 < NaHCO3
D. 二者在相同条件下可相互转化
5. 能用来鉴别 Na2CO3和 NaHCO3两种白色固体最恰当的方法是()
A. 加热
B. 溶解
C. 加Ca(OH)2
D. 加烧碱
6.二氧化碳气体中含有少量氯化氢,要想除去氯化氢,最好用下列哪种溶液()
A.氨水 B.浓硫酸 C.饱和碳酸氢钠溶液 D.饱和石灰水
7.下列钠的化合物及其性质或用途不相符的是()
A.Na2O2—淡黄色固体,可用做漂白剂 B.Na2O—白色固体,性质不稳定
C.NaHCO3—受热易分解,可用做发酵粉 D.Na2CO3—性质稳定,可冶疗胃酸过多
8.常温下,向下列溶液中通入足量的CO2有明显变化的是:()
A.饱和Na2CO3溶液 B.NaOH稀溶液 C.饱和NaHCO3溶液 D.CaCl2溶液
9.下面是比较过氧化钠与氧化钠性质异同点的有关叙述,其中正确的是()
A.过氧化钠和氧化钠都是白色固体物质
B.过氧化钠和氧化钠都能与CO2或水发生化合反应
C.过氧化钠和氧化钠与水反应都有NaOH生成
D.过氧化钠是强还原剂,氧化钠是一种碱性氧化物
10.可以用来断定碳酸氢钠粉末中混有碳酸钠的实验方法是 ( )
A.加热时有无色气体放出
B.溶于水后,滴加稀氯化钡溶液有沉淀生成
C. 滴加盐酸时有气泡产生
D.溶于水后,滴加澄清石灰水有白色沉淀生成
11.加热 5.00g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减小了
0.31g,则原混合物中碳酸钠的质量为()
A.3.88g
B.4.58g
C.4.16g
D.4.41g
12.将7.8gNa2O2溶解在92.2g水中,所得溶液溶质的质量分数是()
A.等于7.8% B.大于8% C.等于 8% D.小于 7.8%
13.有关NaHCO3和Na2CO3的性质,以下叙述错误的是()
A.等质量的NaHCO3和Na2CO3与足量的盐酸反应,产生CO2的质量Na2CO3大
B.等物质的量的NaHCO3和Na2CO3与足量的盐酸反应,产生CO2的质量一样大
C.CaCl2溶液加入到NaHCO3溶液中不产生沉淀,加入到Na2CO3溶液中产生白色沉淀
D.除去Na2CO3固体中混有的少量NaHCO3的最好方法是加热
14.向紫色石蕊试液中加入过量Na2O2粉末,振荡,下列叙述中正确的是( ) A.溶液仍为紫色 B.最后溶液变蓝色 C.最后溶液褪色 D.有气泡产生
15.在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水碳酸钠,搅拌后静置,最终所得晶体的质量:()
A.等于1.06g
B.大于1.06g而小于2.86g
C.等于2.86g
D.大于2.86g
16. 在10mL 0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后,在标准状况下产生二氧化碳的体积为()A.1.344mL B.2.24mL C.0.672mL D.0mL
二、填空题
1.(1)若在碳酸钠饱和溶液中不断通入二氧化碳,将有晶体析出,该晶体是,反应的化学方程式为。
析出晶体的两个主要的原因是:
①,②,③
2.等物质的量的Na2CO3和NaHCO3消耗盐酸的物质的量之比为,生成CO2的物质的量之比为。
3.除去下列物质中的少量杂质
碳酸钠固体中的碳酸氢钠,方法是____ __ __,反应方程式______ ______。
碳酸氢钠溶液中的碳酸钠,方法是 __ _ __,反应方程式___ _ ______。
NaOH溶液中的碳酸钠,方法是_________ __,反应方程式_____ _______。
4.下图中A至F是化合物,G是单质
写出A、B、E、F的化学式:A ;B ;E ;F 。
5.苏打和小苏打有着广泛的应用。
试从消耗反应物的量等角度,回答下列问题:
⑴作为泡沫灭火器的药品,选用,因为。
⑵用于洗涤餐具及实验室的玻璃仪器等,选用,因为。
⑶胃溃疡(胃壁溃烂或穿孔)病人的胃酸过多,医生给服用Al(OH)3胶乳,既不用苏打也不用小苏打,是因为。
6.某学生向老师请教了如下问题:“如何除去NaHCO3溶液中含有的少量NaOH”,老师看后认为该问题有科学性错误,请你指出其中的错误:
_______________________________________________________________
三、计算题
1.将某碳酸钠和碳酸氢钠混合物2.74g加热到质量不再变化时,剩余物质的质量为2.12g。
求(1)混合物中碳酸钠的质量分数?
(2)往加热后的剩余物中加入足量的盐酸,可生成CO2多少克?
家长评价签字。
