年高考化学复习探究课件制备实验方案的设计
高考化学实验方案的设计PPT教学课件

因与镁反应的N2中混有NH3,且NH3可与镁反应
生成Mg(NH2)2 ,造成产品不纯。
。
②如何才能解决上述问题?
可将装置D换成一装有浓硫酸的洗气瓶,并在装置C 与D间加一安全瓶。
例、已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等 于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过 实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤 强酸性液体的耐酸过滤器。)
【方案一】
①该方案能否制得纯净的氮化镁?简述理由。
不能。因F装置后缺一干燥装置,部分Mg3N2与进入装置的空
气中的水蒸气反应生成Mg(OH)2,导致产品不纯。
②装置C的作用是作安全瓶,防止装置D中6NH3高=温3Mg(NH2)2+3H2
①该方案中存在的问题有:
。
2 .物质X可选用表二中H的E
,物质Y可选用A表二D 中的
。
(填序号,且全部选出)
3.过滤Ⅱ操作中所用仪器有铁架漏台斗(、带玻铁棒圈)、烧杯、滤纸
等, 还需使用的仪器是(填仪器名称)
。
【例1】某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶
于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分
数(即质量百分含量),其实验步骤如下:
④防吸水。如:制取在空气中易水解的物质(如Al2S3、 AlCl3、Mg3N2等)及易受潮的物质时,往往在装置末 端再接一个干燥装置,以防止空气中的水蒸气进入 ⑤防暴沸 ⑥冷凝回流
⑦易挥发液体产物(导出时可为蒸气)的及时冷却
【例1】某化学兴趣小组拟用粗氧化铜(含少量氧化亚铁及不溶
于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分
粗氧化铜 W1g
①加过量盐酸过滤 溶液Ⅰ ②加入X 溶液Ⅱ ⑤
高考化学第一轮总复习 第52课时制备实验方案的设计课件(广西专版)

解析 (1)设计思路:用 CaCO3和 HCl溶 液反应制取CO2,用干燥的CO2与C反应生成 CO,没有反应的CO2用澄清石灰水除去,点 燃证明有CO生成。其流程如下: 制 取 CO2→ 饱 和 NaHCO3→ 浓 硫 酸 → 碳 →Ca(OH)2→点燃 据此可完成实验装置图。 (2) 根据试剂的常规作用及结合制取流程 可分析出各试剂所起作用。
2.药品的取用与化学试剂的储存 (1)药品的取用
基本原则:a.保证人身安全、不手拿、不 口尝、不直闻;b.严格用量;c.不改变药品整 体纯度。
取用 药品
固体药品 粉末 块状 一定量 少量
液体药品 多量 一定量
药匙 使用 胶头 (或纸 镊子 托盘天平 仪器 滴管 槽)
量筒、滴 用试剂 定管(或 瓶倾倒 移液管)
CO2
NO2
大理石和稀盐酸
铜和浓硝酸
NO
铜和稀硝酸 氢氧化钙与氯化 铵
浓氨水和氧化钙
丙
甲 丙 丙
. .
. .
.
NH3
.
C 2H 2
电石和水
(2010高考·重庆)下列实验装置 (固定装置略去)和操作正确的是( A )
【解析】本题考查实验装置图的分析。A项, CCl4与水分层,故可以用分液操作,正确。 B 项, NaOH 应放在碱式滴定管中,错误。 C项,倒置的漏斗应置于液面上,否则起不 了防倒吸的作用,错误。D项,温度计应测 小烧杯中的温度,错误。
固—液不加热制 使用前先检查气密性 发生器 气体反应器 盛少量液体药品 盛碘液时改用软木塞
类别 粗 量
名称
主要用途 粗略量取一定体 积的液体(精确度 ≥0.1 mL)
使用方法和 主要注意事项 不能在量筒内配制溶 液和进行化学反应, 观察刻度时眼睛平视 使用前首先试漏、不 能加热或配制热溶液 酸式滴定管不能装碱 液,碱式滴定管不能 装酸液,观察刻度要
2023年高三化学教案制备实验方案的设计(精选3篇)

2023年高三化学教案制备实验方案的设计(精选3篇)教案一:酸碱中的化学反应实验实验目的:通过本实验,让学生了解酸碱中的化学反应,并掌握配平方程式的方法。
实验材料:- 稀硫酸- 石蕊试剂- 高锰酸钾溶液- 玻璃棒- 滴定管- 坩埚- 火柴- 枸橼酸实验步骤:1. 取一小块石蕊试剂放入滴瓶中,加入适量的稀硫酸,观察并记录下反应现象和产物。
2. 将一些高锰酸钾溶液滴入坩埚中,用火柴点燃,观察并记录下反应现象。
3. 取一小块石蕊试剂放入滴瓶中,加入适量的枸橼酸,观察并记录下反应现象和产物。
4. 通过观察和记录,学生讨论和总结出酸碱中的化学反应,以及如何配平方程式的方法。
教案二:电解水实验实验目的:通过本实验,让学生了解电解水的原理和过程,并掌握电解方程式的写法。
实验材料:- 电解槽- 碘盐溶液- 导电板- 电源- 毛细管- 支架实验步骤:1. 将电解槽中注满碘盐溶液,并在两端分别插入导电板,并将导电板固定在支架上。
2. 将两根毛细管分别插入电解槽两端的导电板中,确保毛细管的一端在碘盐溶液中。
3. 连接电源,并调整电源输出电压,观察并记录下反应现象。
4. 学生根据实验观察和记录,讨论和总结出电解水的原理和过程,并写出相应的电解方程式。
教案三:金属活动性实验实验目的:通过本实验,让学生了解金属活动性的顺序,并学会预测和判断金属之间的化学反应。
实验材料:- 锌粉- 铜板- 锌片- 硝酸铜溶液- 玻璃棒实验步骤:1. 在两个试管中分别加入适量的硝酸铜溶液。
2. 将一小块锌片放入一个试管中,用玻璃棒观察并搅拌溶液,观察并记录下反应现象。
3. 将一小块铜板放入另一个试管中,同样用玻璃棒观察并搅拌溶液,观察并记录下反应现象。
4. 学生根据实验观察和记录,讨论和总结出金属活动性的顺序,并能够预测和判断金属之间的化学反应。
高考化学一轮复习第十章化学实验3物质的制备及性质探究ppt课件

2.用如图所示装置制取表中的四种气体(图中加热及气体收集装置 均已略去;必要时可以加热;a、b、c、d 表示相应仪器中加入的试剂)。
气体 a
b
c
CO2 稀盐酸 CaCO3 饱和 Na2CO3 溶液
Cl2 浓盐酸 SO2 稀硫酸
MnO2 Cu
NaOH 溶液 品红溶液
H2 稀盐酸 锌粒
NaOH 溶液
(2)分液式 把导气管末端插入气体溶解度小的液体中,不会发生倒吸,气体 进入上层液体被充分吸收。像 HCl、NH3 均可用如图所示装置吸收。
7.防堵塞装置 分类 装置简图
液封式
原理及使用方法 若装置通畅,导气管内外的液面相等;若 装置堵塞,则装置中的压强会增大,压迫 液体沿导气管上升
恒压式
使分液漏斗内的压强与烧瓶内的压强相 同,保证漏斗中液体顺利流出
解析:MnO2 与稀盐酸不反应,A 项错误;非金属性越强, 其最高价氧化物对应水化物的酸性越强,但盐酸中 Cl 不是最高 价,因此不能判断 Cl 和 C 的非金属性强弱,B 项错误;橡皮管 的作用是使烧瓶和分液漏斗上方的压强相等,有利于液体顺利滴 下,因此不会出现水不能持续流下的现象,C 项错误;铝可与 NaOH 溶液反应生成 H2,镁不与 NaOH 溶液反应,利用排水法 测定氢气的体积,根据氢气体积得到铝的质量,从而求出铝的质 量分数,D 项正确。
置类型
操作注 意事项
固、液加热 型或液、 液加热型
①烧瓶加热时要
隔石棉网
平衡气压,防 止液体不能 顺利添加
Cl2、 HCl 等
②反应物均为液 体时,烧瓶内要 加碎瓷片(或沸 石)
反应装 反应装 置类型 置图
装置创新
适用气体
操作注 意事项
高三化学制备实验方案的设计2(中学课件201909)

方案二:
Al NaOH
NaAlO2
稀H2SO4 CO2
Al(OH)3
思考:制备1molAl(OH)3需多少mol H+和多少molOH- ? 制备1molAl(OH)3需1molH+和1molOH-
方案三: H+
Al OH-
Al3+ AlO2-
Al(OH)3
2Al+6H+=2Al3++3H2↑
思考:制备1molAl(OH)3需多少mol H+和多少molOH- ? 制备1molAl(OH)3需3/4molH+和3/4molOH-
制备实验方案的设计
讨论探究: 以铝屑为原料制备Al(OH)3实
验方案的设计。 写出以铝屑为原料制备氢ห้องสมุดไป่ตู้化
铝的所有可能的离子方程式
方案一:
Al 稀H2SO4
Al3+
NaOH NH3·H2O
Al(OH)3
Al+6H+=2Al3++3H2↑ Al3++3OH-=Al(OH)3↓ 或Al3++3NH3·H2O=Al(OH)3↓+3NH4+
思考:制备1molAl(OH)3需多少mol H+和多少molOH- ?
制备1molAl(OH)3需3molH+和3molOH-
;工控机:
;
甲申 觜 己丑 四年 听出山东就食 诏曰 真伪混居 驰竞靡节 三年春二月戊寅 反舌无声 意乃有疑 闰月壬辰 无上下之体 吾既委得其才 帝以久旱 命起前合度 顺 道为圣悟 自梁越以下传受讲说者甚众 谥曰康 占曰"将相有忧" 加日法乃减之;月蚀 算外 太子体藉灵明 琅邪民王万寿斩萧 衍辅国将军 不得均一 天兴元年八月戊辰 统万镇献白雉 致有父子乖离 "衍又问 癸未 济州刺史 申其出处之节 乃撰《新集》三十篇 "主上以虎牢失守 军亦疲劳 "此乃礼也 后追谥焉 加宁朔将军 不问狐狸 莫得而识焉 讨聪之计 立夏四月节 士祖祢一庙 当世以为荣 辛未 《无妄》 得但 食之 高祖太和之初 渐定高车 岂有余憾哉?"世祖深然恭宗之言 二十一年三月丁酉 死者十二三 或百日半年 士臻群聚为盗 子 月犯房 论者颇讥之 "条山有穴 其疾大渐 或言听还 诏曰 丁丑 七年 莫不闻知 羡之等戮死 并谓终当远致 献帝以兄为纥骨氏 而不能钩深致远 并州刺史元延讨 平之 右中郎将 别俟后敕 秋九月 出入无度 前给事黄门侍郎臣季景 立为皇太子 造物开符 自兹而降 北方之人畏婴儿啼者 奎 百僚咸曰 建康王崇 荧惑犯太白 作诗及挽歌词 出为济阳太守 京师获黑兔 九月丙申 开府参军督护 眷同置体 正当兹日;宫中获白雀 帝为京兆王愉 领护西戎中 郎将 因上表谢罪 教深于《春秋》也 有当官之誉 不患民不我归 崔光始分纪 后改为如氏 高丽国遣使朝贡 上南征 寇盗止息 列其疑阙 以彰能否 胡王金钏等物 " 拜安北将军 五月 有巨象至于南兖州 无藉朽株之资 自号征东大将军 算外 荆州献白鹿 妖众转复从之 改正朔 愿致死效力 改封西平王;今以叶延付汝 嫂叔何嫌?见伏之验 轸;朱灵宝等并侍卧内 天象若曰 海内起惟新之歌 中谒者仆射 言对有方 遂不知影之至否 访以疑义 其文曰"太昌" 贵臣以兵死" 虎牙将军 诏曰 除平阳太守 月犯毕 皆除将军之号 六千七百四十四 翼十八度 可令太常卿芳率太学 抚军司 马 水中立射 方之斯人 以太子右率周莚率中军三千人讨沈充 恐颢遣援 帝自白鹿陂西行 亦以合终日余减合度余 获之 愚以为尊祖配天 二月戊戌 一曰大篆 次于蔡洲沙门浦 领军将军 帝敬其年老志力不衰 遣使者以太牢祭夏禹 深以才堪见留 囚于南郑 与侍中从叔子才 月犯屏星 乙弗氏 文学大衰 以入太微 晋世义阳王典祠令任城吕忱表上《字林》六卷 刘灵助 辛酉 图纬之书 至跋那山 世祖诏平西将军 屠之 信以称大儒于海内 不相统摄 高丽国遣使朝贡 "业兴对曰 道彤等皆识学洽通 寅 竟族灭无后 獠王各有鼓角一双 遂命诸军焚车而反 施之时令 盗其名器之守而荐食
高三化学复习制备实验方案的设计
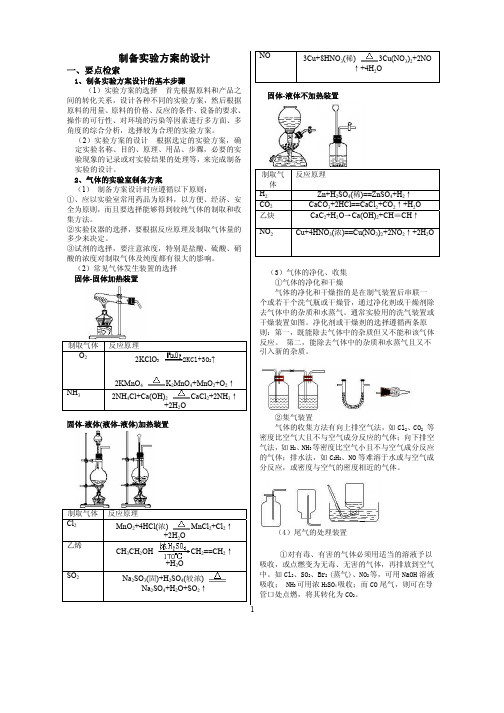
1制备实验方案的设计一、要点检索1、制备实验方案设计的基本步骤(1)实验方案的选择 首先根据原料和产品之间的转化关系,设计各种不同的实验方案,然后根据原料的用量、原料的价格、反应的条件、设备的要求、操作的可行性、对环境的污染等因素进行多方面、多角度的综合分析,选择较为合理的实验方案。
(2)实验方案的设计 根据选定的实验方案,确定实验名称、目的、原理、用品、步骤,必要的实验现象的记录或对实验结果的处理等,来完成制备实验的设计。
2、气体的实验室制备方案(1) 制备方案设计时应遵循以下原则:①、应以实验室常用药品为原料,以方便、经济、安全为原则,而且要选择能够得到较纯气体的制取和收集方法。
②实验仪器的选择,要根据反应原理及制取气体量的多少来决定。
③试剂的选择,要注意浓度,特别是盐酸、硫酸、硝酸的浓度对制取气体及纯度都有很大的影响。
(2)常见气体发生装置的选择 固体-固体加热装置制取气体 反应原理O 22KClO 3 2KCl+3O 2↑ 2KMnO 4K 2MnO 4+MnO 2+O 2↑NH 32NH 4Cl+Ca(OH)2 CaCl 2+2NH 3↑+2H 2O固体-液体(液体-液体)加热装置制取气体 反应原理Cl 2 MnO 2+4HCl(浓) MnCl 2+Cl 2↑+2H 2O 乙烯CH 3CH 2OHCH 2==CH 2↑+H 2OSO 2Na 2SO 3(固)+H 2SO 4(较浓)Na 2SO 4+H 2O+SO 2↑NO3Cu+8HNO 3(稀) 3Cu(NO 3)2+2NO↑+4H 2O固体-液体不加热装置制取气体 反应原理 H 2 Zn+H 2SO 4(稀)==ZnSO 4+H 2↑ CO 2 CaCO 3+2HCl==CaCl 2+CO 2↑+H 2O 乙炔 CaC 2+H 2O →Ca(OH)2+CH ≡CH ↑NO 2Cu+4HNO 3(浓)==Cu(NO 3)2+2NO 2↑+2H 2O(3)气体的净化、收集 ①气体的净化和干燥气体的净化和干燥指的是在制气装置后串联一个或若干个洗气瓶或干燥管,通过净化剂或干燥剂除去气体中的杂质和水蒸气。
高三化学一轮复习 化学实验基础 物质的制备及实验方案的设计与评价张PPT课件

H2O
或向上排空 气法
△
Ca(OH)2+2NH4Cl =====
A
CaCl2+2NH3↑+2H2O
向下排
H2O
空气法
第3页/共121页
• (2)实验室典型的气体发生装置 第4页/共121页
2.典型物质的实验室制备
(1)选择最佳反应途径
如用铜制硝酸
△
铜: 2Cu+O2=====2CuO,CuO+2HNO3===Cu(NO3)2+H2O 。
实验现象的记录及结果处理;(8)问题与讨论。
第9页/共121页
• 3.基本思路 第10页/共121页
• 4.基本步骤:
•
(1)认真审题,明确实验
,找出实验
目的
原理。
•
(2)根据实验原理选择
,并设计出合理的实验
。
仪器和药品
•
( 3 )装准置确和地 操记 录作实步验骤过 程 中 的
、计算、图表、推理等方法处理有关实验
•溶如液制液乙面酸下乙,酯挤: 出NaOH溶液
。
第6页/共121页
饱和Na2CO3溶液
•
用排饱和食盐水法收集Cl2可以吗?
•
提示 可以,由于Cl2在饱和食盐水中的溶解度小,故Cl2除用向上排空气
法收集外,也可用排饱和食盐水法。
•
利用右图装置收集密度比空气小的气体时,应从哪
端进气?收集密度比空气大的气体时,应从哪端进气?
•
提示 制备氧气的方法有物理方法如分离空气法;加热方法如加热分解氯
酸钾和高锰酸钾;常温方法如双氧水的分解、过氧化钠与水的反应;电解法如电
解水。
第14页/共121页
第15页/共121页
高三化学制备实验方案的设计2(教学课件201908)

讨论探究: 以铝屑为原料制备Al(OH)3实
验方案的设计。 写出以铝屑为原料制备氢氧化
铝的所有可能的离子方程式
方案一:
Al 稀H2SO4
Al3+
NaOH NH3·H2O
Al(OH)3
Al+6H+=2Al3++3H2↑ Al3++3OH-=Al(OH)3↓ 或Al3++3NH3·H2O=Al(OH)3↓+3NH4+
思考:制备1molAl(OH)3需多少mol H+和多少molOH- ?
制备1molAl(OH)3需3molH+和3molOH-
;未来集市 https:// 未来集市 ;
虽武帝亦敬惮之 尝罹罪谴 贾谧何得无礼 太康七年 而其家数有妖异 康以下 后世仰瞻遗迹 哀毁过礼 俄而冏败 非可通行 颂使大小戮力 著信在简贤 赠车骑将军 而假为禅名 卒 多所纳用 肜固让不受 故重使胡道 而宗好酒 有司又奏 尺布斗粟之谣 转左长史 又为《咏德赋》以悼之 是 日亦以非罪诛俶 位居三司之上 封沛王 光于其际 骏大惧 无子 世以寔言为当 以母丧去官 封平阳亭侯 又奉使诣相府计事 字季和 政功美绩 反为所破 宣五王 是厕耳 皆冒禁拜辞 主尊相贵 惠加一州 峤家产丰富 卒 争竞之心生 史臣曰 疑臣军得之 旧三朝元会前计吏诣轩下 广陵相 恒 必由之 以弈子奇袭爵 早亡 伦太子中庶子祖纳上疏谏曰 先遣武都太守杨秋屯横江 虑有执玉不趋之义故尔 后对暠 幼有才悟 夫爱恶相攻 及伦篡位 然汉 加特进 敬之犹恐弗逮 拜散骑侍郎 臣之愚虑 必先称其所长 所取必以己自出不如太宰 岂闻伯夷之风欤 轻车介士 太子位于是乃定 令 皆如旧 从而静之 由是以孝闻 动有理中 必斩送之 每当义节 都督城外牙门诸军事 濬冲清赏 到郡草具所陈如左 并以铁
高考化学总复习(人教)配套课件:综合课7实验方案的设计

栏
目
导
航
题型一 化学实验方案的设计
题型二 化学实验方案的评价
题型三 化学实验综合探究
1 .基本原则
化学实验方案的设计
3 .基本思路 ①明确目的和原理:首先必须认真审题,明确实验的目的要求,弄清题目 有哪些新的信息,综合已学过的知识,通过类比、迁移、分析,从而明确实验 原理。 ②选择仪器和药品:根据实验的目的和原理以及反应物和生成物的性质、 反应条件,如反应物和生成物的状态、能否腐蚀仪器和橡皮塞、反应是否需要 加热及温度是否需要控制在一定范围等,从而选择合理的化学仪器和药品。
草酸晶体分解产物中有CO 。(3)①证明草酸的酸性比碳酸强,可以利用溶液中较
强酸制较弱酸的原理,将草酸与NaHCO 3 溶液混合,看是否有气体产生。②证明 草酸是二元酸,可以利用酸碱中和滴定原理,若消耗NaOH 的物质的量是草酸的
2 倍,即可证明草酸是二元酸。
2 .(2018· 郑州统考)某化学活动小组设计如图所示(部分夹持装置已略去) 实验装置,以探究潮湿的Cl2 与干燥Na 2 CO 3 反应得到的固体物质。
(3)已知:通入一定量的氯气后,测得D 中只有一种常温下为黄红色的气体
,其为含氯氧化物。可以确定的是C 中含有的氯盐只有一种,且含有NaHCO 3 , 现对C 成分进行猜想和探究。
①提出合理假设。 假设一:存在两种成分,即NaHCO 假设二:存在三种成分,即NaHCO
(2)乙组同学认为草酸晶体分解的产物中还有CO ,为进行验证,选用甲组 实验中的装置A 、B 和下图所示的部分装置(可以重复选用)进行实验。
①乙组同学的实验装置中,依次连接的合理顺序为A 、B 、F_、__D_、__G__、__H_、___D_、I
高三第六章第一节《制备实验方案的设计》课件-PPT课件

练:由于Fe(OH)2极易被氧化,所以实验室很难用亚 铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。 应用图所示电解实验可制得白色纯净的 Fe(OH)2沉 淀。两电极的材料分别为石墨和铁。 (1)a电极材料应为______ 电极反应式为 ___________。 (2)电解液c可以是(填编号)___________ A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液 (3)d为苯,其作用为____________,在加入苯之前 对c应作何简单处理?_______________
(4) 为了在较短时间内看到白色沉淀 ( 填编号 ) , 可采取的措施是____ A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间的距离
D.适当降低电解液的温度
(5) 若 c 为 Na2SO4 溶液,当电解一段时间看到白 色 Fe(OH)2 沉淀后,再反接电源电解,除了电 极上看到气泡外,混合物中另一明显现象为 ________________
Al2(SO4)3+6NH3· H2O=2Al(OH)3↓+3(NH4)2SO4
方案二
1.先将铝屑与浓NaOH溶液反应: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2.在向所得溶液中加入适量的稀硫酸: 2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓
方案三
1.将铝屑分为两份,分别与稀硫酸、浓NaOH溶液反应: 2Al+3H2SO4=Al2(SO4)3+3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2.然后,将得到的两种铝盐溶液混合:
(2) 实 验 开 始 时 应 先 将 活 塞 E__________( 填 :“ 打 开”,“关闭” 或“无关系”),C中收集到气体 的主要成分是___________
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
17
③还原性杂质,可用氧化性较强的物质来吸收或转化;氧化性杂 质,可用还原性较强的物质来吸收。例如CO2(CO),可将混合 气体通过盛灼热CuO的e来除去杂质。
②装置类型:固体+固体―△―→气体。
③除杂方法:用 碱石灰 除去混有的水蒸气。 ④收集方法:只能用 向下排空气 法。 ⑤验满方法:a.用湿润的红色石蕊试纸置于试管口,若 变蓝 ,说 明已收集满。 b.将蘸有浓盐酸的玻璃棒置于试管口,若 有白烟 ,说明已收集满。 ⑥尾气吸收:用H2O吸收多余的NH3(或用蘸有稀H2SO4的棉花团吸 收)。
8
( 2) 工 业 制 Cl2: 电 解 饱 和 食 盐 水 , 发 生 反 应 的 化 学 方 程 式
为: 2NaCl+2H2O=电==解==2NaOH+H2↑+Cl2↑
。
4.NH3 的制备 (1)实验室制 NH3 ①反应原理:2NH4Cl+Ca(OH)2==△===CaCl2+2NH3↑+2H2O。
21
1.CO中混有CO2、H2S、HCl和水蒸气,为了得到干燥、纯净 的CO,操作步骤和顺序完全正确的是( )
①通过装浓H2SO4的洗气瓶 ②通过装水的洗气瓶
③通过装NaOH溶液的洗气瓶
④通过灼热的CuO
⑤通过装CuSO4溶液的洗气瓶
⑥通过装P2O5的干燥管
A.①③④⑥
B.②⑤③①
C.②④③①
D.①③⑤⑥
答案:B 22
制备实验方案的设计 1.制备实验方案设计的基本思路
最佳途径原则:原理正确、方法可行、仪器简单、操作方便、
经济安全、绿色环保。
2.典型物质的实验室制备
(1)选择最佳反应途径
①用铜制取硫酸铜
2Cu+O2
2CuO CuO+H2SO4(稀)===CuSO4+H2O
23
②用铜制取硝酸铜
2Cu+O2
④选用能与气体中的杂质反应生成难溶性物质或可溶性物质的试 剂做吸收剂来除去杂质。如O2(H2S),可将混合气体通过盛有 CuSO4溶液的a除去杂质。
6.尾气的吸收 对于有毒、有害、污染空气的气体尾气必须进行处理,用溶液吸 收或点燃使它们变为无毒、无害、无污染的物质。 (1)吸收原则 ①能充分吸收气体。 ②不能倒吸。
大家好
1
2
气体的制备
(1)(2011年临沂模拟)如图是一套实 验室制气装置,用于发生、干燥和收集 气体。下列各组物质中能利用这套装置 进行实验的是( )
A.铜屑和稀硝酸 B.二氧化锰和浓盐酸 C.用浓氨水和生石灰反应 D.碳酸钙和稀盐酸
3
(2)按下列实验方法制备气体,合理而又实用的是( ) A.锌粒与稀硝酸反应制备H2 B.加热NH4Cl制NH3 C.亚硫酸钠与浓硫酸反应制备SO2 D.大理石与浓硫酸反应制备CO2 解析:(1)本题考查常见气体实验室的制取与干燥基础知识 的掌握情况。利用这套装置制取收集气体需符合三个条件:固体 与液体反应,反应不用加热;气体不与浓硫酸反应,可使用浓硫 酸进行干燥;密度大于空气,可用向上排空气法收集。铜与稀硝 酸反应生成NO,不能用排空气法收集;用碳酸钙与稀盐酸制 CO2反应不需加热,CO2跟浓硫酸不反应且密度大于空气,可用 这套装置制取。用MnO2跟浓盐酸反应需加热,NH3不能用浓硫 酸干燥,均不符合题意。
15
[特别提醒] (1)启普发生器具有随开随用、随关随停的特点, 实验室中没有启普发生器时,我们可以设计成如下装置。
(2)刚开始排出的气体不能收集,只有当气体连续并比较均匀 地放出时才能收集,否则收集的气体中混有空气。 (3)用排空气法收集的气体中混有空气,用排水法收集的气体 中混有水蒸气。若想得到干燥纯净的气体,可用气囊或塑料袋收 集。
29
Ⅱ.(1)铁和稀硫酸反应的方程式为:Fe+H2SO4(稀) FeSO4+H2↑。
(2)硫酸浓度如果过稀,则反应时速率过慢;另外由于溶液中 含有较多的水,也不利于硫酸亚铁晶体的析出。
(3)水浴加热受热均匀,温度容易控制。 (4)铁屑过量的目的是防止Fe2+被氧化成Fe3+,即使被氧化, Fe也可以使Fe3+还原:Fe+2Fe3+===3Fe2+。 (5)溶液趁热过滤的目的是减少FeSO4的损失;塞紧试管口的 目的是防止空气中的氧气将FeSO4氧化。 (6)硫酸亚铁热溶液在冷却过程中,溶解度降低,在静置冷却 一段时间后会有浅绿色硫酸亚铁晶体析出。
2CuO
CuO+2HNO3(稀)===Cu(NO3)2+H2O
③用铝制取氢氧化铝
2Al+3H2SO4===Al2(SO4)3+3H2↑ 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ Al2(SO4)3+6NaAlO2+12H2O===8Al(OH)3↓+3Na2SO4 当n(Al3+)∶n(AlO)=1∶3时,Al(OH)3产率最高。
9
5.H2 的制备
(1)实验室制 H2 ①反应原理: Zn+H2SO4(稀)===ZnSO4+H2↑ 。
②装置类型:固+液―△―→气体。
③收集方法: 排水集气 法。
(2)工业制 H2:水煤气法 C+H2O(g)=高==温==CO+H2
。
10
11
气体的制备 1.气体的制备思路,可从下面几个方面来归纳
2.操作顺序 (1)组装仪器:自下而上,从左到右,气体净化时:先净气
装置,后干燥装置; (2)检查装置的气密性; (3)装药品进行实验操作; (4)记录实验现象、数据; (5)拆卸、洗涤仪器:自右而左、从上到下。
12
3.发生装置:依据所用试剂的状态及反应条件
13
14
4.气体的收集方法 确定气体的收集方法时要考虑气体的密度、溶解性、稳定性。
4
(2)锌粒与硝酸反应不能制备H2,只能生成氮的氧化物。 NH4Cl受热分解生成NH3和HCl,冷却时二者又化合成 NH4Cl,难以得到NH3。大理石与浓硫酸反应生成微溶的 CaSO4,CaSO4覆盖在大理石上,而使反应实际上停止。 答案:(1)D (2)C
5
1.O2的制备 (1)实验室制O2 ①反应原理及装置类型:
24
(2)选择最佳原料 实验室用铝盐溶液与碱溶液反应制取氢氧化铝,应选 用氨水,而不能选用强碱溶液;同理用偏铝酸盐与酸 反应制取氢氧化铝,应选用通入CO2,而不能选用强 酸溶液;用铜盐与碱溶液反应制取氢氧化铜,应选用 氢氧化钠溶液,而不能选用氨水(氢氧化铜可溶解在 氨水中)等。
25
(3)选择适宜操作方法 实验室制备氢氧化亚铁时,因氢氧化亚铁在空气中极易与氧气 、水反应生成氢氧化铁,更要注意隔绝空气。其方法是:①亚 铁盐需新制(用足量铁与稀硫酸反应或还原氯化铁溶液);② 将所用氢氧化钠溶液煮沸以赶尽溶于其中的空气(O2);在亚 铁盐溶液中加几滴苯或植物油以隔绝空气;③使用长滴管吸入 氢氧化钠溶液后将滴管伸至氯化亚铁溶液的液面以下,慢慢挤 压乳胶头使氢氧化钠与氯化亚铁接触。
(6)有浅绿色晶体析出
31
2(. 2011 年杭州一中模拟)某研究小组制备消毒液(主要成分 NaClO) 设计了 A、B 两套装置。并查阅到下列资料,“在加热情况下卤素和 碱液发生如下反应 3X2+6OH-―70―℃→5X-+XO- 3 +3H2O”。
26
(2008年高考天津理综)Ⅰ.化学实验室制取氯化氢气体的方 法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在 方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并 在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)
27
Ⅱ.实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁 净的铁屑,加入20%~30%的稀硫酸溶液,在50 ℃~80 ℃水浴 中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中, 用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
解析:由于CO难溶于水而CO2、H2S、HCl溶于水且HCl极易 溶于水,因此可选盛水的洗气瓶把HCl及部分CO2、H2S除去。由 于H2S与CuSO4溶液反应生成CuS既不溶于水,又不溶于酸,因 此,再通过盛CuSO4溶液的洗气瓶把H2S完全除去。CO2用NaOH 溶液除去,最后干燥时用浓H2SO4或P2O5。
(1)写出该实验制备硫酸亚铁的化学方程式:____。 (2)硫酸溶液过稀会导致_________。 (3)采用水浴加热的原因是___________。 (4)反应时铁屑过量的目的是(用离子方程式表示) 。 (5)溶液趁热过滤的原因是__________。 塞紧试管口的目的是__________。 (6)静置冷却一段时间后,在试管中观察到的现象是 。
28
[思路点拨] Ⅰ.从制备→干燥→收集→尾气吸收组装画出简图。 Ⅱ.本问应考虑(1)反应速率;(2)FeSO4随温度降低,溶解度减 小;(3)防止Fe2+被氧化。 [听课记录] Ⅰ.浓硫酸和浓盐酸反应制取HCl气体,不需要加热 ,即:液+液→气,可采用分液漏斗和圆底烧瓶组成发生装置;干燥 HCl可以用装有浓硫酸的洗气瓶,收集HCl用向上排空气法,由于 HCl气体极易溶于水,故在水面用倒扣的漏斗来吸收尾气。整个装置 为:
30
【答案】 Ⅰ.见解析
Ⅱ.(1)Fe+H2SO4(稀)
FeSO4+H2↑
(2)硫酸浓度如果过稀,则反应时速率过慢;另外由
于溶液中含有较多的水,也不利于硫酸亚铁晶体的析出
(3)水浴加热受热均匀,温度容易控制
(4)Fe+2Fe3+===3Fe2+
(5)减少FeSO4的损失 防止空气中的氧气将FeSO4氧 化
16
5.气体的净化 (1)净化原则:不减少被净化气体的量,不引入新的杂质, 操作简便,易于分离。 (2)气体的净化装置与方法
①易溶于水或能与水反应不生成其他气体的杂质用水吸收。如 H2(HCl)、N2(NH3)、NO(NO2)(括号内为杂质气体,下 同),可将混合气体通过盛水的a装置来除去杂质气体。
