试验室常用溶液及试剂配制试验室常用溶液试剂的配制表一普通酸
(完整版)试验室常用溶液及试剂配制试验室常用溶液试剂的配制表一普通酸
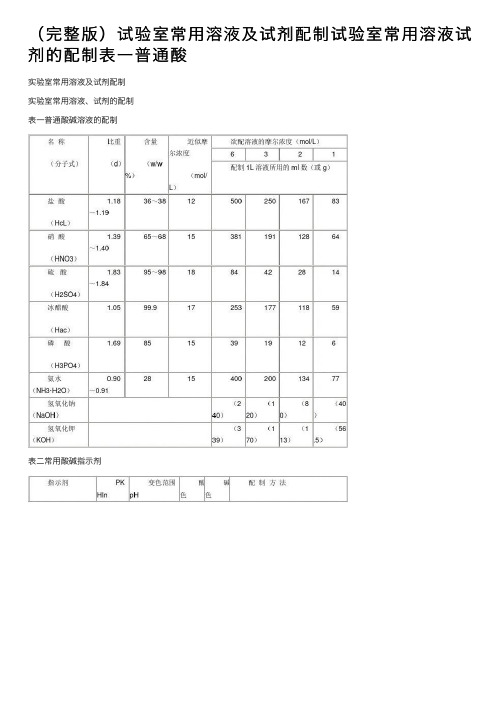
(完整版)试验室常⽤溶液及试剂配制试验室常⽤溶液试剂的配制表⼀普通酸实验室常⽤溶液及试剂配制实验室常⽤溶液、试剂的配制表⼀普通酸碱溶液的配制表⼆常⽤酸碱指⽰剂表三混合酸碱指⽰剂表四容量分析基准物质的⼲燥表五缓冲溶液的配制1、氯化钾-盐酸缓冲溶液2、邻苯⼆甲酸氢钾-氢氧化钾缓冲溶液3、邻苯⼆甲酸氢钾-氢氧化钾缓冲溶液4、⼄酸-⼄酸钠缓冲溶液5、磷酸⼆氢钾-氢氧化钠缓冲溶液6、硼砂-氢氧化钠缓冲溶液7、氨⽔-氯化铵缓冲溶液8、常⽤缓冲溶液的配制实验室常⽤试验⽅法2九、柠檬酸(C6H8O7·H2O)称取试样1.5g(精确到0.0002g)于三⾓瓶内,加⼊⽔50ml溶解,加酚酞指⽰剂3滴,⽤1mol/L 氢氧化钠标准溶液滴定⾄粉红⾊为终点,同时做空⽩试验。
计算:X%(⼀⽔)= (V1-V0)×C×0.06404 m×(1-0.08566)×100X%(⽆⽔)= (V1-V0)×C×0.06404 m×100V1-----消耗氢氧化钠标准溶液的体积,ml;V0-----空⽩所消耗氢氧化钠标准溶液的体积,ml;C------氢氧化钠标准溶液浓度,mol/L;m---样品质量。
⼗、钙含量测定(磷酸氢钙CaHPO4、磷酸⼆氢钙Ca(H2PO4)2·H2O、钙粉等)称取2g(精确到0.0002g)样品,⽤10ml盐酸(1+1)溶解,转移⾄100ml容量瓶中定溶,⽤移液管吸取10ml于250ml锥形瓶中,加50ml⽔,5ml蔗糖溶液(25g/L),2ml三⼄酸胺(1+1),1ml⼄⼆胺(1+1),1滴孔雀绿指⽰液(1g/L),滴加氢氧化钾溶液(200g/L)⾄⽆⾊,再过量10ml,加0.1g盐酸羟胺(每加⼀种试剂都要摇匀),加钙黄绿素少许,在⿊⾊背景下⽤0.05mol/L的EDTA标准溶液滴定⾄绿⾊荧光消失呈现紫红⾊为滴定终点。
实验室常用酸碱指示剂的变色域及配制方法

实验室常用酸碱指示剂的变色域及配制方法1.酚酞指示剂酚酞是一种常用的酸碱指示剂,它呈现鲜红色的酸性溶液和无色的中性或碱性溶液。
它的酸碱变色范围pH为6.8-8.2、配制酚酞指示剂的方法如下:将10g的酚酞溶解在900mL的乙醇中,然后加入100mL的去离子水。
最后将溶液过滤,即可得到酚酞指示剂。
2.酚酞蓝指示剂酚酞蓝是酚酞的氯化钠盐,它可以在碱性溶液中呈现蓝色,而在酸性溶液中呈现红色。
它的酸碱变色范围pH为8.2-10.0。
配制酚酞蓝指示剂的方法如下:将1g的酚酞蓝溶解在100mL的乙醇中,然后加入900mL的去离子水。
最后将溶液过滤,即可得到酚酞蓝指示剂。
3.石蕊试剂石蕊试剂是一种常用的酸碱指示剂,它呈现黄色的酸性溶液和蓝色的碱性溶液。
它的酸碱变色范围pH为5.0-8.0。
配制石蕊试剂的方法如下:将1g的石蕊试剂溶解在100mL的乙醇中,然后加入900mL的去离子水。
最后将溶液过滤,即可得到石蕊试剂。
4.甲基红指示剂甲基红是一种常用的酸碱指示剂,它呈现红色的酸性溶液和黄色的碱性溶液。
它的酸碱变色范围pH为4.4-6.2、配制甲基红指示剂的方法如下:将0.1g的甲基红溶解在100mL的乙醇中,然后加入900mL的去离子水。
最后将溶液过滤,即可得到甲基红指示剂。
5.红色石蕊试剂红色石蕊试剂是一种常用的酸碱指示剂,它呈现红色的酸性溶液和蓝色的碱性溶液。
它的酸碱变色范围pH为4.3-6.2、配制红色石蕊试剂的方法如下:将1g的红色石蕊试剂溶解在100mL的乙醇中,然后加入900mL的去离子水。
最后将溶液过滤,即可得到红色石蕊试剂。
以上是一些常用的酸碱指示剂的变色域及配制方法。
在使用这些指示剂的时候,需要注意其变色范围和pH值,并根据实际需要选择合适的指示剂。
同时,要注意正确保存指示剂,并避免暴露在光线、空气和湿度等不利条件下,以保证其使用效果。
实验室常用药品试剂的配置与使用

实验室常⽤药品试剂的配置与使⽤实验室常⽤药品试剂的制备与使⽤(⼀)认识药品规格纯度规格简写标签颜⾊级别特点(⼆)染⾊试剂的配制1.甲基绿(DNA—绿⾊)和吡罗红(RNA—红⾊)染⾊剂配制:a)A液:取甲基绿2 g溶于98 mL蒸馏⽔中,取吡罗红G 5 g溶于95 mL蒸馏⽔中。
取6 mL甲基绿溶液和2 mL吡罗红溶液加⼊到16 mL蒸馏⽔中,置于棕⾊瓶中备⽤。
b)B液:是⼀种缓冲液,由⼄酸钠和⼄酸混合⽽成。
先取⼄酸钠16.4 g,⽤蒸馏⽔溶解⾄1000 mL备⽤;再取⼄酸12 mL,⽤蒸馏⽔稀释⾄1000 mL备⽤。
取配好的⼄酸钠溶液30 mL和稀释的⼄酸20 mL,加蒸馏⽔50 mL,配成pH为4.8的B液(缓冲液)。
c)取A液20 mL和B液80 mL混合,就是实验中所⽤的吡罗红甲基绿染⾊剂。
应该注意的是该试剂应现⽤现配。
2.I2-KI溶液(淀粉—蓝紫⾊,蛋⽩质—黄⾊)配制:将碘化钾3g溶于蒸馏⽔中,待全部溶解后加⼊碘1g,振荡使其溶解,将此液保存在棕⾊玻璃瓶内。
3.苏丹Ⅲ或苏丹Ⅳ(⽊栓化、⾓质化细胞壁—红⾊,脂肪、挥发油、树脂等—红⾊或淡红⾊)配制:苏丹Ⅲ或苏丹Ⅳ⼲粉0.1g与95%⼄醇10 mL混合,过滤后再加⼊10 mL⽢油。
4.1% 醋酸洋红染料(染⾊体—紫红⾊)配制:将洋红1 g与45% 醋酸100 mL煮沸2h 左右,并随时注意补充加⼊蒸馏⽔到原含量。
冷却后过滤,加⼊4% 铁明矾溶液1~2滴,放⼊棕⾊瓶中备⽤。
5.龙胆紫酸性染料(染⾊质—紫⾊)配制:取龙胆紫1 g,溶于少量2% 醋酸溶液中,滴加2% 醋酸溶液,直⾄溶液不呈深紫⾊为⽌。
6.卡宝染⾊剂(染⾊体—红⾊,着⾊深,保存性好)⼜名苯酚-品红染⾊剂配制:a)原液A:将3g碱性品红溶于100 mL 70% 的⼄醇中。
b)原液B:取原液A 10 mL 加⼊到90 mL 5% 苯酸⽔溶液中。
(两周内有效)c)原液C:取原液B 55 mL,加⼊6 mL福尔马林和6 mL冰醋酸。
[实验室常用洗液配制方法]实验室洗液的配制方法
![[实验室常用洗液配制方法]实验室洗液的配制方法](https://img.taocdn.com/s3/m/61b91a39172ded630a1cb654.png)
[实验室常用洗液配制方法]实验室洗液的配制方法一:铬酸洗液:配制浓度各有不同,从5~12%的各种浓度都有。
配制方法大致相同:取一定量的K2Cr2O7(工业品即可),先用约1~2倍的水加热溶解,稍冷后,将工业品浓H2SO4所需体积数徐徐加入K2Cr2O7不溶液中(千万不能将水或溶液加入H2SO4中),边倒边用玻璃棒搅拌,并注意不要溅出,混合均匀,俟冷却后,装入洗液瓶备用。
新配制的洗液为红褐色,氧化能力很强。
当洗液用久后变为黑绿色,即说明洗液无氧化洗涤力。
例如,配制12%的洗液500mL。
取60克工业品K2Cr2O7置于100mL水中(加水量不是固定不变的,以能溶解为度),加热溶解,冷却,徐徐加入浓硫酸:340mL,边加边搅拌,冷后装瓶备用。
二:碱性高锰酸钾洗液用碱性高锰酸钾作洗液,作用缓慢,适合用于洗涤有油污的器皿。
配法:取高锰酸钾(KMnO4)4克加少量水溶解后,再加入10%氢氧化钠(NaOH)100mL。
三:纯酸纯碱洗液根据器皿污垢的性质,直接用浓硫酸(HCL)或浓硫酸(H2SO4)、浓硝酸(HNO3)浸泡或浸煮器皿(温度不宜太高,否者浓酸挥发刺激人)。
纯碱洗液多采用10%以上的浓烧碱(NaOH)、氢氧化钾(KOH)或碳酸钠(Na2CO3)液浸泡或浸煮器皿(可以煮沸)。
四:碱性乙醇洗液溶解120克氢氧化钠固体于120ml水中,用95%乙醇稀释至1L。
在铬酸洗液洗涤无效时,用于清洗各种油污;由于碱对玻璃的腐蚀,玻璃磨口不能长期在该洗液中浸泡;须存放于胶塞瓶中,防止挥发、防火,久注易失效五:碱性高锰酸钾洗液4克高锰酸钾固体溶于少量水中,再加入100ml10%氢氧化钠溶液清洗玻璃器皿内的有无或其他有机物质;浸泡后器壁上会析出一层二氧化锰,需用盐酸或盐酸加过氧化氢除去六:磷酸钠洗液57克磷酸钠、28克油酸钠溶于470ml水中清洗玻璃器皿上的残留物;浸泡数分钟后用刷子刷洗七:酸性硫酸亚铁洗液含有少量硫酸亚铁溶液清洗由于贮存高锰酸及洗液而残留在玻璃器皿上的棕色污斑;浸泡后洗刷八:硝酸-过氧化氢洗液15%-20%的硝酸加等体积的5%过氧化氢清除特殊难洗的化学污物久存易分解,应存放于棕色瓶九:有机溶剂如三氯乙烯、二氯乙烯、苯、二甲苯、丙酮、乙醇、乙醚、三氯甲烷、四氯化碳、汽油等清除玻璃器皿上的油脂类、单体原液、聚合体等有机污物,应根据污物性质选者使用注意毒性、可燃性,用过的废液溶剂应回收十:硫代硫酸钠洗液10%的硫代硫酸钠溶液。
实验室常用溶液及溶剂的配制

实验室常用溶液及试剂配制表一普通酸碱溶液的配制表二常用酸碱指示剂表三混合酸碱指示剂表四容量分析基准物质的干燥表五缓冲溶液的配制实验室常用试验方法2九、柠檬酸(C6H8O7·H2O)称取试样1.5g(精确到0.0002g)于三角瓶内,加入水50ml溶解,加酚酞指示剂3滴,用1mol/L氢氧化钠标准溶液滴定至粉红色为终点,同时做空白试验。
计算:X%(一水)= (V1-V0)×C×0.06404x m×(1-0.08566)×100X%(无水)= (V1-V0)×C×0.06404x m×100V1-----消耗氢氧化钠标准溶液的体积,ml;V0-----空白所消耗氢氧化钠标准溶液的体积,ml;C------氢氧化钠标准溶液浓度,mol/L;m---样品质量。
十、钙含量测定(磷酸氢钙CaHPO4、磷酸二氢钙Ca(H2PO4)2·H2O、钙粉等)称取2g(精确到0.0002g)样品,用10ml盐酸(1+1)溶解,转移至100ml容量瓶中定溶,用移液管吸取10ml于250ml锥形瓶中,加50ml水,5ml蔗糖溶液(25g/L),2ml三乙酸胺(1+1),1ml乙二胺(1+1),1滴孔雀绿指示液(1g/L),滴加氢氧化钾溶液(200g/L)至无色,再过量10ml,加0.1g盐酸羟胺(每加一种试剂都要摇匀),加钙黄绿素少许,在黑色背景下用0.05mol/L的EDTA标准溶液滴定至绿色荧光消失呈现紫红色为滴定终点。
Ca%= C×V×0.4008x m ×100C------EDTA标准溶液的浓度,mol/L;V-----消耗EDTA标准溶液的体积,ml;m----样品质量。
(二)氟(Fˉ)含量的测定:1、标准曲线的绘制;2、试样含量的测定:称取0.5g(精确到0.0002g)置于50ml纳氏比色管中,加1mol/L盐酸10ml,密闭提取1h (不时摇动),避免粘于管壁,提取后加总离子强度缓冲液25ml,加水至刻度,以滤纸过滤。
常用缓冲溶液的配制及氨基酸常数等
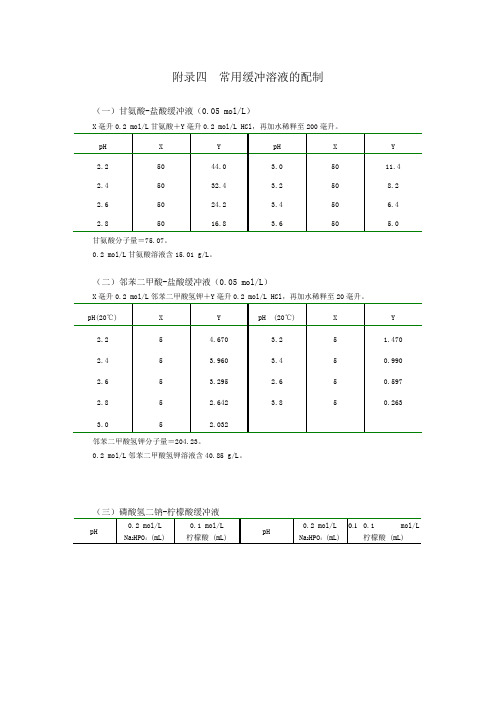
附录四常用缓冲溶液的配制(一)甘氨酸-盐酸缓冲液(0.05 mol/L)甘氨酸分子量=75.07。
0.2 mol/L甘氨酸溶液含15.01 g/L。
(二)邻苯二甲酸-盐酸缓冲液(0.05 mol/L)邻苯二甲酸氢钾分子量=204.23。
0.2 mol/L邻苯二甲酸氢钾溶液含40.85 g/L。
Na2HPO4分子量=141.98;0.2 mol/L溶液为28.40 g/L。
Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
C6H8O7·H2O分子量=210.14;0.1 mol/L溶液为21.01 g/L。
①使用时可以每升中加入1克酚,若最后pH值有变化,再用少量50%氢氧化钠溶液或浓盐酸调节,冰箱保存。
柠檬酸:C6H8O7·H2O分子量=210.14 ;0.1 mol/L溶液为21.01 g/L。
柠檬酸钠:Na3C6H5O7·2H2O分子量=294.12 ;0.1 mol/L溶液为29.41 g/L。
NaAc·3H2O分子量=136.09;0.2 mol/L溶液为27.22 g/L。
冰乙酸11.8 mL稀释至1 L(需标定)。
(七)磷酸二氢钾-氢氧化钠缓冲液(0.05 mol/L)(八)磷酸盐缓冲液Na2HPO4·2H2O分子量=178.05;0.2 mol/L溶液为35.61 g/L。
Na2HPO4·12H2O分子量=358.22;0.2 mol/L溶液为71.64 g/L。
NaH2PO4·H2O分子量=138.01;0.2 mol/L溶液为27.6 g/L。
NaH2PO4·2H2O分子量=156.03;0.2 mol/L溶液为31.21 g/L。
巴比妥钠分子量=206.18;0.04 mol/L溶液为8.25 g/L。
新校理化生实验室先导仪器配置化学教学仪器清单

新校理化生实验室先导仪器配置化学教学
仪器清单
1. 基础实验仪器
- 烧杯(容量:100 mL、250 mL、500 mL)
- 锥形瓶(容量:50 mL、100 mL、250 mL)
- 试管(直径:20 mm、25 mm、30 mm)
- 瓶口试管夹
- 称量瓶(容量:25 mL、50 mL、100 mL)
- 称量纸
- 滴定管(容量:10 mL、25 mL、50 mL)
- 平衡器
- 酒精灯
- 温度计(范围:-10℃至 100℃)
- 实验室计时器
2. 常用试剂
- 硫酸(浓度:98%)
- 盐酸(浓度:37%)
- 氢氧化钠(浓度:6 M)- 硝酸银(浓度:0.1 M)- 氯化铁(浓度:0.1 M)- 硫酸亚铁(浓度:0.1 M)- 过硫酸钠(浓度:0.1 M)- 氨水(浓度:25%)
- 氢氧化钾(浓度:6 M)3. 特殊实验仪器
- 分光光度计
- 导电性计
- PH计
- 离心机
- 原子吸收光谱仪
- 实时PCR仪
请注意,以上清单仅列举了一些常用的实验仪器和试剂,实验
室需要根据具体教学需求和实验内容进行进一步的仪器配置和试剂
采购。
另外,强调实验室安全和储存实验物品的标识是非常重要的。
如果对于具体的仪器配置和试剂采购有进一步需求或疑问,请
随时与相关部门或指导老师进行沟通。
实验室常用溶液配制-培养基_抗生素

常见实验用溶液的配制方法默认分类2008-07-04 14:10:54 阅读4 评论0 字号:大中小一、常用溶液1mol/L亚精胺(Spermidine):溶解2.55g亚精胺于足量的水中,使终体积为10ml。
分装成小份,贮存于-20℃。
1mol/L精胺(Spermine):溶解3.48g精胺于足量的水中,使终体积为10ml。
分装成小份,贮存于-20℃。
10mol/L乙酸胺(ammonium acetate):将77.1g乙酸胺溶解于水中,加水定容至1L后,用0.22um孔径的滤膜过滤除菌。
10mg/ml牛血清蛋白(BSA):加100mg的牛血清蛋白(组分V或分子生物学试剂级,无DNA酶)于9.5ml水中(为减少变性,须将蛋白加入水中,而不是将水加入蛋白),盖好盖后,轻轻摇动,直至牛血清蛋白完全溶解为止。
不要涡旋混合。
加水定容到10ml,然后分装成小份,贮存于-20℃。
1mol/L二硫苏糖醇(DTT):在二硫苏糖醇5g的原装瓶中加32.4ml水,分成小份贮存于-20℃。
或转移100mg的二硫苏糖醇至微量离心管,加0.65ml的水配制成1mol/L二硫苏糖醇溶液。
8mol/L乙酸钾(potassium acetate):溶解78.5g乙酸钾于足量的水中,加水定容到100ml。
1mol/L氯化钾(KCl):溶解7.46g氯化钾于足量的水中,加水定容到100ml。
3mol/L乙酸钠(sodium acetate):溶解40.8g的三水乙酸钠于约90ml水中,用冰乙酸调溶液的pH至5.2,再加水定容到100ml。
0.5mol/L EDTA:配制等摩尔的Na2EDTA和NaOH溶液(0.5mol/L),混合后形成EDTA的三钠盐。
或称取186.1g的Na2EDTA·2H2O和20g的NaOH,并溶于水中,定容至1L。
1mol/L HEPES:将23.8gHEPES溶于约90ml的水中,用NaOH调pH(6.8-8.2),然后用水定容至100ml。
实验室常用溶液的配制标准程序

实验室常用溶液的配制标准程序3 、适用范围XXXX研发部常用溶液:3M 醋酸钠、2N NaOH 、5M NaCL、Solution Ⅰ、Solution ⅡSolution 、Solution Ⅲ、LB培养基、1M Tris-HCl 、10 ×TE Buffer 、10 ×PBS Buffer 、苯酚/ 氯仿/ 异戊醇、10%(W/V )SDS 、0.5M EDTA(pH 8.0) 、50 ×TAEBUffer 、20 ×SSC 、封闭缓冲液(Wester杂交)。
4 、配制4.1 、用具干燥洁净的200ml量桶一只,三角烧瓶两只,天平一架,250ml、1000ml广口瓶各一只。
4.2 、配制步骤4.2.1 、配制NaAC溶液⑴用天平称取40.8克分析纯的NaOAC固体,置于250ml三角烧瓶中。
⑵用100ml量桶准确取40ml去离子水,摇荡三角烧瓶使NaOH固体充分溶解⑶加去离子水将溶液定容到100ml⑷高压灭菌后,室温保存。
4.2.2 、配制NaOH溶液⑴用100ml量桶准确取80ml去离子水,置于250ml三角烧瓶中。
⑵用天平称取8克NaOH固体缓缓加入三角烧瓶中。
⑶摇荡混匀溶液。
用去离子水将溶液体积定容到100ml。
⑷将混匀的溶液转移入玻璃瓶中,室温保存。
4.2.3 、配制NaCL溶液⑴用天平称取292.2克NaCL固体置于1L烧杯中,加入800ml的去离子水后搅拌溶解。
⑵加去离子水将溶液定容至1L,适量分成小份。
⑶高压灭菌后,4 0 C 保存。
4.2.4 、配制Solution Ⅰ溶液(1)量取1M Tris-HCL(ph8.0) 25ml ,1.5M EDTA(ph8.0) 20ml , 20 %Glucose(1.11M) 45ml, dH 2 O 910ml , 置于1L烧杯中。
(2)高温高压灭菌后,4 0 C 保存。
(3)使用前每50 ml的Solution Ⅰ加入2 ml 的RNaseA(20mg / ml).4.2.5 、配制Solution Ⅱ溶液(1) 量取10 %SDS 50 ml, 2N NAOH 50 ml, 置于500 ml 烧杯中。
实验室常见缓冲液配制

实验室常用缓冲液配置方案1)1 M Tris-HCl (pH7.4, 7.6, 8.0)组份浓度:1 M Tris-HCl配制量:1 L配制方法:1. 称量121.1 g Tris置于1 L烧杯中。
2. 加入约800 ml的去离子水,充分搅拌溶解。
值。
4.将溶液定容至1 L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
2)10×TE Buffer (pH7.4, 7.6, 8.0)组份浓度:100 mM Tris-HCl, 10 mM EDTA配制量:1 L配制方法:2.向烧杯中加入约800 ml的去离子水,均匀混合。
3. 将溶液定容至1 L后,高温高压灭菌。
4. 室温保存。
3)1.5 M Tris-HCl (pH8.8)组份浓度:1.5 M Tris-HCl配制量:1 L配制方法:1. 称量181.7 g Tris置于1 L烧杯中。
2. 加入约800 ml的去离子水,充分搅拌溶解。
3. 用浓盐酸调节pH值至8.8。
4. 将溶液定容至1 L。
5. 高温高压灭菌后,室温保存。
注意:应使溶液冷却至室温后再调定pH值,因为Tris溶液的pH值随温度的变化差异很大,温度每升高1℃,溶液的pH值大约降低0.03个单位。
4)3 M 醋酸钠(pH5.2)组份浓度:3M 醋酸钠配制量:100ml配制方法:1.称量40.8g NaAc·3H2O(或者24.6g无水NaAc)置于100-200ml烧杯中,加入月40ml的去离子水搅拌溶解2.加入冰醋酸调节pH值至5.23.加去离子水将溶液定容至100ml4高温高压灭菌后,室温保存。
5)PBS Buffer组份浓度:137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 2 mM KH2PO4配制量:1 L配制方法:2.向烧杯中加入约800 ml的去离子水,充分搅拌溶解。
实验室常用溶剂配方

一、常用溶液1mol/L亚精胺(Spermidine):溶解2.55g亚精胺于足量的水中,使终体积为10ml。
分装成小份,贮存于-20℃。
1mol/L精胺(Spermine):溶解3.48g精胺于足量的水中,使终体积为10ml。
分装成小份,贮存于-20℃。
10mol/L乙酸胺(ammonium acetate):将77.1g乙酸胺溶解于水中,加水定容至1L后,用0.22um孔径的滤膜过滤除菌。
10mg/ml牛血清蛋白(BSA):加100mg的牛血清蛋白(组分V或分子生物学试剂级,无DNA酶)于9.5ml水中(为减少变性,须将蛋白加入水中,而不是将水加入蛋白),盖好盖后,轻轻摇动,直至牛血清蛋白完全溶解为止。
不要涡旋混合。
加水定容到10ml,然后分装成小份,贮存于-20℃。
1mol/L二硫苏糖醇(DTT):在二硫苏糖醇5g的原装瓶中加32.4ml水,分成小份贮存于-20℃。
或转移100mg的二硫苏糖醇至微量离心管,加0.65ml的水配制成1mol/L二硫苏糖醇溶液。
8mol/L乙酸钾(potassium acetate):溶解78.5g乙酸钾于足量的水中,加水定容到100ml。
1mol/L氯化钾(KCl):溶解7.46g氯化钾于足量的水中,加水定容到100ml。
3mol/L乙酸钠(sodium acetate):溶解40.8g的三水乙酸钠于约90ml水中,用冰乙酸调溶液的pH至5.2,再加水定容到100ml。
0.5mol/L EDTA:配制等摩尔的Na2EDTA和NaOH溶液(0.5mol/L),混合后形成EDTA的三钠盐。
或称取186.1g的Na2EDTA·2H2O和20g的NaOH,并溶于水中,定容至1L。
1mol/L HEPES:将23.8gHEPES溶于约90ml的水中,用NaOH调pH(6.8-8.2),然后用水定容至100ml。
1mol/L HCl:加8.6ml的浓盐酸至91.4ml的水中。
实验室常用试剂缓冲液的配制方法

实验室常用试剂缓冲液的配制方法实验室中常常需要使用各种试剂和缓冲液,以下是一些常用试剂和缓冲液的配制方法及其用途。
1.NaCl溶液配制:NaCl作为实验室常用的盐类试剂,可用于生化、分子生物学等多个实验室操作中。
常用浓度为0.9%(w/v)的生理盐水。
配制方法如下:称取对应质量的NaCl加入蒸馏水中,搅拌溶解,用蒸馏水调整至最终体积。
2.血红蛋白溶液配制:血红蛋白溶液可用于实验室的一些生化、免疫学等实验。
常用方法如下:从新鲜血液中分离出血红蛋白,加入适量的生理盐水或缓冲液,控制pH值为7.4-7.6,并用密闭容器保存。
3. Tris-HCl缓冲液配制:Tris-HCl缓冲液在生物化学实验中广泛应用于DNA/RNA电泳、蛋白质电泳等实验。
常用方法如下:按需求称取Tris固体加入一定量的去离子水中,搅拌溶解,用强碱(比如氢氧化钠)或强酸(比如盐酸)调整pH值至所需范围。
1. Tris缓冲液配制:Tris缓冲液常用于酶反应、凝胶电泳等实验中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,并用去离子水稀释至最终体积。
2.PBS缓冲液配制:PBS缓冲液在生物学实验中用于细胞培养、免疫染色等操作中。
配制方法如下:称取适量的NaCl、KCl、Na2HPO4、KH2PO4固体加入适量的去离子水中,搅拌溶解,并用去离子水稀释至最终体积,调整pH值至所需范围。
3. Tris-Borate-EDTA(TBE)缓冲液配制:TBE缓冲液常用于核酸凝胶电泳中,配制方法如下:称取适量的Tris固体加入适量的去离子水中,搅拌溶解,用浓盐酸或盐酸调节pH值至所需范围,然后加入Boric acid和EDTA固体,继续搅拌溶解,并用去离子水稀释至最终体积。
以上仅是一些常见的试剂和缓冲液的配制方法,实验室中还会使用到很多其他试剂和缓冲液。
在配制试剂和缓冲液时,需要注意选择合适的纯度的试剂、使用无菌器具和操作台,并遵循相应的实验操作规范和安全要求。
初中化学基础试剂配制教案

初中化学基础试剂配制教案
一、实验目的
通过本实验,学生将掌握常见化学试剂的配制方法,提高化学实验操作技能。
二、实验仪器和试剂
仪器:量筒、烧杯、玻璃棒、玻璃瓶等
试剂:NaOH溶液、HCl溶液、CuSO4溶液、KMnO4溶液、FeCl3溶液等
三、实验步骤
1. NaOH溶液的配制:
将适量的NaOH固体称取到烧杯中,用蒸馏水加入至所需溶液体积,搅拌均匀即可。
2. HCl溶液的配制:
将适量的HCl浓溶液取至烧杯中,用蒸馏水加入至所需溶液体积,搅拌均匀即可。
3. CuSO4溶液的配制:
将适量的CuSO4固体称取到烧杯中,用蒸馏水加入至所需溶液体积,搅拌均匀即可。
4. KMnO4溶液的配制:
将适量的KMnO4固体称取到量筒中,用蒸馏水加入至所需溶液体积,搅拌均匀即可。
5. FeCl3溶液的配制:
将适量的FeCl3固体称取到烧杯中,用蒸馏水加入至所需溶液体积,搅拌均匀即可。
四、实验注意事项
1. 操作时要注意安全,避免试剂溅洒伤及皮肤和眼睛。
2. 操作前要认真读取试剂的安全说明书。
3. 操作完毕后要及时清洗实验器材,并将废弃试剂处理妥善。
五、实验总结
通过本实验的实践操作,学生不仅掌握了常见化学试剂的配制方法,还能够提高化学实验操作技能,为今后更深入的化学学习打下坚实的基础。
化验室常用试剂配制标准操作规程

化验室常用试剂(溶液)配制标准操作规程1 制定目的为使试剂(溶液)配制操作标准化,特建立本操作规程。
2 适用范围本操作规程适用于化验室常用试剂(溶液)的配制。
3 职责3.1 QA及管理人员负责监督其实施情况。
4 规程细则4.1 氢氧化钠滴定液(1mol/L、0.5mol/L或0.1mol/L)4.1.1 取氢氧化钠适量,加水振摇使溶解成饱和溶液,冷却后,置聚乙烯塑料瓶中,静置数日,澄清后备用。
4.1.2 氢氧化钠滴定液(1mol/L):取澄清的氢氧化钠饱和溶液56ml,加新沸过的冷水使成1000ml,摇匀。
4.1.3 氢氧化钠滴定液(0.5mol/L):取澄清的氢氧化钠饱和溶液28ml,加新沸过的冷水使成1000ml,摇匀。
4.1.4 氢氧化钠滴定液(0.1mol/L):取澄清的氢氧化钠饱和溶液5.6ml,加新沸过的冷水使成1000ml,摇匀。
4.1.5 标定4.1.5.1 氢氧化钠滴定液(1mol/L):取在105℃干燥至恒重的基准邻苯二甲酸氢钾约6g,精密称定,加新沸过的冷水50ml,振摇,使其尽量溶解;加酚酞指示液2滴,用本液滴定;在接近终点时,应使邻苯二甲酸氢钾完全溶解,滴定至溶液显粉红色。
每1ml氢氧化钠滴定液(1mol/L )相当于204.2mg 的邻苯二甲酸氢钾。
根据本液的消耗量与邻苯二甲酸氢钾的取用量,算出本液的浓度,即得。
4.1.5.2 氢氧化钠滴定液(0.5mol/L ):取在105℃干燥至恒重的基准邻苯二甲酸氢钾约3g ,照4.1.5.1标定。
每1ml 氢氧化钠滴定液(0.5mol/L )相当于102.1mg 的邻苯二甲酸氢钾。
4.1.5.3 氢氧化钠滴定液(0.1mol/L )取在105℃干燥至恒重的基准邻苯二甲酸氢钾约0.6g ,照4.1.5.1标定。
每1ml 氢氧化钠滴定液(0.1mol/L )相当于20.42mg 的邻苯二甲酸氢钾。
4.1.5.4 如需用氢氧化钠滴定液(0.05mol/L 、0.02mol/L 或0.01mol/L )时,可取氢氧化钠滴定液(0.1mol/L )加新沸过的冷水稀释制成。
实验室常用溶液的配制标准程序

实验室常用溶液的配制标准程序3 、适用范围XXXX研发部常用溶液:3M 醋酸钠、2N NaOH 、5M NaCL、Solution Ⅰ、Solution ⅡSolution 、Solution Ⅲ、LB培养基、1M Tris-HCl 、10 ×TE Buffer 、10 ×PBS Buffer 、苯酚/ 氯仿/ 异戊醇、10%(W/V )SDS 、0.5M EDTA(pH 8.0) 、50 ×TAEBUffer 、20 ×SSC 、封闭缓冲液(Wester杂交)。
4 、配制4.1 、用具干燥洁净的200ml量桶一只,三角烧瓶两只,天平一架,250ml、1000ml广口瓶各一只。
4.2 、配制步骤4.2.1 、配制NaAC溶液⑴用天平称取40.8克分析纯的NaOAC固体,置于250ml三角烧瓶中。
⑵用100ml量桶准确取40ml去离子水,摇荡三角烧瓶使NaOH固体充分溶解⑶加去离子水将溶液定容到100ml⑷高压灭菌后,室温保存。
4.2.2 、配制NaOH溶液⑴用100ml量桶准确取80ml去离子水,置于250ml三角烧瓶中。
⑵用天平称取8克NaOH固体缓缓加入三角烧瓶中。
⑶摇荡混匀溶液。
用去离子水将溶液体积定容到100ml。
⑷将混匀的溶液转移入玻璃瓶中,室温保存。
4.2.3 、配制NaCL溶液⑴用天平称取292.2克NaCL固体置于1L烧杯中,加入800ml的去离子水后搅拌溶解。
⑵加去离子水将溶液定容至1L,适量分成小份。
⑶高压灭菌后,4 0 C 保存。
4.2.4 、配制Solution Ⅰ溶液(1)量取1M Tris-HCL(ph8.0) 25ml ,1.5M EDTA(ph8.0) 20ml , 20 %Glucose(1.11M) 45ml, dH 2 O 910ml , 置于1L烧杯中。
(2)高温高压灭菌后,4 0 C 保存。
(3)使用前每50 ml的Solution Ⅰ加入2 ml 的RNaseA(20mg / ml).4.2.5 、配制Solution Ⅱ溶液(1) 量取10 %SDS 50 ml, 2N NAOH 50 ml, 置于500 ml 烧杯中。
如何配制在线水质测定仪检测时所需的溶剂

如何配制在线水质测定仪检测时所需的溶剂在使用在线水质测定仪时常常需要将一些试剂配制成所需要的浓度溶液,实际应用中所用溶液可以分为一般溶液,标准溶液和缓冲溶液这三种。
假如未规定精准浓度,只用于一般试验的溶液称为一般溶液或常用溶液。
配制时试剂的质量可以用托盘天平称量,溶液的体积可用量筒或者量杯进行量取。
配制这类溶液的关键是要计算出正确的应当称量溶质的质量,以及应量取溶液溶质的体积。
今日我们就来介绍一些有关于在线水质测定仪一般溶液的配制方法。
配制水质检测所需的一般溶液试剂:(1)水质检测一般溶液配制方法①常用酸溶液的配制,对于液体酸溶液的配制,可用下述方法:先在容器中加入肯定量的水,然后量取肯定体积的浓酸倒入水中,待所配酸溶液冷却后,转移至试剂瓶中,稀释至所需体积。
在配制酸性溶液时,肯定要将浓酸缓慢地倒入水中,并边倒边搅拌,切不可把水直接倾倒在浓酸中,以防浓酸飞溅伤人。
②常用碱性溶液的配置,固体碱溶液的配制:用烧杯在托盘天平上称量出所需的固体碱的质量,溶于适量水中,再稀释至所需的体积。
③常用盐溶液的配制,在托盘天平上称量所需量的试剂,溶于适量的水中,再用水稀释到预定体积。
对于不易溶解或易于水解的盐,需加入适量酸,再用水或稀酸稀释。
易于氧化还原的盐,应当在使用前临时配制。
将配制好的水质检测溶液分类贮存:(2)水质检测一般溶液配制时的注意事项①大家在配制一般溶液时,应当依据对溶液浓度精准度的要求,合理的选择试剂级别、称量器皿、天平的级别、有效数字的表示以及盛装容器等。
②常常或大量使用的溶液,检测人员可先配制10倍于预定浓度的储备溶液。
在需要的时候适当稀释就可以用了。
③对于简单腐蚀玻璃的溶液,肯定要避开盛放在玻璃器皿中。
④配制溶液时对于溶液挥发和分解的试剂,例如KMnO4、AgNO3等此类应当盛放在棕色的试剂瓶中,然后放置于阴凉暗处,避开光线直接照射。
⑤配好在线水质测定仪所需的溶液在盛放于试剂瓶后,应当需要立刻贴上品类名称标签,注明溶液的名称、浓度、配置日期、配制人员,并做好相关的配制记录,记录中应当包括所用试剂的规格、生产厂家以及配制过程等。
化验室常用药品的配制和标定方法

化验室常用药品的配制和标定方法一、氢氧化钠标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(NaOH)= 1mol/LC(NaOH)= 0.5mol/LC(NaOH)= 0.1mol/L(一)氢氧化钠标准溶液的配制:称取120gNaOH,溶于100mL无CO2的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
用塑料管吸取下列规定体积的上层清液,注入用无CO2的水稀释至1000mL,摇匀。
C(NaOH),mol/L NaOH饱和溶液,mL1 560.5 280.1 5.6(二)氢氧化钠标准溶液的标定:1.测定方法:称取下列规定量的、于105—110。
C电烘箱烘至恒重的工作基准试剂邻苯二甲酸氢钾,称准至0.0001 g,溶于下列规定体积的无CO2的水中,加2滴酚酞指示液(10 g/L),用配制好的NaOH溶液滴定至溶液呈粉红色并保持30S。
同时做空白试验。
C(NaOH),mol/L 基准邻苯二甲酸氢钾,g 无CO2水,mL1 6.0800.5 3.0800.1 0.6802.计算:氢氧化钠标准溶液浓度按下式计算:MC(NaOH)= ------------------------(V—V0)×0.2042式中:C(NaOH)——氢氧化钠标准溶液之物质的浓度,mol/L; V——消耗氢氧化钠的量,mL;V0——空白试验消耗氢氧化钠的量,mL;M——邻苯二甲酸氢钾的质量,g;0.2042——邻苯二甲酸氢钾的摩尔质量。
Kg/ mol。
二、盐酸标准溶液的配制和标定(依据国标GB/T5009.1-2003)C(HCl)= 1mol/LC(HCl)= 0.5mol/LC(HCl)= 0.1mol/L(一)盐酸标准溶液的配制:量取下列规定体积的盐酸,注入1000 mL水中,摇匀。
C(HCl) HCl,mL1900.5 450.19(二)盐酸标准溶液的标定:1.测定方法:称取下列规定量的、于270—300。
常用药品配制方法

常用药品配制方法化验室药品配制一、标准滴定溶液的配制及标定GB/T601-20021.盐酸(量取相应体积,定容至1000ml后摇匀)表1表2按表2的规定称取于270℃-300℃(高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50ml水中,加10滴溴甲酚绿-甲基红指示剂,用配置好的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液再呈暗红色。
计算公式C(HCL)=1000m/(V1-V2)/M(无水碳酸钠的摩尔质量为52.99) 2.氢氧化钠标准滴定溶液配制称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按表1的规定,用塑料管量取上层清液,用无二氧化碳的水稀释至1000ml,摇匀。
表1标定按表2的规定称取于105℃-110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示剂(10g/l),用配置好的氢氧化钠溶液滴定至溶液呈粉红色,并保持30s。
同时做空白试验.表2氢氧化钠表尊滴定溶液的浓度【c(NaOH)】,数值以摩尔每升(mol/l)表示,按式(1)计算:出(NaOH)=1000m/(V-V0)MM=204.22(邻苯二甲酸氢钾的摩尔质量的数值)3.硫酸标准滴定溶液配制按表1的规定量取硫酸,缓慢注入1000ml水中,冷却,摇匀。
表1标定按表2的规定称取于270℃-300℃高温炉中灼烧至恒重的工作基准试剂无水碳酸钠,溶于50ml水中,滴10滴溴甲酚绿甲基红指示液,用配置好的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,冷却后继续滴定至溶液呈暗红色。
同时做空白试验表2C(1/2H2so4)=1000m/(V1-V2)MM=52.994(无水碳酸钠的摩尔质量的数值)4.硫代硫酸钠标准滴定溶液C(Na2S2O3)=0.1mol/l配制称取26g硫代硫酸钠(Na2S2O3.5H2O)(或16g污水硫代硫酸钠),加0.2g无水碳酸钠,溶于1000ml水中,缓慢煮沸10min,冷却。
化验室常用试剂的配制方法

20%甘露醇溶液:准确称取甘露醇(A.R)200g,于纯水中加热溶解,冷却后稀释定容
至1L。
8、
25%氯化钡溶液:准确称取BaCl2(A.R)332g,于纯水中加热溶解,冷却后稀释定容至1L。
9、
PH=10缓冲溶液:将54g氯化铵溶于少量纯水中,加入350ml氨水,以纯水稀释定容至1L。
10、
10%甘露醇溶液:准确称取甘露醇(A.R)100g,于纯水中加热溶解,冷却后稀释定容
Effective Date
第V0版
第V1版
初版发行
增加10%的甘露醇配制方法
2012-12-6
2017-12-14
编写人:戴怡强
Prepared by
审批人:
Approved by
如此印章并非红色,IF THE CONTROL STAMP
表此文件并非合法之版COLOR IS NOTRED,THENIT
本,并不会受到控制及IS AN UNCONTROLLEDCOPY.
更新,请使用受控之文PLEASED REFERONLY TO
件。THE CONTROLLED COPY.
一、
目的:规范化验室用常用试剂的配制,提高化验的效率。
二、
内容:
1、
0.4N硝酸溶液:准确移取硝酸(A.R)27ml,溶解于纯水中,稀释定容至1L。
至1L。
三、
注意事项:
1、
注意安全;
2、
严格按照步骤进行操作。
四、
相关记录:
《化验室试剂配制记录表》
工艺名称:化验室常用试剂的配制方法
Craft
客户:/
Customer
产品名称:/
Part Name
