脑脊液总蛋白检测试剂盒(染料结合微板法)
脑脊液 尿液总蛋白测定试剂盒(邻苯三酚红法)产品技术要求jiuzhoutaikang

脑脊液/尿液总蛋白测定试剂盒(邻苯三酚红法)适用范围:用于体外定量测定人脑脊液或尿液中总蛋白的含量。
1.1包装规格60mL×4、60mL×2、60mL×1、45mL×6、40mL×6、80mL×2。
1.2主要组成成分2.1 外观试剂盒外观应整洁,文字符号标识清晰;试剂为澄清液体,无未溶解物。
2.2 装量试剂瓶内试剂的净含量不少于标示值。
2.3 试剂空白吸光度在波长A600nm,记录吸光度值,应不超过0.60A。
2.4 分析灵敏度测试浓度800mg/L的脑脊液或尿液中的总蛋白,吸光度变化值不低于0.002A。
2.5 线性在[5,2000]mg/L范围内,线性回归的确定系数应不低于0.990;在[5,500)mg/L范围内,绝对偏差不超过±50mg/L;在[500,2000]mg/L范围内,线性相对偏差不超过±10%。
2.6 重复性2.6.1批内重复性用高、低两个浓度水平的样本检测,重复测定10次,批内变异系数(CV)不超过10%。
2.6.2 批间差用三个批号的试剂盒测定同一样本,试剂盒批间相对极差不超过15%。
2.7 准确度用40例在测定浓度范围内不同浓度的临床样本,与已上市的同类测定试剂盒作为比对试剂进行比对测试,用线性回归方法计算两组结果的相关系数(r)应不低于0.990,在 [5,500)mg/L范围内,绝对偏差不超过±50mg/L;在[500,2000]mg/L范围内,线性相对偏差不超过±10%。
2.8 稳定性试剂在未开瓶状态下,保存于2℃~8℃可保存12个月。
有效期后两个月内进行检验,应符合2.3、2.4、2.5、2.6.1、2.7 的要求。
脑脊液与尿蛋白测定试剂盒(邻苯三酚红法)产品技术要求baiding

脑脊液与尿蛋白测定试剂盒(邻苯三酚红法)适用范围:用于体外定量测定人脑脊液与尿液中总蛋白的含量。
1.1 规格校准品(选配):1×1mL;质控品(选配):1×1mL。
1.2 组成:注:校准品靶值、质控品质控范围详见包装标签。
2.1 外观2.1.1试剂:暗红色液体。
2.1.2校准品:无色至淡黄色液体。
2.1.3质控品:无色至淡黄色液体。
2.1.4包装外观应整洁,标签字迹清晰,不易脱落。
2.2 净含量液体试剂的净含量不低于标示体积。
2.3 空白吸光度试剂空白吸光度≤0.6。
2.4 分析灵敏度样本浓度为1000 mg/L时,△A≥0.15。
2.5 线性区间在[5,2000] mg/L的范围内,线性相关系数r≥0.990。
测试浓度在[5,400] mg/L 时,绝对偏差不超过±40 mg/L,测试浓度在(400,2000] mg/L 时,相对偏差不超过±10%。
2.6 精密度2.6.1批內精密度用高、中、低3个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于8%。
2.6.2批间差用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。
2.7 准确度回收率在85%-115%范围内。
2.8 质控品赋值有效性测试结果在质控范围内。
2.9 瓶内均匀性校准品和质控品瓶内均匀性(CV)应不大于8%。
2.10 量值溯源校准品量值溯源至国际参考物质SRM927e。
2.11 稳定性2.11.1校准品开瓶稳定性校准品开瓶后2℃~8℃避光保存可稳定3天。
稳定期过后4小时内进行测试,测试结果与靶值的相对偏差不超过±10%。
2.11.2质控品开瓶稳定性质控品开瓶后2℃~8℃避光保存可稳定3天。
稳定期过后4小时内进行测试,应满足2.8的要求。
2.11.3效期稳定性原包装试剂盒在2℃~8℃避光保存条件下有效期为12个月。
有效期满后3个月内测试,应满足2.3、2.4、2.5、2.6.1、2.7和2.8的要求。
脑脊液及尿蛋白测定试剂盒(比色法)产品技术要求lepu

脑脊液及尿蛋白测定试剂盒(比色法)适用范围:本试剂盒用于体外定量测定人尿液中蛋白的含量。
1.1 规格试剂1:1×50mL,试剂2:1×10mL;试剂1:1×40mL,试剂2:1×10mL;试剂1:1×45mL,试剂2:1×15mL;试剂1:1×60mL,试剂2:1×60mL;试剂1:2×40mL,试剂2:2×20mL;试剂1:2×60mL,试剂2:2×30mL;试剂1:2×45mL,试剂2:2×15mL;试剂1:2×60mL,试剂2:2×20mL。
1.2主要组成成分试剂1主要组分:试剂2主要组分:2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1应为无色或浅色澄清液体,试剂2应为无色或浅色澄清液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白在505nm处测定试剂空白吸光度,应≤1.8;2.4 分析灵敏度测试30mg/dL的被测物时,吸光度变化(ΔA)应不低于0.0015。
2.5 准确度参照EP9-A2的方法,用比对试剂盒同时测试40例线性区间内的不同浓度的尿液样本。
其相关系数(r)不小于0.990。
每个浓度点在[1,24)mg/dL区间内绝对偏差不超过±2.88mg/dL;[24,200]mg/dL区间内相对偏差不超过±12%。
2.6 重复性批内变异系数(CV)应不超过10%。
2.7 线性2.7.1在[1,200]mg/dL区间内,线性相关系数r应不低于0.990;2.7.2[1,24)mg/dL区间内绝对偏差不超过±4.8mg/dL;[24,200]mg/dL区间内相对偏差不超过±12%。
2.8 批间差对同一份样品进行重复测定,相对极差≤12%。
2.9 稳定性取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
脑脊液尿液总蛋白测定试剂盒(邻苯三酚红钼络合显色法)产品技术要求中生北控

脑脊液/尿液总蛋白测定试剂盒(邻苯三酚红钼络合显色法)组成:1. 试剂(R)(液体)邻苯三酚红24mg/L钼酸钠 9.6mg/L2. 校准品(液体)磷酸盐缓冲液 200mmol/L牛血清白蛋白,目标浓度:900mg/L。
(每批定值,值有批特异性,详见值单)3. 质控品(液体)磷酸盐缓冲液 200mmol/L牛血清白蛋白,浓度范围:水平1:300mg/L~580mg/L;水平2:590mg/L~1000mg/L。
(每批定值,值有批特异性,详见值单)适用范围:本试剂用于体外定量测定人脑脊液或尿液中总蛋白的含量。
2.1 外观试剂盒中各组件的外观应满足:2.1.1试剂(R)应为暗红色溶液,无杂质、无絮状物,外包装完整无破损;2.1.2校准品应为无色至浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.1.3质控品应为无色至浅黄色透明溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长600nm(580nm~620nm)(光径1cm)处,试剂空白吸光度(A)应≤0.600。
2.4 准确度测定SRM927,相对偏差应不超过±15%。
2.5 分析灵敏度对应于浓度为1000mg/L的总蛋白所引起的吸光度差值(△A)的绝对值应≥0.05。
2.6 重复性重复测定高、低浓度样本,变异系数(CV)应≤10%。
2.7 批间差测定同一样本,批间差(R)应≤10%。
2.8 线性范围在[5,2000]mg/L范围内,线性相关系数(r)应≥0.990;在(400,2000]mg/L范围内,线性相对偏差应不超过±15%;在[5,400]mg/L范围内,线性绝对偏差应不超过±60mg/L。
2.9 质控品定值有效性测定结果应在质控范围内。
2.10 稳定性原包装试剂盒在2℃~8℃避光贮存,有效期为12个月。
有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
伊红Y染料结合法测定脑脊液蛋白在全自动生化分析仪上的应用

【 要 】 目的 摘
2 20 ) 2 0 2
在 B i3 r一5存 在 下 , j
在 全 自动 生 化 分 析仪 上 建 立 一 种 测 定 脑 脊 液 蛋 白含 量 的 分析 方 法 。 方 法
伊 红 Y 和 脑 脊 液 中 的蛋 白 质 进 行 结 合 显 色 , 定 脑 脊 液 中的 蛋 白含 量 , 用 于 自动 化 分 析 。 结 果 通 过 实 验 分 析 , 测 并
・
36 3 ・
检验 医 学 与临 床 2 1 0 2年 2月 第 9卷 第 3期
L bMe l , eray2 1 , 19 No 3 a dCi F bu r 02 Vo. , . n
方法相关性好 ( 1。 图 )
3 讨 论
Y法 的检 测 线 性 范 围不 及 邻 苯 三 酚 红 法 宽 ( 苯 三 酚 红 法 可 达 邻
试 剂 反 应 后 , 别 于 1 5 1 、 5 3 n和 1 2 h 用 岛 津 UV一 分 、 、 0 1 、 0 mi 、 ,
25 4 0紫外 分 光 光度 计 选 定 波 长 50n 测 定 反 应 生成 物 吸 光 4 m, 度 。结 果 表 明 : 应 后 1 n 显 色 趋 于 稳 定 , 稳 定 2 h 反 0 mi, 可
Re g n l 0 I ; a e t2 Vo 0 L;W a ee g h Pr. a e t1 Vo Re g n l 0 3 3 v ln t i 5 0 n , e . 6 m ; M eh d E 4 m S c 6 0n t o ND; Re c in + at o ; at n Re ci — o
脑脊液总蛋白检测试剂盒(染料结合比色法)
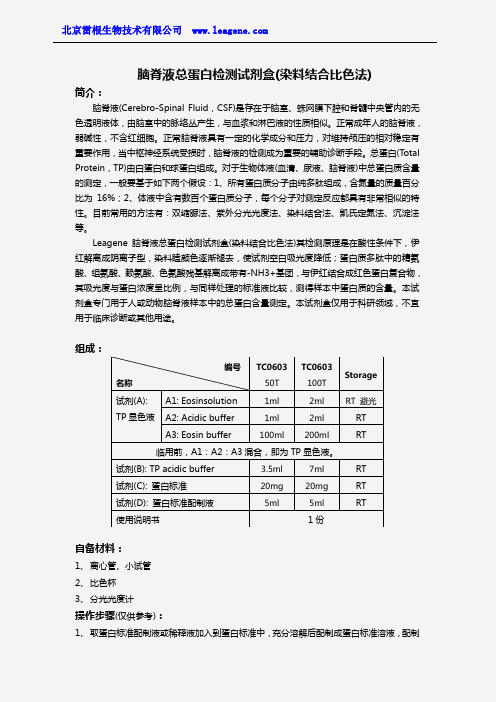
脑脊液总蛋白检测试剂盒(染料结合比色法)简介:脑脊液(Cerebro-Spinal Fluid ,CSF)是存在于脑室、蛛网膜下腔和脊髓中央管内的无色透明液体,由脑室中的脉络丛产生,与血浆和淋巴液的性质相似。
正常成年人的脑脊液,弱碱性,不含红细胞。
正常脑脊液具有一定的化学成分和压力,对维持颅压的相对稳定有重要作用,当中枢神经系统受损时,脑脊液的检测成为重要的辅助诊断手段。
总蛋白(Total Protein ,TP)由白蛋白和球蛋白组成。
对于生物体液(血清、尿液、脑脊液)中总蛋白质含量的测定,一般要基于如下两个假设:1、所有蛋白质分子由纯多肽组成,含氮量的质量百分比为16%;2、体液中含有数百个蛋白质分子,每个分子对测定反应都具有非常相似的特性。
目前常用的方法有:双缩脲法、紫外分光光度法、染料结合法、凯氏定氮法、沉淀法等。
Leagene 脑脊液总蛋白检测试剂盒(染料结合比色法)其检测原理是在酸性条件下,伊红解离成阴离子型,染料瞌颜色逐渐褪去,使试剂空白吸光度降低;蛋白质多肽中的精氨酸、组氨酸、赖氨酸、色氨酸残基解离成带有-NH3+基团,与伊红结合成红色蛋白复合物,其吸光度与蛋白浓度呈比例,与同样处理的标准液比较,测得样本中蛋白质的含量。
本试剂盒专门用于人或动物脑脊液样本中的总蛋白含量测定。
本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、 离心管、小试管2、 比色杯3、 分光光度计操作步骤(仅供参考):1、 取蛋白标准配制液或稀释液加入到蛋白标准中,充分溶解后配制成蛋白标准溶液,配制编号 名称TC060350TTC0603100T Storage 试剂(A): TP 显色液 A1: Eosinsolution 1ml 2ml RT 避光A2: Acidic buffer1ml 2ml RT A3: Eosin buffer100ml200mlRT临用前,A1:A2:A3混合,即为TP 显色液。
脑脊液尿总蛋白测定试剂盒(邻苯三酚红钼法)产品技术要求meigaoyi

脑脊液/尿总蛋白测定试剂盒(邻苯三酚红钼法)适用范围:用于体外定量检测人脑脊液(CSF)或尿液中总蛋白的浓度。
1.1包装规格3×50ml;2×50ml;4×50ml;1×40ml。
1.2主要组成成分邻苯三酚红 27mg/L钼酸钠30mg/l甘氨酸100mmol/l2.1 外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂应为紫红色溶液,无沉淀、无悬浮物、无絮状物。
2.2 净含量液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度在600nm处测定试剂空白吸光度,应≤0.5。
2.4 分析灵敏度测试280mg/dl的被测物时,吸光度(A)应不低于1.0。
2.5 准确性在样品中加入一定体积的国家标准品(GBW(E)090351)回收率应在85%-115%之间。
2.6 重复性重复测定正常值和高值浓度样品,批内变异系数(CV)应≤5%。
2.7 线性2.7.1 在(0.5,300.0)mg/dl区间内,线性相关系数r应不低于0.990;2.7.2 在(45.0,300.0)mg/dl区间内,相对偏差不超过±10%;在(0.5,45.0]mg/dl区间内,绝对偏差不超过±4.5mg/dl。
2.8 批间差抽取3个不同批号试剂,对同一浓度样品进行重复检测,批间相对极差≤10%。
2.9 稳定性该产品在2℃~8℃条件下贮存有效期为18个月,取效期末的产品进行检测,应符合2.1、2.3、2.4、2.5、2.6、2.7之规定。
脑脊液与尿蛋白测定试剂盒(苄索氯铵法)产品技术要求haifeng

脑脊液与尿蛋白测定试剂盒(苄索氯铵法)适用范围:本产品适用于体外定量测定人尿液或脑脊液中的总蛋白(UTP)含量。
1.1 产品规格1.2 主要组成成分注:校准品具有批间、赋值特异性,具体值详见靶值单。
2.1外观2.1.1试剂盒标签标识清晰,外包装完整无破损;2.1.2试剂1:无色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.3试剂2:无色或浅黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;2.1.4校准品:无色或浅黄色液体,目测不得有任何沉淀及絮状悬浮物。
2.2净含量净含量不低于标示值。
2.3空白吸光度测定待检试剂在主波长505nm、副波长700nm,37℃条件下:A≤1.0。
2.4 线性范围(3,200)mg/dL范围内,相关系数r≥0.990;(3,30]mg/dL范围内,绝对偏差应不大于±3mg/dL;(30,200)mg/dL范围内,相对偏差应不大于±10.0%。
2.5分析灵敏度在产品说明书规定参数设定条件下,样本浓度为100mg/dL时,吸光度变化△A≥0.2。
2.6 精密度2.6.1批内重复性CV≤10.0%。
2.6.2 批间差相对极差R≤10.0%。
2.7 准确度与已上市产品比对:(3,200)mg/dL范围内,相关系数r≥0.990;(3,30]mg/dL时,绝对偏差应不大于±3mg/dL;(30,200)mg/dL时,相对偏差应不大于±10.0%;2.8 校准品2.8.1 均一性:CV≤10.0%;2.8.2 开瓶稳定性:开瓶后3天,校准品1:相对偏差不超过±20.0%;校准品2~5:相对偏差不超过±10%。
2.9稳定性未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.3、2.4、2.5、2.6.1、2.7的要求。
2.10溯源性依据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至工作校准品,工作校准品经与Audit Diagnostics脑脊液与尿蛋白测定试剂盒比对测量赋值。
尿液_脑脊液总蛋白测定试剂盒(苄索氯铵法)产品技术要求新产业
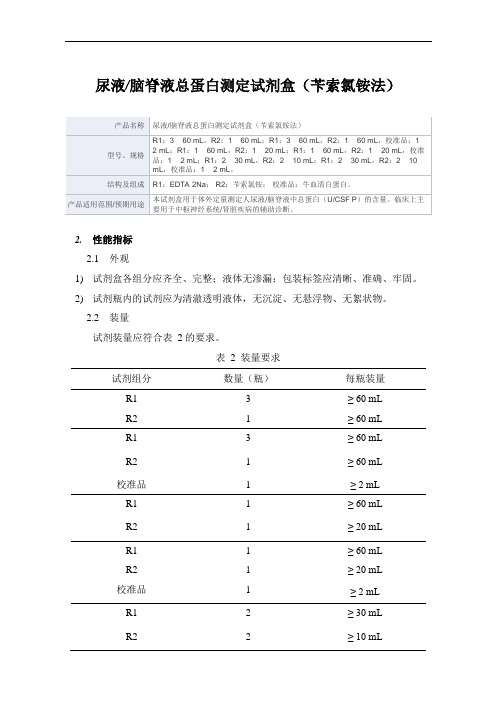
尿液/脑脊液总蛋白测定试剂盒(苄索氯铵法)2.性能指标2.1外观1)试剂盒各组分应齐全、完整;液体无渗漏;包装标签应清晰、准确、牢固。
2)试剂瓶内的试剂应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.2装量试剂装量应符合表 2 的要求。
表 2 装量要求试剂组分数量(瓶)每瓶装量R1 3 ≥ 60 mLR2 1 ≥ 60 mLR1 3 ≥ 60 mLR2 1 ≥ 60 mL校准品 1 ≥ 2 mLR1 1 ≥ 60 mLR2 1 ≥ 20 mLR1 1 ≥ 60 mLR2 1 ≥ 20 mL校准品 1 ≥ 2 mLR1 2 ≥ 30 mLR2 2 ≥ 10 mLR1 2 ≥ 30 mL R2 2 ≥ 10 mL 校准品 1 ≥ 2 mL2.3空白限不大于 3 mg/L。
2.4分析灵敏度试剂盒测试150 mg/L 的被测物时,其吸光度差值≥0.070 Abs。
2.5线性区间试剂盒线性在[40, 2000] mg/L 区间内,应符合如下要求:a) 线性相关系数(r)≥0.990;b) [40, 150] mg/L 区间内,线性绝对偏差在±15 mg/L 范围内;(150, 2000]mg/L 区间内,线性相对偏差在±10%范围内。
2.6精密度2.6.1重复性试剂盒测试浓度在(150±30)mg/L 和(450±90)mg/L 范围内的样本时,变异系数(CV)≤6.0%。
2.6.2批间差试剂盒测试浓度在(150±30)mg/L 和(450±90)mg/L 范围内的样本时,相对极差(R)≤10.0%。
2.7准确度测试国家标准品或可溯源至国家标准品的企业校准品,测定值与理论值的相对偏差应在±10.0%范围内。
2.8校准品外观a)校准品的外观应整洁,标识应清晰、准确、牢固;b)瓶内液体清澈透明,无沉淀、无悬浮物、无絮状物。
2.9校准品正确度使用产品校准品校准测量系统后测量国家标准品或可溯源至国家标准品的企业校准品,量值传递的正确度应符合。
总蛋白测定试剂盒(双缩脲法)产品技术要求lepu

总蛋白测定试剂盒(双缩脲法)
适用范围:本试剂用于体外定量测定人血清中总蛋白的含量。
1.1 规格
试剂盒是由试剂组成的液体单试剂。
规格及装量见表1。
表1 规格及装
量
1.2主要组成成分
试剂主要组分:
2.1 净含量
应不低于试剂瓶标示装量。
2.2 外观
试剂为淡蓝色或深蓝色液体。
外包装完好、无破损,标签完好、字迹清晰。
2.3 试剂空白
在546nm处测定试剂空白吸光度,应≤1.5。
2.4 分析灵敏度
测试70g/L的被测物时,吸光度变化(ΔA)应不低于0.05。
2.5 准确度
用国家标准品(360012)对试剂(盒)进行测试,相对偏差不超过±10%。
2.6 重复性
批内变异系数(CV)应不超过5%。
2.7 线性
2.7.1在[2,120]g/L区间内,线性相关系数r应不低于0.990;
2.7.2 [2,9.6)g/L区间内绝对偏差不超过±0.77g/L;[9.6,120]g/L区间内相对偏差不超过±8%。
2.8 批间差
对同一份样品进行重复测定,相对极差不大于8%。
2.9 稳定性
取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
脑脊液尿液总蛋白测定试剂盒(焦酚红法)产品技术要求jiuqiang

脑脊液/尿液总蛋白测定试剂盒(焦酚红法)适用范围:本试剂盒用于体外定量测定人尿液或脑脊液中总蛋白的含量。
1.1 包装规格见表1。
表1 包装规格1.2 组成成分见表2。
2.1 外观试剂为浅红色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A600nm下测定空白吸光度应≤ 0.2000。
2.4 准确度用国际标准物质NIST SRM 927,对试剂盒进行测试,偏差应不超过±15%。
2.5 分析灵敏度样本浓度为1.000g/L时,其吸光度变化在0.5000~1.0000之间。
2.6 线性区间在(0.010,1.500]g/L区间内,线性相关系数r≥0.990,在(0.010,0.500]g/L 区间内绝对偏差应不超过±0.050 g/L,在(0.500,1.500]g/L区间内相对偏差应不超过±10%。
2.7 测量精密度2.7.1 重复性对高、低不同浓度的同一尿液样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。
2.7.2 批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为18个月。
在试剂盒有效期满后一个月以内,应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.9 校准品溯源性按GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供所用产品校准的来源、赋值过程以及测量不确定度,试剂盒校准品溯源至国际标准物质NIST SRM 927。
总蛋白定量(TP)测试盒说明书

总蛋白定量(TP)测试盒 比色法:100管/96样一、测定原理:碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA 试剂形成紫色的络合物,562nm 处有最大吸收峰,依据吸光度与浓度成正比,通过测吸光度即可计算待测蛋白的浓度。
二、试剂组成及配制:试剂一:粉剂×2 支,稀释液,12.5ml×2 瓶,4℃冷藏密封保存 6 个月。
试剂一应用液的配制:取试剂一粉剂 1 支与试剂一稀释液 1 瓶混匀,溶解完全后4℃待用。
试剂二:250μl×2 支,4℃冷藏密封保存 6 个月。
工作液的配制:按试剂一应用液:试剂二=50∶1 的比例配制,混匀后待用,用多少配多少。
试剂三:终止剂贮备液20ml×1 瓶,4℃冷藏密封保存 6 个月。
终止剂应用液:取终止剂贮备液用双蒸水5 倍稀释后备用,4℃冷藏。
试剂四:524μg/ml 蛋白标准液0.2ml×1 支。
4℃保存1 个月。
三、样本前处理:详见试剂盒内说明书关于样本处理的说明。
四、操作步骤:空白管标准管测定管双蒸水(μl)20524μg/ml 标准品(μl)20待测样本(μl)20工作液(μl)250 250 250五、计算公式:总蛋白浓度 = 测定OD 值 -空白OD 值 ⨯ 标准品浓度 ⨯样本测试前(μg / ml ) 标准OD 值 -空白OD 值 (524μg / ml ) 稀释倍数漩涡混匀,37℃孵育 30 分钟 终止剂应用液(μl ) 750 750 750 漩涡混匀,静置 5 分钟,562nm 波长,0.5cm 光径,双蒸水调零,测定各管吸光度值。
总蛋白提取试剂盒说明书

总蛋白提取试剂盒(Total Protein Extraction Kit)P1250: 蛋白抽提试剂盒-I (实体组织和细胞蛋白抽提, 100 extractions)描述: 从组织细胞中提取总蛋白是Western Blot关键步骤。
实体软组织如脑脊髓富含磷脂, 神经血管含大量结缔组织, 而脂肪则有大量油脂, 常规方法难以有效从这些组织提取蛋白。
本试剂盒为组织或培养细胞总蛋白提取提供完整处理方案。
用裂解-结合缓冲液匀浆裂解实体组织, 或直接用裂解-结合缓冲液重悬培养细胞, 然后加入抽提试剂去除非蛋白成份, 离心、干燥后即可得到总蛋白。
蛋白沉淀溶解后用常规方法进行蛋白定量。
提取过程可在30-60分钟内完成, 可在1.5ml离心管微量提取也可大规模制备, 极为简便高效。
通常一次提取10-100mg组织所取得总蛋白可进行几十到上百次分析如蛋白质电泳、Western Blot、免疫共沉淀。
组成 1. 裂解-结合缓冲液100 ml 2. 抽提试剂100 ml每毫升裂解缓冲液和抽提试剂可提取10-100mg组织或1 ⨯ 107细胞。
试剂盒裂解缓冲液是过量。
适用多种实体软组织(> 1 mg), 如脑、脊髓、神经结或纤维、脂肪、肝脏、消化道组织、肾脏、心脏、肌肉、血管、结缔组织等, 以及多种原代细胞和永生化细胞系。
保留: 室温或4ºC保留2年固体组织蛋白提取1.每10-100mg固体组织剪碎后加入0.5-1 ml裂解液, 放入玻璃匀浆器内上下手动匀浆15次; 或用高速机械匀浆器12,000 rpm 破碎组织。
注意: 初始组织量应在10-100mg范围。
肝肾组织蛋白含量高, 提取时应加较少许组织, 不然形成蛋白膜厚、致密且难溶。
少许小未破碎组织不影响后续抽提。
2.仅取0.5ml组织匀浆液转移到1.5ml离心管, 弃去剩下组织匀浆液。
每0.5ml组织匀浆液加入2倍体积(1 ml)抽提试剂充足混匀。
总蛋白检测验证方案

总蛋白检验方法验证方案编制: 日期:审核: 日期:批准:日期:1.概述验证总蛋白含量测定试验检测方法2.验证目的通过实验验证总蛋白检验检测方法的重复性、中间精密度、重现性、线性、耐用性,确认该检测方法是否适用于本公司生产的产品检验,确保检验结果的准确可靠。
3.验证环境3.1环境洁净度不应低于C级,洁净工作台洁净度为A级。
3.2操作间应保持负压,低于-15Pa。
4.样品信息中农威特猪口蹄疫O、A二价灭活疫苗;生产管理部中间产品5.验证内容(1)重复性(2)中间精密度(3)重现性(4)线性(5)耐用性(6)试验设备及器材6. 试验设备及器材酶标仪(全波长),“M”型96孔板,卡介苗注射器,单通道和多通道移液器,涡旋震荡仪,酶标板振荡器,商品化Lowry法改良试剂盒 7.验证步骤(1)重复性取同一批次中农威特灭活疫苗1瓶及生产管理部样品3份,用同一批次的试剂盒,在同一环境,同一设备,同一操作者按照《总蛋白含量测定标准操作程序》操作用酶标仪完成6次试验,计算样品含量及其标准差。
(2)中间精密度取同一批次中农威特灭活疫苗1瓶及生产管理部样品3份,用同一批次的试剂盒,在同一环境,同一设备,不同操作者按照《总蛋白含量测定标准操作程序》操作用酶标仪完成6次试验,计算样品含量及其标准差。
(3)重现性取同一批次中农威特灭活疫苗1瓶及生产管理部样品3份,用同一批次的试剂盒,在不同实验室,同一设备,同一操作者按照《总蛋白含量测定标准操作程序》操作完成试验,计算样品含量及其标准差。
(4)线性取同一批次中农威特灭活疫苗1瓶,用同一批次的试剂盒,在相同实验室,同一设备,同一操作者对样品进行1:1、1:2、1:3、1:4、1:5稀释,按照《总蛋白含量测定标准操作程序》操作完成试验,计算样品含量及其标准差。
(5)耐用性取同一批次中农威特灭活疫苗1瓶及生产管理部样品3份,用不同批次的试剂盒,在相同实验室,同一设备,同一操作者按照《总蛋白含量测定标准操作程序》操作完成试验,计算样品含量及其标准差表1 样品中待测成分含量和精密度RSD可接受范围样品成分含量重复性(RDS%)重现性(RDS%)中间精密度(RDS%)100%122 8.验证结果(1)重复性实验结果第二次试验结果第五次试验结果(2)中间精密度实验结果第四次试验结果(3)重现性实验结果(4)线性实验结果(5)耐用性实验结果9.验证结果分析参考公式:标准差=(1)卢志强完成试验,检测结果如下:(2)中间精密度结果分析(3)重现性结果分析(4)线性结果分析依照数据绘制出线形图,列出回归方程。
双缩脲双波长自动分析法测定脑脊液总蛋白含量的临床应用

文章编号:1001-5949(2001)10-0584-02・论 著・双缩脲双波长自动分析法测定脑脊液总蛋白含量的临床应用刘 彤1,刘志浩2 【摘要】 目的 在全自动分析仪上建立一种快速简便的脑脊液蛋白双缩脲测定法。
方法 在日产7170A全自动分析仪上,用双缩脲法测定脑脊液蛋白含量。
结果 双缩脲法测定脑脊液蛋白准确度高,精密度好,与磺基水杨酸比浊法有很好的相关性,而且重现性优于比浊法,两法相比,P<0.01,有较显著的差异。
结论 在全自动分析仪上用双缩脲法测定脑脊液蛋白是一种简使、快速、可靠的方法。
【关键词】 缩二脲反应;脑脊髓液蛋白质类;自动分析【中图分类号】 R446.14 【文献标识码】 ADu al-w avelength automatic analysis of cerebrospinal fluid protein with biuret method L IU Tong.(Beijing China-Japan Friendship Hosp.,Beijing100029,China)【Abstract】 Objective To establish a kind of rapid and simple biuret method for measuring cerebrospinal fluid protein of auto2 matic analyser.Method To use biuret method for measuring cerebrospinal fluid protein of HITACHI71701A automatic analyzer. R esults This method has good accruacy and precision.The relativity between this method and sulfosalicylic acid turbidimetry is very good.The reproducibility of this method is better than turbidimetry(P<0.01).Conclusion To measure cerebros pinal fluid protein with biuret method on automatic analyser is a kind of simple,rapid and reliable method.【K ey w ords】 Biuret reaction;Cerebrospinal f luid proteins;A utoanalysis 双缩脲试剂与各种血清蛋白多肽链产生的紫色非常一致(即几种主要血清蛋白显色后吸光度值相似,且具有稳定的吸光系数),是目前公认的最可靠的总蛋白浓度测定方法之一,多年来广泛用于临床标本分析。
用高浓度双缩脲试剂直接测定脑脊液总蛋白

用高浓度双缩脲试剂直接测定脑脊液总蛋白
倪方荣
【期刊名称】《人民军医》
【年(卷),期】1992()1
【摘要】脑脊液总蛋白测定的方法虽有多种,但均有各自的缺点,如比浊法灵敏度低,沉淀颗粒易聚合不稳定:染料结合法都有与白、球蛋白呈色不一致和比色皿难洗净的缺点;免疫学方法虽灵敏又特异,但不适用于常规工作;原双缩脲试剂灵敏度低,需将脑脊液浓缩后才能测定,太麻烦。
我们配制的高浓度双缩脲试剂不但灵敏度高,且保持了该法白、球蛋白呈色一致的优点,可直接测定脑脊液中总蛋白,手工和生化自动分析仪均适用。
试剂与方法一、试剂 1.0.5mol/L的硫酸铜:称取硫酸铜
(CuSO_4·5H_2O)12.85g溶解在100ml蒸馏水中。
2.酒行酸钾钠溶液:取酒石酸钾钠(NKaC_4H_4O_4·4H_2O)25g,碘化钾12.5g,乙二胺四乙酸二钠
(C_(10)H_(14)N_2O_3Na_2·2H_2O)
【总页数】2页(P74-75)
【关键词】双缩脉试剂;测定;脑脊液;总蛋白
【作者】倪方荣
【作者单位】117医院生化科
【正文语种】中文
【中图分类】R446.14
【相关文献】
1.低浓度双缩脲试剂测定脑脊液总蛋白 [J], 刘姣;李颖博
2.用高浓双缩脲试剂直接测定脑脊液总蛋白 [J], 倪方荣
3.单试剂与双试剂双缩脲法测定血清总蛋白的比较 [J], 杨爱华
4.双缩脲双波长自动分析法测定脑脊液总蛋白含量的临床应用 [J], 刘彤;刘志浩
5.改良双缩脲双试剂与单试剂法测定脂浊标本血清总蛋白比较分析 [J], 童占清因版权原因,仅展示原文概要,查看原文内容请购买。
染料比色法测定三种脑脊液蛋白指标

染料比色法测定三种脑脊液蛋白指标
王丹;刘卫平
【期刊名称】《陕西医学检验》
【年(卷),期】1999(014)002
【摘要】经研究60份脑脊液的潘氏试验及用染料比色法测定总蛋白,白蛋白,
计算脑脊液/血清白蛋白指数等几项指标在临床的应用。
认为用溴酚蓝比色法测定脑脊液白蛋白对血脑屏障损伤的诊断敏感性为85.9%,诊断特异性为100%,方法简便,试剂易配,能上机操作,是一种既符合现代生化检验操作又有良好的临床实用性的方法。
【总页数】2页(P34-35)
【作者】王丹;刘卫平
【作者单位】南京军区福州总医院检验中心;南京军区福州总医院检验中心
【正文语种】中文
【中图分类】R446.14
【相关文献】
1.伊红Y染料结合法测定脑脊液蛋白在全自动生化分析仪上的应用 [J], 陈新宽
2.染料结合法测定脑脊液蛋白的实验研究 [J], 喻红波;陈太金;邓军野
3.微量双缩脲比色法测定脑脊液总蛋白的方法学研究 [J], 任治国
4.三种脑部炎症病变脑脊液铁蛋白、脑脊液白蛋白/血清白蛋白比值和免疫球蛋白
的变化及意义 [J], 刘玉华;张素平;邓婉青
5.胶金比色法测定脑脊液蛋白质 [J], 许中
因版权原因,仅展示原文概要,查看原文内容请购买。
总抗氧化能力(T-AOC)检测试剂盒(FRAP 微板法)说明书
植物样品的吸光度值和 0.5mM 的 Fe2+的吸光度值相同,则该血浆(血清)样品的总抗氧化 能力为 0.5mM/(0.5g/5ml)=0.5mmol/100g;
血浆(血清)样品的吸光度值和 0.7mM 的 Fe2+的吸光度值相同,则该血浆(血清)样品的总抗 氧化能力为 0.7mM;
细胞(组织)匀浆样品的吸光度值和 0.3mM 的 Fe2+的吸光度值相同,该匀浆液蛋白浓度为 0.2mg/ml,则该细胞(组织)样品的总抗氧化能力为 0.3mM/0.2mg/ml=0.15mmol/g; 0.3mM 的抗氧化物质,其吸光度值和 0.6mM 的 Fe2+的吸光度值相同,则其相对总抗氧化能力为 0.6mM/0.3mM=2。
注意事项: 1、 实验材料应尽量新鲜,样品提取的整个过程最好在 4℃条件下进行;如取材后不能立即 检测,也可以-80℃冻存后再进行测定(应在 1 个月内测定完毕)。 2、 亚铁标准溶液如变为黄色或棕黄色应弃用。 3、 测定 593nm 如有困难,亦可在 585~605nm 范围内进行测定。 4、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
总抗氧化能力(T-AOC)检测试剂盒(FRAP 微板法)即 Total Antioxidant Capacity Assay Kit with FRAP method,简称 T-AOC Assay Kit,是一种采用铁离子还原能力(Ferric Reducing Ability of Plasma,FRAP)来测定样品抗氧化活性的方法,其原理是在酸性条件下样品中的抗 氧化物质还原 Fe3+-TPTZ 产生 Fe2+-TPTZ,呈现出明显的蓝色(紫色),于 593nm 处有最大 的光吸收,在 Fe3+-TPTZ 过量的情况下测定蓝色物质的生成量即可获得待测样品的还原能 力即总抗氧化能力,由于反应在酸性条件下进行,可以抑制内源性的一些干扰因素,并且由 于血浆等样品中的铁离子或亚铁离子的总浓度通常低于 10μM,因此血浆等样品中的铁离 子或亚铁离子不会显著干扰 FRAP 法的检测反应,本方法可以对血浆、血清、尿液等各种体 液,细胞或组织裂解液、植物或中草药抽提液或各种抗氧化物溶液的总抗氧化能力进行检测。 该试剂盒仅用于科研领域,不适用于临床诊断或其他用途。
脑脊液蛋白定性试验标准操作程序

脑脊液蛋白定性试验标准操作程序
【目的】指导脑脊液蛋白定性试验操作。
【该SOP文件变动程序】本标准操作程序的变动,可由任一使用本SOP的工作人员提出,请专业组长及科主任签字后生效。
【测定原理】脑脊液中球蛋白与苯酚结合,可形成不溶性蛋白盐而下沉,产生白色浑浊或沉淀,又称潘氏试验。
【试剂配制】5%苯酚溶液:取纯苯酚25ml,加蒸馏水至500ml,用力振摇,置37 温箱内1-2天,待完全溶解后,置棕色瓶内保存。
【操作步骤】
取试剂2-3ml ,置于小试管内,用毛细滴管滴入脑脊液1-2滴,衬以黑背景,立即观察结果。
【结果判断】
阴性:清晰透明,不显雾状。
●极弱阳性(±):微呈白雾状,在黑色背景下,才能看到。
●弱阳性(+):灰白色云雾状。
●阳性(2+):白色浑浊。
●强阳性(3+):白色浓絮状沉淀。
●最强阳性(4+):白色凝块。
【临床意义】
正常时多为阴性或极弱阳性。
有脑组织和脑脊髓膜疾患时常呈阳性反应.如化脓性脑脊髓膜炎、梅毒性中枢神经系统疾病、脊髓灰白质炎、流行性脑炎等。
脑出血时多呈强阳性反应,如外伤性血液混入脑脊液中,亦可呈阳性反应。
【注意事项】
1、脑脊液混浊或含有细胞时,须经离心沉淀后取上清液做本试验。
2、做此试验时,所用滴管.试管必须十分清洁,否则易出现假阳性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脑脊液总蛋白检测试剂盒(染料结合微板法)
简介:
脑脊液(Cerebro-Spinal Fluid ,CSF)是存在于脑室、蛛网膜下腔和脊髓中央管内的无色透明液体,由脑室中的脉络丛产生,与血浆和淋巴液的性质相似。
正常成年人的脑脊液约100~150ml ,弱碱性,不含红细胞。
正常脑脊液具有一定的化学成分和压力,对维持颅压的相对稳定有重要作用,当中枢神经系统受损时,脑脊液的检测成为重要的辅助诊断手段。
总蛋白(Total Protein ,TP)由白蛋白和球蛋白组成。
对于生物体液(血清、尿液、脑脊液)中总蛋白质含量的测定,一般要基于如下两个假设:1、所有蛋白质分子由纯多肽组成,含氮量的质量百分比为16%;2、体液中含有数百个蛋白质分子,每个分子对测定反应都具有非常相似的特性。
目前常用的方法有:双缩脲法、紫外分光光度法、染料结合法、凯氏定氮法、沉淀法等。
Leagene 脑脊液总蛋白检测试剂盒(染料结合微板法)其检测原理是在酸性条件下,伊红解离成阴离子型,染料瞌颜色逐渐褪去,使试剂空白吸光度降低;蛋白质多肽中的精氨酸、组氨酸、赖氨酸、色氨酸残基解离成带有-NH3+基团,与伊红结合成红色蛋白复合物,其吸光度与蛋白浓度呈比例,与同样处理的标准液比较,测得样本中蛋白质的含量。
本试剂盒专门用于人或动物脑脊液样本中的总蛋白含量测定。
本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:
自备材料:
1、 96孔板
2、 酶标仪
操作步骤(仅供参考):
1、 取1ml 蛋白标准配制液或稀释液加入到蛋白标准中,充分溶解后配制成蛋白标准溶液,
编号 名称
TC0601 100T
Storage 试剂(A): TP 显色液
A1: Eosinsolution 0.3ml RT 避光
A2: Acidic buffer 0.3ml RT A3: Eosin buffer
25ml
RT
使用前, A1:A2:A3混合,即为TP 显色液。
试剂(B): TP acidic buffer 1ml RT 试剂(C): 蛋白标准 20mg
RT 使用说明书
1份
配制后可立即使用,溶解后的蛋白标准溶液应-20℃保存。
取适量蛋白标准溶液用蛋白标准配制液或稀释液继续进行稀释。
特别提示:待测蛋白溶解于什么样的稀释液中,蛋白标准也宜溶解于什么样的稀释液中。
例如待测蛋白溶解于蔗糖中,亦取蛋白标准溶解于蔗糖中。
一般也可以用NaCl或PBS作为稀释液。
2、TP测定操作,按下表依次加入试剂:
加入物(μl) 空白孔标准孔待测孔
蛋白标准配制液 4
蛋白标准溶液(0.7mg/ml) 4
待检样品(脑脊液) 4
TP acidic buffer 8 8 8
TP显色液240 240 240
3、漩涡混匀, 室温孵育。
4、酶标仪测定波长处的吸光度。
以空白孔调零,读取标准孔和各待测孔的吸光度。
计算:脑脊液总蛋白(mg/L)=(待测孔吸光度/标准孔吸光度)×700
注意事项:
1、蛋白标准粉末溶解于蛋白标准配制液后,即获得蛋白标准原液,该原液中含有防腐剂,
不影响后续检测,该蛋白标准原液-20℃长期保存。
2、如果没有酶标仪,也可以使用分光光度计测定。
使用分光光度计测定蛋白浓度时,每
个试剂盒可以测定的样品数量可能会显著减少。
3、相同浓度的蛋白质,白蛋白呈色稍强,球蛋白稍低。
4、本方法线性范围可达1000mg/L,若CSF中蛋白含量过高,常规检查时潘氏实验达(2+)
者,测定时CSF用量应适量减少,计算时应相应修正。
5、本方法加入试剂后1~5min内呈进行性缓慢下降,10~30min趋于平稳,可稳定2h。
6、TP acidic buffer加入量应准确,边加边混匀,否则影响结果。
有效期:12个月有效。
蛋白标准配制成溶液后应-20℃冻存。
