热力学习题与答案(原件)
大学物理第十三章(热力学基础)部分习题及答案

第十三章热力学基础一、简答题:1、什么是准静态过程?答案:一热力学系统开始时处于某一平衡态,经过一系列状态变化后到达另一平衡态,若中间过程进行是无限缓慢的,每一个中间态都可近似看作是平衡态,那么系统的这个状态变化的过程称为准静态过程。
2、什么是可逆过程与不可逆过程答案:可逆过程:在系统状态变化过程中,如果逆过程能重复正过程的每一状态,而且不引起其它变化;不可逆过程:在系统状态变化过程中,如果逆过程能不重复正过程的每一状态,或者重复正过程时必然引起其它变化。
3、一系统能否吸收热量,仅使其内能变化? 一系统能否吸收热量,而不使其内能变化?答:可以吸热仅使其内能变化,只要不对外做功。
比如加热固体,吸收的热量全部转换为内能升高温度;4、简述热力学第二定律的两种表述。
答案:开尔文表述:不可能制成一种循环工作的热机,它只从单一热源吸收热量,并使其全部变为有用功而不引起其他变化。
克劳修斯表述:热量不可能自动地由低温物体传向高温物体而不引起其他变化。
5、什么是熵增加原理?答:一切不可逆绝热过程中的熵总是增加的,可逆绝热过程中的熵是不变的。
把这两种情况合并在一起就得到一个利用熵来判别过程是可逆还是不可逆的判据——熵增加原理。
6、什么是卡诺循环? 简述卡诺定理?答案:卡诺循环有4个准静态过程组成,其中两个是等温线,两个是绝热线。
卡诺提出在稳度为T1的热源和稳度为T2的热源之间工作的机器,遵守两条一下结论:(1)在相同的高温热源和低温热源之间工作的任意工作物质的可逆机,都具有相同的效率。
(2)工作在相同的高温热源和低温热源之间的一切不可逆机的效率都不可能大于可逆机的效率。
7、可逆过程必须同时满足哪些条件?答:系统的状态变化是无限缓慢进行的准静态过程,而且在过程进行中没有能量耗散效应。
二、选择题1、对于理想气体的内能,下列说法中正确的是( B ):( A ) 理想气体的内能可以直接测量的。
(B) 理想气体处于一定的状态,就有一定的内能。
高三化学化学热力学练习题及答案

高三化学化学热力学练习题及答案1. 选择题1. 下列原因中,能够说明热力学第一定律成立的是:A. 熵是一个状态函数B. 热力学第二定律成立C. 理想气体的内能与温度有关D. 等温过程中,热容量为0答案:D2. 熵最小原理是热力学第几定律的基础?A. 热力学第一定律B. 热力学第二定律C. 热力学第三定律D. 热力学第四定律答案:C3. 以下哪个过程属于绝热过程?A. 等温过程B. 等通压过程C. 等经热过程D. 等熵过程答案:D2. 填空题1. 在绝热条件下,压强增加时,气体的_________。
答案:温度增加2. 一种气体的摩尔熵为5R/J·K^-1,当气体的摩尔数变为原来的2倍时,熵的变化量为_________。
答案:5R/J·K^-13. 摩尔焓是单位质量物质的_________。
答案:焓3. 计算题1. 一个氧气分子的质量为5.3×10^(-26) kg,它的平均动能为3.01×10^(-19) J,求氧气分子的温度。
答案:298 K解析:根据理想气体的平均动能公式:K_avg = (3/2)kT其中,K_avg为平均动能,k为玻尔兹曼常数,T为温度。
将已知数据代入计算:3.01×10^(-19) J = (3/2) × 1.38×10^(-23) J/K × TT = (3.01×10^(-19) J × 2) / ((3/2) × 1.38×10^(-23) J/K)T = 298 K2. 某物质在压强为1 atm,温度为298 K时,其体积为10 L。
将压强增加到2 atm,温度保持不变的情况下,体积变为多少?答案:5 L解析:根据理想气体状态方程:PV = nRT其中,P为压强,V为体积,n为物质的摩尔数,R为气体常数,T 为温度。
将已知数据代入计算:1 atm × 10 L = n × 0.0821 L·atm/(mol·K) × 298 Kn = 10 L × 1 atm / (0.0821 L·atm/(mol·K) × 298 K) ≈ 0.406 mol根据理想气体状态方程,将n和T保持不变,有:2 atm × V = 0.406 mol × 0.0821 L·atm/(mol·K) × 298 KV = 5 L4. 解答题请结合热力学第一定律回答以下问题:在一个封闭容器中,有一定质量的理想气体,初始温度为300 K。
(完整版)工程热力学习题集附答案

工程热力学习题集一、填空题1.能源按使用程度和技术可分为 能源和 能源。
2.孤立系是与外界无任何 和 交换的热力系。
3.单位质量的广延量参数具有 参数的性质,称为比参数。
4.测得容器的真空度48V p KPa =,大气压力MPa p b 102.0=,则容器内的绝对压力为 。
5.只有 过程且过程中无任何 效应的过程是可逆过程。
6.饱和水线和饱和蒸汽线将压容图和温熵图分成三个区域,位于三区和二线上的水和水蒸气呈现五种状态:未饱和水 饱和水 湿蒸气、 和 。
7.在湿空气温度一定条件下,露点温度越高说明湿空气中水蒸气分压力越 、水蒸气含量越 ,湿空气越潮湿。
(填高、低和多、少)8.克劳修斯积分/Q T δ⎰ 为可逆循环。
9.熵流是由 引起的。
10.多原子理想气体的定值比热容V c = 。
11.能源按其有无加工、转换可分为 能源和 能源。
12.绝热系是与外界无 交换的热力系。
13.状态公理指出,对于简单可压缩系,只要给定 个相互独立的状态参数就可以确定它的平衡状态。
14.测得容器的表压力75g p KPa =,大气压力MPa p b 098.0=,则容器内的绝对压力为 。
15.如果系统完成某一热力过程后,再沿原来路径逆向进行时,能使 都返回原来状态而不留下任何变化,则这一过程称为可逆过程。
16.卡诺循环是由两个 和两个 过程所构成。
17.相对湿度越 ,湿空气越干燥,吸收水分的能力越 。
(填大、小)18.克劳修斯积分/Q T δ⎰ 为不可逆循环。
19.熵产是由 引起的。
20.双原子理想气体的定值比热容p c = 。
21、基本热力学状态参数有:( )、( )、( )。
22、理想气体的热力学能是温度的( )函数。
23、热力平衡的充要条件是:( )。
24、不可逆绝热过程中,由于不可逆因素导致的熵增量,叫做( )。
25、卡诺循环由( )热力学过程组成。
26、熵增原理指出了热力过程进行的( )、( )、( )。
31.当热力系与外界既没有能量交换也没有物质交换时,该热力系为_______。
热力学练习题全解

热力学练习题全解热力学是研究热能转化和热力学性质的科学,它是物理学和化学的重要分支之一。
在热力学中,我们通过解决一系列练习题来巩固和应用所学知识。
本文将为您解答一些热力学练习题,帮助您更好地理解和应用热力学的基本概念和计算方法。
1. 练习题一题目:一个理想气体在等体过程中,吸收了50 J 的热量,对外界做了30 J 的功,求该气体内能的变化量。
解析:根据热力学第一定律,内能变化量等于热量和功之和。
即ΔU = Q - W = 50 J - 30 J = 20 J。
2. 练习题二题目:一摩尔理想气体从A状态经过两个等温过程和一段绝热过程转变为B状态,A状态和B状态的压强和体积分别为P₁、P₂和V₁、V₂,已知 P₂ = 4P₁,V₁ = 2V₂,求这个过程中气体对外界做的总功。
解析:由两个等温过程可知,气体对外界做的总功等于两个等温过程的功之和。
即 W = W₁ + W₂。
根据绝热过程的特性,绝热过程中气体对外做功为零。
因此,只需要计算两个等温过程的功即可。
根据理想气体的状态方程 PV = nRT,结合已知条件可得:P₁V₁ = nRT₁①P₂V₂ = nRT₂②又已知 P₂ = 4P₁,V₁ = 2V₂,代入式①和式②可得:8P₁V₂ = nRT₁③4P₁V₂ = nRT₂④将式③和式④相减,可得:4P₁V₂ = nR(T₁ - T₂) ⑤由于这两个等温过程温度相等,即 T₁ = T₂,代入式⑤可得:4P₁V₂ = 0所以,这个过程中气体对外界做的总功 W = 0 J。
通过以上两个练习题的解答,我们可以看到在热力学中,我们通过应用热力学第一定律和理想气体的状态方程等基本原理,可以解答各种热力学问题。
熟练掌握这些计算方法,有助于我们更深入地理解热力学的基本概念,并应用于实际问题的解决中。
总结:本文对两道热力学练习题进行了详细解答,分别涉及了等体过程和等温过程。
通过这些例题的解析,读者可以理解和掌握热力学的基本计算方法,并将其应用于实际问题的求解中。
热力学习题及答案

四.计算题 1. 1mol 理想气体(CV,m=2.5R)在300K,101kPa下恒熵压缩 到4×101kPa,再恒容升温到500K,最后恒压降温至 400K,求整个过程的W、ΔS、ΔA及 ΔG。 已知Sm(300K)=20J· K-1mol-1
ΔS1=0 T ΔV=0 T =500K Δp=0 T1=300K 2 3 P1=101.3kPa P2=405.3kPa P3 T4=400K P4= P3
9.一定量的理想气体,经如图所示的循环过程,A→B 为等温过程,B→C等压过程,C→A为绝热过程,那么 曲边梯形ACca的面积表示的功等于:(C)
(A) B→C的内能变化 ; (B) A→B的内能变化 ; (C) C→A的内能变化 (D) C→B的内能变化 10.常压下 —10℃ H2O(l)变成—10℃的冰,该过程中
ΔU1=ΔU2,ΔH1=ΔH2,ΔG1=ΔG2
2.封闭系统,W’=0时,下列过程中ΔU、 ΔH、 ΔS、 ΔA、 ΔG何者必为零。 ΔU a.绝热密闭刚性容器中进行的化学反应过程_____ ΔG b.某物质的恒温、恒压可逆相变过程_______ c.系统所经历的任一不可逆循环过程_______ 全部
13
S 3
T4
C p ,m
T3
p3 T4 2 30 ln 10 T4 T3 R ln J mol 1 K 1 T3 p4 5.730J mol 1 K 1
p3 dT R ln T p4
Δ S m= Δ S1 +Δ S2+ Δ S3=128.06J· mol-1K-1 S4= Smθ(g,380K)+ΔS(pθ →p4) = Sm θ(g,380K) +Rln(pθ /p4)=180.00J· mol-1K-1 S1=S4-Δ Sm =51.91J· mol-1K-1
热力学基础试题及答案

热力学基础试题及答案一、选择题(每题2分,共20分)1. 热力学第一定律指出能量守恒,下列哪项描述是正确的?A. 能量可以被创造或消灭B. 能量可以从一个物体转移到另一个物体C. 能量可以在封闭系统中增加或减少D. 能量总是从高温物体流向低温物体答案:B2. 熵是热力学中描述系统无序度的物理量,下列哪项描述是正确的?A. 熵是一个状态函数B. 熵是一个过程函数C. 熵只与系统的温度有关D. 熵只与系统的压力有关答案:A3. 理想气体状态方程为PV=nRT,其中P代表压力,V代表体积,n代表摩尔数,R代表气体常数,T代表温度。
下列哪项描述是错误的?A. 理想气体状态方程适用于所有气体B. 在恒定温度下,气体的体积与压力成反比C. 在恒定压力下,气体的体积与温度成正比D. 在恒定体积下,气体的压力与温度成正比答案:A4. 热力学第二定律指出热量不能自发地从低温物体传递到高温物体,下列哪项描述是正确的?A. 热量总是从高温物体流向低温物体B. 热量可以在没有外界影响的情况下从低温物体流向高温物体C. 热量可以在外界做功的情况下从低温物体流向高温物体D. 热量可以在没有外界做功的情况下从低温物体流向高温物体答案:C5. 卡诺循环是理想化的热机循环,其效率只与热源和冷源的温度有关。
下列哪项描述是错误的?A. 卡诺循环的效率与工作介质无关B. 卡诺循环的效率与热源和冷源的温度差有关C. 卡诺循环的效率与热源和冷源的温度成正比D. 卡诺循环的效率在所有循环中是最高的答案:C6. 根据热力学第三定律,下列哪项描述是正确的?A. 绝对零度是可以达到的B. 绝对零度是不可能达到的C. 绝对零度下所有物质的熵为零D. 绝对零度下所有物质的熵为负值答案:B7. 热力学中的吉布斯自由能(G)是用来描述在恒温恒压条件下系统自发进行变化的能力。
下列哪项描述是错误的?A. 吉布斯自由能的变化(ΔG)是负值时,反应自发进行B. 吉布斯自由能的变化(ΔG)是正值时,反应非自发进行C. 吉布斯自由能的变化(ΔG)是零时,系统处于平衡状态D. 吉布斯自由能的变化(ΔG)与系统的温度和压力无关答案:D8. 相变是指物质在不同相态之间的转变,下列哪项描述是错误的?A. 相变过程中物质的化学性质不变B. 相变过程中物质的物理性质会发生变化C. 相变过程中物质的熵值不变D. 相变过程中物质的体积可能会发生变化答案:C9. 热力学中的临界点是指物质的气液两相在该点的物理性质完全相同。
大学热力学试题及答案

大学热力学试题及答案一、选择题(每题2分,共10分)1. 热力学第一定律的数学表达式是:A. ΔU = Q - WB. ΔH = Q + WC. ΔG = Q - WD. ΔS = Q/T答案:A2. 绝对零度是指:A. 温度的最低极限B. 物体内能为零的状态C. 物体分子运动停止的状态D. 物体分子运动速度为零的状态答案:A3. 在等压过程中,系统对外做功,内能的变化是:A. 增加B. 减少C. 不变D. 无法确定答案:B4. 理想气体状态方程为:A. PV = nRTB. PV = nRT + aC. PV = nRT - aD. PV = nT答案:A5. 熵变是一个状态函数,这意味着:A. 熵变只与系统的初始和最终状态有关B. 熵变与过程的路径有关C. 熵变与时间有关D. 熵变与温度有关答案:A二、填空题(每题2分,共10分)1. 根据热力学第二定律,_______不可能自发地从低温物体传到高温物体而不产生其他影响。
答案:热量2. 一个系统在绝热过程中,其熵值会_______。
答案:增加3. 热力学第三定律指出,当温度趋近于绝对零度时,所有纯物质的_______趋于一个常数。
答案:熵4. 根据吉布斯自由能的定义,ΔG = ΔH - TΔS,其中ΔG表示_______。
答案:吉布斯自由能变化5. 在一个封闭系统中,如果系统对外做功且吸收热量,则其内能_______。
答案:增加三、简答题(每题10分,共30分)1. 简述热力学第二定律的开尔文表述。
答案:不可能从单一热源吸热使之完全转化为功而不产生其他影响。
2. 什么是卡诺循环?请简述其效率的计算公式。
答案:卡诺循环是一种理想化的热机循环,由两个等温过程和两个绝热过程组成。
其效率η由公式η = 1 - (Tc/Th)计算,其中Tc是冷源温度,Th是热源温度,且温度以绝对温度(开尔文)表示。
3. 什么是热力学第三定律?它在实际应用中有何意义?答案:热力学第三定律指出,在绝对零度下,所有纯物质的完美晶体的熵值为零。
热力学课外习题(含答案)

判断题:√1.自然界发生的过程一定是不可逆过程。
×2.不可逆过程一定是自发过程。
(做了非体积功发生的过程不是自发过程)×3.熵增加的过程一定是自发过程。
(如自由膨胀过程)×4.绝热可逆过程的∆S = 0,绝热不可逆膨胀过程的∆S > 0,绝热不可逆压缩过程的∆S < 0。
×5.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条绝热可逆途径来计算。
(设计一条可逆非绝热可逆过程来计算熵变)×6.由于系统经循环过程后回到始态,∆S = 0,所以一定是一个可逆循环过程。
(环境可能提供负熵流)×7.平衡态熵最大。
(在隔离体系中是对的)×8.在任意一可逆过程中∆S = 0,不可逆过程中∆S > 0。
9.理想气体经等温膨胀后,由于∆U = 0,所以吸的热全部转化为功,这与热力学第二定律矛盾吗?(不矛盾,因为在热全部转化为功的同时,引起了气体的状态的变化)×10.当系统向环境传热时(Q < 0),系统的熵一定减少。
(熵变是可以过程的热温熵)√11.一切物质蒸发时,摩尔熵都增大。
(混乱度增大)×12.吉布斯函数减小的过程一定是自发过程。
(条件:等温等压,非体积功等于0)×13.在等温、等压下,吉布斯函数变化大于零的化学变化都不能进行。
(当有非体积功如电功时可以发生)×14.系统由V 1膨胀到V 2,其中经过可逆途径时做的功最多。
(等温条件下如对的)×15.因Q p =ΔH ,Q v =ΔU ,所以Q p 和Q v 都是状态函数。
(热是过程量,不是状态函数)×16.水溶液的蒸气压一定小于同温度下纯水的饱和蒸汽压。
(非挥发性溶质的稀溶液)×17.在等温等压不做非体积功的条件下,反应Δr G m <0时,若值越小,自发进行反应的趋势就越强,反应进行得越快。
热力学基础试题及答案

热力学基础试题及答案试题一1. 热力学是研究什么物理系统的基本规律和性质的学科?答:热力学是研究宏观物理系统的基本规律和性质的学科。
2. 请解释热力学第一定律。
答:热力学第一定律,也称为能量守恒定律,表示能量在物理系统中的转化和守恒关系。
它表明能量可以从一种形式转化为另一种形式,但总能量守恒不变。
3. 热平衡的定义是什么?答:热平衡是指物理系统与其周围环境之间没有温度差异,且无任何能量交换的状态。
4. 请解释热容的概念。
答:热容是指物体在温度变化时所吸收或释放的热量的量度。
它与物体的质量和物质的性质有关。
试题二1. 定义熵。
答:熵是热力学状态函数,表示系统的混乱程度或无序程度。
熵越大,系统的无序程度越高。
2. 请解释热力学第二定律。
答:热力学第二定律说明了自然界中存在着一个热量只能从高温区域传递到低温区域的方向性。
这一定律包括熵增原理和卡诺定理。
3. 简要描述热力学过程中的绝热过程。
答:绝热过程是指系统与外界之间没有热量交换的过程。
在绝热过程中,系统的熵保持不变。
4. 请解释热力学温标。
答:热力学温标是用热平衡状态下的热力学系统特性来定义的一个温度刻度。
常见的热力学温标有开尔文温标和摄氏温标。
试题三1. 简要解释焓。
答:焓是系统内可以执行的最大非体积功,它是能量转化过程中的一种状态函数,用来描述系统的能量。
2. 请解释热力学第三定律。
答:热力学第三定律指出在绝对零度(0K)时,任何物质的熵值趋于一个常数,接近于零。
3. 简要描述等温过程。
答:等温过程是指在恒定温度下进行的热力学过程。
在等温过程中,系统与外界之间发生的热量交换能够保持系统温度不变。
4. 简要解释热力学平衡态。
答:热力学平衡态是指系统内各个部分的宏观性质保持稳定且不发生变化的状态。
在热力学平衡态下,系统的熵取极小值。
以上是热力学基础试题及答案。
祝您学习顺利!。
第一章-热力学第一、二定律试题及答案【整理版】

第一章 热力学第一定律一、选择题1-A; 2-C; 3-A; 4-D; 5-B; 6-D; 7-A; 8-D; 9-A; 10-D; 11-B; 12-B; 13- A; 14-C; 15-C; 16-B; 17-C;1.下述说法中,哪一种正确(a )(A)热容C 不是状态函数; (B)热容C 与途径无关;(C)恒压热容C p 不是状态函数;(D)恒容热容C V 不是状态函数。
2.对于内能是体系状态的单值函数概念,错误理解是(c )(A) 体系处于一定的状态,具有一定的内能;(B) 对应于某一状态,内能只能有一数值不能有两个以上的数值;(C) 状态发生变化,内能也一定跟着变化;(D) 对应于一个内能值,可以有多个状态。
3.某高压容器中盛有可能的气体是O 2 ,Ar, CO 2, NH 3中的一种,在298K 时由5dm3绝热可逆膨胀到6dm3,温度降低21K ,则容器中的气体( a )(A) O 2 (B) Ar (C) CO 2 (D) NH 34.戊烷的标准摩尔燃烧焓为-3520kJ·mol -1,CO 2(g)和H 2O(l)标准摩尔生成焓分别为-395 kJ·mol -1和-286 kJ·mol -1,则戊烷的标准摩尔生成焓为( d )(A) 2839 kJ·mol -1 (B) -2839 kJ·mol -1 (C) 171 kJ·mol -1 (D) -171 kJ·mol -15.已知反应)()(21)(222g O H g O g H =+的标准摩尔反应焓为)(T H m r θ∆,下列说法中不正确的是( b )。
(A).)(T H m r θ∆是H 2O(g)的标准摩尔生成焓 (B). )(T H m r θ∆是H 2O(g)的标准摩尔燃烧焓 (C). )(T H m r θ∆是负值 (D). )(T H m r θ∆与反应的θm r U ∆数值相等 6.在指定的条件下与物质数量无关的一组物理量是( d )(A) T , P, n (B) U m , C p, C V(C) ΔH, ΔU, Δξ (D) V m , ΔH f,m (B), ΔH c,m (B)7.实际气体的节流膨胀过程中,下列那一组的描述是正确的( a )(A) Q=0 ΔH=0 ΔP< 0 ΔT≠0 (B) Q=0 ΔH<0 ΔP> 0 ΔT>0(C) Q>0 ΔH=0 ΔP< 0 ΔT<0 (D) Q<0 ΔH=0 ΔP< 0 ΔT≠08.已知反应 H 2(g) + 1/2O 2(g) →H 2O(l)的热效应为ΔH ,下面说法中不正确的是( d )(A) ΔH 是H 2O(l)的生成热 (B) ΔH 是H 2(g)的燃烧热(C) ΔH 与反应 的ΔU 的数量不等 (D) ΔH 与ΔH θ数值相等9.为判断某气体能否液化,需考察在该条件下的( a )(A) μJ-T> 0 (B) μJ-T< 0 (C) μJ-T = 0 (D) 不必考虑μJ-T的数值10.某气体的状态方程为PV=RT+bP(b>0),1mol该气体经等温等压压缩后其内能变化为(d )(A) ΔU>0 (B) ΔU <0 (C) ΔU =0 (D) 该过程本身不能实现11.均相纯物质在相同温度下C V > C P的情况是( b )(A) (∂P/∂T)V<0 (B) (∂V/∂T)P<0(C) (∂P/∂V)T<0 (D) 不可能出现C V>C P12.理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的压力,则其终态的温度,体积和体系的焓变必定是( b )(A) T可逆> T不可逆, V可逆> V不可逆, ΔH可逆>ΔH不可逆(B) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆<ΔH不可逆(C) T可逆< T不可逆, V可逆> V不可逆, ΔH可逆<ΔH不可逆(D) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆>ΔH不可逆13.1mol、373K、1atm下的水经下列两个不同过程达到373K、1atm下的水汽:(1)等温可逆蒸发,(2)真空蒸发。
4热力学 习题及答案

一、9选择题(共21分,每题3分)1、1.1mol理想气体从p-V图上初态a分别经历如图所示的(1)或(2)过程到达末态b.已知Ta<Tb,则这两过程中气体吸收的热量Q1和Q2的关系是[A](A)Q1>Q2>0;(B) Q2>Q1>0;(C) Q2<Q1<0;(D)Q1<Q2<0;(E)Q1=Q2>0.2、图(a),(b),(c)各表示连接在一起的两个循环过程,其中(c)图是两个半径相等的圆构成的两个循环过程, 图(a)和(b)则为半径不相等的两个圆.那么:[ C ](A)图(a)总净功为负,图(b)总净功为正,图(c)总净功为零;(B)图(a)总净功为负,图(b)总净功为负,图(c)总净功为正;(C) 图(a)总净功为负,图(b)总净功为负,图(c)总净功为零;(D) 图(a)总净功为正,图(b)总净功为正,图(c)总净功为负.3、如果卡诺热机的循环曲线所包围的面积从图中的abcda增大为ab’c’da,那么循环abcda与ab’c’da所做的净功和热机效率变化情况是:(A)净功增大,效率提高; [ D ](B)净功增大,效率降低;(C)净功和效率都不变;(D) 净功增大,效率不变.4、一定量的理想气体分别由图中初态a 经①过程a b和由初态a ’ 经②过程初态a ’cb 到达相同的终态b , 如图所示,则两个过程中气体从外界吸收的热量Q 1,Q 2的关系为 [ B ](A ) Q1<0,Q 1>Q 2 ; (B ) Q 1>0, Q 1>Q 2 ;(C) Q 1<0,Q 1<Q 2 ; (D) Q 1>0, Q 1<Q2 .5、根据热力学第二定律可知: [ D ](A) 功可以全部转换为热,但热不能全部转换为功;(B) 热可以从高温物体传到低温物体,但不能从低温物体传到高温物体; (C) 不可逆过程就是不能向相反方向进行的过程; (D) 一切自发过程都是不可逆的.6、对于理想气体来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外做的功三者均为负值? [ D ](A) 等容降压过程; (B ) 等温膨胀过程; (C) 绝热膨胀过程; (D) 等压压缩过程.7、在下列各种说法中,哪些是正确的? [ B ] (1) 热平衡过程就是无摩擦的、平衡力作用的过程. (2) 热平衡过程一定是可逆过程.(3) 热平衡过程是无限多个连续变化的平衡态的连接.(4) 热平衡过程在p-V图上可用一连续曲线表示. (A) (1),(2); (B) (3),(4); (C ) (2),(3),(4); (D) (1),(2),(3),(4). 8、对于室温下的双原子分子理想气体,在等压膨胀的情况下,系统对外所做的功与从外界吸收的热量之比A/Q 等于: [ D ] (A) 1/3; (B) 1/4; (C) 2/5; (D ) 2/7. 9、在温度分别为 327℃和27℃的高温热源和低温热源之间工作的热机,理论上的最大效率为 [ B ] (A) 25% (B) 50%(C) 75% (D) 91.74% 10、一定量的理想气体,从p -V 图上初态a 经历(1)或(2)过程到达末态b ,已知a 、b 两态处于同一条绝热线上(图中虚线是绝热线),则气体在 [ B ] (A) (1)过程中吸热,(2) 过程中放热. (B) (1)过程中放热,(2) 过程中吸热.(C) 两种过程中都吸热. (D) 两种过程中都放热.二、填空题p V1、有1m ol 刚性双原子分子理想气体,在等压膨胀过程中对外做功A,则其温度变化ΔT=___ A/R ___;从外界吸收的热量Q p =__7A/2 ___.2、一个作可逆卡诺循环的热机,其效率为η,它的逆过程的致冷机致冷系数w = T2/(T1-T2),则η与w 的关系为_____11W η=-_____.3.一热机由温度为727℃的高温热源吸热,向温度为527℃的低温热源放热.若热机在最大效率下工作,且每一循环吸热2000J,则此热机每一循环做功__400________J.4.热力学第二定律的克劳修斯叙述是_热量不能自动地从低温物体传向高温物体开尔文叙述是_不可能把从单一热源吸收的热量在循环过程中全部转变为有用的功,而不引起任何其他物体为生变化_________________________.5、下面给出理想气体状态方程的几种微分形式,指出它们各表示什么过程. (1)p dV=(m /M)R dT 表示___等压_________过程; (2)Vdp=(m/M)RdT 表示_____等体_________过程; (3)pdV+Vdp=0表示_______等温_______过程.6、如图,温度为T 0,2T 0,3T 0三条等温线与两条绝热线围成三个卡诺循环:(1)abcd a;(2)dc ef d;(3)abefa,则其效率分别为:η1=___33.3%___;η2=___50% ___;η3=____ 66.7%___.7. 理想气体在如图所示a-b-c 过程中,系统的内能增量E ∆=___0__ 8.已知一定量的理想气体经历p-T 图上所示的循环过程,图中过程1-2中,气体___吸热__(填吸热或放热)。
热力学基础-练习题及参考答案

热力学基础练习1一、选择题1. 在下列各种说法:(1) 准静态过程就是无摩擦力作用的过程;(2) 准静态过程一定是可逆过程;(3) 准静态过程是无限多个连续变化的平衡态的连接;(4) 准静态过程在p-V图上可用一连续曲线表示。
中,正确的是( )A. (1)、(2);B. (3)、(4);C. (2)、(3)、(4);D. (1)、(2)、(3)、(4)。
2. 气体在状态变化过程中,可以保持体积不变或保持压强不变,这两种过程( )A. 一定都是准静态过程;B. 不一定是准静态过程;C. 前者是准静态过程,后者不是准静态过程;D. 后者是准静态过程,前者不是准静态过程。
3. 质量一定的理想气体,从相同状态出发,分别经历等温过程、等压过程和绝热过程,使其体积增加一倍.那么气体温度的改变(绝对值)在( )A. 绝热过程中最大,等压过程中最小;B. 绝热过程中最大,等温过程中最小;C. 等压过程中最大,绝热过程中最小;D. 等压过程中最大,等温过程中最小。
4. 如图所示,一定量的理想气体,沿着图中直线从状态a( 压强p1=4atm,体积V1=2L)变到状态b( 压强p2=2atm,体积V2=4L).则在此过程中( )A. 气体对外作正功,向外界放出热量;B. 气体对外作正功,从外界吸热;C. 气体对外作负功,向外界放出热量;D. 气体对外作正功,内能减少。
二、填空题1. 不规则地搅拌盛于绝热容器中的液体,液体温度在升高,若将液体看作系统,则:(1) 外界传给系统的热量零;(2) 外界对系统作的功________零;(3) 系统的内能的增量_________零(填大于、等于、小于)。
2. 某理想气体等温压缩到给定体积时外界对气体作功|W1|,又经绝热膨胀返回原来体积时气体对外作功|W2|,则整个过程中气体(1) 从外界吸收的热量Q=________________;(2) 内能增加了∆E=______________________。
第一章化学热力学习题参考答案
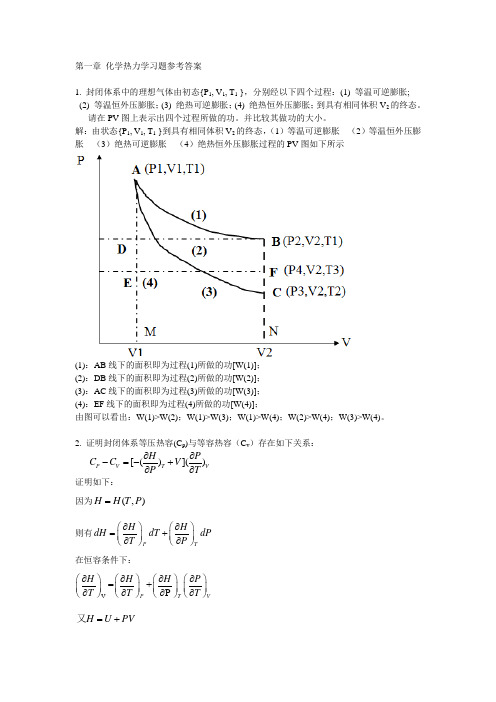
第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀; (2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)]; (2):DB 线下的面积即为过程(2)所做的功[W(2)]; (3):AC 线下的面积即为过程(3)所做的功[W(3)]; (4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭=V P VT VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫--⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P PP T P C V S dT dP T T∂∆=+-∂⎰⎰解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T HCpdT dp p∂=+∂ dH TdS Vdp =+又()()T T H ST V p p∂∂=+∂∂则 (2) ()()T P S Vp T∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P VdH C dT T V dp T∂=+-+∂ 积分得:2211[()]T P P P T P VH C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S SdS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S VdS dT dP T T∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S HT T T T∂∂==∂∂将(6)式代入(5)式得:[()](7)P P C VdS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C VS dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下:Q 2卡诺循环经如下过程(理想气体) 1、等温可逆膨胀22U 0T Q W ∆=+=,2222121lnV T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V WPdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313lnV T V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=- 220,,Q Q U W =∆=,214213411Q V V nRT V WPdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则12144323,V V V VV V V V ==则有即或:根据绝热可逆过程方程PV γ=常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221lnln =ln V VnRT nRT V V Q Q W VQ Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
热力学习题与解答

习题提示与答案第一章基本概念及定义1-1试确定表压力为0.1 kPa 时U 形管压力计中的液柱高度差。
(1)液体为水,其密度为1 000 kg/m 3;(2)液体为酒精,其密度为789 kg/m 3。
提示:表压力数值等于U 形管压力计显示的液柱高度的底截面处液体单位面积上的力,g h p ρ∆=e 。
答案:(1)mm 10.19=∆水h (2)mm 12.92=∆酒精h 。
1-2测量锅炉烟道中真空度时常用斜管压力计。
如图1-17所示,若α=30°,液柱长度l =200 mm ,且压力计中所用液体为煤油,其密度为800 kg/m 3,试求烟道中烟气的真空度为多少mmH 2O(4 ℃)。
提示:参照习题1-1的提示。
真空度正比于液柱的“高度”。
答案:()C 4O mmH 802v =p 。
1-3在某高山实验室中,温度为20 ℃,重力加速度为976 cm/s 2,设某U 形管压力计中汞柱高度差为30 cm ,试求实际压差为多少mmHg(0 ℃)。
提示:描述压差的“汞柱高度”是规定状态温度t =0℃及重力加速度g =980.665cm/s 2下的汞柱高度。
答案:Δp =297.5mmHg(0℃)。
1-4某水塔高30 m ,该高度处大气压力为0.098 6 MPa ,若水的密度为1 000 kg/m 3,求地面上水管中水的压力为多少MPa 。
提示:地面处水管中水的压力为水塔上部大气压力和水塔中水的压力之和。
答案:Mpa 8 0.392=p 。
1-5设地面附近空气的温度均相同,且空气为理想气体,试求空气压力随离地高度变化的关系。
又若地面大气压力为0.1 MPa ,温度为20 ℃,求30 m 高处大气压力为多少MPa 。
提示:h g p p ρ-=0→T R h g p p g d d -=,0p 为地面压力。
答案:MPa 65099.0=p 。
1-6某烟囱高30 m ,其中烟气的平均密度为0.735 kg/m 3。
热力学计算题(50题)

热力学计算题(50题)本文包含了50个热力学计算题的答案,分别为:1. 在1 atm下,如果1 L液态H2O沸腾,则液态H2O的温度是多少?答案:100℃2. 在标准状况下,1摩尔理想气体的体积是多少?答案:22.4 L3. 1升液态水的密度是多少?答案:1千克/升4. 一摩尔甲烷气体在标准状况下的热力学能是多少?答案: -74.8 kJ / mol5. 1升的理想气体在标准大气压下的焓(molar enthalpy)是多少?答案: -295 kJ / mol6. 一升20℃的空气有多少质量?答案:1.2 g7. 一升空气,温度为25℃,压力为1 atm,含有多少氧气分子?答案:其中氧气分子数量为 1.2 × 10^228. 一升CO2气体的温度为298K时,压力是多少?答案: 37.96 atm9. 如果一个物体的热容为25 J/℃,它受热 80℃,所吸收的热量是多少?答案:2000 J10. 摩尔热容是15 J/mol·K的氧气气体在1 atm下被加热10 K 会发生多少变化?答案:1.5 J11. 一个物体被加热10 J,它受热前的温度是20℃,它后来的温度是多少℃?答案:受热后的温度为 73.53℃12. 对于固体氧气(O2),如果将它从25℃加热到50℃,需要消耗多少热量?答案:340 J/mol13. 一升液态水被加热 100℃,需要吸收多少热量?答案:4184 J14. 一克液态水被加热 1℃,需要吸收多少热量?答案:4.18 J15. 对于CO2气体(1 mol),在1 atm和273 K下,它的物态方程是什么?答案:pV = (1 mol)(8.21 J/mol·K)(273 K)16. 用50 J的热量加热1升冷却水可能使它的温度升高多少℃?答案:温度可能升高 10℃17. 如果把长度为10 cm、质量为20 g的铝棒从25℃加热到175℃,需要多少热量?答案:252 J18. 对于一个摩尔二氧化碳气体,如果把压力从1 atm减小到0.75 atm,需要释放多少热量?答案:-495 J19. 对于1摩尔理想气体,如果把温度从200 K增加到1000 K,并保持其体积不变,则需要吸收多少热量?答案:23.32 kJ20. 一个系统吸收 250 J 的热量,释放50 J的热量,系统的内能的变化是多少?答案:200 J21. 对于一个物体,如果它从25℃升高到50℃,则它的热动能将变为原来的几倍?答案:1.5倍22. 一瓶500 g的汽水在室温下是10℃,如果将汽水加热到37℃,需要吸收多少热量?答案:目标温度需要吸收 8725 J 的热量23. 在25℃下,一块金属的热容容值是25 J/K,其体积是1 cm^3,密度为6.5 g/cm^3,求其热导率。
热力学复习题(带答案)

第一章 绪论一、选择题1.对于同一物系, 内能是体系状态的单值函数概念的错误理解是(D)A. 体系处于一定的状态,具有一定的内能B. 对应于某一状态,内能只能有一数值,不能有两个以上的数值C. 状态发生变化,内能也一定跟着变化D. 对应于一个内能值,可以有多个状态2. 真实气体在什么条件下,其行为与理想气体相近? (D)A 高温高压B 低温低压C 低温高压D 高温低压3. 对封闭体系而言,当过程的始态和终态确定后,下列哪项的值不能确定: (A) A. Q B. Q + W, △U C. W (Q=0), △U D. Q (W=0), △U 二、名词解释1.独立变量与从属变量2. 化工热力学的三要素3.均相封闭系统4.热力学性质三、简答题1.自变量与独立变量、函数与从属变量有何区别?2.为什么当非均相封闭系统中各相达到平衡状态时,每个相都可以视为均相封闭系统?第2章 P-V-T关系和状态方程 一、选择题1. T 温度下的过冷纯液体的压力P(A)A.>B.<C.=D.≤2. T 温度下的过热纯蒸汽的压力P (B)A.>B.<C.=D.=0 3. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到 (A ) A. 第三virial 系数 B. 第二virial 系数 C. 无穷项 D. 只需要理想气体方程 4.当时,纯气体的值为 (D )A. 0B. 很高的T 时为0C. 与第三virial 系数有关D. 在Boyle 温度时为零5. 指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为(C ) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽 D. 湿蒸汽6. 纯物质的第二virial 系数B (A ) A . 仅是T 的函数 B. 是T 和P 的函数 C . 是T 和V 的函数D. 是任何两强度性质的函数7. 能表达流体在临界点的P-V 等温线的正确趋势的virial 方程,必须至少用到(A ) A. 第三virial 系数 B. 第二virial 系数C. 无穷项D. 只需要理想气体方程8. 对于纯物质,一定温度下的泡点压力与露点压力是(A )A . 相同的 B. 不同的 C.泡点压力高于露点压力D. 泡点压力低于露点压力9. 对于纯物质,一定温度下泡点与露点,在P -T 图上是(A )A. 重叠的B. 分开的C. 交叉的D. 平行的 10. 泡点的轨迹称为(A )A.饱和液相线B. 饱和汽相线()[]P T V P RT,-0→P ()T P s()T P s()T P s ()T P s ()T P s()T P s ()T P s ()T P sC. 超临界曲线D. 升华曲线 11. 露点的轨迹称为(B )A.饱和液相线B. 饱和汽相线C. 汽液平衡线D. 三相线12. 对于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii j i k a a y y a 中的相互作用参数kij ,i =j 时,其值(A ) A.为0 B. 为1 C. >1 D. 从实验数据拟合得到,在没有实验数据时,近似作零处理13. 对于混合物,PR 方程常数a 的表达式∑∑==-=3131)1(i j ij jj ii j i k a a y y a 中的相互作用参数kij ,i≠j 时,其值(C ) A 为1 B. 为0 C. 从实验数据拟合得到,在没有实验数据时,近似作零处理D.从实验数据拟合得到,在没有实验数据时,近似作1处理14. 计算纯物质的R-K 方程中的参数a,b,是下列哪个因素的函数。
(完整版)大学物理热学习题附答案

一、选择题1.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值 (A) m kT x 32=v (B) m kT x 3312=v (C) m kT x /32=v (D) m kT x /2=v2.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体分子模型和统计假设,分子速度在x 方向的分量的平均值 (A) m kT π8=x v (B) m kT π831=x v (C) m kT π38=x v (D) =x v 03.温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系:(A) ε和w都相等 (B) ε相等,w 不相等 (C) w 相等,ε不相等 (D) ε和w 都不相等4.在标准状态下,若氧气(视为刚性双原子分子的理想气体)和氦气的体积比V 1 / V 2=1 / 2 ,则其内能之比E 1 / E 2为:(A) 3 / 10 (B) 1 / 2 (C) 5 / 6 (D) 5 / 35.水蒸气分解成同温度的氢气和氧气,内能增加了百分之几(不计振动自由度和化学能)?(A) 66.7% (B) 50% (C) 25% (D) 06.两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数n ,单位体积内的气体分子的总平动动能(E K /V ),单位体积内的气体质量ρ,分别有如下关系:(A) n 不同,(E K /V )不同,ρ不同 (B) n 不同,(E K /V )不同,ρ相同(C) n 相同,(E K /V )相同,ρ不同 (D) n 相同,(E K /V )相同,ρ相同7.一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A) 温度相同、压强相同 (B) 温度、压强都不相同(C) 温度相同,但氦气的压强大于氮气的压强(D) 温度相同,但氦气的压强小于氮气的压强8.关于温度的意义,有下列几种说法:(1) 气体的温度是分子平均平动动能的量度;(2) 气体的温度是大量气体分子热运动的集体表现,具有统计意义;(3) 温度的高低反映物质内部分子运动剧烈程度的不同;(4) 从微观上看,气体的温度表示每个气体分子的冷热程度。
高中热力学试题及答案

高中热力学试题及答案一、选择题(每题3分,共30分)1. 热力学第一定律的数学表达式是:A. ΔU = Q - WB. ΔH = Q + WC. ΔG = Q - WD. ΔS = Q/T答案:A2. 在绝热过程中,系统与外界没有热交换,以下说法正确的是:A. 系统内能增加B. 系统内能减少C. 系统内能不变D. 无法确定系统内能变化答案:D3. 根据热力学第二定律,以下说法正确的是:A. 热量可以从低温物体自发地传递到高温物体B. 热量不能自发地从低温物体传递到高温物体C. 所有自然过程都是可逆的D. 所有自然过程都是不可逆的答案:B4. 熵是热力学中描述系统无序程度的物理量,以下说法正确的是:A. 熵总是增加的B. 熵总是减少的C. 熵可以增加也可以减少D. 熵在孤立系统中总是增加的答案:D5. 理想气体状态方程是:A. PV = nRTB. PV = nTC. PV = mRTD. PV = RT答案:A6. 根据热力学第三定律,绝对零度是:A. 温度的极限B. 熵的极限C. 能量的极限D. 压力的极限答案:B7. 卡诺循环效率的数学表达式是:A. 1 - Tc/ThB. 1 - Tc/TaC. 1 - Tc/TbD. 1 - Ta/Th答案:A8. 以下哪种过程是不可逆的:A. 理想气体的等温膨胀B. 理想气体的绝热膨胀C. 理想气体的等压膨胀D. 理想气体的等熵膨胀答案:B9. 热力学温标的单位是:A. 摄氏度B. 开尔文C. 华氏度D. 兰氏度答案:B10. 以下哪种物质在标准状态下不是理想气体:A. 氦气B. 氢气C. 氧气D. 水蒸气答案:D二、填空题(每题2分,共20分)1. 热力学第一定律表明能量______,即能量守恒。
答案:守恒2. 热力学第二定律指出,不可能从单一热源取热使之完全转换为功而不产生其他影响。
答案:不可能3. 熵变ΔS等于系统吸收的热量Q除以绝对温度T,即ΔS = ______。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
材料热力学习题1、阐述焓H 、内能U 、自由能F 以及吉布斯自由能G 之间的关系,并推导麦克斯韦方程之一:T P PST V )()(∂∂-=∂∂。
答: H=U+PV F=U-TS G=H-TS U=Q+W dU=δQ+δWdS=δQ/T, δW=-PdV dU=TdS-PdVdH=dU+PdV+VdP=TdS+VdP dG=VdP-SdTdG 是全微分,因此有:TP P TP ST V ,PT G T P G ,T V P G T P T G P ST G P T P G )()()()()()(2222∂∂-=∂∂∂∂∂=∂∂∂∂∂=∂∂∂∂=∂∂∂∂∂-=∂∂∂∂=∂∂∂因此有又而2、论述: 试绘出由吉布斯自由能—成分曲线建立匀晶相图的过程示意图,并加以说明。
(假设两固相具有相同的晶体结构)。
由吉布斯自由能曲线建立匀晶相图如上所示,在高温T 1时,对于所有成分,液相的自由能都是最低;在温度T 2时,α和L 两相的自由能曲线有公切线,切点成分为x1和x2,由温度T 2线和两个切点成分在相图上可以确定一个液相线点和一个固相线点。
根据不同温度下自由能成分曲线,可以确定多个液相线点和固相线点,这些点连接起来就成为了液相线和固相线。
在低温T 3,固相α的自由能总是比液相L 的低,因此意味着此时相图上进入了固相区间。
HPV UGTSTS FPV3、论述:通过吉布斯自由能成分曲线阐述脱溶分解中由母相析出第二相的过程。
第二相析出:从过饱和固溶体α中(x0)析出另一种结构的β相(xβ),母相的浓度变为xα. 即:α→β+ α1α→β+ α1 的相变驱动力ΔGm的计算为ΔGm=Gm(D)-Gm(C),即图b中的CD段。
图b中EF是指在母相中出现较大为xβ的成分起伏时,由母相α析出第二相的驱动力。
4、根据Boltzman方程S=kLnW,计算高熵合金FeCoNiCuCrAl和FeCoNiCuCrAlTi0.1(即FeCoNiCuCrAl各为1mol,Ti为0.1mol)的摩尔组态熵。
(利用Sterling近似方程Ln(N!)=NLnN-N,已知玻尔兹曼常数k=1.38×10-23J/K,阿佛加德罗常数N=6.02×10-23/mol,气体状态方程常数R=8.31J/(mol·K))。
答:对于FeCoNiCuCrAl,该合金为6组元的等摩尔合金,N=6n,其中N为合金的总原子个数,n为每组元的原子个数。
合金的组态熵为:ΔS=S-KLn(1)=S所以,FeCoNiCuCrAl的摩尔组态熵为14.89.对于FeCoNiCuCrAlTi0.1合金,N=6.1n,ΔS=S-KLn(1)=S所以,FeCoNiCuCrAl的摩尔组态熵为.5、以二元系的吉布斯自由能-成分曲线证明:组成中间化合物时,组元间的亲和力越大,与化合物相邻的端际固溶体的溶解度越小。
(20分)当组成化合物时组元间的亲和力越大,化合物越稳定,其自由能值越低。
如右图所示,化合物β与端际固溶体α和γ分别形成平衡。
当化合物β相的自由能曲线越下垂时,与它形成平衡相的α和γ相自由能曲线公切线的斜率越大,使α和γ相区越窄,即溶解度越小。
以β1和β2为例,组元A和B间的亲和力越大,中间化合物β2的自由能值更低,β与α相的自由能曲线的公切线上与α相的切点分别为x1和x2,明显,x2小于x1,即对第2种情况,溶质原子B在α相中的溶解度更小。
6、阐述一级相变和二级相变的区别。
(10分)一级相变时两相的化学势相等,但化学势的一级偏微商不相等。
一级相变时熵和体积有不连续的变化,相变时有相变潜热,并且体积改变。
二级相变时两相的化学势相等,化学势的一级偏微商也相等,但化学势的二级偏微商不相等。
二级相变时无相变潜热,且体积不连续改变。
7、如果bcc和fcc结构的纯铁α、γ和液态纯铁L的定压热容可以分别表示成下列形式C p(α)=37.142+6.17*10-3T J/(mol·K)(298~1809K)C p(γ)=20.93+8.456*10-3T J/(mol·K)(1187~1674K)C p(L)=41.86 J/(mol·K)(T m~1873K)α/γ和α/L相变焓和相变温度分别为837J/mol、1391℃和13772J/mol、1536℃,试求α/γ和α/L相变自由能与温度之间的关系式。
8、什么是上坡扩散?利用在自由能-成分曲线(Gm-X)图中化学势的图解法,解释为什么有的固溶体中会发生上坡扩散。
(20分)上坡扩散是指一种溶质原子从浓度低的地方向浓度高的地方进行扩散的方式。
固溶体中原子定向迁移的驱动力是化学势梯度,而不是浓度梯度。
如右图所示,当自由能-成分Gm-X出现拐点时,如成分1x B和2x B,尽管成分2中的溶质原子B浓度高于成分1,但由自由能-成分曲线截距法确定的化学势可知,2处的化学势μB2低于1处的化学势μB1,因而,溶质原子将从1处向2处扩散,即从浓度低的地方向浓度高的地方扩散。
9、已知锡在505K (熔点)时的熔化热为7070.96J/mol ,并有1个大气压下的热容量C p(l)为C p(l)=34.69-9.20*10-3T J/(mol·K),固体锡的热容量C p(s)为C p(s)=18.49+26.36*10-3T J/(mol·K),计算锡在绝热器内过冷到485K 时能自动凝固的分数。
(20分)10、铅与环境组成隔离体系,铅的熔点为600K ,凝固热为4811.6J/mol ,并有1个大气压下的热容量C p(l)=32.43-3.10*10-3T J/(mol·K),固体铅的热容量C p(s)=23.56+9.75*10-3T J/(mol·K),求在一个大气压下1)在600K 凝固时铅熵值的变化,2)在600K 凝固时隔离体系熵值的变化,3)液体铅过冷到590K 凝固时熵值的变化,4)过冷到590K 凝固时隔离体系熵值的变化。
(20分)11、已知液体锌的热容量C p(l)为C p(l)=29.66+4.81*10-3T J/(mol·K),固体锌的C p(s)为C p(s)=22.13+11.05*10-3T J/(mol·K),锌的熔点为692.6K ,熔化热=∆H 6589.8J/mol ,求固、液两相的吉布斯自由能差值)(T G ∆与温度的关系。
(20分)12、已知液体锌的热容量C p(l)为C p(l)=29.66+4.81*10-3T J/(mol·K),固体锌的C p(s)为C p(s)=22.13+11.05*10-3T J/(mol·K),锌的熔点为692.6K ,熔化热=∆H 6589.8J/mol ,计算液体锌在绝热器内过冷到680K 时能自动凝固的分数。
13、设在金属晶体中形成一个空位所需的能量(即空位形成能)为E f ,求含N 个原子的金属晶体在一定温度T 时的平衡空位数目。
(20分)14、什么是Spinodal 分解,结合自由能-成分曲线阐述二元系发生Spinodal 分解的热力学条件。
(20分)15、假设正规溶体的化学势近似表示为ij i i i i I X RTLnX G 20)1(-++=μ,纯Fe 的α γ相变在1150℃时的相变自由能为mol J /02.67-,Fe 与V 构成的奥氏体(γ)与铁素体(α)固溶体相都可以看成是正规稀溶体,试求Fe-V 合金在1150℃下奥氏体与铁素体中V 的平衡成分差。
))1ln(,0(x x x -≈-→取时i 12f V2 10 80 3VP T 1=25℃T 2=100℃16、计算题:1摩尔的O 2,从25℃,体积10升,膨胀到100℃、体积80升,计算下列三种过程的Q 、W 、ΔU 和Δ S 。
(O 2的C p 0=29.4J ·mol -1·deg -1) 1)i1f: 恒容+恒温 2)i2f: 恒压+恒温 3)i3f: 恒温+恒容17、论述:为了净化汽车尾气, 甲研制下述反应(1)的催化剂, 而乙研制下述反应(2)的催化剂: (1) CO (g) = C (石墨) + 1/2O 2(g) ,(2) CO (g)+NO (g)= CO 2(g)+1/2N 2(g) . 通过计算, 从热力学角度评价他们的努力。
已知:298K 时CO (g) NO (g) CO 2(g) C (石墨) O 2(g) N 2(g) Δf H θ /kJ×mol -1 -110.5 90.4 -393.5 S θ/J×mol -1×K -1 197.6210.0213.65.73205.0319218、计算题:1摩尔理想气体,在300K 下,自10个大气压膨胀到1个大气压,计算下列不同途径的膨胀功W 、热效应Q 和内能的变化ΔU 。
1)可逆过程2)向真空自由膨胀过程3)恒压过程,即外压始终是一个大气压4)两步恒压过程,即外压先恒为5个大气压,待膨胀停止时,外压再恒为1个大气压。
19、论述:试绘出由吉布斯自由能—成分曲线建立右图示匀晶相图的过程示意图,分5个温度点,并加以说明。
20、碳在1个大气压下、25℃时以石墨为稳定相。
试从热力学角度计算在25℃时由石墨转变为金刚石所需的压强。
已知:在25时,石墨的密度为2.22g/cm 3,金刚石的密度为3.515 g/cm 3,碳的相对原子量为12。
,,,,在T K 相变时,(,忽略两相的等温压缩性。
(20分)21、从自由能-成分出发,解释为什么有时候会先形成亚稳相。
决定优先形成相的是形核驱动力,如右图所示,尽管稳定相β的自由能更低,但是当成分起伏较大时,局部形成亚稳γ相的形核驱动力更大,因此,优先形成亚稳相γ。
T 1T 2T 3T 4T 5A BLβL+βxT。
