十章氨基酸代谢
氨基酸的代谢
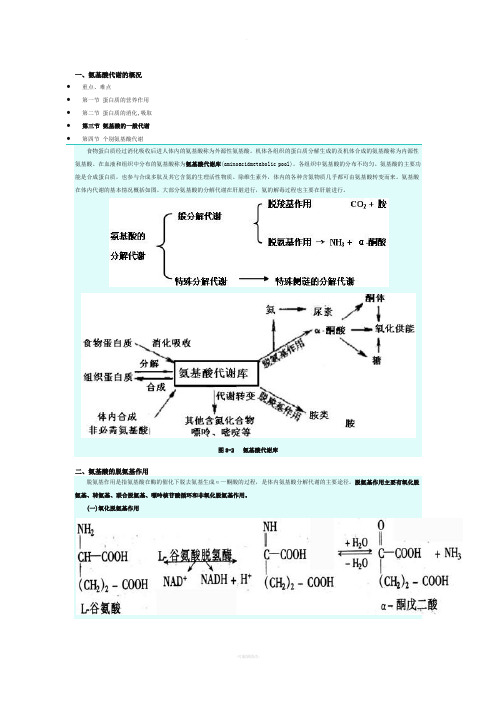
一、氨基酸代谢的概况∙重点、难点∙第一节蛋白质的营养作用∙第二节蛋白质的消化,吸取∙第三节氨基酸的一般代谢∙第四节个别氨基酸代谢食物蛋白质经过消化吸收后进人体内的氨基酸称为外源性氨基酸。
机体各组织的蛋白质分解生成的及机体合成的氨基酸称为内源性氨基酸。
在血液和组织中分布的氨基酸称为氨基酸代谢库(aminoacidmetabolic pool)。
各组织中氨基酸的分布不均匀。
氨基酸的主要功能是合成蛋白质,也参与合成多肽及其它含氮的生理活性物质。
除维生素外,体内的各种含氮物质几乎都可由氨基酸转变而来。
氨基酸在体内代谢的基本情况概括如图。
大部分氨基酸的分解代谢在肝脏进行,氨的解毒过程也主要在肝脏进行。
图8-2 氨基酸代谢库二、氨基酸的脱氨基作用脱氨基作用是指氨基酸在酶的催化下脱去氨基生成α—酮酸的过程,是体内氨基酸分解代谢的主要途径。
脱氨基作用主要有氧化脱氨基、转氨基、联合脱氨基、嘌呤核苷酸循环和非氧化脱氨基作用。
(一)氧化脱氨基作用氧化脱氨基作用是指在酶的催化下氨基酸在氧化的同时脱去氨基的过程。
组织中有几种催化氨基酸氧化脱氨的酶,其中以L-谷氨酸脱氢酶最重要。
L-氨基酸氧化酶与D-氨基酸氧化酶虽能催化氨基酸氧化脱氨,但对人体内氨基酸脱氨的意义不大。
1.L-谷氨酸氧化脱氨基作用由 L谷氨酸脱氢酶(L-glutamatedehydrogenase)催化谷氨酸氧化脱氨。
谷氨酸脱氢使辅酶NAD+还原为NADH+H+并生成α-酮戊二酸和氨。
谷氨酸脱氢酶的辅酶为NAD+。
谷氨酸脱氢酶广泛分布于肝、肾、脑等多种细胞中。
此酶活性高、特异性强,是一种不需氧的脱氢酶。
谷氨酸脱氢酶催化的反应是可逆的。
其逆反应为α-酮戊二酸的还原氨基化,在体内营养非必需氨基酸合成过程中起着十分重要的作用。
(二)转氨基作用转氨基作用:在转氨酶(transaminase ansaminase)的催化下,某一氨基酸的a-氨基转移到另一种a-酮酸的酮基上,生成相应的氨基酸;原来的氨基酸则转变成a-酮酸。
生物化学判断题

第一章蛋白质化学1、蛋白质的变性是其构象发生变化的结果。
T2、蛋白质构象的改变是由于分子共价键的断裂所致。
F3、组成蛋白质的20种氨基酸分子中都含有不对称的α-碳原子。
F4、蛋白质分子的亚基就是蛋白质的结构域。
F5、组成蛋白质的氨基酸都能与茚三酮生成紫色物质。
F6、Pro不能维持α-螺旋,凡有Pro的部位肽链都发生弯转。
T7、利用盐浓度的不同可提高或降低蛋白质的溶解度。
T8、蛋白质都有一、二、三、四级结构。
F9、在肽键平面中,只有与α-碳原子连接的单键能够自由旋转。
T10、处于等电点状态时,氨基酸的溶解度最小。
T11、蛋白质的四级结构可认为是亚基的聚合体。
T12、蛋白质中的肽键可以自由旋转。
F第二章核酸化学1、脱氧核糖核苷中的糖环3’位没有羟基。
F2、若双链DNA中的一条链碱基顺序为CTGGAC,则另一条链的碱基顺序为GACCTG。
F3、在相同条件下测定种属A和种属B的T m值,若种属A的DNA T m 值低于种属B,则种属A的DNA比种属B含有更多的A-T碱基对。
T4、原核生物和真核生物的染色体均为DNA与组蛋白的复合体。
F5、核酸的紫外吸收与溶液的pH值无关。
F6、mRNA是细胞内种类最多,含量最丰富的RNA。
F7、基因表达的最终产物都是蛋白质。
F8、核酸变性或降解时,出现减色效应。
F9、酮式与烯醇式两种互变异构体碱基在细胞中同时存在。
T10、毫无例外,从结构基因中的DNA序列可以推出相应的蛋白质序列。
F11、目前为止发现的修饰核苷酸大多存在于tRNA中。
T12、核糖体不仅存在于细胞质中,也存在于线粒体和叶绿体中。
T13、核酸变性过程导致对580nm波长的光吸收增加。
F14、核酸分子中的含氮碱基都是嘌呤和嘧啶的衍生物。
T15、组成核酸的基本单位叫做核苷酸残基。
T16、RNA和DNA都易于被碱水解。
F17、核小体是DNA与组蛋白的复合物。
T第三章糖类化学1、单糖是多羟基醛或多羟基酮类。
T2、蔗糖由葡萄糖和果糖组成,它们之间以α(1→6)键连接。
[王镜岩生物化学第三版笔记]第十章 氨基酸代谢
![[王镜岩生物化学第三版笔记]第十章 氨基酸代谢](https://img.taocdn.com/s3/m/433ff601b52acfc789ebc9ff.png)
第十章氨基酸代谢植物、微生物从环境中吸收氨、铵盐、亚硝酸盐、硝酸盐等无机氮,合成各种氨基酸、蛋白质、含氮化合物。
人和动物消化吸收动、植物蛋白质,得到氨基酸,合成蛋白质及含氮物质。
有些微生物能把空气中的N2转变成氨态氮,合成氨基酸。
第一节蛋白质消化、降解及氮平衡一、 蛋白质消化吸收哺乳动物的胃、小肠中含有胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、羧肽酶、氨肽酶、弹性蛋白酶。
经上述酶的作用,蛋白质水解成游离氨基酸,在小肠被吸收。
被吸收的氨基酸(与糖、脂一样)一般不能直接排出体外,需经历各种代谢途径。
肠粘膜细胞还可吸收二肽或三肽,吸收作用在小肠的近端较强,因此肽的吸收先于游离氨基酸。
二、 蛋白质的降解人及动物体内蛋白质处于不断降解和合成的动态平衡。
成人每天有总体蛋白的1%~2%被降解、更新。
不同蛋白的半寿期差异很大,人血浆蛋白质的t1/2约10天,肝脏的t1/2约1~8天,结缔组织蛋白的t1/2约180天,许多关键性的调节酶的t1/2均很短。
真核细胞中蛋白质的降解有两条途径:一条是不依赖A TP的途径,在溶酶体中进行,主要降解外源蛋白、膜蛋白及长寿命的细胞内蛋白。
另一条是依赖A TP和泛素的途径,在胞质中进行,主要降解异常蛋白和短寿命蛋白,此途径在不含溶酶体的红细胞中尤为重要。
泛素是一种8.5KD(76a.a.残基)的小分子蛋白质,普遍存在于真核细胞内。
一级结构高度保守,酵母与人只相差3个a.a残基,它能与被降解的蛋白质共价结合,使后者活化,然后被蛋白酶降解。
三、 氨基酸代谢库食物蛋白中,经消化而被吸收的氨基酸(外源性a.a)与体内组织蛋白降解产生的氨基酸(内源性a.a)混在一起,分布于体内各处,参与代谢,称为氨基酸代谢库。
氨基酸代谢库以游离a.a总量计算。
肌肉中a.a占代谢库的50%以上。
肝脏中a.a占代谢库的10%。
肾中a.a占代谢库的4%。
血浆中a.a占代谢库的1~6%。
肝、肾体积小,它们所含的a.a浓度很高,血浆a.a是体内各组织之间a.a转运的主要形式。
生物化学复习要点-氨基酸代谢

氨基酸代谢一、教学大纲基本要求蛋白质的消化、吸收,氨基酸代谢库,必需氨基酸,氮平衡,氨基酸代谢概论,氨基酸的脱氨基、转氨基、联合脱氨基作用;蛋白质降解,尿素循环,氨基酸合成代谢;氨基酸的脱羧基作用,氨基酸的碳链代谢,氨的排出、转运。
二、本章知识要点(一)氨基酸代谢概述蛋白质作为动物体的主要组成成分,总是在不断地进行着新陈代谢。
而蛋白质的基本组成单位是氨基酸,所以氨基酸代谢是蛋白质代谢的重要内容。
1.蛋白质的消化、吸收(1)蛋白质的消化动物的唾液中虽有少量唾液蛋白质酶能分解蛋白质,但在整个消化过程中,其作用不大。
蛋白质食物主要是在胃和小肠中进行消化的。
胃粘膜主细胞可分泌胃蛋白酶原,胰液能提供胰蛋白酶原、糜蛋白酶原、弹性蛋白酶原和羧基肽酶原,这些酶原激活后可转变成有活性的酶,在这些酶以及动物体所含的氨肽酶、羧肽酶和二肽酶等共同作用下,来完成日粮中蛋白质的消化过程。
(2)蛋白质的吸收在正常情况下,只有氨基酸及少量二肽、三肽能被动物体吸收进入血液。
这种吸收主要在小肠粘膜细胞上进行,肾小管细胞和肌肉细胞也能吸收,这是一个耗能、需氧的主动运输过程。
关于氨基酸吸收的机理,目前仍未完全解决。
A.Meister在1968-1969年,从肾脏研究中,提出关于氨基酸吸收的“γ-谷氨酰基循环”假说,具有一定理论意义。
他认为氨基酸吸收或向各组织、细胞内转移是通过谷胱甘肽起作用,这个过程由六步连续的酶促反应完成。
2.氨基酸的代谢库动物体吸收进入血液的氨基酸与体内游离的氨基酸构成了氨基酸代谢库。
在正常情况下,氨基酸代谢库中的氨基酸维持在一个动态平衡中。
一方面,氨基酸被消耗,或用来合成蛋白质,或合成其它含氮物质,或氧化分解提供能量;另一方面,可由体外吸收、体内合成或体内蛋白质分解所产生的氨基酸补充。
3.必需氨基酸必需AA是指机动物体内不能合成或合成量不足,必须由日粮提供的一类氨基酸,构成天然蛋白质的20种氨基酸中有10种氨基酸是多数动物的必需氨基酸:3种碱性AA(赖AA、精AA、组AA),3种支链AA(亮AA、异亮AA、缬AA),2种芳香AA(苯丙AA、色AA),1种含硫AA(甲硫AA),1种羟基AA(苏AA)。
生物化学氨基酸代谢

蛋白质的代谢
分解代谢——氨基酸的分解代谢
本章学习内容安排
1. 蛋白质的营养价值
2. 氨基酸的来源与去路
3. 氨基酸的体内分解代谢*
4.
(1)一般氨基酸的代谢**
(2)个别氨基酸的代谢
第十章 氨基酸代谢
第一节 蛋白质的营养
一、蛋白质的生理功能
• 营养非必需氨基酸(nonessential amino acid) 体内能够自行合成,不必由食物供给的氨基酸。
• 含必需氨基酸种类多、数量足的蛋白质营养价值 高。
衡量蛋白质营养价值的必需氨基酸
人体必需氨基酸有8种
赖氨酸 Lys 色氨酸 Trp 缬氨酸 Val 苯丙氨酸 Phe 苏氨酸 Thr 亮氨酸 Leu 异亮氨酸 Ile 甲硫氨酸 Met
需要消耗ATP。 2. -谷氨酰基循环:肠粘膜细胞膜上的-谷氨酰转移酶
分两阶段进行:GSH对氨基酸的转运、GSH的再生, 共消耗3×ATP/1×氨基酸 3. 某些抗原、毒素蛋白可以少量未经消化直接吸收,这是 导致过敏反应和食物中毒的原因。
三、蛋白质及其消化产物在肠中的腐败作用
肠道中未被吸收的食物蛋白质及其水解产物氨基 酸和/或小肽被肠道中的细菌消化利用,称为蛋白质的 腐败作用。
性的酶
2. 蛋白水解酶的催化活性具有特异性,对肽键的位置和形成
肽键的氨基酸残基有一定的选择。
3. 如:内肽酶、外肽酶选择肽键位置
4.
胃蛋白酶只能水解芳香族氨基酸的氨基和酸性氨
基酸
的羧基之间的肽键。
蛋白质的消化过程
眎
胰蛋白酶 碱性a.a 羧肽酶B
C端多肽
食物 食物蛋白酶
东北师范大学生物化学 第十章氨基酸代谢

必需氨基酸
(氨基酸和糖的转 变是不可逆的)
酮体
生酮兼生糖氨基酸
Tyr(酪),Phe(苯),Ile(异), Trp(色)
生酮氨基酸 Lys Leu 生糖氨基酸:
三 氨基酸合成代谢 非必需氨基酸(10) 必需氨基酸(8):
Phe 、Met 、 Thr、 Val、 Leu、 Lys、Trp、Ile
半必需氨基酸:His Arg
NAD+ + H2O + (NADP+)
+ NH4+ + NADH +H+ (NADPH)
在动物体内辅酶为NAD+,在植物体内辅酶为NADP+
非必需氨基酸由相应的α -酮酸氨基化生成
八种必需氨基酸中,除赖氨酸和苏氨酸外其余六种亦可由相 应的α-酮酸加氨生成。但和必需氨基酸相对应的α-酮酸不能 在体内合成,所以必需氨基酸依赖于食物供应。
一 蛋白质的酶促降解
(一)外源蛋白质的降解
(二)内源蛋白质的降解
(一)外源蛋白质的降解(细胞外途径)
1 蛋白质的消化
胃蛋白酶:水解芳香族氨基酸的羧基形成的肽键
胰蛋白酶:水解碱性氨基酸羧基形成的肽键
肽链内切酶
胰凝乳蛋白酶:水解芳香族氨基酸的羧基形成 的肽键
弹性蛋白酶:脂肪族氨基酸的羧基形成的肽键 氨肽酶
肝脏是合成尿素的主要器官,肾脏是排出尿素的主要器官
氨基甲酰磷酸合成酶
一种在线粒体中参与尿素的合成
一种在细胞质中参与嘧啶的从头合成
尿素合成的特点: 主要在肝脏的线粒体和胞液中进行 一分子尿素需消耗4个 高能磷酸键 精氨琥珀酸合成酶是尿素合成的关键酶 尿素分子中的两个氮原子,一个来源于NH3, 一个来源于天冬氨酸
氨基酸代谢A

6
二、氨基酸的吸收
主要在小肠进行,是一种主动转运 过程,需由特殊载体携带。转运氨 基酸进入细胞时,同时转运入Na+。
除此之外,也可经γ-谷氨酰循环进 行。需由γ-谷氨酰基转移酶催化, 利用谷胱甘肽(GSH),合成γ-谷 氨酰氨基酸进行转运。消耗的GSH可 重新再合成。
氨基酸的
分解代谢
脱羧基作用 → CO2 + 胺 一般分解代谢→
酮酸
脱氨基作用 → NH3 + α-
9
一、氨基酸的脱氨基作用
氨基酸主要通过三种方式脱氨基,即
氧化脱氨基,联合脱氨基和非氧化脱 氨基。
(一)氧化脱氨基:反应过程包括脱氢 和水解两步。
-2H
+H2O
R-CCOHC(OONHH2)+ CNOHO3H → R-C(=NH)COOH → R-
41
二、一碳单位的代谢
Metabolism of one carbon unit (一)一碳单位的定义和化学结构: 一碳单位(one carbon unit)是指只含一个
碳原子的有机基团,这些基团通常由其载 体携带参加代谢反应。 常见的一碳单位有甲基(-CH3)、亚甲基或 甲烯基(-CH2-)、次甲基或甲炔基(=CH) 、 甲 酰 基 ( -CHO ) 、 亚 氨 甲 基 ( CH=NH)、羟甲基(-CH2OH)等。
Leu 由于酪氨酸在体内需由苯丙氨酸
为原料来合成,半胱氨酸必需以 蛋氨酸为原料来合成,故这两种 氨基酸被称为半必需氨基酸。
4
第二节 蛋白质的消化、吸收
5
一、蛋白质的消化 (一)胃中的消化: 胃蛋白酶水解食物蛋白质为多肽、
氨基酸代谢的生物化学过程

氨基酸代谢的生物化学过程氨基酸代谢是生物体内一个重要的生物化学过程。
在人体中,氨基酸代谢主要发生在肝脏中,包括蛋白质的降解和新合成。
在这个过程中,一系列酶参与了氨基酸的转化,将其转化为能量或者供应新的蛋白质合成所需的氨基酸。
首先,氨基酸代谢的第一步是氨基基团的去除,这一过程称为脱氨作用。
脱氨酶是参与脱氨作用的关键酶,它能够催化氨基酸与α-酮酸反应,生成α-酮酸和氨气。
在这个过程中,氨基酸被转化为不同的代谢产物,例如α-酮酸、氨氨基酸和氨基酸。
这些代谢产物可以进一步参与能量代谢或者合成新的蛋白质。
其次,氨基酸的碳骨架可以被进一步代谢,主要通过三羧酸循环进行。
三羧酸循环是细胞内一个重要的代谢通路,能够将氨基酸的碳骨架转化为能量和有机物。
在这个过程中,氨基酸的碳骨架会被氧化分解,生成辅酶A和NADH等还原辅酶,并最终产生ATP。
此外,氨基酸代谢还涉及氨基酸的合成。
在蛋白质合成过程中,氨基酸可以被合成成新的蛋白质。
氨基酸的合成过程往往需要多种酶的参与,例如转氨酶、缬氨酸合成酶等。
这些酶能够催化氨基酸的合成反应,从而满足细胞对新蛋白质的需求。
总的来说,氨基酸代谢是一个复杂而严密的生物化学过程,通过一系列酶的协同作用,将蛋白质分解为氨基酸,进而参与能量代谢或者蛋白质合成。
这个过程的正常进行对维持生物体内稳态至关重要,任何环节的紊乱都可能导致疾病的发生。
因此,对氨基酸代谢过程的深
入研究不仅有助于我们更好地理解生物体内的代谢调控机制,也为相关疾病的防治提供了新的思路和方法。
【316字】。
第十章 蛋白质的酶促降解及氨基酸代谢

第十章蛋白质的酶促降解及氨基酸代谢一、名词解释1、氨基酸代谢库2、必需氨基酸、非必需氨基酸、半必需氨基酸3、氧化脱氨基作用4、转氨基作用5、联合脱氨基作用6、嘌呤核苷酸循环7、鸟氨酸循环8、生糖氨基酸、生酮氨基酸、生糖兼生酮氨基酸9、泛素10、S-腺苷甲硫氨酸11、一碳单位二、填空1、氨基酸代谢库中的内源氨基酸是由和组成。
2、多肽链经胰蛋白酶降解后,产生新肽段羧基端主要是和氨基酸残基。
3、胰凝乳蛋白酶专一性水解多肽链由氨基酸端形成的肽键。
4、氨基酸的最主要脱氨基方式是。
5、转氨酶和脱羧酶的辅酶通常是。
6、谷氨酸经脱氨后产生和氨,前者进入进一步代谢。
7、尿素循环中产生的和两种氨基酸不是蛋白质氨基酸。
8、尿素分子中两个N原子,分别来自和。
9、在人体中氨在中通过循环生成经排泄。
10、体内最重要的转氨酶有和。
11、肝细胞线粒体中的氨基甲酰磷酸合成酶Ⅰ的催化作用需要______﹑_____,______参与。
12、精氨酸在的催化下,生成尿素和。
13、氨基酸脱下氨的主要去路有、和。
14、不同氨基酸与之间通过作用生成谷氨酸,这是氨基酸分解代谢反应,催化这一反应的酶叫酶,其辅酶是。
15、嘌呤核苷酸循环将氨基酸的和结合,生成,随后裂解为和延胡索酸。
16、人体内合成尿素的直接前体是,它水解后生成尿素和,后者又与反应,生成,这一产物再与反应,最终合成尿素,这就是尿素循环,尿素循环的后半部是在中进行的。
17、嘌呤核苷酸循环最终将氨释放出的化合物称,催化此反应的酶是。
18、氨甲酰磷酸合成酶Ⅰ定位于细胞内的,它催化和合成氨甲酰磷酸。
19、人体内不能合成而需要从食物供应的氨基酸称为。
20、是除氨的主要器官,它可通过将NH3和CO2合成无毒的,而禽类则合成的是。
21、合成一分子尿素需消耗分子的高能键。
22、生酮氨基酸经代谢后可产生,它是合成酮体的原料。
23、提供一碳单位的氨基酸有、、和等。
常见的一碳单位有、、、、和等。
24、生物体中活性蛋氨酸是,它是活泼的供应者。
氨基酸代谢

胰酶及其作用 胰酶是消化蛋白质的主要酶,最适pH 为7.0左右,包括内肽酶和外肽酶。 内肽酶(endopeptidase) 水解蛋白质肽链内部的一些肽键,如胰蛋白 酶、糜蛋白酶、弹性蛋白酶。 外肽酶(exopeptidase) 自肽链的末段开始,每次水解一个氨基酸 残基,如羧基肽酶(A、B) 、氨基肽酶。
大多数氨基酸可参与转氨基作用,但 赖氨酸、脯氨 酸、羟脯氨酸除外。
3. 体内重要的转氨酶 ①丙氨酸氨基转移酶
(alanine aminotransferase, ALT或 glutamic pyruvic transaminase, GPT)
②天冬氨酸氨基转移酶
(aspartate aminotransferase, AST 或 glutamic oxalo-acetic transaminase, GOT)
蛋白质的泛素化过程
UB:泛素
E1:泛素激活酶
E2:泛素结合酶
E3:泛素蛋白连接酶
Pr:被降解蛋白质
蛋白酶体存在于细胞核和胞浆内,主要降解 异常蛋白质和短寿蛋白质。 2个α环:7个α亚基
20S的核心 26S蛋白 酶体 颗粒(CP)
2个β环:7个β亚基
19S的调节颗粒(RP) : 18个亚基, 6 个亚基具有ATP酶活性
Digestion, Absorption and Putrefaction of proteins
一、外源性蛋白质消化成氨基酸和 寡肽后被吸收
(一)在胃和肠道蛋白质被消化成氨基酸和寡肽
蛋白质消化的生理意义 由大分子转变为小分子,便于吸收。 消除种属特异性和抗原性,防止过敏、毒
性反应。
1、蛋白质在胃中被水解成多肽和氨基酸
氨基酸代谢

第一个反应是泛素C-末端的羧基与泛素活化 酶结合,消耗ATP,将泛素激活。
第二个反应泛素被转移到泛素结合酶的巯基 上;
第三个反应泛素蛋白连接酶识别待降解蛋白 质,并将活化的泛素转移到蛋白质赖氨酸 的侧链氨基上,侧链氨基可连接上下泛素, 形成泛素链。
O
ATP AMP+PPi
O
泛素 C O- + HS-E1
(二)丙酮酸和草酰乙酸通过转氨基作用生成 丙氨酸和天冬氨酸
丙酮酸
或草酰乙酸
谷氨酸
转氨酶
丙氨酸
或天冬氨酸
α - 酮戊二酸
(三)谷氨酰胺合成酶利用谷氨酸和游离氨 合成谷氨酰胺
• 其余12种氨基酸体内可以合成,称非必需氨基酸。 (nutritionally non-essential amino acid)
组氨酸和精氨酸虽能在人体内合成,但 合成量不多,长期缺乏也能造成负氮平衡, 可以将这两种氨基酸视为营养半必需氨基酸 (nutritionally semi-essential amino acid)。 酪氨酸在体内需由苯丙氨酸为原料来合成, 半胱氨酸必需以蛋氨酸为原料来合成.
是一个26S蛋白质复合物, 由20S的核心颗粒(core particle, CP)和 19S的调节颗粒(regulatory particle, RP)组成。
核心颗粒
蛋白酶体的核心颗粒是由4个环——2个α环和 2个β环组成的圆柱体。
每个α环由7个α类型的亚基组成,它们位于 圆柱体的顶端。
每个β环由7个β类型的亚基组成,它们位于 圆柱体的中央。
β-羟酪胺和苯乙醇胺结构类似儿茶酚胺,它 们可取代儿茶酚胺与脑细胞结合,但不能传递 神经冲动,使大脑发生异常抑制。
CH2NH2 CH2
第十章 氨基酸代谢

P217
此反应发生在线粒体中; 鸟氨酸转氨甲酰酶(ornithine transcarbamoylase)催 化该反应;
鸟氨酸产生于细胞溶胶,所以它必须通过一个特异的运 送体系进入线粒体;
尿素循环的以后几步都在细胞溶胶中进行,瓜氨酸必须 从线粒体中脱出。
(3)尿素第二个氮原子的获取
不同生物其合成蛋白质的能力不同,所摄取的氮源也不
同,但要合成蛋白质,必须先合成氨基酸;
蛋白质代谢的概念(阅读)2-2
蛋白质的代谢主要是讨论生物机体内氨基酸和蛋白质的
合成、分解和转变的化学过程,以及这些过程与生物机
体的生殖、发育和一切生理之间的关系;
微生物、植物与动物的蛋白质代谢途径有其相同的一面,
(1)尿素第一个氮原子的获取
P216
反应发生于细胞溶胶; NH4+在ATP、Mg2+存在下与HCO3-缩合: 形成氨甲酰磷酸;
氨甲酰磷酸合成酶(carbamoylphosphate synthetase, CPS) (该酶不属于尿素循环的一员)催化该反应;
反应伴随有两个ATP的水解。
(2)氨甲酰磷酸的氨甲酰基转移到鸟氨酸上形成瓜氨酸
在柠檬酸循环中形成的草酰乙酸(经转氨基反应形成天 冬氨酸)将两循环连接在一起;
鸟氨酸循环把两个氨基和一个碳原子(CO2)转化为非 毒性的排泄物尿素;
每生成1mol尿素消耗3molATP;
尿素是哺乳动物的蛋白质代谢的最终产物;
尿素循环中的能量变化
循环中使用了4个“高能”磷酸键(3个ATP水解为两个
合成的尿素进入血液,再被肾脏汇集,从尿中排除;
第十章 氨基酸及核苷酸的代谢

具有很强的专一性, 有特异的识别位点,通常具有 二重旋转对称性的回文序列
常用的DNA限制性内切酶的专一性
酶
辨认的序列和切口
说明
Alu I Bam H I Bgl I
‥ ‥A G C T ‥‥ ‥ ‥T C G A ‥ ‥
‥ ‥G G A T C C ‥‥ ‥ ‥C C T A G G ‥‥
‥ ‥A G A T C T ‥‥ ‥ ‥T C T A G A ‥‥
四核苷酸,平端切口 六核苷酸,粘端切口 六核苷酸,粘端切口
Eco R I Hind Ⅲ
‥ ‥G A A T T C ‥‥ ‥ ‥C T T A A G ‥‥
5
精氨酸
延胡索酸
4
精氨琥珀酸
谷氨酸
谷氨酸
2ATP+CO2+NH3+H2O
鸟氨酸 1 2ADP+Pi
氨甲酰磷酸 线
2
粒
体
瓜氨酸
AMP+PPi
3
ATP
瓜氨酸
基质
天冬氨酸
-酮戊二酸
草酰乙酸
谷氨酸
氨基酸
(二)α-酮酸的代谢转变
氨基酸碳骨架
葡萄糖
磷酸烯醇 式丙酮酸
丙氨酸 苏氨酸 甘氨酸 丝氨酸 半胱氨酸
丙酮酸
一、 核酸的酶促降解
核酸酶
核苷酸酶 核苷酸磷酸化酶
核酸
核苷酸
核苷 磷酸
碱基+戊糖
一、核 酸 酶
1、核酸酶的分类
(1)根据对底物的 专一性分为
氨基酸又怎样进一步分解—脱氨,尿素循环一碳单位.

①消耗氧 ②生成产物是α-酮酸和氨
1. 氨基酸氧化酶: 是一种黄素蛋白(FP)。
黄素蛋白接受由氨基酸脱出的氢,转 变为还原型黄素蛋白(FP-2H),又将氢 原子直接与氧结合生成H2O2。
(一)脱氨基作用 1. 氧化脱氨
一碳单位不能游离存在,常与四氢叶酸结 合而转运和参加代谢。
一碳单位主要来源于丝氨酸,甘氨酸,苏 氨酸及组氨酸 (P266 )。
维生素B11(叶酸folic acid)
(1)结构
(2)功能
叶酸在5、6、7、8位加上四个氢,生成四氢叶酸 (FH4),四氢叶酸是一碳单位的载体,传递一碳单位。
一碳单位主要生理功用:
NH2
NH2
(CH2)3
C O HC NH2
NH2 尿素
COOH 鸟氨酸
(Orn)
NH2 CO
NH
(CH2)3 HC NH2
COOH 瓜氨酸
NH2 C NH NH 尿素
(CH2)3
HC NH2
COOH
H2O
精氨酸
(Arg)
鸟氨酸 NH3 + CO2 H2O
瓜氨酸 NH3
精氨酸 H2O
1. 氨甲酰磷酸的合成 2. 瓜氨酸的合成 3. 由瓜氨酸合成精氨基琥珀酸 4. 生成Arg 5. Arg的水解
3. 脱酰胺基作用
嘌呤核苷酸循环
α-酮酸 α-氨基酸
Glu
转氨酶
α-KGA
OAA
谷草转氨酶
腺苷酸基
琥珀酸合成酶
Asp + IMP
腺苷酸基琥珀酸
NH3 +H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
最佳食用油:玉米油、米糠油、芝麻油等尤 佳,植物油与动物油按1∶0.5或1∶1的比例调配 食用更好。
最佳汤食:鸡汤最优,特别是母鸡汤还有防 治感冒、支气管炎的作用,尤其适于冬春季饮用。
最佳护脑食物:菠菜、韭菜、南瓜、葱、花 椰菜、菜椒、豌豆、番茄、胡萝卜、小青菜、蒜 苗、芹菜等蔬菜,核桃、花生、开心果、腰果、 松子、杏仁、大豆等壳类食物
1. 日常膳食中获取,如:肉类、水产类、蛋、乳制品和部分
豆类食品。需选择低脂、摄取全面最好。由于各种食物蛋 白质中的氨基酸模式不同,故可把2种或2种以上的食物蛋 白质适当混合食用,其中的氨基酸可相互补充,当日常膳食 中某一种或几种必需氨基酸含量不足或缺乏时,会使人体 肌肉合成受限制。
2. 运动营养补充品,如:乳清蛋白、复合高质蛋白(增肌粉、 顶级高质蛋白)、全谱氨基酸或支链氨基酸。其蛋白质含 量高,比日常膳食蛋白质中氨基酸含量更全面、更科学、 生物价值更高。每日可在膳食获取蛋白质以外,每公斤体 重补充0.5克。最好每日分为几次补充,这样会提高人体对 蛋白质的吸收和利用。
最有益健康的食品
❖ 最佳蔬菜:由于红薯既含丰富的维生素,又是抗 癌能手,所以被选为所有蔬菜之首。其次分别是 芦笋、卷心菜、花椰菜、芹菜、茄子、甜菜、胡 萝卜、荠菜、苤蓝、金针菇、雪里红、大白菜。
❖ 最佳水果:最佳水果的排名依次是:木瓜、草莓、 橘子、柑子、猕猴桃、芒果、杏、柿子与西瓜。
❖ 最佳肉食:鹅鸭肉化学结构接近橄榄油,有益于 心脏。鸡肉则被称为“蛋白质的最佳来源”。
❖ 由于酪氨酸在体内需由苯丙氨酸为原料 来合成,半胱氨酸必需以蛋氨酸为原料 来合成,故这两种氨基酸被称为半必需 氨基酸。
❖ 精氨酸、组氨酸在人体内合成慢,不能 满足需要也称半必需氨基酸。
非必需氨基酸: 非必需氨基酸并非体内蛋 白质合成不需要,而是人体内可以合成,当 总氮量不足时,体内合成非必需氨基酸会受 限制,从而制约人体蛋白蛋(人体肌肉)的合 成。
❖ 如谷类含Lys少,Trp多,而豆类含Lys多, Trp少,两者混合食用可提高营养价值。
第二节 蛋白质的消化、吸收
一、蛋白质的消化
(一)胃中的消化: 胃蛋白酶水解食物蛋白质为多肽、寡肽及少量
氨基酸。 (二)肠中的消化: 有两种类型的酶:⑴ 肽链外切酶:如羧肽酶A、
羧肽酶B、氨基肽酶、二肽酶等;⑵ 肽链内切 酶:如胰蛋白酶、糜蛋白酶、弹性蛋白酶等。 蛋白质在肠中完全水解为氨基酸。
第一节 蛋白质的营养作用
一、蛋白质的生理功能
1. 是构成组织细胞的重要成分。 2. 参与组织细胞的更新和修补。 3. 参与物质代谢及生理功能的调控。 4. 氧化供能人体每日18%能量由蛋白质提供。 5. 其他功能:如转运、凝血、免疫、记忆、
识别等均与蛋白质有关。
二、氮平衡(nitrogen balance)
四、蛋白质的营养价值及互补作用
蛋白质在体内的利用率称为蛋白质的营养 价值
决定蛋白质营养价值高低的因素有:① 必 需氨基酸的含量;② 必需氨基酸的种类; ③ 必需氨基酸的比例,即具有与人体需求 相符的氨基酸组成。
将几种营养价值较低的食物蛋白质混合后 食用,以提高其营养价值的作用称为食物 蛋白质的互补作用。
蛋白质在健美运动中也有重要意义
健美运动是以追求肌肉的围度和肌肉的质量为第一目的, 对于蛋白质的需要量是很高的,因此,及时补充优质蛋白质 对健美运动训练是非常必要的,只有这样才能保证训练的 连续性,达到训练目的。通常健美运动训练每公斤体重每 日需补充1克~1.5克蛋白质,也就是一个60公斤体重的健美 训练者,每日需补充60克~90克蛋白质。 蛋白质的补充来源可分为二部份:
❖ 氮平衡有以下几种情况:
❖ 1.氮总平衡:每日摄入氮量与排出氮量 大致相等,表示体内蛋白质的合成量与分 解量大致相等,称为氮总平衡。此种情况 见于正常成人。
❖ 2.氮正平衡:每日摄入氮量大于排出氮 量,表明体内蛋白质的合成量大于分解量, 称为氮正平衡。此种情况见于儿童、孕妇、 病后恢复期。
❖ 3.氮负平衡:每日摄入氮量小于排出氮 量,表明体内蛋白质的合成量小于分解量, 称为氮负平衡。此种情况见于消耗性疾病
第十章 蛋白质降解和氨基 酸代谢
Metabolism of Amino Acids
氨 基 酸 ( amino acids) 是 蛋 白 质 (protein)的基本组成单位。本章主 要讨论蛋白质的酶促水解与氨基酸代 谢包括氨基酸的合成代谢和氨基酸的 分解代谢。
本章内容:
➢蛋白质的营养作用 ➢蛋白质的消化、吸收与腐败 ➢氨基酸的一般代谢 ➢个别氨基酸的代谢
人体每日须分解一定量的组织蛋白质, 并以含氮终产物的形式排出体外。同时, 须从食物中摄取一定量的蛋白质,以维 持正常生理活动之需。由于食物中的含 氮物主要是蛋白质,故可用氮的摄入量 来代表蛋白质的摄入量。
体内蛋白质的合成与分解处于动态平衡 中,故每日氮的摄入量与排出量也维持 着动态平衡,这种动态平衡就称为氮平 衡(nitrogen balance)。
•消化过程 ——自胃中开始,在小肠中完成。
(一)胃中的消化作用
胃酸、胃蛋白酶
胃蛋白酶原
胃蛋白酶 + 多肽碎片
1、营养价值(nutrition value):
外源性蛋白质被人体利用的程度。 吸收的食物蛋白被机体利用的几率(利用率)。
一般:动物蛋白质 >植物蛋白质。N保留量=源自×100%N吸收量
蛋白质的互补作用
❖ 指营养价值较低的蛋白质混合食用,其必 需氨基酸可以互相补充而提高营养价值。 其本质即为食物蛋白质之间在AA组成上的 取长补短,互相补充。
三、必需氨基酸与非必需氨基酸
体内不能合成,必须由食物蛋白质 供给的氨基酸称为必需氨基酸 (essential amino acid)。
体内能够自行合成,不必由食物供 给的氨基酸就称为非必需氨基酸。
❖ 必需氨基酸一共有八种:赖氨酸(Lys)、 色氨酸(Trp)、苯丙氨酸(Phe)、蛋 氨酸(Met)、苏氨酸(Thr)、亮氨酸 (Leu)、异亮氨酸(Ile)、缬氨酸 (Val)。
