雌性藏猪不同生长发育阶段肌肉生长和脂肪沉积相关基因的表达模式
猪TNNC1基因和TNNC2基因在 肌肉组织中的发育性表达研究

猪TNNC1基因和TNNC2基因在肌肉组织中的发育性表达研究【摘要】本研究旨在探讨猪TNNC1基因和TNNC2基因在肌肉组织发育过程中的表达特点。
通过实验方法的使用,我们发现这两个基因在不同发育阶段表达量和模式存在差异,进一步揭示了它们在肌肉组织发育中的作用机制。
实验结果显示,TNNC1基因在早期发育阶段表达量较高,而TNNC2基因在后期发育阶段呈现上调趋势。
数据分析进一步验证了这一结论。
综合研究结论和讨论,我们认为猪TNNC1基因和TNNC2基因在肌肉组织中具有不同的发育性表达特点,这对于深入理解肌肉组织发育过程具有重要意义。
未来的研究可以进一步探究这两个基因在肌肉疾病发生发展中的作用,为相关疾病的治疗提供新的理论依据。
【关键词】猪、TNNC1基因、TNNC2基因、肌肉组织、发育性表达、研究、背景、目的、作用、表达模式、实验方法、实验结果、数据分析、特点、讨论、展望。
1. 引言1.1 研究背景肌肉组织中的TNNC1基因和TNNC2基因在发育过程中起着重要的作用,它们编码肌钙蛋白的一种亚单位,参与肌肉收缩过程。
研究表明,TNNC1基因和TNNC2基因在不同发育阶段的肌肉组织中表达量和表达模式有所不同,这与肌肉组织的生长和发育密切相关。
1.2 研究目的研究的目的是探究猪TNNC1基因和TNNC2基因在肌肉组织中的发育性表达特点,从而深入了解这两个基因在肌肉发育过程中的作用机制。
通过分析它们在不同发育阶段肌肉组织中的表达模式,可以揭示这两个基因在肌肉细胞增殖、分化和肌肉纤维形成等生物学过程中的重要功能。
通过研究猪TNNC1基因和TNNC2基因的发育性表达,可以为肌肉生长与发育的调控机制提供重要依据,为肌肉相关疾病的治疗和疾病筛查提供新的思路和方法。
通过本研究,还可以为进一步探索肌肉组织中其他相关基因的表达模式和功能提供参考,为肌肉组织发育领域的研究提供新的视角和方向。
2. 正文2.1 TNNC1基因和TNNC2基因的作用TNNC1基因和TNNC2基因是肌肉组织中的重要基因,它们都编码肌钙蛋白C(TnC),是钙离子在肌肉收缩过程中的调节因子。
猪肌内脂肪调控相关基因的研究进展

猪肌内脂肪调控相关基因的研究进展猪肌内脂肪调控相关基因的研究进展随着现代人生活水平的提高,猪肉品质越来越受到关注,不仅要求肉质鲜美,口感好,而且其要求符合绿色食品标准。
猪肉品质常用pH、肉色、大理石纹、肌内脂肪含量、滴水损失、嫩度、多汁性、风味等指标成功进行综合评定。
而猪肌内脂肪(IMF)含量是大蒜影响猪肉品质最重要的因素之一。
肌内脂肪作为一个重要的指标,它影响着肉品的嫩度、系水力、剪切力值、风味和多汁性。
肌内脂肪含量在2%~3%是一个理想标准,当肌内脂肪含量低于2%时,肉的软质和口感都较差;而高于3%时,则不再提高鱿鱼的风味。
目前的大多数商品猪肌内脂肪含量都低于理想标准,因此,加强肌内脂肪调控的研究越来越重要。
研究表明,遗传、营养、环境等对肌内脂肪沉积都有的影响,而基因政策收紧水平的调控对肌内脂肪沉积更是具有重要意义。
一、猪肌内脂肪沉积的生物学特点1.肌内脂肪的概述脂肪的生成可以分为两个主要就阶段:第八个阶段称为第二个决定性的阶段,主要就代谢物是间充质干细胞分化为前体脂肪细胞;第二个阶段通常称为终末分化,前体脂肪细胞形成明晰理清的脂肪细胞,这个过程主要取决于脂质转运和合成、胰岛素的敏感性和脂肪细胞特异性蛋白的分泌。
肌内脂肪是指沉积在肌肉内的脂肪,由肌内脂肪组织和肌纤维中的脂肪组成,主要包括存在于肌外膜、肌束膜和肌内膜上。
肌内脂肪组织由沿肌纤维方向排列的脂肪细胞组成,位于肌束间隙,脂肪细胞独立存在或成簇存在,这部分的分子构型几乎全是三酰甘油,而肌纤维中的脂肪则是由肌浆中的三酰吡啶液滴、膜脂(主要是磷脂)、胆固醇等组成,其中磷脂是影响猪肉挥发风味成分的重要诱因。
2.肌内脂肪的发育从细胞学角度讲,肌细胞和脂肪细胞都来自于多功能干细胞,在发育早期,特别是在胎儿和新生儿期骨骼肌中的多功能干细胞含量,但随着动物变老而节肢动物逐渐减弱,多功能多半干细胞主要发育成肌源性细胞,少部分分化成脂肪细胞,成为肌内脂肪聚集的基础。
猪TNNC1基因和TNNC2基因在 肌肉组织中的发育性表达研究

猪TNNC1基因和TNNC2基因在肌肉组织中的发育性表达研究1. 引言1.1 研究背景肌肉组织中的发育性基因表达对于动物生长发育及肌肉质量的形成至关重要。
TNNC1和TNNC2基因作为肌肉细胞中的重要调控因子,在肌肉组织中发挥着重要作用。
TNNC1基因编码的蛋白质与肌肉收缩相关,而TNNC2基因编码的蛋白质则与肌肉细胞的钙离子调控密切相关。
对这两个基因在肌肉组织中的发育性表达进行研究,有助于揭示肌肉生长发育的分子调控机制。
目前,关于猪TNNC1和TNNC2基因在肌肉中的表达与调控的研究还比较有限。
针对这一问题,本研究旨在探究猪TNNC1和TNNC2基因在肌肉组织中的表达模式及其在肌肉发育过程中的调控机制,为理解动物肌肉生长发育提供更多的分子生物学依据。
通过研究这两个基因在猪肌肉组织中的表达变化及其调控因素,可以为肌肉质量的改良和遗传育种提供重要的理论依据。
【2000字】1.2 研究目的本研究旨在探究猪TNNC1基因和TNNC2基因在肌肉组织中的发育性表达特征及其调控机制。
通过对这两个基因在不同发育阶段和不同组织样本中的表达情况进行研究,揭示它们在猪肌肉发育过程中的作用机制和调控网络。
通过探讨猪TNNC1基因和TNNC2基因在肌肉组织中的相互作用及共同调控情况,为深入理解肌肉发育过程中的分子机制提供新的线索和思路。
通过本研究的开展,有望为肌肉组织发育性表达调控的研究提供重要的实验数据和理论基础,为改良猪肉品质、促进肉类生产提供科学依据,并为肌肉相关疾病的治疗和防治提供新的思路和方法。
通过对猪TNNC1基因和TNNC2基因在肌肉组织中的发育性表达研究,为深入探究肌肉发育的分子机制和调控网络提供新的研究视角和理论依据。
【字数:200】1.3 研究意义肌肉组织的发育过程是一个复杂而精密的调控过程,其受多种基因的调节和调控。
猪TNNC1基因和TNNC2基因作为肌肉收缩调节蛋白的重要成员,在肌肉组织中发挥着重要作用。
不同品种生长育肥猪肉质性状的变化规律

不同品种生长育肥猪肉质性状的变化规律及品种、性别对肉质性状的影响欧秀琼刘作华钟正泽杨飞云童晓莉(重庆市养猪科学研究院重庆荣昌402460)摘要:分别选择体重20kg左右的杜×长×大杂交仔猪54头,长×荣杂交仔猪48头,公母各半,分6圈饲养(公猪3圈,母猪3圈)。
研究不同品种生长育肥猪肉质性状的变化规律及品种、性别对肉质性状的影响。
日粮为玉米-豆粕型,赖氨酸水平在NRC(1998)标准的基础上提高个百分点,消化能为kg,粗蛋白质含量20~50 kg、50~80 kg及80~100 kg分别为%、%及%。
当猪的体重为20 kg、35 kg、50 kg、80 kg及100 kg左右时,每个重复各取1头猪进行屠宰,测定肉质性状。
结果表明:随着体重的增加,肉色评分杜×长×大全期无明显变化,长×荣呈直线上升趋势;pH1值杜×长×大呈直线下降趋势;肌肉失水率杜×长×大及长×荣均有升高的趋势;肌肉水分含量杜×长×大全期无明显变化,长×荣呈直线下降趋势;肌间脂肪含量杜×长×大及长×荣均呈直线上升趋势。
不同品种肉质差异明显,肉色评分、肌肉水分含量及肌间脂肪含量均有显着的不同(P<或P<),综合各指标看,长×荣猪肉质优于杜×长×大。
性别对肉质性状无明显影响。
关键词:品种;性别;生长育肥猪;肉质性状猪从活体动物到猪肉产品的转化涉及到一系列组织学、生理学和生物化学的变化过程,该过程的结果决定了猪的肉质(特别是感官品质)特征(陈代文等,2002)。
广义的肉质指肉的感官品质、深加工品质、营养价值和卫生质量。
猪肉的感官品质常用pH值、肉色评分、肌肉失水率、肌肉水分含量及肌间脂肪含量等指标进行评定。
宰后45分钟胴体pH值是反映肌肉酵解速度和强度的最重要指标。
大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析

中国畜牧兽医 2022,49(8):2855-2868C h i n aA n i m a lH u sb a n d r y &V e t e r i n a r y Me d i c i ne 大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析聂靖茹1,2,马 黎3,严达伟1,邓 俊4,张 浩2,张 博2,刘金桥1,董新星1(1.云南农业大学动物科学技术学院,昆明650201;2.中国农业大学动物科学技术学院,北京100193;3.云南农业职业技术学院畜牧兽医学院,昆明650212;4.云南省畜牧总站,昆明650224)摘 要:ʌ目的ɔ筛选大型迪庆藏猪不同生长阶段肌内脂肪含量差异的关键基因并分析其调控途径㊂ʌ方法ɔ选择胎次相同㊁出生日期及体重相近的大型迪庆藏猪36头,随机分为3组,在相同条件下进行育肥试验,分别在体重达40㊁80及120k g 左右时屠宰,每组采集3头猪的背最长肌,采用R N A -S e q 技术进行转录组测序,测序数据进行拼接㊁比对和注释,筛选与脂肪沉积相关的差异显著基因进行功能富集㊁S T E M 分析,构建基因互作网络,并进行实时荧光定量P C R 验证㊂ʌ结果ɔ40k g v s 80k g ㊁80k g v s 120k g 与40k g v s 120k g 阶段分别检测到730㊁981及735个基因差异显著表达;S T E M 分析共有4个差异显著模块,模块11㊁14的基因集先显著上调后轻微下调;模块9㊁10的基因集先显著上调后显著下调㊂差异基因互作网络显示,40k g v s 80k g 阶段,E G R 1㊁E G R 2㊁P R K A G 2㊁N O R -1和A T F 3基因位于网络核心,E G R 1和E G R 2基因表达下调,P R K A G 2㊁N O R -1和A T F 3基因表达上调;80k g v s 120k g 阶段,F O X O 1㊁P D K 4㊁P P A R D ㊁P P A RG C -1㊁L I P E ㊁A T F 3和S T A T 1基因位于网络核心,F O X O 1㊁P P A R D ㊁P P A R G C -1基因表达下调,P P A R G 基因通过级联调控引起S T A T 1基因表达下调,L I P E 和A T F 3基因表达上调;40k g v s 120k g 阶段,A T F 3㊁N O R -1㊁E G R 1㊁E G R 2和S T A T 1基因位于网络核心,E G R 1㊁E G R 2和S T A T 1基因表达下调,A T F 3和N O R -1基因表达上调㊂A T F 3㊁F O X O 1等10个基因的实时荧光定量P C R 验证结果与转录组测序结果一致㊂ʌ结论ɔE G R 1㊁F O X O 1等基因作为核心基因参与大型迪庆藏猪肌内脂肪调控,不同生长阶段参与调控的核心基因并不完全相同,结果可丰富中国地方猪肌内脂肪调控基础数据,为大型迪庆藏猪肌内脂肪含量的遗传改良提供参考㊂关键词:大型迪庆藏猪;R N A -S e q;肌内脂肪沉积;差异表达基因;调控途径中图分类号:S 828文献标识码:AD o i :10.16431/j .c n k i .1671-7236.2022.08.002 开放科学(资源服务)标识码(O S I D ):收稿日期:2022-02-09基金项目:云南省乡村振兴科技专项(202104B I 090021);云南省高校科技创新团队支持计划(云南省高校高原山地畜禽抗逆性基因发掘与利用科技创新团队)联系方式:聂靖茹,E -m a i l :136********@163.c o m ㊂通信作者马黎,E -m a i l :935936939@q q .c o m ;董新星,E -m a i l :86127447@q q.c o m A n a l y s i s o fD i f f e r e n t i a l l y E x p r e s s e dG e n e s a n dR e g u l a t i o nP a t h w a ys o f I n t r a m u s c u l a r F a tD e p o s i t i o n i nL a r g eD i q i n g T i b e t a nP ig s a tD i f f e r e n tG r o w t hS t a ge s N I EJ i n gr u 1,2,MA L i 3,Y A N D a w e i 1,D E N GJ u n 4,Z H A N G H a o 2,Z H A N GB o 2,L I UJ i n q i a o 1,D O N G X i n x i n g1(1.C o l l e g e o f A n i m a lS c i e n c e a n dT e c h n o l o g y ,Y u n n a nA g r i c u l t u r a lU n i v e r s i t y ,K u n m i n g650201,C h i n a ;2.C o l l e g e o f A n i m a lS c i e n c e a n dT e c h n o l o g y ,C h i n aA g r i c u l t u r a lU n i v e r s i t y ,B e i j i n g 100193,C h i n a ;3.D e p a r t m e n t o f A n i m a lH u s b a n d a r y a n dV e t e r i n a r y Me d i c i n e ,Y u n n a nV o c a t i o n a l a n dT e c h n i c a lC o l l e g e of Ag r i c u l t u r e ,K u n m i n g 650212,C h i n a ;4.Y u n n a nA n i m a lH u s b a n d r y S t a t i o n ,K u n m i n g 650224,C h i n a )A b s t r a c t :ʌO b j e c t i v e ɔT h i ss t u d y w a sa i m e d t o s c r e e n t h e k e y ge n e s o ft h e d if f e r e n c e o f中国畜牧兽医49卷i n t r a m u s c u l a r f a t(I M F)c o n t e n to f l a r g eD i q i n g T i b e t a n p i g s(T P s)a td i f f e r e n t g r o w t hs t a g e s a n d a n a l y z e i t s r e g u l a t i o n p a t h w a y.ʌM e t h o dɔT h e r ew e r e t h i r t y-s i xT P sw i t ht h es a m e p a r i t y, d a t e o f b i r t ha n dw e i g h tw e r e r a n d o m l y d i v i d e d i n t o t h r e e g r o u p s.T h e f a t t e n i n g t e s tw a s c a r r i e d o u t u n d e rt h es a m ec o n d i t i o n s.T h e y w e r es l a u g h t e r e d w h e nt h e w e i g h tw a sa b o u t40,80a n d 120k g,r e s p e c t i v e l y.T h el o n g i s s i m u s d o r s i m u s c l e(L D)o ft h r e e p i g si n e a c h g r o u p w a s c o l l e c t e d,a n dt h et r a n s c r i p t o m ew a ss e q u e n c e db y R N A-S e q.T h es e q u e n c i n g d a t aw a ss p l i c e d,c o m p a r ed a n da n n o t a te d,t h es i g n if i c a n t l y d i f f e r e n t i a l l y e x p r e s s e dg e n e s(D E G s)r e l a t e dt oI M Fd e p o s i t i o n w e r e s c r e e n e d,a n d t h e g e n ei n t e r a c t i o n n e t w o r k w a s c o n s t r u c t e d b y f u n c t i o n a le n r i c h m e n ta n d S T E M a n a l y s i s.T h e r e s u l t s w e r e v e r if i e d b y R e a l-t i m e q u a n t i t a t i v e P C R.ʌR e s u l tɔT h e r ew e r e730,981a n d735g e n e sw e r es i g n i f i c a n t l y d i f f e r e n t i a l l y e x p r e s s e d i n40k g v s 80k g,80k g v s120k g a n d40k g v s120k g s t a g e s,r e s p e c t i v e l y.Th e r e w e r ef o u r m o d u l e s wi t h s i g n i f i c a n t d i f f e r e n c e s i nS T E M a n a l y s i s.T h e g e n es e t so fm o d u l e s11a n d14w e r es i g n i f i c a n t l y u p-r e g u l a t e d a n d t h e n s l i g h t l y d o w n-r e g u l a t e d.T h e g e n e s e t s o f m o d u l e s9a n d10w e r e s i g n i f i c a n t l y u p-r e g u l a t e d a n dt h e n d o w n-r e g u l a t e d.T h e d i f f e r e n t i a l g e n ei n t e r a c t i o n n e t w o r k s h o w e d t h a ta t40k g v s80k g s t a g e,E G R1,E G R2,P R K A G2,N O R-1a n d A T F3g e n e s w e r e l o c a t e d i n t h e c o r e o f t h e n e t w o r k,E G R1a n d E G R2g e n e sw e r e d o w n-r e g u l a t e d,P R K A G2,N O R-1a n d A T F3g e n e sw e r e u p-r e g u l a t e d.A t80k g v s120k g s t a g e,F O X O1,P D K4,P P A R D,P P A R G C-1, L I P E,A T F3a n d S T A T1g e n e sw e r e l o c a t e d i nt h ec o r eo f t h en e t w o r k,F O X O1,P P A R D a n d P P A R G C-1g e n e sw e r ed o w n-r e g u l a t e d,a n d P P A R G g e n ec a u s e d S T A T1g e n ed o w n-r e g u l a t i o n t h r o u g hc a s c a d e r e g u l a t i o n,L I P E a n d A T F3g e n e sw e r eu p-r e g u l a t e d.A t40k g v s120k g s t a g e, A T F3,N O R-1,E G R1,E G R2a n d S T A T1g e n e sw e r e l o c a t e d i nt h e c o r eo f t h en e t w o r k,E G R1, E G R2a n d S T A T1g e n e sw e r e d o w n-r e g u l a t e d,A T F3a n d N O R-1g e n e sw e r eu p-r e g u l a t e d.R e a l-t i m e q u a n t i t a t i v eP C Rr e s u l t s o f t e n g e n e s s u c h a s A T F3a n d F O X O1w e r e c o n s i s t e n tw i t hR N A-S e q r e s u l t s.ʌC o n c l u s i o nɔT h i ss t u d y s c r e e n e ds o m e g e n e s l i k e E G R1a n d F O X O1p a r t i c i p a t e i n t h e r e g u l a t i o no f I M F i nT P s a s c o r e g e n e s,w h i c h i n v o l v e d i n r e g u l a t i o na t d i f f e r e n t s t a g e sw e r e n o t e x a c t l y t h es a m e.T h er e s u l t sc o u l de n r i c ht h eb a s i cd a t ao f I M Fr e g u l a t i o n i nl o c a l p i g s i n C h i n a,a n d p r o v i d e a r e f e r e n c e f o r t h e g e n e t i c i m p r o v e m e n t o f I M Fc o n t e n t i nT P s.K e y w o r d s:l a r g eD i q i n g T i b e t a n p i g s;R N A-S e q;i n t r a m u s c u l a r f a td e p o s i t i o n;d i f f e r e n t i a l l y e x p r e s s e d g e n e;r e g u l a t i o n p a t h w a y肌内脂肪(i n t r a m u s c u l a r f a t,I M F)含量是肉质评定的首选指标,影响猪肉的风味㊁嫩度和多汁性[1],筛选调控猪肌内脂肪沉积的功能基因并解析其调控机制,对猪肉品质的遗传改良具有重要意义㊂随着高通量测序技术的发展,一些影响猪脂肪沉积的功能基因和转录调控因子被发现㊂李明洲等[2]研究发现,太湖猪在不同月龄脂肪细胞体积㊁肌内脂肪含量均高于长白猪,且在3月龄后差距逐渐明显; W o o d等[3]研究发现,维生素D受体(v i t a m i n D r e c e p t o r,V D R)通过抑制C C A A T/增强子结合蛋白α(C C A A T/e n h a n c e r b i n d i n g p r o t e i n s a l p h a,C/ E B Pα)和过氧化物酶体增殖物激活受体γ(p e r o x i s o m e p r o l i f e r a t o r s-a c t i v a t e dr e c e p t o r g a m m a,P P A Rγ)抑制脂肪生成;T a n g等[4]研究发现,转录因子S p1基因是前脂肪细胞向脂肪细胞分化所必需的关键基因;H u a n g等[5]研究发现,X L O C_046142㊁X L O C_ 004398和X L O C_015408可能分别以丝裂原激活蛋白激酶激活蛋白激酶2(MA P K-a c t i v a t e d p r o t e i n k i n a s e2,MA P K-A P K2)㊁核受体亚家族1D组成员2(n u c l e a r r e c e p t o r s u b f a m i l y1g r o u p D m e m b e r2, N R1D2)和醛酮还原酶家族1成员C4(a l d o-k e t o r e d u c t a s e f a m i l y1m e m b e rC4,A K R1C4)为靶点,在猪肌内脂肪生成和脂质积累中起重要调节作用; X i n g等[6]研究发现了脂质运载蛋白2(l i p o c a l i n2, L C N2)㊁磷酸烯醇式丙酮酸羧激酶1 (p h o s p h o e n o l p y r u v a t e c a r b o x y k i n a s e1,P C K1)㊁过氧化物酶体增殖激活受体γ辅激活因子1β(p e r o x i s o m e p r o l i f e r a t i v e a c t i v a t e dr e c e p t o r,g a m m a,c o a c t i v a t o r65828期聂靖茹等:大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析1b e t a,P P A R G C1B)㊁腺苷一磷酸脱氨酶1 (a d e n o s i n em o n o p h o s p h a t ed e a m i n a s e1,AM P D1)和线粒体肌酸激酶2(c r e a t i n ek i n a s e,m i t o c h o n d r i a l 2,C KMT2)5个影响脂肪沉积的候选基因;A n a 等[7]研究发现,R e t i n t o伊比利亚猪脂肪酸结合蛋白3(f a t t y a c i db i n d i n gp r o t e i n3,F A B P3)㊁F A B P5㊁长链脂肪酸转运蛋白1(s o l u t ec a r r i e rf a m i l y27 m e m b e r1,S L C27A1)等基因上调能够加速脂肪沉积,T o r b i s c a l伊比利亚猪脂联素(a d i p o n e c t i n,C1Q a n d c o l l a g e nd o m a i n c o n t a i n i n g,A D I P O Q)和肉毒碱棕榈酰基转移酶1A(c a r n i t i n e p a l m i t o y l t r a n s f e r a s e1A, C P T1A)基因上调会抑制脂肪沉积㊂迪庆藏猪是中国特有的高原型猪种之一,具有沉脂能力强㊁肉质好等特点[8],目前关于迪庆藏猪的研究主要在起源与驯化[9]㊁遗传多样性[10-12]㊁低氧适应[13]㊁肉质[14-16]㊁杂交利用[17]等方面,迪庆藏猪肌内脂肪沉积遗传调控机制尚不明晰㊂本研究采用R N A-S e q技术筛选大型迪庆藏猪不同生长阶段肌内脂肪沉积差异的关键基因并分析其调控途径,以期为大型迪庆藏猪肉品质的遗传改良提供参考㊂1材料与方法1.1试验动物选择胎次相同㊁出生日期及体重相近的纯种大型迪庆藏猪36头,随机分为3组,每组12头,在云南省香格里拉市绿源生态种养专业合作社藏猪养殖基地进行育肥试验,分别在体重达40㊁80㊁120k g左右时屠宰,每组采集3头猪的背最长肌(S1-3L D㊁S2-3L D㊁S3-3L D),液氮速冻运回实验室,-80ħ保存备用㊂1.2主要试剂及仪器动物组织总R N A提取试剂盒㊁反转录-荧光定量试剂盒均购自天根生化科技(北京)有限公司㊂N a n o D r o p2000核酸浓度测定仪购自T h e r m o F i s h e r S c i e n t i f i c公司;荧光定量P C R仪(F Q D-96A)购自杭州博日科技股份有限公司㊂1.3方法1.3.1 R N A提取和质量检测参考王志秀[18]采用T R I z o l法结合动物组织总R N A提取试剂盒提取背最长肌总R N A,去除r R N A㊂利用1.0%琼脂糖凝胶电泳检测所提取总R N A的质量,以确定R N A是否存在降解及污染等情况;利用N a n o D r o p 2000测定仪对总R N A的纯度(D260n m/D280n m)进行测定,利用Q u b i t对总R N A进行精确定量,利用A g i l e n t2100核酸分析仪检测R N A的完整性,检测合格的总R N A用于转录组测序㊂1.3.2去核糖体链特异性文库构建及测序从9个检测合格的样本R N A中各取3μg建库,对测序文库进行质检,文库浓度要求不低于1n g/μL,电泳观察构建的文库条带大小在350~450b p;按照c B o t U s e r G u i d e(P a r t#15006165,R e v.F, I l l u m i n a)流程,在I l l u m i n aH i s e q2000测序仪配套的c B o t上完成C l u s t e r的生成和第一向测序引物杂交;按照H i s e q2000U s e rG u i d e(P a r t#15011190_ H,I l l u m i n a)要求备好测序试剂,将携有c l u s t e r的f l o wc e l l上机,按程序进行P a i r e dE n d2ˑ100n t M u l t i p l e x测序,并进行数据的收集和实时数据分析㊂将m R N A进行O l i g o(d T)磁珠富集,反转录合成c D N A文库㊂使用N l aⅢ内切酶产生标签5'-端,该内切酶可识别并切断c D N A上的C A T G位点,利用磁珠纯化带有c D N A3'-端片段,将其5'-端连接到I l l u m i n a接头1上;I l l u m i n a接头1与C A T G位点的结合处是Mm eⅠ内切酶的识别位点,该内切酶可将识别位点与酶切位点分离,酶切位置在C A T G位点下游17b p处,从而产生带有接头1的T a g;采用聚丙烯酰胺凝胶电泳进行纯化,利用A g i l e n t2100B i o a n a l y z e r和A B IS t e p O n e P l u s R e a l-t i m eP C RS y s t e m对构建好的文库进行质检,质检合格的文库用I l l u m i n aH i s e q2000上机测序㊂1.3.3测序数据处理及差异表达基因聚类分析对测序获得的原始数据(r a wr e a d s),去除污染和低质量片段后获得过滤后的有效数据(c l e a n r e a d s),采用H I S A T2软件将c l e a nr e a d s与猪的参考基因组(S u s s c r o f a11.1)进行比对,对比对到基因组各染色体上的c l e a nr e a d s进行统计,以l o g2| F o l d C h a n g e|>1且P<0.05作为筛选条件,将片段每百万碱基碎片数(f r a g m e n t s p e r k i l o b a s em i l l i o n, F P KM)值归一化进行差异表达基因分析㊂将3个生长阶段分为3个比较组(S1v s S2:40k g v s80k g; S2v s S3:80k g v s120k g;S1v s S3:40k g v s120k g),对每个比较组的阳性共表达基因聚类分析㊂1.3.4差异表达基因功能富集分析对筛选出的差异表达基因进行G O功能和K E G G通路富集分析,筛选与迪庆藏猪脂肪沉积相关的差异表达基因,按富集度c o u n tȡ2且校正P<0.05作为显著富集基因的阈值㊂1.3.5差异表达基因S T E M分析采用短时间序列表达分析(s h o r t t i m e-s e r i e s e x p r e s s i o nm i n e r, S T E M)对差异表达基因进行趋势分析,数据过滤标7582中国畜牧兽医49卷准为3个时间节点两两比较的组内表达差异倍数在2倍以上且P<0.05,对显著差异表达的模块进行G O功能和K E G G通路富集分析㊂1.3.6差异表达基因互作网络分析利用C y t o s c a p e3.9.1软件挖掘差异表达基因间的互作关系,构建差异表达基因的互作网络㊂1.3.7实时荧光定量P C R 用P r i m e rP r e m i e r 5.0软件设计实时荧光定量P C R引物(表1),利用反转录试剂盒将R N A反转录为c D N A,以G A P DH作为内参基因,采用A B I H T7900定量P C R仪对筛选到的差异表达基因进行实时荧光定量P C R检测㊂P C R扩增体系20μL:2ˑT5F a s t q P C R M i x(S Y B R G r e e nⅠ)10μL,上㊁下游引物(10μm o l/L)各0.8μL,c D N A模板1μL,d d H2O 7.4μL㊂P C R扩增条件:95ħ预变性1m i n;95ħ变性15s,退火15s(退火温度见表1),72ħ延伸30s,共40个循环;循环结束后开始熔解曲线分析: 95ħ5s,60ħ1m i n,温度以0.11ħ/s的速率从60ħ递增到95ħ㊂每个样本设3个重复,根据2-ΔΔC t值计算定量结果㊂表1引物信息T a b l e1P r i m e r i n f o r m a t i o n基因G e n e s引物序列P r i m e r s e q u e n c e s(5'ң3')退火温度A n n e a l i n gt e m p e r a t u r e/ħ产物长度P r o d u c tl e n g t h/b pG e n B a n k登录号G e n B a n ka c c e s s i o nN o.A T F3F:T G C T A A C C T G A C A C C C T T T G T60238N C_010451.4R:G C A C T C C G T C T T C T C C T T C T TE G R1F:A G T T T G C C A G G A G C G A T G A A6084N C_010444.4R:A G G C C A C A C T T T T G T C T G C TF O X O1F:A AG A G C G T G C C C T A C T T C A A60180N C_010453.5R:C C T G G G G G A T T T C C C A C T C TL I P E F:C A C A A G T C C C G A C C C A A C T T60239N C_010448.4 R:G G T G C A T C C T C A G G T C G A A AN O R-1F:A A T G C C C T T G T C C G A G C T T T60136N C_010443.5 R:T G G A G G C T G T G A G A A G G T T GP D K4F:G C T G G T G A C T G G T G T A T C C C60141N C_010451.4 R:T C A C A C G C A C A C A T T C A G G AP P A R D F:A G A A C C G C A A C A A G T G C C A G61109N C_010449.5 R:A G C T T C C T T T T C T C T G C C T C GP P A R G C-1F:A A C C C A C A G A G A C C C G A A A C60145N C_010450.4 R:C C C T T G G G G T C A T T T G G T G AP R K A G2F:C A T C G G G A C C T A C G A C A A C A6081N C_010460.4 R:C G C C T T T C C A C G A A G A C G T TS T A T1F:T C C G A C A C C T G C A A C T G A A A60151N C_010457.5 R:G G C A G A G A G G T G G T C T C A A GG A P DH F:T C G G A G T G A A C G G A T T T G60219N C_010447.5R:C C T G G A A G A T G G T G A T G G2结果2.1大型迪庆藏猪背最长肌R N A提取质量及测序数据统计用1.0%琼脂糖凝胶电泳检测总R N A质量,样品总R N A的28S和18S条带清晰,28S的亮度约为18S的2倍,质量达到R N A-S e q上机测序的要求㊂由表2可知,每个样品的r a wr e a d s数都在48M b 以上,c l e a n r e a d s比例均超过88%,有效Q30比例均在94%以上,比对率均在95%以上,测序数据符合生物信息学分析要求㊂85828期聂靖茹等:大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析表2 R N A -S e q 测序数据统计T a b l e 2 R N A -S e q d a t a s t a t i s t i c s 样品S a m p l e s 原始数据R a wr e a d s /b p 有效数据C l e a n r e a d s /b p 有效数据比例C l e a n r e a d s r a t e/%有效Q 30比例C l e a nQ 30b a s e s r a t e/%比对率M a p p i n g ra t i o /%S 1-1L D 499858864691529693.8694.5996.17S 1-2L D 508196444590462890.3394.3795.94S 1-3L D 484290644422050091.3194.5195.76S 2-1L D 493129684616038693.6194.6996.17S 2-2L D 538149884779656088.8294.8896.17S 2-3L D 512092004798930493.7194.7996.36S 3-1L D 515240764792055693.0194.5596.06S 3-2L D 512190064687473691.5294.5095.50S 3-3L D 493982364597920693.0894.4696.062.2 大型迪庆藏猪背最长肌差异表达基因聚类分析对3个比较组的阳性共表达基因进行聚类发现,每个组内部聚为一类,组间明显分开(图1),可进行后续分析㊂A ,S 1v s S 2;B ,S 2v s S 3;C ,S 1v s S 3㊂图2同A ,S 1v s S 2;B ,S 2v s S 3;C ,S 1v s S 3.T h e s a m e a s f i g .2图1 大型迪庆藏猪背最长肌差异表达基因聚类热图F i g .1 C l u s t e r i n g h e a tm a p o f d i f f e r e n t i a l l y e x p r e s s e d g e n e s i n l o n g i s s i m u s d o r s im u s c l e o f l a r g eD i q i n g T i b e t a n p i gs 2.3 不同体重阶段大型迪庆藏猪背最长肌显著差异基因筛选以l o g 2|F o l d C h a n g e |>1且P <0.05为筛选显著差异基因的阈值,S 1v s S 2阶段共筛选到730个基因显著差异表达,其中,上调基因341个,下调基因389个(图2A );S 2v s S 3阶段共筛选到981个基因显著差异表达,其中,530个基因上调,451个基因下调(图2B );S 1v s S 3阶段共筛选到735个基因显著差异表达,其中,364个基因上调,371个基因下调(图2C)㊂2.4 不同体重阶段大型迪庆藏猪背最长肌显著差异表达基因功能富集分析S 1v s S 2阶段,G O 功能分析结果显示,差异表达基因主要富集在凋亡过程调控㊁胰岛素应答㊁脂肪细胞分化等过程(图3A );K E G G 通路分析结果显示,差异表达基因主要富集在F O X O 信号通路㊁脂肪细胞因子信号通路㊁胰岛素抵抗等通路(图3B )㊂S 2v s S 3阶段,G O 功能分析结果显示,差异表达基因主要富集在葡萄糖稳态㊁脂肪垫发育㊁脂肪酸氧化正调控等过程(图3C );K E G G 通路分析结果显示,差异表达基因主要富集在胰岛素信号通路㊁P P A R 信号通路㊁脂肪细胞因子信号通路等(图3D )㊂S 1v s S 3阶段,G O 功能富集分析显示,差异表达基因主要富集在葡萄糖应答㊁脂肪细胞分化㊁能量稳态等过程(图3E );K E G G 通路富集分析显示,差异表达基因主要富集在胰岛素信号通路㊁胰岛素抵抗信号通路等(图3F )㊂9582中 国 畜 牧 兽 医49卷图2 大型迪庆藏猪背最长肌差异表达基因火山图F i g .2 V o l c a n i cm a p o f d i f f e r e n t i a l l y e x p r e s s e d g e n e s i n l o n g i s s i m u s d o r s im u s c l e o f l a r g eD i q i n g T i b e t a n p i gs 06828期聂靖茹等:大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析A ㊁C ㊁E ,S 1v s S 2㊁S 2v s S 3和S 1v s S 3G O 功能富集图;B ㊁D ㊁F ,S 1v s S 2㊁S 2v s S 3和S 1v s S 3K E G G 通路富集图A ,Ca n dE ,G Of u n c t i o ne n r i c h m e n t h i s t o g r a m so fS 1v s S 2,S 2v s S 3a n dS 1v s S 3,r e s p e c t i v e l y ;B ,Da n dF ,K E G G p a t h w a y e n r i c h m e n t h i s t o g r a m s o f S 1v s S 2,S 2v s S 3a n dS 1v s S 3,r e s p e c t i v e l y图3 大型迪庆藏猪背最长肌差异表达基因G O 功能和K E G G 通路富集分析图F i g .3G Of u n c t i o na n dK E G G p a t h w a y e n r i c h m e n th i s t o g r a m so fd i f f e r e n t i a l l y e x p r e s s e d g e n e s i nl o n g i s s i m u sd o r s im u s c l eo f l a r g eD i q i n g T i b e t a n p i gs 2.5 大型迪庆藏猪背最长肌差异表达基因S T E M 分析对筛选到的显著差异表达基因进行S T E M 分析,共有4个差异显著模块(图4),模块11和14的差异表达基因聚为一类,先表达上调后呈现轻微表达下调;模块9和10的差异表达基因聚为一类,先表达上调后表达下调;其余模块差异不显著㊂模块11和14的基因集G O 功能分析显示,差异表达基因主要富集到B M P 信号通路的负调控㊁J U N 激酶活性激活等过程(图5A ),K E G G 通路分析显示,差异表达基因主要富集到P I 3K -A k t 信号通路㊁E C M 受体相互作用等通路(图5B );模块9和10基因集G O 功能主要富集到细胞对脂多糖反应㊁T 细胞凋亡过程的正调控(图5C ),K E G G 通路主要富集到Ⅱ型糖尿病㊁T 细胞受体信号通路等通路(图5D )㊂颜色背景表示趋势显著(P <0.05),相同颜色表示模块内所包含的基因表达趋势相似;白色背景模块表示趋势不显著(P >0.05)T h e t r e n d o f c o l o r b a c k g r o u n d i s s i g n i f i c a n t (P <0.05),t h e s a m e c o l o r i n d i c a t e s t h a t t h e g e n e e x p r e s s i o n t r e n d c o n t a i n e d i n t h e m o d u l e i s s i m i l a r ;T h e t r e n do fw h i t eb a c k g r o u n dm o d u l e i sn o t s i g n i f i c a n t (P >0.05)图4 大型迪庆藏猪背最长肌S T E M 分析F i g .4 S T E Ma n a l y s i s o f l o n g i s s i m u s d o r s im u s c l e i n l a r g eD i q i n g T i b e t a n p i gs 1682中 国 畜 牧 兽 医49卷A ㊁B ,模块11㊁14的G O 功能和K E G G 通路富集图;C ㊁D ,模块9及10的G O 功能和KE G G 通路富集图Aa n dB ,G Of u n c t i o na n dK E G G p a t h w a y e n r i c h m e n t h i s t o g r a m s o fm o d u l e 11a n d14,r e s p e c t i v e l y ;Ca n dD ,G Of u n c t i o na n d K E G G p a t h w a y e n r i c h m e n t h i s t o g r a m s o fm o d u l e 9a n d10,r e s p e c t i v e l y图5 大型迪庆藏猪背最长肌差异表达基因显著富集模块G O 功能和K E G G 通路富集分析图F i g .5G Of u n c t i o na n dK E G G p a t h w a y e n r i c h m e n t h i s t o g r a m s o f d i f f e r e n t i a l l y e x p r e s s e d g e n e s o f s i g n i f i c a n t e n r i c h m e n tm o d u l e s i n l o n g i s s i m u s d o r s im u s c l e o f l a r g eD i q i n g T i b e t a n p i gs 2.6 不同体重阶段大型迪庆藏猪背最长肌差异表达基因互作网络2.6.1 S 1v s S 2 选择S 1v s S 2阶段显著富集通路中的基因绘制网络图,结果见图6㊂由图6可知,转录激活因子3(a c t i v a t i n g t r a n s c r i pt i o nf a c t o r3,A T F 3)㊁核受体亚家族4A 组成员3(n u c l e a rr e c e p t o r s u b f a m i l y 4g r o u p A m e m b e r3,N R 4A 3/N O R -1)㊁AM P 激活蛋白激酶γ2调节亚单位(p r o t e i n k i n a s e A M P -a c t i v a t e d n o n -c a t a l yt i cs u b u n i t g a m m a 2,P R K A G 2)㊁早期生长应答因子1(e a r l y g r o w t hr e s po n s e1,E G R 1)㊁早期生长应答因子2(e a r l yg r o w t h r e s p o n s e2,E G R 2)基因位于网络核心,其中A T F 3㊁N O R -1㊁P R K A G 2基因表达上调,A T F 3基因与脂联素表达有关,N O R -1和P R K A G 2基因会影响胰岛素敏感性;E G R 1㊁E G R 2基因表达下调,这2个基因与脂质代谢㊁脂肪生成有关㊂26828期聂靖茹等:大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析图6 S 1v s S 2阶段差异表达基因互作网络F i g .6 I n t e r a c t i o n n e t w o r k d i a g r a mo f d i f f e r e n t i a l l y e x p r e s s e d g e n e s a t S 1v s S 2s t a ge 2.6.2 S 2v s S 3 选择S 2v s S 3阶段显著富集通路中的基因绘制网络图,结果见图7㊂由图7可知,过氧化物酶体增殖物激活受体δ(pe r o x i s o m e p r o l if e r a t o r a c t i v a t e d r e c e p t o r d e l t a ,P P A R D )㊁丙酮酸脱氢酶激酶(p y r u v a t ed e h y d r og e n a s ek i n a s e4,P D K 4)㊁叉头盒O 1(f o r kh e a db o xO 1,F O X O 1)㊁过氧化物酶体增殖激活受体γ辅激活因子1α(pe r o x i s o m e p r o l if e r a t i v ea c t i v a t e dr e c e p t o r ,ga m m a ,c o a c t i v a t o r 1a l p h a ,P P A R G C 1A /P P A R G C -1)㊁A T F 3㊁信号转导和转录激活因子1(s i gn a l t r a n s d u c e r a n da c t i v a t o r o f t r a n s c r i p t i o n 1,S T A T1)㊁脂肪酶E (l i pa s eE ,L I P E )基因位于网络中心,其中,L I P E ㊁A T F 3基因表达上调,L I P E 基因参与抗脂分解㊁脂质稳态等过程,A T F 3基因可调控脂联素表达;P P A R D ㊁P D K 4㊁F O X O 1㊁P P A R G C -1㊁S T A T 1基因表达下调,P P A R D 基因在脂肪代谢中发挥作用,P D K 4和F O X O 1基因可相互作用影响葡萄糖摄取及游离脂肪酸含量,P P A R G C -1基因在脂肪储存中起调控作用,S T A T 1基因可在脂肪细胞分化过程中起作用㊂2.6.3 S 1v s S 3 选择S 1v s S 3阶段显著富集通路中的基因绘制基因网络图,结果见图8㊂由图8可知,A T F 3㊁N O R -1㊁E G R 1㊁E G R 2㊁S T A T 1基因位于网络中心,其中,A T F 3㊁N O R -1基因表达上调,A T F 3基因可调控脂联素表达,N O R -1基因影响胰岛素敏感性;E G R 1㊁E G R 2㊁S T A T 1基因表达下调,E G R 1㊁E G R 2基因影响脂质代谢,S T A T 1基因与脂肪细胞分化有关㊂图7 S 2v s S 3阶段差异表达基因互作网络F i g .7 I n t e r a c t i o n n e t w o r k d i a g r a mo f d i f f e r e n t i a l l y e x p r e s s e d g e n e s a t S 2v s S 3s t a ge 图8 S 1v s S 3阶段差异表达基因互作网络F i g .8 I n t e r a c t i o n n e t w o r k d i a g r a mo f d i f f e r e n t i a l l y e x p r e s s e d g e n e s a t S 1v s S 3s t a ge 2.7 大型迪庆藏猪背最长肌脂肪沉积差异表达基因实时荧光定量验证随机挑选了E G R 1㊁F O X O 1等10个差异表达基因进行实时荧光定量P C R 验证,E G R 1㊁F O X O 1㊁P D K 4㊁P P A R D ㊁P P A R G C -1㊁S T A T 1基因表达下调,A T F 3㊁L I P E ㊁N O R -1㊁P R K A G 2基因表达上调,与R N A -S e q 结果一致(图9)㊂3682中 国 畜 牧 兽 医49卷图9 大型迪庆藏猪背最长肌差异表达基因实时荧光定量P C R 验证结果F i g .9 R e a l -t i m e q u a n t i t a t i v eP C Rv e r i f i c a t i o n r e s u l t s o f d i f f e r e n t i a l l y e x p r e s s e d g e n e s i n l o n g i s s i m u s d o r s im u s c l e o f l a r g eD i q i n g T i b e t a n p i gs 3 讨 论3.1 大型迪庆藏猪S 1v s S 2背最长肌脂肪沉积差异表达基因大型迪庆藏猪40k g v s 80k g 阶段,A T F 3㊁N O R -1㊁P R K A G 2基因表达上调,E G R 1㊁E G R 2基因表达下调㊂A T F 3㊁N O R -1和P R K A G 2基因均在胰岛素抵抗信号通路中富集,当诱发胰岛素抵抗时,脂肪细胞㊁肌肉细胞对正常浓度的胰岛素反应不足,使得胰岛素作用的敏感性降低,促进葡萄糖摄取和利用效率下降,能量摄入过多[19],脂肪分解减少[20]㊂而脂联素能够激活腺苷酸活化蛋白激酶(AM P -a c t i v a t e d p r o t e i nk i n a s e ,AM P K ),减少丙二酰辅酶A 生成,促使脂肪酸进入线粒体得到氧化[21]㊂当发生脂联素抵抗时,脂联素对AM P K 的刺激减弱,骨骼肌中脂肪酸氧化的作用减弱,从而促进胰岛素抵抗[22]㊂A T F 3基因是脂联素基因表达的负调节因子,脂联素基因低表达会导致肥胖和胰岛素抵抗[23]㊂N O R -1基因在骨骼肌和脂肪组织中大量表达,参与肌内脂肪形成[24],N O R -1基因过度表达会导致循环儿茶酚胺浓度降低,引起胰岛素敏感性降低[25],导致脂肪分解减少,脂肪沉积增加[20]㊂P R K A G 2基因编码AM P 活化蛋白激酶γ2亚单位,该基因上调导致AM P K 活性增加,糖原合成激活㊁葡萄糖摄取增加,诱发胰岛素抵抗,脂肪沉积增多[26]㊂本试验中,A T F 3基因表达上调,引起脂联素基因下调,可能导致脂肪含量增加;N O R -1基因上调引起胰岛素敏感性降低,导致脂肪分解减少;P R K A G 2基因上调导致糖原合成激活㊁葡萄糖摄取增加,脂肪沉积增多㊂E G R 1和E G R 2基因属于早期生长反应因子家族,与脂质代谢㊁脂肪生成㊁胰岛素及胆固醇生物合成有关,在脂肪细胞分化信号通路中富集㊂E G R 1基因是3T 3-L 1脂肪细胞分化的负调节因子,敲除E G R 1基因能增强脂肪细胞分化[27]㊂E G R 2基因是脂肪细胞分化负调节因子m i R -224-5p 的直接靶点,m i R -224-5p 在早期脂肪形成中调节EG R 2基因表达[28]㊂本试验中,E G R 1和E G R 2基因表达下调,可能促进脂肪细胞分化和脂肪形成㊂3.2 大型迪庆藏猪S 2v s S 3背最长肌脂肪沉积差异表达基因大型迪庆藏猪80k g v s 120k g 阶段,L I P E ㊁A T F 3基因表达上调,P P A R D ㊁P D K 4㊁F O X O 1㊁P P A R G C -1㊁S T A T 1基因表达下调㊂L I P E 和A T F 3基因均富集到葡萄糖稳态信号通路中,影响肌肉组织对葡萄糖的吸收与利用及脂肪组织对胰岛素的敏感性[29]㊂L I P E 基因参与游离脂肪酸的动员[30]㊁抗脂分解及脂质稳态,导致高肌内脂肪含量[31]㊂A T F 3基因通过负调控脂联素基因而引起肥胖和胰岛素抵抗[23]㊂本试验中,L I P E 基因表达上调可能减少脂肪分解㊁提高肌内脂肪含量,A T F 3基因表达上调可引起脂联素基因表达下调,可能导致肌内脂肪含量增加㊂P P A R D 基因在W n t 和P P A R 信号通路中富集,参与脂肪代谢㊁能量调控,进而影响脂肪细胞的分化[32]㊂研究发现,W n t 信号通路能够调节脂肪沉积[33],同时能维持前脂肪细胞向脂肪成熟细胞分化的状态,W n t 信号通路减弱时,可分化大量脂肪细胞[34]㊂P P A R D 基因是胰岛素敏感和脂肪代谢的关键调节因子,在脂肪代谢中发挥作用,主要参与脂肪酸分解[35],增强脂肪酸运输㊁氧化㊁能量解偶联㊁线粒体呼吸㊁产热等相关基因的转录[36],上调脂肪酸氧化相关基因,降低体重㊁脂滴数量和脂滴大46828期聂靖茹等:大型迪庆藏猪不同生长阶段肌内脂肪沉积差异表达基因及其调控通路分析小[35]㊂猪P P A R D基因定位在7号染色体一个脂肪沉积的数量性状基因座(q u a n t i t a t i v e t r a i t l o c u s, Q T L)附近,可促进胆固醇和血清高密度脂蛋白积累[37]㊂P D K4㊁F O X O1㊁P P A R G C-1㊁S T A T1基因均在葡萄糖稳态㊁胰岛素受体及胰岛素信号通路过程中富集,通过影响脂联素及胰岛素作用的敏感性,进而影响葡萄糖摄取和利用效率及能量代谢,从而影响肌内脂肪含量㊂F O X O1基因会对脂联素受体的表达及脂联素敏感性的调节产生影响[38],同时F O X O1基因在调节胰岛素信号转导的糖异生和糖原分解中发挥重要作用,通过抑制细胞周期蛋白依赖激酶而阻止脂肪生成转录因子表达[39],在终末分化开始时,F O X O1基因被激活并转移到前脂肪细胞的细胞核,与P P A R G基因的启动子结合,导致有丝分裂后细胞生长停滞,负调控脂肪生成[40]㊂此外,F O X O1与P D K4基因的启动子区结合,增加肌肉中P D K4基因m R N A的表达[41],减少丙酮酸脱氢酶复合物(p y r u v a t e d e h y d r o g e n a s e c o m p l e x, P D C)通量,减弱碳水化合物氧化和葡萄糖摄取,并减少游离脂肪酸[42]㊂P P A R G C-1是一种转录共激活因子,可调控能量代谢,在米色和棕色脂肪组织中对脂肪代谢㊁脂肪细胞增殖㊁脂肪储存起重要调控作用[43],脂肪组织中缺乏P P A R G C-1基因的小鼠会产生胰岛素抵抗[44]㊂S T A T1基因位于P P A R G基因下游,在脂肪细胞分化中通过级联调节负调控脂肪形成[45]㊂本试验中,P P A R D㊁F O X O1㊁P P A R G C-1㊁S T A T1㊁P D K4基因表达下调, P P A R D基因表达下调可能使脂肪酸运输㊁氧化等相关基因的转录下调,脂肪酸分解减少㊁脂肪酸积累增多㊁脂滴变大㊂F O X O1基因表达下调导致与P P A R G基因的启动子结合减少,脂肪生成增多;另外,F O X O1与P D K4基因的启动子结合减少,葡萄糖摄取增加,游离脂肪酸增多㊂P P A R G C-1基因表达下调可能使骨骼肌对胰岛素的敏感性降低,肌内脂肪含量增加㊂S T A T1基因位于P P A R G基因下游,P P A R G基因通过级联调控引起S T A T1基因表达下调,促进脂肪生成㊂3.3大型迪庆藏猪S1v s S3背最长肌脂肪沉积差异表达基因大型迪庆藏猪40k g v s120k g阶段,A T F3㊁N O R-1基因表达上调,S T A T1㊁E G R1㊁E G R2基因表达下调㊂A T F3和N O R-1基因富集到胰岛素信号通路中,通过影响肌肉组织和脂肪组织中胰岛素敏感性来影响葡萄糖摄取及能量代谢效率,增加肌内脂肪含量[19-20]㊂S T A T1基因在能量稳态㊁胰岛素抵抗信号通路中富集,通过级联调节负调控脂肪形成[45]㊂E G R1㊁E G R2基因属于立早基因(i m m e d i a t e e a r l yg e n e s,I E G s),参与细胞生长㊁分化,富集到脂肪细胞分化信号通路㊂E G R1和E G R2为脂肪细胞分化的负调节因子[27-28],其表达下调促进脂肪形成㊂4结论A T F3㊁N O R-1㊁P R K A G2㊁E G R1㊁E G R2㊁L I P E㊁P P A R D㊁P D K4㊁F O X O1㊁P P A R G C-1㊁S T A T1作为核心基因调控大型迪庆藏猪肌内脂肪沉积;不同生长阶段参与调控的核心基因并不完全相同,40k g v s80k g阶段,A T F3㊁N O R-1㊁P R K A G2基因表达上调,E G R1㊁E G R2基因表达下调;80k g v s 120k g阶段,L I P E㊁A T F3表达上调,P P A R D㊁P D K4㊁F O X O1㊁P P A R G C-1㊁S T A T1基因表达下调;40k g v s120k g阶段,A T F3㊁N O R-1基因表达上调,E G R1㊁E G R2㊁S T A T1基因表达下调㊂参考文献(R e f e r e n c e s):[1] WO O DJ D,E N S E R M,F I S H E R A V,e ta l.F a td e p o s i t i o n,f a t t y a c i dc o m p o s i t i o na n dm e a t q u a l i t y:Ar e v i e w[J].M e a t S c i e n c e,2008,78:343-358. [2]李明洲,李学伟,朱砺,等.脂肪型和瘦肉型猪肌肉生长和脂肪沉积相关基因的差异表达分析和调控网络构建[J].自然科学进展,2008,18(2):134-144.L IM Z,L IX W,Z HUL,e t a l.D i f f e r e n t i a l e x p r e s s i o na n a l y s i s a n d r e g u l a t o r y n e t w o r k c o n s t r u c t i o n f o rg e n e sa s s o c i a t e d w i t h m u s c l e g r o w t h a n d a d i p o s ed e p o s i t i o n i n o b e s e a n d l e a n p i g s[J].P r o c e s si nN a t u r a lS c i e n c e,2008,18(2):134-144.(i nC h i n e s e) [3] WO O D R J.V i t a m i n D a n d a d i p o g e n e s i s:N e wm o l e c u l a r i n s i g h t s[J].N u t r i t i o n R e v i e w s,2008,66(1):40-46.[4] T A N G Q Q,J I A N G M S,L A N E M D.R e p r e s s i v ee f f e c t o f S p1o nt h e C/E B Pαg e n e p r o m o t e r:R o l e i na d i p o c y t ed i f f e r e n t i a t i o n[J].M o l e c u l a ra n d C e l l u l a rB i o l o g y,2012,19(7):4855-4865.[5] HU A N G W L,Z HA N G X X,L IA,e ta l.G e n o m e-w i d e a n a l y s i so fm R N A sa n d l n c R N A so f i n t r a m u s c u l a rf a tr e l a t e dt ol i p i d m e t a b o l i s m i nt w o p ig b r e e d s[J].C e l l u l a rP h y s i o l o g y a n dB i o c h e m i s t r y,2018,50(6):2406-2422.5682中国畜牧兽医49卷[6] X I N G K,WA N G K J,A O H,e ta l.C o m p a r a t i v ea d i p o s e t r a n s c r i p t o m ea n a l y s i sd i g so u t g e n e sr e l a t e dt of a t d e p o s i t i o ni n t w o p i g b r e e d s[J].S c i e n t i f i cR e p o r t s,2019,9(1):12925.[7] A N A V,L U I S N J,N A T A C HA P R,e t a l.C o m p a r a t i v e t r a n s c r i p t o m e p r o f i l e b e t w e e n I b e r i a n p i gv a r i e t i e s p r o v i d e sn e wi n s i g h t s i n t ot h e i rd i s t i n c t f a td e p o s i t i o na n d f a t t y a c i d s c o n t e n t[J].A n i m a l s,2021,11(3):627.[8]云南省畜牧局,云南省家畜家禽品种志编写委员会.云南省家畜家禽品种志[M].昆明:云南科技出版社,1987.A N I MA L HU SB A N D R Y B U R E A U O F Y U N N A NP R O V I N C E,C OM P I L A T I O N C OMM I T T E E O FL I V E S T O C K A N D P O U L T R Y B R E E D S O FY U N N A N P R O V I N C E.S p e c i e s o f L i v e s t o c k a n dP o u l t r y i n Y u n n a n P r o v i n c e[M].K u n m i n g:Y u n n a nS c i e n c e a n dT e c h n o l o g y P r e s s,1987.(i nC h i n e s e) [9] Y A N GS L,Z H A N G H,M A O H M,e ta l.T h el o c a lo r i g i n o f t h eT i b e t a n p i g a n da d d i t i o n a l i n s i g h t s i n t o t h eo r i g i n o fA s i a n p i g s[J].P L o SO n e,2011,6(12):e28215.[10]李相运,任战军,常洪.迪庆藏猪的遗传多样性研究[J].生物多样性,2000,8(3):253-256.L IX Y,R E N ZJ,C HA N G H.G e n e t i cd i v e r s i t y o fD i q i n g-T i b e t a n p i g o fY u n n a n[J].C h i n e s eB i o d i v e r s i t y,2000,8(3):253-256.(i nC h i n e s e)[11]李相运,常洪.合作猪㊁迪庆藏猪和成华猪的血清运铁蛋白多型性[J].甘肃农业大学学报,2000,35(2):194-196.L IX Y,C HA N G H.T r a n s f e r r i n p o l y m o r p h i s m o fH e z u o p i g a n dD i q i n g-T i b e t a n p i g a n dC h e n g h u a p i g i nC h i n a[J].J o u r n a lo f G a n s u A g r i c u l t u r a l U n i v e r s i t y,2000,35(2):194-196.(i nC h i n e s e)[12]方晨,胡瑞举,杨明华,等.迪庆藏猪F U T1基因遗传变异分析[J].中国畜牧杂志,2020,56(12):29-35.F A NG C,HU R J,Y A N G M H,e t a l.G e n e t i cv a r i a t i o na n a l y s i so f F U T1g e n ei n D i q i n g T i b e t a np i g[J].C h i n e s eJ o u r n a lo f A n i m a l S c i e n c e,2020,56(12):29-35.(i nC h i n e s e)[13] WU DD,Y A N GCP,WA N G M S,e t a l.C o n v e r g e n tg e n o m i c s i g n a t u r e so fh i g h-a l t i t u d ea d a p t a t i o na m o n gd o me s t i c m a m m a l s[J].N a t i o n a l S c i e n c e R e v i e w,2020,7(6):952-963.[14]严达伟,赵桂英,苟潇,等.迪庆藏猪肉质特性的研究[J].云南农业大学学报,2007,22(1):86-91.Y A N D W,Z H A O G Y,G O U X,e ta l.S t u d y o nc h a r a c t e r i s t i c s o fD i q i n g T i b e t a n p i g sm e a t q u a l i t y[J].J o u r n a lo f Y u n n a n A g r i c u l t u r a l U n i v e r s i t y,2007,22(1):86-91.(i nC h i n e s e)[15]马黎,聂靖茹,鲁绍雄,等.迪庆藏猪与野藏杂交猪肌肉全谱游离氨基酸味道强度值比较[J].中国畜牧兽医,2021,48(4):1275-1283.MA L,N I EJR,L U S X,e ta l.C o m p a r i s o no ft h et a s t e a c t i v i t y v a l u e o f f u l l s p e c t r u mf r e e a m i n o a c i d i nm u s c l e o fD i q i n g T i b e t a n p i g a n d W i l dB o a rˑD i q i n gT i b e t a n p i g[J].C h i n aA n i m a lH u s b a n d r y&V e t e r i n a r yM e d i c i n e,2021,48(4):1275-1283.(i nC h i n e s e) [16]马黎,张博,鲁绍雄,等.大型迪庆藏猪与野藏杂交猪肌肉全谱游离氨基酸比较[J].江西农业大学学报,2020,42(5):941-952.MAL,Z HA N GB,L U SX,e t a l.C o m p a r i s o no f f u l ls p e c t r u mf r e ea m i n oa c i di n m u s c l eo fl a r g e D i q i n gT i b e t a n p i g a n dh y b r i d W i l db o a rˑT i b e t a n p i g[J].A c t aA g r i c u l t u r a lU n i v e r s i t a t i sJ i a n g x i e n s i s,2020,42(5):941-952.(i nC h i n e s e)[17]刘韶娜,张斌,相德才,等.迪庆藏猪杂交后代生长性能及屠宰性能比较研究[J].江苏农业科学,2020,48(19):181-184.L I USN,Z HA N GB,X I A N GDC,e t a l.C o m p a r a t i v es t u d y o n g r o w t h p e r f o r m a n c e a n ds l a u g h t e r p e r f o r m a n c eo f D i q i n g T i b e t a n p i g h y b r i d o f f s p r i n g[J].J i a n g s uA g r i c u l t u r a l S c i e n c e s,2020,48(19):181-184.(i nC h i n e s e)[18]王志秀.基于转录组和蛋白组数据鉴定猪肌肉生长和脂肪沉积相关的基因[D].北京:中国农业大学,2017.WA N GZX.I d e n t i f i c a t i o no f g e n e s r e l a t e dt om u s c l eg r o w t ha n dl i p i dd e p o s i t i o nf r o mt r a n s c r i p t o m i ca n dp r o t e o m i c p r o f i l e s i n p i g[D].B e i j i n g:C h i n aA g r i c u l t u r a lU n i v e r s i t y,2017.(i nC h i n e s e)[19] L E B O V I T Z H E.I n s u l i nr e s i s t a n c e:D e f i n i t i o n a n dc o n s e q u e n c e s[J].E x p e r i m e n t a l a nd C l i n i c a lE n d o c r i n o l o g y&D i a b e t e s,2001,109(S u p p l2):S135-S148.[20] K I M J Y,N A S R A,T F A Y L I H,e ta l.I n c r e a s e dl i p o l y s i s,d i m i n i s h e d a d i p o s e t i s s u e i n s u l i n s e n s i t i v i t y,a n di m p a i r e db e t a-c e l lf u n c t i o n r e l a t i v et o ad i p o s et i s s u e i n s u l i n s e n s i t i v i t y i no b e s e y o u t hw i t h i m p a i r e dg l u c o s et o l e r a n c e[J].D i a b e t e s,2017,66(12):3085-3090.6682。
藏猪和大约克猪CKM基因多态性及表达差异分析

2021年34卷1期 西"农业学&Vo a-3433No-1SouthwestChonaJouenaaoeAgeocuatueaaScoences197文章编号:1001 -4829(2021)1 -0197 -05 DOI :10. 16213/j. cnki. scjas.2021. 1.029藏猪和大约克猪CKM基因多态性及表达差异分析巩兴龙S 段梦琪打张 健1,李雨晴S 张芳芳2,赵 雪1,强巴央宗打商 鹏1 *(1-西藏农牧学院动物科学学院,西藏林芝860000;2-黑龙江省大庆市杜尔伯特蒙古族自治县一心乡畜牧水产中心,黑龙江大庆163000)摘 要:!目的】本研究旨在探究猪CKM 基因的多态性及其mRNA 表达水平,通过对CKM 基因起始密码子上游3 kb 区域进行多态 性检测,发现了单核"Y 多态性位点C-1185T 和C-S324T ,且该位点符合哈迪-温&格定“(P <0.05 )… [方法】1用实时荧光定量PCR 技术对CKM 基因在藏猪和大约克猪不同组织的mRNA 表达量进行检测。
【结果"发现在同一品种猪种,CKM 基因的mR-NA 表达水平从高至低依次为背最长肌 >背脂>*脏组织,不同猪种内CKM 基因在•最长肌、•脂和*脏组织中存在差异表达,[•最长肌中,藏猪(TP )机显著高于大约克猪(YY )( P<0.01),在背脂中,大约克猪(YY )显著高于藏猪(TP )( P<0.05),在肝脏组织中,藏猪(TP)机显著高于大约克猪(YY )( P<0.01)。
【结论"推测CKM 基因与骨-肌的生长发育呈负相关。
本研究为下一 步?入'展CKM 基因功能研究奠定基1。
关键词:猪;CKM 基因;多态性;基因表达 中图分类号:S813.1文献标识码:APolymorphisms and Expression Differences of CKMGenes in Tifetan and Yordshirr PigsGONG Xing-long 1 % DUAN Meng-qi 1 % ZHANG Jian 1 % LI Yu-qing 1 % ZHANG Fang-fang 2 %ZHAO Xue 1 % CHAMBA Yangzom 1 % SHANG Peng 1 *(1 - Animal Science Col d ge % Tibet Ag/cu/ure & Animal Husbandy University % Tibet Linzhi 860000 % China ; 2- DulbeX Mongolian Auton omous County , Daqing City % Heilonaiang Province % Xinxiang Animal Husbandy and Aquatic Center % Heilongjiang Daqing 163000 % China )Abstract :' Objective ] The puyose of this study was to investigate the polymoyhism of the pig CKM gene and its mRNA expression dvef By detectongthepoaymoephosm on the3 kb eegoon upsteeam oethestaetcodon oethe CKM gene % songaenucaeotodepoaymoephosm s otes C-1185Tand C-1324T % and this site complies with Hardy-WeinbergerX Iaw (P <0. 05)-【MeTod ] Real-time quantitative PCR was used to detect the mRNA expression of CKM gene in diOexnt tissues of Tibetan pigs and Yorkshire pigs-【Result ] It was found that in the same breed of pigbreeds % the mRNA expression level of CKM gene in order Xrom tUe highest to Te lowest was the longest back muscle > back fat > lives tis sue % CKM genes in diOexnt pig breeds were diOexn/ally expressed in dngissimus dorsi muscle % back fat and lives tissues- In dngissimus doesomuscae % Tobetan pog ( TP ) wassognoeocantayhogheethan Yoekshoeepog ( YY ) ( P <0(01 ) % on back eat % Yoekshoeepogs ( YY ) weeesognoeocantayhogheethan Tobetan pogs ( TP ) ( P <0(05 ) % and on aoeeeto s ue % Tobetan pogs ( TP ) weeeexteemeaysognoeocantayhogheethan Yorkshire pigs (YY ) (P <0.01)-【Conclusion ] I- O speculated that there O a negative correlation between the CKM gene and the growthand development of skeletal muscle- This study lays Te foundation for further research on the function of CKM gene.【研究意义]动物产肉性能与肉品质一直以来都是广大育种工作者关注的热点,从分子水平研究猪肌肉组织生长发育调控机制将为育种工作提供新的突破口。
猪肌内脂肪沉积调控机制研究进展

11440卷第11肌内脂肪(Intramuscular Fat ,IMF )是指肌肉样品中通过化学方法提取的脂肪,是嵌入在猪肌肉纤维之间的脂肪组织,主要来源于脂肪细胞和肌细胞。
肌内脂肪是猪肉品质的重要指标,是影响猪肉品质的重要性状之一,与风味、多汁性、嫩度等密切相关,决定猪肉的品质和营养价值。
肌内脂肪含量较高时,猪肉具有更好的嫩度、多汁性和适口性。
十几年来,养猪生产中由于对较高瘦肉率和较低背膘厚的追求,商品猪肌内脂肪含量一直在下降。
胴体瘦肉率每提高一个百分点,肌内脂肪含量降低0.07%。
肌内脂肪的沉积受多种因素调控,不同品种猪在脂肪代谢相关酶活性、相关基因表达量等方面均存在较大差异。
通过改变日粮中能量、蛋白质以及脂肪酸比例,肌内脂肪也会受到不同程度的影响。
进一步研究发现,脂肪调控基因通过调控脂代谢与脂生成的过程调控肌内脂肪沉积的进程。
为了适应消费者对猪肉品质的需求,研究猪肌内脂肪沉积的相关机制,寻找提高肌内脂肪含量的策略,对优质猪肉的生产至关重要。
猪肌内脂肪沉积调控机制研究进展田紫金 1,3,李碧侠 1,2 *,吴 萍 3(1.江苏省农业科学院畜牧研究所,江苏 南京 210014;2.江苏省农业种质资源保护与利用平台,江苏 南京 210014;2.江苏科技大学蚕业研究所,江苏 镇江 212100)基金项目:国家生猪产业技术体系南京综合试验站项目(CARS-35);江苏省种业振兴揭榜挂帅项目(JBGS[2021]102);镇江市“1+1+N ”新型农业技术推广项目(ZJNJ[2022]02)第一作者:田紫金(1998—),女,研究生,研究方向为猪肉品质,E-mail :*通信作者:李碧侠(1979—),女,研究员,研究方向为猪遗传育种与生产, E-mail : 1 肌内脂肪与猪肉品质肌内脂肪含量可直接影响猪肉的大理石纹、嫩度、系水力、多汁性以及风味,是评价猪肉品质的重要指标,直接影响猪肉的感官接受度。
脂肪型和瘦肉型猪肌肉生长和脂肪沉积相关基因的差异表达分析和调控网络构建

关 键词
猪 肌肉生长 脂肪沉积 功能分类芯片 基因差异表达 基因调控网络
点 最终 反 应 了猪 的生 产 类 型[ . 目前 ,猪 肉 ( 括 】 ] 包 骨 骼肌 和脂 肪 ) 长 发 育 研 究 中 尚有 很 多 亟 待解 决 生 的问题 ,特 别是 猪 肉性 状 中具 有 重 要育 种意 义 的某
维普资讯
13 4
自翌科手遗展 第1卷 第2 20年2 . 8 期 0 8 月
*学 术论 文 *
脂 肪 型和 瘦 肉 型猪 肌 肉生 长 和 脂 肪 沉 积 相 关 基 因 的差 异 表 达 分 析 和 调 控 网络 构 建 *
李 明洲 李 学 伟 朱 砺 滕 晓坤 肖华胜 帅素 容 陈 磊 李 强 郭 玉姣
和 脂肪 细胞 在分 化 生长 相 对 速度 上 的竞争 ,其平 衡
2 0 —80 0 70 —2收 稿 ,2 0 —82 0 70 —7收 修 改 稿 * 教 育 部 长 江 学 者 和 创 新 团 队 发展 计 划 ( 准 号 :I 0 5 —) 教 育 部 高 等 学 校 博 士 学 科 点 专 项 基 金 ( 准 号 : 20 0 2 0 3 、 四 J 省 教 批 RT 5 56 、 批 06660 ) I l 育 厅 自然 科 学 重 点 科 研 项 目( 准 号 :2 0 D 0 ) 四 J 省 教 育厅 青 年基 金 ( 准号 :2 0 B 0 ) 助 项 目 批 06 04和 I l 批 06 04资
些 具体 生物 学 指标 的 分 子 遗 传 基 础 研 究 尤 为 欠 缺.
基于转录组测序的藏猪睾丸组织性成熟相关基因鉴定
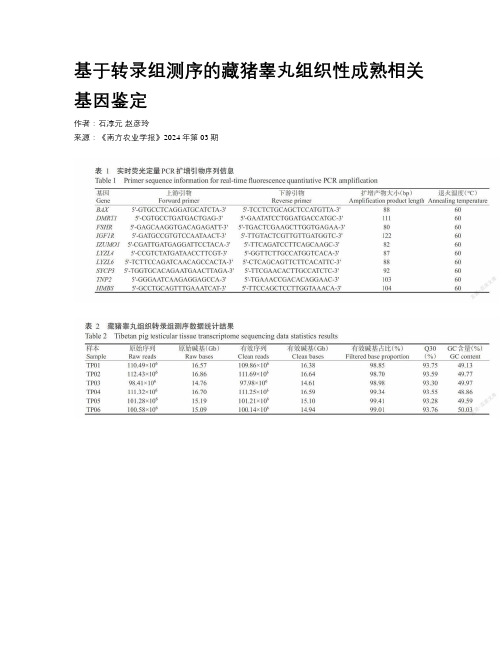
基于转录组测序的藏猪睾丸组织性成熟相关基因鉴定作者:石淳元赵彦玲来源:《南方农业学报》2024年第03期摘要:【目的】基于转录组测序分析筛选出藏猪睾丸组织中的性成熟相关基因,为提高藏猪的繁殖育种性能提供参考依据。
【方法】以性成熟前(2月龄)和性成熟后(24月龄)的藏公猪为研究对象,通过人工阉割法采集藏猪睾丸组织进行转录组测序,依据错误发现率(FDR)<0.05且logFold Change|>1的标准筛选差异表达基因(DEGs),综合GO功能注释分析和KEGG信号通路富集分析筛选出藏公猪性成熟相关候选基因,并通过实时荧光定量PCR验证转录组测序结果的准确性。
【结果】经转录组测序,从性成熟前后藏猪睾丸组织样品中筛选出5929个DEGs,其中有3822个DEGs呈上调表达、2107个DEGs呈下调表达。
筛选获得的5929个DEGs主要注释到生精过程、纤毛运动、鞭毛精子运动、运动纤毛、精子主块、精子顶囊、动力蛋白轻链结合、动态蛋白中间链结合等与精子发生和精子运动等有关的GO功能条目;KEGG信号通路富集分析发现,DEGs主要富集于受体相互作用通路、轴突引导通路、神经活性配体一受体相互作用通路、钙信号通路等;综合DEGs的GO功能注释分析和KEGG信号通路富集分析结果,共筛选出9个与藏公猪性成熟相关的基因,分别是BAX、DMRTI、FSHR、IGFIR、IZUMO1、LYZL4、LYZL6、SYCP3和TNP2。
实时荧光定量PCR 检测结果显示,BAX、DMRTI、FSHR、IGFIR等4个基因在性成熟后藏猪睾丸组织中的相对表达量较性成熟前呈明显的下降趋势,且下降幅度均在50%以上;IZUMO1、LYZL4、LYZL6、SYCP3、TNP2等5个基因的相对表达量较性成熟前上升了1.07~30.25倍,其中IZUMO1、LYZL4和LYZL6基因的上升倍數达极显著水平(P<0.01),与转录组测序结果基本一致。
猪肌内脂肪沉积的主效基因及其分子标记[发明专利]
![猪肌内脂肪沉积的主效基因及其分子标记[发明专利]](https://img.taocdn.com/s3/m/c7e20af488eb172ded630b1c59eef8c75fbf95ad.png)
[19]中华人民共和国国家知识产权局[12]发明专利申请公布说明书[11]公开号CN 101544979A [43]公开日2009年9月30日[21]申请号200910077822.9[22]申请日2009.01.22[21]申请号200910077822.9[71]申请人北京德宝群兴科技有限公司地址100193北京市海淀区圆明园西路2号[72]发明人尹靖东 李德发 马润林 [74]专利代理机构北京亿腾知识产权代理事务所代理人陈惠莲[51]Int.CI.C12N 15/12 (2006.01)C12N 15/11 (2006.01)C12Q 1/68 (2006.01)权利要求书 2 页 说明书 10 页 附图 1 页[54]发明名称猪肌内脂肪沉积的主效基因及其分子标记[57]摘要本发明提供了猪肌内脂肪沉积的主效基因及其分子标记,并公开了其在猪育种、制备与猪肌内脂肪沉积的基因诊断相关的产品中的应用。
以本发明为基础开发猪肌内脂肪沉积性状的基因诊断技术,建立肌内脂肪超级沉积的核心猪群,将使猪育种工作者能够在短时间内培育出高瘦肉率、高肌内脂肪含量的猪种。
200910077822.9权 利 要 求 书第1/2页 1、猪肌内脂肪沉积的主效基因,它由A、B、C三个等位基因组成,其中,等位基因A的碱基序列如SEQ ID NO:3所示,等位基因B的碱基序列如SEQ ID NO:4所示,等位基因C的碱基序列如SEQ ID NO:5所示。
2、根据权利要求1所述的等位基因A的分子标记,它包括如下7种形式:(1)、166位为G;(2)、168、169位为GG;(3)、172位为C;(4)、176位多一个A;(5)、180位为C;(6)、191位为G;(7)、调控序列S1和S2均表达,S1的碱基序列如SEQ ID NO:1所示,S2的碱基序列如SEQ ID NO:2所示;且以上7种情况均连锁。
3、根据权利要求1所述的等位基因B的分子标记,它包括如下7种形式:(1)、166位为A;(2)、168、169位为AA;(3)、172位为G;(4)、176位少一个A;(5)、180位为T;(6)、191位为C;(7)、调控序列S1缺失,S2表达,S1的碱基序列如SEQ ID NO:1所示,S2的碱基序列如SEQ ID NO:2所示;且以上7种情况均连锁。
浅谈猪体脂的沉积规律

浅谈猪体脂的沉积规律体脂有2个来源,即内源性合成和日粮脂肪的直接沉积。
猪的脂肪几乎全部都在脂肪组织中合成,碳水化合物、挥发性脂肪酸和氨基酸脱氨后的产物都可用于再合成脂肪酸,所合成的脂肪酸主要是棕榈酸和硬脂酸等饱和脂肪酸。
脂肪沉积在化学上就是脂类的不断积累、脂肪细胞的分化和肥大。
体内的3个主要脂肪贮存部位是外周脂肪组织(包括背膘和腹脂)、肝脏和肌肉,但各部位的脂质沉积能力是不同的。
皮下脂肪对脂类的沉积有优先权,然后是瘦肉组织和内脏组织的脂肪沉积。
骨骼中蛋白、脂肪的比例是恒定的,对体脂沉积率的改变不敏感。
脂肪沉积在其他部位(肌肉、器官、皮肤及皮下脂肪)的分配取决于脂肪沉积率,并受日粮组成的影响。
饲粮脂肪不仅影响胴体脂肪的数量而且影响脂肪酸的形成,从而影响猪肉品质。
在同一能量水平下,饲料中添加不同来源油脂并不会造成体脂的增加。
在等代谢能摄人条件下,每增加1 g消化脂肪可增加0.42g体脂肪,提高增重0.47g(杨凤,1993)。
在温暖环境中,添加脂肪的作用更明显。
有研究认为,脂肪的这种效应取决于脂肪酸的饱和程度,添加不饱和脂肪酸(如橄榄油、葵花油、亚麻油、豆油、深海鱼油等)可抑制体脂的合成。
也有研究表明,脂肪酸链的长度与不饱和程度影响了猪脂肪细胞的脂肪酸合成。
Sun等(2004)发现添加2.0%~4.0%共轭亚油酸(CLA )可以提高猪的眼肌面积和肌内脂肪含量,同时降低第10肋及最后肋背膘厚度。
Ostrowska等在生长猪的日粮中连续8周添加0.07%~0.5%共轭亚油酸(CLA),可提高猪的饲料转化率,降低脂肪沉积,提高瘦肉率。
不饱和脂肪酸对脂肪合成的抑制作用需在连续摄入不饱和脂肪酸时才能发生,CLA 降低脂肪沉积可能与其能抑制脂肪细胞分化、促进凋亡有关。
猪肉的脂肪酸组成在很大程度上受饲粮脂肪酸种类的影响,可通过添加不同油脂(不同脂肪酸)来调控体脂组成。
饲喂不饱和脂肪酸,可增加胴体不饱和脂肪酸的含量,提高猪肉的保健价值,但随着猪肉中不饱和脂肪酸的比例增加,猪胴体脂肪变软,脂肪氧化酸败程度增加,猪肉产生异味,猪肉品质下降。
基于全基因组重测序的藏猪脂质沉积相关基因鉴定

·325·优秀青年学者论坛张彦(1986-),博士,现为云南生猪产业前沿技术顶尖团队主要成员,近期重点开展地方猪杂交组合筛选及功能基因挖掘、地方猪性别分选精子差异蛋白筛查等研究工作。
主持国家重点研发计划项目子课题“肉用山羊种畜场疫病防控技术示范基地建设”、云南省青年科学基金项目“云南地方猪性别分选精子差异表达蛋白鉴定与分析”,作为主要成员参与国家自然科学基金项目“膜穿透性海藻糖在猪卵母细胞玻璃化冷冻中的保护作用及机制研究”、云南省重大科技专项“云南地方家畜(猪、羊)种质资源开发平台建设及成果转化”等省部级以上科研项目5项;在《Journal of Proteomics 》《中国畜牧杂志》《南方农业学报》等国内外期刊发表学术论文10余篇;获授权发明专利4项、实用新型专利10项;参与制定地方标准4项。
收稿日期:2022-09-07基金项目:云南省重大科技专项(202102AE090039);云南省基础研究计划面上项目(202101AT070061)通讯作者:熊和丽(1981-),https:///0000-0003-0041-7992,博士,副研究员,主要从事猪遗传育种研究工作,E-mail :149895846@第一作者:张彦(1986-),https:///0000-0002-6733-3534,博士,主要从事地方猪遗传育种与繁殖研究工作,E-mail :2013903654@基于全基因组重测序的藏猪脂质沉积相关基因鉴定张彦,熊和丽*,张斌,相德才,刘韶娜,赵智勇(云南省畜牧兽医科学院养猪与动物营养研究所,云南昆明650024)摘要:【目的】从全基因组水平解析藏猪与大白猪间的遗传差异,并鉴定出与藏猪脂质沉积相关的基因,为藏猪优质肉质特征的利用及新品种培育提供理论参考。
【方法】选用5份自测云南迪庆藏猪的全基因组重测序数据,以及NCBI 数据库中来自西藏、四川、甘肃地区34份藏猪和具有低脂肪沉积特征的14份大白猪全基因组重测序数据,获得全基因组SNP 后以VCFtools 进行选择信号检测,采用VCFtools 分别计算候选SNP 在藏猪和大白猪中的等位基因频率,再利用自编Python 脚本及所有SNP 注释文件进行注释以确定候选基因,最后运用DA VID 对候选基因进行GO 功能注释和KEGG 信号通路富集分析,进一步鉴定与脂质沉积相关的功能基因。
15022241_MYNN基因在猪不同组织及肌肉中的表达规律

!"#$%&$#'%()*+,%$-./ 0 1232.#$%./ 42-#5#$2
"#$%&'%()*%+',-.$'%(/%!/0*('0&%/'%&'&%B
?@AA 基因在猪不同组织及肌肉中的表达规律
李 萌 靳 玉 舒 张 旗 成 志 敏 张 宁 芳 乐 宝 玉 高 鹏 飞 曹 果 清 李 步 高 郭 晓 红
!;((2?2;<&$#'%(85#2$52%$-1232.#$%./ 42-#5#$28"%$C#&?.#5*(3*.%(L$#G2.+#3/B%#?*&*&B&%!"#$%
9>864076DS$7748"5Y373$O6"4#$-[674$T3464S66RH9677$#-,S393,469$74$,7#2O5#-689$- Af! @@T6-6$-"$22696-44$778673-"$47"6[6P#HO6-43P6RH9677$#-$-O87,P67P#-T$77$O87"#97$G$! ,6H726O#9$73-"H7#37 O3+#9,696G6PP8OP$[69H3-,9637.$"-6574#O3,S7HP66-3-"P8-T 4$77867#2H$T7'DS66RH9677$#-,S393,469$74$,7#2Af@@ OC@;$-%%"$22696-44$77867$-,P8"$-T S6394P$[697HP66-P8-T.$"-65,696G6PP8O7O3PP$-4674$-6H3-,963774#O3,SG$,6H726O#! 9$73-"234#2U39T6 dS$46H$T73-" A37S6-H$T7344S63T6#2I&"3573-"4S6"6[6P#HO6-43P6R! H9677$#-H34469-7$-O87,P6,696G6PP8OP$[69H3-,9637.$"-6574#O3,S7HP66-344S9667493T! 67%I&%B&"357#2U39T6 dS$46H$T73-" A37S6-H$T7Y696748"$6"G5C63P!4$O6EFC'DS6 9678P477S#Y6"4S34Af@@ Y37Y$"6P56RH96776"$-[39$#874$77867#2H$T73-"4S696Y377$T-$2$! ,3-4"$22696-,63O#-T4S64$77867K&'&1K&'&%DS66RH9677$#-#2Af@@$-O87,P6P$[! 69H3-,9637,696G6PP8O.$"-6574#O3,S7HP66-P8-T4$77867 Y6967$T-$2$,3-4"$22696-,634 4S966"6[6P#HO6-4743T67#2U39T6 dS$46H$T73-" A37S6-H$T7K&'&1K&'&%3-"3P7# S3"37H6,$2$,98P6YS$,S$-"$,346"4S34$4O35HP353-$OH#943-49#P6$-4S676H$T4$77867'DS6 6RH9677$#-#24QEE T6-6,#8P"96P346"4#4S64$77863T63-"4S6T6-64$,G3,.T9#8-"#2G966"7' DS69678P47#24S$7748"5H9#[$"6"3G644698-"69743-"$-T#24S6G$#P#T$,3P28-,4$#-7#2H$T Af! @@':894S69748"$6739696Q8$96"4#"6469O$-6$47O#P6,8P39O6,S3-$7O767H6,$3PP5$-4S696T8P3! 4$#-#27.6P643PO87,P6"6[6P#HO6-4'
miR-222在藏猪和DLY猪背最长肌和腰大肌中的表达差异研究

116猪业科学 SWINE INDUSTRY SCIENCE 2018年35卷第10期遗传改良GENETIC IMPROVEMENT北京顺鑫农业小店种猪分公司协办miR-222在藏猪和DLY猪背最长肌和腰大肌中的表达差异研究郑 婷1,甘麦邻1,李 强2,钟志君3,张顺华1*,朱 砺1*(1.四川农业大学动物科技学院,四川 成都 611130;2.四川省畜牧总站,四川 成都 610041;3. 四川省畜牧科学研究院,四川 成都 610066)摘 要:为了探究miR﹣222在藏猪和DLY 猪背最长肌和腰大肌中的差异表达情况,试验选用雌性藏猪和DLY 猪各6头,采用RT﹣PCR 法检测miR﹣222和PGC1α在背最长肌和腰大肌中的表达情况。
结果表明,在藏猪和DLY 猪中miR﹣222在背最长肌的表达量均显著(P <0.05)高于腰大肌,而藏猪和DLY 猪背最长肌的PGC1α表达量均显著(P <0.05)低于腰大肌。
miR﹣222在猪背最长肌和腰大肌的表达特性,提示miR﹣222与猪的肌肉发育特性有关。
关键词:miR-222;PGC1α;猪;背最长肌;腰大肌基金项目:四川省科技支撑计划项目(16ZC2838;2016NZ0089),四川省畜牧科学研究院开发基金项目(SASA2017A01)资助通讯作者:张顺华(1974-),女,四川德阳人,博士,硕士生导师,研究方向:猪的遗传育种。
E-mail :363445986@朱砺(1975-),男,四川广元人,教授,博士生导师,研究方向:猪的遗传育种。
E-mail :zhuli7508@动物肌肉组织是人类主要的蛋白质来源之一,对于农场动物,尤其是肉用家畜来说,产肉是最重要的经济性状之一,动物骨骼肌的发育情况直接决定了其产肉能力和肉品质。
脊椎动物的骨骼肌细胞是一种经过复杂的分化过程形成的具有收缩功能的多核细胞。
在动物胚胎发育的过程中,来自中胚层的祖细胞首先进行增殖,随后退出细胞周期在生肌调节因子(myogenic regulatory factors, MRFs)的驱动下分化、融合成肌管,最终形成肌纤维[1-2]。
猪脂肪组织发育和体脂沉积的神经内分泌及免疫调控

2016年第11期随着现代社会的发展,人们的生活质量不断提高,这样导致了肥胖人数的不断增加。
这也同时对畜牧养殖业的发展提出了更高的要求,需要养殖出脂肪率更低、瘦肉率更高的生猪。
对此,近年来对猪的脂肪组织发育研究已逐渐得到农业研究部门的重视。
通过研究发现,猪的脂肪组织发育要经过一个很复杂的过程,这一过程中,猪的神经分泌系统和免疫调控组织也会参与其中。
本文对这一过程进行了研究。
1猪的脂肪组织发育在机体中,脂肪的主要作用是储存或者释放能量。
相关研究发现脂肪主要是由脂肪细胞构成的,另外有10%~25%的水分和蛋白质。
根据所含有的脂类的不同,可以将猪脂肪分为三种,分别是分泌脂肪、目标脂肪和沉积脂肪。
猪的脂肪组织的生长发育大体上可以分为两个方面,一方面是脂肪细胞的增殖,一方面是脂肪细胞的增大。
导致脂肪细胞体积和质量都迅速增加的主要物质是甘油三酯的含量不断增高造成的。
在机体需要能量时,脂肪会将自身中的能量进行释放,满足机体对能量的需求,因此在机体的能量调节中发挥着重要的作用,比如在机体的膀胱组织中能量的调节。
同时脂肪还会分泌出大量的活性物质,对于细胞的代谢会产生重要的作用。
这推翻了过去人们认为脂肪是一种不活跃的物质的观点。
在脂肪细胞的发育过程中,多种因素和生长因子,如IGF-1、CAMMP 以及糖皮质激素等都会对细胞的分化产生重要的影响。
随着脂肪细胞的发育,最终会到达凋亡环节,也即脂肪细胞的死亡。
在这一过程中同样也有许多未知参与进来,比如Leptin 可以对下丘脑进行作用,通过激发信号系统诱导细胞凋亡。
而肿瘤坏死因子(TNF-α)对于脂肪细胞的溶解也会发生很大的促进作用。
在这些因素的作用下,脂肪细胞最终启动凋亡程序。
2体脂沉积神经内分泌的生长激素和胰岛素调节通过对猪脂肪组织发育的研究发现,生长激素(GH )可以对猪的脂肪组织发育进行调节,脂肪组织也是GH 的主要靶器官。
GH 主要是通过胰岛素生长因子(IGF-1)对脂肪组织进行发育调节的,而且该生长因子也是促进细胞增殖的一种广泛的必需物质。
生长激素基因在西藏小型猪不同生长阶段和不同组织器官中的表达

生长激素基因在西藏小型猪不同生长阶段和不同组织器官中的表达田雨光;王玉珏;岳敏【摘要】Objective To study the expression of Growth Hormone ( GH) gene in different tissues and different growth stages of Tibet-minipigs.Methods The expression level of GH gene in heart, liver, spleen, lung, kidney, muscle, skin tissue of Tibet mini-pig was analyzed by Real-time PCR in 0 years old (1 days), 0.1 years old (36 days), 0.25 years old (90 days), 0.5 years old (180 days), 1 years old (360 days), 2 years old (720 days), and 3 years old (1080 days).Results The expressions of GH mRNA could be detected in various tissues (heart, liver, spleen, lung, kidney, muscle, skin) in different growth stages (0, 0.1, 0.25, 0.5, 1, 2, 3 years old) in Tibet mini-pigs.The GH gene was most highly expressed in skin in 0, 0.5 years old and most lowly expressed in muscle comparing with other tissues.Moreover, the GH gene was also most highly expressed in lung and liver in 0.25, 1 years old and0.1, 3 years old, respectively .The expression level of GH gene reached the peak in 0.1 years old among different growth stages . Conclusion The expression of GH gene in Tibet mini-pig showed an obvious temporal and spatial specificity .%目的:对西藏小型猪生长激素基因在不同脏器和不同年龄阶段的表达水平进行测定。
藏猪和杜洛克猪CAPN3基因表达差异及其与肉质性状相关性分析

藏猪和杜洛克猪CAPN3基因表达差异及其与肉质性状相关性分析陶璇;顾以韧;梁艳;杨雪梅;钟志君;陈晓晖;杨跃奎;曾凯;吕学斌【摘要】为了揭示脂肪型的藏猪和瘦肉型的杜洛克猪肌肉生长及嫩度相关基因的表达差异,采用QRT-PCR方法检测了两猪种背最长肌中钙蛋白酶3(CAPN3)基因在180日龄的表达差异,分析其表达与肌纤维面积(CSA)、肌肉剪切力的相关性.结果表明,180日龄藏猪CAPN3 mRNA表达量显著高于杜洛克猪(P<0.05).相关性分析结果显示,CAPN3 mRNA表达量与肌纤维面积、剪切力均呈显著负相关(P<0.05).以上结果初步揭示了两猪种在180日龄CAPN3基因表达的品种差异,为深入研究猪肌肉生长及剪切力的调控机制提供了基础数据.【期刊名称】《养猪》【年(卷),期】2016(000)004【总页数】3页(P76-78)【关键词】猪;背最长肌;荧光定量PCR;CAPN3基因;肌纤维面积;剪切力【作者】陶璇;顾以韧;梁艳;杨雪梅;钟志君;陈晓晖;杨跃奎;曾凯;吕学斌【作者单位】四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066;四川省畜牧科学研究院,四川成都610066;动物遗传育种四川省重点实验室,四川成都610066【正文语种】中文【中图分类】S828.8钙蛋白酶(Calpain,CAPN)是一种存在于细胞内的非溶酶体性的限制性蛋白水解酶,与肉的嫩度和风味等食用品质密切相关[1],是理想的肉质嫩度分子标记[2]。
与猪脂肪沉积相关的几个候选基因研究进展_凌飞

!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!性浆膜炎均有一定的防治效果,其中组方P优于组方Ⅱ,且预防组的效果优于治疗组;此外,组方Ⅰ(黄莲+黄岑+黄柏等6味)、组方Ⅱ和组方P均能促进鸭PBMC的转化,其中组方P还能促进鸭免疫器官的发育。
参考文献:[1]Bin Huang,Sumathi Subramaniam,Joachim Frey,et al.Vaccination of ducks with recombinant outer membrane protein(OmpA)and a41kDa partialprotein(P45N’)of Riemerella anatipestifer[J].Veterinary Microbiology,2002,84: 219-230.[2]Sandhu T S.Diseases of Poultry[C].Ames:Iowa State UniversityPress,2003:676-682.[3]吴华,李胜利,侯百枝,等.鸭疫里氏杆菌病药物防治研究进展[J].动物医学进展,2007,28(4):96-100.[4]张大丙,曲丰发,郑献进.鸭疫里默氏菌血清型的研究概况[J].中国兽医杂志,2006,12(11):38-40.[5]Pathanasophon P,Phuektes P,Tanticharoenyos T,et al.Apotentialnew serotype of Riemerella anatipestifer isolated from ducksin Thailand[J].J Avian Pathol,2002,31(3):267-270. [6]卢玉葵,张济培,陈建红,等.40种中草药对三株鸭疫里里默氏杆菌的体外抑菌试验[J].养禽与禽病防治,2006(6):18-20.[7]王嵩.中药抗细菌感染的研究[J].北京中医杂志,2002,21(4):249-251.[8]李曼玲.抗菌消炎中药的研究Ⅰ活性成分———有机酸类[J].中药通报,1986,11(6):57-60.[9]Kim H M,Moon E J,Li E,et al.The nitric oxide producingactivities of Scutellaria baicalensis[J].Toxicol,1999,135(2-3): 109-115.[10]管敏强,易礼胜.家禽饲料营养与免疫研究[J].饲料研究,2002(1):13.[11]Rivas A,Fabricant T.Indication of Immunodepression inchicken infected various strain of Marek’s diease virus[J].Avian Diease,1985,32:1-8.[12]黎德兵,崔恒敏,赵翠燕.鸭疫里默氏杆菌感染后雏鸭血清生化指标变化的研究[J].畜禽业,2007(11):26-27.[13]黎德兵,崔恒敏,章蕾.鸭疫里默氏杆菌病发病机理的研究Ⅰ人工感染雏鸭部分血液指标的动态变化[J].黑龙江畜牧兽医,2004(1):8-10.与猪脂肪沉积相关的几个候选基因研究进展凌飞1,2,李静2(1.华南理工大学生物科学与工程学院,广东广州510641;2.华南农业大学动物科学学院,广东广州510642)摘要:猪IGF2基因、CUP3基因、ADIPOQ基因、SCAP基因、PPARγ基因、POUIFI基因、GHRL基和Ob基因影响猪脂肪沉积。
关于猪肌内脂肪的研究进展

关于猪肌内脂肪的研究进展肌内脂肪含量是猪肉品质的主要决定因素之一。
通过改变肌内脂肪含量来改善猪肉品质是一条有效的途径。
肌内脂肪的沉积受遗传、营养、环境等许多因素影响,其中对基因和营养方面的研究较多,但环境和性别因素对肌内脂肪的沉积的影响的研究较少,而后者对肌内脂肪的含量有一定的影响。
文章对猪肌内脂肪调控的研究进展作简要综述,以期通过肌内脂肪调控来获得更高品质的猪肉产品,并且用于指导生产实际。
随着人们对猪肉品质要求的不断提高,安全优质猪肉生产成为养猪业亟需解决的重要问题,如何提高肉质已成为当今畜牧业的研究热点。
肌内脂肪含量是评定肌肉品质好坏的主要指标之一,然而,由于多年来国外猪种的大量引入,在片面追求生长性能和瘦肉率的同时却忽略了肌内脂肪含量这一重要的指标。
一般认为,肌内脂肪含量越低,肌肉的多汁性、嫩度、香味及总体可接受性越低。
肌内脂肪对猪肉品质的影响主要体现在嫩度、大理石纹、风味和多汁性上。
许多研究表明,肌内脂肪含量与肌肉的嫩度呈正相关。
因此,肌内脂肪调控的研究对改善肌肉风味以及提高肌肉食用价值方面等有重要意义一.肌内脂肪与肉品质的关系肌内脂肪含量与组成与猪肉的食用品质密切相关,可影响猪肉的嫩度、风味、肉色、系水力及大理石纹评分。
肌内脂肪含量的高低对肌肉嫩度有重要影响。
肌内脂肪含量增加,切断了肌纤维束间的交联结构,咀嚼过程中肌纤维也更容易断裂。
猪肉肌内脂肪的含量影响肌肉剪切力,肌内脂肪含量高,肌肉剪切力降低,嫩度增加,而且随着储存时间的增加影响程度也增加,在杜洛克猪中增加尤为明显。
肉的风味、多汁性随肌内脂肪含量的增加而持续改善,提高肌内脂肪含量使肉的嫩度和多汁性相应改进。
随着肌内脂肪含量的增加,肉的系水力提高且肉色逐渐变浅。
肌内脂肪含量不仅影响肌肉嫩度,还影响肌肉风味研究发现,杜洛克猪生长快、适应性强,肌内脂肪含量相对较高,口感较好。
肌内脂肪与肉品风味有很大的关系。
此外,肌内脂肪酸的组成及比例对风味物质影响也很大二.影响肌内脂肪沉积的因素:1 遗传因素对肌内脂肪的调控1.1 H-FABP 基因对肌内脂肪含量的影响H-FABP 基因主要在心脏、骨骼肌和泌乳的乳腺中表达,它的作用是将细胞膜外的脂肪酸运送到β-氧化和三酰甘油及磷脂合成的部位,H-FABP 在细胞内与脂肪酸结合,使细胞内外保持一定的浓度差,促使细胞摄取脂肪酸1.2 A-FABP 基因对肌内脂肪含量的影响A-FABP 全部在脂肪细胞中表达,其基因序列全长8 144 bp,包含2 370 bp 的5′上游区域和1 435 bp 的3′下游区域1.3 LPL 基因对肌内脂肪含量的影响脂蛋白脂肪酶(Lipoprotein Lipase)是影响动物及人体脂肪沉积的关键酶之一,它可以将血液中乳糜微粒和极低密度脂蛋白所携带的甘油三酯分解成甘油和脂肪酸,为脂肪组织提供合成甘油三酯所需的原料,从而促进脂肪沉积2 营养因素对肌内脂肪的调控2.1 饲粮能量水平对肌内脂肪含量的影响有关能量水平对肌内脂肪含量影响的研究报道较少。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ex r s i n p te n o e e a s c a e wih p e so a t r s f g n s s o i t d t m u c e r wt a s l g o h nd a i o e d p st n d r n g o h a d d v l p e o f m a e s a o ii u i g dp e mU o r w n a e o m nt f e wt t e l Ti e a i s b tn pg
L n — h u I Mi g Z o , L e W e , S I Xu — i HUAI S — n ZHU i L U iF n u Ro g , L , I Ha— e g ,
WANG Jn Y n 2 I i— o g ,JANG Z o g Ro g ,T NG Xio K n h n— n E பைடு நூலகம் a— u
李 明 洲。 李 学伟H 帅素 容 朱 砺 刘 海 峰 王 金 勇 蒋 忠荣
滕 晓坤
1 .四川 农 业 大 学 动 物 科 技 学 院 , 四川 雅 安 6 5 1 2 04
2 重 庆 市 畜 牧 科 学 研 究 院 ,重 庆 荣 昌 4 26 . 0 40 3 .四川 省 甘 孜 藏 族 自治 州 畜 牧 业 科 学 研究 所 ,四 川 康 定 660 200
1.Colgeo i lS in e a d Te hn lg l e fAnma ce c n c oo y。S c a rc lu a iest Ya’ a 6 5 4,Sc u n Prvn e,Chia ihu n Agiu trlUn v ri y, n 2 01 ih a o ic n 2.Ch n qig An ma o g n i lHus a dr n ttt Ro g h n 4 2 6 b n y I si e, u n c a g 0 4 0,Ch n qig,Chia og n n 3. I siue o i lHu ba d , Ga z b tn n ttt f Anma s n r y n e Tiea Autn mo s rfcu e fS e ua P o i c o o u P ee tr o ih n r vn e, Ka g ig n dn 6 6 0 2 0 0, Sc u n ih a
4.生 物 芯 片 上海 国 家工 程 研 究 中 心 , E海 2 10 023
摘 要
本 研 究 利 用 包 含 1 个 与 猪 肌 肉生 长 和 脂 肪 沉 积 密 切 相 关 基 因 的 O i 功 能 分 类 基 因 芯 片 检 测 了 藏 猪 在 0 4 lo g
2 、6和 8月 龄 间 背 最 长 肌 中这 些 基 因 的表 达量 变 化 ,并 在 2月 龄 时 与 脂 肪 型 的 太 湖 猪 和 瘦 肉 型 的 长 白 猪 进 行 、4
P o ic r v n e,Ch n ia
4.Na o a gn eig Ce trfrBic p a h n h i i l t n En ie rn ne o o hi tS a g a ,Sh n h i 2 2 a g a 01 03,Chn ia
20.81 稿 。20.42 0 70.3收 080 0接 受 * 教 育 部 长 江 学 者 和 创 新 团 队 发 展 计 划 ( oIT 556 、教 育 部 高 等 学 校 博 士 学 科 点 专 项 基 金 ( o200 203 、 国 家 科 技 支 撑 计 划 N .R 05 .) N .06660 ) ( 020 B D 10 ) 和 四川 省 教 育 厅 青 年 基 金 ( o20 B0 ) 资 助 项 目 [ hsrs c a udd b h rn r tePo a o N .07 A 5 B3 N .0 6 04 T i ee hw sfne yt g t fm h rg m f a e as o r r
维普资讯
动物 学报
5 ( )4 2 5 ,20 4 3 :4 —4 2 0 8
A t oo c iia ca Zo lgia Sn c
雌 性 藏 猪 不 同 生 长 发 育 阶 段 肌 肉 生 长 和 脂 肪 沉 积 相 关 基 因 的表 达 模 式 *
比较 。A O A分 析 结 果 表 明 :2—8月 龄 间 藏 猪 分 别 有 1 NV 0和 7个 基 因 的 表 达 差 异 达 极 显 著 ( P<0 0 ) 和显 著 水 .1
平 ( 00 ) P< .5 ;2月 龄 时 藏 猪 体 重 极 显 著 低 于 长 白猪 ( P<00 ) 和 显 著 低 于 太 湖 猪 ( .1 P<00 ) 而 藏 猪 肌 纤 维 .5 , 面积 却 为最 大 ,但 品 种 间 差异 未 达 显 著 水 平 ( P>00 ) .5 ;2月 龄 时 3 品 种 间 分 别 有 1 个 5和 1 3个 基 因 的 表 达 差 异 达 极 显 著 ( 0 0 ) 和显 著 水 平 ( P< .1 P<00 ) T M 聚类 分 析 结 果 表 明 :直 线 下 降 和 上 升 是 藏 猪 在 2—8月 龄 间 .5 。S E 最 具 代 表性 的 基 因 表 达模 式 ( P<00 ) 另 外 ,5个 差 异 表 达 基 因 的 荧 光 定 量 R -C .1 。 TP R验 证 结 果 与 基 因 芯 片 结 果 的 Pr n相 关 系 数 平 均 高 达 086± .0 。提 示 :藏 猪 在 2—8月 龄 间 骨 骼 肌 生 长 发 育 强 度 较 肌 内 脂 肪 合 成 沉 积 eo s .5 0 19 占优 势 ,2月 龄 时 藏 猪 脂 肪 酸 合 成 相 关 基 因 的 表 达 水 平 较 其 他 两 品 种 低 ,而 脂 肪 酸 B氧 化 和 肌 纤 维 生 长 相 关 基 因 的 表 达 水 平 较 高 ,与 其 在 高 原 独 特 的 自然 生 态 环 境 和 全 放 牧 散 养 的 饲 喂 方 式 下 长 期 形 成 的 品 种 特 性 相 符 [ 物 动
