产品说明书及最小销售单元标签设计样稿-隔离衣
一类医疗器械隔离衣、手术衣产品备案资料全套

备案号: 第一类医疗器械备案表产品名称(产品分类名称):隔离衣备案人: 有限责任公司市场监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“/"。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(Excel形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
产品技术要求隔离衣医疗器械产品技术要求编号:隔离衣1.产品型号/规格及其划分说明型号:按隔离衣结构分为I连身式和II分身式;规格:按照隔离衣尺寸分为160、165、170、175、180、18502.性能指标2.1隔离衣的型号规格应符合表1、表2的规定。
产品说明书及最小销售单元标签设计样稿

使用说明书
一、适用范围与结构
适用范围:用于钳夹组织。
结构:由中间连接的两片组成,头部为钳喙;或由头部、杆部和手柄组成,头部为一对带钳喙的叶片。
采用GB/T 1220中规定的20Cr13、30Cr13不锈钢材料或GB/T 2965中规定的TC4钛合金材料制成。
非无菌提供。
二、产品型号规格
三、使用方法
四、注意事项
1. 使用前必须对器械进行检查,以免存在损坏、锈蚀或功能失效,失效器械不应继续使用。
2. 医疗卫生机构应当根据《医疗废物管理条例》对医疗废物进行管理。
3. 请勿将器械浸入生理盐水中,以免引起锈蚀。
4. 首次使用前请去油后,再进行清洗消毒。
五、生产日期、使用期限
[生产日期] 见包装标签。
[使用期限] 在正确使用与维护保养的情况下,使用期限为一年。
六、维护保养
1、手术结束后,应及时将淋巴结钳上残留的血渍及残留的组织冲洗干净,烘干备用;
2、清洗烘干后的淋巴结钳,应存放在专用的器械保管橱内。
七、贮存
包装后的淋巴结钳应贮存在相对湿度不超过80%,无腐蚀气体,通风良好的室内。
【生产备案凭证编号】
【医疗器械备案凭证编号/产品技术要求编号】
无锡********有限公司
注册地址:无锡市***区****路****号
生产地址:无锡市***区****路****号
邮编:214000
电话:*******
E-mail:*****
说明书编制日期:年月日
最小销售单元设计标签样稿:。
防护服-(非无菌)最小销售标签

医用一次性防护服最小销售标签
“仅供应急使用”
【品名】医用一次性防护服
【型号】连体式/分体式
【规格】160/165/170/175/180/185
【结构组成】防护服由连帽上衣、裤子组成,袖口、脚踝口为弹性收口,帽子面部收口及腰部收口可采用弹性收口、拉绳收口或搭扣。
防护服的左右前襟、左右臂及背部位置为关键部位。
【适用范围】供临床医务人员在工作时接触到的具有潜在感染性的患者血液、体液、分泌物等提供阻隔、防护用。
【注意事项】
1.本品为一次性使用产品,不得重复使用;
2本品使用后、超过有效期的应按照《医疗废物管理条例》处理;
3.建议在隔离留观区(房)和隔离病区(房)等场所使用。
【禁忌症】对原材料过敏慎用。
【生产批号】
【生产日期】
【有效期至】
【注册人/生产企业名称/售后服务单位】
【住所/生产地址】
【联系方式】
【医疗器械生产企业许可证编号】
【医疗器械注册证编号/产品技术要求编号】
其他详见说明书。
2、隔离衣的产品技术要求模板
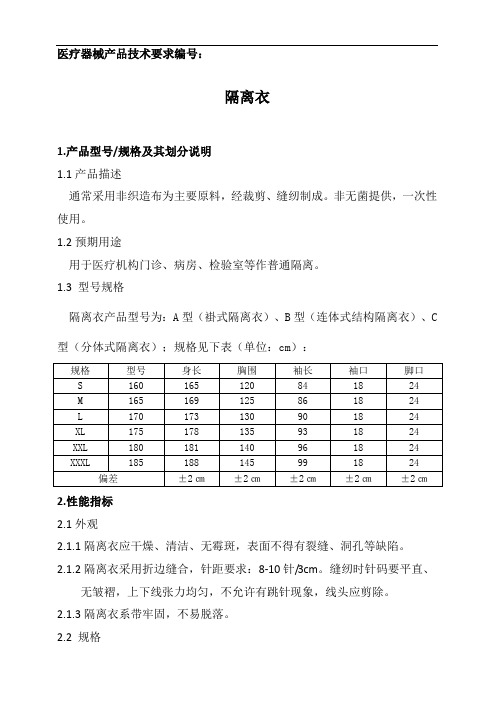
医疗器械产品技术要求编号:
隔离衣
1.产品型号/规格及其划分说明
1.1产品描述
通常采用非织造布为主要原料,经裁剪、缝纫制成。
非无菌提供,一次性使用。
1.2预期用途
用于医疗机构门诊、病房、检验室等作普通隔离。
1.3 型号规格
隔离衣产品型号为:A型(褂式隔离衣)、B型(连体式结构隔离衣)、C 型(分体式隔离衣);规格见下表(单位:cm):
2.性能指标
2.1外观
2.1.1隔离衣应干燥、清洁、无霉斑,表面不得有裂缝、洞孔等缺陷。
2.1.2隔离衣采用折边缝合,针距要求:8-10针/3cm。
缝纫时针码要平直、
无皱褶,上下线张力均匀,不允许有跳针现象,线头应剪除。
2.1.3隔离衣系带牢固,不易脱落。
2.2 规格
隔离衣的规格应符合1.3的规定。
2.3 干态断裂强力
隔离衣的干态断裂强力应≥20N。
3.检验方法
3.1外观
取样品3包,在自然光线下,感观检测,针距使用通用量具测量,应符合2.1.1、2.1.2、2.1.3的要求。
3.2规格尺寸
取样品3包,采用通用量具检测,应符合2.2的要求。
3.3干态断裂强力
按YY/T0506.2-2016标准要求检测,应符合2.3的要求。
4.术语
无。
一次性隔离衣企业标准2020版

高邮市金景服饰有限公司企业标准Q/321084GYJJ001-2020一次性隔离衣2020年5月15日发布2020年5月16日实施高邮市金景服饰有限公司发布前言本标准的编写格式符合GB/T1.1-2009给出的规则起草。
请注意本文件的某些内容可能涉及专利。
本文件的发布机构不承担识别这些专利的责任。
本标准起草单位:高邮市金景服饰有限公司。
本标准主要起草人:王松、陆政兵。
一次性隔离衣1.范围本标准规定了一次性隔离衣(以下简称隔离衣)的产品分类、技术要求、检验方法、检验规则、标志、包装和贮运。
本产品适用于电子工厂、无尘车间,食品加工、实验室、生物工程、科研室等行业对微尘比较敏感和清洁度要求比较高的行业,产品采用非织造布为主要原料。
经裁剪、缝纫制成,非无菌提供,一次性使用,可防固体粉尘、防护液体等。
2.规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件。
仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T191包装储运图示标志GB/T3923.1-2013纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测定条样法GB/T4744-2013纺织织物抗渗水性测定静水压试验(eqv ISO811:1981) GB/T4745-2012纺织织物表面抗湿性测定沾水试验(eqv IS04920:1981) 3.材料材料应选择符合GB/T38462《纺织品隔离衣用非织造布》要求的隔离衣用非织造布。
4.产品分类产品分为连帽连身式隔离衣和无帽倒穿隔离衣。
5.要求5.1结构5.1.1连帽连身隔离衣由连帽上衣、裤子组成,是连身式结构。
无帽倒穿隔离衣背为全开由布带扎紧。
5.1.2隔离衣的结构应合理,穿脱方便,结合部位严密。
5.1.3袖口、脚踝口采用弹性收口、帽子面部收口及腰部采用弹性收口、拉绳收口或搭扣。
5.2号型规格隔离衣号型分为165/M、175/L、185/XL号型规格表见表1。
第一类医疗器械备案表(隔离衣)

第一类医疗器械备案表产品名称(产品分类名称): 隔离衣备案人: 沈阳XX有限责任公司沈阳市市场监督管理局制填表说明1.本表用于进口和境内第一类医疗器械、体外诊断试剂备案。
2.要求填写的栏目内容应使用中文、打印完整、清楚、不得空白,无相关内容处应填写“∕”。
因备案表格式所限而无法填写完整时,请另附附件。
3.备案时应一并提交含有备案表内容(含附件)的电子文档(E×cel形式)。
4.境内医疗器械、体外诊断试剂只填写备案人名称、注册地址和生产地址中文栏。
进口医疗器械、体外诊断试剂备案人名称、注册地址和生产地址中文栏自行选择填写。
进口医疗器械产品名称(体外诊断试剂为产品分类名称,以下同)中文栏必填。
5.如系统支持,则进口医疗器械产品名称、备案人名称、注册地址和生产地址原文栏必填,原文填写内容应与备案人注册地址或生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件中载明内容和文种一致。
6.境内医疗器械备案人应填写组织机构代码。
7.进口医疗器械产品名称、备案人名称、注册地址和生产地址英文栏必填。
如原文非英文,英文内容必须与原文一致。
8.所填写各项内容应与所提交备案材料内容相对应。
9.产品类别及分类编码应根据医疗器械分类规则和医疗器械分类目录、第一类医疗器械产品目录、第一类体外诊断试剂分类子目录等相关文件填写。
10.备案人、代理人注册地址栏填写备案人和代理人企业营业执照等相关证明性文件上载明的注册地址。
11.备案人、代理人所在地系指备案人和代理人注册地址所在国家(地区)或省(区、市)。
12.如有其他需要特别加以说明的问题,请在本表“其他需要说明的问题”栏中说明。
注:填表前,请详细阅读填表说明。
最小销售单元的标签设计样稿

9.2、最小销售单元的标签设计样稿(气腹机)(总3页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--最小销售单元的标签设计样稿23二氧化碳(CO2)气腹机规格型号:Q-645 型 电 源: ~110-220V 50/60Hz 安全类型:I 类BF 型 产品技术标准号: 注册证号:生产日期: 使用期限:5年 出厂编号:(其他内容详见说明书)北京凡星光电医疗设备股份有限公司设备外标签图样二氧化碳(CO2)气腹机 图号适用于产品型号Q-620型/Q-630型/Q-645型技术参数及说明图1为产品铭牌 图2为熔断器样例图3为包装箱标示产品名称字体:黑体 10号字 公司名称字体:黑体 9号字 剩余内容字体:黑体 8号字 行距 固定值 10毫米40mm30mm40m15m 15m 15m图340mm60mm 图1熔断器:F3AL 250V60mm 图210mm4作 业 指 导 书共 页 工序名称指导书编号文件编号 版次图示说明:图1:产品铭牌贴付位置图图2:产品包装效果图第 页擦整机并贴包装盒外面的出厂标签A/0作业步骤:1、 用无尘布加适量的抹机水擦整机表面,不能有灰尘、污点、手纹印等脏物;将产品铭牌粘贴在整机后面板的右侧,熔断器标签贴于产品后面板熔断器下方,标签的方向如图所示:2、 拿取折好的包装箱,在其侧面固定位置粘贴出厂标签,该标签上的产品编号应与相应的整机产品铭牌上的产品编号相同;3、 自检合格后转入下一工序;注意事项:1、 两种标签的粘贴位置及方向要统一,粘贴后要端正、平整;2、 包装箱上的标签编号一定要与整机的相同;3、 保持工作台面整洁无杂物堆放;4、 发现异常情况及时反馈; ;NO. 使用材料 图号 用量 NO. 使用工、治具 1 产品铭牌1 1 抹机水2 熔断器标签1 2 无尘布3外包装标签1NO . 日期 变更事项变更人 批准制作 日期批准。
产品说明书及最小销售单元标签设计样稿

医疗器械说明书一般应当包括以下内容:(一)产品名称、型号、规格;(二)注册人或者备案人的名称、住所、联系方式及售后服务单位,进口医疗器械还应当载明代理人的名称、住所及联系方式;(三)生产企业的名称、住所、生产地址、联系方式及生产许可证编号或者生产备案凭证编号,委托生产的还应当标注受托企业的名称、住所、生产地址、生产许可证编号或者生产备案凭证编号;(四)医疗器械注册证编号或者备案凭证编号;(五)产品技术要求的编号;(六)产品性能、主要结构组成或者成分、适用范围;(七)禁忌症、注意事项、警示以及提示的内容;(八)安装和使用说明或者图示,由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明;(九)产品维护和保养方法,特殊储存、运输条件、方法;(十)生产日期,使用期限或者失效日期;(十一)配件清单,包括配件、附属品、损耗品更换周期以及更换方法的说明等;(十二)医疗器械标签所用的图形、符号、缩写等内容的解释;(十三)说明书的编制或者修订日期;(十四)其他应当标注的内容。
医疗器械说明书中有关注意事项、警示以及提示性内容主要包括:(一)产品使用的对象;(二)潜在的安全危害及使用限制;(三)产品在正确使用过程中出现意外时,对操作者、使用者的保护措施以及应当采取的应急和纠正措施;(四)必要的监测、评估、控制手段;(五)一次性使用产品应当注明“一次性使用”字样或者符号,已灭菌产品应当注明灭菌方式以及灭菌包装损坏后的处理方法,使用前需要消毒或者灭菌的应当说明消毒或者灭菌的方法;(六)产品需要同其他医疗器械一起安装或者联合使用时,应当注明联合使用器械的要求、使用方法、注意事项;(七)在使用过程中,与其他产品可能产生的相互干扰及其可能出现的危害;(八)产品使用中可能带来的不良事件或者产品成分中含有的可能引起副作用的成分或者辅料;(九)医疗器械废弃处理时应当注意的事项,产品使用后需要处理的,应当注明相应的处理方法;(十)根据产品特性,应当提示操作者、使用者注意的其他事项。
6.医用护目镜产品说明书及最小销售单元标签样稿

(产品使用说明书样稿)【产品备案号】【产品技术要求编号】【生产备案号】医用护目镜产品使用说明书【产品名称】医用护目镜【产品型号规格】HM-01;HM-02;HM-03MZ-01;MZ-02;MZ-03【基本结构】通常由高分子材料制成的防护罩、泡沫条和固定装置组成。
非无菌提供,一次性使用。
【适用范围】用于医疗机构中检查治疗时起防护作用。
【使用说明】本产品应由经专业医护培训的医务人员操作使用或在专业医护人员指导下使用。
1. 根据使用者特点选取适当型号产品,打开包装,取出包装内物件;2. 使用者用医用护目镜时应进行相应的产品外观、透光性的检查。
【注意事项】1. 在规定的运输和贮存条件下,产品自生产日期算起,有效期为三年。
产品超过期限不得使用。
2. 本产品为单人使用产品,不得多人共用或重复使用,以避免交叉感染。
3. 产品使用后的处理方式:依医疗器械废弃物处理。
【禁忌症】本产品仅起物理防护作用,不可作为治疗器械使用。
【储运条件】宜贮存在清洁、干燥、通风、遮光的室内,运输应防止破损、阳光直晒和雨雪浸淋,禁止与有毒、有异味的物品混运。
【生产日期】见包装封口处。
【使用期限】在遵守储运、贮存规则的条件下,自生产日期起使用期限为三年。
【配件清单】每包装内含:医用护目镜一套备案人/生产企业/售后单位名称:备案人/生产企业地址:电话:邮编:(产品最小销售单元标签样稿)【产品备案号】【产品技术要求编号】【生产备案号】医用护目镜【产品名称】医用护目镜【产品型号规格】HM-01;HM-02;HM-03MZ-01;MZ-02;MZ-03【基本结构】通常由高分子材料制成的防护罩、泡沫条和固定装置组成。
非无菌提供,一次性使用。
【禁忌症】本产品仅起物理防护作用,不可作为治疗器械使用。
【生产日期】见包装封口处。
【使用期限】在遵守储运、贮存规则的条件下,自生产日期起使用期限为三年。
其他内容详见说明书!备案人/生产企业/售后单位名称:备案人/生产企业地址:电话:邮编:。
隔离衣说明书及标签样稿

说明书【1.产品名称】隔离衣【2.型号、规格】型号:连体式、分体式,规格:160(S号)、165(M号)、170(L号)、175(XL 号)、180(XXL号)、185(XXXL号)【3.产品描述(结构及组成)】本产品采用非织造布为主要原料,经裁剪、缝纫制成。
非无菌提供,一次性使用。
【4.预期用途】用于医疗机构门诊、病房、检验室等作普通隔离。
【5.禁忌】无。
【6.注意事项、警示以及提示的内容】本产品仅供一次性使用,不得二次使用,使用前应仔细阅读使用说明书;使用前检查包装是否完好,并对包装标志、生产日期、进行确认,并在有效期内使用;包装破损,严禁使用。
本产品自启用后使用时间期限为8小时。
在脱下前要尽量避免接触隔离衣的外表面,隔离衣脱下后应当是内表面朝外,将外表面和污染物包裹在里面,避免污染物接触到人体和环境。
本产品使用后放入黄色垃圾袋中作为医疗器械废物处理。
【7.使用说明】1、穿隔离衣:应遵循先穿下衣,再穿上衣,然后戴好帽子,最后拉上拉锁的顺序。
2、脱隔离衣:脱分体式隔离衣时应先将拉链拉开。
向上提拉帽子,使帽子脱离头部。
脱袖子、上衣,将污染面向里放入医疗废物袋。
脱下衣,由上向下边脱边卷,污染面向里,脱下后置于医疗废物袋。
脱连体式隔离衣时,先将拉链拉到底。
向上提拉帽子,使帽子脱离头部,脱袖子;由上向下边脱边卷,污染面向里直至全部脱下后放入医疗废物袋内。
【8.产品维护和保养方法,特殊储存、运输条件、方法】本产品应贮存在相对湿度不超过80%,且无腐蚀性物质侵蚀、通风良好的室内。
运输过程中应轻拿轻放,防止暴晒和雨淋。
【9.生产日期、使用期限或失效日期】见产品包装和合格证的标签标识。
【10.医疗器械标签所用的图形、符号、缩写等内容的解释】查询使用说明小心搬运怕雨怕晒如包装破损切勿使用不得二次使用【11.医疗器械备案凭证号/产品技术要求的编号】赣洪械备2020XXXX号【13.备案人/生产企业名称/售后服务单位】南昌XXXXXXXXX有限公司【14.备案人/生产企业住所】南昌市XXXXXXXXXXXXXXXX【15.医疗器械生产备案号】赣洪食药监械生产备2020XXXX号【16.生产地址】南昌市XXXXXXXXXXXXXXXX【17.备案人/生产企业联系方式】联系电话:0791-XXXXXXXX邮政编号:331700【18.说明书的编制或者修订日期】编制日期:2020年XX月XX日最小销售单元的标签样稿生产日期:生产批号:2020XXXX 有效期限:隔离衣不得二次使用如包装破损切勿使用医疗器械生产备案号:赣洪食药监械生产备2020XXXX号医疗器械备案凭证号:赣洪械备2020XXXX号产品技术要求编号:赣洪械备2020XXXX号【型号规格】连体式170(L号)【产品描述(结构及组成)】本产品采用非织造布为主要原料,经裁剪、缝纫制成。
防护服产品技术要求模板防疫物资

医疗器械产品技术要求编号:一次性医用防护服1.产品型号/规格、划分说明及结构组成:1.1产品型号规格:型号:无菌型、非无菌型规格:160/165/170/175/180/1851.2划分说明:按照产品是否灭菌分为无菌型、非无菌型两种型号,按照防护服尺寸大小不同划分为不同的规格。
1.3 结构组成:防护服由连帽上衣、裤子组成,为连身式结构。
防护服图示见图1。
图1 防护服图示2. 性能指标2.1 防护服的结构要求2.1.1防护服由连帽上衣、裤子组成,为连身式结构。
防护服的结合部位严密,穿脱方便。
2.1.2袖口、脚踝口采用弹性收口,帽子面部收口及腰部采用弹性收口、拉绳收口或搭扣。
—1——2—2.2 防护服号型及尺寸如表1所示。
2.3 外观2.3.1 防护服应干燥、清洁、无霉斑,表面不允许有粘连、裂缝、孔洞等缺陷。
2.3.2 防护服连接部位采用针缝加工方式。
针缝的针眼应密封处理,缝合的针距每3cm 应为8~14针,线迹应均匀、平直,不得有跳针。
2.3.3 防护服拉链不能外露,拉头应能自锁。
2.4 液体阻隔功能 2.4.1 抗渗水性防护服关键部位静水压应不低于1.67kPa (17cmH 2O )。
2.4.2 透湿量防护服材料透湿量应不小于2500g/(m 2·d )。
2.5 抗合成血液穿透性防护服抗合成血液穿透性应不低于表2中2级的要求。
2.6 表面抗湿性防护服外侧面沾水等级应不低于GB/T 4745-2012中3级的要求。
2.7 断裂强力防护服关键部位材料的断裂强力应不小于45N 。
2.8 断裂伸长率防护服关键部位材料的断裂伸长率应不小于15%。
2.9 过滤效率防护服关键部位材料及接缝处对非油性颗粒的过滤效率应不小于70%。
2.10 阻燃性能具有阻燃性能的防护服应符合下列要求:a) 损毁长度不大于200mm;b) 续燃时间不超过15s;c) 阴燃时间不超过10s。
2.11 抗静电性防护服的带电量应不大于0.6μC/件。
产品说明书及最小销售单元标签设计样稿要求

产品说明书及最小销售单元标签设计样稿要求
医疗器械应符合相应法规规定。
进口医疗器械产品应提交境外政府主管部门批准或者认可的说明书原文及其中文译本。
体外诊断试剂产品应按照《体外诊断试剂说明书编写指导原则》的有关要求,并参考有关技术指导原则编写产品说明书。
进口体外诊断试剂产品应提交境外政府主管部门批准或者认可的说明书原文及其中文译本。
具体编写按照已于2014年6月27日公布的国家食品药品监督管理总局令第 6 号《医疗器械说明书和标签管理规定》要求编写。
最小销售单元标签设计样稿
对于小型医疗器械,其最小销售单元标签通常指销售产品的最小包装上印制的文字及图标。
对于大型的医疗器械设备,如有源医疗器械,最小销售单元标签通常指设备铭牌标签。
如:
对于体外诊断试剂,其最小销售单元标签通常指试剂瓶外的标签。
隔离衣医疗器械产品技术要求
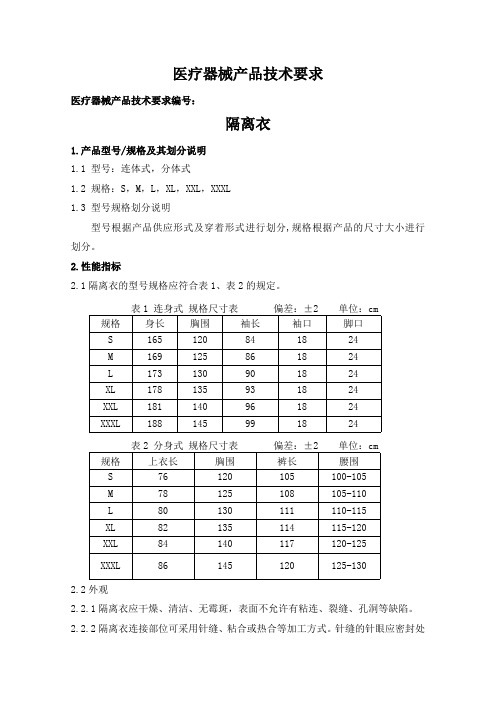
医疗器械产品技术要求医疗器械产品技术要求编号:隔离衣1.产品型号/规格及其划分说明1.1 型号:连体式,分体式1.2 规格:S,M,L,XL,XXL,XXXL1.3 型号规格划分说明型号根据产品供应形式及穿着形式进行划分,规格根据产品的尺寸大小进行划分。
2.性能指标2.1隔离衣的型号规格应符合表1、表2的规定。
表1 连身式规格尺寸表偏差:±2 单位:cm 规格身长胸围袖长袖口脚口S165120841824M169125861824L173130901824XL178135931824XXL181140961824XXXL188145991824表2 分身式规格尺寸表偏差:±2 单位:cm 规格上衣长胸围裤长腰围S76120105100-105M78125108105-110L80130111110-115XL82135114115-120XXL84140117120-125XXXL86145120125-1302.2外观2.2.1隔离衣应干燥、清洁、无霉斑,表面不允许有粘连、裂缝、孔洞等缺陷。
2.2.2隔离衣连接部位可采用针缝、粘合或热合等加工方式。
针缝的针眼应密封处理,针距每3cm应为8针-14针,线迹应均匀、平直,不得有跳针。
粘合或热合等加工处理后的部位,应平整、密封,无气泡。
2.2.3装有拉链的隔离衣拉链拉头应能自锁。
2.3结构连身式和分身式结构分别见图1、图2。
图1 连体式隔离衣图2 分体式隔离衣2.3.1隔离衣的结构应合理,穿脱方便,结合部位严密。
2.3.2袖口、脚踝口采用弹性收口,帽子面部收口及腰部采用弹性收口、拉绳收口或搭扣。
2.4 液体阻隔功能2.4.1 抗渗水性隔离衣关键部位静水压应不低于1.67kPa (17cm H20)。
2.4.2 透湿量隔离衣材料透湿量应不小于2500g/(m2.d)。
2.4.3 抗合成血液穿透性隔离衣抗合成血液穿透性应不低于表3中2 级的要求。
完整版一类医疗器械隔离衣产品备案资料 3产品技术要求

产品技术要求编号:隔离衣沈阳XXX有限责任公司发布2020 年02月01日编制沈阳XXX有限责任公司发布医疗器械产品技术要求编号:隔离衣1. 产品型号/规格及其划分说明型号:按隔离衣结构分为I连身式和n分身式;规格:按照隔离衣尺寸分为160、165、170、175、180、185。
2. 性能指标2.1隔离衣的型号规格应符合表1、表2的规定。
2.2外观2.2.1隔离衣应干燥、清洁、无霉斑,表面不允许有粘连、裂缝、孔洞等缺陷。
2.2.2隔离衣连接部位可采用针缝、粘合或热合等加工方式。
针缝的针眼应密封处理,针距每3cm应为8针~14针,线迹应均匀、平直,不得有跳针。
粘合或热合等加工处理后的部位, 应平整、密封,无气泡。
223装有拉链的隔离衣拉链拉头应能自锁。
2.3结构连身式和分身式结构分别见图1、图2。
2.3.1隔离衣的结构应合理,穿脱方便,结合部位严密。
I冷3宝2.5 断裂伸长率 隔离衣关键部位材料的断裂伸长率应不小于2.6 应无异常气味。
2.7 包装密封性要好,不允许漏气。
3. 检验方法3.1 型号规格使用通用量具,对每种号型的隔离衣样品进行测量, 测定 3件,其规格均应符合 2.1 的要求。
3.2 外观3.2.1 目视检查,应符 2.2.1 的要求。
3.2.2 目视检查,针距使用通用量具进行测量,应符合 2.2.2 的要求。
3.2.3 对每件隔离衣样品的拉锁进行拉合操作 5 次,测定 3 件,均应符合 2.2.3 的要求。
3.3 结构目视检查,应符合 2.3 的要求。
3.4 断裂强力隔离衣关键部位材斜按照 GB/T3923.1-1997 规定的条样法进行试验, 结果应符合 2.4 的要求。
3.5 断裂伸长率隔离衣关键部位材料按照 GB/T3923.1-1997 规定的条样法进行试验, 结果应符合 2.5 的要求。
3.6 气味检验采取用鼻子闻的方法检验,符合 2.86 的要求。
3.7包装密封性检验:参照GB15980标准要求,将小包装进入水中,轻轻挤压,不出气泡为2.3.2袖口、脚踝口采用弹性收口,帽子面部收口及腰部采用弹性收口、 2.4断裂强力 隔离衣关键部位材料的断裂强力应不小于45N 。
《隔离衣》产品技术要求

《隔离衣》产品技术要求本页仅作为文档封面,使用时可以删除This document is for reference only-rar21year.March隔离衣1.产品型号/规格及其划分说明1.1 型号/规格:隔离衣(以下简称“隔离衣”)的型号规格:连体式、分体式,规格:160(S号)、165(M号)、170(L号)、175(XL号)、180(XXL号)、185(XXXL号)。
隔离衣的型号规格及尺寸见表1、表2,隔离衣示意图见图1连体式、图2分体式。
表1 连体式规格及尺寸(cm)表2 分身式规格及尺寸(cm)1.2型号/规格划分说明:产品型号按隔离衣结构形式进行划分,规格按隔离衣的尺寸进行划分。
2.性能指标2.1 外观2.1.1 隔离衣应干燥、清洁、无霉斑,表面不允许有裂缝、孔洞等缺陷。
2.1.2 隔离衣连接部位采用缝纫的加工方式。
缝纫的针距每 3 cm 应不得少于 6 针针,线迹应均匀、平直,不得有跳针。
2.1.3 装有拉链的隔离衣拉链不能外露。
2.2 结构2.2.1 隔离衣由连帽上衣、裤子组成,可分为连体式结构和分身式结构。
连体式和分身式结构分别见图1、图2。
2.2.2 隔离衣的结构应合理,穿脱方便,结合部位严密。
2.2.3 袖口、脚踝口采用弹性收口,帽子面部收口及腰部采用弹性收口、拉绳收口或搭扣。
2.3 型号规格隔离衣型号规格见表1、表2,其尺寸应符合表1、表2的要求。
2.4 单位面积质量隔离衣所用非织造布或淋膜非织造布的单位面积质量应大于20g/m2。
2.5 表面抗湿性隔离衣外侧面沾水等级应不低于3级的要求。
2.6 微生物指标3.检验方法3.1 外观3.1.1 随机抽取3件样品进行试验。
目视检查,应符合2.1.1的要求。
3.1.2 随机抽取3件样品进行试验。
目视检查,针距使用通用量具进行测量,应符合2.1.2的要求。
3.1.3 随机抽取3件样品进行试验。
目视检查,应符合2.1.3的要求。
医用一次性防护服产品使用说明书和标签

十一、说明书和标签品名:医用一次性防护服XXXX有限公司医用一次性防护服(无菌型)使用说明书【产品名称】医用一次性防护服【型号】无菌型连身式、无菌型分身式【规格】160、165、170、175、180、185【生产许可证编号】【医疗器械注册证编号/产品技术要求编号】【结构及组成】由覆膜无纺布、胶条制成,由连帽上衣、裤子组成,可分为连身式结构和分身式结构。
产品分无菌型、非无菌型。
【产品适用范围】供临床医务人员在工作时接触到的具有潜在感染性的患者血液、体液、分泌液提供阻隔、防护用。
【产品主要性能】1)防护服关键部位静水压应不低于1.67 kPa(17 cm H2O);2)防护服材料透湿量应不小于2500g/(㎡•d);3)防护服抗合成血液穿透性应不低于2级(1.75 kPa);4)防护服外侧面沾水等级应不低于3级的要求;5)防护服关键部位材料的断裂强力应不小于45N;6)防护服关键部位材料的断裂伸长率应不小于15%;7)防护服关键部位材料及接缝处对非油性颗粒的过滤效率应不小于70%;8)阻燃性能(若适用):损毁长度不大于200mm;续燃时间不超过15s;阴燃时间不超过10s;9)防护服的带电量应不大于0.6μC/件;10)防护服材料静电衰减时间不超过0.5s(若适用);11)产品应无菌,环氧乙烷残留量应不超过10μg/g。
【注意事项,警示以及提示性内容】1)请仔细阅读使用说明,并在有效期内使用;2)本品经环氧乙烷灭菌,使用前请检查包装情况,若包装破损应禁止使用;3)本产品为一次性使用,禁止重复使用;4)产品使用后,应按医院或环保部门要求进行处理。
【使用说明】1)使用前根据身材选择合适的型号/规格;2)穿防护服时,先穿裤子,再穿上衣,然后戴好帽子,最后拉上拉链;3)穿好防护服后,确保头部、手腕处、脚踝口覆盖严密。
【尺寸】各型号规格的尺寸见表1、表2。
表1 连身式尺寸单位:㎝规格身长胸围袖长袖口脚口160 165 120 84 18 24165 169 125 86 18 24170 173 130 90 18 24175 178 135 93 18 24180 181 140 96 18 24185 188 145 99 18 24允差±2 ±2 ±2 ±2 ±2表2 分身式尺寸单位:㎝规格上衣长胸围裤长腰围160 76 120 105 100~105165 78 125 108 105~110170 80 130 111 110~115175 82 135 114 115~120180 84 140 117 120~125185 86 145 120 125~130允差±2 ±2 ±2 ±2【禁忌症】尚未发现【储存方法】本产品应储存在阴凉、干燥、无腐蚀性气体的环境内,避免阳光直射。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
产品说明书
【产品名称】隔离衣
【规格型号】
型号: S(160)□M(165) L(170)□XL(175)□XXL(180)
【结构组成】通常采用非织造布为主要原料、经裁剪、缝纫制成。
非无菌提供,一次性使用
【产品性能】隔离衣结构应合理,穿脱方便,结合部位严密;断裂强力应不小于20N;胀破强度应不小于40kPa。
【预期用途】用于医疗机构门诊、病房、检验室等做普通隔离
【禁忌症】对非织造布等原材料过敏者慎用。
【储存、运输条件、方法】该产品应贮存在温度-30℃~55℃,相对湿度不超过80%,无腐蚀性气体。
干燥、阴凉、通风良好的环境内。
运输过程中应防止重压、阳光直晒、雪雨浸淋和辐射,运输要求按订货合同规定。
【使用方法】按启口处撕开包装取出本品,方可使用。
【注意事项】1.一次性使用,严禁重复使用;2.包装破损慎用。
【生产日期】
【有效期限】
【备案人】
【住所】
【生产企业】
【生产地址】
【联系方式】
【售后服务单位】
【第一类医疗器械生产备案凭证编号】
【第一类医疗器械备案凭证编号/产品技术要求编号】
【说明书编制日期或者修订日期】
标签样稿。
