双液系气液平衡相图的绘制(华南师范大学物化实验)
物化实验双液系的气-液平衡相图实验报告

双液系的气-液平衡相图一实验目的1.绘制在pθ下环己烷-异丙醇双液系的气-液平衡相图,了解相图和相律的基本概念;2.掌握测定双组分液体的沸点及正常沸点的方法;3.掌握用折光率确定二元液体组成的方法。
二实验原理在常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例互溶,则称完全互溶双液体系,若只能部分互溶,则称部分互溶双液体系。
液体的沸点是指液体的蒸汽压与外界压力相等时的温度,在一定的外压下,纯液体的沸点有其特定值,但双液系的沸点不仅与外压有关而且还与两种液体的相对含量有关。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图中于 (a)。
而实际溶液由于A 和B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图2-4-1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验是用回流冷凝法测定环已烷—异丙醇体系的沸点—组成图。
其方法是用阿贝折射仪测定不同组成的体系,在沸点温度时气、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制沸点—组成图。
三仪器和试剂沸点仪1套;恒温槽1台;阿贝折射仪1台;量筒8个;玻璃漏斗8个;滴管2个;环己烷(分析纯);异丙醇(分析纯);实验装置如下:四实验步骤1.工作曲线的绘制配制环己烷的质量百分数0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70, 0.80和0.90的环己烷-异丙醇溶液。
计算所需环己烷和异丙醇的质量,并用分析天平准确称取。
为避免样品挥发带来的误差,称量应尽可能的迅速。
各种溶液的确切组成要按照实际称样结果精确计算。
调节超级恒温水浴的温度为35度,使阿贝折光仪上温度与其保持一致。
分别测定上述九个溶液以及异丙醇和环己烷的折光率。
根据这些数据作出折光率-组成工作曲线。
双液系气-液平衡相图绘制华师华南师范大学物理化学实验报告

实验报告姓名学号专业化学(师范)年级、班级课程名称物理化学实验实验项目实验类型 验证 设计 综合实验时间实验指导老师马国正实验评分一、实验目的(1)用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。
并找出恒沸点混合物的组成及恒沸点的温度。
(2)掌握测定双组分液体的沸点及正常沸点的测定方法。
(3)了解阿贝折光仪的构造原理,熟悉掌握阿贝折光仪的使用方法。
二、实验原理(1)沸点的定义沸点是液体饱和蒸汽压和外压相等时的温度,双液系的沸点不仅于外压有关,而且还与两种液体的相对含量有关。
(2)理想二组分系统的拉乌尔定律理想的二组分体系在全部浓度范围内符合Raoult定律。
结构相似、性质相似的组分间可以形成近似的理想体系,这样可以形成简单的T-x(y)图。
大多数情况下,曲线将出现或正或负的偏差。
当这一偏差足够大时,在T-x(y)曲线上将出现极大点(负偏差)或极小点(正片差)。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。
(3)平衡时气相、液相的组成确定回流冷凝法保持气液相对量不变,测定双液系沸点,通过阿贝折射仪测定其液相折射率确定气液相平衡时的组成,通过双液系气液平衡时的组成对校正后的沸点作图,得到在1个大气压下乙醇-乙酸乙酯气液平衡相图。
三、仪器与试剂沸点仪(1套)小试管(5mL带软木塞)(若干)阿贝折射仪(1台)烧杯(2个)1/10温度计(50~100℃)(1支)吸管(2支)擦镜纸乙酸乙酯(A.R.)无水乙醇(A.R.)不同比例的乙醇-乙酸乙酯混合液丙酮(C.P.)无水乙醇(A.R.)四、实验步骤(1)折射率-体积分数工作曲线取几滴纯乙醇、纯乙酸乙酯分别测定其折射率,两点作n D26−φ工作曲线(n-V)。
(2)折射率-摩尔分数工作曲线在n D26−φ线上取8个点,利用乙醇、乙酸乙酯密度合量比(%)等条件将以上点对应的体积分数换算成摩尔分数,按对应的折射率重新绘n D26−x点,再将点连成平滑曲线,即为n D26−x工作曲线(n-x)(3)溶液的沸点与平衡气-液相组成测定a)样品I-VI分别为乙醇体积分数为5%、15%、22%、38%、50%、90%的乙醇-乙酸乙酯混合液。
物化实验双液系的气-液平衡相图实验报告

双液系的气-液平衡相图一实验目的1.绘制在pθ下环己烷-异丙醇双液系的气-液平衡相图,了解相图和相律的基本概念;2.掌握测定双组分液体的沸点及正常沸点的方法;3.掌握用折光率确定二元液体组成的方法。
二实验原理在常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例互溶,则称完全互溶双液体系,若只能部分互溶,则称部分互溶双液体系。
液体的沸点是指液体的蒸汽压与外界压力相等时的温度,在一定的外压下,纯液体的沸点有其特定值,但双液系的沸点不仅与外压有关而且还与两种液体的相对含量有关。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图中于 (a)。
而实际溶液由于A 和B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图2-4-1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
本实验是用回流冷凝法测定环已烷—异丙醇体系的沸点—组成图。
其方法是用阿贝折射仪测定不同组成的体系,在沸点温度时气、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制沸点—组成图。
三仪器和试剂沸点仪1套;恒温槽1台;阿贝折射仪1台;量筒8个;玻璃漏斗8个;滴管2个;环己烷(分析纯);异丙醇(分析纯);实验装置如下:四实验步骤1.工作曲线的绘制配制环己烷的质量百分数0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.70, 0.80和0.90的环己烷-异丙醇溶液。
计算所需环己烷和异丙醇的质量,并用分析天平准确称取。
为避免样品挥发带来的误差,称量应尽可能的迅速。
各种溶液的确切组成要按照实际称样结果精确计算。
调节超级恒温水浴的温度为35度,使阿贝折光仪上温度与其保持一致。
分别测定上述九个溶液以及异丙醇和环己烷的折光率。
根据这些数据作出折光率-组成工作曲线。
双液系气-液相图绘制

双液系的气-液平衡相图一、实验目的1、绘制在常压下环己烷-乙醇双液系的气-液平衡相图,能用相律分析相图;2、掌握测定双组分液体沸点的方法,通过实验进一步理解分馏原理;3、掌握用折光率确定二元液体组成的方法,学会阿贝折光仪的使用。
二、实验原理两种液态物质混合而成的二组分系统称为双液系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液系。
液体的沸点是指液体的蒸汽压与外界大气压相等时的温度。
在一定外压下,纯液体有确定的沸点。
而双液系的沸点不仅与外压有关,还与其组成有关。
根据相律,对于指定双液系,定压下气、液两相平衡共存的区域中,自由度为1,当温度一定时,平衡共存的气、液两相组成确定。
根据杠杆原理,两相的相对量也为定值。
所以实验测定一系列不同组成的双液系溶液的气、液组成和沸点,就可以绘出温度-组成(T-x)图。
BB B B(a)(b)(c)图中(a)是一种最简单的完全互溶双液系的T-x图,如果液体与拉乌尔定律的偏差不大,在T-x图上溶液的沸点介于A、B二纯液体的沸点之间。
图(a)中上面是一条气相线,下面是一条液相线,对应于同一沸点温度二曲线上的两个点,就是互相平衡的气相点和液相点,其相应的组成可以从横轴上获得。
实际溶液由于二组分的相互影响,与拉乌尔定律存在较大偏差,在T-x图上会有最高点或最低点出现,如图(b)和(c)。
这些点称为恒沸点,相应溶液称为恒沸点混合物,蒸馏所得的气相与液相组成相同,靠蒸馏无法改变其组成。
本实验用回流冷凝法,以沸点测定仪测定环己烷-乙醇二元体系的T-x图。
方法是,用阿贝折光仪测定一系列标准混合溶液的组成,作折射率-组成图;在待测液沸点温度时测定气、液相的折射率,再从折射率-组成工作曲线上查得相应组成,然后绘制T-x图。
沸点测定仪是一只带回流冷凝管的长颈圆底烧瓶。
电流经变压器和粗导线通过浸于溶液中的电热丝加热被测液,当其沸腾后,气相在支管被冷凝后回流。
实验二 双液系的气—液平衡相图
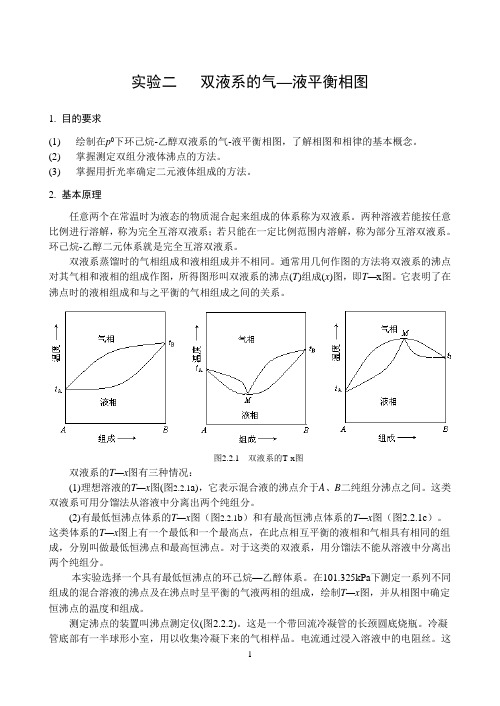
实验二双液系的气—液平衡相图1. 目的要求(1) 绘制在p0下环己烷-乙醇双液系的气-液平衡相图,了解相图和相律的基本概念。
(2) 掌握测定双组分液体沸点的方法。
(3) 掌握用折光率确定二元液体组成的方法。
2. 基本原理任意两个在常温时为液态的物质混合起来组成的体系称为双液系。
两种溶液若能按任意比例进行溶解,称为完全互溶双液系;若只能在一定比例范围内溶解,称为部分互溶双液系。
环己烷-乙醇二元体系就是完全互溶双液系。
双液系蒸馏时的气相组成和液相组成并不相同。
通常用几何作图的方法将双液系的沸点对其气相和液相的组成作图,所得图形叫双液系的沸点(T)组成(x)图,即T—x图。
它表明了在沸点时的液相组成和与之平衡的气相组成之间的关系。
图2.2.1 双液系的T-x图双液系的T—x图有三种情况:(1)理想溶液的T—x图(图2.2.1a),它表示混合液的沸点介于A、B二纯组分沸点之间。
这类双液系可用分馏法从溶液中分离出两个纯组分。
(2)有最低恒沸点体系的T—x图(图2.2.1b)和有最高恒沸点体系的T—x图(图2.2.1c)。
这类体系的T—x图上有一个最低和一个最高点,在此点相互平衡的液相和气相具有相同的组成,分别叫做最低恒沸点和最高恒沸点。
对于这类的双液系,用分馏法不能从溶液中分离出两个纯组分。
本实验选择一个具有最低恒沸点的环己烷—乙醇体系。
在101.325kPa下测定一系列不同组成的混合溶液的沸点及在沸点时呈平衡的气液两相的组成,绘制T—x图,并从相图中确定恒沸点的温度和组成。
测定沸点的装置叫沸点测定仪(图2.2.2)。
这是一个带回流冷凝管的长颈圆底烧瓶。
冷凝管底部有一半球形小室,用以收集冷凝下来的气相样品。
电流通过浸入溶液中的电阻丝。
这样可以减少溶液沸腾时的过热现象,防止暴沸。
测定时,温度计水银球要一半在液面下,一半在气相中,以便准确测出平衡温度。
而折光率的测定又只需少量样品,溶液组成分析:由于环己烷和乙醇的折光率相差较大,4.实验步骤(1) 纯液体折光率的测定:分别测定乙醇和环己烷的折光率,重复2次~3次。
双液系的气-液平衡相图的绘制实验报告

实验四 双液系的气-液平衡相图的绘制一、目的要求1.用沸点仪测定大气压下乙醇—环己烷或异丙醇-环己烷双液系气-液平衡时气相与液相组成及平衡温度,绘制温度—组成图,确定恒沸混合物的组成及恒沸点的温度。
2.了解物化实验中光学方法的基本原理,学会阿贝折光仪的使用。
3.进一步理解分馏原理。
二、实验原理两种在常温时为液态的物质混合起来而组成的二组分体系称为双液系。
两种液体若能按任意比例互相溶解,称为完全互溶的双液系;若只能在一定比例范围内互相溶解,则称部分互双液系。
双液系的气液平衡相图t x -图可分为三类。
如图4.1。
图 4.1 二元系统t x -图这些图的纵轴是温度(沸点),横轴是代表液体B 的摩尔分数B x 。
在t x -图中有两条曲线:上面的曲线是气相线,表示在不同溶液的沸点时与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
例如图4.1(a)中对应于温度t 1的气相点为y 1,液相点为1l ,这时的气相组成y 1点的横轴读数是g B x ,液相组成点1l 点的横轴读数为lB x 。
如果在恒压下将溶液蒸馏,当气液两相达平衡时,记下此时的沸点,并分别测定气相(馏出物)与液相(蒸馏液)的组成,就能绘出此t x -图。
y 1l 1t 1g Bx l Bx AB t/℃(a )气液t/℃AB B x →(b )t/ ℃气液ABB (c )图4.1(b)上有个最低点,图4.1(c)上有个最高点,这些点称为恒沸点,其相应的溶液称为恒沸混合物,在此点蒸馏所得气相与液相组成相同。
三、仪器和药品1.仪器玻璃沸点仪一套;阿贝折光仪一台;WLS 系列可调式恒流电源一台;SWJ 型精密数字温度计一台;SYC 超级恒温槽一台。
2.药品无水乙醇(AR )或异丙醇(AR );环己烷(AR )。
四、实验步骤(一)、步骤1.按图4.2连好沸点仪,数字贝克曼温度计,感温杆勿与电热丝相碰。
2.接通冷凝水,用超级恒温槽完成冷凝循环。
完全互溶双液系气液平衡相图的绘制。实验报告

完全互溶双液系气液平衡相图的绘制一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图2.7(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图2.7(c))所示。
图2.7 二组分真实液态混合物气—液平衡相图(T-x 图)后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T -x 相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2.8)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T -x 相图。
本实验中两相的成分分析均采用折光率法测定。
折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同。
因此可先配制一系列已知组成的溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的组成。
双液系气液平衡相图的绘制实验报告

双液系沸点-组成图测绘实验报告实验时间:2015年4月15日学号:1120132970一、目的要求1 •测定相应组成时的沸点并制作常压下环已烷一无水乙醇双液系的平衡相图。
2 •从沸点组成图了解分馏原理。
3.了解沸点的测定技术,掌握两组分液体沸点的测定方法。
4 •掌握折光率与组成的关系及阿贝折光仪的测量原理和使用方法。
二.实验原理1、由液态物质混合而成的二组分系统称为双液系统。
若两液体能以任意比例互溶,称其为完全互溶双液系,若两液体只能部分互溶,称其为部分互溶双液系。
一个完全互溶的二元体系,两个纯液体组分在所有组成范围内完全互溶。
在定压下,完全互溶的二元体系的沸点一组成图可分为三类,如图C7.1所示。
a. 溶液的沸点介于两纯组分沸点之间,如苯一甲苯体系;b. 溶液有最低恒沸点,如环己烷-乙醇体系;c. 溶液有最高恒沸点,如丙酮一氯仿体系。
Xi JF4 Xi jn B A B X x B 下面以a为例,简单说明绘制沸点-组成图的原理。
加热总组成为x1的溶液, 体系的温度上升,达液相线上1点时溶液开始沸腾,组成为x2的气相开始生成,但气相量很少,趋于0,x1、x2二点代表达到平衡时液、气两相组成。
继续加热, 气相量逐渐增多,沸点继续上升,气、液二相组成分别在气相线和液相线上变化,当达某温度(如2点)并维持温度不变时,则x3、x4为该温度下液、气两相组成,气相、液相的量之比按杠杆规则确定。
从相律 f = c - p +2 可知:当外压恒定时,在气、液两相共存区域自由度等于1;当温度一定时,则气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也已确定。
因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相的量与液相的量之比也不变时(达气-液平衡),则体系的温度也就恒定。
分别取出气、液两相的样品,分析其组成,得到该温度下气、液两相平衡时各相的组成。
改变溶液总组成,得到另一温度下气、液两相平衡时各相的组成。
实验四双液系的气——液平衡相图的绘制

向港040940538实验四双液系的气——液平衡相图的绘制一、实验目的1、用沸点仪测定大气压下—环己烷或异丙醇—环己烷双液系气—液平衡时气相与液相组成及平衡温度,绘制温度--组成图,确定恒沸混合物的组成及恒沸点的温度。
2、了解物化实验中光学方法的基本原理,学会阿贝折光仪的使用。
3、进一步理解分馏原理。
二、实验原理两种在常温时为液态的物质混合起来而组成的二组分体系成为双液系。
两种液体若能按任意比例互相溶解,成为完全互溶的双液系;若只能在一定比例范围内互相溶解,则称部分双液系。
双液系的气相平衡相图可分为三类。
这些图的纵轴是温度(沸点),横轴是代表液体B的摩尔分数。
在图中有两条曲线:上面的曲线是气相线,表示在不同溶液的沸点与溶液成平衡时的气相组成,下面的曲线表示液相线,代表平衡时液相的组成。
三、实验仪器和药品1.实验仪器仪器名称数量仪器名称数量玻璃沸点仪一套阿贝折光仪一台WLS系列可调式恒流电源一台SWJ型精密数字温度计一台SYC超级恒温槽一台2.药品异丙醇环己烷四、实验步骤1.按要求连接好实验装置。
注意:感温杆勿与电热丝相碰。
2.接通冷凝水,用超级恒温槽完成冷凝循环。
量取35ml异丙醇从测管加入蒸馏瓶内,并时传感器浸入溶液3㎝左右。
将加热丝接通恒流电源,将电流调定1.1安,使电热丝将液体加热至缓慢沸腾,待温度基本恒定后,再连同支架一起倾斜蒸馏瓶,使小槽中气相冷凝液倾回蒸馏瓶内,重复三次,记下乙醇的沸点及环境气压。
3.依次再加入2、6、12、20ml环己烷,同上法测定溶液的沸点和吸取气、液相并测其折射率。
4.将溶液倒入回收瓶。
5.从侧管加入35ml环己烷,测其沸点。
6.依次加入2、4、10、16ml异丙醇,按上法测其沸点和吸取气、液相并测其折射率。
7.关闭仪器和冷凝水,将溶液倒入回收瓶。
五、实验注意现象1.沸点仪中没有装入溶液之前绝对不能通电加热,如果没有溶液,通电加热丝时,沸点仪会炸裂。
2.一定要在停止通电加热之后,方可取样进行分析。
双液系气液平衡相图的绘制

实验四双液系气液平衡相图的绘制姓名:谭成彬班级:生物工程学院生物工程07级四班学号;07041010428一、实验目的1.测定常压下环己烷—乙醇二元系统的气液平衡数据,绘制沸点—组成相图。
2.掌握双组份沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝斯折射仪的使用方法。
二、实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组间分溶解度不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合成完全互溶体系时,如果该两组分的蒸汽压不同,则混合物的组成于平衡的气相的组成不同。
当压力保持一定,混合物沸点与两组分的含量有关。
恒定压力下,真实的完全互溶双液系的气—液平衡相图(T—x图),根据体系对拉乌尔的偏差情况,可分为三类:1)一般偏差:混合物的沸点介于两种纯组分之间,如果苯—苯体系,如图1(a)所示。
2)最大负偏差:混合物存在最高沸点,如盐—水体系,如图1(b)所示。
3)最大正偏差:混合物纯在最低沸点,如正丙醇—水体系,如图1(c)所示。
(a) (b)(c)图1 二组分也太混合物气——液平衡相图(T—x图)对于后两种情况,为具有沸点的双系相图。
他们爱最高或最低衡沸点时气相和液相组成相同,因而不能像第一类那样通过反复蒸馏的方法而使双液系的两个组分分离,而只能采取精馏扥那个方法分离出一种纯物质和另一种衡沸混合物。
为了测定双液系的T—x图,需要在气—液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验一环己烷—乙醇为体系,该体系属于上述第三类型,在沸点仪中蒸馏不同组成的混合物,、液二相组成,即可作出T—x 相图。
本实验气液两相的组成均采用折光率测定。
折光率是物质的一个特征数值,天宇物质的浓度计温度有关,因此在测定物质的折光率是要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同,因此可先配制一系列已知组成的溶液,在恒定温度下扯其折光率,作出折光率—组成曲线,便可通过折光率的大小在工作曲线上找出未知溶液的组成。
完全互溶双液系气液平衡相图的绘制

完全互溶双液系气液平衡相图的绘制一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法及原理。
4.了解和掌握沸点仪的测定原理及方法。
5.加深对完全互溶双液系气液平衡相图的理解和增强个人动手能力。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T-x 图),根据体系对拉乌尔定律的偏差情况,可分为三类:(1 )一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a) 所示。
(2 )最大负偏差:存在一个最小蒸气压值,比两个纯液体的蒸气压都小,混合物存在着最高沸点,如盐酸-水体系,如图 1 (b) 所示。
(3 )最大正偏差:存在一个最大蒸气压值,比两个纯液体的蒸气压都大,混合物存在着最低沸点,如正丙醇—水体系,如图1(c) )所示。
对于后两种情况,为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了绘制双液系的T-x 相图,需测定几组原始组成不同的双液系在气-液两相平衡后的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型。
在沸点仪(如图 2 所示)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x 相图。
本实验中气液两相的组成均采用折光率法测定。
折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
双液系的气液平衡相图(物理化学实验)

双液系的气液平衡相图实验者:林澄昱生04 2010030007 同组者:张弯弯实验日期:2012-03-10 提交日期:2012-03-16实验指导:刘晓惠1引言两种蒸气压不同的挥发性液体在混合之后,其溶液组成与与其平衡气相的组成不同。
在恒外压下,二组分系统达到气液平衡时,表示液态混合物的沸点与平衡时气液两相组成关系的相图,称为沸点和组成(T-x)图。
大致分为三大类,包括:(1)理想液体混合物或接近理想液体混合物的双液系,其混合物沸点介于两纯物质沸点之间。
见图1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,有最高恒沸点。
见图1(b);(3)各组分蒸汽压对拉乌尔定律产生很大的正偏差,有最低恒沸点。
见图2(c)1。
图1 三类沸点组成(T-x)图本实验为了绘制常压下环己烷-乙醇的气液平衡相图,先利用阿贝折射仪测定一系列已知组成混合溶液及纯液体的折射率,绘制标准曲线,再通过沸点仪测定一系列混合溶液的沸点,收集少量气相冷凝液以及溶液,测定其各自折射率,反查标准曲线得到气液两相的组成,绘得双液系的气液平衡相图。
2实验操作2.1实验药品、仪器及测试装置示意图2.1.1实验药品环己烷,无水乙醇;2.1.2实验仪器沸点仪,调压器,温度传感器,锥形瓶,分析天平(AR2140),阿贝折射仪(型号不明,为靠近恒温箱的一台),恒温箱,胶头滴管,10ml吸量管,洗耳球;2.1.3装置示意图1. 冷却水入口2. 气相冷凝液贮存小泡3. 温度传感器4. 喷嘴5. 电热丝6. 调压器2图2 沸点仪2.2实验条件恒温槽温度:26 ℃室温:未测气压:未测2.3实验操作步骤及方法要点2.3.1标准曲线的测定及绘制2.3.1.1标准溶液的配制取5个干燥、洁净的锥形瓶,编号为1~5,分别称量空瓶质量并记录;依照表1分别量取并加入相应体积的环己烷和无水乙醇,每加入一种溶液以后称量其质量并记录;得到5份已知组分的标准溶液。
表1 标准溶液的配制方案通过称量得到的质量,可以计算得到每锥形瓶中液体含有的环己烷质量分数,通过测定其折射率,可以确定特定环己烷质量分数与折射率的关系;同时,直接量取纯的无水乙醇和环己烷,测定其折射率,可以绘制在环己烷质量分数在0~1之间的无水乙醇混合溶液与折射率的关系曲线。
双液系气液平衡相图的绘制(华南师范大学物化实验)

双液系气—液平衡相图的绘制一、实验目的(1)用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图.找出恒沸点混合物的组成及恒沸点的温度.(2)掌握测定双组分液体的沸点及正常沸点的测定方法.(3)了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。
二、实验原理2。
1液体的沸点液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。
2。
2双液系的沸点双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关.理想的二组分体系在全部浓度范围内符合拉乌尔定律。
结构相似、性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T —x (y )图。
大多数情况下,曲线将出现或正或负的偏差.当这一偏差足够大时,在T —x(y )曲线上将出现极大点(负偏差)或极小点(正偏差)。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物.恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a )所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图1(b )所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点,如水-乙醇体系,如图1(c ))所示。
图1. 二组分真实液态混合物气-液平衡相图(T —x 图)考虑综合因素,实验选择具有最低恒沸点的乙醇—乙酸乙酯双液系。
根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1.若温度一定时,则气液亮相的组成也随之而定。
当溶液组成一定时,根据杠杆原t AtAt At Bt B t Bt / o Ct / o t / o x Bx Bx B ABAABB(a)(b)(c)x 'x '理,两相的相对量也一定。
双液系的气液平衡相图-物化实验报告
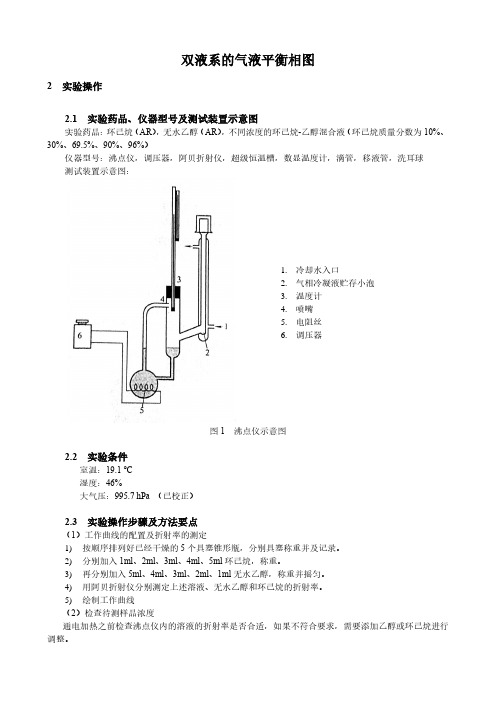
双液系的气液平衡相图2 实验操作2.1 实验药品、仪器型号及测试装置示意图实验药品:环己烷(AR),无水乙醇(AR),不同浓度的环己烷-乙醇混合液(环己烷质量分数为10%、30%、69.5%、90%、96%)仪器型号:沸点仪,调压器,阿贝折射仪,超级恒温槽,数显温度计,滴管,移液管,洗耳球测试装置示意图:1.冷却水入口2.气相冷凝液贮存小泡3.温度计4.喷嘴5.电阻丝6.调压器图1 沸点仪示意图2.2 实验条件室温:19.1 ℃湿度:46%大气压:995.7 hPa (已校正)2.3 实验操作步骤及方法要点(1)工作曲线的配置及折射率的测定1)按顺序排列好已经干燥的5个具塞锥形瓶,分别具塞称重并及记录。
2)分别加入1ml、2ml、3ml、4ml、5ml环己烷,称重。
3)再分别加入5ml、4ml、3ml、2ml、1ml无水乙醇,称重并摇匀。
4)用阿贝折射仪分别测定上述溶液、无水乙醇和环己烷的折射率。
5)绘制工作曲线(2)检查待测样品浓度通电加热之前检查沸点仪内的溶液的折射率是否合适,如果不符合要求,需要添加乙醇或环己烷进行调整。
(3)测定各溶液达到汽液平衡时的气相和液相组成打开冷却水,接通电源,慢慢调节调压器电压进行加热,直到溶液沸腾或者出现小气泡,再将电压调到33V。
待温度恒定后,记下该温度值,关电压,停止加热,同时用长滴管从冷凝管上口在小泡中取气相冷凝液,迅速测定折射率,液相溶液稍冷后,从温度计口取液相溶液测定折射率(沸腾过程已经使液相混合比较均匀了,类似“鼓泡法”;而且实际上也没有地方伸入滴管进行搅拌)。
如果沸点仪圆底烧瓶内液体快要蒸干了、电阻丝没有浸泡在液体中,就要及时补充溶液,否则体系内温度会急剧上升。
如果液面低于烧瓶侧面支管口,应及时补充液体,否则无法取液相溶液。
补充溶液时,要等到体系冷却下来。
3 结果与讨论3.1 原始实验数据表1 环己烷-乙醇混合液(标准液)的折射率序号空瓶质量/g瓶+乙醇质量/g瓶+混合液质量/g折射率129.932130.624634.4739 1.3701231.016832.487935.5774 1.3810331.169233.423335.6596 1.3926427.875530.927732.4152 1.4040528.387232.241132.9446 1.41696无水乙醇 1.36387纯环己烷 1.4284表2 环己烷-乙醇混合液(待测液)沸点及气相、液相的折射率序号环己烷质量分数温度/℃气相冷凝液折射率液相折射率1077.56 1.3638 1.3634210%75.63 1.3704 1.3654330%73.16 1.3825 1.3668469.50%64.42 1.3978 1.3817590%64.65 1.4072 1.4162696%67.26 1.4108 1.42417100%80.13 1.4278 1.4272 3.2计算的数据、结果(1)绘制折射率-组成工作曲线根据表1数据计算出各个标准溶液对应的环己烷质量分数,如表3。
完全互溶双液系气液平衡相图的绘制。实验报告

完全互溶双液系气液平衡相图的绘制一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图2.7(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图2.7(c))所示。
图2.7 二组分真实液态混合物气—液平衡相图(T-x 图)后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T -x 相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2.8)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T -x 相图。
本实验中两相的成分分析均采用折光率法测定。
折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同。
因此可先配制一系列已知组成的溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的组成。
物化实验报告_双液系的气液平衡相图

双液系的气液平衡相图1.1实验目的1.用沸点仪测定在常压下环已烷—乙醇的气液平衡相图。
2.掌握阿贝折射仪的使用方法。
1.2 实验原理将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。
在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。
沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。
第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。
图1 沸点组成图为了测定二元液系的T-x图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。
本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。
方法是用沸点仪(图2)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折射仅测定其折射率。
为了求出相应的组成,必须先测定已知组成的溶液的折射率,作出折射率对组成的工作曲线,在此曲线上即可查得对应于样品折射率的组成。
沸点仪的种类很多,图2所示是一种带有电阻丝加热的沸点仪。
沸腾的溶液由喷嘴喷向温度计,因此可以测得蒸气与液相平衡的温度。
气相经冷凝后贮存在小泡内。
图2 沸点仪1 水冷却入口,2 气相冷凝液贮存小泡,3 温度计,4 喷嘴,5 电炉丝,6 调压器2 实验操作2.1 实验药品、仪器型号及测试装置示意图1.仪器沸点仪、调压器、阿贝折射仪(编号00011887)SL-1超级恒温槽、1/10℃温度计、酒精温度计、滴管、放大镜。
大学物化实验报告--双液系的气—双液系的气—液平衡相图(精编文档).doc

【最新整理,下载后即可编辑】实验目的与要求:1. 绘制常压下环己烷-乙醇双液系的气液平衡相图(T—X图),了解相图和相律的基本概念;2. 掌握测定双组分液体的沸点及正常沸点的方法;3. 掌握用折光率确定二元液体组成的方法。
实验原理:常温下,任意两种液体混合组成的体系称为双液体系。
若两液体能按任意比例相互溶解,则称完全互溶双液体系;若只能部分互溶,则称部分互溶双液体系。
双液体系的沸点不仅与外压有关,还与双液体系的组成有关。
恒压下将完全互溶双液体系蒸馏,测定馏出物(气相)和蒸馏液(液相)的组成,就能找出平衡时气、液两相的成分并绘出T—X图。
通常,如果液体与拉乌尔定律的偏差不大,在T—X图上溶液的沸点介于A、B二纯液体的沸点之间见图1 (a)。
而实际溶液由于A、B二组分的相互影响,常与拉乌尔定律有较大偏差,在T—X图上就会有最高或最低点出现,这些点称为恒沸点,其相应的溶液称为恒沸点混合物,如图1(b),(c)所示。
恒沸点混合物蒸馏时,所得的气相与液相组成相同,因此通过蒸馏无法改变其组成。
图1 完全互溶双液系的相图图2 沸点仪 1.温度计;2.加料口;3.加热丝;4.气相冷凝液取样口;5.气相冷凝液本实验采用回流冷凝的方法绘制环己烷-乙醇体系的T —X 图。
其方法是用阿贝折射仪测定不同组分的体系在沸点温度时气相、液相的折射率,再从折射率—组成工作曲线上查得相应的组成,然后绘制T —X 图 仪器与试剂:沸点仪1套 超级恒温槽1台WZS -I 型阿贝折光仪25ml 量筒、小漏斗、滴管、大烧杯无水乙醇 , 环己烷,x 环己烷 各为0.1,0.3,0.5,0.7,0.95的乙醇溶液。
(250mL 试剂瓶盛装)注:x 环己烷 为环己烷的物质的量分数浓度,定义为乙醇环己烷环己烷环己烷n n n x +=个人实验图乙醇/环己烷平衡相图温度/℃908070600.000.200.400.600.80 1.00 1.20环己烷%最低恒沸物的沸点64.9℃。
双液系气液平衡相图的测绘实验流程

为二进制系统绘制气体—液体平衡相图的实验涉及多个步骤。
一,实验设置必须做好准备。
这包括装配必要的设备,如高压反应堆、供气系统和温度控制系统。
反应堆在使用前应小心清洗和干燥,以确保实验的准确性。
一旦设置完成,下一步就是准备样本解决方案。
这涉及按预期比例衡量和混合二进制的两个组成部分。
必须注意确保解决办法完全混合,避免任何可能影响实验结果的杂质。
在样品溶液制备后,它们被引入高压反应堆,然后用期望的气体密封并加压。
随后反应堆被置于温度控制系统中,其中温度逐渐上升或下降,以探索系统在一系列温度中的相位行为。
在实验中,气体和液体相的样品是在不同的温度和压力下采集的。
然后利用气相色谱或光谱测量等技术对这些样品进行分析,以确定每个阶段的构成。
这些数据对构建相位图至关重要。
实验数据被绘制在一个图表上,为二进制系统构建气体—液体平衡相图。
本图显示了气温,气压,气相和液相的构成之间的关系。
通过分析相位图,可以得到关于二进制系统的相位行为和热力学性质的宝贵信息。
为二进制系统绘制气体—液态平衡相图的过程是一项复杂而复杂的实
验,需要仔细准备、精确测量和严格分析。
然而,从这一实验中获得的结果可以为系统在不同条件下的行为提供有价值的洞察力,这对于各种工业工艺和应用都是至关重要的。
完全互溶双液系气液平衡相图的绘制。实验报告

完全互溶双液系气液平衡相图的绘制一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图2.7(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点如图2.7(c))所示。
图2.7 二组分真实液态混合物气—液平衡相图(T-x 图)后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T -x 相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪(如图2.8)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T -x 相图。
本实验中两相的成分分析均采用折光率法测定。
折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同。
因此可先配制一系列已知组成的溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的组成。
完全互溶双液系气液平衡相图的绘制。实验报告e

完全互溶双液系气液平衡相图的绘制一.实验目的1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。
2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。
3.掌握阿贝折射仪的使用方法。
二.实验原理两种液体物质混合而成的两组分体系称为双液系。
根据两组分间溶解度的不同,可分为完全互溶、局部互溶和完全不互溶三种情况。
两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,那么混合物的组成与平衡时气相的组成不同。
当压力保持一定,混合物沸点与两组分的相对含量有关。
恒定压力下,真实的完全互溶双液系的气-液平衡相图〔T -x 〕,根据体系对拉乌尔定律的偏差情况,可分为3类: 〔1(a)所示。
〔2〕最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—(b)所示。
〔3(c)〕所示。
图2.7 二组分真实液态混合物气—液平衡相图〔T-x 图〕后两种情况为具有恒沸点的双液系相图。
它们在最低或最高恒沸点时的气相和液相组成相同,因而不能象第一类那样通过反复蒸馏的方法而使双液系的两个组分相互别离,而只能采取精馏等方法别离出一种纯物质和另一种恒沸混合物。
为了测定双液系的T -x 相图,需在气-液平衡后,同时测定双液系的沸点和液相、气相的平衡组成。
本实验以环己烷-乙醇为体系,该体系属于上述第三种类型,在沸点仪〔如图2.8〕中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T -x 相图。
本实验中两相的成分分析均采用折光率法测定。
折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率时要求温度恒定。
溶液的浓度不同、组成不同,折光率也不同。
因此可先配制一系列组成的溶液,在恒定温度下测其折光率,作出折光率-组成工作曲线,便可通过测折光率的大小在工作曲线上找出未知溶液的组成。
三.仪器与试剂t At At At Bt B t Bt / o Ct / o Ct / o Cx Bx Bx BABAABB(a)(b)(c)x 'x '沸点仪,阿贝折射仪,调压变压器,超级恒温水浴,温度测定仪,长短取样管。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
双液系气-液平衡相图的绘制一、实验目的(1)用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。
找出恒沸点混合物的组成及恒沸点的温度。
(2)掌握测定双组分液体的沸点及正常沸点的测定方法。
(3)了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。
二、实验原理2.1液体的沸点液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。
2.2双液系的沸点双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。
理想的二组分体系在全部浓度范围内符合拉乌尔定律。
结构相似、性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T-x (y )图。
大多数情况下,曲线将出现或正或负的偏差。
当这一偏差足够大时,在T-x (y )曲线上将出现极大点(负偏差)或极小点(正偏差)。
这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。
恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类:(1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。
(2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图1(b)所示。
(3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点,如水-乙醇体系,如图1(c))所示。
图1. 二组分真实液态混合物气—液平衡相图(T-x 图)考虑综合因素,实验选择具有最低恒沸点的乙醇-乙酸乙酯双液系。
根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1。
若温度一定时,则气液亮相的组成也随之而定。
当溶液组成一定时,根据杠t AtAt At Bt B t Bt / o Ct / o t / o x Bx Bx B ABAABB(a)(b)(c)x 'x '杆原理,两相的相对量也一定。
反之,实验中利用回流的方法保持气液两相的相对量一定,则体系的温度也随之而定。
2.3沸点测定仪沸点测定仪利用回流的方法保持气液两相相对量一定,测量体系温度不发生改变时,即两相平衡后,取出两相的样品,用阿贝折射计测定气液平衡气相、液相的折射率,再通过预先测定的折射率-组成工作曲线来确定平衡时气相、液相的组成(即该温度下气液两相平衡成分的坐标点)。
改变体系总成分,再如上法找出另一对坐标点。
这样得若干对坐标点后,分别按气相点和液相点连成气相线和液相线,即得T-x平衡图。
三、实验步骤3.1乙醇-乙酸乙酯溶液的折射率组成工作曲线的测绘3.1.1折射率-体积分数工作曲线。
对于乙醇-乙酸乙酯等部分有机液体混合体系,当使用体积分数(φ)表示时,能得到直线的工作曲线,故只要分别准确测出25℃时纯乙醇、乙酸乙酯的折射率,将其连成直线,就得到工作曲线(n-V)。
3.1.2折射率-摩尔分数工作曲线。
在线上取8个点,利用乙醇、乙酸乙酯的密度合量比(%)等条件将以上点对应体积分数换算成摩尔分数,按对应的折射率重新绘点,再将点连成平滑曲线,即为工作曲线(n-x)。
3.2沸点仪的安装将沸点仪洗净、烘干。
检查带温度计的软木塞是否塞紧、电热丝是否靠近容器底部的中心,温度计的水银球位置是否合适。
3.3样品的测定3.3.1溶液的配制粗略配制乙醇体积分数为5%、10%、15%、22%、38%、50%、70%、90%组成的乙醇-乙酸乙酯溶液。
3.3.2沸点的测定自侧管假如索要测定的溶液(约20mL),其页面应在水银球的中部。
打开冷凝水,接上电源,用调压变压器调节电压(约12V),将液体缓慢加热使液体沸腾,最初在冷凝管下端内的液体不能代表平衡气相的组成,为加速达到平衡,可以等小槽中气相冷凝液体收集满后,调节冷凝管的三通阀门,使冷凝液体流回圆底烧瓶,重复三次,直到温度计上的读数稳定数分钟,记录温度计的读数,同时读出环境的温度;算出露茎温度,以便进行温度校正,并读出室内大气压力。
3.3.3取样切断电源,停止加热,在冷凝管三通小槽处放置一个标有相应浓度记号的尾接小试管,并调节冷凝管的三通阀门,使冷凝液体不再流回至圆底烧瓶,而是流入尾接小试管中,并立即塞紧,防止其挥发;再用另一支干燥胶头滴管,从侧管处吸取容器中的溶液约1~2mL,转移到另一个小试管,也立即塞紧,两支小试管置于盛有冷水的小烧杯中保持待测,以防组分改变。
在样品的转移过程中动作要迅速而仔细。
并应尽早测定样品的折射率,不宜久藏。
当沸点仪内液体冷却后,将该溶液自侧管倒入到指定的回收瓶中,再换另一浓度的双液体系溶液测定。
3.3.4折射率的测定分别测定上面取的气相和液相样品的折射率。
每次加样要测读两次,若读得的两个数值很接近,则取其平均值。
每次加样前测量之前,必须先将折光仪的棱镜面洗净,方法是用数滴挥发性溶剂(如丙酮)淋洗,再用擦镜纸轻轻擦去残留在镜面上的溶剂,阿贝折射计在使用完毕后也必须将镜面处理干净。
3.3.5平衡气相和液相组成的测定根据气相折射率的数据,在工作曲线n-x上分别查出平衡气相和液相的组成(x)。
按上述步骤,本别测定乙醇和乙酸乙酯的沸点,以及各溶液的沸点和平衡时气相和液相的组成。
四、数据处理4.1溶液沸点的校正(1)由于温度计的水银未全部浸入待测温度的区域内而需进行露茎校正。
Δt露茎=Kh(t观-t环)式中,K=0.00016,是水银对玻璃的相对膨胀系数;h为露出于被测体系之外的水银柱长度,称露茎高度,以温度差值表示;t观为测量温度计上的读数;t环为环境温度,可用辅助温度计读出,其水银球置于测量温度计露茎的中部。
露茎校正后:t沸=t观+Δt露茎。
编号乙醇体积分数/%h/℃t观/℃t环/℃Δt露茎/℃t沸/℃1 100 72.1 79.0 24.0 0.63 79.632 90 70.4 77.3 23.5 0.61 77.913 70 67.9 74.8 23.5 0.56 75.364 50 66.2 73.1 23.5 0.53 73.635 38 65.8 72.7 23.5 0.52 73.226 22 65.8 72.7 23.5 0.52 73.227 15 66.2 73.1 23.8 0.52 73.628 10 67.3 74.2 23.5 0.55 74.759 5 68.8 75.7 23.8 0.57 76.2710 0 70.5 77.4 24.0 0.60 78.00表1.露茎校正数据记录(2)溶液的沸点与大气压有关,应用特鲁顿规则及克劳修斯-克拉贝龙公式可得溶液沸点因大气压变动的近似校正公式。
式中,ΔT是沸点的压力校正值;T沸是溶液的沸点(均用热力学温度表示);p是测定时的大气压,mmHg(1mmHg=133.32Pa)。
若用摄氏温标,Δt压表示沸点的压力校正值,则Δt压=Δt,由此,在1atm(1atm=101325Pa)下的溶液正常沸点为t正常=t沸+Δt压编号乙醇体积分数/%t沸/℃t沸/K p/mmHg ΔT/K t正常/℃1 100 79.63352.78773.25 -0.6279.012 90 77.91351.06773.25 -0.6177.303 70 75.36348.51773.25 -0.6174.754 50 73.63346.78773.25 -0.6073.035 38 73.22346.37773.25 -0.6072.626 22 73.22346.37773.25 -0.6072.627 15 73.62346.77773.25 -0.6073.028 10 74.75347.90773.25 -0.6174.149 5 76.27349.42773.25 -0.6175.6610 0 78.00351.15773.25 -0.6177.39表2.沸点的压力校正4.2乙醇-乙酸乙酯溶液的折射率组成工作曲线的绘制室温下,测得纯乙醇的折射率为 1.3621,纯乙酸乙酯的折射率为1.3728。
4.3折射率-摩尔分数工作曲线在图2的工作曲线上选取8个点,将对应点的体积分数换算成摩尔分数。
使用公式为名称密度ρ/(g·mL-1)相对分子质量M/(g·mol-1) 乙醇0.78506 46.07 乙酸乙酯0.92454 88.12表3.乙醇和乙酸乙酯的相关参数取点编号折射率/体积分数φ/% 摩尔分数X B1 1.3632900.942 1.3642800.873 1.3653700.794 1.3664600.715 1.3675500.626 1.3685400.527 1.3696300.418 1.3707200.29表4.绘制折射率-摩尔分数工作曲线数据记录4.4双液系气-液平衡相图的绘制编号乙醇体积分数/%沸点/℃液相折射率/液相中乙醇的摩尔分数气相折射率/气相中乙醇的摩尔分数1 100 79.01 1.3620 1 1.3617 12 90 77.30 1.3631 0.95 1.3646 0.853 70 74.75 1.3645 0.84 1.3668 0.674 50 73.03 1.3668 0.67 1.3680 0.575 38 72.62 1.3681 0.56 1.3690 0.476 22 72.62 1.3705 0.30 1.3696 0.407 15 73.02 1.3711 0.24 1.3705 0.308 10 74.14 1.3719 0.12 1.3710 0.259 5 75.66 1.3725 0.04 1.3720 0.1110 0 77.39 1.3727 0 1.3728 0表5.乙醇-乙酸乙酯混合液测定数据根据平衡相图,可得恒沸温度:72.60℃。
恒沸组成:乙醇的摩尔分数为0.418,乙酸乙酯的摩尔分数为0.582.五、注意事项(1)电阻丝一定要被待测液体浸没,否则电热丝容易烧断,而且通电加热时可能会引起有机液体燃烧。
(2)所加电压不能太大,加热丝上有小气泡逸出即可。
(2)先加溶液,再加热。
取样时,先停止通电再取样。
(3)每次取样量不宜过多,取样管一定要干燥,不能留有上次的残液,气相部分的样品要取干净。
(4)阿贝折射仪的棱镜不能用硬物触及,擦拭棱镜需用擦镜纸。
(5)测定折射率时,动作要迅速,尽量避免样品挥发损失,确保数据准确。
六、分析与讨论6.1实验结果讨论根据平衡相图,可得恒沸温度为72.60℃,乙醇的摩尔分数为0.418,乙酸乙酯的摩尔分数为0.582。
查找文献资料,查得乙醇-乙酸乙酯混合溶液的恒沸温度为56.9℃,乙醇的摩尔分数为0.0558,乙酸乙酯的摩尔分数为0.9442。
