分析化学试卷10
分析化学模拟试题卷10及答案

分析化学试卷10及答案选择题 ( 共 9题 18分 )1. 2 分对于下列四种表述,不正确的是----------------()(1) 为了减小测量误差,称样量越大越好(2) 仪器分析方法因使用仪器,因此准确度高(3) 增加平行测定次数不能消除系统误差(4) 做空白试验可消除系统误差(A)1,2 (B)1,2,4 (C)1,3,4(D)1,2,32. 2 分用沉淀滴定法测定银,下列方式中适宜的是-----------------( )(A) 莫尔法直接滴定 (B) 莫尔法间接滴定(C) 佛尔哈德法直接滴定 (D) 佛尔哈德法间接滴定3. 2 分用NaOH标准溶液测定FeCl3溶液中的游离HCl时,Fe3+将产生沉淀而引起干扰,可消除其干扰的物质是-----------------------( )(A) Na2H2Y (B) CaY2- (C) 柠檬酸三钠 (D)三乙醇胺4. 2 分某有色络合物溶液的透射比T = 9.77%,则吸光度值lg(1/T)为------------------( )(A)1.0 (B)1.01 (C)1.010(D)1.01015. 2 分移取饱和Ca(OH)2溶液50.00mL,用0.05000mol/L HCl标准溶液滴定,终点时, 耗去20.00mL,由此得Ca(OH)2沉淀的Ksp为-------------------------( )(A) 1.6×10-5 (B) 8.0×10-6(C) 2.0×10-6 (D) 4.0×10-66. 2 分若络合滴定反应为: M + Y = MY,则酸效应系数aY(H)表示--------------------( )│H+HiY(i=1-6)(A)[Y]/c(Y)(B) ∑[HiY]/c(Y)(C) [Y]/([Y]+∑[HiY]) (D) ([Y]+∑[HiY])/[Y]7. 2 分在一定酸度下,用EDTA滴定金属离子M。
化学物质分析考试试题

化学物质分析考试试题一、选择题(每题5分,共30分)1.以下哪种方法可以用来分离混合物中的无机酸和无机碱?A. 蒸发B. 萃取C. 结晶D. 水解2. 下列哪种技术常用于确定有机化合物的结构?A. 红外光谱B. 紫外光谱C. 质谱D. 核磁共振3. 化学物质分析中常用的气相色谱柱是由什么材料制成的?A. 玻璃B. 铝C. 铁D. 硅胶4. 下列哪种技术常用于确定化合物的相对分子质量?A. 毛细管电泳B. 红外光谱C. 质谱D. 紫外光谱5. 以下哪种技术常用于分离和提纯有机化合物?A. 蒸馏B. 透析C. 溶剂萃取D. 酸碱中和6. 下列哪种技术常用于确定金属元素的存在和浓度?A. 火焰原子吸收光谱法B. 紫外-可见光谱法C. 红外光谱法D. 核磁共振法二、填空题(每题10分,共30分)1. 化学式CH3COOH代表的是____________酸。
2. 某物质的分子式为C6H12O6,其相对分子质量为___________。
3. 用火焰原子吸收光谱法分析某金属离子时,其光源通常是_____________。
4. 红外光谱仪可以用来测量物质的_____________。
5. 溶剂萃取是利用不同溶解度将物质分离的一种_______________方法。
6. 在质谱图中,质谱能谱图显示了_____________。
三、简答题(共40分)1. 请简要解释质谱仪的原理和应用。
质谱仪是一种分析仪器,其原理基于对样品分子进行电离,并测量这些离子分子的相对质量和丰度的能力。
其主要包括离子源、质量分析器和检测器。
首先,样品中的分子会被电离成带正电荷的离子,并通过电场加速器加速,然后进入质量分析器。
在质量分析器中,离子根据它们的质量-电荷比通过磁场进行分离,最后被检测器检测并生成质谱图。
质谱仪广泛应用于有机化学、医学、环境科学等领域,可以用于确定化合物的分子结构、分析化学物质的质量和纯度等。
2. 请解释色谱技术的原理和应用。
分析化学试卷(含答案)

《分析化学》试卷一.选择题(每题2分,共30分)1. 定量分析中,精密度与准确度之间的关系是( )A.精密度高,准确度必然高B.准确度高,精密度也就高C.精密度是保证准确度的前提D.准确度是保证精密度的前提2. 可用下列何种方法减免分析测试中的系统误差()A.进行仪器校正B.增加测定次数C.认真细心操作D.测定时保证环境的湿度一致3. 测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA 标准溶液20.50mL,以下结果表示正确的是( )A.10%B.10.1%C.10.08%D.10.077%4. 在滴定分析中,一般用指示剂颜色的突变来判断化学计量点的到达,在指示剂变色时停止滴定。
这一点称为()A.化学计量点B.滴定误差C.滴定终点D.滴定分析5. 滴定管可估读到±0.01mL,若要求滴定的相对误差小于0.1%,至少应耗用体积()mLA. 10B. 20C. 30D. 406. 共轭酸碱对的Ka与Kb的关系是()A.KaKb = 1B.KaKb =KwC.Ka/Kb =KwD.Kb /Ka =Kw7. 酸碱滴定中选择指示剂的原则是()A.指示剂变色范围与化学计量点完全符合B.指示剂应在pH =7.00时变色C.指示剂的变色范围应全部或部分落入滴定pH突跃范围之内D.指示剂变色范围应全部落在滴定pH突跃范围之内8. 测定(NH4)2SO4中的氮时,不能用NaOH直接滴定,这是因为()A.NH3的Kb太小B.(NH4)2SO4不是酸C.(NH4)2SO4中含游离H2SO4D.NH4+的Ka太小9. 一般情况下,EDTA与金属离子形成的配合物的配位比是()A.1:1B.2:1C.1:3D.1:210. 铝盐药物的测定常用配位滴定法。
加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。
该滴定方式是()。
A.直接滴定法B.置换滴定法C.返滴定法D.间接滴定法11. 间接碘量法中加入淀粉指示剂的适宜时间是()。
分析化学试卷附答案
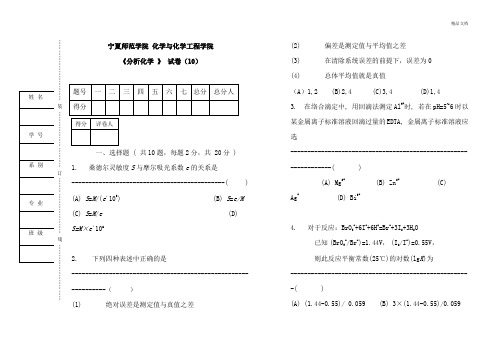
宁夏师范学院化学与化学工程学院《分析化学》试卷(10)一、选择题 ( 共10题,每题2分,共 20分 )1. 桑德尔灵敏度S与摩尔吸光系数e的关系是---------------------------------------------( ) (A) S=M/(e´106) (B) S=e/M (C) S=M/e(D)S=M×e´1062. 下列四种表述中正确的是--------------------------------------------------------------()(1) 绝对误差是测定值与真值之差(2) 偏差是测定值与平均值之差(3) 在清除系统误差的前提下,误差为0(4) 总体平均值就是真值(A)1,2 (B)2,4 (C)3,4 (D)1,43. 在络合滴定中, 用回滴法测定Al3+时, 若在pH=5~6时以某金属离子标准溶液回滴过量的EDTA, 金属离子标准溶液应选----------------------------------------------------------------( )(A) Mg2+ (B) Zn2+ (C)Ag+ (D) Bi3+4. 对于反应:BrO3-+6I-+6H+=Br-+3I2+3H2O已知(BrO3-/Br-)=1.44V,(I2/I-)=0.55V,则此反应平衡常数(25℃)的对数(lg K)为-----------------------------------------------------( )(A) (1.44-0.55)/ 0.059 (B) 3×(1.44-0.55)/0.059(C) 2×6×(1.44-0.55)/0.059(D) 6×(1.44-0.55)/0.0595. EDTA滴定金属离子时,若仅浓度均增大10倍,pM突跃改变--------------------------( )(A) 1个单位 (B) 2个单位(C) 10个单位 (D) 不变化6. 在氧化还原滴定中,配制Fe2+标准溶液时,为防止Fe2+被氧化,应加入--------------( )(A) HCl (B) H3PO4(C) HF (D) 金属铁7. 溴酸钾法测定苯酚的反应如下:BrO3- + 5Br- + 6H+→ 3Br2+ 3H2OBr2 + 2I-→ 2Br- + I2I2 + 2S2O32-→ 2I- + S4O62-在此测定中, Na2S2O3与苯酚的物质的量之比为-----------------------------------------( )(A) 6:1 (B) 4:1 (C) 3:1 (D) 2:18. 对 Ox-Red 电对, 25℃时条件电位( ) 等于--------------------------------------( )9. AgNO3滴定NaCl时,若浓度均增加10倍,则突跃pAg增加------------------------------( )(A)1个单位 (B)2个单位 (C)10个单位 (D)不变化………………………………装……………………………订……………………………线……………………10. 下面哪种说法不符合正态分布的特点--------------------------------------------------------( )(A) 大误差出现的概率小,小误差出现的概率大(B) 绝对值相同,正负号不同的误差出现的概率相等 (C) 误差为零的测量值出现的概率最大 (D) 各种数值的误差随机出现二、填空题 ( 共15题 30分 )11. 图1~图4是分光光度法中常见的图形,它们分别代表什么曲线(填A 、B 、C 、D)(1) 图1 __________ A. 工作曲线 (2) 图2 __________ B. 吸收曲线(3) 图3 __________ C. 络合比法测定络合物组成 (4) 图4 __________ D. 测量结果的相对误差 12. 在滴定分析中若指示剂的变色点与化学计量点恰好相同,____(能或不能)说滴定误差为零。
考研药学综合(分析化学)模拟试卷10(题后含答案及解析)

考研药学综合(分析化学)模拟试卷10(题后含答案及解析)题型有:1. 名词解释题 2. 单项选择题 3. 判断题请判断下列各题正误。
4. 简答题5. 计算题1.光谱线干扰正确答案:在所选光谱通带内,试样中共存元素的吸收线与被测元素的分析线相近(吸收线重叠)而产生的干扰称为光谱线干扰,使分析结果偏高。
消除办法:另选波长或化学方法分离干扰组分。
2.指示剂正确答案:指示剂是指能在计量点附近发生颜色变化的试剂。
3.偶然误差正确答案:偶然误差是由于一些难以控制的偶然原因所引起的误差。
4.n→σ*正确答案:含有杂原子的饱和化合物由杂原子空轨道(n)跃迁到σ反键轨道(σ*),此类跃迁需要的能量较高,n→σ*吸收波长一般落在远紫外区。
5.共沉淀正确答案:在一定条件下,当某沉淀从溶液中析出时,溶液中本不应形成沉淀的可溶性杂质也随该沉淀一起析出沉淀的现象称为共沉淀。
6.滴定终点正确答案:滴定分析中指示剂发生颜色改变的那一点。
7.金属离子指示剂正确答案:配位滴定中,能与金属离子生成有色配合物,从而指示滴定过程中金属离子浓度变化的显色剂(多为有机染料、弱酸)。
8.比移值正确答案:在一定条件下,溶质移动距离与流动相移动距离之比。
单项选择题下列各题的备选答案中,只有一个是符合题意的。
9.对配位反应中的条件稳定常数正确的叙述是( )。
A.酸效应系数总是小于配位效应系数B.条件稳定常数是理想状态下的稳定常数C.所有的副反应均使条件稳定常数减小D.条件稳定常数能更准确地描述配位化合物的稳定性正确答案:D10.测定某组分的保留指数,气相色谱法采用的基准物是( )。
A.苯与环己烷B.正丁烷和丁二烯C.正构烷烃D.苯和正庚烷正确答案:C11.玻璃电极膜电位产生的机理是( )。
A.电流B.离子交换和扩散C.电子传导D.电子扩散正确答案:B12.为使滴定终点颜色变化明显,扬司法测定卤化物时应避免的是( )。
A.不使卤化银呈胶状B.避光C.随指示剂Ka的不同而改变pH值D.被测离子浓度大些正确答案:A13.以下对洗脱体积判断正确的是( )。
分析化学试卷

C 沉淀剂、指示剂和催化剂
D 氧化剂、络合剂和掩蔽剂
9. 采用铬酸钾指示剂法,用AgNO3标准溶液直接测定Cl-含量时,要求溶液pH在 6.5~10.5
范围内。若酸度过高,则(
)。
A 形成Ag2O沉淀
C AgCl沉淀吸附Cl-增强
B CrO42-浓度降低,Ag2CrO4沉淀推迟
D AgCl沉淀不完全
)V。
6. 在非水滴定中,可以利用溶剂的(
)效应测定各种酸或碱的总浓度;也
可以利用溶剂的(
)效应测定各种酸或碱的含量。
7. 样品为As2O3, 沉淀形式为Ag3AsO4, 称量形式为AgCl, 被测成分为As,换算因数F为
(
)。
四、简答题(每题 5 分,共计 20 分)
1. 用 0.1000 mol/L 盐酸标准溶液测定药用硼砂含量,在实验设计和实验操作过程中,如何
终点变色敏锐。 ( )7. 氧化还原滴定曲线上任意点都说明该条件下两电对的电位相等。 ( ) 8. 用 0.1 mol/L 亚硝酸钠溶液滴定 0.1 mol/L 对氨基苯磺酸溶液和用 0.01 mol/L 亚
硝酸钠溶液滴定 0.01 mol/L 对氨基苯磺酸溶液,两种情况下的滴定突跃范围相同。 ( )9. 因为碘氧化还原电对中无氢离子,所以直接碘量法不受溶液 pH 值的影响。 ( )10. 在pH=12 溶液中,用EDTA滴定Ca2+, Mg2+不会干扰测定。
试卷一
分析化学试卷
一. 选择题(单选题,每题 1 分,共计 10 分)
1. 在KMnO4法中,若用HCl调节溶液酸度,则被测物的含量将(
)。
A 偏高
C 偏低
B 正常
D 偏低或偏高
成人教育分析化学试卷及标准答案

X X X大学继续教育学院试卷课程分析化学(专业)专业姓名学号得分1.下列各组物质中可用作标准缓冲溶液的是(C )A、HAc-NaAcB、六次甲基四胺C、硼砂D、NH4Cl-NH32.当两电对的电子转移数均为1 时,为使反应完全度达到99.9%,两电对的条件电位至少相差( D)A、0.09VB、0.18VC、0.27VD、0.36V3. 配位滴定中,出现指示剂的封闭现象的原因是(D )A、指示剂与金属离子生成的络合物不稳定B、被测溶液的酸度过高C、指示剂与金属离子生成的络合物翁定性小于MY 的稳定性D、指示剂与金属离子生成的络合物稳定性大于MY 的稳定性4.下列说法中违背非晶形沉淀条件的是( D )A、沉淀应在热溶液中进行B、沉淀应在浓的溶液中进行C、沉淀应在不断搅拌下迅速加入沉淀剂D、沉淀应放置过夜使沉淀陈化5. 符合比尔定律的有色溶液,浓度为c 时,透射比为T0,浓度增大一倍时,透射比的对数为( D)A、T0/ 2B、2T0C、(lgT0)/2D、2lgT06. 下列有关置信区间的描述中,正确的有:(A )A、在一定置信度时,以测量值的平均值为中心的包括真值的范围即为置信区间B、真值落在某一可靠区间的几率即位置信区间C、其他条件不变时,给定的置信度越高,平均值的置信区间越宽D、平均值的数值越大,置信区间越宽7. 用Zn2+标准溶液标定EDTA 时,体系中加入六次甲基四胺的目的是( B )A、中和过多的酸B、调节pH 值C、控制溶液的酸度D、起掩蔽作用8.用K 2Cr2O7 滴定Fe2+,在化学计量点时,有关离子浓度的关系是(C )A、[Fe 3+] = [Cr 3+],[Fe2+] = [Cr 2O72-]B、3[Fe 3+] = [Cr 3+],[Fe2+] = 6[Cr 2O72-]C、[Fe3+] = 3[Cr 3+],[Fe2+] = 6[Cr 2O72-]D 、[Fe3+] = 3[Cr 3+],6[Fe2+] = [Cr 2O72-]8. 在络合滴定中,用回滴法测定Al3+时,若在pH=5~ 6 时以某金属离子标准溶液回滴过量的EDTA,金属离子标准溶液应选( B )A、Mg 2+B、Zn 2+C、Ag +D、Bi 3+9. 每100 mL人体血浆中,平均含K+18.0mg和Cl-365 mg。
分析化学考试试卷

分析化学考试试卷.一选择题(共15分,每题1分)(一)某溶液含Ca2+、Mg2+及少量Al3+、Fe3+,今加入三乙醇胺, 调至pH=10, 以铬黑T为指示剂, 用EDTA滴定, 此时测定的是 C(A) Mg2+量 (B) Ca2+量(C) Ca2+, Mg2+总量(D) Ca2+,Mg2+,Al3+,Fe3+总量(二)强酸滴定强碱时,若浓度均增大10倍,则其pH突跃增大 B(A) 1 (B) 2 (C) 10 (D) 不变化(三)在一定酸度下,用EDTA滴定金属离子M。
当溶液中存在干扰离子N时, 影响络合剂总副反应系数大小的因素是 C(A) 酸效应系数αY(H)(B) 共存离子副反应系数αY(N)(C) 酸效应系数αY(H)和共存离子副反应系数αY(N)(D) 络合物稳定常数K(MY)和K(NY)之比值(四)用EDTA滴定Bi3+时, Fe3+干扰,用何种方法消除 B(A)加NaOH (B)加抗坏血酸 (C) 加三乙醇胺 (D)加KCN(五)用EDTA滴定Ca2+ Mg2+,若有少量Fe3+ Al3+干扰,消除干扰的方法是 D (A)加KCN掩蔽Fe3+加NaF掩蔽Al3+ (B)加抗坏血酸还原Fe3+加NaF掩蔽Al3+ (C)加NaOH沉淀Fe3+Al3+ (D)在酸性条件下加三乙醇胺,再调碱性掩蔽Fe3+Al3+(六)若仅设想常量分析用的滴定管读数误差±0.01mL,若要求测定的相对误差小于0.1%,消耗滴定液应大于 B(A)10mL (B)20mL (C)30mL (D)40mLB-4-1(七)用EDTA滴定法测定水中Ca2+含量,则用于标定EDTA的基准物质应为 D(A)Pb(NO3) (B) Na2CO3(C) Zn (D) CaCO3(八)下列算式的结果应以几位有效数字报出 D[0.1010? (25.00-24.80)] ÷1.0000(A) 五位(B) 四位(C) 三位(D) 二位(九)H2PO4-的共轭碱是D(A) H2PO4-(B) H3PO4(C) PO43-(D) HPO42-(十)已知H3PO4的p K a1 = 2.12, p K a2 = 7.20, p K a3 =12.36。
分析化学考研试题

分析化学考研试题---9一、选择题(20分,每题1分)1.准确移取饱和Ca(OH)2溶液50mL,用0.0500mol/LHCl标液滴定,终点时耗去20.00mL,由此得Ca(OH)2沉淀的K sp①1.6³10-5,②8.0³10-6,③2.0³10-6,④4.0³10-62.以某吸附指示剂(p K a=5.0)作银量法的指示剂,测定pH应控制在①pH<5,②pH>5,③5<pH<10,④pH>103.现用EDTA滴定含有Al3+、Fe3+、Zn2+的溶液中的Zn2+。
若用二甲酚橙(XO)做指示剂,Al3+、Fe3+对有封闭作用,为消除的Al3+、Fe3+干扰,可采用下列哪种掩蔽剂掩蔽①F-+抗坏血酸,②F-+CN-,③CN-,④抗坏血酸4.已知Ag+/Ag电对的标准电极电位фO=0.80,Ag2CrO4K sp=1.1³10-12。
则Ag2CrO4/Ag电对的标准电极电位为①0.80V,②0.45V,③1.15V,④0.10V5.已知MnO4-/Mn2+电对的标准电极电位фO=1.51V,当pH=3.0时,它的条件电位为①1.51V,②1.23V,③0.94V,④0.68V6.用二苯胺磺酸钠作指示剂,用Ce4+滴定Fe2+时,突跃范围为0.86V-1.26V。
若加入H3PO4后,则突跃范围为①0.86V-1.26V,②,0.86V-1.50V③,0.62V-1.26V④0.62V-1.50V7.佛尔哈德法可直接测定下列哪种离子①F-,②Cl-,③I-,④Ag+8.用重量法测定样品中的SiO2,一般用Na2CO3熔融后,用下列哪种溶剂浸取①H2O,②HCl,③HF,④CH3CH2OH9.若不知所测样品的组成,则要想检验分析方法有无系统误差,有效的方法是①用标准试样对照,②用人工合成样对照,③空白试验,④加入回收试验10.测定某铁样中镍的含量,现用熔融法分解该铁样,采用下列哪种坩埚材料较好①铁,②镍,③铂,④银11.已知的H3PO4p K a1-p K a3分别为2.12、7.20、12.36,则PO43-的p K b为①11.88,②6.80,③1.74,④2.1212.已知某酸的浓度与其酸度均为0.1mol/L,则这种酸为①H2SO4,②HAc,③HCl,④HF13.欲配制pH=5.00缓冲液500mL,已用去6mol/LHAc34.0mL则需加NaAc?3H2O约多少克(已知p K a=4.74,NaAc?3H2O式量136.1)①20,②30,③40,④5014.甲基橙(p K a=3.4)的变色范围为3.1-4.0,若用0.1mol/L NaOH滴定0.1mol/LHCl,则刚看到混合色时,[In]/[HIn]的比值为①1.0,②2.0,③0.5,④10.015.用浓度为0.1mol/L NaOH滴定等浓度的某弱酸HA或HB,若HA与HB的突跃范围的差别为+1.0pH单位,则HA和HB离解常数K aHA和K aHB比值K aHA / K aHB为①10,②100,③0.1,④0.01016.浓度为0.1mol/L的某弱酸弱碱盐NH4A溶液pH=7.00,则HA的p K a为(NH3?H2O K b=1.8³10-5)①9.26,②4.74,③7.00,④10.0017.现要用EDTA滴定法测定某水样中Ca2+的含量,则用于标定EDTA的基准物质应为①Pb(NO3)2,②Na2CO3,③Zn,④CaCO318.用双指示剂法测定某含有NaOH或NaHCO3或Na2CO3或某任意混合物的样品,若V1>V2>0,则溶液组成为①NaOH,②NaHCO3+Na2CO3,③NaOH+Na2CO3,④NaHCO319.氨盐中氮的测定,常用浓H2SO4分解试样,再加浓NaOH将NH3蒸馏出来,用一定量过量的HCl来吸收,剩余的HCl再用NaOH标液滴定,则化学计量点的pH在下列哪种范围①强酸性,②弱酸性,③强碱性,④弱碱性20.以FeSO4溶液滴定0.02000mol/L Ce(SO4)2溶液至化学计量点时,他们的体积比为0.5000,FeSO4溶液的浓度为(mol/L)①0.01000,②0.02000,③0.03000,④0.04000二、填空题(30分,每空1分)1.常用的氧化还原滴定法有、、。
分析化学试题及答案

分析化学试题及答案一、选择题(每题2分,共10分)1. 以下哪种物质不是分析化学中常用的缓冲溶液?A. 磷酸盐缓冲液B. 醋酸-醋酸钠缓冲液C. 碳酸钠缓冲液D. 硫酸铵缓冲液答案:D2. 滴定分析中,滴定终点的确定方法不包括以下哪项?A. 颜色变化法B. 电导法C. 重量法D. 电位法答案:C3. 原子吸收光谱分析中,元素的灵敏度与以下哪个因素无关?A. 原子化效率B. 光源强度C. 光谱仪分辨率D. 元素的原子量答案:D4. 高效液相色谱法(HPLC)中,分离效果与以下哪个因素无关?A. 柱温B. 流动相的组成C. 检测器类型D. 色谱柱的填料答案:C5. 紫外-可见光谱法中,最大吸收波长与以下哪个因素有关?A. 溶剂B. 温度C. 样品浓度D. 仪器的型号答案:A二、填空题(每空1分,共10分)1. 标准溶液的配制通常采用______法和______法。
答案:直接配制法;标定法2. 酸碱滴定中,滴定终点的pH值与______的pKa值接近。
答案:指示剂3. 色谱分析中,保留时间是指______。
答案:样品组分从进样到检测器的时间4. 原子吸收光谱分析中,火焰原子化器的原子化效率通常______石墨炉原子化器。
答案:低于5. 紫外-可见光谱法中,最大吸收波长对应的吸收系数称为______。
答案:摩尔吸光系数三、简答题(每题5分,共20分)1. 简述什么是标准溶液,并说明其在分析化学中的重要性。
答案:标准溶液是具有准确已知浓度的溶液,它在分析化学中用于校准仪器、标定其他溶液的浓度以及进行定量分析。
标准溶液的准确性直接影响分析结果的可靠性。
2. 解释什么是色谱分离原理,并举例说明。
答案:色谱分离原理是基于不同组分在固定相和流动相之间分配系数的差异,通过色谱柱实现组分的分离。
例如,在气相色谱中,不同的有机化合物在固定相(如聚二甲基硅氧烷)和流动相(如氮气或氦气)中的溶解度不同,从而实现分离。
3. 什么是原子吸收光谱分析中的基体效应?如何减少其影响?答案:基体效应是指样品中存在的其他元素或化合物对分析元素的原子化或吸收信号产生的影响。
分析化学试卷及其答案

分析化学测试卷一. 选择(40分)1.定量分析结果的标准偏差代表的是( C )。
A. 分析结果的准确度B. 分析结果的精密度和准确度C. 分析结果的精密度D. 平均值的绝对误差2.下列哪种情况应采用返滴定法( C )。
A. 用AgNO3标准溶液测定NaCl试样含量B. 用HCl标准溶液测定Na2CO3试样含量C. 用EDTA标准溶液测定Al3+试样含量D. 用Na2S2O3标准溶液测定K2Cr2O7试样含量3.下列各项叙述中不是滴定分析对化学反应要求的是( D )。
A. 反应必须有确定的化学计量关系B. 反应必须完全C. 反应速度要快D. 反应物的摩尔质量要大4.下列叙述中错误的是( B )。
A. K2CrO4指示剂法,在溶液pH=12时,用AgNO3标准溶液滴定含Cl-试样,会产生正误差B. 共沉淀、后沉淀和均匀沉淀都会使测定结果产生正误差C. 偶然误差可通过增加测定次数减小D. 在消除系统误差后,精密度高的结果,其准确度一定高5.重量分析法测定0.5126 g Pb3O4试样时,用盐酸溶解样品,最后获得0.4657 g PbSO4沉淀,则样品中Pb的百分含量为( C )。
(已知Pb3O4=685.6,PbSO4=303.26,Pb=207.2)。
A. 82.4%B. 93.1%C. 62.07%D. 90.8%6.用含少量NaHCO3的基准Na2CO3标定盐酸溶液时(指示剂变色点为pH5.1),结果将( D )。
A. 偏低B. 不确定C. 无误差D. 偏高分析:m不变,但消耗盐酸的V减小,由m/M =CV,则C增大7.碘量法测定漂白粉中有效氯时,其主要成分CaCl(OCl)与Na2S2O3的物质的量比为( B )A. 2:1B. 1: 2C. 1: 1D. 3: 18.磷酸的pKa1=2.12,pKa2=7.21,pKa3=12.66。
当用0.200mol/L NaOH标准溶液滴定浓度均为0.100mol/L盐酸和磷酸混合溶液时,可产生明显的滴定突跃最多为( B )。
分析化学试卷及答案10复习课程

分析化学试卷及答案10宁夏师范学院化学与化学工程学院《分析化学》试卷(10)一、选择题 ( 共10题,每题2分,共 20分 )1. 桑德尔灵敏度S与摩尔吸光系数e的关系是---------------------------------------------( )(A) S=M/(e´106) (B) S=e/M(C) S=M/e(D) S=M×e´1062. 下列四种表述中正确的是--------------------------------------------------------------()(1) 绝对误差是测定值与真值之差(2) 偏差是测定值与平均值之差(3) 在清除系统误差的前提下,误差为0(4) 总体平均值就是真值(A)1,2 (B)2,4 (C)3,4 (D)1,43. 在络合滴定中, 用回滴法测定Al3+时, 若在pH=5~6时以某金属离子标准溶液回滴过量的EDTA, 金属离子标准溶液应选----------------------------------------------------------------( )(A) Mg2+ (B) Zn2+ (C)Ag+ (D) Bi3+………………………………装……………………………订……………………………仅供学习与交流,如有侵权请联系网站删除谢谢24. 对于反应:BrO3-+6I-+6H+=Br-+3I2+3H2O已知(BrO3-/Br-)=1.44V,(I2/I-)=0.55V,则此反应平衡常数(25℃)的对数(lg K)为-----------------------------------------------------( )(A) (1.44-0.55)/ 0.059 (B) 3×(1.44-0.55)/0.059(C) 2×6×(1.44-0.55)/0.059(D) 6×(1.44-0.55)/0.0595. EDTA滴定金属离子时,若仅浓度均增大10倍,pM突跃改变--------------------------( )(A) 1个单位 (B) 2个单位(C) 10个单位 (D) 不变化6. 在氧化还原滴定中,配制Fe2+标准溶液时,为防止Fe2+被氧化,应加入--------------( )(A) HCl (B) H3PO4(C) HF (D) 金属铁7. 溴酸钾法测定苯酚的反应如下:BrO3- + 5Br- + 6H+→ 3Br2+ 3H2OBr2 + 2I-→ 2Br- + I2I2 + 2S2O32-→ 2I- + S4O62-在此测定中, Na2S2O3与苯酚的物质的量之比为-----------------------------------------( )(A) 6:1 (B) 4:1 (C) 3:1 (D) 2:18. 对 Ox-Red 电对, 25℃时条件电位( ) 等于 --------------------------------------( )仅供学习与交流,如有侵权请联系网站删除谢谢39. AgNO3滴定NaCl时,若浓度均增加10倍,则突跃pAg增加------------------------------( )(A)1个单位 (B)2个单位 (C)10个单位 (D)不变化10. 下面哪种说法不符合正态分布的特点--------------------------------------------------------( )(A) 大误差出现的概率小,小误差出现的概率大 (B) 绝对值相同,正负号不同的误差出现的概率相等(C) 误差为零的测量值出现的概率最大(D) 各种数值的误差随机出现二、填空题 ( 共15题 30分 )11. 图1~图4是分光光度法中常见的图形,它们分别代表什么曲线(填A、B、C 、D)得分评卷人仅供学习与交流,如有侵权请联系网站删除谢谢4仅供学习与交流,如有侵权请联系网站删除 谢谢5(1) 图1 __________ A. 工作曲线 (2) 图2 __________ B. 吸收曲线(3) 图3 __________ C. 络合比法测定络合物组成(4) 图4 __________ D. 测量结果的相对误差 12. 在滴定分析中若指示剂的变色点与化学计量点恰好相同,____(能或不能)说滴定误差为零。
《分析化学》试卷(附答案)

《分析化学》试卷(附答案)分析化学试卷(答案)⼀、填空(共15分每空1分)1.⽤⽆⽔Na2CO3标定HCl溶液时,选⽤甲基橙作指⽰剂。
若Na2CO3吸⽔,则测定结果偏⾼。
2.标定EDTA时,若选⽤铬⿊T作指⽰剂,则应控制pH=10。
若选⽤⼆甲酚橙作指⽰剂,则应控制pH=5。
3.测定⽔的总硬度时⽤三⼄醇胺掩蔽Fe3+、Al3+等少量共存离⼦。
4.50ml滴定管的最⼩分度值是0。
1ml,如果放出约20ml溶液时,记录数据为位有效数字。
在滴定操作中左⼿控制滴定管,右⼿握锥形瓶。
5.铝合⾦中铝含量的测定中,在⽤Zn2+返滴定过量的EDTA后,加⼊过量的NH4F,使AlY-与F-发⽣置换反应,反应式为AlY-+6F-+2H+== AlF63-+H2Y2-6.⽤移液管吸取溶液时,右⼿拿移液管,左⼿拿吸⽿球,溶液上升⾄标线以上,迅速⽤⾷指按紧上⼝。
7.在定量转移中,当溶液由烧杯沿玻璃棒转移主容量瓶内,溶液流完后,将烧杯沿玻璃棒稍向上提。
⼆、选择(共10分每题1分)1.⽤SO42-使Ba2+形成BaSO4沉淀时,加⼊适当过量的SO42-,可以使Ba2+沉淀的更完全,这是利⽤何种效应?( E )A.盐效应;B.酸效应;C.络合效应;D.溶剂化效应;E.同离⼦效应.2.⽤重铬酸钾法测定铁矿⽯中铁的含量时选⽤下列哪种还原剂?( A )A.⼆氯化锡;B.双氧⽔;C.铝;D.四氯化锡.3.⽤下列哪⼀标准溶液滴定可以定量测定碘?(D )A.Na2S;B.Na2SO3;C.Na2SO4;D.Na2S2O3.4.⽤含有微量杂质的草酸标定⾼锰酸钾浓度时,得到的⾼锰酸钾的浓度将是产⽣什么结果?( B )A.偏⾼;B.偏低;C.正确;D.与草酸中杂质的含量成正⽐.5.不含其它⼲扰性杂质的碱试样,⽤0.1000MHCl滴定⾄酚酞变⾊时,⽤去HCl20.00ml,加⼊甲基橙后,继续滴定⾄终点⼜⽤去HCl10.00ml,此试样为下列哪种组成?( A )A.NaOH, Na2CO3 ;B.Na2CO3 ;C.Na2CO3 , NaHCO3 ;D.NaHCO3 , NaOH .6.EDTA在PH<1的酸性溶液中相当于⼏元酸?( E )A.3;B.5;C.4;D.2;E.6.7.如果要求分析结果达到0.1%的准确度,滴定时所⽤滴定剂溶液的体积⾄少应为多少ml?(D )A.10ml;B.10.00ml;C.18ml;D.20ml.11.配制0.1M的NaS2O3标准液,取⼀定量的Na2S2O3晶体后,下列哪步正确?( B )A.溶于沸腾的蒸馏⽔中,加0.1gNa2CO3放⼊棕⾊瓶中保存;B.溶于沸腾后冷却的蒸馏⽔中,加0.1gNa2CO3放⼊棕⾊瓶中保存;C.溶于沸腾后冷却的蒸馏⽔中,加0.1gNa2CO3放⼊玻璃瓶中保存.8.使⽤碱式滴定管滴定的正确操作⽅法应是下⾯哪种?(B )A.左⼿捏于稍⾼于玻璃近旁;B.右⼿捏于稍⾼于玻璃球的近旁;C.左⼿捏于稍低于玻璃球的近旁.9.欲取50ml某溶液进⾏滴定,要求容器量取的相对误差≤0.1%,下列容器中应选哪种?( D )A.50ml滴定管;B.50ml容量瓶;C.50ml量筒;D.50ml移液管.10.需配0.1MHCl溶液,请选最合适的仪器量取浓酸.( A )A.量筒;B.容量瓶;C.移液管;D.酸式滴定管.三、简答(共30分每⼩题5分)1.⽤草酸钠标定KMnO4溶液时,适宜的温度范围为多少?过⾼或过低有什么不好?为什么开始滴⼊的KMnO4紫⾊消失缓慢,后来却消失很快?写出该标定反应的化学⽅程式。
分析化学试卷10

5.以甲基橙为指示剂,用0.1mol/LHCl滴定0.1mol/LNa
2B
4O
7溶液,以测定Na
2B
4O
7.
10H
2O试剂的纯度,结果表明该试剂的纯度为110%。已确定HCl浓度及操作均无问题,则因其此结果的原因是__________________。
4的质量百分数。(BaCl
2Mr=208.24,BaCrO
4Mr=253.32,BaO Mr=153.33)
四、设计题
今有50ml含Ni2+
水溶液,由于较多的共存离子存在,需萃取分离后才能进行分光光度测定。请设计此萃取实验,使样品萃取后可以直接测定。(需指出实验所需要的主要仪器、试剂、简要实验过程和步骤)
、Mg2+
增加而Zn2+
、Ni2+
减小D.Zn2+
、Ni2+
增加而Ca2+
、Mg2+减小
13.
(1)用0.050mol/L KMnO
4溶液滴定0.25mol/L Fe2+
溶液,
(2)用0.010mol/L KMnO
4溶液滴定0.050mol/L Fe2+
溶液;上述两种情况下其滴定突跃将是A.一样大B.
4试样0.4650g,样品经溶解处理后加入过量稀硫酸,此时,BaCrO
4不沉淀。沉淀经陈化、过滤、洗涤后置于恒重瓷坩埚中,在800-850℃灼烧至恒重,称其重量为0.2650g。合并滤液处理后,用莫尔法以
0.1200mol/LAgNO
化工系10分析化学-酸碱平衡

某溶液可能含有NaOH和各种磷酸盐,今用一HCl标准溶液滴定,以酚酞为指示剂时, 用去 12.84 mL, 若改用甲基橙为指示剂则需20.24 mL, 此混合液的组成是----------------( )(A) Na3PO4 (B) Na3PO4+NaOH(C) Na3PO4+Na2HPO4(D) Na2HPO4+NaH2PO4下列物质中属于两性物质的是--------------------------------------------( ) (A) H2CO3 (B) 氨基乙酸盐酸盐(C) 氨基乙酸 (D) 氨基乙酸钠以同浓度NaOH溶液滴定某一元弱酸(HA),若将酸和碱的浓度均增大10倍, 两种滴定pH相同时所相应的中和百分数是----------------------------------------( )(A) 0 (B) 50 (C) 100 (D) 150用NaOH溶液滴定H3PO4溶液至pH = 4.7时,溶液的简化质子条件为--------------( )(H3PO4的p K a1~p K a3分别是2.12、7.20、12.36)(A) [H3PO4] = [H2PO4-] (B) [H2PO4-] = [HPO42-] (C) [H3PO4] = [HPO42-] (D) [H3PO4] = 2[PO43-]六次甲基四胺[(CH 2)6N 4]缓冲溶液的缓冲pH 范围是-------------------------------------( ) ⎨p K b [(CH 2)6N 4] = 8.85⎬(A) 4~6 (B) 6~8 (C) 8~10 (D) 9~11下列溶液用酸碱滴定法能准确滴定的是-------------------------------------------( ) (A) 0.1 mol/L HF (p K a = 3.18) (B) 0.1 mol/L HCN (p K a = 9.21) (C) 0.1 mol/L NaAc [p K a (HAc) = 4.74] (D) 0.1 mol/L NH 4Cl [p K b (NH 3) = 4.75]二乙三氨五乙酸( ETPA, 用HL 表示)的p K a1~p K a5分别是1.94、2.87、4.37、8.69和10.56, 溶液中的H 3L 2-组分浓度最大时的pH 是------------------------------------( ) (A) 2.87 (B) 3.62 (C) 5.00 (D) 9.62用NaOH 滴定某一元酸HA,在化学计量点时,[H +]的计算式是--------------------------( ) (A) )(a HA ⋅c K (B) )()(a -A HA ⋅c c K (C))(a W-A ⋅c K K (D))(W a -A ⋅c K K写出CaCl2溶液的物料平衡方程式,若溶液中以物种 Ca2+和Cl-存在:___________________________________________。
广西大学大二化学专业分析化学试卷及答案8 (3)

广西大学分析化学课程试卷(10)卷共8页考试形式闭卷年月日院系年级专业学号姓名成绩一.选择题 (共36分)1.(本题2分)以下情况产生的误差属于系统误差的是————――――――()(1) 指示剂变色点与等当点不一致(2) 滴定管读数最后一位估测不准(3) 称样时砝码数值记错(4) 称量过程中天平零点稍有变动2.(本题2分)下列数据中有效数字为二位的是——————————————()(1) [H+]=10-3.4(2) pH=2.0 (3) lg K=16.5 (4) lg K=16.463.(本题2分)pH=1.00的HCl溶液和pH=13.00的NaOH溶液等体积混合,所得溶液的pH 值是———————————————————————————( )(1) 14 (2) 12 (3) 7 (4) 64.(本题2分)某碱液25.00mL,以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,用去15.28mL,再加甲基橙继续滴定,又消耗HCl 6.50 mL,此碱液的组成是( )(1) NaOH + NaHCO3 (2) NaOH+Na2CO3(3) NaHCO3 (4) NaCO35.(本题2分)下列各组混合溶液中,能用过量NaOH溶液分离的是—―――—-()(1) Pb2+—A13+(2) Pb2+—Co2+(3) Pb2+—Zn2+(4) Pb2+—Cr3+6.(本题2分)在原子吸收分析的理论中,用峰值吸收代替积分吸收的基本条件之一是――――――――――――――――――――――――――()(1)光源发射线的半宽度要比吸收线的半宽度小得多(2)光源发射线的半宽度要与吸收线的半宽度相当(3)吸收线的半宽度要比光源发射线的半宽度小得多(4)单色器能分辨出发射谱线,即单色器必须有很高的分辨率7.(本题2分)在原子吸收法中,原子化器的分子吸收属于――――――――()(1)光谱线重叠的干扰(2)化学干扰(3)背景干扰(4)物理干扰8.(本题2分)指出下列哪种是紫外可见分光光度计常用的光源―――――――()(1) 硅碳棒(2) 激光器(3) 空心阴极灯(4) 卤钨灯9.(本题2分)一种能作为色散型红外光谱仪色散元件的材料为――――――()(1) 玻璃(2) 石英(3) 卤化物晶体(4) 有机玻璃10.(本题2分)红外光谱法,样品状态可以是―――――――――――――――()(1)气体状态(2)固体状态(3)固体、液体状态(4)气体、液体、固体状态都可以11.(本题2分)在核磁共振实验中能够测量到净的吸收,其原因是―――――――()(1)处于较低自旋能级的核比较高能级的核稍多,以及核的自旋-晶格驰豫(2)处于较低自旋能级的核比较高能级的核稍多,以及核的自旋-自旋驰豫(3)处于较低自旋能级的核比较高能级的核稍少,以及核的非辐射驰豫(4)处于较低自旋能级的核比较高能级的核稍多,以及电子的屏蔽12.(本题2分)玻璃膜钠离子选择电极对钾离子的电位选择性系数为0.002,这意味着电极对钠离――――――――――――――――――――――――()(1) 0.002倍(2) 500倍(3) 2000倍(4) 5000倍13. (本题2分)根据范弟姆特方程式,在高流速情况下,影响柱效的因素主要是()(1) 传质阻力(2) 纵向扩散(3) 涡流扩散(4) 柱弯曲因子14.(本题2分)应用GC法定量分析样品中各组分含量时,它们之间的分离度至少应为―――――――――――――――――――――――――()(1) 0.50(2) 0.75(3) 1.0(4) 1.515.(本题2分)在高固定液含量色谱柱的情况下,为了使柱效能提高,可选用( )(1) 适当提高柱温(2) 增加固定液含量(3) 增大载体颗粒直径(4) 增加柱长16.(本题2分)热导池监测器是一种――――――――――――――――――()(1)浓度型监测器(2) 质量型检测器(3) 只对含碳、氢的有机化合物有响应的检测器(4)只对含硫、磷化合物有响应的检测器17.(本题2分)硅藻土型载体,使用前处理的目的是―――――――――――( )(1) 增大表面积(2) 使粒度细小、均匀(3) 除去表面吸附中心和催化中心(4) 增加机械强度和热稳定性18.(本题2分)非火焰原子吸收法的主要缺点是―――――――――――――()(1)检测限高(2)不能检测难挥发元素(3)重现性差(4)不能直接分析粘度大的试样二.填空题 (共14分)1.(本题2分)0.1mol/L NaCl溶液的电荷平衡式是。
分析化学习题十

第十章电位法及双指示电极电流滴定法一、单项选择题(类型说明:每一道试题下面有A、B、C、D四个备选答案,请从中选择一个最佳答案。
)1.下列关于盐桥的作用的错误叙述是()A. 阻止两极溶液混合而直接反应B. 使电池的内电路导通C. 使液接电位减少或消除D. 使不对称电位减少或稳定E AgCl/Ag一0.059lga Cl-,则25℃时,θE AgCl/Ag =()2.对于Ag一AgCl 电极有E=θE Ag+/ Ag—0.059lgK sp(AgCl) B. θE Ag+/ Ag + 0. O59lga Ag+A. θE Ag+/ Ag + 0. 0591gK sp{ AgCl) D. θE Ag+/ Ag—0.059lga Ag+C. θ3.下列电池中,不是测定稀HCI溶液pH值的电池为()A. p t∣H2(0.2atm),HCI(a)‖KCl(饱和)∣Hg2Cl2,HgB. Ag∣AgCl(s),HCI(a1),NaCl(a2)‖KNO3(饱和)‖SCEC. 玻璃电极∣HCl(a)‖KCl(lmol/L)∣H g2Cl2,HgD. 锑电极∣HCI(a1),NaCl(a2)‖KCI(0.lmol/L),AgCl(s)∣Ag4.下列电极中,电极电位的产生不属于离子交换和扩散作用原理的电极是()A. 玻璃电极B. pM汞电极(HgHg-EDTA)电极C. 氟离子选择电极D. 葡萄糖氧化酶电极5.下面为不同KCl浓度时,甘汞电极的E 值,其中KCl浓度最小的电位值是()A. 0.505伏B. 0.425伏C. 0. 242伏D.0.280伏6.用pH4.0的缓冲液校正pH计后,测得pH6.86标准缓冲溶液和供试液的pH值分别为6.70和6.00,则供试液的真实pH值是()A. 5. 80B. 5. 89C. 6. 16D. 7.257.浸泡后的玻璃电极玻璃膜的内外表面点位(指干玻璃膜时为Na+占据的电位)()A. 几乎全由Na+占据 B. 由H+和Na+共同占据C. 几乎全由H+占据D. 由H+和OH-共同占据8.pH玻璃电极的响应机理与膜电位的产生是由于()A. H+在膜表面的离子交换和扩散作用 B. H+进入膜的晶格缺陷形成相界电位C. H+穿透膜而使膜内外H+产生浓度差D. H+在膜表面的吸附作用9.pH玻璃电极产生不对称电位不是来源于玻璃膜()A. 内外表面的水化程度不同 B. 内外溶液中的H+活度不同C. 外表面的机械磨损和老化D. 外表面受到的化学腐蚀或脱水10.用玻璃电极作指示电极测量溶液的pH值约为10的试液,校正pH计时最合适的缓冲溶液为()A.pH4.00的邻苯二甲酸氢钾溶液 B.pH6.68的混合磷酸盐溶液C.pH9.18的硼砂溶液D.pH3.65 的酒石酸氢钾溶液11.直接电位法测定下列离子浓度,当测定电动势的绝对误差相同时,其测定浓度的相对误差最大的是()A. Th4+ B. S2— C. Ca2+ D. La3+12.Ag—AgCl 电极的电极电位的产生是基于电极相界面存在()A. Ag和AgCl的电子交换反应B. Ag+的交换和扩散C. AgCl分子的交换D. 水合Cl-和Ag+的交换13.pH计的―校正‖旋钮不具有的作用是()A. 校正温度的影响B. 抵消SCE 的电极电位C. 使得测溶液的pH值可直接读出D. 抵消指示电极的电极常数14.用0.l000mol/L 的Ce4+标准溶液滴定20.00ml 0.1000mol/L 的Fe2+溶液(其中含0.05000 mol/L的Fe3+),永停滴定法指示终点,电流最大时,滴定剂加入的体积(ml)为()A. 5.00B. 7.50C. 10.00D. 15.0015.下列情况中,不宜用永停滴定法的是()A. 滴定剂是可逆电对B. 被滴定物是可逆电对C. 滴定剂和被滴定物都为不可逆电对D. 滴定剂和被滴定物都为可逆电对16.25℃时,用直接电位法测Ca2+浓度时,电动势测量误差为士0.5mv,则△C/C%约为()A.±2% B.±4% C.±5% D.±8%17.下列各项中,哪一项可用于精确校正玻璃电极有点老化(即S偏离理论值)引起的误差()A. 用两个适宜的标准pH缓冲溶液校正仪器B. 使标准缓冲溶液和试液的温度相同C. 电极在使用前用缓冲溶液浸泡D. 电极在合适的pH值范围内使用18.下列关于玻璃电极的叙述,正确的是()A. 整个玻璃电极的电位是玻璃膜内外两相界电位之差B. 转换系数在所有pH值范围都为常数C. 内参比溶液可是含一定浓度KCl或NaCl的pH值适宜的缓冲溶液D. 只要电极不破损就可长期使用19.下列关于玻璃电极的性能叙述,错误的是()A. 可测任何pH值范围的一切试液的pH值B. 能测有色、浑浊、粘稠试液的pH值C. 氧化还原性物质不干扰pH值测定D. 水中浸泡足够长时间可使不对称电位减少,直至稳定20.酸碱电位滴定法最常用的电极对为()A. 双铂电极B. 玻璃电极和SCEC. 铂电极和SCED. 锑电极和SCE 21.沉淀电位滴定中,用AgNO3标准溶液滴定时,参比电极应使用()A. 饱和甘汞电极B. 带KCl盐桥的SCEC. Ag∣AgCl(s),KCl(饱和)D. 带KNO3盐桥的SCE22.下列电极中,在电极与试液接触的相界面上不发生电子交换的电极反应的电极是()A. 甘汞电极 B. 标准氢电极 C. 玻璃电极 D. 锑电极23.在永停滴定中,当被滴定物属于可逆电对(Ox/Red)时,电解电流最大的情况是()A. [Ox]>[ Red] B. [Ox]< [Red] C. [Ox]=[ Red] D.[Ox]= 024.下列关于玻璃电极构成的叙述,错误的是()A. 以Ag—AgCl 电极为内参比电极B. 用pH缓冲液或KCl(NaCl)溶液作内参比溶液C. 不能用普通导线作电极引线D. 下端是一易破损的球形薄玻璃膜二、多项选择题(类型说明:每一道试题下面有A、B、C、D、E五个备选答案,其中有二至五个选项是符合题目要求的,请选出正确选项。
无机及分析化学 (10)
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
5.氧化物均为高熔点、高硬度的物质。
4.氯化物都是共价型化合物,易升华、易 聚合、易溶于有机溶剂。
3.氢氧化物均为两性,而其他碱土金属氢 氧化物均为碱性。
2.都能被冷的浓硝酸钝化,而其他碱土金属均 易于硝酸反应。
6.氯化物都具有共价性,能溶于有机溶剂中。它们的水 合氯化物晶体受热时都会发生水解反应。
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
1.碱金属和碱土金属氟化物和氯化物熔点均较高, 所以他们多为离子型晶体。
2.碱金属氟化物或氯化物的熔点在同一族中从上到 下逐渐降低(除Li外),而碱土金属氟化物或氯化物 的熔点从上到下逐渐升高(除BaF2外)。
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
晶型
中国大学MOOC
中国大学MOOC
中国大学MOOC
中国大学MOOC
3.Li+、Be2+的卤化物熔点最低,这与它们半径最 小,极化力最大有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分析化学试卷10一、选择题1.下列有关系统误差的正确叙述是:A.系统误差具有随机性 B.系统误差在分析过程中不可避免C.系统误差具有单向性D.系统误差是由一些不确定的偶然因素造成的2.配制PH=9.0的缓冲溶液,缓冲体系最好选择A.一氯乙酸(PK a=2.86)-盐B.氨水(PK b=4.74)-盐C.六压甲基四胺(PK b=8.85)-盐D.醋酸(PK a=4.74)-盐3.实验室两位新分析人员对同一样品进行分析,得到两组分析结果。
考察两组接过的精密度是否存在显著性差异,应采用的检验方法是:A. t检验法B. Q检验法C. T检验法D. F检验法4.下列物质中,可以直接用来标定I2溶液浓度的物质是:A. As2O3B. 硼砂C. 邻苯二甲酸氢钾D. 淀粉KI 5.等体积的0.10mol/L的羟胺(NH2OH)和0.050mol/L的NH4Cl混合溶液的PH值为:(NH2OH PK b=8.04,NH3 PK b=4.74)A. 6.39B. 7.46C. 7.61D. 7.76 6.在水溶液中,HClO4酸和HCl酸均显示强酸性质而无法区别其强度,是由于A. 两种酸本身性质相同B. 两种酸均具有Cl元素C. 对两种酸而言,水是较强的碱D. 水易形成氢键7.用0.10mol/L NaOH标准溶液滴定0.10mol/L甲酸(PK a=3.75)时,最好应选用的指示剂是:A. 甲基橙(PK a=3.4)B. 甲基红(PK a=5.2)C. 酚红(PK a=8.0)D. 酚酞(PK a=9.1)8.用甲醛法测定(NH4)2SO4质量分数≥98%的肥田粉中NH4+含量时,若将试样溶解后用250ml容量瓶定容,用25.00ml移液管吸取三份溶液做平行测定,分别用0.2000mol/L NaOH溶液滴定,则应称取多少克试样?((NH4)2SO4 Mr=132)A. 2.6g~4.0gB. 1.3g~2.0gC. 5.2g~8.0gD.1.0g~1.5g9.将酚酞分别加入到MnS(a)和CuS(b)的饱和水溶液中,所观察到的现象是:(已知:MnS K sp=2×10-10;Cus K sp=6×10-36;H2S K a1=1.3×10-7,K a2=7.1×10-15 A. a,b均无色 B. a无色,b呈红色 C. a呈红色,b无色 D. a,b 均呈红色10.用BaSO4重量法测定煤中S的含量,最后洗涤沉淀的洗涤剂应选择:A. H2OB. 稀H2SO4C. 稀BaCl2D. H2O+NH4Cl11.使用磺基水杨酸分光光度法测定微量Fe3+时,光度计检测器直接测定的是:A. 入射光的强度 B. 吸收光的强度 C. 透过光的强度 D. 散射光的强度12.今在铵盐存在下,利用氨水作为沉淀剂沉淀Fe3+,若铵盐浓度固定,增大氨的浓度,Fe(OH)3沉淀对Ca2+、Mg2+、Zn2+、Ni2+等四种离子的吸附量将是A. 四种离子都增加B. 四种离子都减小C. Ca2+、Mg2+增加而Zn2+、Ni2+减小D.Zn2+、Ni2+增加而Ca2+、Mg2+减小13.(1)用0.050mol/L KMnO4溶液滴定0.25mol/L Fe2+溶液,(2)用0.010mol/L KMnO4溶液滴定0.050mol/L Fe2+溶液;上述两种情况下其滴定突跃将是A. 一样大B.(1)>(2)C.(2)>(1)D.缺电位值,无法判断14.用摩尔法测定Cl-;控制PH=4.0,其滴定终点将A.不受影响B.提前到达C.推迟到达D.刚好等于化学计量点15.在配位滴定中用返滴定法测定Al3+时,若在PH=5~6以某金属离子标准溶液回滴过量的EDTA,金属离子标准溶液应选用A. Ag+B. Zn2+C. Al3+D. Ca2+16.在螯合物萃取体系中,当水相的H+浓度越大时,其萃取效率A. 越低B. 越高C.取决于萃取剂的浓度D.取决于萃取常数17.在酸碱滴定中,选择强酸强碱作为滴定剂的理由是A.强酸强碱可以直接配制标准溶液B.使滴定突跃尽量大C.加快滴定反应速度D.使滴定曲线较美观18.“持久性有机污染物(POPs)”如二恶英定对环境和人体健康具有极大危害,对此类物质错误的描述是A.具有长期残留性和高度危害性B.只有通过生物方法可以全部降解C.Cl-离子可能与KMnO4反应D.以上均不对20.测定酸性粘土试样中SiO2的含量,宜采用的分解试剂是:A.K2CO3+KOHB.HCl+乙醇C.HF+HClD.CaCO3+NH4Cl二、填空题1.0.5000g有机物试样以浓H2SO4煮解,使其中的氮转化为(NH4)HSO4,并使其沉淀为(NH4)2PtCl6,再将沉淀物灼烧成0.1765g Pt,则试样中N%为________________________。
(N Ar=14.01 Pt Ar=195.08)2.不同离子交换剂中下列基团的性质是(填A、B、C、D)(1)____CO2H (2)____N+(CH3)3______(3)____SO3H______(4) ____NHCH3_____(A)强酸性(B)强碱性(C)弱酸性(D)弱碱性3.用普通分光光度法测得标液c1的投射率为20%,试液投射率为12%。
若以示差法测定,以标液c1作参比,则试液投射率为______________,相当于将仪器标尺扩大__________倍。
4.在分析化学中,通常只涉及少量数据的处理,这是有关数据应根据________分布处理;对于以样本平均值表示的置信区间的计算式为_____________________________。
5.以甲基橙为指示剂,用0.1mol/L HCl滴定0.1mol/L Na2B4O7溶液,以测定Na2B4O7.10H2O试剂的纯度,结果表明该试剂的纯度为110%。
已确定HCl浓度及操作均无问题,则因其此结果的原因是____________________________________。
6.用过量BaCl2沉淀SO42-时,溶液中含有少量NO3-、Ac-、Zn2+、Mg2+、Fe3+等杂质,当沉淀完全后,扩散层中优先吸附的离子是______________,这是因为_______________________。
7.配制总浓度为0.20mol/L六亚甲基四胺缓冲溶液,最大缓冲指数βmax=_______________,出现在PH=__________时。
(六亚甲基四胺PK b=8.85)8.已知Fe3+/Fe2+ϕθ=0.771V,Sn4+/Sn2+ϕθ=0.154V,当用Sn2+还原Fe3+时,反应的平衡常数logK=___________________,化学计量点电位ϕsp=___________________。
9.写出三种氧化还原滴定指示剂的类型,并各举出一个例子。
(1)_______________ ,_________________(2)_______________ ,_________________(3)_______________ ,_________________10.0.10mol/L NH4H2PO4和0.10mol/L NH4CN混合溶液的质子条件是:__________________________________________。
三、计算题1.用原子吸收法测定活体肝样中锌的质量分数(μg/g),8次测定结果如下:138、125、134、136、140、128、129、132。
请用Grubbs法检验分析结果是否有需要舍去的数值?求取舍后合理结果的置信区间。
如果正常肝样中标准值是128μg/g,问次样品中锌含量是否异常?(置信度为95%)P=95%2.PH=10.0的氨性缓冲溶液(终点时含有0.010mol/L 游离氨)中,用0.0200mol/L EDTA滴定同浓度Cu2+溶液,分别计算滴定至化学计量点前后0.1%时的PCu’和PCu 值。
若是用PAN为指示剂,计算滴定的终点误差。
(CuY logK=18.8,PH=10.0时,lgαY(H)=0.5,lgαCu(OH)=0.8,PAN PCu ep=13.8,Cu-NH3配合物的各级累计常数:lgβ1~lgβ4:4.13、7.61、10.48、12.59)3.用0.1000mol/L HCl标准溶液滴定0.1000mol/L乙胺(C2H5NH2)和0.2000mol/L吡啶(C5H5N)的混合溶液,若以滴定误差不大于0.3%为依据,请问:(1)能否进行分别滴定,有几个滴定突跃?(2)滴定乙胺至化学计量点时,吡啶反应的百分数?(3)滴定至PH=7.80时的终点误差。
(C2H5NH2 PK b=3.25,C5H5N PK b=8.77)4.称取0.1505g软锰矿样品用Na2O2-NaOH处理,锰转化为MnO42-,煮沸除去过氧化物。
酸化溶液,滤去MnO2沉淀,加入浓度为0.1104mol/L FeSO4标准溶液50.00ml。
待反应完全后,再用0.01950mol/L KMnO4标准溶液滴至红色,用去18.16ml,计算试样中MnO2的质量百分数。
(MnO2Mr=86.94)5.称取含惰性物质的BaCl2和少量BaCrO4试样0.4650g,样品经溶解处理后加入过量稀硫酸,此时,BaCrO4不沉淀。
沉淀经陈化、过滤、洗涤后置于恒重瓷坩埚中,在800-850℃灼烧至恒重,称其重量为0.2650g。
合并滤液处理后,用莫尔法以0.1200mol/L AgNO3标准溶液滴定至终点,用去28.50ml。
计算试样中BaCl2和BaCrO4的质量百分数。
(BaCl2Mr=208.24,BaCrO4 Mr=253.32,BaO Mr=153.33) 四、设计题今有50ml含Ni2+水溶液,由于较多的共存离子存在,需萃取分离后才能进行分光光度测定。
请设计此萃取实验,使样品萃取后可以直接测定。
(需指出实验所需要的主要仪器、试剂、简要实验过程和步骤)。
