罗卓娅中国药典2010年版溶出度增修订概况ppt课件
合集下载
中国药典培训PPT课件

由国家政府制定并颁布的药品标准 ( 1 ) ch.p+ 部 局 颁 ( 新 药 转 正 统 一 等 ) —— 共 性 12000多个。 (2)“注册标准”+进口标准——个性 上市药品质量控制:GAP等+GMP+标准检验+GSP
企业标准:制药企业为确保本企业生产的药品每一 批都能保证质量稳定均一并能达到国标的要求而制 定的本企业内控的药品质量标准。
•11
2010版主要特点——有效性与可控性
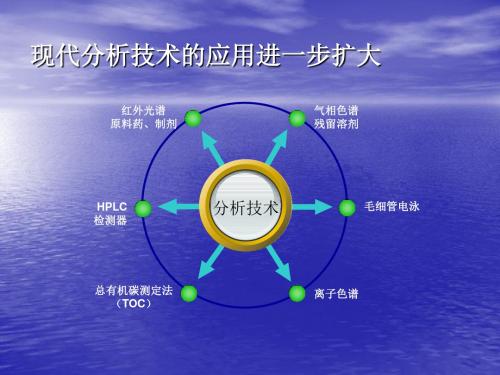
• 化学药: • 一是检测方法更加专属准确——化药品种中采用离子色谱
法和毛细管电泳法;新增了335个品种的HPLC测定含量 以取代生物测定法等。 • 二是红外光谱在原料药特别是制剂鉴别中的应用进一步扩 大,50种原料、72种制剂增加了IR鉴别,打击假药提供了 科学有效的手段。 • 三是进一步增加溶出度、含量均匀度等检查项目。新增99 个品种(共414种)溶出度(如抗贫血药富马酸亚铁胶囊 原子吸收法测定溶出量)
144/24 91.1
放射药 23
0
23
0
0
总数 2139 268 1871
1448 77.4
•9
主要收载项目情况比较表
增修订项目
2005
2010
红外光谱鉴别/原料/制剂
530/2
580/73
有关物质 HP LC法
142
707
残留溶剂
24
97
渗透压摩尔浓度
4
45
溶出度或释放度
315
414
含量均匀度
•12
2010版主要特点——有效性与可控性
• 59种(共219种)含量均匀度检查。 • 四是为产品工艺改进奠定基础。如:西咪替丁4种晶型考
企业标准:制药企业为确保本企业生产的药品每一 批都能保证质量稳定均一并能达到国标的要求而制 定的本企业内控的药品质量标准。
•11
2010版主要特点——有效性与可控性
• 化学药: • 一是检测方法更加专属准确——化药品种中采用离子色谱
法和毛细管电泳法;新增了335个品种的HPLC测定含量 以取代生物测定法等。 • 二是红外光谱在原料药特别是制剂鉴别中的应用进一步扩 大,50种原料、72种制剂增加了IR鉴别,打击假药提供了 科学有效的手段。 • 三是进一步增加溶出度、含量均匀度等检查项目。新增99 个品种(共414种)溶出度(如抗贫血药富马酸亚铁胶囊 原子吸收法测定溶出量)
144/24 91.1
放射药 23
0
23
0
0
总数 2139 268 1871
1448 77.4
•9
主要收载项目情况比较表
增修订项目
2005
2010
红外光谱鉴别/原料/制剂
530/2
580/73
有关物质 HP LC法
142
707
残留溶剂
24
97
渗透压摩尔浓度
4
45
溶出度或释放度
315
414
含量均匀度
•12
2010版主要特点——有效性与可控性
• 59种(共219种)含量均匀度检查。 • 四是为产品工艺改进奠定基础。如:西咪替丁4种晶型考
《中华人民共和国药典》2010年版培训 PPT课件

2019/1/29
• 药品质量可控性有效性提升(重金属有害元素检 查体系完善,中药专属性检测方法,液相色谱专 属性,原材料要求提高) • 标准内容更趋科学规范合理(药品名,辅料要求, 可见异物抽样要求,检测次数和时限) • 技术创新,国际协调(中药一测多评,特征图谱, 指纹图谱,杂质控制,无菌检查)
2019/1/29
• • • • • • •
装量(注射液,注射用浓溶液) 装量差异(注射用无菌粉末未检含量均一度者) 渗透压摩尔浓度(静脉输液和椎管注射用注射液) 可见异物 不溶性微粒 无菌 细菌内毒素/热原
2019/1/29
附录-药用辅料
• 药用辅料系指生产药品和调配处方时使用的赋形 剂和附加剂;是除活性成分以外,在安全性方面 已进行合理的评估,且包含在药物制剂中的物质 • 可能影响药品质量、安全性和有效性 • 制剂生产用pH调节剂属于辅料 • 生产药品所用辅料必须符合药用要求;注射剂用 药用辅料应符合注射用质量要求
2019/1/29
凡例-说明书、包装、标签
• 符合法律法规 • 内包材应无毒、洁净,与药品相容 • 麻醉药品,精神药品,医疗用毒性药品、放射性 药品和非处方药的说明书和包装标签,应有规定 标识
2019/1/29
附录-注射剂
• 注射剂所用原辅料应控制来源和工艺并符合注射 用质量要求,所用溶剂安全无害不影响疗效质量 • 注射剂用容器应用适宜方法验证密封性 ,符合国 标规定,胶塞有足够弹性和稳定性 • 生产过程尽可能缩短注射剂配制时间,防止微生 物热源污染和药物变质 • 注射剂应遮光储存 • 注射剂用辅料应在标签或说明书中标明名称和所 用溶剂,抑菌剂应标明浓度
2019/1/29
凡例-总则
• • • • 药典依据:《中华人民共和国药品管理法》 《中国药典》指的是药典现行版 凡例和附录对药典以外国家标准具同等效力 药典规定针对符合GMP的产品
2010版药典课件

• 新版药典凡例总则之一明确“《中国药典》由一 部、二部、三部及其增补本组成,内容分别包括 凡例、正文和附录”,强化了《中国药典》的结 构、系统性、整体性、灵活性及其不可分割的特 点。
• 4、首次在药典中规范国家标准
• 新版药典凡例总则之二明确“国家药品标准由凡 例、正文及其引用的附录共同构成”,解决了长 期以来存在的“国家药品标准”与《中国药典》 之间的“模糊”关系,确立了《中国药典》在国 家药品标准体系中的核心地位。
• 明确正文所设各项规定是针对符合GMP的 产品而言。任何违反GMP或有未经批准添 加物质所生产的药品,即使符合《中国药 典》或按照《中国药典》没有检出其添加 物质或相关杂质,亦不能认为其符合规定。
实现了技术标准与行为标准的衔接,反映 了监管实践对药品质量及其判定依据的认 识升华。
一部
• 正文(增加)
植物油脂和提取物系指从植、动物中制得的挥发 油、油脂、有效部位和有效成分。其中,提取物 包括以水或醇为溶剂经提取制成的流浸膏、浸膏 或干浸膏、含有一类或数类有效成分的有效部位 和含量达到90%以上的单一有效成分。
• 项目与要求
• 十六:饮片的质量标准(增加)
• 十七:制剂中的干燥方法一般用“干燥”或“低 温干燥”,采用特殊干燥方法的,在具体品种项 下注明。(修订)
2010版《中国药典》 “凡例”增修订内容
• 总则
• 首次在凡例中设置“总则”一节,共七项 条款。
• 明确《中国药典》依据《中华人民共和国 药品管理法》组织制定和颁布实施。
• 明确国家药品标准由凡例、正文及其引用 的附录共同构成。本部药典收载的凡例、 附录对药典以外的其他中药(化药)国家标准 具有同等效力。扩大了凡例的约束范围。
• 明确品种项下收载的内容统称为正文,正 文系根据药物自身的理化与生物学特性, 按照批准的来源、处方、制法和运输、贮 藏等条件所制定的、用以检测药品质量是 否达到用药要求并衡量其质量是否稳定均 一的技术规定。
• 4、首次在药典中规范国家标准
• 新版药典凡例总则之二明确“国家药品标准由凡 例、正文及其引用的附录共同构成”,解决了长 期以来存在的“国家药品标准”与《中国药典》 之间的“模糊”关系,确立了《中国药典》在国 家药品标准体系中的核心地位。
• 明确正文所设各项规定是针对符合GMP的 产品而言。任何违反GMP或有未经批准添 加物质所生产的药品,即使符合《中国药 典》或按照《中国药典》没有检出其添加 物质或相关杂质,亦不能认为其符合规定。
实现了技术标准与行为标准的衔接,反映 了监管实践对药品质量及其判定依据的认 识升华。
一部
• 正文(增加)
植物油脂和提取物系指从植、动物中制得的挥发 油、油脂、有效部位和有效成分。其中,提取物 包括以水或醇为溶剂经提取制成的流浸膏、浸膏 或干浸膏、含有一类或数类有效成分的有效部位 和含量达到90%以上的单一有效成分。
• 项目与要求
• 十六:饮片的质量标准(增加)
• 十七:制剂中的干燥方法一般用“干燥”或“低 温干燥”,采用特殊干燥方法的,在具体品种项 下注明。(修订)
2010版《中国药典》 “凡例”增修订内容
• 总则
• 首次在凡例中设置“总则”一节,共七项 条款。
• 明确《中国药典》依据《中华人民共和国 药品管理法》组织制定和颁布实施。
• 明确国家药品标准由凡例、正文及其引用 的附录共同构成。本部药典收载的凡例、 附录对药典以外的其他中药(化药)国家标准 具有同等效力。扩大了凡例的约束范围。
• 明确品种项下收载的内容统称为正文,正 文系根据药物自身的理化与生物学特性, 按照批准的来源、处方、制法和运输、贮 藏等条件所制定的、用以检测药品质量是 否达到用药要求并衡量其质量是否稳定均 一的技术规定。
《中国药典》2010年版附录 PPT课件

五、主要修订项目内容
红外光谱 1、原料药鉴别 遇多晶干扰 (1)按规定对样品进行预处理(重结晶与干燥) (2)采用对照品平行操作 (3)采用溶液法 2、制剂鉴别 (1)提取(溶剂的选择) 辅料无干扰,晶型不变 直接与标准光谱比对 辅料无干扰,晶型有变 与对照品同法处理后比对 辅料有干扰,晶型不变 在指纹区选择3~5个特征谱带 波数允差为0.5% 辅料有干扰,晶型有变 不宜采用红外鉴别
完善了原附录 增加了干扰与校正,样品溶液的制备以及 测定方法中增加了标准加入法等段落。 本法是重金属测定中最灵敏的一个方法(10-12~10-15) 4、等离子体发射光谱 新增附录 本法灵敏(10-9~10-12)、准确、线性范围宽、元素覆盖 范围宽、可实现多种元素同时测定。 5、离子色谱 新增附录 可实施金属的形态与价态分析 6、原子荧光 未收载 与ICP-MS和ICP-AES比 差 与AA比相仿
(2)分离度R(关键指标)
( ) t R2 - t R1
R=2 或R= ( ) W1 + W2
2 t R2 - t R1 1.70 W1, n 2 + W2, n 2
5、拖尾因子 必要时,应规定拖尾因子
五、主要修订项目内容
pH值测定法 1、pH的含义 pH=-log aH+ 2、pH值的测定 pH=pHs+(E-Es)/R R=0.05916+0.000198(t-25℃) 影响pH值测定的因素 表观pH值 3、弱缓冲液的pH测定 除另有规定外,按下法测定 先用苯二甲酸盐缓冲液(pH4.01)校正仪器,1min内 pH改变<0.05时读数,再用硼砂缓冲液(pH9.18)校 正仪器,1min内pH改变<0.05时读数,取二次读数的 平均值。 4、水的pH值测定 加KCl适量(由制药用水正文自行规定)
《中国药典概况》PPT课件

2. 正文(Monographys)
是药典的主要内容,为所收载药品或制剂的质 量标准。包括品名、药物结构式、分子式与分 子量、来源或有机化合物名称、性状、鉴别、 含量测定、类别、剂量、注意、规格、储藏、 制剂等.
3. 附录(Appendix)
附录部分记载了制剂通则、生物制品通则、通 用检测方法和指导原则。一般杂质检查方法、 一般鉴别试验、有关物理常数测定法、试剂配 制法以及色谱法、光谱法等内容。
2005年版收载品种3214种,其中一部收载中药1146种。
2010年版收载品种4567种,其中一部收载中药2165种。
二部(化学药) 2271种 化学药品、抗生素、生化药品、放射性药品 辅料
2010年版《中国药典》与2005年版比较 收载品种 新增品种 保留上版 修订品种 修订幅度%
生化药品和生物制品区别
广义上来讲生物制品是个大范畴,包括 生化药品;一般把疫苗、菌苗、灭活毒菌 株、血液制品等归为生物制品。生化药品 则指的是治疗类药物,如基因工程药物、 提取的蛋白类药物、多糖及核酸类药物等 等。
2010年版《中国药典》主要特点:
一、药品安全性得到进一步保障
在药品安全性方面,除在附录中加强安全性检查总 体要求外,在品种正文标准中也大幅度增加或完善 安全性检查项目,进一步提高对高风险品种的标准 要求,进一步加强对重金属或有害元素、杂质、残 留溶剂等的控制,并规定制剂按无菌制剂要求。
新版药典着力解决了制约中药药品质量与安 全的突出问题,大大提高了中药药品标准质 量控制水平。
1953年,颁布第一版《中国药典》,收载药品531种。 其中植物药与油脂类65种,动物药13种。
1963年版分为两部,收载品种1310种,其中一部收载 中药材446种,中药成方制剂197种。
《中国药典》2010年版中药标准增修订内容介绍

(三)专项研究课题 (1)含朱砂、雄黄中成药中游离砷、 )含朱砂、雄黄中成药中游离砷、 汞检测方法研究; 汞检测方法研究; (2)农药多残留检测方法研究; )农药多残留检测方法研究; (3)黄曲霉毒素检测研究; )黄曲霉毒素检测研究; (4)重金属及有害元素研究; )重金属及有害元素研究; (5)生物活性测定法研究。 )生物活性测定法研究。
2010版药典标准起草技术要求及编写细则 版药典标准起草技术要求及编写细则 《中国药典》中药质量标准研究技术要求 中国药典》 中国药典》 《中国药典》中药质量标准复核技术要求 中国药典》 《中国药典》中药质量标准起草说明编写 细则 中国药典》 《中国药典》中药质量标准起草与复核工 作规范 中国药典》 《中国药典》中药质量标准正文各论编写 细则
05版:UV法测定黄连总生物碱含量 版 法测定黄连总生物碱含量 10版:HPLC法测定盐酸小檗碱和芍药 版 法测定盐酸小檗碱和芍药 苷含量
(二)标准整体水平全面大幅度提高
黄氏响声丸
薄荷、浙贝母、连翘、蝉蜕、胖大海、酒大 薄荷、浙贝母、连翘、蝉蜕、胖大海、 川芎、儿茶、桔梗、诃子肉、甘草、 黄、川芎、儿茶、桔梗、诃子肉、甘草、 薄荷脑
(二)标准整体水平全面大幅度提高
2、标准起点高、可控性强,质量标 标准起点高、可控性强, 准中鉴别、含量测定、 准中鉴别、含量测定、检查等项目 均较前几版有大幅度增加。 均较前几版有大幅度增加。
(二)标准整体水平全面大幅度提高
大幅度的增加了TLC鉴别 大幅度项的标准大部分增 加了含量测定。 加了含量测定。 制剂中可控项目平均超过所含药味的1/3。 制剂中可控项目平均超过所含药味的1/3。 90%以上的中药制剂均有定量检测指标 90%以上的中药制剂均有定量检测指标。 以上的中药制剂均有定量检测指标。
2010版-溶出度

16
释放度
依然是三种方法:第一法用于缓释制剂或控释制剂, 第二法用于肠溶制剂,第三法用于透皮贴剂。 第一法:增加了补充介质的温度 (37℃±0.5℃) 第二法:增加了缓冲液中释放量,加入介质的温度 (37℃±0.5℃)。方法2缓冲液中释放量,直接弃去酸液, 加37℃±0.5℃的缓冲液,这样可以使pH更准确。 第三法:未调整 (不锈钢网碟,释放面朝上,介质 温度为32℃±0.5℃)
15
正文修订更合理
本版药典对大部分难溶性口服固体制剂进 行了筛选,除增加了大量品种的溶出度检 查项外,同时也修改了一部分原有的不合 理的溶出度方法,使参数更合理,药品安 全性显著提高。 例如:非洛地平片 P454 2005:三法(小杯法),转速100转/分, 2010:二法(桨法),转速50转/分,
21
新版更加环保
1、很多盐酸盐原料药的含量测定由传统的加入醋 酸汞试液后高氯酸滴定的方法改为电位滴定方法测 定,即可不用醋酸汞了。例如:盐酸二甲双胍,盐 酸曲马多,盐酸美西律,盐酸氯丙嗪等 2、试验中用到的毒性大,有放射性等试剂的方法 都改成了对人无危害的试剂来试验。例如:a.薄层 色谱展开剂中用到苯的都用其它试剂取代了。b、 钠盐鉴别试验取消了醋酸氧铀锌试液鉴别法。c、 锌盐鉴别试验取消了硫氰酸汞铵试液鉴别法。 3、新版HPLC中已明确了超高效液相色谱的应用。
17
溶出度测定中存在的问题
1、个别品种未能按附录的修订而在文字上作相 应修订。(例如:溶出介质量没有在品种中具体说明,
右旋糖酐铁片 、灰黄霉素片 、氢氯噻嗪片 等)
2、部分难溶性品种因建立溶出度测定方法的研 究还未成熟,未能收入药典中。 3、个别品种溶出度测定方法中的参数欠合理, 仍要继续完善。
释放度
依然是三种方法:第一法用于缓释制剂或控释制剂, 第二法用于肠溶制剂,第三法用于透皮贴剂。 第一法:增加了补充介质的温度 (37℃±0.5℃) 第二法:增加了缓冲液中释放量,加入介质的温度 (37℃±0.5℃)。方法2缓冲液中释放量,直接弃去酸液, 加37℃±0.5℃的缓冲液,这样可以使pH更准确。 第三法:未调整 (不锈钢网碟,释放面朝上,介质 温度为32℃±0.5℃)
15
正文修订更合理
本版药典对大部分难溶性口服固体制剂进 行了筛选,除增加了大量品种的溶出度检 查项外,同时也修改了一部分原有的不合 理的溶出度方法,使参数更合理,药品安 全性显著提高。 例如:非洛地平片 P454 2005:三法(小杯法),转速100转/分, 2010:二法(桨法),转速50转/分,
21
新版更加环保
1、很多盐酸盐原料药的含量测定由传统的加入醋 酸汞试液后高氯酸滴定的方法改为电位滴定方法测 定,即可不用醋酸汞了。例如:盐酸二甲双胍,盐 酸曲马多,盐酸美西律,盐酸氯丙嗪等 2、试验中用到的毒性大,有放射性等试剂的方法 都改成了对人无危害的试剂来试验。例如:a.薄层 色谱展开剂中用到苯的都用其它试剂取代了。b、 钠盐鉴别试验取消了醋酸氧铀锌试液鉴别法。c、 锌盐鉴别试验取消了硫氰酸汞铵试液鉴别法。 3、新版HPLC中已明确了超高效液相色谱的应用。
17
溶出度测定中存在的问题
1、个别品种未能按附录的修订而在文字上作相 应修订。(例如:溶出介质量没有在品种中具体说明,
右旋糖酐铁片 、灰黄霉素片 、氢氯噻嗪片 等)
2、部分难溶性品种因建立溶出度测定方法的研 究还未成熟,未能收入药典中。 3、个别品种溶出度测定方法中的参数欠合理, 仍要继续完善。
中国药典2010年版溶出度增修订概况

二、溶出度测定法在中国药典中的沿革
1、方法沿革
1985年版 篮法、桨法 1995年版 篮法、桨法、小杯法
2、品种沿革
1985年版 1990年版 1995年版 2000年版 2005年版 2010年版 7个 44个 128个 205个 275个 418个
3、仪器沿革
三、中国药典2010年版溶出度概况
一、溶出度的基本概念
崩解时限与溶出度?
崩解—— 系指口服固体制剂在规定条件下全部崩解溶散或成碎粒, 除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。
崩解和溶解的意义不一样,药物崩解的快慢并不能反映 其被人体吸收的快慢,崩解仅是溶解的前奏,崩解时限只 能表示溶解过程的最初阶段,而溶解才是机体吸收的先决 条件,溶出度检查与体内吸收情况更密切些。
方法选择的原则
d.对飘浮于液面的制剂,一般应选用转篮法。如辅料 堵塞网孔则选用桨法,将供试品放入沉降篮中,并在 正文中加以规定。采用小杯法时不能使用沉降篮。 e.小杯法主要用于在转篮法和桨法条件下,溶出液的 浓度过稀,即使采用较灵敏的方法仍难以进行定量测 定的品种。
转速选择的原则
转速的选择:在质量研究的基础上,尽量选择低转速 , 转篮法推荐100转/分,最低不得低于50转/分;桨法 推荐50转/分,最高不超过75转/分;小杯法推荐35转/ 分,最高不超过50转/分。
自身对照法的应用原则
溶出量的测定采用自身对照法的仅限于没有化学对照 品的多组分药品,在制定方法时,应对对照溶液的制 备方法进行验证,以保证其有效成分尽可能完全溶解, 在质量标准中应详细列出使有效成分完全溶解的处理 方法,限度一般规定为75%以上。
其他要求
溶出度取样时间及限度的确定,应考虑临床用药需求 以及制剂特点,考察溶出曲线。一般取样时间为45分 钟,限度(Q)为标示量的70%。 复方制剂的溶出度测定应重点针对难溶性或治疗窗窄 的成分进行。
中国药典版仪器分析增修订概况PPT课件
苯磺酸顺阿曲库铵 注射用苯磺酸顺阿曲库铵 手性色谱柱chiralcel OD-RH
甲氨蝶呤
甲氨蝶呤片
牛血清白蛋白键合硅胶柱
注射用甲氨蝶呤
色谱法的应用:高效液相色谱
• 离子对色谱法是根据被测组分离子与离子对试剂离子形成中性的离子对化
合物后,在非极性固定相中溶解度增大,从而使其分离效果改善。主要用 于分析离子强度大的酸碱物质。
TL CS
UV
GC
其 他
谱
10版 新增
259
1818
25
9
54 426
8
中成药
05版 收载
281
1144
11
16
102 627
8
32 162 6 10 90 1
709 12 8 24 1 321 33 16 19 4
提取物
10版 新增
05版 收载
21 3 2
5
1
11
16
17 10
12
50 16 17
Minutes 25 minutes
µBondapak™ C18
Ligand Density = 1.42 µmoles/m2
TF USP = 10
Amitriptyline
65 minutes
色谱法的应用:高效液相色谱
mAU 210nm,4nm (1.00)
250
•
200
150
100
50
0
-50
色谱法的应用:高效液相色谱
• 20世纪70年代中期,HPLC仪开始出现,主要填料:10 µm 的无定型硅胶颗粒。 • 70年代后期,发展了反相液相色谱。 • 80年代,HPLC 被广泛应用于化合物的分离,主要填料:粒径为5 ~ 10 µm 球形硅胶。 • 90年代早期,粒径为 5 µm 的高纯硅胶,即所谓的 B 型硅胶被发展,并成为这个行业
我国2010版药典培训教材(ppt 49页)

2010版药典培训
一、中国药典发展及概况
《中国药典》(增补本) 与药典具有相同法律地位 对本版药典的品种进行增补、修订 增补本收载的品种将全部收入新版药典
2010版药典培训
一、中国药典发展及概况
2、2010年版中国药典的概况 2010版药典主要包括凡例、正文、附录、标准物质(对照
品、对照药材、对照提取物、标准品)四部分。
2010版药典培训
中国2010版药典培训内容汇总
一、中国药典发展及概况 二、2010版药典的修订内容 三、中国药典发展展望
2010版药典培训
一、中国药典发展及概况
1、中国药典发展简况 中 国 最 早 的 药 典 ( 公 元 659 年 ) 是 ——《 新 修 本 草 》 又 称 《唐本草》,比欧洲药典(1542年出版)早880多年。 最早的中药处方和制剂规范,并且具有药典性质的是——宋 代(公元1078年)“太平惠民和剂局”组织集编的《太平惠民 和剂局方》。
2010版药典培训
一、中国药典发展及概况
凡例部分:首次增加了总则 首次明确了药典制定颁布的依据是——中华人民共和国药 品管理法 首次明确了药典的基本结构包括:《中国药典》由一部、 二部、三部及其增补本组成,内容包括凡例、正文玫附录。
2010版药典培训
一、中国药典发展及概况
药典凡例中规范国家标准的定义:国家药品标准由凡例 与正文及其引用的附录首次在共同构成。这就明确了《中国 药典》在国家药品标准体系中的核心地位。 首次明确凡例和附录的法律约束力:凡例、附录对药典 以外的其他国家药品标准具同等效力。 。
滴定法改HPLC
例:丙硫氧嘧啶片
异烟肼片
永停滴定法改HPLC
例:对氨基水杨酸钠肠溶片
2010版中国药典培训课件湖南《中国药典》2010年版二部化学药品增修订概况-PPT精品文档-PPT
药品通用名称 (制剂) ➢ 规范并真正反映药品的组成和剂型特点,明确了剂型的亚类,与制剂
通则一致。 ✓ 将胶丸统一修改为软胶囊 ✓ 硫糖铝片改硫糖铝咀嚼片。 ✓ 替硝唑注射液(均为大容量规格)改名为替硝唑氯化钠注射液 ✓ 把甲硝唑注射液中大容量规格改名为甲硝唑氯化钠注射液 (明确了处方组成,增加渗透压检查,使归类更科学合理)
• 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应 的规定。
凡例的增修订情况
总则
• 六、正文所设各项规定是针对符合《药品生产质量管理规范》的产品 而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合 《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质, 亦不能认为其符合规定。
凡例的增修订情况
总则
• 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共 和国药品管理法》组织制定和颁布实施。 《中国药典》由一部、二部、三部及其增补本组成,内容分别包 括凡例、正文和附录。 本部为《中国药典》二部。
• 二、国家药品标准由凡例与正文及其引用的附录共同构成。本部药典 收载的凡例、附录对药典以外的其他化学药品国家标准具同等效力。
LOGO
主要内容
31 二部特点及品种收载情况 2 凡例的增修订情况 3 各论的增修订情况 4 现代分析技术的应用 35 存在问题与分析
2010年版药典(二部)的特点
药品的 有效性 明显提高
收
现代分析技术的应用进一步扩大
2010年版与2005年版二部增修订情况比较表
2005年版 2项 酸度
干燥失重 ----
---------UV吸收系数 法
2010年版 3项(+LC)
酸度 水分 溶液的澄清度 有关物质 异常毒性 细菌内毒素 HPLC外标法
通则一致。 ✓ 将胶丸统一修改为软胶囊 ✓ 硫糖铝片改硫糖铝咀嚼片。 ✓ 替硝唑注射液(均为大容量规格)改名为替硝唑氯化钠注射液 ✓ 把甲硝唑注射液中大容量规格改名为甲硝唑氯化钠注射液 (明确了处方组成,增加渗透压检查,使归类更科学合理)
• 五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应 的规定。
凡例的增修订情况
总则
• 六、正文所设各项规定是针对符合《药品生产质量管理规范》的产品 而言。任何违反GMP或有未经批准添加物质所生产的药品,即使符合 《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质, 亦不能认为其符合规定。
凡例的增修订情况
总则
• 一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共 和国药品管理法》组织制定和颁布实施。 《中国药典》由一部、二部、三部及其增补本组成,内容分别包 括凡例、正文和附录。 本部为《中国药典》二部。
• 二、国家药品标准由凡例与正文及其引用的附录共同构成。本部药典 收载的凡例、附录对药典以外的其他化学药品国家标准具同等效力。
LOGO
主要内容
31 二部特点及品种收载情况 2 凡例的增修订情况 3 各论的增修订情况 4 现代分析技术的应用 35 存在问题与分析
2010年版药典(二部)的特点
药品的 有效性 明显提高
收
现代分析技术的应用进一步扩大
2010年版与2005年版二部增修订情况比较表
2005年版 2项 酸度
干燥失重 ----
---------UV吸收系数 法
2010年版 3项(+LC)
酸度 水分 溶液的澄清度 有关物质 异常毒性 细菌内毒素 HPLC外标法
中国药典2010年版一部中成药及相关标准的增修订内容介绍共138页PPT资料

22
四. 2019年版药典增修订的特点
中药质量控制的主要特点
注重中药的安全性质量控制 实现中药的多成分、多指标质量控制 加强有毒有效中药的质量控制 完善中药及其代用品的质量控制
23
Ⅰ.标准整体水平全面大幅度提高
首次对原标准(包括拟新增品种和2019年版全部修订 品种)收载的方法进行了全面验证和复核,使质量标准 整体水平和系统性、可行性、规范性大大提高。
标准起点高、可控性强,质量标准中鉴别、含量测定、 检查等项目均较前几版有大幅度增加。
2019版药典共收载检测项目6236项,其中新增检测项 目3553项,是历版药典中新增检测项目数量最多的一 版。
24
Ⅱ.对原专属性不强的测定方法(紫外、重量法、容 量法)修改为HPLC、GC等专属性强的方法。
戊已丸
8
药典分列的品种或易混淆品种应注意核对和明 确所用药材品种
不同剂型的系列品种处方药材基源应一致
含量限度应根据中药制剂实测结果与原料药材 的含量情况综合确定
原粉入药的转移率原则上要求在90%以上。有毒成分及 中西药复方制剂中化学药品的含量应规定上下限。
9
注重中药安全性检测方法和指标的建立和完善 加强对重金属及有害元素、毒性成分、残留溶 剂、真菌毒素及生物安全等检测。
339
347
5
2
26 1127 12
179 726 17
10版 新增
633
2492
31
12
134 1554
31
合计
05版 收载
620
1507
16
16
298 1363
37
32 162 6
709 12 8 24 1
10 90 1
四. 2019年版药典增修订的特点
中药质量控制的主要特点
注重中药的安全性质量控制 实现中药的多成分、多指标质量控制 加强有毒有效中药的质量控制 完善中药及其代用品的质量控制
23
Ⅰ.标准整体水平全面大幅度提高
首次对原标准(包括拟新增品种和2019年版全部修订 品种)收载的方法进行了全面验证和复核,使质量标准 整体水平和系统性、可行性、规范性大大提高。
标准起点高、可控性强,质量标准中鉴别、含量测定、 检查等项目均较前几版有大幅度增加。
2019版药典共收载检测项目6236项,其中新增检测项 目3553项,是历版药典中新增检测项目数量最多的一 版。
24
Ⅱ.对原专属性不强的测定方法(紫外、重量法、容 量法)修改为HPLC、GC等专属性强的方法。
戊已丸
8
药典分列的品种或易混淆品种应注意核对和明 确所用药材品种
不同剂型的系列品种处方药材基源应一致
含量限度应根据中药制剂实测结果与原料药材 的含量情况综合确定
原粉入药的转移率原则上要求在90%以上。有毒成分及 中西药复方制剂中化学药品的含量应规定上下限。
9
注重中药安全性检测方法和指标的建立和完善 加强对重金属及有害元素、毒性成分、残留溶 剂、真菌毒素及生物安全等检测。
339
347
5
2
26 1127 12
179 726 17
10版 新增
633
2492
31
12
134 1554
31
合计
05版 收载
620
1507
16
16
298 1363
37
32 162 6
709 12 8 24 1
10 90 1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国药典2010年版溶出度增修订概况
罗卓雅 2010.5.26. 山西
1
2019/9/7
想了解……
溶出度总体要求有变化吗? ——仪器要求改了吗?
操作要求改了吗? 判断标准改了吗? 品种标准中有对溶出度的新要求吗? ——新增要求控制? 修订原有方法?
新要求带来影响……
主要内容
一、溶出度的基本概念 二、溶出度测定法在中国药典中的沿革 三、中国药典2010年版溶出度内容概况 四、本版药典溶出度方法制订沿用的原则 五、存在问题和思考 六、展望
第一法(篮法)、第二法(桨法)、第三法(小杯法)
1、文字上细化对仪器的要求;
转篮 ……均为不锈钢或其他惰性材料
2、增加准确量取溶出介质的量化要求;
实际量取的体积与规定体积的偏差不超过±1%
3、增加准确取样时间的量化要求;
实际取样时间与规定时间的差异不得过±2%
4、增加小杯法采用沉降装置的描述。
当在正文规定需要使用沉降装置时, 可将片剂或胶囊剂先装入规定的沉降装置内
篮网丝径:2005:0.25mm;2010:0.28mm±0.03mm 溶出杯高:2005:168mm±8mm:2010:185mm±25mm
3、溶出介质量不在附录中明确;
2005:除另有规定外,分别量取经脱气处理的溶出介质900ml, 置各溶出杯内
2010:分别量取经脱气处理的溶出介质,置各溶出杯内
三、中国药典2010年版溶出度概况
1、内容汇总 2、新增内容 3、修订内容
三、中国药典2010年版溶出度概况 内容汇总
1、附录 溶出度测定法
释放度测定法 缓释、控释和迟释制剂指导原则
2、正文 溶出度 418个 释放度(缓释制剂)21个(片15个,胶囊6个) 释放度(肠溶制剂)16个 释放度(贴片) 1个 共465个
三、中国药典2010年版溶出度概况 修订内容
附录溶出度测定法修订内容
5、不再要求取样完成时间;
删去:应按照品种各论中规定的取样时间取样,自6杯中 完成取样的时间应在1分钟内
6、“溶出度仪的校正”改称为“溶出度仪的适用 性及性能确认试验”,同时“校正片”改称为“标准 片”;
7、溶出介质脱气方法只作为“可采用”的方法;
二、溶出度测定法在中国药典中的沿革
1、方法沿革
1985年版 篮法、桨ቤተ መጻሕፍቲ ባይዱ 1995年版 篮法、桨法、小杯法
2、品种沿革
1985年版 7个 1990年版 44个 1995年版 128个 2000年版 205个 2005年版 275个 2010年版 418个
3、仪器沿革
12
2019/9/7
13
2019/9/7
三、中国药典2010年版溶出度概况 修订内容
附录溶出度测定法修订内容
8、不再要求除另有规定外的取样时间及限度;
溶出度测定法——
是将某种固体制剂的一定量分别置于溶出度仪的转篮 (或溶出杯)中,在37℃±0.5℃恒温下,在规定的转速、 溶出介质中依法操作,在规定的时间内取样并测定其溶出量。
——《中国药品检验标准操作规范》2005年版
一、溶出度的基本概念
何为溶出度?
溶出度试验——
是一种控制药物制剂质量的体外检测方法,是以实验 为基础,以溶解为理论,并用数学分析手段处理溶出度试验 数据,是研究制剂所含主药的晶型、粒度、处方组成、辅料 品种和性质、生产工艺等对制剂质量统一性的方法。
一、溶出度的基本概念
溶出度与溶出曲线?
溶出曲线——
系把在不同时间点中测得的溶出量按次序依次连接起 来,成为一条连续的曲线。
(点动成线,平面上的曲线可以看作是由具有某种规 律的点组成的集合。是动点按某种规律运动而成的轨 迹。)
溶出曲线可以看成是由具有其本身溶出特征的不同时 间溶出量组成的集合。
溶出曲线表示制剂的整个溶出过程,相同处方同一生 产工艺的产品,其溶出曲线应该是相近的。
三、中国药典2010年版溶出度概况
附录:附录Ⅹ C 溶出度测定法 定义 第一法 篮法 第二法 桨法 第三法 小杯法 仪器装置、测定法、结果判定
内容汇总
溶出条件和注意事项
溶出度仪适用性及性能确认、溶出介质要求、胶囊壳干扰排除
三、中国药典2010年版溶出度概况 新增内容
附录溶出度测定法新增内容
1、明确三种测定方法的名称;
三、中国药典2010年版溶出度概况 修订内容
附录溶出度测定法修订内容
4、修订测定法中加样与启动仪器顺序;
2005:启动仪器至规定转速并平稳→已放置样品的转篮 降入溶出杯中(或样品投入溶出杯中)→自供试品接触溶出 介质起立即计时
2010:已放置样品的转篮降入溶出杯中(或样品投入溶 出杯中) →按各品种项下规定的转速启动仪器,计时;
一、溶出度的基本概念
何为溶出度? 崩解时限与溶出度? 溶出度与溶出曲线?
一、溶出度的基本概念
何为溶出度?
溶出度——
系指活性药物成分从片剂、胶囊剂或颗粒剂等制剂 在规定条件下溶出的速率和程度。
——《中国药典》2010年版
活性药物成分 固体制剂 规定条件 溶出 速率和程度
一、溶出度的基本概念
何为溶出度?
体外检测方法 实验为基础 溶解为理论
一、溶出度的基本概念
崩解时限与溶出度?
崩解——
系指口服固体制剂在规定条件下全部崩解溶散或成碎粒, 除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。
崩解和溶解的意义不一样,药物崩解的快慢并不能反映 其被人体吸收的快慢,崩解仅是溶解的前奏,崩解时限只 能表示溶解过程的最初阶段,而溶解才是机体吸收的先决 条件,溶出度检查与体内吸收情况更密切些。
一、溶出度的基本概念
溶出度与溶出曲线?
溶出度是指活性药物从片剂、胶囊剂或颗粒剂等制剂在 规定条件下溶出的速率和程度。
规定条件中的时间如果是一点,测得的溶出量就是单点 溶出度;时间如果是连续的多个点,测得的溶出量按次序连 起来就是溶出曲线。
——溶出曲线是溶出度的表达形式之一,它可以更直观 地反映溶出过程的规律。
三、中国药典2010年版溶出度概况 新增内容
新增测定溶出度(释放度)品种 2010年版相比2005年版增订了127个溶出度品种
原2005年版品种新增溶出度测定——50个 2010年版新增品种设溶出度测定——77个
三、中国药典2010年版溶出度概况
附录溶出度测定法修订内容
修订内容
1、定义上明确为是对“活性”药物的溶出度要求; 2、修订对仪器部分参数的规格要求;
罗卓雅 2010.5.26. 山西
1
2019/9/7
想了解……
溶出度总体要求有变化吗? ——仪器要求改了吗?
操作要求改了吗? 判断标准改了吗? 品种标准中有对溶出度的新要求吗? ——新增要求控制? 修订原有方法?
新要求带来影响……
主要内容
一、溶出度的基本概念 二、溶出度测定法在中国药典中的沿革 三、中国药典2010年版溶出度内容概况 四、本版药典溶出度方法制订沿用的原则 五、存在问题和思考 六、展望
第一法(篮法)、第二法(桨法)、第三法(小杯法)
1、文字上细化对仪器的要求;
转篮 ……均为不锈钢或其他惰性材料
2、增加准确量取溶出介质的量化要求;
实际量取的体积与规定体积的偏差不超过±1%
3、增加准确取样时间的量化要求;
实际取样时间与规定时间的差异不得过±2%
4、增加小杯法采用沉降装置的描述。
当在正文规定需要使用沉降装置时, 可将片剂或胶囊剂先装入规定的沉降装置内
篮网丝径:2005:0.25mm;2010:0.28mm±0.03mm 溶出杯高:2005:168mm±8mm:2010:185mm±25mm
3、溶出介质量不在附录中明确;
2005:除另有规定外,分别量取经脱气处理的溶出介质900ml, 置各溶出杯内
2010:分别量取经脱气处理的溶出介质,置各溶出杯内
三、中国药典2010年版溶出度概况
1、内容汇总 2、新增内容 3、修订内容
三、中国药典2010年版溶出度概况 内容汇总
1、附录 溶出度测定法
释放度测定法 缓释、控释和迟释制剂指导原则
2、正文 溶出度 418个 释放度(缓释制剂)21个(片15个,胶囊6个) 释放度(肠溶制剂)16个 释放度(贴片) 1个 共465个
三、中国药典2010年版溶出度概况 修订内容
附录溶出度测定法修订内容
5、不再要求取样完成时间;
删去:应按照品种各论中规定的取样时间取样,自6杯中 完成取样的时间应在1分钟内
6、“溶出度仪的校正”改称为“溶出度仪的适用 性及性能确认试验”,同时“校正片”改称为“标准 片”;
7、溶出介质脱气方法只作为“可采用”的方法;
二、溶出度测定法在中国药典中的沿革
1、方法沿革
1985年版 篮法、桨ቤተ መጻሕፍቲ ባይዱ 1995年版 篮法、桨法、小杯法
2、品种沿革
1985年版 7个 1990年版 44个 1995年版 128个 2000年版 205个 2005年版 275个 2010年版 418个
3、仪器沿革
12
2019/9/7
13
2019/9/7
三、中国药典2010年版溶出度概况 修订内容
附录溶出度测定法修订内容
8、不再要求除另有规定外的取样时间及限度;
溶出度测定法——
是将某种固体制剂的一定量分别置于溶出度仪的转篮 (或溶出杯)中,在37℃±0.5℃恒温下,在规定的转速、 溶出介质中依法操作,在规定的时间内取样并测定其溶出量。
——《中国药品检验标准操作规范》2005年版
一、溶出度的基本概念
何为溶出度?
溶出度试验——
是一种控制药物制剂质量的体外检测方法,是以实验 为基础,以溶解为理论,并用数学分析手段处理溶出度试验 数据,是研究制剂所含主药的晶型、粒度、处方组成、辅料 品种和性质、生产工艺等对制剂质量统一性的方法。
一、溶出度的基本概念
溶出度与溶出曲线?
溶出曲线——
系把在不同时间点中测得的溶出量按次序依次连接起 来,成为一条连续的曲线。
(点动成线,平面上的曲线可以看作是由具有某种规 律的点组成的集合。是动点按某种规律运动而成的轨 迹。)
溶出曲线可以看成是由具有其本身溶出特征的不同时 间溶出量组成的集合。
溶出曲线表示制剂的整个溶出过程,相同处方同一生 产工艺的产品,其溶出曲线应该是相近的。
三、中国药典2010年版溶出度概况
附录:附录Ⅹ C 溶出度测定法 定义 第一法 篮法 第二法 桨法 第三法 小杯法 仪器装置、测定法、结果判定
内容汇总
溶出条件和注意事项
溶出度仪适用性及性能确认、溶出介质要求、胶囊壳干扰排除
三、中国药典2010年版溶出度概况 新增内容
附录溶出度测定法新增内容
1、明确三种测定方法的名称;
三、中国药典2010年版溶出度概况 修订内容
附录溶出度测定法修订内容
4、修订测定法中加样与启动仪器顺序;
2005:启动仪器至规定转速并平稳→已放置样品的转篮 降入溶出杯中(或样品投入溶出杯中)→自供试品接触溶出 介质起立即计时
2010:已放置样品的转篮降入溶出杯中(或样品投入溶 出杯中) →按各品种项下规定的转速启动仪器,计时;
一、溶出度的基本概念
何为溶出度? 崩解时限与溶出度? 溶出度与溶出曲线?
一、溶出度的基本概念
何为溶出度?
溶出度——
系指活性药物成分从片剂、胶囊剂或颗粒剂等制剂 在规定条件下溶出的速率和程度。
——《中国药典》2010年版
活性药物成分 固体制剂 规定条件 溶出 速率和程度
一、溶出度的基本概念
何为溶出度?
体外检测方法 实验为基础 溶解为理论
一、溶出度的基本概念
崩解时限与溶出度?
崩解——
系指口服固体制剂在规定条件下全部崩解溶散或成碎粒, 除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。
崩解和溶解的意义不一样,药物崩解的快慢并不能反映 其被人体吸收的快慢,崩解仅是溶解的前奏,崩解时限只 能表示溶解过程的最初阶段,而溶解才是机体吸收的先决 条件,溶出度检查与体内吸收情况更密切些。
一、溶出度的基本概念
溶出度与溶出曲线?
溶出度是指活性药物从片剂、胶囊剂或颗粒剂等制剂在 规定条件下溶出的速率和程度。
规定条件中的时间如果是一点,测得的溶出量就是单点 溶出度;时间如果是连续的多个点,测得的溶出量按次序连 起来就是溶出曲线。
——溶出曲线是溶出度的表达形式之一,它可以更直观 地反映溶出过程的规律。
三、中国药典2010年版溶出度概况 新增内容
新增测定溶出度(释放度)品种 2010年版相比2005年版增订了127个溶出度品种
原2005年版品种新增溶出度测定——50个 2010年版新增品种设溶出度测定——77个
三、中国药典2010年版溶出度概况
附录溶出度测定法修订内容
修订内容
1、定义上明确为是对“活性”药物的溶出度要求; 2、修订对仪器部分参数的规格要求;
