金属的化学性质教学设计(初化人教版)
金属化学性质教学设计(精选8篇)

金属化学性质教学设计(精选8篇)金属化学性质教学设计第1篇一、教学目标1、知识与技能a、初步认识常见金属与盐酸、稀硫酸以及金属化合物溶液间的置换反应。
b、熟悉常见金属的活动性顺序,学会利用金属与酸以及金属化合物溶液之间的置换反应,推断常见金属活动性顺序。
2、过程与方法a、学会通过实验探究金属活动性顺序的方法。
b、学习通过对实验现象的对比分析,对信息的归纳处理,获取结论的科学方法。
3、情感、态度与价值观a、通过学生亲自做探究实验,激发学生学习化学的浓厚兴趣,发展求知欲和探究激情。
b、通过对实验的探究、分析,培养学生严谨、认真、实事求是的科学态度。
c、使学生在实验探究、讨论中学会与别人交流、合作,增强协作精神。
二、教学内容分析1、内容分析在介绍金属的物理性质的基础上,本课题侧重介绍金属的化学性质,其中金属活动性顺序是一个重点。
此前,学生在第一课时已经研究了金属与氧气的反应,对其中表现出的金属活泼程度的不同有所了解。
在这里安排对金属活动性顺序的探究,能使学生掌握金属化学性质的'共性,又能通过反应上的区别加深对金属活动性顺序的理解。
虽然学生在以前的学习中已经见过几个置换反应,但是并不熟悉,运用也不熟练,因此我改变了教材在探究活动中让学生填写相关化学反应方程式的要求,重点要求学生对反应能否进行、反应进行的剧烈程度等情况进行认真观察、比较即可。
而将对置换反应特点和规律的总结放在下一课时,这样学生对金属活动性顺序的建构更加完整,对置换反应的理解、掌握和运用也更容易。
2、重点、难点分析教学重点:金属活动性顺序。
教学难点:对金属活动性顺序知识有意义的建构。
三、教学对象分析九年级的学生已初步具备了一定的提出问题、分析问题和解决问题的能力,对事物的认识正处于从感性到理性的转变时期,实验是激发他们学习兴趣的最好方法。
因此,可以用“实验探究──讨论”的教学模式,完成对金属活动性的认识从具体到抽象、从感性到理性的转变,引导学生在“做中学,学中会”。
人教版九年级化学8.2《金属的化学性质》教学设计

在情感态度与价值观方面,学生普遍认识到金属在生活中的重要作用,但对于金属资源的保护、环保等方面的意识较为淡薄。因此,教师在教学过程中应注重培养学生的环保意识和社会责任感,使他们在掌握金属化学性质的基础上,关注金属资源的合理利用和可持续发展。
在教学过程中,注重培养学生的:
1.对化学学科的兴趣,激发学生的探究欲望和创造性思维。
2.科学态度和批判性思维,学会质疑和验证,培养严谨的学术精神。
3.环保意识,理解金属资源的重要性,倡导节约使用和回收再利用。
二、教学重点与难点
1.教学重点:金属的活泼性、还原性及其在化学反应中的应用。
2.教学难点:金属活动顺序的理解及其在化学反应预测中的应用。
三、教学步骤
1.导入新课:通过日常生活中的金属制品引入,激发学生探究金属化学性质的兴趣。
2.知识讲解:系统讲解金属的活泼性、还原性,结合金属活动顺序表进行说明。
3.实验探究:设计系列实验,让学生亲身体验金属的化学性质,如金属与酸的反应、金属的置换反应等。
4.反馈交流:组织学生进行小组讨论,分享实验观察结果,讨论金属化学性质的应用。
三、教学重难点和教学设想
(一)教学重点
1.金属的化学性质,如活泼性、还原性等基本概念及其应用。
2.金属与酸、金属与金属离子反应的实验现象及其原理。
3.金属化学性质在日常生活中的实际应用和环保意义。
(二)教学难点
1.金属活泼性、还原性等概念的理解和区分。
初中化学金属的化学性质教学设计

初中化学金属的化学性质教学设计一、引言化学是一门研究物质及其性质、组成、结构、变化规律的学科。
在初中化学教学中,金属是一个重要的研究对象。
金属具有独特的物理和化学性质,通过深入了解金属的化学性质,可以帮助学生培养对实验的思维、观察和分析能力。
本教学设计将从金属的硬度、延展性、导电性、热传导性等方面入手,设计一系列实验和讨论,旨在帮助学生全面了解金属的化学性质。
二、实验一:金属的硬度1. 实验目的通过实验观察和测量不同金属的硬度,了解不同金属在硬度上的差异。
2. 实验材料和仪器锤子、不同金属样品(如铁、铝、铜等)、硬度测量器(如刮痕硬度计)3. 实验步骤(1)将不同金属样品放置于水平的实验台面上。
(2)用锤子分别敲击不同金属样品,观察和记录金属的反应(如损坏、变形等)。
(3)使用硬度测量器对不同金属样品进行硬度测量,记录结果。
4. 实验结果和讨论通过上述实验,学生可以观察到不同金属在受力下的反应差异。
例如,铁比铝更容易损坏,因此铁可能具有更高的硬度。
通过硬度测量器可以精确测量出不同金属的硬度值,这可以帮助学生进一步了解金属在物理性质上的差异。
三、实验二:金属的延展性1. 实验目的通过实验研究不同金属的延展性,了解金属在受力下的变形特点。
2. 实验材料和仪器不同金属样品(如铜丝、铝箔等)、量尺、直尺、蜡烛3. 实验步骤(1)将不同金属样品准备好,如铜丝、铝箔等。
(2)使用量尺和直尺测量金属样品的初始长度和宽度。
(3)将金属样品加热至较高温度,使其变得柔软。
(4)在变软的金属样品上加力,拉伸或压缩金属样品,观察和记录金属的变形情况。
(5)待金属样品冷却后,重新测量其长度和宽度,与初始数值进行比较。
4. 实验结果和讨论学生通过上述实验可以观察到金属在受热后变得更加柔软,并能够在外力作用下发生变形。
不同金属的延展性也有所不同,例如铝箔比铜丝更容易拉伸。
通过实验结果的对比分析,学生可以进一步认识到不同金属在延展性上的差异。
人教版初中化学 教学设计 _金属的化学性质

教学设计一、教学目标1、知识与技能:(1)知道铁、铝、铜等常见金属与氧气的反应(2)初步认识金属活动顺序和置换反应(3)能用金属活动顺序对有关的置换反应进行简单的判断,并能利用金属活动顺序解释一些与生活、生产中的实际问题。
2、过程和方法:(1)学会运用控制变量的方法探究金属活动顺序(2)初步学会运用实验、观察的方法获取信息,能用文字,化学语言表述有关信息,运用比较、分类、归纳概括的方法对获取的信息进行加工。
3、情感态度与价值观:(1)培养学生的合作意识,体验合作学习带来的快乐。
(2)培养学生勤于思考,严谨求实的科学精神。
二、教学过程教师活动学生活动设计意图【课题引入】新闻报道【媒体展示】新闻内容犯罪团伙用黄铜充当黄金行骗我们该怎样辨别真伪呢,拆穿骗子的阴谋呢?【过渡】对金属的认识,只了解物理性质是不够的,还要研究其化学性质。
【板书】2、金属的化学性质【要求】学生阅读教材P9“一、金属与氧气的反应”,通过阅读,解决学案上的问题【板书】金属---------氧气【提问】学案上的问题学生思考回答:金属的物理性质、颜色学生阅读,思考问题学生回答学生回顾激发学生学习的兴趣有的放失,培养学生阅读能力了解基本知识点,达到学以致用的目的利用原有的知识基础提高学生【小结】比较常温、高温下金属与氧气反应的难易,得出金属的活动性是有强弱的。
【板书】Mg、Al >Fe、Cu>Au 【提出问题】还能用那些方法判断金属的活动性强弱呢?【回顾】金属(Mg、Zn)与酸的反应【板书】金属------酸【提出问题】金属(Mg、Zn)与酸的反应共同的现象是什么?放出气体的速度不同,就可以判断金属活动强弱是不是所有的金属与酸反应放出气体?【媒体展示】探究一【介绍】药品同学们都知道影响反应速度的因素有固体颗粒大小、药品浓度、温度等,要比较四种金属与酸反应的剧烈程度,应如何选择药品?各小组讨论拿出实验方案组织汇报实验方案评价实验方案【媒体展示】实验内容【展示介绍】井穴板【要求】1、四个小组做金属与盐酸反应,另外四个小组做金属与硫酸反应2、注意做好记录组织学生汇报实验现象【小结】通过小组探究,你得出什么结论?【板书】Mg>Zn>Fe>Cu 【提问】你知道三个反应中放出的是学生回答学生讨论,形成实验方案学生选代表表述学生操作学生选代表表述学生回答学生回答学生在学案上书写化学方程式学生对比,纠正错误学生逐项回答学生倾听的探究能力。
《金属的化学性质》教案(最新6篇)

《金属的化学性质》教案(最新6篇)《金属的化学性质》教案篇一教学目标知道铁、铝、铜等常见金属与氧气的反应,初步认识常见金属与盐酸、硫酸的置换反应以及与化合物的溶液的反应。
通过对金属活动性顺序的学习,能对有关的置换反应进行简单的判断,并能用金属活动性顺序解释一些与日常生活有关的化学问题。
通过活动与探究,培养学生细致观察实验现象的良好行为习惯、从细微实验现象差别分析得出实验结论的能力,形成科学、严谨的治学精神。
重点和难点金属与氧气反应;金属活动性顺序;置换反应的判断实验准备教师:镁条、锌片、铁片、铜片、稀盐酸、稀硫酸、铝丝、铁丝、硫酸铜溶液、硝酸银溶液和多媒体课件。
学生:镊子、试管夹、试管架、试管、砂纸、火柴、酒精灯、小木条。
课时安排2课时教学设计教学过程点评第一课时创设情境引入多媒体展示下列实物照片:黄金项链、银戒指、铁匠铺刚打制出的镰刀、镁条。
从学生熟悉的装饰品入手,有力地激发了学生寻求“金属为什么会变色”的欲望。
问题是否为各种金属的本质颜色?不是本质颜色的原因是什么?学生活动①学生讨论并填写下列表格并交流:(任选两种)物质本色观察到的颜色是否变色原因(猜想)②猜想镁条、镰刀变色的原因。
③链接民间谚语:“真金不怕火炼”的具体含义是什么?学生讨论、小结:有的金属能与氧气发生反应,有的不能。
如(化学方程式):3Fe+2O2Fe3O4。
从生活中的普通现象得到金属能与酸反应这一性质,无生硬感和灌输感,可谓水到渠成。
衔接生活小知识绿豆在铁锅中煮熟后为何会变黑?在生活中有这样一个现象:绿豆在铁锅中煮了以后会变黑;苹果、梨子用铁刀切了以后,表面也会变黑。
请同学们想一想这是为什么呢?教师讲解:这是因为绿豆、苹果、梨子与多种水果的细胞里,都含有鞣酸,鞣酸能和铁反应,生成黑色的鞣酸铁。
绿豆在铁锅里煮,会生成一些黑色的鞣酸铁,所以会变黑。
问题:从刚才的生活小常识中你有什么启示?过渡自然。
由生活常识创设情境,激起学生强烈的好奇心,比平淡的言语过渡更具“挑逗性”,学生也觉得“学习化学真有用”。
金属的化学性质教学设计

金属的化学性质教学设计教学目标:1、知识与技能⑴知道铁、铝、铜等金属与氧气的反应。
⑵初步认识常见金属与盐酸、硫酸的置换反应。
初步认识金属的化学性质及其活动性顺序。
2、过程与方法:⑴通过认识金属的化学性质及其活动性顺序,初步学会观察、实验等方法获取信息,能用文字、图表和化学语言表达有关信息。
⑵初步学会运用比较、分类、归纳、概括等方法对获取的信息进行加工。
3、情感、态度与价值观⑴培养学生的合作意识以及勤于思考、善于总结归纳的科学精神,发展学生学习化学的兴趣。
⑵培养学生勇于创新的科学精神;培养学生辨证唯物主义观点;保持和增强对化学现象的好奇心和探究欲。
教学重点、难点:金属与盐酸、硫酸的反应;置换反应的特点;部分金属活动顺序。
教学设计第一课时一、创设情境,导入新课导入提问:铝制品耐腐蚀,我们都知道,但是同学们,为什么铝制品很耐腐蚀呢?这与我们今天要讲的金属的化学性质有关。
那么金属有哪些化学性质呢?复习回顾,课前热身:1、书写化学方程式,并注明反应类型。
⑴铁丝在氧气中燃烧:3Fe+2O2点燃Fe3O4 , 化合反应⑵铝粉在空气中燃烧:4Al+3O2点燃2Al2O3,化合反应⑶镁带在空气中燃烧:2Mg+O2点燃2MgO ,化合反应二、合作交流,共同探究:(一)金属与氧气的反应活动1:实验:镁、铁、铝、铜等金属与氧气在常温和高温下的反应。
交流总结:1、镁、铝在常温下就能与氧气发生反应。
2Mg+O2===2MgO 4Al+3O2===2Al2O3相互呼应,解释铝耐腐蚀的原因:铝易与氧气发生反应生成一层致密的氧化铝薄膜,阻止铝进一步被氧化。
2、铁铜在加热的条件下能与氧气发生反应。
3Fe+2O2∆Fe3O4 2Cu+O2∆2CuO3、金、银在高温下也不与氧气反应例:“真金不怕火炼”就说明了金即使在高温下也不与氧气反应。
活动探究2:让同学们总结这几种金属的活动性。
小结:镁、铝较活泼,铁、铜次之,金、银不活泼。
强调:铁丝在空气中不能燃烧,只能在纯氧中燃烧。
人教版九年级化学下册第八单元 课题2金属的化学性质 教学设计

人教版九年级化学下册第八单元课题2金属的化学性质教学设计一、教学目标1.了解金属的常见性质和化学性质。
2.掌握金属与非金属的区别。
3.理解金属与非金属之间的电子转移过程。
4.能够描述金属氧化反应和金属与酸的反应。
二、教学重点1.金属的化学性质及其在生活中的应用。
2.金属中电子的特殊性质及其在化学反应中的作用。
三、教学准备1.教师准备实验: 一块铜片、一块锌片、盐酸、稀硫酸等实验用品。
2.教师准备PPT或者黑板、粉笔。
四、教学过程1. 导入与引入引导学生回忆前一课中学习的金属和非金属的区别,并让学生思考金属的一些常见性质和化学性质。
2. 金属的常见性质简单介绍金属的常见性质:导电性,热导性,延展性,硬度,熔点,密度等。
并与非金属进行对比,让学生了解金属的特点和非金属的特点。
3. 金属与非金属的特性分析通过实验或者示意图,让学生观察金属与非金属的外观差异、导电性实验等,并引导学生思考金属导电的原因。
4. 金属的电子转移过程通过实验或者示意图,让学生观察金属与非金属在化学反应中电子的转移过程,引导学生理解金属的电子特殊性质。
5. 金属与氧的反应通过实验或者示意图,让学生观察金属与氧反应的现象,引导学生理解金属氧化反应的化学性质。
6. 金属与酸的反应通过实验或者示意图,让学生观察金属与酸反应的现象,引导学生理解金属与酸反应的化学性质。
7. 学生参与讨论让学生根据所学内容,讨论金属的应用及其与非金属的区别,展示所学知识。
五、教学总结通过本节课的学习,学生应该对金属的常见性质和化学性质有了初步的了解,掌握了金属与非金属的区别以及金属在化学反应中的特殊性质。
在以后的学习和生活中,学生能够运用所学知识来理解和解释金属的一些现象,理解金属在生活中的应用和重要性。
以上是对《人教版九年级化学下册第八单元课题2金属的化学性质教学设计》的简要教学设计,希望对您有所帮助。
金属的化学性质教学设计(优秀5篇)

金属的化学性质教学设计(优秀5篇)《金属的化学性质》教案篇一【教学目标】(1)知识与技能目标:①知道铁、铝、铜等常见金属与氧气的反应②初步认识金属活动性顺序和置换反应(2)过程与方法目标:①初步学会运用观察、实验等方法获取信息,能用文字、图表和化学语言表述有关信息。
②初步学会运用比较、分类、归纳、概括等方法对获取的信息进行加工,帮助学生逐步形成良好的学习方法和习惯3.情感态度与价值观(1)激发学生学习化学的兴趣。
(2)培养勤于思考、严谨求实、勇于实践的科学精神。
(3)了解化学与日常生活和生产的密切关系。
【教学重难点】重点是:通过实验探究熟悉金属活动性顺序。
难点是:运用金属活动性顺序解释生活、生产中的实际问题1.金属活动性顺序。
运用金属活动顺序表判断金属的置换反应能否发生,化学方程式的书写(尤其含亚铁的)。
【教学方法】问题情景→实验探究→得出结论→练习巩固→联系实际。
实验探究法、问题教学法、讨论法【学法指导】探究法、对比法、讨论法【教具准备】教师用具:投影仪、镁条、铝片、铜片、被氧化了的镁条与铝片、酒精灯、坩埚钳、火柴、砂纸。
学生用具:稀盐酸、稀硫酸、硝酸银溶液、硫酸铜溶液、硫酸铝溶液、铝丝、铜丝、镁钉、锌粒、铜片、铁片、砂纸、火柴、试管(若干)。
【课时安排】1课时【教学过程】【问题导入】展示古代金、银、铜、铁等金属制品的图片。
为什么有的保留这么完整,表面没有什么改变;而有的金属表面却有这么大的改变呢?这些金属制品的“化妆师”是谁呢?【互动合作】学生思考并回答问题。
回忆相关反应的现象、条件,书写化学方程式。
3Fe+2O2Fe3O42Mg+O22MgO4Al+3O22Al2O3观察并记录实验现象。
请一位同学上黑板书写上述反应的化学方程式。
学生小组讨论并汇报本组的实验方案或生活实例。
听讲,进一步理解金属与氧气的反应。
【板书】课题2金属的化学性质【课题引入】确切地说应该是空气中的氧气在偷偷在起作用。
我们先来回忆一下以前学习过的金属和氧气的化学反应有哪些呢?它们反应的现象是什么?化学方程式怎样写?【展示】镁、铁燃烧的图片【演示】将一根铜丝和金戒指分别放在酒精灯火焰上燃烧。
初中化学《金属的化学性质》教学设计

初中化学《金属的化学性质》教学设计初中化学《金属的化学性质》教学设计《金属的化学性质》主要介绍了几种重要的金属的化学性质其中包括与氧气的化学性质及与酸的化学性质,并根据几种金属与不同物质反应的总结置换反应的概念。
那么,《金属的化学性质》教学设计怎样写?下面给大家分享《金属的化学性质》教学设计,欢迎借鉴!《金属的化学性质》教学设计1一、教学目标【知识与技能】能判断金属的活动性顺序,能够用金属活动性顺序解释日常生活中的问题。
【过程与方法】通过实验探究,提高思考、分析、解决问题的能力。
【情感态度与价值观】养成严谨的科学态度,提高学习化学的学习兴趣。
二、教学重难点【重点】金属活动性顺序。
【难点】金属活动性顺序的应用和适用条件。
三、教学过程环节一:导入新课【提出问题】之前我们已经学习了什么是置换反应,那么老师在大屏幕上出示几个置换反应,大家来判断一下产物是什么。
Zn+H2SO4=_______________Cu+H2SO4=_______________【学生回答】锌与硫酸生成氢气和硫酸锌。
通过上节课的实验可以知道铜与硫酸不发生反应。
【教师引导】既然锌能与酸反应,铜不能与酸反应,由此可知金属的活泼性是不同的。
那么金属的活动性强弱是怎样的顺序呢,这节课我们就一起来探究金属的活动性。
环节二:新课讲授【学生实验】①铁与硫酸铜的反应;②铁、铜分别与盐酸的反应【提出问题】通过实验,思考铁与铜,哪种金属更加活泼?为什么?【学生回答】铁比铜活泼,因为铁与盐酸发生了反应,有气泡产生,而铜与盐酸不反应,并且铁能把铜从硫酸铜溶液中置换出来,说明铁更活泼。
【提出问题】通过这两组实验,你能说说我们在证明金属活动性强弱时采取的实验方法吗?【学生回答】第一种方法是让金属与另一金属的盐溶液反应,根据能否发生置换反应判断金属活泼性强弱;第二种方法是让金属与酸反应,根据能否发生反应、发生反应的剧烈程度来判断金属活泼性强弱。
【教师引导】现有镁、铜、锌三种金属,利用上述实验方法,你能设计方案并通过实验来判断镁、铜、锌三种金属谁的活动性更强吗?(药品:镁条、铜丝、锌粒、稀盐酸、稀硫酸、氯化镁溶液、硫酸锌溶液、硫酸铜溶液。
人教版九年级化学第八单元课题2金属的化学性质教学设计

-小组讨论:针对金属活动性顺序的应用,让学生分组讨论,共同解决实际问题,如金属提炼、金属防腐蚀等。
6.课后作业设计,巩固所学知识,提高学生的思维品质。
-作业设计:布置具有挑战性的课后思考题,如“如何利用金属活动性顺序表预测未知金属与氧气、酸、盐溶液的反应?”等,激发学生的求知欲。
1.教师提出讨论题目,如:“如何利用金属活动性顺序表预测未知金属与氧气、酸、盐溶液的反应?”
2.学生分组进行讨论,组内成员共同分析、探讨,形成共识。
3.各组汇报讨论成果,教师点评、总结,引导学生深入理解金属活动性顺序的应用。
4.鼓励学生提出问题,激发他们的求知欲,培养批判性思维。
(四)课堂练习
1.教师设计具有针对性的练习题,涵盖金属与氧气、金属与酸、金属与盐溶液反应的知识点。
4.扩展阅读:查找资料,了解金属活动性顺序在ห้องสมุดไป่ตู้业中的应用,例如金属的提炼、防腐蚀技术等,并撰写一篇不少于300字的小短文,分享你的学习心得。
5.小组合作任务:每组设计一个关于金属活动性顺序的趣味问题或小实验,下周课堂上与其他小组分享,以促进同学们的交流与合作。
2.提问:“为什么金属会发生这些变化?金属的化学性质又是怎样的呢?”引发学生思考,为新课的学习做好铺垫。
3.通过展示金属活动性顺序表,让学生初步了解金属活动性的规律,激发学生的学习兴趣。
(二)讲授新知
1.介绍金属与氧气的反应,讲解不同金属在空气中与氧气反应的现象,如铁生锈、铝氧化等,阐述金属活动性顺序在这一反应中的作用。
3.组织学生进行小组讨论、交流,培养学生的合作精神和批判性思维。
4.设计具有挑战性的问题,激发学生的求知欲和创新能力。
课题二__金属的化学性质(教学设计)

第八单元金属和金属材料课题2 金属的化学性质第一课时【教学目标】:1、知识目标1)知道铁、铝、铜等常见金属与氧气的反应2)初步认识常见金属与盐酸、硫酸的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
3)能用金属活动顺序表对有关的置换反应进行判断,并能利用金属活动顺序表解释一些与日常生活有关的化学问题。
2、过程与方法1)认识科学探究的基本过程,能进行初步的探究活动。
2)初步学会运用观察、实验等方法获取信息,并能用图表和化学语言表达有关信息。
3)初步学会运用比较、归纳、概括等方法对获取的信息进行加工。
3、情感与价值观1)激发学习化学的兴趣2)培养勤于思考、严谨求实、勇于实践的科学精神。
3)了解化学与日常生活和生产的密切关系【教学重点】:金属活动性顺序、置换反应【教学难点】:对金属活动性顺序的初步探究课前预习1、、等在常温下就能与氧气反应,、等常温下几乎不与氧气反应,但在高温时也能与氧气反应,即使在高温下也不与氧气反应,由此我们可以看出,镁、铝比较活泼,铁、铜次之,金最不活泼。
2、很多金属不仅能与氧气反应,而且还能与或反应,金属与酸反应的剧烈程度,可以反映金属的活动性。
下图时甲、乙、丙、丁四种金属与盐酸反应的漫画,周围的小黑点表示反应生成的气体,则这四种金属的活动性顺序为:若甲为镁,生成的气体时氢气,则反应的化学方程式为 ,反应类型是 (填置换反应、分解反应、化合反应),该反应由一种 和一种 反应,生成另一种 和另一种 。
课内探究自主学习情景导入:拿破仑的故事在拿破仑时期。
一次宴会上,皇宫贵族们为了显示自己地位的高贵,都选用金制、银 制的餐具。
惟独拿破仑用的是铝制的餐具, 你知道这是为什么吗?(当时拿破仑已经是 一国元首。
)一、金属与氧气的反应1、在常温下,镁和铝可以和氧气反应2Mg + O 2 ===== 2MgO 4Al + 3O 2 ===== 2Al 2O 3 2、在高温时,铁和铜也可以和氧气反应3、金在高温时也不能与氧气反应【结论】:镁和铝比较活泼,铁和铜次之,金最不活泼 二、金属与酸反应〔活动与探究〕 金属与酸反应 四位先生的表情:3Fe + 2O 2 ==== Fe 3O 4 高温 2Cu + O 2 ==== 2CuO 高温完成下表【合作交流】【讨论】:1、哪些金属能与盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与盐酸、稀硫酸发生反应?根据反应时是否有氢气产生,将金属分为两类。
《金属的化学性质》教学设计

《金属的化学性质》教学设计1.课题:人教版第八单元课题2 金属的化学性质2、教学目标分析知识与技能:(1)知道铁、铝、铜等常见金属与氧气的反应。
(2)初步认识常见金属与盐酸、硫酸的置换反应,以及与盐溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
(3)能用金属活动性顺序对有关的置换反应进行简单地判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
过程与方法:(1)体验和学习利用控制实验条件进行科学探究的方法,学会运用控制实验条件探究金属活动性顺序。
(2)学习通过对实验现象进行筛选、对比、归纳、分析、进行信息处理,获取科学结论的科学方法。
情感态度与价值观:(1)通过对五彩纷呈的化学现象的观察,激发学生的好奇心和求知欲,发展学习化学的兴趣。
(2)培养学生的合作意识以及勤于思考、勇于创新实践、严谨求实的科学精神。
(3)了解化学与日常生活和生产的密切关系,提高学生解决实际问题的能力。
(4)在有趣的实验与老师的点拨中轻松掌握化学知识,体验到学习的快乐。
3、教学重难点:重点:金属活动性顺序的理解和应用难点:(1)用置换反应和金属活动性顺序判断反应能否发生。
(2)用置换反应和金属活动性顺序解释某些与生活有关的化学问题。
4.教学方法:小组合作法、实验探究法5.教学准备:仪器药品、铁片、铜片、铝片、铁丝、铜丝、铝丝、酒精灯、火柴、砂纸、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液6、教学过程导入:【创设情景】在现代考古中,发现从地下出土的文物里,金银器具总是比铁器保存得完整、完好,而且年代比铁器早。
你知道为什么吗?新授:【活动探究一】金属与氧气反应【问题引导】所有金属是不是都能与氧气反应?(不,“真金不怕火炼”说明在高温下也不与氧气反应)(1)金属与氧反应的难易程度(见下表)活泼程度:镁铝>铁铜>金,根据金属与氧气反应的难易程度判断。
【讲述】金属的活泼程度又称为金属的活动性,同时我们找到判断金属活动性的第一种方法。
金属的化学性质教学设计(初化人教版)

金属的化学性质(第1课时)◆教材分析:本节内容选自九年义务教育(人教版)初三化学第八章。
第八章上接“碳”下承“酸碱盐”的桥梁部分,是在原有知识的基础上对金属的化学性质进行较为深入、系统地学习,这样使元素和化合物知识更加完整。
具体内容主要有常见金属的三点化学性质及置换反应的定义。
本课题它侧重于对金属活动性顺序的理解和能利用金属活动性顺序解释—些与日常生活有关的化学问题,使学生在获得知识的同时,解决实际问题的能力也获得提高,而且学好本课题为以后学习酸、碱、盐打下良好的基础。
根据学生的实际情况,我将本节内容分成如下三个课时:①金属与氧气的反应,与酸的反应,置换反应②金属与化合物溶液的反应;③金属活动性顺序的应用与探究。
◆学情分析:实验技能方面:通过上学期的学习,学生已经熟练掌握一些实验仪器的操作,具备良好的实验素质,同时也具有一定的探索和归纳总结的能力,为本节课打下了良好的实验基础。
理论知识方面:学生已经掌握了氧气、氢气的化学性质,以及元素方面的一些基本知识,并学习了物质的分类和化学方程式的书写,为本节课打下了理论知识基础。
1◆教学重点:金属与氧气与酸反应的化学性质和置换反应判断。
◆教学难点:金属活动性强弱的探究过程。
◆学习目标:◆(1) 知识和技能目标:初步认识镁、铝、铁、铜等常见金属与氧气的反应,与盐酸、稀硫酸的置换反应。
◆(2) 过程和方法目标:通过活动与探究,学习对获得的事实进行分析,得出结论的科学方法。
◆(3)情感态度与价值观目标:培养学生的合作意识以及勤于思考、严谨求实、勇于创新的科学精神。
◆课前准备:制作学习任务单,PPT,教学设计,微课视频。
◆教学流程:教学过程:教师活动学生活动教学意图创设情境引入:多媒体展示电视购物视频和黄金图片。
提出问题:如何鉴别真假黄金?观看视频,并思考教师的问题。
从学生熟悉的装饰品入手,有力地激发了学生寻求“鉴别真假黄金”的欲望。
过渡语:今天我给大家带大声朗读本节课的学习目标。
初中化学金属的化学性质教案

初中化学金属的化学性质教案课时安排:2课时一、教学目标:1.了解金属的一般化学性质;2.掌握常见金属的活泼性、稳定性等特点;3.了解金属与非金属的反应;4.培养学生观察实验现象、提炼实验规律的能力。
二、教学内容:1.金属的活泼性;2.金属的稳定性;3.金属与非金属的反应。
三、教学步骤与重点:步骤一:引入新知1.利用实验现象,引导学生思考:金属在空气中会发生氧化,这是因为金属有什么特性呢?为什么一些金属易氧化,而另一些金属不易氧化?2.导入新课,告诉学生本节课将学习金属的一般化学性质,包括活泼性和稳定性。
步骤二:学习活泼性的特征及表现1.设计简单实验,将锌粉分别与铁片、铜片、镁粉、钠片接触,观察实验现象。
2.引导学生讨论实验现象,总结活泼性的特征及表现。
3.让学生探究为什么锌粉片能与铜离子溶液反应得更快、更剧烈?步骤三:学习金属稳定性的特征及分类1.利用周期表,将常见金属分成活泼金属、稳定金属两类,并列举代表性金属。
2.学生根据已学知识,编写实验记录,说明下列金属属于活泼金属还是稳定金属:铁、银、钾、铝、锌、铜。
步骤四:金属与非金属的反应1.设计实验,分别让铜、铁与硫反应,观察实验现象。
2.让学生根据实验记录,总结金属与非金属的反应规律。
3.提问:金属与非金属的反应是氧化反应吗?为什么?四、教学延伸1.在家庭实践中观察金属与非金属的反应现象,如铁器生锈等,加深对本节课知识的理解和应用。
2.探究常见金属对水的反应情况,如钠与水反应得更剧烈等。
五、教学反思通过观察实验现象,学生能够初步理解金属的活泼性、稳定性等概念。
通过教师引导和问答,学生能够提炼实验规律,并分析实验现象背后的原因。
但是,由于课时有限,学生掌握的金属化学性质还较为简单,尚未涉及稀有金属、金属合金等内容。
在教学过程中,教师需要注意引导学生思考和互动讨论,以提高学生的学习兴趣和启发他们主动探究。
九年级化学《金属的化学性质》教学设计

教学设计:金属的化学性质教学目标:1.熟悉金属的化学性质,包括金属的物理性质、化学反应性和氧化性。
2.完成金属的化学性质相关实验,培养学生的动手能力和科学实验观察与分析能力。
3.培养学生的合作能力和团队精神,通过小组合作探究和分析金属的化学性质。
教学重点:1.掌握金属的物理性质和化学反应性。
2.了解金属的常见氧化反应。
教学难点:1.理解金属离子的形成过程和金属的电子结构对其化合物特性的影响。
2.理解氧化反应的原理和应用。
教学过程:一、导入(10分钟)1.引入金属的化学性质,提问学生金属与非金属的区别,并给予简单解答。
2.提醒学生关于金属的物理性质和化学反应特性的相关实验,激发学生的兴趣。
二、自主学习(30分钟)1.学生自主学习金属的物理性质和化学反应性,通过参考教材或其他资料,了解金属的常见性质和实际应用。
2.学生将自主到的信息整理成小组报告,准备展示和讨论。
三、小组合作(30分钟)1.将学生分为小组,每个小组选择一种金属进行深入探究。
鼓励学生通过实验和观察,探究该金属的物理性质和化学反应性。
2.学生通过实验记录和观察记录,整理出金属的性质和反应特点,并与其他小组分享和比较。
四、知识讲解(30分钟)1.教师对学生的实验结果进行点评和总结,引导学生从实验中找出金属的物理性质和化学反应性的共性和差异。
2.通过知识讲解,解释金属的物理性质和化学反应性的原因,包括金属与非金属的电子结构和原子半径差异对化学性质的影响。
五、应用拓展(30分钟)1.以氧化反应为案例,让学生了解金属的氧化反应和常见金属氧化反应的应用。
例如,腐蚀现象、金属矿提取等。
2.引导学生进行小组讨论,讨论金属的氧化反应对环境和工业生产的影响,并提出相应的措施。
六、课堂小结(10分钟)1.教师对本节课的重点和难点进行总结,帮助学生梳理知识结构。
2.鼓励学生提出问题和疑惑,为下一节课的学习做好准备。
教学延伸:1.学生可根据自身兴趣和实验条件,选择其他金属进行实验和探究。
《金属的化学性质》教学设计(初化人教版)
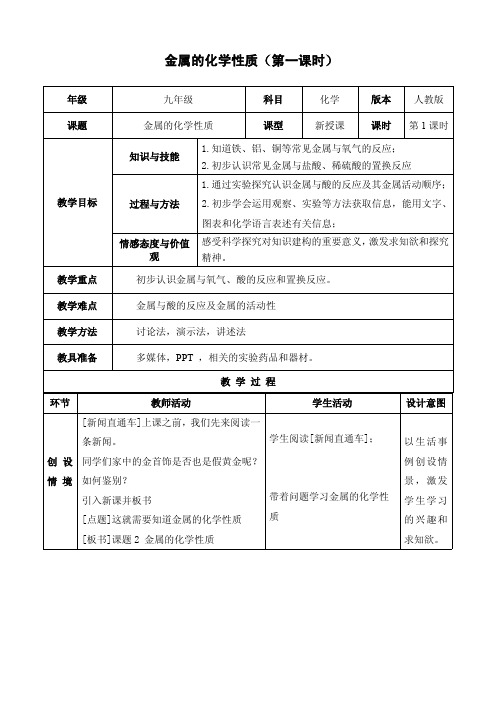
年级
九年级
科目
化学
版本 人教版
课题 教学目标 教学重新授课
课时 第 1 课时
知识与技能
1.知道铁、铝、铜等常见金属与氧气的反应; 2.初步认识常见金属与盐酸、稀硫酸的置换反应
1.通过实验探究认识金属与酸的反应及其金属活动顺序;
过程与方法 2.初步学会运用观察、实验等方法获取信息,能用文字、
动性 [提出问题] (1)铝的活动性较强,常温下能与空气
[答]金属的活动性顺序: Mg,Al>Fe,Cu>Au
中的氧气反应,但为什么小明家中的铝锅
不易被锈蚀呢? [投影]播放视频资料 [提出问题]
学生通过观看视频资料回答 [ 答] 其表面形成一层致密的 氧化铝薄膜,从而阻止铝进一
步氧化,因而铝具有很好的抗
小结
的反应,和酸的反应。
纳能力
作业:课本 P14 页 1、4 题
②置换反应:A+BC=AC+B
交流自己的感受和体会。
多媒体展示:
呼 应 同学们,你能鉴别家中金首饰的真伪了 学生通过金属的化学性质思
课 首 吗?(悄悄告诉你:假黄金一般是铜锌合 考鉴别方法
运用知识
金哟。)
课 题 2 金属的化学性质
板书 设计
CH4+2O2 ===CO2 + 2H2O
反应的特 点,掌握 置换反应 这个基本 的反应类 型。
H2+CuO ===Cu + H2O
[小结]置换反应和化合反应、分解反应一
样,也是属于化学反应基本类型之一,他
的特点可表示为:A+BC=AC+B,A 置换 B,
书写化学方程式时,将 A 与 B 的位置交换,
金属的化学性质教学设计(初化人教版)

息,喜忧参半。既盼望涨工资,又担 买几个金戒指储备收藏。又
心通货膨胀,看,这老两口坐着专机 爬不动受骗上当,来找大家
干啥来了!
鉴定帮忙!
学以致用,应 用上节课学
[提出问题]:老两口大老远来了, 思考问题,积极出谋划策。
习的,合金的
求咱们来帮他们鉴定他们买的金戒
性质与纯金
指是真(纯金)是假(黄铜,铜锌合 如:测密度,用牙咬(硬度) 属的差别
更深刻的理 解金属活动 性顺序表的 应用,避免错 误的出现
[布置课后作业]:完成学案上的 习题。希望大家都学有所获!
7
学以致用,巩 固课堂效果
8
六、教学过程
教师活动
学生活动
设计意图
[课堂引入]:十八大报告提出: 看赵本山宋丹丹小品剧照。 引入新课,提 听音频:十八大指引我们奔 高学习兴趣
到 2020 年 城 乡 居 民 人 均 收 入 比 向小康,2020 年工资成倍 引 出 真 假 戒
2010 年翻一番。老百姓听到这个消 增长;心理害怕通货膨胀, 指的鉴别。
氧化。写方程式。
和书写化学
反应方程式
3
[总结点题]:区分真假戒指的第 一种化学方法,用火烧!利用金属与 氧气发生化学反应的原理。
领会,学以致用,把学到的 的能力 知识用于解决实际问题。
发现同学的 学生概括方法、现象、结论: 错 误 并 改 正 用火烧,变黑的为假戒指, 错误的能力 不变色的为真戒指!
4
出,则为假金戒指,若无现 象则为真金戒指。
观察分析能 力的培养
[讲授新课]:请大家观察我们写 的金属和酸反应的这些化学反应方 程式,从物质的类别角度分析,有什
观察发现:反应物为单质和 化合物,生成物为新的单质 和新的化合物
金属的化学性质 初中九年级化学教案教学设计课后反思 人教版

新入职教师教学设计比赛姓名:支媛学科:化学年级:初三3、【合作探究二】:探究金属与酸的反应4、【小组交流,归纳新知】5、【七嘴八舌】:畅谈收获【教师】:同学们,并非所有的金属都能通过与氧气的反应来判断其金属性的强弱。
那么我们还能通过设计怎样的实验来继续探究金属的金属性强弱呢?【教师】:不错!可以通过探究金属与酸反应来判别金属的金属性强弱。
那么我们判断金属性强弱的依据是什么?【教师】:没错!回答的非常好!【教师】小组合作探究金属与酸的反应。
要求:4人一小组,每组分别有Fe、Mg、Zn、Cu四种金属以及稀盐酸和稀硫酸溶液,分别探究四种金属与酸反应的情况,完成实验报告,小组组长代表发言。
时间:5分钟【教师】:同学们很棒!!!根据大家的实验现象,能否判断以上金属的金属性强弱?【教师】:完全正确!【师生归纳小结】:利用金属与酸反应判断金属性强弱的依据:1、能否与酸反应;2、与酸反应的剧烈程度,反应越剧烈金属性越强,反之则越弱。
金属与酸反应的通式:金属+ 酸= 盐(金属化合物)+ H2 ↑【老师】:讲授新知:金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au金属活动性,由强逐渐减弱【教师】:根据金属活动顺序表,同学们能总结出金属铜不能与酸反应的原因吗?【教师】:同学们分析的很到位!我们把位于氢前面的金属称之为活泼金属,排在氢后面的金属称之为不活泼金属。
【教师】:同学们,通过本节课的探究学习,如何判断金属的金属性强弱?小组交流讨论,组长代表发言。
时间:2分钟。
【教师】:回答的很棒!!【同学们】:快速阅读课文,积极举手回答。
【学生1】:老师,我们可以将金属与酸反应。
【学生2】:老师,可以借鉴金属与氧气的反应。
可以根据:1、金属是否可以与酸反应;2、金属与酸反应的剧烈程度来判断,反应越剧烈说明其金属性越强,反之则越弱。
【学生们】:认真听实验要求,并浏览实验报告相关内容。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属的化学性质
锌、铁等金属能够跟酸溶液发生置换反应,放出氢气。
是不是所有金属都能跟酸溶液发生置换反应呢?
[实验]取三支试管,分别加入等体积的稀盐酸,然后将镁、铜、银三种金属,分别放入三支盛有盐酸的试管里,观察发生的现象。
如果有气体放出,检验生成的气体是不是氢气。
实验证明,铜和银跟盐酸不发生反应,镁能跟盐酸发生反应放出氢气,生成易溶于水的氯化镁。
Mg+2HCl=MgCl2+H2↑
可见并不是所有金属都能跟酸发生置换反应。
镁、锌、铁等金属都能跟酸发生置换反应放出氢气,但是它们反应的激烈程度是否一样呢?我们来观察下面的实验。
[实验]在三支试管里分别加入同体积、同溶质质量分数的稀盐酸,然后向三支试管里同时加入镁、锌、铁三种金属,观察发生的现象,比较它们跟稀盐酸反应的激烈程度。
实验证明,在相同条件下(相同溶质质量分数的盐酸),镁跟酸反应最激烈,锌次之,铁更次之。
由此看出,金属能否跟酸发生置换反应放出氢气,以及跟酸反应时激烈程度如何,是由金属的化学活动性决定的。
按活动性强弱给金属排队
人们经过大量的实验,总结出常见的金属活动性顺序如下:
表中的(H)是指酸中的氢元素。
在金属活动性顺序中,排在氢前面的金属都能置换酸中的氢,而排在氢后面的金属则不能置换酸中的氢。
金属的位置越靠前,它的活动性就越强,就越容易跟酸溶液发生置换反应。
【练一练】下列金属哪些能跟稀硫酸发生置换反应?写出有关的化学方程式。
镁、铁、铜、汞、铝、银。
