4-Azido-L-phenylalanine_LCMS_26263_MedChemExpress
艾塞那肽注射液说明书

核准日期: 年 月 日艾塞那肽注射液说明书请仔细阅读说明书并在医师指导下使用对艾塞那肽及其它成份过敏者禁用【药物名称】通用名称:艾塞那肽注射液英文名称:Exenatide Injection汉语拼音:Aisainatai Zhusheye【成份】本品主要成份为艾塞那肽。
化学结构式:分子式:C 184H 282N 50O 60S分子量:4186.6辅料:甘露醇、醋酸钠三水合物、间甲酚(2.00-2.4mg/ml )、冰醋酸、注射用水。
【性状】本品为无色澄明液体【适应症】本品用于改善2型糖尿病患者的血糖控制,适用于单用二甲双胍、磺酰脲类,以及二甲双胍合用磺酰脲类,血糖仍控制不佳的患者。
【规格】(1)5μg剂量刻度注射笔:0.25 mg/ml,1.2 ml/支,单次注射药量5μg,内含60次注射的药量。
(2)10μg剂量刻度注射笔:0.25 mg/ml,2.4 ml/支,单次注射药量10μg,内含60次注射的药量。
【用法用量】本品的起始剂量为每次5微克(μg),每日2次,在早餐和晚餐前60分钟内(或每天的2顿主餐前;给药间隔大约6小时或更长)皮下注射。
不应在餐后注射本品。
根据临床应答,在治疗1个月后剂量可增加至10微克。
每日2次。
每次给药应在大腿、腹部或上臂皮下注射给药。
本品推荐用于接受二甲双胍、一种磺酰脲类、二甲双胍合用一种磺酰脲类治疗,血糖仍控制不佳的2型糖尿病患者。
在二甲双胍治疗的基础上加用本品时,可继续使用二甲双胍的目前剂量,因为合用本品发生低血糖而需要进行调整二甲双胍剂量的可能性较低。
在磺酰脲类治疗基础上加用本品,应该考虑降低磺酰脲类的剂量,以降低低血糖发生的风险。
(参照【注意事项】,低血糖)本品为无色澄明液体,当溶液有颗粒、浑浊或变色时不得使用。
过有效期后不得使用。
尚无本品静脉或肌肉注射的安全性和有效性资料。
注射笔使用指南注射笔的详细操作图示和注射指导请参见本品包装盒中所附“注射笔使用手册”。
钛酸异丙酯产品安全技术说明书(阿拉丁)

GHS02:易燃物; GHS06:急毒性物质钛酸异丙酯Titanium(IV) isopropoxide99.99%CAS No. 546-68-9EC-编号208-909-64急救措施4.1必要的急救措施描述一般的建议请教医生。
向到现场的医生出示此安全技术说明书。
如果吸入如果吸入,请将患者移到新鲜空气处。
如呼吸停止,进行人工呼吸。
请教医生。
在皮肤接触的情况下用肥皂和大量的水冲洗。
请教医生。
在眼睛接触的情况下用大量水彻底冲洗至少15分钟并请教医生。
如果误服禁止催吐。
切勿给失去知觉者喂食任何东西。
用水漱口。
请教医生。
4.2最重要的症状和影响,急性的和滞后的无数据资料4.3及时的医疗处理和所需的特殊处理的说明和指示无数据资料5消防措施5.1灭火介质火灾特征无数据资料灭火方法及灭火剂干粉 干砂不要用水喷射。
5.2源于此物质或混合物的特别的危害无数据资料5.3救火人员的预防如有必要,佩戴自给式呼吸器进行消防作业。
5.4进一步的信息喷水冷却未打开的容器。
6泄露应急处理6.1人员的预防,防护设备和紧急处理程序使用个人防护装备。
避免吸入蒸气、气雾或气体。
保证充分的通风。
消除所有火源。
注意蒸气积累达到可爆炸的浓度,蒸气可蓄积在地面低洼处。
6.2环境预防措施如能确保安全,可采取措施防止进一步的泄漏或溢出。
不要让产品进入下水道。
6.3抑制和清除溢出物的方法和材料围堵溢出物,用非可燃性材料(如砂子、泥土、硅藻土、蛭石)吸收溢出物,将其收集到容器中,根据当地的或国家的规定处理6.4参考其他部分丢弃处理请参阅第13节。
7安全操作与储存7.1安全操作的注意事项避免接触皮肤和眼睛。
避免吸入蒸气或雾滴。
火舌回闪有可能穿过相当长的距离。
容器遇火可能会爆炸切勿靠近火源。
-严禁烟火。
采取措施防止静电积聚。
7.2安全储存的条件,包括任何不兼容性在氩气下操作,避免潮湿。
储存于氩气中 使容器保持密闭,储存在干燥通风处。
国际化妆品原料标准中文名称、INCI名、CAS号查询表(2010年版)

序号
1681 5894 10462 12033 1493 1494 1682 1679 1685 8598 10441 5892 5893 5896 5897 5895 8599 6505 6506 8241 8602 6523 66 71 660 14686 8209 8210 1683 3847 8600 3852 3851 3854 3855 3856 3857 3848 4272 8206 14846 4080 3860 3858 3859
中文名称
1,2-丁二醇 1,2-己二醇 1,2-戊二醇 1,3-丙二醇 1,3-双-(2,4-二氨基苯氧基)丙烷 1,3-双-(2,4-二氨基苯氧基)丙烷 HCl 1,4-丁二醇 1,4-丁二醇/琥珀酸/己二酸/HDI 共聚物 1,4-丁二醇二(甲基丙烯酸)酯 1,5-萘二酚 1,5-戊二醇 1,6-己二胺 1,6-己二醇 1,6-己二醇二水杨酸酯 1,6-己二醇二硬脂酸酯 1,6-己二醇蜂蜡酸酯 1,7-萘二酚 10-羟基癸酸 10-羟基癸烯酸 1-甲基乙内酰脲-2-酰亚胺 1-萘酚 1-羟乙基-4,5-二氨基吡唑硫酸盐 1-乙酰萘 1-乙酰氧基-2-甲基萘 2-(2-氨基乙氧基)乙醇 2,2'-硫代双(4-氯苯酚) 2,2'-亚甲基双 4-氨基苯酚 2,2'-亚甲基双-4-氨基苯酚 HCl 2,3-丁二醇
国际化妆品原料标准中文名称目录(2010年版)
序号 INCI名称 中文名称
酸 (C10-18 脂酸甘油三酯类聚甘油-3酯类) 磷酸酯类 (动物)肝水解产物 (动物)睾丸水解产物 (动物)脊髓索带提取物 (动物)脊髓索带脂质 (动物)脊髓脂质提取物 (动物)脐带提取物 (动物)气管水解产物 (动物)乳房提取物 (动物)神经提取物 (动物)胎盘蛋白 (动物)胎盘酶 (动物)胎盘脂质 (动物)心脏水解产物 (动物)心脏提取物 (动物)胸腺水解产物 (动物)胸腺提取物 (镁/钾/硅)(氟化物/氢氧化物/氧化 物) (牛)肝提取物 (牛)睾丸提取物 (牛)骨髓类脂质 (牛)骨髓提取物 (牛)肌肉提取物 (牛)卵巢提取物 (牛)脾提取物 (牛)网膜类脂质 (牛/猪)脑提取物 (日用)香精 (三油酰氧甲基)甲氨基乙醇硫酸酯 (神经)鞘磷脂 (神经)鞘脂类 (四丁氧基)丙基三硅氧烷 (天冬氨酸/谷氨酸)金 (辛/癸)酸异辛酯 (椰油/葵花籽油)酰胺丙基甜菜碱 (月桂/肉豆蔻)基二醇羟丙基醚 1-(3,4-二甲氧基苯基)-4,4-二甲基1,3-戊二酮 1,10-癸二醇 1,2,4-苯三酚三乙酸酯 1,2,4-三羟基苯 1,2,6-己三醇 1
多奈哌齐——精选推荐
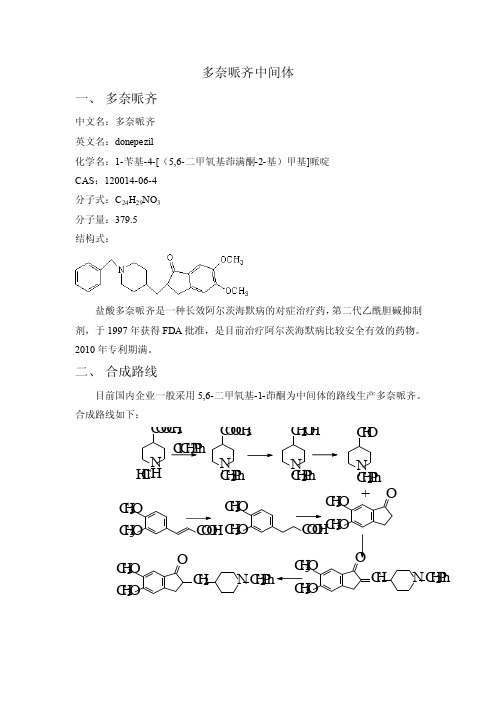
多奈哌齐中间体一、 多奈哌齐中文名:多奈哌齐英文名:donepezil化学名:1-苄基-4-[(5,6-二甲氧基茚满酮-2-基)甲基]哌啶CAS :120014-06-4分子式:C 24H 29NO 3分子量:379.5结构式:盐酸多奈哌齐是一种长效阿尔茨海默病的对症治疗药,第二代乙酰胆碱抑制剂,于1997年获得FDA 批准,是目前治疗阿尔茨海默病比较安全有效的药物。
2010年专利期满。
二、 合成路线目前国内企业一般采用5,6-二甲氧基-1-茚酮为中间体的路线生产多奈哌齐。
合成路线如下: N C O O C H 3H H C l C l C H 2P h N C O O C H 3C H 2P h N C H 2O H C H 2P h N C H 2P h C H O C H 3O C H 3O C O O H C H 3O C H 3O O C H 3O C H 3O C O O H +C H 3O C H 3O O C H NC H 2P h C H 3O C H 3O O C H 2NC H 2P h三、 市场情况2008年国内22个城市样本医院神经类药品销售额已达到35.15亿元,在这类药物中,抗老年痴呆症药物只有5只,分别为多奈哌齐、石杉碱甲、美金刚、卡巴拉汀和加兰他敏。
多奈哌齐为第二代乙酰胆碱酶抑制剂,于1997年经美国FDA 批准用于轻中度阿尔茨海默型痴呆症状的治疗。
多奈哌齐是FDA 批准用于治疗阿尔茨海默病的第2只处方药,具有治疗剂量小、副作用低、耐受性好等特点,在全球50多个国家地区上市,是目前全球抗老年痴呆症药物市场的领军品种。
2007年时全球市场销售额达到33.11亿美元,同比2006年增长了31.44%,2008年多奈哌齐销售额创下35.54亿美元新高,2009年多奈哌齐在美国销售额为13.5亿美元,在美国畅销药排名中排在第22位。
目前国内已有原料药生产国家批准文号的企业有五家,另外有多家公司能够供应多奈哌齐化合物。
阿司咪唑

合成方法
合成方法
化合物(I)和碘甲烷在乙醇中回流8h,环合得到化合物(Ⅱ)。再水解脱去酯基,得到化合物(Ⅲ)。用对甲氧 基苯乙基溴进行N-烷基化,得化合物(Ⅳ)。再用对氟苄基溴烷基化,得阿司咪唑。
1. 1-[(4-氟苯基)甲基]-苯并咪唑-2-(3H)-酮的制备
在反应瓶中加入2-羟基苯并咪唑5.0g(37.3mmol)和NaH 1.6g(53mmol)(NaH含量大约为80%,浸入矿物油中) 的DMF 100ml的悬浮液.加毕.在60ºC.(最好有N2保护)搅拌反应1h.再加入4-氟苄基氯(FBC)5.4g(37mmol),加热 ( 6 0 ºC ) 搅 拌 反 应 5 . 5 h . 冷 却 至 室 温 后 加 入 冰 水 7 0 0 m l , 用 二 氯 甲 烷 ( 5 0 0 m l × 2 ) 提 取 . 有 机 层 用 食 盐 水 洗 . 无 水 N a 2 S O 4 干燥.过滤.滤液减压浓缩.剩余物用石油醚析晶.得1-[(4-氟苯基)甲基]-苯并咪唑-2-(3H)-酮固体8.0g,为无色 结 晶 m p 1 7 8 ~ 1 7 9 ºC , 收 率 8 8 % .
治疗措施
阿司咪唑中毒的治疗要点为: 1.大量摄入者予洗胃,后灌服活性炭和导泻。 2.对心肌抑制和Q-T间期延长者予5%碳酸氢钠250ml静注可能有效。 3.对症、支持治疗。
专家点评
专家点评
阿司咪阿司咪唑自1983年上市以来,在许多国家得到了广泛应用。国外研究显示阿司咪唑治疗荨麻疹的总有 效率为74%。国内的一项多中心双盲安慰剂对照试验表明阿司咪唑对急性荨麻疹的总有效率为82.9%,对慢性荨麻 疹的总有效率为86.0%,均显著高于安慰剂,主要不良反应为嗜睡、倦怠、口干等,连续用药3个月的患者中,半 数有食欲及体重增加。阿司咪唑的心脏毒性虽然发生率较低,但由于后果严重,已限制了它的应用。阿司咪唑为 强效和长效的H1受体拮抗剂,无中枢镇静和抗毒蕈碱样作用。代谢产物去甲阿司咪唑仍有抗胆胺作用。长期服用 可增进食欲和增加体重,服用过量可引起心脏Q-T间期延长和室性心律失常。适用于各种原因引起过敏性疾病。
安捷伦产品目录

15
Real-Time PCR
16
Mx3000P QPCR System
17
Brilliant III Ultra-Fast SYBR Green QPCR and QRT-PCR Reagents
18
Brilliant III Ultra-Fast QPCR and QRT-PCR Reagents
Agilent / STRATAGENE
Agilent website: /genomics
Welgene | Agilent Stratagene
威健股份有限公司 | Stratagene 總代理
Table of Content
Table of Contents
/ XL1-Red Competent Cells SoloPack Gold Supercompetent Cells
/ TK Competent Cells Specialty Cells
/ Classic Cells / Fine Chemicals For Competent Cells
適用於 UNG 去汙染或 bisulphite
sequencing
適用於 TA Cloning
最高敏感性
取代傳統 Taq 的好選擇
-
2
威健股份有限公司 | Stratagene 總代理
PCR Enzyme & Instrument
Agilent SureCycler 8800
市場上領先的 cycling 速度和 sample 體積 10 ~ 100 μL 簡易快速可以選擇 96 well 和 384 well 操作盤 優秀的溫控設備讓各個 well 都能保持溫度的穩定 七吋的高解析度觸控螢幕讓操作上更為簡便 可以透過網路遠端操控儀器及監控儀器 Agilent 專業的技術支援可以幫助您應對各種 PCR 的問題
抗抑郁药---盐酸维拉佐酮

2014.10.20
前言 • MDD治疗的主要药物种类
• 第一代经典抗抑郁药:主要包括单胺氧化酶抑制剂(maoi)和三环类 抗抑郁药(tca)。
• 第二代新型抗抑郁药:以选择性五羟色胺(5-ht)再摄取抑剂为主。 • 盐酸维拉佐酮(vilazodone hydrochloride)是首个吲哚烷基胺类新 型抗抑郁药。
2014.10.20
药物背景 • 安全性
• 盐酸维拉佐酮在8个临床试验共计2 177例MDD患者的临床研究中显 示具有良好的耐受性和安全性。在与安慰剂,对照的Ⅲ临床研究中, 因不良反应导致盐酸维拉佐酮治疗组中止治疗的患者占7.1%,安慰 剂对照组为3.2%,治疗组导致停药的常见不良反应主耍为恶心(1. 3%)和腹泻(1.2%) 。 • 由于抗抑郁药可增加儿童、青少年和l 8~24岁年轻人服药初期自杀想 法和自杀行为的风险,因此以上患者要慎用。 • 维拉唑酮在治疗终止时,尤其突然终止时,会出现戒断症状(烦躁不 安、易怒、眩晕、感觉障碍、意识模糊等症状)。
2014.10.20
报告框架
• 1.药物背景
• 2.专利介绍 • 3.合成路线
Viibryd(盐酸维拉佐酮)
2014.10.20
药物背景
• • • • • • • • • • • • • • • • 通用名称:维拉佐酮(Vilazodone) 商品名:Viibryd 原研公司:德国Merck KGaA 基本专利: DE19934333254 优先权:1993 年9 月30 日 相关中国专利: CN94116585 类别:抑郁症治疗药 化合物类型:新分子实体 5-[4-[4-( 5-cyano-1H-indol-3-yl) butyl]-1(New molecular entity) piperazinyl]-2-benzofurancarboxamide 分子式:C26H27N5O2 ·HCl hydrochloride 相对分子质量:477.99 CAS 号:163521-08-2 适应症:重度抑郁症(MDD) 化学名: 5-[4-[4-( 5-氰基-1H-吲哚-3-基) 丁基]-1-哌嗪基]-2-苯并呋喃草酰胺盐酸 盐; 获批单位:Trovis 制药有限责任公司 批准日期:2011 年1 月21 日
四正柏生物科技基因定点突变试剂盒说明书

基因定点突变试剂盒保存条件及效期:−20℃保存,有效期一年。
产品描述:定点突变是一种广泛应用的分析蛋白和DNA 的非常有力的工具。
普通的定点突变试剂盒通常是基于反向PCR 技术,采用高保真耐热DNA 聚合酶和互补的突变引物向目的基因引入单个碱基或多个邻近碱基的突变、缺失、或插入。
当遇到多个位点突变的需求时,利用单点突变试剂盒只能对目标位点逐一引入突变,耗时费力。
Mut Multi Site-directed Mutagenesis(MSDM)Kit 针对每一个目标突变只采用一条突变引物,利用Mut MSDMEnzyme 的耐热DNA 聚合酶活性合成与模板互补的带有引物突变的DNA 链,然后通过其耐热的连接酶活性修复突变DNA 链之间的切刻(nicks),使其连接成为一条与模板互补的突变单链DNA 。
经过多个PCR 循环反应后,带有多个特定突变的DNA 链成倍增长。
PCR 反应结束后,采用DpnI 限制性内切酶消化含有甲基化的双链质粒模板,而带有突变的环形单链质粒则通过转化而在大肠杆菌体内复制,最终得到带有不同突变组合的质粒DNA 。
本试剂盒适用于≤6kb 质粒的多点突变,根据质粒性质不同,最多可引入5个位点的突变、插入或删除(通常以1~3个位点突变为主)。
该方法操作简单快捷,突变阳性率高。
产品组分:产品编号规格MSM5303-1010rxnMut MSDM Enzyme12μl 10x MutMSDM Buffer 100μl MutdNTPs25μl Dpn I (10U/ l)12μl ddH 2O1ml版本号:2016-02-19产品说明书图1.Mut 多点基因定点突变试剂盒原理和操作流程示意图使用方法:1.模板准备:(1)请使用6kb以下的质粒作为模板;如果模板质粒过大,可将所需突变的序列亚克隆到较小的载体中,完成突变后再克隆到目的载体中。
(2)对于非甲基化的质粒(例如从大肠杆菌JM110或SCS110菌株中提取的质粒),可通过转化dam+的大肠杆菌菌株(如DH5α、TOP10、JM109、XL1-Blue等),再抽提获得甲基化的质粒作为PCR反应模板。
沙奎那韦

谢谢观看
联合治疗可以使AIDS合并症或垂危状态的危险性减少53%,死亡率减少72%。这与治疗18个月后AIDS合并症或 死亡率由29.4%降至16.0%是相符的;同样,单纯死亡率由8.6%降至4.1%。在3个治疗组中,平均疗程为11~13个 月,平均随访时间是17个月。
该研究中,所有治疗组CD4细胞基线计数平均为156~176/立方毫米。16周后(DAVG16),沙奎那韦联合ddc 治疗组CD4细胞增加26/立方毫米,血浆病毒载量减少0.6log10RNA拷贝/毫升。16周时,CD4细胞平均值增加47/ 立方毫米。12周时,血浆病毒载量平均值降低0.7log10RNA拷贝/毫升。
与核苷类似物(齐多夫定等)不同,沙奎那韦直接作用于病毒靶酶,不需经代谢激活,对静止细胞也有潜在 作用。在10-10摩尔/升浓度下,沙奎那韦对淋巴母细胞株和单核细胞株以及被实验室病毒株或临床分离的HIV-1 感染的淋巴细胞和单核细胞的起始培养有作用。
实验室细胞培养结果显示,沙奎那韦在与其他逆转录酶抑制剂(包括AZT(齐多夫定)、ddc(扎西他滨)、 ddI(去羟肌苷)进行两联或三联治疗HIV-1感染时,有附加的协同抗病毒作用,但毒性并不增加 。
机体对静注沙奎那韦6、36、72毫克后清除率很高,为1.14升/小时/千克(CV12%),略高于肝血流,并为常 数。体内存留时间平均为7小时。
适应症
沙奎那韦可与其他抗逆转录病毒药物联合使用治疗成人HIV-1感染 。
用法与用量
1
标准剂量
2
剂量调整
3
不良反应
4
禁忌
5
药物相互作用
成人及16岁以上儿童:推荐方案是与核苷类似物联合用药,餐后2小时内服用沙奎那韦600毫克,每天3次。 联合使用的抗逆转录病毒药物的剂量参考处方手册。与其他蛋白酶抑制剂合用时,沙奎那韦应减量(见【药物相 互作用】)。与其他蛋白酶抑制剂一样,强烈推荐按医嘱服药。
盐酸依匹斯汀滴眼液(来源于FDA)英文

Page 3ELESTAT™(epinastine HCl ophthalmic solution) 0.05%SterileDESCRIPTIONELESTAT™(epinastine HCl ophthalmic solution) 0.05% is a clear, colorless, sterile isotonicsolution containing epinastine HCl, an antihistamine and an inhibitor of histamine release fromthe mast cell for topical administration to the eyes.Epinastine HCl is represented by the following structural formula:C16H15N3 •HCl Mol. Wt. 285.78Chemical Name: 3-Amino-9, 13b-dihydro-1H-dibenz[c,f]imidazo[1,5-a]azepine hydrochlorideEach mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine0.044% (0.44mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetatedisodium; purified water; sodium chloride; sodium phosphate, monobasic; and sodiumhydroxide and/or hydrochloric acid (to adjust the pH). ELESTAT™has a pH of approximately7 and an osmolality range of 250 to 310 mOsm/kg.CLINICAL PHARMACOLOGYEpinastine is a topically active, direct H1-receptor antagonist and an inhibitor of the release ofhistamine from the mast cell. Epinastine is selective for the histamineH1-receptor and hasaffinity for the histamine H2 receptor. Epinastine also possesses affinity for the α1-, α2-, and 5-HT2 –receptors. Epinastine does not penetrate the blood/brain barrier and, therefore, is notexpected to induce side effects of the central nervous system.Fourteen subjects, with allergic conjunctivitis, received one drop of ELESTAT ™in each eyetwice daily for seven days. On day seven average maximum epinastine plasma concentrations of0.04 ±0.014 ng/ml were reached after about two hours indicating low systemic exposure. Whilethese concentrations represented an increase over those seen following a single dose, the day 1NDA 21-565Page 4and day 7 Area Under the Curve (AUC) values were unchanged indicating that there is noincrease in systemic absorption with multiple dosing. Epinastine is 64% bound to plasmaproteins. The total systemic clearance is approximately 56 L/hr and the terminal plasmaelimination half-life is about 12 hours. Epinastine is mainly excreted unchanged. About 55% ofan intravenous dose is recovered unchanged in the urine with about 30% in feces. Less than10% is metabolized. The renal elimination is mainly via active tubular secretion.Clinical studies: Epinastine HCl 0.05% has been shown to be significantly superior to vehiclefor improving ocular itching in patients with allergic conjunctivitis in clinical studies using twodifferent models: (1) conjunctival antigen challenge (CAC) where patients were dosed and thenreceived antigen instilled into the inferior conjunctival fornix; and (2) environmental fieldstudies where patients were dosed and evaluated during allergy season in their natural habitat.Results demonstrated a rapid onset of action for epinastine HCl 0.05% within 3 to 5 minutesafter conjunctival antigen challenge. Duration of effect was shown to be 8 hours, making a twicedaily regimen suitable. This dosing regimen was shown to be safe and effective for up to 8weeks, without evidence of tachyphylaxis.INDICATIONS AND USAGEELESTAT™ophthalmic solution is indicated for the prevention of itching associatedwith allergic conjunctivitis.CONTRAINDICATIONSELESTAT™ophthalmic solution is contraindicated in those patients who have shownhypersensitivity to epinastine or to any of the other ingredients.WARNINGSELESTAT™is for topical ophthalmic use only and not for injection or oral use. PRECAUTIONSInformation for Patients: Patients should be advised not to wear a contact lens if their eye isred. ELESTAT™should not be used to treat contact lens related irritation. The preservative inELESTAT™, benzalkonium chloride, may be absorbed by soft contact lenses. Contact lensesshould be removed prior to instillation of ELESTAT™and may be reinserted after 10 minutesfollowing its administration.Patients should be instructed to avoid allowing the tip of the dispensing container to contactthe eye, surrounding structures, fingers, or any other surface in order to avoid contaminationof the solution by common bacteria known to cause ocular infections. Serious damage to theeye and subsequent loss of vision may result from using contaminated solutions.Bottle should be kept tightly closed when not in use.NDA 21-565Page 5Carcinogenesis, Mutagenesis, Impairment of Fertility:In 18-month or 2-year dietary carcinogenicity studies in mice or rats, respectively,epinastine was not carcinogenic at doses up to 40 mg/kg [approximately30,000times higher than the maximum recommended ocular human dose of 0.0014 mg/kg/day (MROHD) on a mg/kg basis, assuming 100% absorption in humans andanimals].Epinastine in newly synthesized batches was negative for mutagenicity in the Ames/Salmonella assay and in vitro chromosome aberration assay using humanlymphocytes. Positive results were seen with early batches of epinastine in two in vitrochromosomal aberration studies conducted in 1980s with human peripheral lymphocytesand with V79 cells, respectively. Epinastine was negative in the in vivo clastogenicitystudies, including the mouse micronucleus assay and chromosome aberration assay inChinese hamsters. Epinastine was also negative in the cell transformation assay usingSyrian hamster embryo cells, V79/HGPRT mammalian cell point mutation assay, and invivo/in vitro unscheduled DNA synthesis assay using rat primary hepatocytes. Epinastine had no effect on fertility of male rats. Decreased fertility in female rats wasobserved at an oral dose up to approximately 90,000 times the MROHD. Pregnancy: Teratogenic Effects: Pregnancy Category CIn an embryofetal developmental study in pregnant rats, maternal toxicity with noembryofetal effects was observed at an oral dose that was approximately150,000 timesthe MROHD. Total resorptions and abortion were observed in an embryofetal study inpregnant rabbits at an oral dose that was approximately 55,000 times the MROHD. Inboth studies, no drug-induced teratogenic effects were noted.Epinastine reduced pup body weight gain following an oral dose to pregnant rats that wasapproximately 90,000 times the MROHD.There are, however, no adequate and well-controlled studies in pregnant women.Because animal reproduction studies are not always predictive of human response,ELESTAT™ophthalmic solution should be used during pregnancy only if the potentialbenefit justifies the potential risk to the fetus.Nursing Mothers: A study in lactating rats revealed excretion of epinastine in the breastmilk. It is not known whether this drug is excreted in human milk. Because many drugsare excreted in human milk, caution should be exercised when ELESTAT™ophthalmicsolution is administered to a nursing woman.Pediatric Use: Safety and effectiveness in pediatric patients below the age of 3 yearshave not been established.NDA 21-565Page 6Geriatric Use: No overall differences in safety or effectiveness have been observedbetween elderly and younger patients.ADVERSE REACTIONSThe most frequently reported ocular adverse events occurring in approximately 1 –10% ofpatients were burning sensation in the eye, folliculosis, hyperemia, and pruritus.The most frequently reported non-ocular adverse events were infection (cold symptoms andupper respiratory infections) seen in approximately 10% of patients, and headache, rhinitis,sinusitis, increased cough, and pharyngitis seen in approximately 1 - 3% of patients.Some of these events were similar to the underlying disease being studied. DOSAGE AND ADMINISTRATIONThe recommended dosage is one drop in each eye twice a day.Treatment should be continued throughout the period of exposure (i.e., until the pollenseason is over or until exposure to the offending allergen is terminated), even whensymptoms are absent.HOW SUPPLIEDELESTAT™(epinastine HCl ophthalmic solution) 0.05% is supplied sterile in opaque whiteLDPE plastic bottles with dropper tips and white high impact polystyrene (HIPS) caps asfollows:5 mL in 8 mL bottle NDC XXXX-XXXX-XX10 mL in 15 mL bottle NDC XXXX-XXXX-XXStorage: Store at 15-25ºC (59-77ºF). Keep bottle tightly closed and out of the reach ofchildren.Rx OnlyOctober 2003© 2002 Allergan, Inc.Irvine, CA 92612, U.S.A. 9343X®™Marks owned by Allergan, Inc. Part No., Copy Code。
阿考替胺的药物介绍及合成路线分析

阿考替胺的药物介绍及合成路线分析阿考替胺(acotiamide),化学名为n-{2-[双(1-甲基乙基)氨基]乙基}-2-[(2-羟基-4,5-二甲氧基苯甲酰基)氨基]噻唑-4-甲酰胺盐酸盐三水合物,由日本安斯泰莱制药公司和泽里新药株式会社联合开发,于2021年2月在日本被批准用于治疗功能性消化不良,目前尚未在国内上市,国内有十几家公司在申报3.1类新药,目前处于在审评阶段。
一、品种基本情况1.药品名称通用名:阿考替胺化学名称:n-{2-[双(1-甲基乙基)氨基]乙基}-2-[(2-羟基-4,5-二甲氧基苯甲酰基)氨基]噻唑-4-甲酰胺盐酸盐三水合物分子式:c21h30n4o5s?hcl?3h2o分子量:541.06结构式为:2.注册分类、适应症及发展状况注册分类:化学药物3+3剂型及规格:片剂,100mg适应症:机能性消化不良,饭后腹胀,上腹部胀等消化器官症状。
用量:成人使用,一天三次,饭前口服一片100mg。
发展状况:2022年2月在日本上市,欧洲和美国北部处于临床第二阶段。
中国有十几家公司:南京新诺泰制药、瑞阳制药、天津汉康制药生物、山东创新医药和北京1海步国际药业、济南益新药业、烟台东城药业、北京深蓝海生物医药、山东洛新药业、合肥拓瑞生物科技、南京海纳药业、河北国龙药业、南京艾德凯腾生物医药、山东诚创药业、,四川迪康科技制药有限公司和江苏昊森制药有限公司正在申请3.1类新药,目前处于审查阶段。
3.品种概述阿考替胺是毒蕈碱m1和m2受体及腺苷a1受体拮抗剂、乙酰胆碱酯酶抑制剂,用于治疗功能性消化不良。
阿考替胺可为质子泵抑制剂提供有用的替代,与广泛使用的促动力药不同的是,该药对5-ht和多巴胺d2受体亲和力较低并减轻诱发心血管不良副作用的可能性。
阿替拉明是根据罗马III诊断标准进行的临床试验,已证明其对FD患者有效。
主要用于改善胃动力紊乱和胃排空延迟,从而改善FD的症状,包括餐后饱胀、上腹胀、早饱等。
不同浓度的葛根多糖对小鼠肠道菌群的影响

不同浓度的葛根多糖对小鼠肠道菌群的影响陈融,刘博,陈凯,杨锐乐,王米*(中国农业科学院上海兽医研究所,农业农村部兽用化学药物及制剂学重点实验室,上海 200241)摘 要:为探究不同浓度的葛根多糖对小鼠肠道菌群的影响,本试验选取30只体重为(17.00±1.00)g的雄性昆明小鼠,按照体重被随机分为3组,每组10只,包括对照组(生理盐水)、低浓度组(12.5 mg/kg体重)、高浓度(100 mg/kg体重)组,葛根多糖连续灌服14 d后,颈椎脱臼法处死小鼠,称取胸腺、心脏、肝脏、脾脏、肺脏、肾脏和睾丸重量;收集盲肠内容物,通过GC-MS法测定肠道内短链脂肪酸浓度,并结合Illumina Miseq高通量测序技术对肠道菌群的多样性进行分析。
结果显示:2种浓度葛根多糖对于小鼠脏器指数无显著影响;与对照组相比,低浓度葛根多糖能显著降低盲肠内异丁酸和异戊酸含量,而高浓度葛根多糖仅显著降低异戊酸含量;低浓度葛根多糖能够显著提高粪球菌属(Coprococcus)、厌氧棍状菌属(Anaerotruncus)、颤螺旋菌属(Oscillospira)的相对丰度,显著降低棒状杆菌属(Corynebacterium)、葡萄球菌属(Staphylococcus)、丁酸弧菌属(Anaerostipes)、产碱菌属(Alcaligenes)的相对丰度;高浓度葛根多糖能够显著提高粪球菌属的相对丰度,使产碱杆菌属的相对丰度显著降低。
结果表明,低浓度葛根多糖能显著提高肠道菌群多样性,并改善肠道菌群结构,对机体产生有益影响。
关键词:多糖;脏器指数;短链脂肪酸;肠道菌群中图分类号:S816.7 文献标识码:A DOI编号:10.19556/j.0258-7033.20200629-01肠道菌群是肠道微环境的重要组成部分,数量与人体细胞比例接近1:1,对于宿主维持肠道免疫稳态,增强免疫应答具有重要意义[1-2]。
研究表明,与宿主基因相比,日粮对于肠道菌群组成的影响更大,通过饮食干预能够影响到菌群结构,具有疾病预防和治疗的作用[3-6],这为功能性食品及添加剂等产品的研究开发提供了更多思路。
