广东省汕头市2018届高三化学第一次模拟考试 理综化学
【配套K12】广东省汕头市2018届高三化学摸底考试试题

广东省汕头市2018届高三化学摸底考试试题第I卷(选择题共126分)一、选择题(本大题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项符合题目要求)7. 化学与生活、社会密切相关,下列有关说法中正确的是A. “低碳生活”是指生活中尽量使用含碳量较低的物质B. 燃煤中加入CaO后可减少酸雨的发生及温室气体的排放C. 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一D. 鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排8. 常温下,下列各组离子在指定溶液中一定能大量共存的是A. 滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42-B. 能使红色石蕊试纸变蓝色的溶液中: K+、CO32-、NO3-、AlO2-C. 由水电离产生的(H+) = 10-13mol/L的溶液中:Na+、Cl-、NO3-、CH3COO-D. pH = l 的溶液中: Na+、Fe2+、NO3-、Cl-9. 某同学设计如右图装置,探究氯碱工业原理,下列说法正确的是A. 石墨电极与直流电源负极相连B. 铜电极的反应式为:2H++ 2e-= H2↑C. 氢氧化钠在石墨电极附近产生, Na+向石墨电极迁移D. 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色10.设N A为阿伏加德罗常数的值。
下列说法正确的是(O-16 Fe-56)A.常温下,0.5 mol·L-1 Fe2(SO4)3溶液中含Fe3+数目为N AB.标准状况下,22.4L苯中含C—H数目为6N AC.常温常压下,16 g O2和O3混合气体中,含氧原子的总数为N AD.5.6g Fe与足量稀盐酸反应,转移电子数为0.3N A11. X、Y、Z、W均为短周期元素,在周期表中位置如图。
Y原子的最外层电子数是电子层数的3倍。
下列说法中不正确...的是A. Y和Z的气态氢化物,前者更稳定B. Z和W的最高价氧化物对应水化物的酸性:W<ZC. X、W的气态氢化物相互反应,生成物中既含离子键又含共价键D. Y、W的单质,均可通过电解的方法获得12. 在2L密闭容器中进行反应C(s)+H22(g) △H>0,测得c(H2O)随反应时间(t)的变化如图。
最新-广东省汕头市2018届高三化学毕业班教学质量检测

绝密★启用前试卷类型:A汕头市2018~2018学年度普通高中毕业班教学质量监测试题化学本试卷共12页,36小题,满分300分。
考试用时150分钟。
注意事项:1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号、试室号、座位号填写在答题卡上,并用2B铅笔在答题卡上的相应位置填涂考生号。
用2B铅笔将试卷类型(A)填涂在答题卡相应位置上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁。
考试结束后,将试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Na-23 Fe-56 Ba-137 一、单项选择题:本题包括16小题,每小题4分,共64分。
每小题给出的四个选项中,只有一个选项符合题目要求。
选对的得4分,选错或不答的得0分。
6.下列关于果醋制作的叙述中,错误..的是A.制作过程中需要通入氧气B.温度一般要控制在50℃左右C.醋酸菌能将果酒变成果醋D.当氧气、糖充足时,醋酸菌可将果汁中的糖分解成醋酸7.下列各组离子在碱性条件下能大量共存,而在强酸性条件下能发生氧化还原反应的是A.Mg2+、Na+、SO-24、Cl-B.K+、CO-23、Cl-、NO-3C.Na+、K+、NO-3、SO-23D.NH+4、Na+、SO-24、NO-38.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是A.X、Y元素的金属性 X<YB.一定条件下,W单质可以将Z单质从其氢化物中置换出来C.常温常压下,Z单质与W的常见单质可以直接反应D.Y的最高价氧化物对应的水化物能溶于稀氨水9.设N A为阿伏加德罗常数,下列说法中正确的是A.标准状况下,22.4 L水中含分子数为N AB.23g金属Na与1L0.1mol/L的盐酸溶液反应,生成0.1N A个H2C.标准状况下,2.24L18O2中所含中子的数目为N AD.14g分子式为C n H2n的(n≥2)链烃中含有的C=C的数目一定为N A/n10.央视焦点访谈节目在2018年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。
广东省汕头市2018届高三模拟考试化学试题及答案

1汕头市2017~2018学年度普通高中毕业班教学质量监测试题理 科 综 合可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 K-39 Cr-52 Fe-567. 对中国古代著作涉及化学的叙述,下列解说错误..的是 A.《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐B. 清代《本草纲目拾遗》中对“强水”条目记叙如下:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛”。
“强水” 指的是硝酸C. 《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2D. 《本草经集注》中写到“以火烧之,紫青烟起,乃真硝石也”,“硝石”指的是KNO 3 8. 下列说法中正确的是A. 酒精能使蛋白质变性,常用95%乙醇杀菌消毒B. 高铁酸盐可用于净水是因为它具有极强的水解能力可生成吸附性的胶体粒子C. 糖类、油脂和蛋白质在一定条件下都可..发生水解反应 D. 煤的气化和煤的液化都可以使煤变为清洁能源,煤的气化和煤的液化都属于物理变化9. 设N A 为阿伏加德罗常数值。
下列有关叙述正确的是A. 高温下,0.2molFe 与足量水蒸气反应生成的H 2时转移的电子数为0.6N AB. 0.1mol 丙烯酸中含有双键的数目为0.1N AC. 25℃时,pH =13的1.0 L Ba(OH)2溶液中含有的OH -数目为0.1N AD. 标况下11.2 L CO 和CO 2混合气体中,所含碳原子数为N A 10. 下列图示实验正确的是11. 工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意如下,下列说法正确的是A. 铁板a 为阳极,电极反应为:Fe -2e -=Fe 2+B. 阴极区附近溶液pH 降低C. 阴极区溶液中发生的氧化还原反应为:Cr 227O -+6Fe 2++14H +=2Cr 3++6Fe 3++7H 2O D. 若不考虑气体的溶解,当溶液中有1 mol Cr 227O -被还原时,铁板b 处将收集到3molH 212. X 、Y 、Z 、R 、W 是原子序数依次增大的五种短周期元素。
广东汕头市2018届高三化学摸底试题带答案

广东汕头市2018届高三化学摸底试题(带答案)汕头金山中学2018届高三摸底考试理科综合第I卷(选择题共126分)一、选择题(本大题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项符合题目要求)7.化学与生活、社会密切相关,下列有关说法中正确的是A.“低碳生活”是指生活中尽量使用含碳量较低的物质B.燃煤中加入CaO后可减少酸雨的发生及温室气体的排放C.纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一D.鼓励汽车、家电“以旧换新”,可减少环境污染,发展循环经济,促进节能减排8.常温下,下列各组离子在指定溶液中一定能大量共存的是A.滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42-B.能使红色石蕊试纸变蓝色的溶液中:K+、CO32-、NO3-、AlO2-C.由水电离产生的(H+)=10-13mol/L的溶液中:Na+、Cl-、NO3-、CH3COO-D.pH=l的溶液中:Na+、Fe2+、NO3-、Cl-9.某同学设计如右图装置,探究氯碱工业原理,下列说法正确的是A.石墨电极与直流电源负极相连B.铜电极的反应式为:2H++2e-=H2↑C.氢氧化钠在石墨电极附近产生,Na+向石墨电极迁移D.用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色10.设NA为阿伏加德罗常数的值。
下列说法正确的是(O-16Fe-56)A.常温下,0.5molL-1Fe2(SO4)3溶液中含Fe3+数目为NAB.标准状况下,22.4L苯中含C—H数目为6NAC.常温常压下,16gO2和O3混合气体中,含氧原子的总数为NAD.5.6gFe与足量稀盐酸反应,转移电子数为0.3NAXYZW11.X、Y、Z、W均为短周期元素,在周期表中位置如图。
Y原子的最外层电子数是电子层数的3倍。
下列说法中不正确的是A.Y和Z的气态氢化物,前者更稳定B.Z和W的最高价氧化物对应水化物的酸性:W<ZC.X、W的气态氢化物相互反应,生成物中既含离子键又含共价键D.Y、W的单质,均可通过电解的方法获得12.在2L密闭容器中进行反应C(s)+H2O(g)CO(g)+H2(g)△H0,测得c(H2O)随反应时间(t)的变化如图。
广东省汕头市高考理综-化学一模考试试卷A卷

广东省汕头市高考理综-化学一模考试试卷A卷姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分) (2018高二上·佛山期末) 万卡特拉曼·莱马克里斯南、托马斯·施泰茨和阿达·尤纳斯三位科学家因为“核糖体的结构和功能”的研究而获得诺贝尔化学奖。
核糖体含有的元素除氮、磷等元素外,一定含有的元素是()A . C,H,OB . C,Fe,HC . C,H,NaD . H,O,K2. (2分)(2015·扶沟模拟) NA代表阿伏加德罗常数的值,下列有关叙述不正确的是()A . 在熔融状态下,1 mol Na2O2 完全电离出的离子数目为3 NAB . 将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数C . 在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NAD . 含1mol Cl﹣的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH数为 NA3. (2分) (2016高一下·武城期末) 已知在周期表中第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是()A . 位于周期表的第七周期第ⅣA族B . 原子的最外层有4个电子C . 肯定是非金属元素D . 常见的化合价有+2和+4价4. (2分) (2019高三上·广东期末) 有关下列四组实验描述错误的是()A . 加热甲装置中的烧杯可以分离SiO2和NH4ClB . 利用装置乙可证明非金属性强弱:Cl>C>SiC . 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中D . 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成5. (2分) (2018高一下·齐齐哈尔期末) Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。
2018届高三下学期第一次质量检测理综化学试卷 含答案

可用到的相对原子质量:H-1 C-12 O-16第I卷(选择题共126分)一、选择题(本题共13小题,每小题6分,在毎小题给出的四个选项中,只有一项是符合题目要求)7.化学在生活中应用广泛,下列物质性质与对应用途错误的是A.明矾易水解生成胶体,可用作净水剂B.晶体硅熔点高硬度大,可用作芯片C.氮气化学性质稳定,可用作粮食保护气D.溴化银见光易分解,可用作胶片感光剂8.设NA为阿伏加徳罗常数的值。
下列有关叙述正确的是A..25℃时,1LpH =11的氨水中OH-为0.001 NAB.标准状况下,2.24 L SO3的氧原子数为0.3NAC.4.6 g乙醇中含有的共价键数为0. 7NAD.3.6gD2O所含质子数为2NA9.己知,下列说法错误的是A.该反应属于加成反应B.异丙苯的一氯代物共有6种C.可用溴水鉴别异丙烯苯和异丙苯D.异丙苯是苯的同系物10.某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。
取废水祥品分别进行如右图所示①~④四个实验。
下列推断正确的是A.废水含有Na+,不含K+B.废水含有SO42-和CO32-C.废水不含Fe3+,可能含Fe2+D.废水一定含有Na+、Al3+、SO42-11.下列实验操作不能达到实验目的的是12.X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如右图所示。
下列说法错误是A.Q位于第三周期IA族B.X、Y、Z三种元素组成的化合物可能是盐或碱C.简单离子半径:M->Q+>R2+D.Z与M的最高价氧化物对应水化物均为强酸13.铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。
若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH (烃基自由基)。
下列说法错误的是A.无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+B.不鼓入空气时,正极的电极反应式为H++e-=H·C.鼓入空气时,每生成1mol·OH有2mol电子发生转移D.处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气26.(15分)甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。
汕头市2018~2018学年度普通高中毕业班教学质量监测试题理科综合化学

D
)
B. 100∶1 D. 无法确定
当pH乙 = 1时,pH甲 = 2,c(H+)甲∶c(H+)乙 = 1∶10
当pH乙 = 2时,pH甲 = 4,c(H+)甲∶c(H+)乙 = 1∶100
当pH乙 = 3时,pH甲 = 6,c(H+)甲∶c(H+)乙 = 1∶1000
12. 下列叙述中,正确的是
8.下列叙述正确的是
最大 0族除外) 最小(
(
C
)
A.同周期元素中,ⅦA族元素的原子半径 越难 B.ⅥA族元素的原子,其半径越大,越容易 得到电子
C.室温时,零族元素的单质都是气体
D.所有主族元素的原子,形成单原子离子时
的化合价和它的族序数相等
F元素无正价,O元素无 +6价
9.下列各组离子中,在碱性溶液中共存,且加入
CH3CH CH2
聚合
O F G: O CH C CH3 n
缩聚
E
CH3 [ CH―CH2― ]n ― (1)聚合物F的结构简式是___________________ 。 CH3―C―COOH O
思路
(2)D的结构简式是_________________________。 (3)B转化为C的化学方程式是 ______________________________________________ 。 △
稀 NaOH 溶液 饱和 Na2CO 3溶液 混合振荡、静置分液
C 乙酸乙酯 乙酸
D 蛋白质
蔗糖
浓(NH4)2SO4溶液 盐析、过滤、洗涤
主 观 题
30、(16分)由丙烯经下列反应可得到F、G两种高分子 化合物,它们都是常用的塑料。
2018届高三第一次模拟考试理综化学试题 含解析

1.已知①中国古代四大发明之一的黑火药,它是由硫磺、木炭粉和硝石组成;②油条中铝含量超标十分普遍,是影响人们健康的食品安全隐患。
油条无铝配方由碳酸氢钠(小苏打)和臭粉组成。
下列关于硝石和臭粉的成份组合正确的是A.KNO3、NH4HCO3 B.KNO3、Na2CO3 C.HNO3、(NH4)2CO3 D.NH4NO3、Na2CO3【答案】A【解析】黑火药是我国古代的四大发明之一,它是硝酸钾、硫粉、木炭粉按一定比例混合而成的,硝石是指硝酸钾,油条无铝配方由碳酸氢钠(小苏打)和臭粉组成,碳酸氢铵能说出刺激性气味的氨气,臭粉组成为NH4HCO3,硝石和臭粉的成份组合为:KNO3、NH4HCO3 ,故选A。
【点睛】解题关键是能够用化学知识解释化学现象,黑火药是我国古代的四大发明之一,它是硝酸钾、硫粉、木炭粉按一定比例混合而成的,硝石是指硝酸钾,油条无铝配方由碳酸氢钠(小苏打)和臭粉组成,碳酸氢铵能说出刺激性气味的氨气。
2.常温下,下列各组离子一定能在指定溶浓中大量共存的是A.pH=l的溶液:Ba2+、Al3+、Cl-、SO42-B.能使酚酞试液变红的溶液:Na+、K+、HCO3-、I-C.c(OH-)/c(H+)=10-12的溶液:NH4+、Cu2+、NO3-、Cl-D.含有0.1mol/LFe(NO3)2的溶液:H+、Mg2+、SCN-、SO42-【答案】C3.下列说法正确的是A.乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应B.CH3CH2CH3分子中的3个碳原子不可能在同一直线上C.聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物D.等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同【答案】B【解析】A.乙烯含有碳碳双键,可与溴水发生加成反应,与高锰酸钾发生氧化还原反应,反应类型不同,故A错误;B.CH3CH2CH3为烷烃,具有甲烷的结构特点,则3个碳原子不可能在同一直线上,故B正确;C.麦芽糖相对分子质量较小,不是高分子化合物,故C错误;D.乙醇可拆写成C2H4•H2O的形式,等质量的C2H4和C2H4•H2O含C2H4,乙烯高于乙醇,故消耗氧气的量乙烯大于乙醇,故D错误;故选B。
2018年广东省汕头市高三第一次模拟考试化学试题及答案

汕头市高考模拟考试理综化学试题(一)选择题部分(36分)一、单项选择题(本题包括6小题,每小题4分,共24分。
每小题只有一个....选项符合题意)7.下列说法错误的是A.安装煤炭“固硫”装置,降低酸雨发生率B.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用C.研发易降解的塑料,防止白色污染D.氮的固定只有在高温、高压、催化剂的条件下才能实现8. 在溶液中能大量共存的一组离子或分子是A.Na+、K+、SO32-、Cl2B.NH4+、H+、NO3-、HCO3-C.Na+、CH3COO-、CO32-、OH-D.K+、Al3+、SO42-、NH3·H2O9. 设n A为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,O 16)A.标准状况下,22.4 L四氯化碳含有的分子数为n AB.常温常压下,18g水含有的分子数为 n AC.1 mol Cu和足量稀硝酸反应产生NO分子数为n AD.1L1.0 mol·L-1 Na2CO3溶液中含有CO32-数为 n A10. 下列说法中正确的是A.乙醇与乙酸都存在碳氧双键B.油脂水解可得到氨基酸和甘油C.淀粉和纤维素水解最终产物都是葡萄糖D.卤代烃加入硝酸酸化的硝酸银溶液可根据生成的卤化银沉淀颜色检验卤原子11.短周期非金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是A.原子半径:甲<乙C.最高价氧化物的水化物的酸性:丙<丁D.最外层电子数:丙>丁>戊12. 下列实验装置设计正确,且能达到目的的是二、双项选择题(本题包括2小题,每小题6分,共12分。
每小题有两个选项符合题意。
若只选一个且正确得3分,但只要选错就得0分)22.下列关于0.1 m ol·L-1 NH4Cl溶液的说法正确的是A.向溶液中加滴加几滴浓盐酸,c(NH4+)减少B.向溶液中加入少量CH3COONa固体,c(NH4+)减少C.溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.向溶液中加适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-)23.氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。
精品解析:广东省汕头市2018届高三第一次(3月)模拟考试理综化学试题(解析版)

广东省汕头市2018届高三第一次(3月)模拟考试理综化学试题1. 化学与生产、生活息息相关,下列说法正确的是A. SO2、CO2、NO2都是可形成酸雨的气体B. 农业施肥作业时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用C. 地沟油不宜食用,可以分馏提取汽油,做汽车的燃料D. 向牛奶中加入果汁会产生沉淀,是因为发生了酸碱中和反应【答案】B【解析】A.SO2和NO2都是可形成酸雨的气体,CO2不能形成酸雨,但能形成温室效应,选项A错误;B、K2CO3为强碱弱酸盐,NH4Cl为强酸弱碱盐,草木灰与NH4Cl混合使用时,CO32-与NH4+发生水解相互促进反应生成NH3,降低肥效,选项B正确;C、地沟油主要成分为油脂,汽油只要成分为烃,选项C错误;D、因牛奶中含有蛋白质,加入果汁能使蛋白质凝聚而沉淀,且牛奶不是酸,则不是酸碱之间的反应,选项D错误;答案选B。
2. 下列关于有机化合物的说法正确的是A. 丙烷的二氯取代物有3种B. 和苯乙烯互为同系物C. 饱和(NH4)2SO4溶液和福尔马林均可使蛋白质溶液产生沉淀,其原理相同D. 聚合物()可由单体CH3CH=CH2和CH2=CH2加聚制得【答案】D【解析】A. 丙烷的二氯取代物有1,1-二氯丙烷、2,2-二氯丙烷、1,2-二氯丙烷、1,3-二氯丙烷4种,选项A错误;B、和苯乙烯相差C2H2,不符合相差若干个CH2,不互为同系物,选项B错误;C、饱和(NH4)2SO4溶液和福尔马林均可使蛋白质溶液产生沉淀,但前者为蛋白质的盐析,后者为蛋白质的变性,原理不相同,选项C错误;D、聚合物()可由单体CH3CH=CH2和CH2=CH2加聚制得,选项D正确。
答案选D。
3. 设N A为阿伏加德罗常数值,下列有关叙述正确的是( )A. 常温常压下,30 g乙烷中所含的极性共价键数为6N AB. 0.1 mol Fe与足量盐酸反应,转移的电子数为0.3N AC. 0.1 mol Sr原子中含中子数为3.8N AD. 0.1 mol·L-1的NH4NO3溶液中含有的氮原子数为0.2N A【答案】A【解析】A、30g乙烷的物质的量为1mol,而乙烷中含6对极性共价键,故1mol乙烷中含极性共价键6N A,选项A 正确;B、0.1mol Fe与足量盐酸反应生成氯化亚铁,转移的电子数为0.2N A,选项B错误;C、0.1 mol9038Sr 原子中含中子数为5.2N A,选项C错误;D、没有给定硝酸铵溶液的体积,无法计算硝酸铵溶液中氮原子的物质的量,选项D错误;答案选A。
广东省汕头市2018届高三化学第一次模拟考试 理综化学

汕头市2018届普通高考第一次模拟考试题理综化学可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Cl-35.5 Ni-59第Ⅰ卷一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7. 化学与生产、生活息息相关,下列说法正确的是A.SO2、CO2、NO2都是可形成酸雨的气体B.农业施肥作业时,草木灰(有效成分为2CO3)不能与NH4Cl混合使用C.地沟油不宜食用,可以分馏提取汽油,做汽车的燃料D. 向牛奶中加入果汁会产生沉淀,是因为发生了酸碱中和反应8.下列关于有机化合物的说法正确的是A.丙烷的二氯取代物有3种B .和苯乙烯互为同系物C.饱和(NH4)2SO4溶液和福尔马林均可使蛋白质溶液产生沉淀,其原理相同CH2—]n)可由单体CH3CH=CH2和CH2=CH2加聚制得D.聚合物(—[CH2—CH2—CH—|CH39. 设N A为阿伏加德罗常数值下列有关叙述正确的是A. 常温常压下, 30 g乙烷中所含的极性共价键数为6N AB. 0.1mol Fe与足量盐酸反应,转移的电子数为0.3N ASr原子中含中子数为3.8N AC. 0.1 mol9038D. 0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2N A10. 下列实验叙述错误..的是A.用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,说明原溶液中有Na+而无法判断是否有+B.配制硫酸铁溶液时,将硫酸铁溶解在硫酸中,再加水稀释C.中和滴定时,滴定管用蒸馏水洗涤2~3次后即可加入标准溶液进行滴定D.验证铁钉是否发生吸氧腐蚀,可将铁钉浸没在NaCl溶液中观察现象11. 五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误..的是A. c元素的离子半径比e的离子半径小B. d元素对应的最高价氧化物的水化物酸性比e元素弱C. b、c、d三种元素对应的最高价氧化物的水化物相互间能发生反应D. a与b两种元素可形成既有离子键又有非极性共价键的化合物12. 氢硫酸中存在电离平衡:H2SH++HS-和HS-H++S2-。
2018高三一诊化学答案12.21
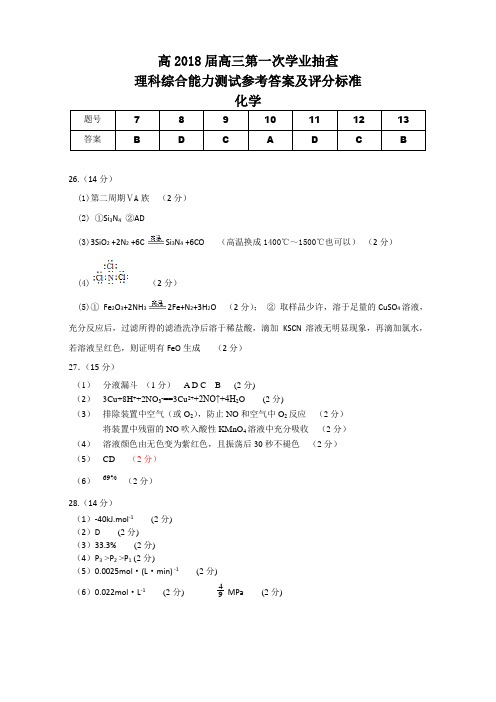
高2018届高三第一次学业抽查理科综合能力测试参考答案及评分标准化学26.(14分)(1)第二周期ⅤA族(2分)(2) ①Si3N4②AD(3)3SiO2 +2N2 +6C Si3N4 +6CO (高温换成1400℃~1500℃也可以)(2分)(4)(2分)(5)①Fe2O3+2NH32Fe+N2+3H2O (2分);②取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣洗净后溶于稀盐酸,滴加KSCN溶液无明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成(2分)27.(15分)(1)分液漏斗(1分) A D C B (2分)(2)3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O (2分)(3)排除装置中空气(或O2),防止NO和空气中O2反应(2分)将装置中残留的NO吹入酸性KMnO4溶液中充分吸收(2分)(4)溶液颜色由无色变为紫红色,且振荡后30秒不褪色(2分)(5)CD (2分)(6)69% (2分)28.(14分)(1)-40kJ.mol-1(2分)(2)D(2分)(3)33.3%(2分)(4)P3 >P2 >P1 (2分)(5)0.0025mol·(L·min) -1(2分)(6)0.022mol·L-1(2分)94MPa(2分)35.(15分)(1)①(2分)②Fe3+的价电子排布式为3d5,处于半充满状态,结构稳定 (2分)③< (1分) FeO和NiO相比,阴离子相同,阳离子所带电荷相同,但r(Fe2+)>r(Ni2+),所以FeO晶格能小,熔点低 (2分)(2)①O>N>C>H (2分)②A B(2分)(3)① 2 (2分) ②(2分)36.(15分)(1)C10H17N (2分)(2)加成反应(1分)(3)(2分)(4)(2分)(2分)(5)6 (2分)(6)(每步1分,共4分)。
广东省2018届高三理综第一次模拟考试试题

广东省2018届高三理综第一次模拟考试试题本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共14页,38小题,满分300分。
考试用时150分钟。
可能用到的相对原子质量:H1 C12 N14 O16 Mg24 S32 Cl35.5 Fe56 C O59Ag108第Ⅰ卷(选择题共126分)一、选择题:本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.研究人员将猴胚胎细胞(a)中的细胞核取出,移植入一雌猴的去核卵母细胞(b)中,得到重组细胞(c),经培养获得胚胎并移植到另一雌猴(d)体内进一步发育,获得克隆猴(e)。
下列叙述正确的是A.e的细胞内的全部基因都来自a,b不提供基因B.c经一系列增殖和分化形成e的过程中,细胞核起控制作用C.d为胚胎发育提供遗传物质和其他适宜条件D.e的形成过程中没经过受精作用,其体细胞中无同源染色体2.下列有关组织细胞中化合物鉴定实验的叙述,正确的是A.蛋白酶和蛋白质的混合溶液中加入双缩脲试剂后,会产生紫色反应B.将斐林试剂加入果糖溶液中后,溶液呈现无色,水浴加热后有砖红色沉淀生成C.观察DNA与RNA在细胞中分布的实验中,用盐酸处理有利于DNA与吡罗红结合D.酵母菌进行有氧呼吸和无氧呼吸的产物都能用酸性重铬酸钾溶液来鉴定3.炎性甲亢是由甲状腺滤泡细胞膜通透性发生改变,滤泡细胞中的甲状腺激素大量释放进入血液,而引起机体内甲状腺激素含量明显升高的一种疾病。
下列相关叙述错误的是A.正常情况下,甲状腺激素的分泌受神经系统的调节B.炎性甲亢患者血液中促甲状腺激素的含量比正常人的低C.炎性甲亢患者的机体细胞代谢快,产热量大于散热量D.甲状腺激素作用的靶细胞是几乎全身所有的细胞4.某实验小组用一定浓度的旷萘乙酸(NAA)溶液和激动素(KT)溶液探究二者对棉花主根长度及侧根数的影响,结果如下图所示。
据此分析,下列相关叙述错误的是A.主根和侧根对NAA的敏感性不同B.NAA能一定程度地消除根的顶端优势,而KT能增强根的顶端优势C.NAA能抑制主根生长,KT能促进主根生长,且浓度越高效果越明显D.一定浓度的KT对NAA促进侧根生长的效应具有增强作用5.湿地生态系统是在多水和过湿条件下形成的生态系统,如沼泽等,湿地生态系统研究已成为当前的热点。
广东省2018届高三第一次模拟考试理综化学试题 word

2018年普通高等学校招生全国统一考试广东省理科综合模拟试卷(一)7.《梦溪笔谈》中记载:“信州铅山县有苦泉,流之为涧,挹其水熬之,则成胆矾……熬胆矾铁釜,久之亦化为铜。
”文中涉及的化学反应类型有A.复分解反应B.置换反应C.取代反应D.加成反应8.化学在生活中有广泛的应用,下列物质的性质与应用相对应的是9.短周期元素W、X、Y、Z的原子序数依次增太.W的单质是空气的主要成分之一,常用作粮食的保护期,Y是同周期所有元素中原子半径最小的元素,Z的最外层电数等于其最内层电子数.下列说法正确的是A.元素的非金属性:Y>X>WB.WX与ZX中的化学键类型相同C.简单离子的半径:Z>Y>XD.Y的氢化物的水溶液可使红色石蕊试纸变蓝10.已知互为同分异构体,下列说法不正确的是A.盆烯可与酸性高锰酸钾溶液反应B.苯与棱晶烷的一氯代物均只有一种C.上述三种物质中,与甲苯互为同系物的只有苯D.上述三种物质中,只有棱晶烷的所有原子不处于同一平面内11.用氢氧化锂生产锂基润滑脂可用作宇航设备的润滑剂,清华大学首创三室膜电解法制备LiOH,其工作原理如图所示,下列说法不正确的是A.X电极连接电源正极B.M为阳离子交换膜C.气体A为氧气D.Y电极反应式为12. 下列根据实验操作和实验现象所得出的结论正确的是13.常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数随溶液pH的变化关系如图所示。
下列说法错误的是A.常温下,H2A=HA-+H+的电力平衡常数B.当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性C.pH=6.27时,D.V(NaOH溶液):V(H2A溶液)=3:2时,26硫酰氯可用作有机化学的氯化剂,在制取药物和染料时也有重要作用,其部分性质如下表所示。
I 实验室合成硫酰氯前需先制取干燥氯气,制备干燥纯净的氯气所用的一起如下图(1)圆底烧瓶中发生反应的离子方程式为:________________________________(2) 上述仪器的连接顺序是e 接__,__接__,__接__,__接__,__接__。
广东省汕头市达标名校2018年高考一月适应性考试化学试题含解析

广东省汕头市达标名校2018年高考一月适应性考试化学试题一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.元素周期表中,铟(In)与铝同主族,与碘同周期。
由此推断A.In最外层有5个电子B.In的原子半径小于IC.In(OH)3的碱性强于Al(OH)3D.In属于过渡元素2.已知:C(s)+ H2O(g)== CO(g) + H2(g) △H = a kJ·mol-12 C(s)+ O2(g)== 2CO(g) △H = -220 kJ·mol-1H-H 、O=O和O-H键的键能(kJ·mol-1)分别为436、496和462,则a为()A.-332 B.-118 C.+350 D.+1303.N A为阿伏加德罗常数的值,下列说法正确的是()A.标准状况下,33.6LSO3中含有氧原子的数目为4.5N AB.1L浓度为0.1mol/L的磷酸溶液中含有的氧原子个数为0.4N AC.0.1mol丙烯酸中含有双键的数目为0.2N AD.1L0.2mol/L的FeCl3溶液和过量KI溶液充分反应可生成0.1molI24.2019年诺贝尔化学奖授予在锂电池发展上做出贡献的三位科学家。
某可连续工作的液流锂离子储能电池放电时工作原理如图所示,下列说法正确的是A.放电时,储罐中发生反应:S2O82-+2Fe2+=2Fe3++2SO42-B.放电时,Li电极发生了还原反应C.放电时,Ti电极发生的电极方程式为:Fe2+-e−=Fe3+D.Li+选择性透过膜可以通过Li+和H2O5.瑞香素具有消炎杀菌作用,结构如图所示,下列叙述正确的是A.与稀H2SO4混合加热不反应B.不能使酸性高锰酸钾溶液褪色C.1mol 瑞香素最多能与3mol Br2发生反应D.1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 3mol6.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,下列说法不正确的是A.该电池的负极反应式为:CH3CH2OH + 3H2O - 12e-2CO2↑ + 12H+B.该电池的正极反应式为:O2 + 4e- + 4H+2H2OC.电流由O2所在的铂电极经外电路流向另一电极D.微处理器通过检测电流大小而计算出被测气体中酒精的含量7.如图为高中化学教材《必修1》(人教版)中NaCl在水中的溶解和电离示意图。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
汕头市2018届普通高考第一次模拟考试题理综化学可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 Cl-35.5 Ni-59第Ⅰ卷一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7. 化学与生产、生活息息相关,下列说法正确的是A.SO2、CO2、NO2都是可形成酸雨的气体B.农业施肥作业时,草木灰(有效成分为2CO3)不能与NH4Cl混合使用C.地沟油不宜食用,可以分馏提取汽油,做汽车的燃料D. 向牛奶中加入果汁会产生沉淀,是因为发生了酸碱中和反应8.下列关于有机化合物的说法正确的是A.丙烷的二氯取代物有3种B .和苯乙烯互为同系物C.饱和(NH4)2SO4溶液和福尔马林均可使蛋白质溶液产生沉淀,其原理相同CH2—]n)可由单体CH3CH=CH2和CH2=CH2加聚制得D.聚合物(—[CH2—CH2—CH—|CH39. 设N A为阿伏加德罗常数值下列有关叙述正确的是A. 常温常压下, 30 g乙烷中所含的极性共价键数为6N AB. 0.1mol Fe与足量盐酸反应,转移的电子数为0.3N ASr原子中含中子数为3.8N AC. 0.1 mol9038D. 0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2N A10. 下列实验叙述错误..的是A.用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,说明原溶液中有Na+而无法判断是否有+B.配制硫酸铁溶液时,将硫酸铁溶解在硫酸中,再加水稀释C.中和滴定时,滴定管用蒸馏水洗涤2~3次后即可加入标准溶液进行滴定D.验证铁钉是否发生吸氧腐蚀,可将铁钉浸没在NaCl溶液中观察现象11. 五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误..的是A. c元素的离子半径比e的离子半径小B. d元素对应的最高价氧化物的水化物酸性比e元素弱C. b、c、d三种元素对应的最高价氧化物的水化物相互间能发生反应D. a与b两种元素可形成既有离子键又有非极性共价键的化合物12. 氢硫酸中存在电离平衡:H2SH++HS-和HS-H++S2-。
已知酸式盐NaHS溶液呈碱性,若向10ml浓度为0.1mol/L的氢硫酸中加入以下物质,下列判断正确的是A. 加水,会使平衡向右移动,溶液中氢离子浓度增大B. 加入20ml浓度为0.1mol/L NaOH溶液,则c(Na+)=c(HS-)+c(H2S)+2c(S2-)C. 通入过量SO2气体,平衡向左移动,溶液pH值始终增大D. 加入10ml浓度为0.1mol/L NaOH溶液,则c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-)13. 高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。
其电池总反应为:3n + 22FeO4 + 8H2O 3n(OH)2 + 2Fe(OH)3 + 4OH下列叙述不正确...的是A.放电时负极反应为:n-2e-+2OH-= n(OH)2B.充电时阳极发生氧化反应,附近溶液碱性增强C.充电时每转移3mol电子,阴极有1.5moln生成D.放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-第Ⅱ卷三、非选择题:包括必考题和选考题两部分。
第22题~第32题为必考题,每个试题考生都必须做答。
第33题~第38题为选考题,考生根据要求做答。
(一)必考题(11题,共129分)26. (15分)硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。
某同学欲利用氯气..和单质硼...反应制备三氯化硼。
已知BC13的沸点为12.5 ℃,熔点为-107.3 ℃,遇水剧烈反应,生成硼酸和盐酸。
该同学选用下图所示的部分装置(可以重复选用)进行实验,请回答下列问题:(1)A中反应的离子方程式为__________ ____。
(2)图中g管的作用是___ _ _。
(3)装置的连接顺序依次为A→→→→E→D→F;在E、F装置间连接D装置的作用是。
(4)停止实验时,正确的实验操作是。
(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为(填“正盐”或“酸式盐”或“碱式盐”)。
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC1O、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色。
现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。
实验序号0.1mol/LNaClO溶液/mL0.1mol/LNaCl溶液/mL0.2mol/LNaOH溶液/mLH2O /mL品红溶液现象① 5.0 0 0 4滴较快褪色②0 5.0 5.0 0 4滴不褪色③ 5.0 0 5.0 0 4滴缓慢褪色则=_______,结论:。
27. (14分)醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。
一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:相关离子生成氢氧化物的pH和相关物质的溶解性如下表:金属离子开始沉淀时的pH 沉淀完全时的pH 物质20℃时溶解性(H2O)Fe3+ 1.1 3.2 CaSO4微溶Fe2+ 5.8 8.8 NiF 可溶Al3+ 3.0 5.0 CaF2难溶Ni2+ 6.7 9.5 NiCO3sp=1.0×10-5(1)将含镍废料粉碎的目的是。
(2)“酸浸”实验中,镍的浸出率结果如图所示,从能量损耗和成本角度考虑,若要使镍的浸出效果最佳,选择的最好温度和时间分别为℃、 min。
(3)实验过程中,滤渣1主要成分的化学式为、。
(4)调节pH步骤中,溶液pH的调节范围是~。
选择此范围的目的是。
(5)酸浸过程中,lmol NiS失去6N A个电子,同时生成两种无色有毒气体。
写出该反应的化学方程式:。
(6)沉镍过程中,若c(Ni2+)=4.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为g。
(保留小数点后1位有效数字)28.(14分)研究氮、硫、碳及其化合物的转化对于环境的改善有重大意义,可减少如雾霾天气、酸雨、酸雾等环境污染问题。
(1)在一定条件下,CH4可与NO反应除去NO,已知有下列热化学方程式:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 J·mol-1②N2(g)+2O2(g)2NO2(g) △H=+67.0 J·mol-1③H2O(g)=H2O(l) △H=-41.0 J·mol-1则CH4(g)+2NO2(g) CO2(g)+2H2O(g)+N2 (g) △H=____J·mol-1;(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)2SO3(g)。
在一定温度和压强下,往一密闭容器通入SO2和O2[其中n(SO2):n(O2)=21],测得容器内总压强在不同温度下与反应时间如图1所示。
①图1中C点时,SO2的转化率为 _ _。
②图1中B点的压强平衡常数p= 。
(p=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(3)已知4NH3(g)+6NO(g)5N2(g)+6H2O(g)ΔH1=-1800 J·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图2所示。
①与容器a中的反应相比,容器b中的反应改变的实验条件可能是,判断的依据是。
②一定温度下,下列能说明反应已达到平衡状态的是A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变C.ΔH保持不变 D.容器的总压强保持不变(4)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图3所示,在催化剂b表面发生的电极反应为:。
35.【化学——选修3:物质结构与性质】(15分)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。
NaAlH4可由AlCl3和NaH在适当条件下合成。
NaAlH4的晶胞结构如图所示。
(1)基态Ti原子的价电子轨道表示式........为。
(2)AlH4-的空间构型为,中心原子Al的轨道杂化方式为;(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式...为(标明配位键)。
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于晶体,其电子式为。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有个;NaAlH4晶体的密度为g·cm-3(用含a的代数式表示)。
若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为(填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。
这种结构变化由表面层扩展到整个晶体,从而释放出氢气。
该释氢过程可用化学方程式表示为。
36.【化学——选修5:有机化学基础】(15分)香料甲和G在生活中有很多用途,工业上利用有机物A()制备,其合成路线如下已知R1—CHO+R2—CH2—CHO (R1、R2代表烃基或氢原子)回答下列问题:(1)C的名称是,F中官能团的名称是。
(2)②的反应类型是,E的结构简式为。
(3)下列关于D的叙述正确的是 .A. 分子式为C9H10OB. 1molD最多能与5molH2发生加成反应C. 自身能发生加聚、缩聚反应D. 最多有9个碳原子位于同一平面(4)C有多种同分异构体,其中属于芳香族化合物的有种。
(5)写出反应①的化学方程式。
(6)F的同分异构体是一种重要的药物中间体,其合成路线与G相似,请以为原料设计它的合成路线(其他所需原料自选)。
