SDS-PAGE分离胶配方表-及其原理
SDS-PAGE分离胶-浓缩胶配方
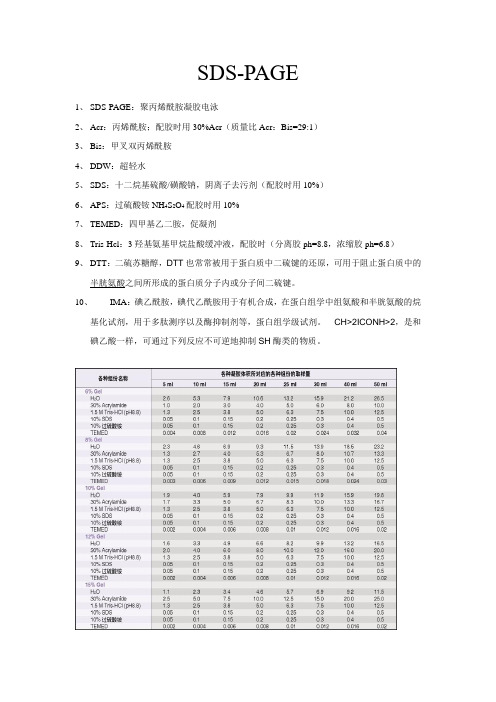
SDS-PAGE1、SDS-PAGE:聚丙烯酰胺凝胶电泳2、Acr:丙烯酰胺;配胶时用30%Acr(质量比Acr:Bis=29:1)3、Bis:甲叉双丙烯酰胺4、DDW:超轻水5、SDS:十二烷基硫酸/磺酸钠,阴离子去污剂(配胶时用10%)6、APS:过硫酸铵NH4S2O4配胶时用10%7、TEMED:四甲基乙二胺,促凝剂8、Tris-Hcl:3羟基氨基甲烷盐酸缓冲液,配胶时(分离胶ph=8.8,浓缩胶ph=6.8)9、DTT:二硫苏糖醇,DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA:碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH酶类的物质。
1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶(也称堆积胶、积层胶或上层胶):TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
SDS-PAGE原理、试剂配制和注意事项

SDS是阴离子去污剂,能断裂分子内和分子间的氢键,破坏蛋白分子的二、三级结构。
作用有四:去蛋白质电荷、解离蛋白质之间的氢键、取消蛋白分子内的疏水作用、去多肽折叠。
而强还原剂如巯基乙醇,二硫苏糖醇能使绊胱氨酸残基间的二硫键断裂。
在样品和凝胶中加入还原剂和SDS后,分子被解聚成多肽链,解聚后的氨基酸侧链和SDS结合成蛋白- SDS 胶束,所带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异。
SDS-PAGE一般采用的是不连续缓冲系统,浓缩胶是由AP催化聚合而成的大孔胶,凝胶缓冲液为pH6.7的Tris-HC1。
分离胶是由AP催化聚合而成的小孔胶,凝胶缓冲液为pH8.9 Tris-HC1。
电极缓冲液是pH8.3 Tris-甘氨酸缓冲液。
2种孔径的凝胶、2种缓冲体系、3种pH值使不连续体系形成了凝胶孔径、pH值、缓冲液离子成分的不连续性,这是样品浓缩的主要因素。
当样品液和浓缩胶选TRIS/HCL缓冲液,电极液选TRIS/甘氨酸。
电泳开始后,HCL解离成氯离子,甘氨酸解离出少量的甘氨酸根离子。
蛋白质带负电荷,因此一起向正极移动,其中氯离子最快,甘氨酸根离子最慢,蛋白居中。
电泳开始时氯离子泳动率最大,超过蛋白,因此在后面形成低电导区,而电场强度与低电导区成反比,因而产生较高的电场强度,使蛋白和甘氨酸根离子迅速移动,形成以稳定的界面,使蛋白聚集在移动界面附近,浓缩成一中间层。
过硫酸铵(AP)为催化剂,四甲基乙二胺(TEMED)为加速剂。
在聚合过程中,TEMED 催化过硫酸铵产生自由基,后者引发丙烯酰胺单体聚合,同时甲叉双丙烯酰胺与丙烯酰胺链间产生甲叉键交联,从而形成三维网状结构。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
SDS_PAGE分离胶_浓缩胶配方

SDS-PAGE1、SDS-PAGE:聚丙烯酰胺凝胶电泳2、Acr:丙烯酰胺;配胶时用30%Acr〔质量比Acr:Bis=29:13、Bis:甲叉双丙烯酰胺4、DDW:超轻水5、SDS:十二烷基硫酸/磺酸钠,阴离子去污剂〔配胶时用10%6、APS:过硫酸铵NH4S2O4配胶时用10%7、TEMED:四甲基乙二胺,促凝剂8、Tris-Hcl:3羟基氨基甲烷盐酸缓冲液,配胶时〔分离胶ph=8.8,浓缩胶ph=6.89、DTT:二硫苏糖醇,DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA:碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH酶类的物质。
1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶<即下层胶>:SDS-PAGE 分离胶浓度最佳分离范围6%胶50-150kD 8%胶30-90kD注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶<也称堆积胶、积层胶或上层胶>:TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS〔十二烷基硫酸钠,SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
SDS-PAGE原理、方法详解

SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)一、材料准备(1)丙烯酰胺单体(Arc):在交联剂作用下形成聚丙烯酰胺(2)N,N’-甲叉双丙烯酰胺(Bis):交联剂(3)10%十二烷基硫酸钠(SDS):阴离子去污剂,可与蛋白质结合,形成SDS-蛋白质复合物。
由于SDS带有大量负电荷,当与蛋白质形成复合物后好比蛋白质穿上带负电的“外衣”,蛋白质本身带有的电荷则被掩盖,即消除了蛋白质分子之间电荷差异。
配制方法:10g SDS,用双蒸水溶解并定容至100ml,室温保存。
(4)10%过硫酸铵(Ap):引发剂。
配制方法:0.1 g过硫酸铵溶解于1ml双蒸水中。
过硫酸铵会缓慢分解,应新鲜配制。
(5)N、N、N’、N’-四甲基乙二胺(TEMED):其碱基催化AP产生氧自由基,激活单体形成自由基,发生聚合。
配制方法:原液使用。
应使用电泳级TEMED。
(6)30%丙烯酰胺凝胶贮液(Arc-Bis贮液)配制方法(50mL体系):14.55 g丙烯酰胺+0.45 g N,N-甲叉双丙烯酰胺,先用40ml双蒸水溶解,搅拌,直到溶液变成透明,再用双蒸水稀释至50 ml,0.45μm滤膜过滤。
用棕色瓶储存于4℃(丙烯酰胺单体贮液在储存过程中因光和碱催化发生脱氨反应,会缓慢转化成丙烯酸和双丙烯酸,储存液应测定pH值不超过7.0。
丙烯酰胺单体贮液应在暗色瓶中保存,每隔数月须重新配制。
丙烯酰胺具有很强的神经毒性和致癌性,并可通过皮肤吸收,其作用具有累积性。
称量时必须戴手套和面具。
)(7)分离胶缓冲液(pH8.8的Tris-HCl缓冲液):1.5M Tris-HCl,pH8.8。
配制方法:9.08 g Tris溶解在40ml 双蒸水中,用4 mol/L盐酸调节pH值8.8,再用双蒸水加至50ml。
4℃保存。
(8)浓缩胶缓冲液(pH6.7的Tris-HCl缓冲液):1.0M Tris-HCl,pH6.8。
配制方法:6.06 g Tris溶解在40 ml双蒸水中,用4 mol/L盐酸调节pH值6.8,再用双蒸水加至50 ml。
SDS-PAGE原理步骤详细介绍含图片业内借鉴

专业课件
7
蛋白质-SDS胶束的特点 (1)形状像一个长椭圆棒 (2)短轴对不同的蛋白质亚基-SDS 胶束基本上是相同的 (3)长轴的长度则与亚基分子量的大 小成正比
专业课件
8
胶束在SDS-PAGE系统中的电泳迁 移率不再受蛋白质原有电荷的影响, 而主要取决于椭圆棒的长轴长度,即 蛋白质或亚基分子量的大小。
当蛋白质的分子量在15KD— 200KD之间时,电泳迁移率与分子量 的对数呈线性关系
专业课件
9
3、影响SDS电泳的关键因素 (1) 溶液中SDS单体浓度 大多数蛋白质与SDS结合的重量比 为1:1.4 (2) 样品缓冲液的离子强度 低离子强度的溶液中,SDS单体才 具有较高的平衡浓度
专业课件
10
(3) 二硫键是否完全被还原 当二硫键被彻底还原后,蛋白质分
专业课件
2
一、SDS-PAGE的基本原理
(一)蛋白质分子的解聚 样品介质和聚丙烯酰胺中加入离子
去污剂和强还原剂后,蛋白质亚基的 电泳迁移率主要取决于亚基分子量的 大小,而电荷因素可以被忽略
专业课件
3
1、SDS
阴离子去污剂 变性剂 助溶性试剂
断裂分子内和分子间的氢键 分子去折叠 破坏蛋白质分子的二级和三级结构
专业课件
25
三、方法 1、分类 (1)根据对样品的处理方式的不同
还原SDS电泳 非还原SDS电泳 带有烷基化作用的还原SDS电泳
专业课件
26
(2)根据缓冲系统和凝胶孔径的不同
连续电泳 不连续电泳
(3)根据电泳的形式
圆盘电泳 垂直电泳
平板电泳 水平电泳
专业课件
27
专业课件
28
专业课件
SDS-PAGE全部试剂配方

SDS-PAGE试剂配方30%凝胶贮液(150ml, 4℃保存)29.2% Acr:43.8g 0.8% Bis:1.2g将Acr完全溶解于120ml水中,再加入Bis使其完全溶解,加ddH2O定容至150ml,用滤纸过滤溶液,棕色玻璃瓶中4℃保存。
分离胶Buffer (1.5M Tris-HCl 250ml)Tris:45.4725g SDS:1g将Tris溶于200ml水中,在磁力搅拌器上不断搅动溶液使其完全溶解,用HCl调节pH 至8.8,此过程中加入HCl时浓度需逐渐降低,越接近目标pH越要小心防止pH调节过头。
加ddH2O定容至250ml,加入SDS(此时容易产生气泡,可用超声或抽气破碎气泡),抽滤或滤纸过滤,4℃保存。
浓缩胶Buffer (0.5M Tris-HCl 100ml)Tris:6.07g SDS:0.4g将Tris溶于80ml水中,后续步骤同分离胶Buffer,调节pH值至6.8(可配置200ml调pH后100ml用于添加SDS作浓缩胶Buffer,剩余100ml为Tris-HCl贮液)SDS裂解液(10ml):0.5M Tris-HCl pH:6.8 2ml2%甘油2ml4%SDS 0.4g65mM DTT 100mg(使用时临时加入)ddH2O 6ml样品溶解液:(100ml)终浓度为50 mmol/L Tris﹒HClpH=6.8(总体积的20%=20ml),2% SDS=2g,0.1% 溴酚蓝=0.1g,10% 甘油=10ml,补ddH2O到100ml10%过硫酸铵:5g(0.5g)过硫酸铵,溶于50mL(5mL)去离子水中;现配现用或分装至0.5mL 离心%过硫酸铵:管中冷冻备用TEMED(N-N-N`-N`-四甲基乙二胺)原液,室温保存(有毒,致癌物质)。
蛋白sds-page凝胶配方及制胶

蛋白sds-page凝胶配方及制胶
SDS-PAGE(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis)是一种常用的蛋白质电泳技术,用于分离和定量蛋白质。
以下是制作SDS-PAGE凝胶的基本配方和制胶步骤:
配方:
1. 1%丙烯酰胺(Acrylamide)溶液:将3.7g丙烯酰胺和60μl N,N'-亚甲基双丙烯酰胺溶解在0.5ml双蒸水中,搅拌均匀。
2. 2.5%BT(Bis-Tris)溶液:将0.1g BT和0.25ml TBE(三酸乙酸盐电泳缓冲液)混合均匀。
3. 10%过硫酸铵(AMS)溶液:将10μl AMS溶解在1ml双蒸水中。
4. 5xTBE电泳缓冲液。
制胶步骤:
1. 将电冰板预热至30℃。
2. 将1%丙烯酰胺溶液和2.5%BT溶液混合,100V恒压电泳10-15分钟,直至胶液凝固。
3. 将胶板取出,放入考马士亮蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
4. 将胶板再次放入考马士亮蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
5. 将胶板放入考马士固蓝R-250中染色约2小时,然后用自来水冲洗至背景无色。
6. 将胶板干燥后,即可用于蛋白质电泳。
SDSPAGE分离胶配方表及其原理

S D S P A G E分离胶配方表及其原理The Standardization Office was revised on the afternoon of December 13, 2020SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
SDSPAGE所有详细试剂配方

SDSPAGE所有详细试剂配方SDS-(聚丙烯酰胺凝胶电泳)是一种常用于蛋白质分析的实验技术。
该技术通常涉及到几种试剂,如胶溶液、缓冲液、电泳缓冲液、染色溶液等。
下面是SDS-常见的试剂配方及其详细说明。
一、胶溶液配方:1. 30%(w/v)丙烯酰胺(acrylamide)溶液- 在称量瓶中称取30g丙烯酰胺,并用蒸馏水调至100ml。
搅拌溶解直至均匀。
-这是制备聚丙烯酰胺凝胶的基础溶液。
2. 响应稀释液(Response diluent)-用于稀释聚丙烯酰胺溶液以获得不同浓度的凝胶。
-可通过将聚丙烯酰胺溶液与水按1:3体积比混合来制备响应稀释液。
二、缓冲液配方:1. 离子化追踪剂(Tris-Glycine running buffer)-用于凝胶电泳盒中电解质的运行。
-配方为:3g Tris base (pH 8.8)14.4g glycine将固体溶解于1L蒸馏水中,并调整pH至8.8三、电泳缓冲液配方:1. 离子化追踪剂(Tris-Glycine SDS running buffer)-用于在电泳过程中提供离子追踪剂。
-配方为:30g Tris base144g glycine10gSDS将固体溶解于1L蒸馏水中。
2. 加速剂(stacking gel buffer)- 用于形成凝胶中的聚集堆积层(stacking layer)。
-配方为:30g Tris base (pH 6.8)144g glycine1gSDS将固体溶解于1L蒸馏水中,并调整pH至6.8四、样品处理缓冲液配方:1. 样品加载缓冲液(sample loading buffer)-用于处理蛋白样品,以便在凝胶上获得良好的分离效果。
-配方为:0.5M Tris-HCl(pH 6.8)20%(v/v)甘油10%(w/v)SDS0.05%(w/v)溴酚蓝(bromophenol blue)旋转混合并加入蛋白样品。
五、凝胶染色溶液配方:1. 吸附性染色剂(Coomassie blue staining solution)-用于染色聚丙烯酰胺凝胶上分离的蛋白质。
SDS-PAGE配方
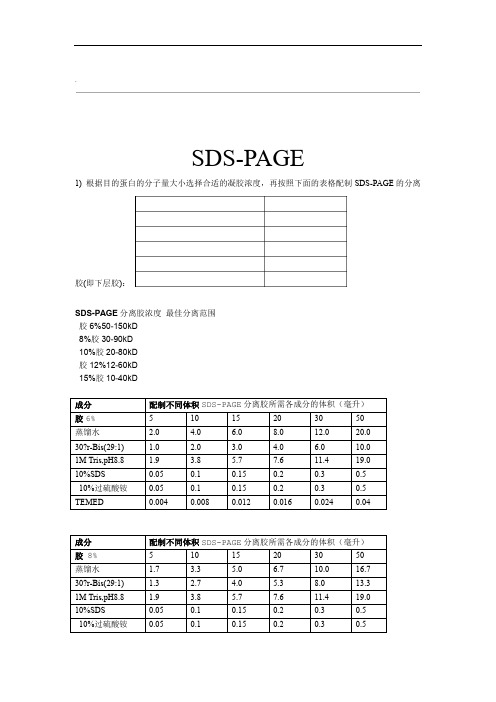
.SDS-PAGE1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):SDS-PAGE分离胶浓度最佳分离范围胶6%50-150kD8%胶30-90kD10%胶20-80kD胶12%12-60kD15%胶10-40kD.'.成分分离胶所需各成分的体积(毫升)配制不同体积SDS-PAGE胶。
即可配制成非变性注:如果配制非变性胶,参考上述配方,不加10%SDSPAGE 冰箱放两周,但是最好新鲜配置效果好。
10%过硫酸铵配好后可以在4D :(也称堆积胶、积层胶或上层胶)按照如下表格配制SDS-PAGE的浓缩胶1)1L电泳缓冲溶液5XTris-Glycine0.5% W/V SDS ,1.25M Glycine 0.125M Tris,Tris 15.1 gGlycine 95 gSDS 5.0 g.'.5X SDS-PAGE 加样缓冲液:5ml250mM Tris-HCl (pH6.8), 10% SDS, 0.5% BPB, 50% glycerol, 5% 2-ME 1M Tris-HCl (pH6.8): 1.25 mLSDS:0.5 gBPB: 25mgGlycerol: 2.5ml2-ME: 使用时加入小份(25微升),新鲜使用。
TBST 缓冲液每2L体积中含:1M TrisHCL(pH7.5) 100mLNacl 16g0.4g KCL1ml吐温1)抗体去除液50mL抗体去除液中含:每6.25mL pH6.80.5M TrisHCL()10mL 10%SDS0.175mL Beta-ME33.75mL 水.'.SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
SDS-PAGE分离胶配方表-及其原理

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=,pK a=只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
SDSPAGE试剂配方

SDS-PAGE电泳所用溶液:30 %聚丙烯酰胺溶液(100 mL)丙烯酰胺(Arc) 29 gN,N’-亚甲双丙烯酰胺(Bis) 1 g用双蒸水定容至100mL,过滤备用,4℃存放丙稀酰胺29.2g,N-N-甲叉双丙稀酰胺0.8g,加入去离子水定容至100mL,pH值不能超过7.0,过滤于棕色玻璃瓶中4℃贮存。
5×Tris-甘氨酸缓冲液(1 L)Tris碱15.1 g甘氨酸(电泳级) 94 g10 %SDS 50 mL使用时稀释5倍使用2×SDS凝胶加样缓冲液(10mL)0.5 mol/L Tris-Cl (pH 6.8) 2 mL10%(W/V)SDS 4 mL甘油 2 mLβ-巯基乙醇 1.0 mL(DTT(二硫苏糖醇)0.31g)溴酚兰0.02g双蒸水0.5 mL室温存放备用考马斯亮蓝染色液考马斯亮蓝R-250 (G-250) 1.0 g甲醇450 mL冰醋酸100 mLddH2O 450 mL0.2g考马斯亮蓝R250+84mL 95%乙醇+20mL冰醋酸,定容至200mL,过滤备用考马斯亮蓝脱色液(甲醇脱色液效果好,但有毒性)甲醇100 mL冰醋酸100 mLddH2O 800 mL医用酒精:冰醋酸:水=4.5:0.5:5(V:V:V)SDS-PAGE所需溶液:A液——30%丙稀酰胺(W/V):丙稀酰胺29.2g,N-N-甲叉双丙稀酰胺0.8g,加入去离子水定容至100mL,pH值不能超过7.0,过滤于棕色玻璃瓶中4℃贮存。
B液——1.5mol/L Tris·HCl,pH8.8:18.17g(9.09g)Tirs碱,溶于80mL(40mL)去离子水中,加入约3mL(1.5mL)以上的浓盐酸调节pH值至8.8,定容至100mL(50mL)。
C液——1.5mol/L Tris·HCl,pH6.8:12.1g(6.05g)Tirs碱,溶于80mL(40mL)去离子水中,加入约7mL(3.5mL)以上的浓盐酸调节pH 值至6.8,定容至100mL(50mL)。
SDS-PAGE电泳试剂配制

SDS-PAGE电泳试剂配制SDSPAGE 电泳试剂配制SDSPAGE 电泳(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离和分析技术。
在进行 SDSPAGE 电泳实验时,准确配制各种试剂是获得可靠实验结果的关键。
下面,让我们详细了解一下SDSPAGE 电泳试剂的配制方法。
首先,我们来看看分离胶缓冲液的配制。
分离胶缓冲液一般是 15M TrisHCl(pH 88)。
要配制 100ml 的这种缓冲液,我们需要称取 1817g Tris 碱,加入约 80ml 去离子水,用浓盐酸调节 pH 值至 88。
这一步需要耐心和细心,因为 pH 值的准确性对电泳结果影响很大。
调节好 pH 后,将溶液定容至 100ml。
接下来是浓缩胶缓冲液,通常是 10M TrisHCl(pH 68)。
同样配制100ml,称取 1211g Tris 碱,加入约 80ml 去离子水,用浓盐酸调 pH 至68,最后定容至 100ml。
然后是 30%丙烯酰胺溶液。
这是 SDSPAGE 电泳中非常重要的试剂。
配制 100ml 该溶液,需要称取 29g 丙烯酰胺和1g N,N’亚甲双丙烯酰胺,用去离子水溶解后定容至 100ml。
丙烯酰胺是有毒物质,在配制和使用过程中要特别小心,避免接触皮肤和吸入粉末。
SDS 溶液的配制也不容忽视。
一般是 10%(w/v)的 SDS 溶液。
称取 10g SDS,加入适量去离子水搅拌溶解,然后定容至 100ml。
还有 10%过硫酸铵溶液。
称取 1g 过硫酸铵,加入 10ml 去离子水,现配现用。
过硫酸铵溶液容易失效,所以每次使用前都要新鲜配制。
TEMED(四甲基乙二胺)在凝胶聚合过程中起到催化作用。
由于它挥发性强,使用时要注意迅速加入。
电泳缓冲液也是必不可少的。
一般使用的是 Tris甘氨酸缓冲液。
配制 1L 缓冲液,需要称取 303g Tris 碱、1877g 甘氨酸和 1g SDS,用去离子水溶解后定容至 1L。
SDS-PAGE电泳试剂配制

SDS-PAGE电泳试剂配制SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用的蛋白质分离技术,可以将蛋白质按照其分子量大小分离出来。
在这个过程中,需要使用一系列试剂来形成凝胶、还原并变性蛋白质样品、以及进行电泳。
下面我们将介绍SDS-PAGE电泳试剂的配制方法。
聚丙烯酰胺凝胶电泳胶液配制1. 蒸馏水将蒸馏水取2L,通过0.22μm的滤膜过滤3遍来除杂质,备用。
2. 均聚化溶液将40%(w/v)丙烯酰胺10mL,在干燥器中烘干2小时,然后加入蒸馏水固定容积至50mL。
将10%(w/v)N, N’-二甲基亚硫脲5mL加入均聚化溶液中,搅拌30分钟至完全溶解。
3. 凝胶制备将均聚化溶液加入10%(w/v)的三甲基丙烯酰氨基甲基纤维素,搅拌5分钟后加入0.1%TEMED等待至少1小时凝胶化。
4. 等电聚焦凝胶制备将均聚化溶液加入3.33%(w/v)等电聚焦剂,根据需要调节pH值,搅拌5分钟后加入氨基甲酸1mL,搅拌2分钟至完全溶解。
加入TEMED及APS,混合倒入制好的除尘洞中,并插入梳子。
至少1小时后移除梳子,使凝胶完全凝固。
蛋白样品处理试剂配制1. SDS缓冲液将10%SDS 1.25mL加入pH6.8的磷酸盐缓冲液(1M),加入蒸馏水固定容积至100mL,搅拌10分钟至SDS完全溶解,备用。
2. β-巯基乙醇将β-巯基乙醇400μL加入1mL磷酸盐缓冲液(1M),备用。
3. 样品缓冲液将10%SDS 100μL,β-巯基乙醇50μL加入磷酸盐缓冲液1mL中,加入蒸馏水固定容积至10mL,轻轻搅拌即可。
4. 热变性载入缓冲液将4倍浓度的样品缓冲液加入β-巯基乙醇,于100℃水浴中加热5分钟。
冷却至室温,即可使用。
电泳相关试剂配制1. 电泳缓冲液将磷酸盐缓冲液1L加入SDS 10g进行混合后,加入蒸馏水将其固定至2L,备用。
2. Anode buffer将磷酸盐缓冲液1L加入SDS 5g进行混合后,加入蒸馏水将其固定至2L,备用。
SDS-PAGE分离胶配方表-及其原理

SDSPAGE电泳本理:之阳早格格创做散丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 战接联剂N,N’—亚甲基单丙烯酰胺(简称Bis)正在催化剂效率下,散合接联而成的具备网状坐体结构的凝胶,并以此为收援物举止电泳.散丙烯酰胺凝胶电泳可根据分歧蛋黑量分子所戴电荷的好别及分子大小的分歧所爆收的分歧迁移率将蛋黑量分散成若搞条区戴,如果分散杂化的样品中只含有共一种蛋黑量,蛋黑量样品电泳后,便应只分散出一条区戴.SDS是一种阳离子表面活性剂能挨断蛋黑量的氢键战疏火键,并按一定的比率战蛋黑量分子分散成复合物,使蛋黑量戴背电荷的量近近超出其自己本有的电荷,掩盖了百般蛋黑分子间天然的电荷好别.果此,百般蛋黑量SDS 复合物正在电泳时的迁移率,没有再受本有电荷战分子形状的效率,而不过棒少的函数.那种电泳要领称为SDS散丙烯酰胺凝胶电泳(简称SDS—PAGE).由于SDSPAGE 可设法将电泳时蛋黑量电荷好别那一果素与消大概减小到不妨略而没有计的程度,果此常常使用去审定蛋黑量分散样品的杂化程度,如果被审定的蛋黑量样品很杂,只含有一种具三级结构的蛋黑量大概含有相共分子量亚基的具四级结构的蛋黑量,那么SDS—PAGE 后,便只出现一条蛋黑量区戴. TEMED:通过催化过硫酸铵产死自由基而加速丙烯酰胺与单丙烯酰胺的散合.过硫酸铵(AP):提供启动丙烯酰胺与单丙烯酰胺所必须的自由基.SDS—PAGE 可分为圆盘状战笔曲板状、连绝系统战没有连绝系统.本真验采与笔曲板状没有连绝系统.所谓“没有连绝”是指电泳体系由二种大概二种以上的缓冲液、pH 战凝胶孔径等所组成.正在没有连绝电泳系统中,含有上、下槽缓冲液(Tris—Gly,pH8.3)、浓缩胶缓冲液(Tris—HCl,pH6.8)、分散胶缓冲液(Tris—HCl,pH8.8),二种凝胶的浓度(即孔径)也没有相共.正在那种条件下,缓冲系统中的HCl 险些局部解离成Cl-,二槽中的Gly (pI=6.0,pK a=9.7)惟有很少部领会离成Gly 的背离子,而酸性蛋黑量也可解离出背离子.那些离子正在电泳时皆背正极移动.C1—速度最快(开始离子),其次为蛋黑量,Gly 背离子最缓(尾随离子).由于C1—很快超出蛋黑离子,果此正在其后里产死一个电导较矮、电位梯度较陡的地区,该区电位梯度最下,那是正在电泳历程中产死的电位梯度的没有连绝性,引导蛋黑量战Gly 离子加快移动,截止使蛋黑量正在加进分散胶之前,快、缓离子之间浓缩成一薄层,有好处普及电泳的辨别率.蛋黑量离子加进分散胶后,条件有很大变更.由于其pH 降下(电泳举止常常超出9.0),使Gly 解离成背离子的效力减少;共时果凝胶的浓度降下,蛋黑量的泳动受到效率,迁移率慢遽下落.此二项变更,使Gly 的移动超出蛋黑量,上述的下电压梯度没有复存留,蛋黑量便正在一个较均一的pH 战电压梯度环境中,按其分子的大小移动.分散胶的孔径有一定的大小,对于分歧相对于分子品量的蛋黑量去道,通过时受到的阻滞程度分歧,纵然洁电荷相等的颗粒,也会由于那种分子筛的效力,把分歧大小的蛋黑量相互分启.SDSPAGE电泳胶配造:SDSPAGE试剂配造:。
(完整版)SDS-PAGE分离胶-浓缩胶配方

SDS-PAGE1、SDS-PAGE:聚丙烯酰胺凝胶电泳2、Acr:丙烯酰胺;配胶时用30%Acr(质量比Acr:Bis=29:1)3、Bis:甲叉双丙烯酰胺4、DDW:超轻水5、SDS:十二烷基硫酸/磺酸钠,阴离子去污剂(配胶时用10%)6、APS:过硫酸铵NH4S2O4配胶时用10%7、TEMED:四甲基乙二胺,促凝剂8、Tris-Hcl:3羟基氨基甲烷盐酸缓冲液,配胶时(分离胶ph=8.8,浓缩胶ph=6.8)9、DTT:二硫苏糖醇,DTT也常常被用于蛋白质中二硫键的还原,可用于阻止蛋白质中的半胱氨酸之间所形成的蛋白质分子内或分子间二硫键。
10、IMA:碘乙酰胺,碘代乙酰胺用于有机合成,在蛋白组学中组氨酸和半胱氨酸的烷基化试剂,用于多肽测序以及酶抑制剂等,蛋白组学级试剂。
CH>2ICONH>2,是和碘乙酸一样,可通过下列反应不可逆地抑制SH酶类的物质。
1)根据目的蛋白的分子量大小选择合适的凝胶浓度,再按照下面的表格配制SDS-PAGE的分离胶(即下层胶):注:如果配制非变性胶,参考上述配方,不加10%SDS即可配制成非变性PAGE胶。
1)按照如下表格配制SDS-PAGE的浓缩胶(也称堆积胶、积层胶或上层胶):TBST 缓冲液每2L体积中含:1)抗体去除液每50mL抗体去除液中含:SDS-PAGE电泳的基本原理:SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基硫酸钠),SDS会与变性的多肽,并使蛋白带负电荷,由于多肽结合SDS的量几乎总是与多肽的分子量成正比而与其序列无关,因此SDS多肽复合物在丙稀酰胺凝胶电泳中的迁移率只与多肽的大小有关,在达到饱和的状态下,每克多肽可与1.4g去污剂结合。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
sds-page中浓缩胶和分离胶工作原理

sds-page中浓缩胶和分离胶工作原理SDS-PAGE(聚丙烯酰胺凝胶电泳)是一种常用于蛋白质分离和定量的方法。
它通过将蛋白质样品在聚丙烯酰胺凝胶中的电泳来实现蛋白质分离。
SDS-PAGE中的关键步骤包括制备胶液、制备样品和运行凝胶电泳。
其中,浓缩胶和分离胶是SDS-PAGE中的两个关键组分,下面将分别详细介绍它们的工作原理。
浓缩胶是SDS-PAGE中的第一个凝胶。
其主要作用是将样品中的蛋白质浓缩在一个较小的体积中,从而提高蛋白质的负载量。
浓缩胶通常是由较高浓度的聚丙烯酰胺凝胶制成。
制备浓缩胶的步骤如下:1.根据需要的凝胶浓度和厚度,将适量的丙烯酰胺和交联剂加入缓冲液中,得到聚合物化合物。
2.将聚合物化合物倒入凝胶模具中,加入推荐量的TEMED和过硫酸铵(APS),使聚合反应开始。
3.反应后,将浓缩胶从模具中取出,并用缓冲液冲洗浓缩胶,以去除未反应的物质。
浓缩胶的工作原理是通过聚合物网状结构的形成,将蛋白质限制在凝胶中。
聚合物中包含交联剂,能够在聚丙烯酰胺分子之间产生交联反应,形成一个三维的网状结构。
蛋白质样品中的SDS(十二烷基硫酸钠)和化学试剂在电泳过程中会与聚合物发生作用,使蛋白质分子展开并与聚合物的分子结合。
这样,蛋白质就被限制在凝胶内部,无法自由迁移。
分离胶是SDS-PAGE中的第二个凝胶,也是用来实现蛋白质分离的关键步骤。
分离胶的主要作用是根据蛋白质的大小和电荷特性,将蛋白质样品分离成不同的带状条纹。
分离胶通常是由较低浓度的聚丙烯酰胺凝胶制成。
制备分离胶的步骤如下:1.根据需要的凝胶浓度和厚度,将适量的丙烯酰胺和交联剂加入缓冲液中,得到聚合物化合物。
2.将聚合物化合物倒入凝胶模具中,加入推荐量的TEMED和过硫酸铵(APS),使聚合反应开始。
3.反应后,将分离胶从模具中取出,并用缓冲液冲洗分离胶,以去除未反应的物质。
分离胶的工作原理是通过改变凝胶的孔隙结构来实现蛋白质的分离。
在分离胶中,聚丙烯酰胺凝胶网状结构相对较松散,有更多的孔隙。
SDSPAGE凝胶配方及制胶

SDS-PAGE 凝胶配方及制胶12%分离胶试剂5ml 8ml 10ml 15ml 25ml30ml 60ml 90ml 120ml 30%Acr-Bis (ml ) 2 3.2 4610122436 48 1.5M Tris-HCl PH8.8(ml ) 1.25 2 2.5 3.75 6.25 7.5 15 22.5 30 ddH2O (ml ) 1.65 2.64 3.3 4.95 8.25 9.9 19.8 29.7 39.6 10%SDS (ul ) 50 80 100 150 250 300 600 900 1200 10%APS (ul ) 50 80100 150 250300 600 900 1200 TEMED (ul ) 3 4.8 6 9 15 18 36 54 725%浓缩胶试剂4ml 6ml 8ml 12ml 16ml 20ml 24ml 36ml 48ml 30%Acr-Bis (ml ) 0.66 0.99 1.32 1.98 2.64 3.3 3.96 5.94 7.92 1M Tris-HCl PH6.8(ml ) 0.5 0.75 1 1.5 22.5 34.56ddH2O (ml ) 2.74 4.14 5.48 8.28 11.02 13.7 16.56 24.84 33.12 10%SDS (ul ) 40 60 80 120 160 200 240 360 480 10%APS (ul ) 40 60 80 120 160 200 240 360 480 TEMED (ul )4681216202436481、按顺序加溶液,每加完一个溶液摇匀一下。
2、TEMED 要在通风橱中加,加入后混匀30秒左右后再注胶;吸打时枪头不出液面,以减少气泡3、分离胶配好后要用水封顶,聚合至少40min (也可聚合一夜)4、加入浓缩胶后插梳子(要洗干净),梳子倾斜插入,避免产生气泡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SDS-PAGE电泳原理:
聚丙烯酰胺凝胶是由丙烯酰胺 (简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应
在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=,pK a=只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。
这些离子在电泳时都向正极移动。
C1—速度最快(先导离子),其次为蛋白质,Gly 负离子最慢(尾随离子)。
由于C1—很快超过蛋白离子,因此在其后面形成一个电导较低、电位梯度较陡的区域,该区电位梯度最高,这是在电泳过程中形成的电位梯度的不连续性,导致蛋白质和Gly 离子加快移动,结果使蛋白质在进入分离胶之前,快、慢离子之间浓缩成一薄层,有利于提高电泳的分辨率。
2.分子筛效应
蛋白质离子进入分离胶后,条件有很大变化。
由于其pH 升高(电泳进行时常超过,使Gly 解
离成负离子的效应增加;同时因凝胶的浓度升高,蛋白质的泳动受到影响,迁移率急剧下降。
此两项变化,使Gly 的移动超过蛋白质,上述的高电压梯度不复存在,蛋白质便在一个较均一的pH 和电压梯度环境中,按其分子的大小移动。
分离胶的孔径有一定的大小,对不同相对分子质量的蛋白质来说,通过时受到的阻滞程度不同,即使净电荷相等的颗粒,也会由于这种分子筛的效应,把不同大小的蛋白质相互分开。
SDS-PAGE电泳胶配制:
SDS-PAGE试剂配制:。
