清凉含片质量标准草案
15质量标准草案及起草说明

一、规格 0.2g(相当于原总药材 0.2g)质量标准草案复方苦木消炎胶囊Fufang Kumu Xiaoyan Jiaonang【处方】穿心莲 100g 苦木 100g【制法】以上二味,穿心莲加水煎煮二次,每次 2 小时,合并煎液,滤过,滤液浓缩成稠膏;苦木粉碎成粗粉,照流浸膏剂与浸膏剂项下的渗漉法(中国药典 2000年版一部附录 I O),用乙醇作为溶剂,缓缓渗漉,漉液回收乙醇,浓缩成稠膏。
将上述二种稠膏混匀,干燥,粉碎,过筛,加辅料适量,制成颗粒,装成 1000 粒胶囊,即得。
【性状】本品内容物为褐绿色粉末或颗粒;味苦。
【鉴别】(1)取本品 10 粒,去囊壳,研细,加乙醇 30ml,加热回流 15 分钟,滤过,滤液照下述方法试验:( 1.1)取上述滤液的一半,蒸干,残渣加 1%盐酸溶液适量使溶解,滤过,取滤液分置二支试管中,一管滴加碘化铋钾试液 1~2 滴,生成橘红色沉淀,另一管滴加碘化汞钾试液 1~2 滴,生成黄白色沉淀。
(1.2)取上述滤液的另一半,加活性炭适量,温热,滤过,滤液供下列试验:①取滤液 2ml,滴加 2%3,5-二硝基苯甲酸的甲醇溶液及 5%氢氧化钾溶液各 2 滴,即显紫红色。
②取滤液 2ml,加固体氢氧化钾 1 小粒,振摇后,溶液显橘红色。
(2)取本品 10 粒,去除囊壳,将内容物研细,混匀,称粉末1g,加甲醇 10ml,冷浸过夜,滤过,滤液蒸干,残渣加甲醇 1ml 使溶解,作为供试品溶液。
另取苦木药材 1g,加甲醇 10ml,冷浸过夜,滤过,滤液蒸干,残渣加甲醇 1ml 使溶解,作为对照药材溶液。
吸取上述两种溶液各10μl,照薄层色谱法(中国药典 2000 年版一部附录 VI B )试验,分别点于同一以羧甲基纤维素钠为粘合剂的硅胶 G 薄层板上,以氯仿-甲醇( 17:3)为展开剂,展开,取出,晾干,喷以改良碘化铋钾试液,供试品色谱中,在与对照药材色谱相应的位置上,应显相同颜色的斑点。
喉咽清含片质量标准研究

酯 一乙醇( 1 为展 开剂 , 4: ) 展开 , 取出 , 晾干 , 以香 草醛硫 喷
膝、 车前草为本品处方中主药 , 齐墩果 酸为其主要有效成分 , 测定该制剂 中齐墩果酸 的含量 , 可有效控制本 品的质量。
Su yO eQu lySa d r o u a qn u c l a lt td it a t tn a dfrHo y n igB ca be lh i T
李娟 肖志 勇 , , 朱绍雄
( . 南医药 工业研 究所 , 1湖 湖南 长沙 4 0 1 ;. 10 4 2 长沙 医学 院 , 湖南 长 沙 40 1 ) 10 6
ro , eb ameii a dcmmo ap s m ota dla T w r d nie yT C. e o ca i nHB a lod tr n d o t J rak l r sn o d ncr ei ro fi HB eeie t db L Ola l cdi T w sas eemie u n e n i f n i
mO ap s m o ta d l a o l e dfe e t t d q ai t ey b L B c r e i ro e c ud b i rn i e u l ai l y T C.T e l e r r n e o l a oi cd w s 1 0 8—6 0 8 g u n f a t v h i a a g o e n l a i a . 0 n f c . 4 .
1 仪器与试药
酸 乙醇试液 , 15o 热至 斑点 显色 清晰 。供试 品 色谱 在 0 C加 中, 与对照药材色谱相应的位置上 , 在 显相同的颜色的斑点,
薄荷含片的工艺研究

薄荷含片的工艺研究薄荷含片是一种将薄荷精油包裹在含片中,供人口腔保健和味觉刺激的产品。
它具有口香清新、解渴止咳、去腥抑菌等作用,深受人们喜爱。
下面我将介绍薄荷含片的工艺研究。
薄荷含片的工艺研究主要包括薄荷精油提取、含片制备以及品质评估等环节。
首先是薄荷精油的提取。
薄荷精油是薄荷含片的主要原料之一,它是通过蒸馏法从薄荷叶中提取而来。
传统的薄荷精油提取方法包括水蒸气蒸馏法和水浸提法。
蒸馏法是将薄荷叶放入蒸馏釜中,加热蒸馏,通过冷凝收集薄荷精油。
水浸提法是将薄荷叶浸泡在水中,通过水的溶解作用将薄荷精油溶解入水中,然后用油水分离方法分离薄荷精油。
近年来,随着技术的发展,还出现了超临界流体提取法、微波辅助提取法等新的提取方法,以提高薄荷精油的提取效率和质量。
接下来是含片的制备。
含片是薄荷精油的载体,主要由黏合剂、甜味剂、分散剂、增稠剂等成分组成。
制备含片的关键是黏合剂的选择和含片的加工工艺。
常用的黏合剂有明胶、木聚糖、羟丙基甲基纤维素、硬脂酸甘油酯等。
选择合适的黏合剂可以使含片具有良好的黏附性和溶解性,增强薄荷精油的释放效果。
制备过程中需要进行逐层混合、浇注、成型、干燥等步骤,确保含片质量的稳定和可控。
最后是品质评估。
对薄荷含片的品质进行评估是工艺研究的重要环节之一。
常见的评估指标包括含片的外观、口感、溶解度、释放性能、储存稳定性等。
外观评估主要包括形状、颜色、纹理等方面,要求含片外观整齐、色泽均匀。
口感评估重点考察含片的口腔黏附性、溶解速度等指标,要求含片具有适宜的口腔黏附性和溶解速度,使口腔黏膜能够充分接触到薄荷精油。
溶解度评估主要通过溶解试验来确定。
释放性能评估通过嗅觉和口感评价,研究薄荷精油的释放动力学和持续时间。
储存稳定性评估要求含片在储存过程中不发生质量变化,保持其功能和品质。
综上所述,薄荷含片的工艺研究包括薄荷精油提取、含片制备以及品质评估等环节。
通过合理的工艺研究和优化,可以制备出品质优良的薄荷含片,满足人们口腔保健和口感需求。
喉疾灵口含片质量标准研究

喉疾灵口含片质量标准研究背景介绍喉疾灵口含片是一种常用于缓解喉咙疼痛和口腔异味的中成药。
由于其良好的临床疗效,喉疾灵口含片被广泛应用于临床。
但是,众所周知,口腔黏膜是人体吸收药物的一个主要通道,药物的质量差异可能对人体造成严重的毒副作用。
因此,制定和严格执行喉疾灵口含片的标准是非常必要的。
质量标准的制定喉疾灵口含片的质量标准应该包含哪些方面呢?外观质量外观是影响药品质量的关键因素之一。
喉疾灵口含片的外观应该符合以下要求:1.颜色一致:喉疾灵口含片颜色应该均一一致,没有色差;2.形状规整:喉疾灵口含片形状应该规整,不应该有破裂、翘边或裂口;3.无异物:喉疾灵口含片不应该有外来物质、杂质或异物;4.无粘连:喉疾灵口含片不应该有粘连或受潮。
理化质量理化质量主要是指化学成分和物理性质。
喉疾灵口含片的理化质量应该符合以下要求:1.主要成分含量一致:喉疾灵口含片中主要成分的含量应该符合药典规定,不得偏离过多;2.PH值稳定:喉疾灵口含片的PH值应该稳定且符合规定值范围;3.含水量符合规定:喉疾灵口含片应该符合药典规定的含水量标准;4.溶度符合规定:喉疾灵口含片应该符合药典规定的溶度标准。
微生物学质量微生物污染是对人体健康极其有害的。
为了避免喉疾灵口含片被微生物污染,应该要求:1.细菌总数符合规定:喉疾灵口含片应该符合药典规定的细菌总数标准;2.真菌和酵母符合规定:喉疾灵口含片应该符合药典规定的真菌和酵母标准;3.病毒标准符合规定:喉疾灵口含片应该符合药典规定的病毒标准。
质量保证措施为了保证喉疾灵口含片的质量,应该采取以下措施:1.加强原材料的质量监督:严格按照国家药典要求控制进货原材料,检验合格后方可使用;2.加强生产环节的管控:严格按照GMP的要求进行生产,对每一批生产的喉疾灵口含片进行严格的检验;3.加强产品的复检:对已经生产的喉疾灵口含片进行复检,对不合格的产品进行处置和追溯。
总结喉疾灵口含片是一种广泛应用于临床的中成药,为了保障它的质量,需要制定严格的质量标准。
TCNHFA 111.187-2023 保健食品用原料薄荷团体标准 起草说明

保健食品用原料薄荷团体标准起草说明本标准研究制定的主要依据是GB/T1.1—2020《标准化工作导则第1部分:标准化文件的结构和起草规则》、保健食品用原料团体标准编制通则、《中华人民共和国药典》2020年版一部及四部、GB2762《食品安全国家标准食品中污染物限量》、GB2763《食品安全国家标准食品中农药最大残留限量》、GB16740《食品安全国家标准保健食品》、GB2761《食品安全国家标准食品中真菌毒素限量》等标准文件;本标准研究制定充分体现“科学性、先进性、实用性、规范性和环保性”的原则;本标准收载的检验项目及技术要求均参照上述标准文件转化而来。
1.范围薄荷收载于原卫生部关于进一步规范保健食品原料管理的通知(卫法监发[2002]51号)文附件1.既是食品又是药品的物品名单。
本标准适用于保健食品用原料薄荷。
薄荷,拉丁名:MenthaeHaplocalycisHerba,确定该名称的依据为参照《中华人民共和国药典》2020年版一部薄荷药材标准。
2.技术要求2.1来源:本标准规定的来源为唇形科植物薄荷Me〃妨α∕zαp∕ocα∕yxBriq.的干燥地上部分。
夏、秋二季茎叶茂盛或花开至三轮时,选晴天,分次采割,晒干或阴干。
确定其来源的依据为参照《中华人民共和国药典》2020年版一部薄荷药材标准。
2.2感官要求:本标准规定的感官要求包括色泽、气味与滋味、形态。
确定上述要求的依据为参照《中华人民共和国药典》2020年版一部薄荷药材标准【性状】项,检验方法按标准正文规定的方法测定。
2.3理化指标:本标准规定的理化指标包括水分、灰分、酸不溶性灰分、铅、总碑、总汞和农药残留限量。
水分、灰分两项指标为必设指标。
确定水分和灰分指标及其限度的依据为参照《中华人民共和国药典》2020年版一部薄荷药材标准【检查】项,检验方法按标准正文规定的方法测定。
酸不溶性灰分为非必设指标。
酸不溶性灰分是对薄荷中不溶于酸的无机成分总量进行测定,对控制药材的杂质限度和提高药材纯净度方面有着非常重要的作用。
清凉润喉片含量测定方法

司) ; 色 谱 甲醇 ( 天 津市 康 科德 科 技有 限 公 司 ) ; 乙腈 ( 国 药集 团化 Y = 3 4 6 2 8 4 9 X 一 2 9 9 8 1 , R = I结 果 表 明 , 栀 子 苷 在 0 . 3 1 6 g一
学 试 剂 有 限公 司 ) ; 栀子苷标准品( 中 国药 品 生 物 制 品检 定 所 提 3 . 1 6 0 g 范 围 内呈 现 良好 的 线 性 关 系 。结 果 见 表 1 。 以进 样 量 供批号 2 0 1 1 0 9 0 1 ) ; 清 凉润 喉 片 ( 本 实 验 室制 备 批号 2 0 1 1 1 1 1 8 ) 。 1 . 2仪器 : 福立 F L 2 2 0 0 I I 高效 液 相 色 谱仪 ( 浙江 福 立 分 析仪 器 有 限公 司 ) ; A B 1 3 5 一 s 电子 天平 和 A L 2 0 4电子 天平 ( 梅特 勒 一托 利
X I L ) 2 多 仪器 有 限公 司 ) ; K Q 一 2 5 0 D A型数 控 超声 波清 洗 器 ( 昆 山市 超 V(
( g ) 为横 坐 标 , 峰面 积 ( A) 为 纵坐 标 , 绘 制标 准 曲线 , 见图 3 。
表 1 栀 子 苷 标 准 曲线 数 据 4 6 8 1 0 1 5 2 0 M( m g )O . 3 1 6 0 . 6 3 2 0 . 9 4 8 1 . 2 6 4 1 . 5 8 0 2 . 3 7 0 3 . 1 6 0
2 . 2 溶液 的制 备
图 3 栀 子 苷 标 准 曲 线
3 . 4精 密 度 试 验 : 样 品液 配 制 同 “ 对照 品溶 液 的制 备 ” 和“ 供 试 品 溶 液的 制备 ” 。 用微 孑 L 滤膜 过滤 , 弃去 初 滤液 , 收集续 滤 液 。 分 别精 密 吸取 1 0 L对 照品溶 液 和供 试 品溶液 测定 , 重 复 测定 6 次 。测 得 对照 品 中栀 子苷 峰面 积 R S D为 1 . 1 5 %, 供试 品 中栀 子 苷峰 面积 S D为 1 . 1 1 %。 结果 表 明 , 本方 法 的精密度 较好 , 测 定结 果见 表 2 。 5 0 %乙 醇 4 m L, 称重, 超声 处 理 1 5 m i n , 放冷 , 再 称定 重 量 , 用5 0 % R 表 2 精 密 度 试 验 数 据 甲醇 补 足 减 失 的重 量 , 摇匀 , 再 加入 l m L流 动 相 溶 液 , 摇匀, 滤 序 号 1 2 3 4 5 6 过, 精 密 吸取 1 O L , 注 入 高效 液 相 色谱 仪进 行 测定 。 3 5 5 6 7 0 5 5 4 0 2 1 0 5 4 1 0 3 7 1 5 4 2 8 7 0 7 5 4 2 4 6 1 9 5 3 8 8 8 8 1 2 . 2 - 3 测定法 : 精 密 吸取 栀 子 苷标 准 品溶 液 和 供试 液 各 1 0 L , 分 标准 品峰面积 5 样品峰 面积 2 4 1 7 4 3 3 2 4 5 2 2 9 7 2 4 2 5 7 6 3 2 4 5 7 2 7 8 2 4 4 4 5 3 6 2 4 9 4 2 6 4 别注 入 高 效 液 相 色谱 仪 。标 准 品溶 液 和供 试 品溶液 H P L C色 谱 3 . 5 重 复性 试验 : 取 同一批 号 清凉 润 喉 片样 品 6份 , 样 品液 制 备 图见 图 1 和图 2 。 同“ 供试 品溶液 的制备 ” , 用 微 孔 滤膜 过 滤 , 弃 去 初 滤液 , 收集 续 滤液, 分 别 进样 1 O L , 得栀 子 苷峰 面 积 的 R S D为 1 . 1 7 %。结 果 表 明, 本 方 法 的重 复性 较好 , 结 果 见表 3 。 2 . 2 . 1 对 照 品溶 液 的 制备 : 精密称取栀子苷标准品 0 . 7 9 m g , 置 于 5 m L容 量 瓶 中 , 用 流动 相 定容 , 摇 匀 即得 , 浓度 为 0 . 1 5 8 m g / m L 。 2 . 2 . 2供 试 品溶 液 的 制 备 : 精密称取清凉润喉片约 2 g , 加 蒸 馏 水 1 0 m L溶 解 , 过滤 , 取 滤 液 置 具塞 锥 形 瓶 中 , 水 浴蒸 干 , 精 密 加 入
清喉咽含片成型工艺的研究

2024年银行从业资格考试个人贷款押题在银行从业资格考试中,个人贷款是一个重要的考点。
为了帮助大家更好地备考,以下是一些精心整理的押题,希望能对大家有所帮助。
一、个人贷款的基本概念1、个人贷款的定义和特点个人贷款是指银行或其他金融机构向符合条件的自然人发放的用于个人消费、生产经营等用途的本外币贷款。
其特点包括:贷款品种多、用途广;贷款便利;还款方式灵活等。
2、个人贷款的分类按照产品用途,可分为个人消费类贷款和个人经营类贷款;按照担保方式,可分为信用贷款、担保贷款(包括保证贷款、抵押贷款、质押贷款)等。
二、个人贷款的受理与调查1、贷款申请的受理客户需要提交的申请材料通常包括个人身份证明、收入证明、贷款用途证明等。
银行工作人员要对申请材料进行初步审查,确保材料的完整性和规范性。
2、贷前调查包括对借款人基本情况、收入情况、信用状况、贷款用途等方面的调查。
调查方式包括面谈、电话调查、实地考察等。
三、个人贷款的风险评估与审批1、风险评估主要评估借款人的信用风险、市场风险、操作风险等。
常用的评估方法包括信用评分模型、风险评级等。
2、贷款审批审批人员要根据风险评估结果,结合银行的信贷政策和相关规定,决定是否批准贷款以及贷款的额度、利率、期限等条件。
四、个人贷款的合同签订与发放1、合同签订贷款获批后,银行与借款人签订贷款合同,明确双方的权利和义务。
合同条款包括贷款金额、利率、还款方式、违约责任等。
2、贷款发放银行按照合同约定的方式将贷款资金发放给借款人。
五、个人贷款的贷后管理1、贷后检查定期对借款人的还款情况、贷款用途等进行检查,及时发现潜在风险。
2、贷款风险分类根据借款人的还款情况和风险状况,将贷款分为正常、关注、次级、可疑和损失五类。
3、贷款本息回收督促借款人按时还款,对逾期贷款进行催收。
六、个人住房贷款1、个人住房贷款的种类包括商业性个人住房贷款、住房公积金个人住房贷款和个人住房组合贷款。
2、个人住房贷款的流程从申请、审批、签订合同到发放贷款、贷后管理等环节的具体要求和操作要点。
四味清口含片的质量标准研究

四味清口含片的质量标准研究目的建立四味清口含片的质量控制标准。
方法采用薄层色谱法(TLC)定性鉴别四味清口含片中的桂心、甘草、细辛、广陈皮,采用高效液相色谱法(HPLC)测定四味清口含片中桂皮醛的含量。
色谱条件为Hypersil ODS(C18)色谱柱(4.6mm× 250mm,5μm),检测波长为290 nm,流动相为甲醇–φ=0.1 %磷酸水溶液(35∶65,v/v),流速为1.0mL/min,柱温为30℃,理论板数以桂皮醛峰计算不低于3000。
结果TLC法能分别检出四味清口含片中桂心(肉桂)、甘草、细辛、广陈皮,均具有良好的鉴别特征,阴性未见干扰;桂皮醛进样量在0.010~0.500μg 范围内与峰面积积分值线性关系良好,r=0.9999。
在精密度试验、稳定性试验、重复性试验中峰面积的相对标准偏差(RSD)分别为1.03%、1.27%、1.23%。
加样回收率为97.23%~101.54%,平均值为99.43%,RSD为0.99% (n=9)。
结论本方法具有良好的专属性和重现性,加样回收率试验符合要求,能准确、稳定地对四味清口含片进行定性鉴别和定量测定,可用于该制剂的质量控制。
[Abstract] Objective To establish the quality control standard of Siweiqing buccal tablets. Methods Thin layer chromatography (TLC)was used to identify Cortex Cinnamomi,radix glycyrrhizae,Citrus Chachiensis Hortorum and Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.)Kitag. in these tablets preparation. The high performance liquid chromatography (HPLC)was adopted to determine the content of cinnamaldehyde. The chromatographic conditions were as follows:the chromatographic column Hypersil ODS(C18)column (4.6mm×250mm,5μm),the detection wavelength of 290nm,the mobile phase of methanol–φ=0.1% phosphoric acid (35∶65,v/v),the flow velocity of 1.0mL/min,the column temperature at 30℃,the theoretical plate number no less than 3000. Results Citrus Chachiensis Hortorum,radix glycyrrhizae,Cortex Cinnamomi and Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.)Kitag. can be identified by TLC without interference of negative samples. The linear relationship between content of cinnamaldehyde and peak area was obtained during the range of 0.010-0.500μg,r=0.999 9. RSD’s found of the peak area for the precision test,the stability test and the repeatability test were 1.03%,1.27% and 1.23%,respectively. The recoveries of cinnamaldehyde obtained were in the range of 97.23%-101.54% and the average of 99.43% with RSD of 0.99% (n=9). Conclusion The method can be applied to qualitative identification and quantitative assay of Siweiqing buccal tablets with good reproducibility. The sampling recovery test is in compliance with the requirement. The quality standard can effectively control the quality of Siweiqing buccal Tablets with good specificity,reproducibility and stability. It can be applied to the quality control of Siweiqing buccal tablets.[Key words] Siweiqing buccal tablets;Quality standards;TLC;HPLC;Cinnamaldehyde;Content determination四味清口含片处方源于《华佗神方》,由桂心、甘草、细辛、广陈皮组成。
关于TTB口含片质量标准的分析方法与与验证

关于TTB口含片质量标准的分析方法与与验证本文主要建立TTB口含片质量标准的分析方法及验证。
分析项目包括:鉴别试验、限度检查、含量及其它成份测定,溶出度检查。
实验方法:分别采用紫外分光光度法、高效液相法和显色法鉴定,采用转篮法测定溶出度,采用HPLC法测定含量。
本文所确立的方法TTB口含片质量控制。
TTB(cifixime)又名世福素,是第一个上市的第三代口服头孢菌素,再其C7位上结合有苯甘氨酸类的基团,从而具备可口服吸收的结构,它具有抗菌谱广、抗菌作用强、有效浓度持续时间长等优点,在治疗各类感染中有较高的疗效。
该药物1987年由日本藤泽(fujisawa)公司开发,现已在全球二十多个国家上市,该药品被子列为我国“十五”推荐研究开发的重要头孢菌素品种及国家级化学医药新产品指南[12]据最近报道,2002年美国氰胺公司和日本藤泽公司的TTB销售额超过1.8亿美元。
我国1994年由广州白云山制药总厂在中国独家生产TTB并经多家医院的临床验证,治疗效果达到日本同类产品效果,现已在国内逐步推广使用,由于价格较贵,目前市场上占有率并不高。
但口服头孢菌素由于服用方便且经济实惠,因而深受医务人员和患者的欢迎。
我国目前口服第三代头孢菌素品种较少,TTB作为一代优秀的头孢菌素类新品种,具有很好的前景[1]目前我国头孢菌素生产业尚属于发展阶段,开发TTB新剂型、新工艺不仅有利于产品质量调整,而且可以增加竞争力,再不断开发国内市场的同时,以优质低价的产品参与国际竞争。
一、仪器与试剂仪器:高效液相色谱仪(Agilent 1100 series),智能药物溶出仪(RCZ-8A,天津大学精密仪器厂),754型紫外分光光度计(上海第三分析仪器厂),SC69-02C水分快速测定仪(上海恒平科学仪器有限公司),紫外扫描仪(Shimadzu岛津UV-260),电子天平ARZ140 Adventurer (OHAUS CORP.Florham NJ USA ),微量进样器50μl(上海高鸽工贸有限公司),精密PH计(PHS-3C上海雷磁仪器厂)试剂:磷酸(85% 武汉市化学试剂厂),盐酸(分析纯,信阳市化学试剂厂)10%四丁基氢氧化铵(分析纯中国医药(集团)上海化学试剂公司),甲醇(康科德,天津市康科德科技有限公司),纯净水(ICE DEW冰露武汉可口可乐饮料有限公司),氢氧化钠(分析纯天津市化学仪器供应站),磷酸二氢甲(分析纯天津市北方化玻购销中心),Methanol(HPLC grade Fisher Chemalert),Acetonitrile (HPLC grade Burdick&Jackson),TTB(购自广州白云山制药有限公司,批号kw060801)二、方法与内容1.性状本品原料的性状是淡黄色,辅料为白色,制成制剂后为浅黄色片。
复方青橄榄利咽含片质量标准

复方青橄榄利咽含片质量标准1. 引言多年来,复方青橄榄利咽含片一直是人们在治疗口腔疾病中常用的药物之一。
然而,众所周知,药品的质量标准直接影响着药效和安全性。
本文将从深度和广度的角度对复方青橄榄利咽含片的质量标准进行评估,帮助我们更好地了解这一药物。
2. 药品的生产和质量标准在开始介绍复方青橄榄利咽含片的质量标准之前,首先需要了解药品的生产和质量标准的重要性。
药品的生产过程包括原料采购、生产工艺、制剂工序等多个环节,而药品的质量标准则是对这些环节进行严格监控和要求的总称。
只有通过严格的质量标准,药品才能确保其安全、有效的使用。
3. 复方青橄榄利咽含片的质量标准复方青橄榄利咽含片是一种用于治疗口腔疾病的药物,其质量标准是确保其药效和安全性的重要保障。
在质量标准中,包括对原料的要求、生产工艺的规定、制剂的外观、理化指标、微生物限度等多个方面的规定。
这些规定的执行,直接关系到复方青橄榄利咽含片的药效和安全性。
4. 评估复方青橄榄利咽含片的质量标准针对复方青橄榄利咽含片的质量标准,我们需要从多个角度进行全面评估。
要从原料的采购和质量检验开始,保证原料的质量符合要求;对制剂工艺和生产环节进行审查,确保每一个工序的执行都符合标准;对成品进行全面的理化指标和微生物限度的检验。
只有通过全面评估,才能确保复方青橄榄利咽含片的质量。
5. 个人观点在我看来,复方青橄榄利咽含片的质量标准是确保其药效和安全性的关键。
只有严格执行各项质量标准,药物才能发挥其应有的作用,为病患提供有效的治疗。
我们每一位消费者都应该对药品质量标准进行关注,并选择符合规定的药品。
6. 总结与回顾通过本文的介绍和评估,我们对复方青橄榄利咽含片的质量标准有了更深入的了解。
我们了解了药品质量标准对药品的重要性;我们针对复方青橄榄利咽含片的质量标准进行了评估和讨论;我们分享了个人观点。
希望通过本文,读者能够更加了解和重视复方青橄榄利咽含片的质量标准。
通过本文的撰写,我们对复方青橄榄利咽含片的质量标准有了更深入的了解。
清凉含片的说明书

清凉含片的说明书日常生活中所说的五官是指眼鼻口耳喉,但是中医当中所说的五官却不是这么简单的了。
很多医院就设有五官科,但是如果细分的话可以分为耳鼻喉科和眼科,这些都是属于五官科的范畴。
目前治疗五官类疾病往往采用药物进行治疗,今天,我们为您推荐一种叫做清凉含片的药物,它对于五官疾病治疗效果显著。
【药品名称】通用名称:清凉含片商品名称:清凉含片拼音全码:qinglianghanpian【主要成份】薄荷、紫苏叶、葛根、乌梅肉、薄荷脑。
【性状】本品为椭圆形或圆形压制片,灰绿色;气清香,味甜。
【适应症/功能主治】清热解暑,生津止渴。
用于受暑受热,口渴恶心,烦闷头昏,咽喉肿痛。
【规格型号】1g*16s【用法用量】含化,一次2-4片。
【不良反应】尚不明确。
【禁忌】尚不明确。
【注意事项】1.饮食宜清淡。
2.不宜在服药期间同时服用滋补性中成药。
3.有高血压、心脏病、肝病、糖尿病、肾病等慢性病严重者、孕妇或正在接受其它治疗的患者,均应在医师指导下服用。
4.服药三天后症状未改善,并出现其他严重症状时应去医院就诊。
5.按照用法用量服用,小儿、年老体虚者应在医师指导下服用。
6.对本品过敏者禁用,过敏体质者慎用。
7.本品性状发生改变时禁止使用。
8.儿童必须在成人监护下使用。
9.请将本品放在儿童不能接触的地方。
10.如正在使用其他药品,使用本品前请咨询医师或药师。
【药物相互作用】如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。
【贮藏】密封,避光。
【包装】铝塑包装,每板8片,每盒2板。
【有效期】24 月【批准文号】国药准字Z22025034【生产企业】修正药业集团股份有限公司看完上述对于清凉含片的介绍,您是否对于该药物有了一个比较清晰的了解了呢?五官疾病不像其他疾病那么简单,五官对于人体的重要性是不言而喻的,它会直接对于生活造成影响,所以请及时治疗吧。
qingjingsu 清净秀素 纯天然酵素含片

蔬果纤维咀嚼片1:范围本标准规定了蔬果纤维咀嚼片的要求、生产加工过程卫生要求、实验方法、检验规则和标识、包装、运输、贮存和保质期。
本标准适合于以综合蔬果纤维素为主要原料,经食用酵母发酵、稀释、分散、浓缩、低温干燥、粉碎,再加入水果粉、甘草、乳糖、麦芽糊精、食品添加剂(麦芽糖醇、木糖醇、乳酸、薄荷脑、大茴香脑),经调配、混合、造粒、整粒、打锭、包装等工艺制成的果蔬纤维咀嚼片。
2:规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 191 包装储运图示标志GB 2023 食品添加剂乳酸GB 2760 食品安全国家标准食品添加剂使用标准GB 3862 食品添加剂天然薄荷脑GB 4789.2食品安全国家标准食品微生物学检验菌落总数测定GB 4789.3食品安全国家标准食品微生物学检验大肠菌群计数GB 4789.4食品安全国家标准食品微生物学检验沙门氏菌检验GB 4789.5食品安全国家标准食品微生物学检验志贺氏菌检验GB 4789.10 食品安全国家标准食品微生物学检验金黄色葡萄球菌检验GB 4789.15 食品安全国家标准食品微生物学检验霉菌和酵母计数GB 5009.3 食品安全国家标准食品中水分的测定GB/T 5009.11 食品中总砷及无机砷的测定GB 5009.12 食品安全国家标准食品中铅的测定GB/T 5009.13 食品中铜的测定GB/T 5009.88 食品中膳食纤维的测定GB 5749 生活饮用水卫生标准GB/T 6543 运输包装用单瓦楞纸箱和双瓦楞纸箱GB 7718 食品安全国家标准预包装食品标签通则GB 9683 复合食品包装袋卫生标准GB 12695 饮料企业良好生产规范GB 13113 食品容器及包装材料用聚对苯二甲酸乙二醇脂成型品卫生标准GB 13509 食品添加剂木糖醇GB/T 16919 食用螺旋藻粉GB/T 19618 甘草GB/T 20884 麦芽糊精GB/T 20886 食品加工用酵母GB 23489 食品添加剂大茴香脑(天然)GB 25595 食品安全国家标准乳糖GB 28050 食品安全国家标准预包装食品营养标签通则GB 28307 食品安全国家标准食品添加剂麦芽糖醇和麦芽糖醇液JJF 1070 定量包装商品净含量计量检验规则国家质量监督检验检疫总局令第75号【2005】《定量包装商品计量监督管理办法》国家质量监督检验检疫总局【2009】第123号令食品标识管理规定(修订版)3:要求3.1 原辅料3.1.1 生产用水:应符合GB 5749 的规定3.1.2 综合蔬果纤维素:以蔬菜、水果及可食用植物为主要原料,经相应工艺提炼而成,应符合供应商企业标准的要求。
参冬清凉喉片的质量标准研究

参冬清凉喉片的质量标准研究
张素芬;邓鸣;田四琦
【期刊名称】《解放军医药杂志》
【年(卷),期】2007(019)002
【摘要】目的:建立参冬清凉喉片的质量标准.方法:采用薄层色谱法对处方中玄参、麦冬及甘草进行定性鉴别.以高效液相色谱法测定黄芩中黄芩苷的含量.结果:薄层斑点清晰,重现性好;黄芩苷在6~60 μg/ml范围内线性关系良好(r=0.9999),平均回
收率为101.87%,相对标准偏差(RSD)为0.68%.结论:本方法简便、准确、专属性强、重现性好,可有效地控制参冬清凉喉片的质量.
【总页数】4页(P70-72,封三)
【作者】张素芬;邓鸣;田四琦
【作者单位】解放军白求恩国际和平医院药剂科,石家庄,050082;解放军白求恩国
际和平医院药剂科,石家庄,050082;解放军白求恩国际和平医院药剂科,石家
庄,050082
【正文语种】中文
【中图分类】R943.3
【相关文献】
1.芩冬清热口服液的质量标准研究 [J], 郭佳超;陆蕊杭;伊昕昕
2.人参黄连有效组分速崩片的质量标准研究 [J], 高旭;吕金朋;张辉;李晶峰
3.复方参蛭胶囊的质量标准研究 [J], 向泽栋;孙平;薛晴;李震;刘国飞;高鹏;代龙
4.银冬颗粒的质量标准研究 [J], 李金玲;徐玲;徐晓玉
5.参芪益气口服液质量标准研究 [J], 李萍;曾金;欧人豪;韦祖巧;肖萍
因版权原因,仅展示原文概要,查看原文内容请购买。
西吡氯铵含片 质量标准

西吡氯铵含片质量标准西吡氯铵含片是一种常见的药物,用于治疗呼吸道感染引起的痰液过多、咳嗽等症状。
为了保证西吡氯铵含片的质量、安全和有效性,制定了严格的质量标准。
以下是关于西吡氯铵含片质量标准的一份2000字的文档:西吡氯铵含片质量标准一、名称:西吡氯铵含片二、性状:本品为白色或类白色片剂。
三、含量测定:每片含西吡氯铵50mg。
四、质量标准:1. 外观:本品应为白色或类白色片剂,表面光滑,无明显杂质。
2. 含量测定:每片含西吡氯铵50mg,含量偏差不得超过正负5%。
3. 溶解度:本品在水中溶解度不得低于20mg/mL。
4. 酸碱度:本品的pH值在4.5~6.5之间。
5. 水分:不得超过2.0%。
6. 不溶物:不得超过0.5%。
7. 质量失重:不得超过1.0%。
8. 铜离子含量:不得超过20ppm。
9. 铅离子含量:不得超过10ppm。
10. 重金属含量:不得超过20ppm。
11. 细菌和真菌:细菌总数应不超过1000cfu/g,霉菌和酵母菌总数不得超过100cfu/g。
12. 质量稳定性:本品应在规定的保存条件下保持稳定,不得因贮存及运输而发生质量变化。
五、包装:采用符合医药行业标准的塑料或铝塑包装,每瓶装60片,外包装应有生产批号、生产日期、有效期限等标识。
六、保存:本品应密封保存于干燥处,避光,并应远离有毒、易挥发物品。
七、有效期:24个月。
八、执行标准:《药典》2015年版以上就是关于西吡氯铵含片质量标准的详细说明,制定严格的质量标准有助于保证西吡氯铵含片的质量和安全性,有效地保障患者的用药安全。
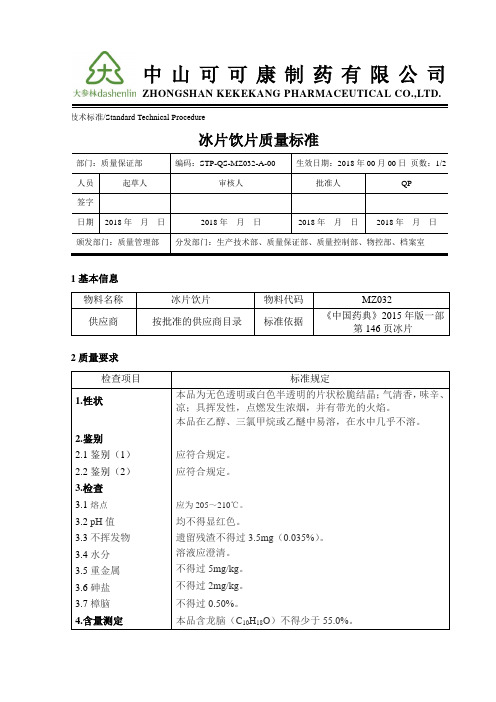
STP-QS-MZ032-A-00 冰片饮片质量标准
3包装
蛇皮袋包装并扎口。
4取样
取样按《物料取样标准பைடு நூலகம்作规程》(SOP-QC1-028-A-02)执行。
5检验方法
检验按《冰片饮片检验标准操作程序》(SOP-QC7-MZ032-A-00)及《样品的接收检验保存管理程序》(SOP-QC1-008-A-01)执行。
2.鉴别
2.1鉴别(1)
应符合规定。
2.2鉴别(2)
应符合规定。
3.检查
3.1熔点
应为205~210℃。
3.2pH值
均不得显红色。
3.3不挥发物
遗留残渣不得过3.5mg(0.035%)。
3.4水分
溶液应澄清。
3.5重金属
不得过5mg/kg。
3.6砷盐
不得过2mg/kg。
3.7樟脑
不得过0.50%。
4.含量测定
6留样与复检
6.1留样按《留样管理规定》(SOP-QA1-022-A-01)及《样品的接收检验保存管理程序》(SOP-QC1-008-A-01)执行。
6.2复检按《物料储存期及复检期管理规定》(SOP-QA5-007-A-01)执行。
7贮存条件和注意事项
密封,置凉处。
技术标准/Standard Technical Procedure
冰片饮片质量标准
部门:质量保证部
编码:STP-QS-MZ032-A-00
生效日期:2018年00月00日页数:1/2
人员
起草人
审核人
批准人
QP
签字
日期
2018年月日
2018年月日
2018年月日
2018年月日
含片生产工艺规程

含片生产工艺规程片生产工艺规程片生产工艺规程是指对片加工过程中涉及的工艺流程、操作步骤、设备使用和技术要求等进行规范化和标准化的文件。
该规程旨在确保生产过程的可控性和产品质量的一致性,提高生产效率和工艺水平。
一、工艺流程(一)原材料准备:根据生产计划和物料要求,准备符合质量要求的片生产原材料。
(二)切割工艺:根据产品要求和设计图纸,采用适当的切割设备对原材料进行切割,并注意保持切割精度。
(三)尺寸加工:对切割得到的片进行尺寸加工,包括边修整、面研磨和孔加工等步骤,确保尺寸精度和平面度。
(四)表面处理:根据产品要求和使用环境,对片的表面进行处理,包括抛光、喷涂、镀膜等工艺。
(五)检验检测:对加工得到的片进行严格的检验和检测,包括尺寸测量、外观检查和性能测试等,确保产品质量符合要求。
(六)包装出库:对合格的片进行包装和标识,并按照订单要求进行出库发货。
二、操作步骤(一)原材料准备:检查原材料质量,确保符合要求;根据生产计划准备相应的原材料。
(二)切割工艺:对原材料进行切割,注意切割精度和切割速度,确保切割质量。
(三)尺寸加工:按照设计图纸和要求对切割得到的片进行尺寸加工,注意加工精度和加工顺序。
(四)表面处理:根据产品要求和使用环境,选择适当的表面处理方法进行处理,注意操作规范和安全。
(五)检验检测:对加工得到的片进行严格的检验和检测,记录检测结果,合格的进行下一步工艺,不合格的进行返工修正或淘汰处理。
(六)包装出库:对合格的片进行包装和标识,确保包装质量和产品完好无损;按照订单要求进行出库发货。
三、设备使用(一)切割设备:使用切割机械或设备进行原材料的切割工艺,确保切割质量和效率。
(二)尺寸加工设备:使用尺寸加工设备对切割得到的片进行尺寸加工,包括边修整机、平面磨床和加工中心等设备。
(三)表面处理设备:根据产品要求和工艺流程选择适当的表面处理设备,如抛光机、涂装喷涂设备和真空镀膜设备等。
(四)检测设备:使用适当的检测设备对加工得到的片进行尺寸和性能检测,包括三坐标测量机、显微镜、硬度计等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
红景天提取物技术要求编制说明红景天提取物无现行标准,市售红景天提取物厂家众多,大都根据客户需求进行生产,依据企标检测,红景天提取物的质量无法保证。
基于红景天提取物在保健食品中的应用,现按照国家食品药品监督管理局食品许可司的要求,通过对收集到的样品进行试验,起草了统一的技术要求草案。
一、仪器、试样、试药主要检测仪器:Waters ALLiance-2695-2996型高效液相色谱仪,Empower工作站;安捷伦6890N气相色谱仪;减压干燥箱;箱型电阻炉;岛津2550型紫外-可见分光光度计;METTLER AE-240型电子分析天平;超声波清洗仪;OLympus CX21、BX41型光学显微镜。
样品:分别从陕西省、四川省及西藏等地收集多家生产的红景天提取物及委托厂家按照三种生产工艺生产的样品三批。
药材:分别从西藏、青海等地收集红景天药材品种。
对照品:红景天苷(批号:110818-200404,纯度≥98%,含量测定用,)、酪醇(批号:111676-200401,纯度≥98%,含量测定用)均由中国食品药品检定研究院提供。
试药:甲醇、乙腈(色谱纯,美国TEDIA公司);高纯水;硅胶G(青岛海洋化工厂);其他试剂均为分析纯。
二、植物基源红景天属植物是我国主产药用植物之一,我国目前红景天的商品来源主要有大花红景天和圣地红景天。
但是目前收载在《中华人民共和国药典》2010年版一部中的红景天药材品种为大花红景天,为了规范红景天提取物技术要求,在药材基源选择方面我们选择了收载于《中华人民共和国药典》2010年版一部中的大花红景天作为红景天提取物的药材,同时对购买的大花红景天药材按照《中华人民共和国药典》2010年版一部中的红景天药材标准进行了显微鉴别,并确定该药材为大花红景天。
三、工艺过程我们对提取物生产企业进行了考察,了解到目前红景天提取物生产工艺主要有醇提和水提两种,其工艺过程分别是:1. 水提取工艺红景天原料(粉碎),水煎煮提取2次,第一次加7.5倍量水,提取1.5小时,第二次加7.5倍量水,提取1小时,滤过,合并滤液,浓缩至相对密度为1.25~1.30(400C)喷雾干燥。
2. 醇提取工艺(1)40%乙醇提取红景天原料(粉碎)加6倍量,40%乙醇提取2次每次冷浸72小时,过滤,合并滤液,减压浓缩至相对密度1.05~1.08 (600C)→流浸膏→喷雾干燥→粗品→粉碎、过筛→混匀、包装。
(2)80%乙醇提取红景天原料(粉碎)→80%乙醇6倍量提取3次(每次1.5小时),过滤,合并滤液→减压浓缩至相对密度1.15(600C)→喷雾干燥→粗品→粉碎、过筛→混匀、包装。
我们通过药材公司购买了红景天药材,并按照上述工艺进行了小试和中试。
四、感官情况根据多家产品观察的结果,最终感官指标确定结果见表1。
表1五、薄层鉴别薄层方法的建立是为了鉴别红景天提取物中是否含有红景天苷和酪醇两种有效成份,现有标准中只有红景天苷的薄层鉴别,为了增加对红景天提取物的性状鉴别,所以新增了酪醇的薄层鉴别。
下面分别比较了两种薄层方法:方法一:取提取物样品粉末(过三号筛)约0.5g,置具塞锥形瓶中,加入甲醇10mL,密塞,超声处理30分钟,放冷,滤过,取续滤液,作为供试品溶液。
另取红景天苷对照品、酪醇对照品适量,分别加甲醇制成每1mL含0.5mg的红景天苷对照品溶液和酪醇对照品溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述三种溶液各10μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇-丙酮-水(6:3:1:1)的下层溶液为展开剂,展开,展距18cm,取出,晾干,置碘蒸气中熏。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
(见图1)方法二:取提取物样品粉末1g,加甲醇19mL,超声处理30分钟,放冷,滤过,取续滤液,作为供试品溶液。
另取红景天苷对照品和酪醇对照品适量,分别加甲醇制成每1mL含0.5mg的红景天苷对照品溶液和每1mL含0.5mg酪醇对照品溶液,作为对照品溶液。
照薄层色谱法试验,吸取上述三种溶液各5μL,分别点于同一硅胶G薄层板上,以三氯甲烷-甲醇(16︰5)为展开剂,展开,取出,晾干,喷以1%三氯化铁溶液—1%铁氰化钾溶液(1︰1)的新鲜混合液,供试品色谱中,在与对照品色谱相应的位置上,显相同蓝色斑点。
(见图2)1 2 3 4 5 6 7 1 2 3 4 5 6 7 8图1 红景天苷和酪醇薄层色谱图图2 红景天苷和酪醇薄层色谱图备注:图1:依次1-5为红景天提取物样品,6为红景天苷对照品,7为酪醇对照品图2:依次1-6为红景天提取物样品,7为红景天苷对照品,8为酪醇对照品经过对多批样品进行试验,通过试验结果,从图中可以看出对照品溶液与供试品溶液的主斑点分离都很好,清晰可见,从简单、方便、快捷角度考虑,所以选择方法一作为红景天提取物的薄层鉴别方法。
六、理化要求1. 水分提取物应规定一定的水分限度,以保证其质量控制及贮存、运输过程中不易发生质量变化。
按《中华人民共和国药典》2010年版一部附录IX H(第三法)减压干燥法规定的方法进行测定。
计算供试品中的含水量(%)。
经过对多批样品进行试验,通过试验结果,红景天提取物的水分在1.2%~5.9%之间,但是高于5.0%的只有两批,因此可确定本品的水分不得高于5.0%。
2. 灰分按照《中华人民共和国药典》2010年版一部附录IX K(总灰分测定法)规定的方法进行测定。
经过对多批样品进行试验,通过试验结果,红景天提取物的灰分在0.6%~4.8%之间,但是有一批为10.0%,因此可确定红景天提取物的灰分不得高于5.0%。
3. 醇溶性浸出物按照《中华人民共和国药典》2010年版一部附录X A项下热浸法进行测定,溶剂为70%乙醇,以干燥品计算浸出物含量。
经过对多批样品进行试验,通过试验结果,按干燥品计算红景天提取物的醇溶性浸出物在71.8%~98.7%之间,因此可确定,按干燥品计算醇溶性浸出物不得低于70.0%。
4. 重金属测定分别按GB/T 5009.11《食品中总砷及无机砷的测定》、GB 5009.12《食品中铅的测定》、GB/T 5009.15《食品中镉的测定》、GB/T 5009.17《食品中总汞及有机汞的测定》规定的方法进行测定。
经对多批提取物砷、铅、镉、汞测定结果,根据WM/T 2-2004 药用植物及制剂外经贸绿色行业标准、GB 2762-2005 食品中污染物限量标准、GB 16740-1997 保健(功能)食品通用标准。
规定砷、铅、镉、汞限度指标见表2表2 砷、铅、镉、汞测定结果及限度指标5. 农药残留测定按照GB/T 5009.19食品中有机氯农药多组分残留量规定的方法进行测定。
经对32批提取物六六六、滴滴涕、五氯硝基苯测定结果,根据WM/T 2-2004 药用植物及制剂外经贸绿色行业标准、GB 2763-2005 食品中农药最大残留限量。
规定六六六、滴滴涕、五氯硝基苯限度指标见表3表3 六六六、滴滴涕、五氯硝基苯测定结果及限度指标6. 特征图谱取本品粉末约0.1g,精密称定,置25mL量瓶中,加甲醇适量,超声处理20分钟,取出,放置至室温,加甲醇至刻度,摇匀,用微孔滤膜(0.45μm)滤过,取续滤液,即得。
另外精密称取红景天苷对照品,加甲醇制成每1mL含60μg的溶液,作为参照物溶液。
分别精密吸取参照物溶液与供试品溶液各10μL注人液相色谱仪,测定,记录色谱图(图3~图7)。
仪器与试剂:仪器:Waters ALLiance-2695型高效液相色谱仪,Waters 2996光电二级管阵列检测器,Empower 工作站;METTLER AE-240型电子分析天平;超声波清洗仪。
对照品:红景天苷(批号:110818-200404,纯度≥98%,含量测定用),酪醇(批号:111676-200401,纯度≥98%,含量测定用)均由中国食品药品检定研究院提供;乙腈(色谱纯,美国TEDIA 公司),冰醋酸(分析纯),高纯水。
样品:红景天提取物由委托厂家生产(80%醇提样品)提供。
色谱条件: AKZONOBEL :KromasiL 100-5C 18 250mm ×4.6mm ,柱温35℃;以乙腈为流动相A ,以0.3%冰醋酸为流动相B ,按下表(表4)中的规定进行梯度洗脱,流速为1.0mL/min ;检测波长为278nm 。
表4 流动相梯度洗脱条件AU 0.000.02 0.04 0.06 0.08 0.10 0.120.14·ÖÖ0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 18.00 20.00 22.00 24.00 26.00 28.00 30.00 32.00 34.00 36.00 38.00 40.00 42.00 44.00 46.00 48.00 50.00 52.00 54.00图3 样品色谱图AU0.000.100.200.300.400.50·ÖÖ0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 18.00 20.00 22.00 24.00 26.00 28.00 30.00 32.00 34.00 36.00 38.00 40.00 42.00 44.00 46.00 48.00 50.00 52.00 54.00图5 圣地红景天药材色谱图AU -0.0020.000 0.002 0.004 0.006 0.008 0.010 0.012 0.014 0.016·ÖÖ0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 18.00 20.00 22.00 24.00 26.00 28.00 30.00 32.00 34.00 36.00 38.00 40.00 42.00 44.00 46.00 48.00 50.00 52.00 54.00图7 空白溶剂色谱图AU -0.0020.000 0.002 0.004 0.006 0.008 0.010 0.012 0.014 0.016 0.018 0.020·ÖÖ0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 18.00 20.00 22.00 24.00 26.00 28.00 30.00 32.00 34.00 36.00 38.00 40.00 42.00 44.00 46.00 48.00 50.00 52.00 54.00图6 混合对照色谱图AU0.000.100.200.30 0.400.50·ÖÖ0.00 2.00 4.00 6.00 8.00 10.00 12.00 14.00 16.00 18.00 20.00 22.00 24.00 26.00 28.00 30.00 32.00 34.00 36.00 38.00 40.00 42.00 44.00 46.00 48.00 50.00 52.00 54.00图4 大花红景天药材色谱图经对多批样品测定后最终确定样品中共有7个特征峰,与参照物红景天苷(S 峰)相应的峰为S 峰,各特征峰与S 峰的相对保留时间,应在规定值的±5%范围内,计算后相对保留时间规定值为:0.46(峰1)、0.88(峰2)、1.00(峰S )、1.31(峰3)、2.81(峰4)、3.66(峰5)、3.80(峰6),见图8。
