药品检测项目一览表
临床科室药事管理部分质量监督检查项目表

临床科室药事管理部分质量监督检查项目
表
1. 药品库存管理:
- 药品采购记录是否完整并按规定保存?
- 药品库存量是否与记录一致?
- 过期药品和损坏药品的处理是否符合规定?
2. 药品使用管理:
- 药品的开药、核对和发药过程是否规范?
- 药品的存储和使用是否符合规定温度和湿度要求?
- 药品的使用记录是否准确完整?
3. 药品配送管理:
- 药品的配送是否按时到位?
- 药品配送过程中的温度记录是否符合规定?
- 药品是否按照规定储存和分发给临床科室?
4. 不良反应和事件报告管理:
- 临床科室是否按照规定报告药物不良反应和事件?
- 不良反应和事件报告的记录和处理是否及时完整?
5. 药品计量和使用安全管理:
- 药品计量和使用过程中是否存在错误?
- 药品计量和使用的记录是否详细准确?
请注意,这只是一份可能的质量监督检查项目表,具体的项目和要求可能会根据实际情况而有所变化。
在制定检查项目时,请参考相关法律法规和临床科室的具体要求。
药品GMP检查指南原料药(新版)

机构与人员药品GMP认证(原料药)检查评定标准一、药品GMP认证(原料药)检查项目共172项,其中关键项目(条款号前加“*”)47项,一般项目125项。
二、药品GMP认证(原料药)检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
严重缺陷或一般缺陷>20%的,不予通过药品GMP认证。
一、机构与人员*0301 企业应建立药品生产和质量管理机构,明确各级机构和人员的职责。
看企业组织机构图,查生产质量管理组织机构及功能设置(图示),是否涵盖生产、质量、物料仓储、设备、销售及人员管理等内容,并有负责培训的职能部门/人员。
1.有企业的组织机构图。
1.1组织机构图中体现企业各部门的设置、隶属关系及各部门之间的关系,其中生产和质量管理部门分别独立设置。
1.2组织机构图中体现质量管理部门受企业负责人直接领导。
1.3组织机构图中明确各部门名称及部门负责人。
2.岗位职责。
2.1制定了各级领导的岗位职责。
2.2制定了各部门及负责人的职责,特别是质量管理部门有独立的权限,并能对生产等部门执行《药品生产质量管理规范》进行临督和制约。
2.3制定了各岗位的岗位职责。
2.4岗位职责的制定能体现GMP的所有规定,权力、责任明确,且无交叉,无空白。
0302 企业应配备一定数量的与药品生产相适应的具有相应的专业知识、生产经验及工作能力,应能正确履行其职责的管理人员和技术人员。
药品检验报告模板_胶囊剂
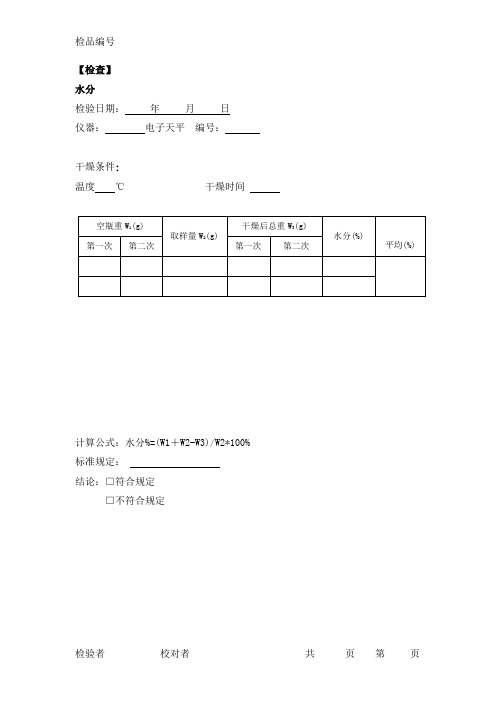
水分
检验日期:年月日
仪器:电子天平编号:
干燥条件:
温度℃干燥时间
计算公式:水分%=(W1+W2-W3)/W2*100% 标准规定:
结论:□符合规定
□不符合规定
检验日期:年月日温度: ℃湿度: %
仪器:电子天平编号:
取供试品10粒,结果:
标示装量:
平均装量:
限度:标示装量(或平均装量)的±10%
上限: ×(1+ %)=
下限: ×(1- %)=
10粒的情况:
标准规定:每粒装量与平均装量相比较,超出装量差异限度的不得多于2粒,并不得有1粒超出装量差异限度1倍。
结论:□符合规定
□不符合规定
崩解时限
检验日期:年月日温度: ℃湿度: %
仪器:ZBS-6E崩解时限仪编号:YWH-003
溶剂:溶剂温度: ℃
是否加挡板□是□否
崩解时间:分钟
崩解情况:片均在分钟内全部崩解
标准规定:□硬胶囊应在30分钟内全部崩解
□软胶囊应在1小时内全部崩解
□肠溶胶囊先不加挡板在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象,继加入挡板在人工肠液中检查,1小时内应全部崩解
结论:□符合规定
□不符合规定
微生物限度见微生物限度检查表。
药材质量检测项目

药材质量检测项目
药材质量检测项目包括多个方面,具体如下:
1. 外观检验:包括药材的形状、大小、色泽、杂质、虫蛀等情况。
2. 水分检测:测定药材中的水分含量,以判断其干燥程度和储存过程中的质量变化。
3. 总灰分检测:测定药材燃烧后残留的矿物质和无机盐的含量,以评估药材的纯净程度。
4. 酸不溶性灰分检测:测定药材中不能被酸溶解的残留物的含量,以鉴别药材中泥土、沙子等杂质的含量。
5. 浸出物检测:通过一定溶剂浸泡药材,测定其中可溶性物质的含量,以评估药材的有效成分。
6. 挥发油检测:测定药材中挥发性油类的含量,以判断药材的气味和品质。
7. 重金属检测:检查药材中重金属的含量,以确保药材的安全性。
8. 农药残留检测:检查药材中农药残留的含量,以确保药材无农药污染。
9. 黄曲霉素检测:检查某些药材中黄曲霉素的含量,以预防霉变和毒素的产生。
10. 无机成分检测:测定药材中无机成分的含量,以了解药材的化学成分和药理作用。
这些检测项目涵盖了药材的外观、物理性质、化学成分和安全性等多个方面,以确保药材的质量和安全性。
中药饮片质量验收主要项目和要求、常规鉴别项目、入库验收记录表

中药饮片质量验收主要项目和要求、常规鉴别项目、入库验收
记录表
中药饮片质量验收主要项目和要求主要包括以下内容:
1.外观要求:饮片应干燥、无霉变、无异味、无蛀虫、无变色、无混杂物等。
2.含水量:要求符合国家标准规定的范围。
3.化学成分分析:检查中药饮片中有效成分的含量是否符合要求。
4.微生物检验:检查中药饮片中的细菌、霉菌、酵母菌等是否
符合国家标准规定的限定数量。
5.重金属、农药残留检验:检查中药饮片中的重金属和农药残
留是否超过国家标准规定的限定数量。
6.其他检验项目:根据具体中药饮片的特点,可包括灰分含量、糖皮质激素残留、毒物质含量等检验。
常规鉴别项目主要包括外观特征、组织形态、气味、味道、颜色等方面的鉴别。
入库验收记录表一般包括以下内容:
1.中药饮片名称、产地、批号、规格等基本信息。
2.验收日期和验收人员。
3.外观质量的检查结果。
4.含水量、化学成分分析、微生物检验、重金属、农药残留等检验结果。
5.其他检验项目的验收结果。
6.复验、抽样检验结果,如需复验的则记录复验结果。
7.验收结论。
8.备注。
(如有特殊情况或需要补充说明等)
入库验收记录表应进行签字确认,以作为中药饮片质量验收的有效证据。
稳定性试验规定,稳定性指导原则,稳定性试验方法

FDA药物稳定性试验指导原则药品稳定性试验规定每年底制定下年度原料和制剂成品稳定性试验书面计划,内容包括:规格标准、检验方法、检验周期、每批数量、考查项目、考查频次、时间等。
经批准后执行,新开发的制剂品种在开发阶段应制定稳定性计划。
3 公司药品生产用原料稳定性试验可采用影响因素试验法:3.1 将一批供试品除去包装以后,平放在平皿中,在以下条件下按规定贮存,检测重点考查项目各项质量指标的变化情况。
重点考查项目包括:性状、熔点、含量、有关物质、吸湿性及根据药品性质选定的考查项目。
影响因素试验条件:3.1.1 暴露在常温空气中;3.1.2 高温试验,温度分别为60℃、40℃两个温度水平;3.1.3 高湿试验,湿度分别为90%±5%、75%±5%两个湿度水平;3.1.4 强光照射试验,照度为4500LX±500LX4 制剂稳定性试验:4.1 加速试验:取供试品三批,按市售包装,在温度40℃±2℃,相对温度75%±5%的条件下放置6个月,在第一个月、第二个月、第三个月、第六个月末取样检测各剂型规定的重点考查项目的质量指标变化情况。
片剂的重点考察项目为:性状、含量、有关物质、崩解时限或溶出度。
硬胶囊剂的重点考查项目为:外观、内容物色泽、含量、有关物质、崩解时限或溶出度、水份。
液体制剂的重点考察项目为:性状、相对密度、含量、pH值、微生物限度检查。
3个月后测试符合要求,有效期暂定为2年,6个月后测试符合要求有效期暂定为3年。
4.2 长期试验:取供试品三批,按市售包装,在规定保存条件下贮存,每年检测一次,重点考查项目的质量指标变化情况,观察3年的检验结果,以确定产品的贮存期或有效期。
5 严格按照批准的书面稳定性计划,做好试验记录,如发现异常情况,采取措施及时调整。
6 试验结束后,对试验结果进行数理统计后处理,评定并作出结论。
写出稳定性试验报告,所有资料归档保存。
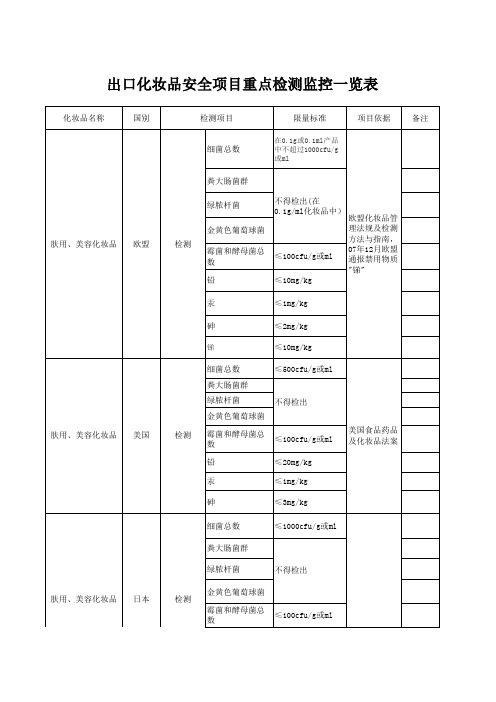
欧盟、美国、日本等国家化妆品重金属、微生物标准

出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
及化妆品法案
(眼部口唇类)
出口化妆品安全项目重点检测监控一览表
禁用物质"锑"
出口化妆品安全项目重点检测监控一览表
岁以下用)或每毫升化妆品
中)
准,参照我国
化妆品卫生规
范(2007年
版)
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
理法规及检测
方法与指南,
07年12月欧盟
通报禁用物质
"锑"
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表。
药物检测资料

药物检测
在当今社会,药物滥用和药物检测的话题备受关注。
药物检测是检测一个人体
内是否存在某种药物或药物代谢物的过程。
药物检测的方法和技术不断进步,能够检测出越来越多种类的药物,为防止药物滥用提供了重要的手段。
药物检测的意义
药物检测在各个领域都有着重要的意义。
在医学领域,药物检测可以确保患者
在服用药物时是否按照医嘱使用,避免药物过量或不足的情况发生。
在司法领域,药物检测可以作为一种证据,帮助调查机构解决案件和维护社会秩序。
药物检测的方法
目前,常见的药物检测方法包括尿液检测、口腔检测、血液检测和毛发检测等。
每种方法都有其适用的场景和特点。
尿液检测是最常见的一种方法,适用于快速筛查,但可能存在隐私问题;口腔检测则适用于现场快速检测;血液检测和毛发检测可以提供更精准的信息,但需要专业设备和技术支持。
药物检测的挑战
尽管药物检测技术不断进步,但仍然面临一些挑战。
例如,一些药物的代谢产
物在体内停留时间较短,可能无法被传统检测方法检测出来;另外,一些药物滥用者可能会采取各种措施来规避检测,如换药、稀释尿液等。
未来发展趋势
随着科技的不断发展,药物检测技术也在不断演进。
未来,随着技术的提升,
药物检测方法将更加精准、快速和便捷。
同时,人们对隐私和伦理问题的关注也将促使药物检测方法在保护个人隐私的同时更加有效。
综上所述,药物检测是一个重要且不断发展的领域,对于维护社会稳定和个人
健康都有着重要的意义。
我们期待未来药物检测技术能够更好地发展,为社会健康和安全保驾护航。
123.2药物鉴别的项目下

6. 无机酸根 氯化物
鉴别一 供试品+稀HNO3酸化后+AgNO3生成白色凝乳状沉淀
Ag+ Cl AgCl
鉴别二 供试品+等量的MnO2+H2SO4生成Cl2,使湿润的KI淀 粉试纸显蓝色。
MnO2 2Cl 4H+ Cl2 Mn2 2H2O
鉴别试验的项目
一般鉴别试验
6. 无机酸根 硫酸盐
供试品溶液(中性)+氨制硝酸银
银镜
苯甲酸盐 苯甲酸盐+ FeCl3 中性 赭色沉淀 +稀HCl
COOH
白色沉淀
鉴别试验的项目
一般鉴别试验
3.芳香第一胺类
稀盐酸 芳香第一胺类 + 亚硝酸钠
碱性β—萘酚试液
橙黄色到 猩红色↓
鉴别试验的项目
一般鉴别试验
4.托烷生物碱类
水解
托烷生物碱类
发烟硝酸
莨菪酸
三硝基衍生物
NO3 H2SO4 HNO3 HSO4
2HNO3
6FeSO4
3H2SO4
3Fe2
SO4
3
2NO+4H2O
xFeSO4 yNO xFeSO4 yNO 棕色
鉴别试验的项目
一般鉴别试验
6. 无机酸根 硝酸盐
鉴别二 供试品+ H2SO4+Cu,加热生成红棕色的蒸汽
3Cu+8HNO3 3Cu NO3 2 2NO 4H2O
鉴别试验的项目
一般鉴别试验
1.有机氟化物
茜素氟蓝 硝酸亚铈
有机氟化物 氧瓶燃烧 无机氟离子
pH4.3
蓝紫色配合物
鉴别试验的项目
一般鉴别试验
药品质量分析检测实验室环评报告公示
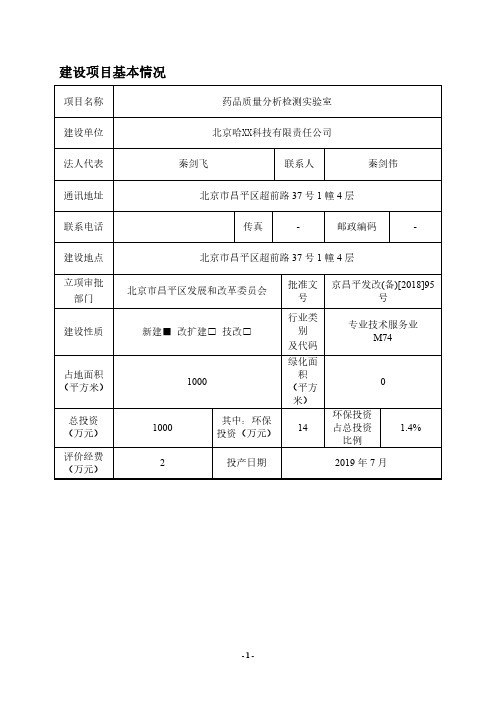
建设项目基本情况项目名称药品质量分析检测实验室建设单位北京哈XX科技有限责任公司法人代表秦剑飞联系人秦剑伟通讯地址北京市昌平区超前路37号1幢4层联系电话 传真-邮政编码-建设地点北京市昌平区超前路37号1幢4层立项审批部门北京市昌平区发展和改革委员会批准文号京昌平发改(备)[2018]95号建设性质新建■改扩建□技改□行业类别及代码专业技术服务业M74占地面积(平方米)1000绿化面积(平方米)总投资(万元)1000其中:环保投资(万元)14环保投资占总投资比例1.4%评价经费(万元)2投产日期2019年7月工程内容及规模:一、项目背景及编制依据1.项目背景北京哈XX科技有限责任公司于2011年4月19日成立,原有经营范围为:生产片剂、硬胶囊剂、散剂、颗粒剂;技术开发、技术转让、技术服务、技术咨询;工程和技术研究与试验发展。
根据公司发展需要,建设单位拟投资1000万元在北京市昌平区超前路37号1幢4层(中关村兴业创业园内)(建筑面积1000m2)作为经营场所,建设药品质量分析检测实验室项目。
建设内容包括样本HPLC实验室、理化分析室、红外普通仪器室、激光粒度仪室、微生物实验室、ICP-MS实验室等。
项目目前正处于准备阶段,设备未购置、未开工建设,预计于2019年7月投产。
厂址原有原项目于2011年4月25日取得北京市昌平区环境保护局《北京哈XX科技股份有限公司建设项目环境影响报告表的批复》(昌环保审字【2011】0674号),于2016年12月29日取得北京市昌平区环境保护局《关于北京哈XX科技股份有限公司项目建设项目竣工环境保护验收的批复》(昌环保验字[2016]0163号),于2018年11月停产、设备搬离。
2.编制依据按照《中华人民共和国环境保护法》、《建设项目环境保护管理条例》(国务院2017年第682号令)及《中华人民共和国环境影响评价法》(2016年修订)中第十六条“国家根据建设项目对环境的影响程度,对建设项目的环境影响评价实行分类管理。
代码、收费、取验单、标本采集一览表

血栓3项
2502-009 278.99 VWF因子定量、AT-Ⅲ定量、D二聚体定量
D二聚体定量 2502-004 118.99
血浆凝血酶原 时间测定(PT)
(仪器法)
250203020 —2
31.99
PT、INR
三溶血试验 2502-002 41.85
酸溶血、热溶血、糖水试验
地贫筛查+Hb电 2502-003 85.32
黄疸3项
2503-043 29.32
Tbili、Dbili、Bili
尿微量白蛋白 测定(mALB,各 种免疫学方法)
2503070061
血清胱抑素 (Cystatin C) 250307028
测定
30 54.32
尿微量白蛋白测定(mALB,各种免疫学方法 胱抑素(Cystatin C,肾功能指标)
肾功能(不含 K、Na、Cl、 Ca,与电解质 六项组合为全
肾功)
2503-038
121.32
GLU、BUN、CRE、Cystatin C、RBP
尿肾功4项 2503-011 68
UmAlb、NAG、β2-MG、CRE
体检肝功能(与 肝功Ⅱ组合为 全肝功,不含
HBsAg)
肝功能Ⅱ(与体 检肝功组合为
3.风湿过敏/免疫功能/炎症鉴别
免疫5项
2504-012 84.32
IgG、IgA、IgM、C3、C4
风湿4项
2504-027 82.32
RF、ASO、UA、CRP
自身抗抗体11 项(LIA)
2504-021
SS-A/RO-60Kd、SS-A/RO- 52Kd、SS-B/La、 227.32 Sm U1-snRNP、Scl-70、ACA、Jo-1、
检验科危急值报告项目及范围附表完整

3·易燃、易爆药品的贮存,要求有专用的危险品库,并符合危险品仓库的管理要求。
4·普通化学试剂库设在检验科内,要专人负责,并建立试剂使用登记制度。
5·各种电器设备,如干燥箱、保温箱等仪器,以实验室为单位,由专人保管,并建立仪器卡片。
3.6仅对被检样品所检项目负责的声明。
4.检验报告的格式,
4.1检验科主任设计各类检验报告格式。
4.2根据各专业技术特点编制检验报告。
4.3各类检验报告需满足第3条要求。
5.检验报告的审核、签发和存档
5.1检测人员必须根据室内质量控制数据确认所检项目结果受控。
5.2检测人员必须认真核对检验样品与检验报告一一对应的唯一性。
8.1检测人员必须科学、严谨、省慎地出具检验报告。
8.2检测人必须对检测结果负全责,审核人必须负审核责任,科主任必须负管理、督查责任。
8.3发现有疑问报告,但未发出检验科,复检,排除检验科外因素,属科内业务质量问题则采取纠正措施,分清责任,科内进行处罚。
8.4有疑问报告已发到临床,作为检验科事故处理。科主任组织调查、复检,排除检验科外因素后属科内质量问题则采取纠正措施,分清责任,上报医院领导进行友处罚。.
检验科危急值范围由检验科初步拟定。各科室应根据各科室病种及其病危处理情况,与检验科共同拟定危急值种类和范围。便于更好的为病人服务。
检验科报告审核制度
1.目的
对检验报告的格式、内容、编制、审核、签发及修改等全过程实施质量控制,确保向患者提供准确、可靠、有效的检验报告。
2.范围
适用于检验科出具的各科检验报告。
<2.5或>25
mmol/L
药物检验报告单

药物检验报告单检验项目以下是药物检验报告单中常见的检验项目:1.化学成分检测:包括药物中的化学成分及其浓度的检测,如活性成分、辅料等。
2.质量控制检测:通过对药物的质量进行各项指标的检测,以确保产品符合规定的质量标准。
3.安全性检测:包括对药物的毒性、致敏性等安全性指标的检测,以保证药物的使用安全性。
4.稳定性检测:通过对药物在不同条件下的稳定性进行检测,以评估药物的贮存期限及贮存条件要求。
检验流程药物检验报告单的编写通常遵循以下步骤:1.样品准备:将待检药物按照规定的方法、数量制备成样品,以便进行后续的检验操作。
2.数据记录:在检验过程中,将每一步操作的数据记录下来,包括药物的样品编号、检验时间、检验人员等信息,以确保数据的准确性。
3.检验操作:按照标准的检验方法和流程进行各项检验操作,如药物的化学成分检测、质量控制检测等。
4.结果分析:对检验结果进行分析和评估,判断药物是否符合规定的质量标准和安全要求。
5.报告编写:根据检验结果,编写药物检验报告,包括药物的检验项目、检验结果、结论等内容。
6.审核和签发:对编写好的药物检验报告进行审核,并由专业人员签发,以保证报告的准确性和可信度。
数据解读药物检验报告单中的数据解读是非常重要的环节。
根据不同的检验项目,可以从以下几个方面对数据进行解读:1.化学成分检测:根据药物中各种化学成分的浓度,可以判断药物的活性成分是否符合要求,以及辅料的合理性。
2.质量控制检测:通过对质量指标的检测,可以评估药物的质量是否稳定,并判断药物是否符合规定的质量标准。
3.安全性检测:通过对药物的毒性、致敏性等指标的检测,可以评估药物的安全性,判断是否存在潜在的安全风险。
4.稳定性检测:通过对药物在不同条件下的稳定性的检测,可以评估药物的贮存期限及贮存条件要求是否符合要求。
结论与建议根据药物检验报告单的检验结果,可以得出以下结论和建议:1.结论:根据检验结果,判断药物是否符合规定的质量标准和安全要求。
药厂质量控制检测项目

药厂质量控制检测项目
药厂的质量控制检测项目涵盖了多个方面,以确保生产的药品符合相关的法规和标准。
以下是一些常见的质量控制检测项目:
1. 药品成分分析:对药品中各组分的含量进行定量或定性分析,包括活性成分、辅助成分等。
2. 物理性质测试:例如颗粒度、溶解度、比重、粘度等物理特性的测试,以确定药品的特性。
3. 化学性质测试:包括药品的酸碱性、氧化性、还原性等的测试,以确保药品符合要求的化学性质。
4. 微生物检验:检测药品中是否存在细菌、真菌、霉菌等微生物污染,以保证药品的微生物质量符合标准。
5. 重金属及有害物质检测:检测药品中是否存在有毒重金属(如铅、汞等)和其他有害物质,以确保药品的安全性。
6. 生物等效性/生物相当性测试:对特定类别的药品(如
仿制药)进行生物等效性或生物相当性研究,以评估其与原始药品的等效性。
7. 稳定性研究:对药品在不同条件下(如温度、湿度)的稳定性进行评估,以确定其保质期和存储条件。
8. 标签声明验证:检验药品标签上所声明的成分和含量是否符合实际情况,确保准确的标签信息。
这些只是一些常见的质量控制检测项目,并且具体的检测项目和方法会根据不同的药品类型和法规要求而有所差异。
药厂通常遵循国家或地区的相关法规和药典要求来设计和执行质量控制检测项目。
2020药典检测项目 -回复

2020药典检测项目-回复2020药典检测项目是指在2020年的药物药理学领域中,针对药物的质量控制和安全性评估进行的一系列测试和分析项目。
这些项目旨在确保药物的治疗效果和安全性,以满足患者和药品监管机构的需求。
本文将一步一步回答有关2020药典检测项目的问题。
第一部分:什么是药典检测项目?药典检测项目是指药物质量控制和安全性评估的一系列测试和分析项目。
药物必须符合国家和国际药典中规定的质量标准,以确保其有效性和安全性。
药典检测项目通常包括物质的鉴别、含量测定、杂质检测、稳定性测试等内容,以确保药物的质量与规格符合要求。
第二部分:2020药典检测项目的意义是什么?2020年的药典检测项目意义重大,它确保了患者的用药安全和有效性。
药品必须符合规定的质量标准,以保证其安全性和治疗效果。
通过对2020药典检测项目的执行,药品生产商能够评估和控制药物的质量,并确保其与2019和以前版本的药典标准基本一致。
第三部分:2020药典检测项目的具体内容有哪些?具体而言,2020药典检测项目可能包括以下内容:1. 药物鉴别:通过物理性质、化学反应、光谱分析等方法,确定药物的真实性和纯度。
2. 含量测定:使用色谱、光谱等方法,确定药物中的有效成分的含量,并与规定的含量标准进行比较。
3. 杂质检测:检测药物中可能存在的杂质,如不纯物质、重金属、微生物等,以确保药物的安全性。
4. 稳定性测试:评估药物在一定条件下的稳定性,以确定其保存期限和贮存条件。
第四部分:2020药典检测项目的执行流程是怎样的?药典检测项目的执行流程通常包括以下步骤:1. 样品准备:准备药品样品,包括合适的样品数量和类型,以及合适的样品处理方法。
2. 仪器操作:根据测试项目的要求,进行必要的仪器设备设置和操作,如高效液相色谱、气相色谱、质谱仪等。
3. 检测分析:按照药典中规定的方法进行样品的检测分析。
这包括样品的准备、标准曲线的制备、仪器的校准与测试、数据记录和分析等过程。
仿制药质量保证项目检查结果

仿制药质量保证项目检查结果
根据国家药监局的要求,仿制药质量保证项目检查结果应包括以下几个方面:
1. 目标药物的主要成分分析:对仿制药的主要成分进行定性和定量分析,确保与原研药成分一致。
2. 目标药物的物理性质测试:包括目标药物的外观、溶解度、比旋光度等物理性质测试,确保仿制药物与原研药物的物理性质相似。
3. 目标药物的药动学评价:对仿制药的吸收、分布、代谢和排泄等药动学过程进行研究和评价,确保仿制药与原研药具有相似的药动学特性。
4. 目标药物的稳定性评价:对仿制药在不同环境条件下的稳定性进行评价,包括药物的降解速度、崩解时间、含量变化等参数的测定。
5. 目标药物的微生物限度测试:对仿制药的微生物污染进行测试,确保药品符合国家药典对微生物限度的要求。
6. 目标药物的质量控制指标测试:对仿制药的相关质量控制指标(如含量、溶出度、纯度等)进行测试,确保仿制药符合国家药典中的质量要求。
以上是一些常见的仿制药质量保证项目检查结果,具体检查项目和结果会根据不同的药品和治疗方案而有所不同。
欧盟、美国、日本等国家化妆品重金属、微生物标准
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
及化妆品法案
(眼部口唇类)
出口化妆品安全项目重点检测监控一览表
禁用物质"锑"
出口化妆品安全项目重点检测监控一览表
岁以下用)或每毫升化妆品
中)
准,参照我国
化妆品卫生规
范(2007年
版)
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
理法规及检测
方法与指南,
07年12月欧盟
通报禁用物质
"锑"
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表
剂
出口化妆品安全项目重点检测监控一览表
出口化妆品安全项目重点检测监控一览表。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电位滴定与永停滴定
中国药典2010年版二部附录Ⅶ A/一部附录Ⅷ A
美国药典32版附录<541>
1.33
非水溶液滴定
中国药典2010年版二部附录Ⅶ B/一部附录Ⅷ B
美国药典32版附录<541>
1.34
氧瓶燃烧法
中国药典2010年版二部附录Ⅶ C
美国药典32版附录<471>
1.35
氮测定
中国药典2010年版二部附录Ⅶ D/一部附录Ⅸ L
中国药典2010年版二部附录Ⅷ J/一部附录Ⅸ F
美国药典32版附录<211>
1.58
铵盐检查
中国药典2010年版二部附录Ⅷ k
美国药典32版附录<905>
1.2
可见异物
中国药典2010年版二部附录Ⅸ H/一部附录Ⅺ C
1.3
溶散时限
中国药典2010年版二部附录Ⅰ H/一部附录Ⅰ A;Ⅰ k
1.4
金属性异物
中国药典2010年版二部附录Ⅰ G/一部附录Ⅰ Y
美国药典32版附录<751>
1.5
每瓶总揿次、每瓶总吸次、每瓶总喷次
中国药典2010年版二部附录Ⅰ L/一部附录Ⅰ Z
1.53
氟检查
中国药典2010年版二部附录Ⅷ E
1.54
氰化物检查
中国药典2010年版二部附录Ⅷ F
1.55
铁盐检查
中国药典2010年版二部附录Ⅷ G/一部附录Ⅸ D
美国药典32版附录<241>
1.56
重金属检查
中国药典2010年版二部附录Ⅷ H/一部附录Ⅸ E
美国药典32版附录<231>
1.57
砷盐检查
相对密度测定
中国药典2010年版二部附录Ⅵ A/一部附录Ⅶ A
美国药典32版附录<841>
1.26
馏程测定
中国药典2010年版二部附录Ⅵ B/一部附录Ⅶ B
美国药典32版附录<>
1.27
熔点测定
中国药典2010年版二部附录Ⅵ C/一部附录Ⅶ C
美国药典32版附录<741>
1.28
凝点测定
中国药典2010年版二部附录Ⅵ D/一部附录Ⅶ D
美国药典32版附录<461>
1.36
乙醇量测定
中国药典2010年版二部附录Ⅶ E/一部附录Ⅸ M
1.37
甲氧基、乙氧基与羟丙氧基测定
中国药典2010年版二部附录Ⅶ F
1.38
脂肪酸凝点
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
1.39
酸值
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
美国药典32版附录<401>
1.44
杂质
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
1.45
水分与挥发物
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
1.46
酸败度测定
中国药典2010年版一部Ⅸ P
1.47
维生素A测定
中国药典2010年版二部附录Ⅶ J
美国药典32版附录<571>
1.48
维生素D测定
中国药典2010年版二部Ⅶ k
1.14
溶解度
中国药典2010年版二部/一部凡例
1.15
分散均匀性
中国药典2010年版二部附录ⅠA
1.16
发泡量
中国药典2010年版二部附录Ⅰ A/一部附录Ⅰ D
1.17
一般鉴别试验
中国药典2010年版二部附录Ⅲ/一部附录Ⅳ
美国药典32版附录<191>
1.18
紫外-可见分光光度法
中国药典2010年版二部附录Ⅳ A/一部附录Ⅴ A
美国药典32版附录<651>
1.29
旋光度测定
中国药典2010年版二部附录Ⅵ E/一部附录Ⅶ E
美国药典32版附录<781>
1.3
折光率测定
中国药典2010年版二部附录Ⅵ F/一部附录Ⅶ F
美国药典32版附录<831>
1.31
pH值测定
中国药典2010年版二部附录Ⅵ H/一部附录Ⅶ G
美国药典32版附录<791>
美国药典32版附录<601>
1.6
排空率
中国药典2010年版二部附录ⅠL
1.7
每揿(吸、喷)主药含量
中国药典2010年版二部附录Ⅰ L/一部附录Ⅰ Z
美国药典32版附录<601>
1.8
喷射速率
中国药典2010年版二部附录Ⅰ L/一部附录Ⅰ Z
美国药典32版附录<601>
1.9
喷出总量
中国药典2010年版二部附录Ⅰ L/一部附录Ⅰ Z
药品检测项目一览表
检测产品/类别
检测项目/参数
检测标准(方法)名称及编号(含年号)
限制范围或说明
序号
名称
药品
1.1
重量差异(装量差异)
中国药典2010年版二部附录Ⅰ A;Ⅰ B;Ⅰ D;ⅠE;Ⅰ G;Ⅰ H;Ⅰ J;Ⅰ L;Ⅰ M;Ⅰ N;Ⅰ O;Ⅰ P;Ⅰ Q;Ⅰ R /一部附录Ⅰ A;Ⅰ B;Ⅰ C;Ⅰ D;Ⅰ E;ⅠⅠ;Ⅰ K;Ⅰ L;Ⅰ P;Ⅰ T;Ⅰ U;Ⅰ W
1.4
皂化值
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
美国药典32版附录<401>
1.41
羟值
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
美国药典32版附录<401>
1.42
碘值
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
美国药典32版附录<401>
1.43
加热试验
中国药典2010年版二部附录Ⅶ H/一部附录Ⅸ N
美国药典32版附录<851>
1.19
红外分光光度法
中国药典2010年版二部附录Ⅳ C /一部附录Ⅴ C
美国药典32版附录<851>
1.2
纸色谱法
中国药典2010年版二部附录Ⅴ A/一部附录Ⅵ A
美国药典32版附录<621>
1.21
薄层色谱法
中国药典2010年版二部附录Ⅴ B/一部附录Ⅵ B
美国药典32版附录<621>
1.22
柱色谱法
中国药典2010年版二部附录Ⅴ C /一部附录Ⅵ C
美国药典32版附录<621>
1.23
高效液相色谱法
中国药典2010年版二部附录Ⅴ D/一部附录Ⅵ D
美国药典32版附录<621>
1.24
气相色谱法
中国药典2010年版二部附录Ⅴ E/一部附录Ⅵ E
美国药典32版附录<621>
1.25
美国药典32版附录<601>
1.1
每揿(喷)喷量
中国药典2010年版二部附录Ⅰ L/一部附录Ⅰ Z
1.11
溶化性
中国药典2010年版二部附录Ⅰ N/一部附录Ⅰ C;Ⅰ T
1.12
沉降体积比
中国药典2010年版二部附录Ⅰ G;
I O;I Q;I R
1.13
外观均匀度
中国药典2010年版二部附录Ⅰ P/一部附录Ⅰ B
1.49
氯化物检查
中国药典2010年版二部附录Ⅷ A/一部附录Ⅸ C
美国药典32版附录<221>
1.5
硫酸盐检查
中国药典2010年版二部附录Ⅷ B
美国药典32版附录<221>
1.51
硫化物检查
中国药典2010年版二部附录Ⅷ C
1.52
硒检查
中国药典2010年版二部附录Ⅷ D
美国药典32版附录<291>
