原电池电动势和电极电势的测量
原电池电动势的测定实验报告

实验九原电池电动势的测定及应用一、实验目的1.测定Cu-Zn电池的电动势和Cu、Zn电极的电极电势。
2.学会几种电极的制备和处理方法。
3.掌握数字电位差计的丈量原理和正确的使用方法。
二、实验原理电池由正、负两极组成。
电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。
电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。
从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系:9-1)n子的数目;F为法拉第常数(其数值为E为电池的电动势。
所以测出该电池的电动势E后,进而又可求出其它热力学函数。
但必须注意,测定电池电动势时,首先要求电池反应自己是可逆的,可逆电池应满足如下条件:(1)电池反应可逆,亦即电池电极反应可逆;(2)电池中不允许存在任何不成逆的液接界;(3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的丈量中,经常使用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
在进行电池电动势丈量时,为了使电池反应在接近热力学可逆条件下进行,采取电位计丈量。
原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就可计算得到由它们组成的电池的电动势。
由(9-1)式可推导出电池的电动势以及电极电势的表达式。
下面以铜-锌电池为例进行分析。
电池暗示式为:符号“|”代表固相(Zn 或Cu{}2(Zn Zn a +2)2()Cu a e Cu s ++222()(Cu Zn Cu a Zn a +++电池反应的吉布斯自由能变更值为: 22CuZna RT a ++-(9-2)为尺度态时自由能的变更值;体物质的活度等于11Zn a =。
而在标态时,则有:9-3)为电池的尺度电动势。
由(9-1)至(9-1)式可得: RT E E nF =-9-4)对于任一电池,其电动势等于两个电极电势之差值,其计算9-5对铜-锌电池而言2,Cu Cu +2,Zn Znϕ+2,Cu Cu +2,Zn Zn +是当a =时,铜电极和锌电极的尺度电极电势。
实验十六 电极电位和原电池电动势的测定
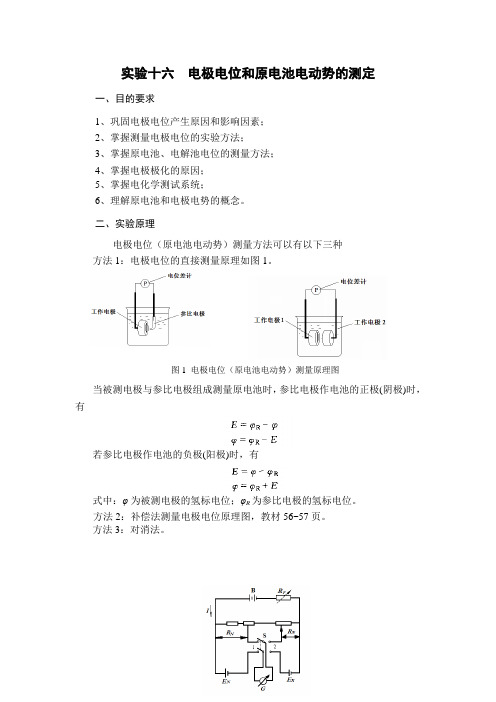
图1 电极电位(原电池电动势)测量原理图实验十六 电极电位和原电池电动势的测定一、目的要求1、巩固电极电位产生原因和影响因素;2、掌握测量电极电位的实验方法;3、掌握原电池、电解池电位的测量方法;4、掌握电极极化的原因;5、掌握电化学测试系统;6、理解原电池和电极电势的概念。
二、实验原理电极电位(原电池电动势)测量方法可以有以下三种方法1:电极电位的直接测量原理如图1。
当被测电极与参比电极组成测量原电池时,参比电极作电池的正极(阴极)时,有若参比电极作电池的负极(阳极)时,有式中:φ为被测电极的氢标电位;φR 为参比电极的氢标电位。
方法2:补偿法测量电极电位原理图,教材56~57页。
方法3:对消法。
图2 补偿法测量电极电位测量原理图对消法测定电动势就是在所研究的电极(电池)的外电路上加一个方向相反的电压。
当两者相等时,电路的电流为零(通过检流计指示)。
此时,所研究的电池的电动势就可以从外电路的电压数值读出。
原电池是由两个“半电池”组成,每个半电池中有一个电极和相应的溶液。
由不同的半电池可以组成各式各样的原电池,电池中的正极起还原作用,负极起氧化作用,电池的电动势等于两个电极电位的差值:左右ϕϕϕϕ-=-=-+E++++=a nF RT ln 0ϕϕ ---+=a nFRT ln 0ϕϕ 例如Cu-Zn 电池 Zn|ZnSO 4(a 1)||CuSO 4(a 2)|CuZn 的电极电位22201ln 2Zn Zn Zn Zn Zn RT F a ϕϕ+++=- Cu 的电极电位22201ln 2Cu Cu Cu Cu Cu RT F a ϕϕ+++=- Cu-Zn 电池的电动势为: ++++--=2222Cu n /Zn Zn 0Cu 0ln 2)(ααϕϕZ Cu /F RT E 三、仪器与药品 电化学测试系统 1套 饱和甘汞电极 1只盐桥 1个 电解池 1套Cu 电极片 1个 Fe 电极片 1个容量瓶 1个 量筒 1个广口瓶 3个 饱和KCl 溶液CuSO4(0.1mol.L-1)溶液 CuSO4(0.01mol.L-1)溶液NaCl (0.1mol.L-1)溶液四、实验步骤图4 工作电极的结构示意图 1、电极制备工作电极表面要平整,不能出现尖角或台阶,这些结构将会影响电极电位的分布。
实验四氧化还原与电化学

实验四氧化还原与电化学
一、实验目的
1. 了解原电池的电动势和电极电势的测定方法
2. 掌握电极电势和氧化还原反应的关系
3. 掌握反应物浓度,介质对氧化还原反应的影响
二、实验原理
1. 电极电势代数值越大,其氧化态的氧化能力越强,还原态的还原能力越弱;反之,代数值越小,其氧化还原能力越弱,还原态的还原能力越强。
2. 根据氧化剂和还原剂所对应电极电势的相对大小,可以判断氧化还原反应进行的方向。
当氧化剂所对应电对的电极电势与还原剂所对应的电极电势的差值:
( 1 )大于0 时,反应能自发进行;
( 2 )等于0 时,反应处于平衡状态
( 3 )小于0 时,反应不能进行。
3. 通常用标准电极电势进行比较,当差值小于0.2 时,则考虑反应物浓度,介质酸碱性的影响,用能斯特方程计算。
4. 原电池是通过氧化还原反应将化学能转化为电能的装置,负极发生氧化反应,给出电子,正极发生还原反应,得到电子,电子通过导线由负极流向正极。
三、仪器和药品
仪器:数字式万用表、温度计、量筒、烧杯、NO2平衡仪
药品:
固体MnO2
酸HCl,H2SO4,
碱NaOH
盐KIO3、KClO3、Na2SO3、KMnO4、CuSO4、ZnSO4
其他KI-淀粉试纸,铜片,锌片
四、实验内容
五、问题、讨论
1. 介质的酸度变化时H2O2、Br2、Fe3+的氧化性有无影响?试从电极电势予以说明。
?。
高中物理实验九原电池电动势和电极电势的测定

实验十一 原电池电动势和电极电势的测定1 目的要求(1) 测定Cu-Zn 原电池的电动势及Cu 、Zn 电极的电极电势。
(2) 学会几种电极和盐桥的制备方法。
(3) 掌握可逆电池电动势的测量原理和UJ34型电位差计的操作技术。
2 基本原理凡把化学能转变为电能的装置称为化学电源(或电池、原电池)。
电池是由两个电极和连通两个电极的电解质溶液组成的。
如图3.1所示。
把Zn 片插入ZnSO 4溶液中构成Zn 电极,把Cu 片插在CuSO 4溶液中构成Cu 电极。
用盐桥(其中充满电解质)把这两个电极连接起来就成为Cu-Zn 电池。
可逆电池应满足如下条件:(1) 电池反应可逆,亦即电池电极反应可逆。
(2) 电池中不允许存在任何不可逆的液接界。
(3)即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
用电位差计测量电动势也可满足通过电池电流为无限小的条件。
在电池中,每个电极都具有一定的电极电势。
当电池处于平衡态时,两个电极的电极电势之差就等于该可逆电池的电动势,按照我们常采用的习惯,规定电池的电动势等于正、负电极的电极电势之差。
即: -+-=ϕϕE (1)式中:E 是原电池的电动势。
+ϕ-ϕ分别代表正、负极的电极电势。
其中:还原氧化ααϕϕlnZF RT -=++ (2)还原氧化ααϕϕln0ZF RT -=-- (3) 在式(2)、(3)中:+ϕ-ϕ分别代表正、负电极的标准电极电势.R=8.134J.mol -1.K -1。
T 是绝对温度。
Z 是反应中得失电子的数量。
F=96500C ,称法拉第常数。
氧化α为参与电极反应的物质的还原态的活度。
对于Cu-Zn 电池,其电池表示式为:Zn|ZnSO 4(m 1)||CnSO 4(m 2)|Cu其电极反应为:⎩⎨⎧+→→+++++e Zn Zn Cu e Zn Cu 2)(2)(Cu 2222αα负极反应:正极反应:其电池反应为:)()(2222+++++→+Zn Cu Zn Cu CuZn αα其电动势为:Zn Zn Cu Cu E ,,22++-=ϕϕ (4)+++-=2221ln20,,Cu CuCu CuCu F RT αϕϕ (5) +++-=2221ln20,,Zn ZnZn ZnZnF RT αϕϕ (6) 在式5和6中,Cu 2+,Zn 2+的活度可由其浓度m i 和相应电解质溶液的平均活度系数γ±计算出来。
原电池的电动势与电极电位(势)解读

Cu2+(aq) + 2e = Cu(s)
(阴极为精铜)
电解的应用: 电镀
电镀银 阳极Ag(s) (接原电池+极)
Ag → Ag+ + e (氧化反应) 阴极(镀件) (接原电池-极) Ag+ + e → Ag (还原反应)
例3. 原电池 锌锰干电池放电反应
负极(氧化反应): Zn(s) → Zn2+(aq) + 2e
正极(还原反应): MnO2(s) + H+(aq) + e → MnO(OH)(s) 2 MnO(OH)(s) → Mn2O3(s) + H2O(l)
合并,得总的放电反应: Zn(s) + 2 MnO2(s) + 2 H+(aq) → Zn2+(aq) + Mn2O3(s) + H2O(l)
同一溶液内的氧化还原反应过 程,电子转移时无定向运动,不 产生电流,只放热 (右图):
Zn CuSO 4 aq ZnSO4 aq Cu
(一)原电池 (续)
若选择适当的电极, 组装为“原电池”, 使转移的电子定向运 动→产生电流。
原电池: 是化学能→电能的装 置。
右 图 : Daniell 电 池 (锌-铜原电池)
诺基亚试产百部燃料电池耳机
左起依次为耳机、燃料电池
锂电池
2005年12月,日本生产出锂电池驱动汽车, 最高时速超过300 km/h.
▪ 手机.
例5. 锌汞纽扣电池
电解池原电池电动势电势计算

电解池原电池电动势电势计算电解池是一种将化学能转化为电能的装置。
在电解池中,通过电解反应使电流产生,从而把化学能转化为电能,是化学电池中最常用的一种。
电解池的原电池电动势就是在标准状态下,由电解反应引起的电动势,是电解池中化学能转变为电能的能力。
下面是电解池原电池电动势的电势计算方法。
一. 原电池电动势的定义原电池电动势E0是指在标准活化状态下,以纯物质作氧化剂和还原剂,产生1mol电子时,电池中的电势差。
二. 标准电极电势的测定标准电极电势是指在标准条件下,电化学电池中氧化反应和还原反应中电子的转移系数都是1时所测定的电极电势,它是用标准电极强度计测定的。
三. 标准电动势计算公式标准电池电动势的计算公式是:E0cell = E0cathode - E0anode其中,E0cell是标准电池电动势,E0cathode是还原电极的标准电极电势,E0anode是氧化电极的标准电极电势。
对于化学方程式2H+ + 2e− → H2,它的标准电极电势为0V。
对于化学方程式Cu2+ + 2e− → Cu,它的标准电极电势为+0.34V。
因此,铜/铜离子电池的标准电池电动势为:E0cell = E0cathode - E0anode = 0V - (+0.34V) = -0.34V四. 温度影响对于每个化学电池来说,它的电动势都会随着温度的变化而变化。
五. 氧化还原电位氧化还原电位是一种描述氧化还原反应趋势的物理量。
在实际应用中,氧化还原电位的计算、测定与预测是很关键的。
六. 应用范围电解池原电池电动势的电势计算是电化学基础知识之一,它在工业、生物、医学、环保等领域都有着广泛的应用。
对于电解池中的原电池电动势,它的电势计算是非常重要的,只有通过电势计算才能确定电池的电势差,从而实现化学能和电能之间的转化。
原电池电动势与电极电位

5. 可逆电池
例如电池
Pt,H2|HCl(α) |AgCl|Ag
当该电池在放电与充电时两极上进行的反应分别为: 负极 放电 充电 1/2H2 = H+ + eH+ + e- = 1/2H2 正极 放电 充电 AgCl + e- = Ag + ClAg + Cl- = AgCl + e-
可以看出,电极反应是可逆的,即充电时的电极反应恰好 是放电反应的逆过程;充放电在无限接近平衡状态下进行的; 该电池时单液电池,不存在其他不可逆过程。
测定电动势时必须正确断路,才能使电动势等于两 个相同金属的外电位之差,可以测量。
5. 可逆电池
可逆电池具备以下三个条件: 可逆电池具备以下三个条件: (1)原电池的两个电极必须是可逆电极。即电池的化学 )原电池的两个电极必须是可逆电极。
反应可逆。
(2)电极上通过的电流无限小,也即是电极反应进行得 )电极上通过的电流无限小, 无限缓慢。 无限缓慢。即电池的能量转换是可逆的。 (3)电池中所进行的其他反应也是可逆的,即当反向电流 ) 通过电池时, 通过电池时,电极反应以外的其他部分的变化也应当趋向于 恢复到原来的状态。 恢复到原来的状态。
Pt , H 2 ( p $ ) | H + ( a H + =1) | H 2 ( p $ ),Pt(s)
C u 2 + | C u(s) Ag + | Ag(s) Au 3 + | Au(s)
E(Ox|Red) = 0 E (Ox|Red) > 0
(自发电池)
3. 氢标电极电位ϕ在计算中的应用
(1)根据原电池两个电极的电位求电动势。 一个自发电池的电动势等于正极的电极电位与负 极的电极电位之差。 (2)计算某电极反应的电极电位。 根据电极电位已知的两个电极反应,通过设计电 池,求未知反应的电极电位 。
原电池电动势的测定及应用实验报告

原电池电动势的测定及应用实验报告实验目的1、学会Cu、Zn电极的制备和简单处理方法。
2、测定Cu-Zn原电池的电动势和Cu、Zn电极的电极电势。
3、掌握电位差计(包括数字式电子电位差计)的测量原理和正确使用方法。
实验原理电池电动势E的测定必须是在热力学可逆的条件下进行。
因此在测定时,首先要求被测电池反应本身是可逆的,即要求电池的电极反应是可逆的,并且不存在不可逆的液体接界,同时要求电池在放电或充电过程都必须在平衡态或无限接近平衡态下进行,即要求通过电池的电流无限小。
当一个可逆的化学反应是在无限缓慢的情况下进行时,就可以认为该电池的反应是在接近热力学可逆的条件下进行的。
而一个电池反应的快慢是以通过该电池电流的大小反映的,当通过电池的电流无限小时,则该可逆电池的反应就是在接近热力学可逆的情况下进行的。
为了使可逆电池在接近热力学可逆条件下进行,通常采用根据补偿法或称对消法(在外电路上加一个方向相反而电动势几乎相等的电池)设计的电位差计来测量电池的电动势。
液体接界电势的存在会破坏电池的可逆性,所设计的电池要尽量避免出现液接界,在精确度要求不高的测量中,常用“盐桥”来减小液接界电势。
电位差计(示意图如下),是利用补偿法测量直流电动势(或电压)的精密仪器,其工作原理如图所示:工作电源E,限流电阻R p,滑线电阻R AB构成辅助回路,待测电源E x(或标准电池E n),检流计G和R AC构成补偿回路。
按图中规定电源极性接入E、E x,双向开关K打向2,调节C点,使流过G中的电流为零。
(称达到平衡。
若E<E x或E、E x极性接反,则无法达到平衡),则E x=V AC=I R AC 即E x被电位差I R AC所补偿。
I为流过滑线电阻R AB的电流,称辅助回路的工作电流。
若已知I和R AC就可求出E x。
实际的电位差计,滑线电阻由一系列标准电阻串联而成,工作电流总是标定为一固定数值I0,使电位差计总是在统一的I0下达到平衡,从而将待测电动势的数值直接标度在各段电阻上(即标在仪器面板上),直接读取电压值,这称为电位差计的校准。
大学物理化学实验报告-原电池电动势的测定

物理化学实验报告院系化学化工学院班级化学061学号13姓名沈建明实验名称:原电池电动势的测定日期2009.03.26 同组者姓名史黄亮室温16.84℃气压101.7 kPa成绩一、目的和要求1.学会一些电极的制备和处理方法;2.掌握对消法测定电池电动势及电极电势的原理和方法;3.熟悉数字式电子电位差计的工作原理和正确的使用方法。
二、基本原理测定电池电动势必须要求电池反应本身是可逆的,即电池必须在可逆的情况下工作,此时只允许有无限小的电流通过电池。
因此根据对消法原理(在外电路上加一个方向相反而电动势几乎相等的电池)设计了一种电位差计,以满足测量工作的需要。
T温度下的电极电势ψT=ψTθ-(RT/2F)*ln(1/a);—a= r±*m (r±参见附录表V-5-30)ψTθ=ψ298θ+α(T-298)+0.5β(T-298)^2—α,β为电池电极的温度系数:铜电极(Cu2+/Cu),α=-0.000016 V/K,β=0锌电极[Zn2+/Zn(Hg)],α=0.0001 V/K,β=0.62*10-6 V/K三、仪器、试剂SDC-Ⅱ数字电位差综合测试仪、YJ56电镀仪毫安表、饱和甘汞电极、U型玻璃管等;0.1000mol/L CuSO4溶液、0.0100mol/L CuSO4溶液、0.1000mol/L ZnSO4溶液、Hg2Cl2溶液、饱和KCl溶液、琼脂、氯化钾(A.R.)、铜片、锌片等。
四、实验步骤㈠、电极制备Ⅰ. 铜电极①取2片铜片,用沙皮纸将其表面打磨干净,再放入稀硝酸溶液中处理片刻,用蒸馏水冲洗干净;②将处理后的铜片放入电镀液(0.1000mol/L CuSO4溶液)中,与电源的负极相连,电源的正极与另一片铜片相连,回路中连有一只毫安表,调节电镀装置使毫安表的读数为40左右,电镀约1h;Ⅱ. 锌电极①取一片锌片,用沙皮纸将其表面的氧化物打磨去除,放入稀硫酸溶液中片刻,使其表面氧化物进一步反应完全;②用蒸馏水冲洗锌片后,将其放入Hg2Cl2溶液约6秒钟,使其表面汞齐化;③取出后再用蒸馏水淋洗,用纸吸干表面的水,放入0.1000 mol/L ZnSO4溶液中备用;㈡、制盐桥①在100ml烧杯中加入适量蒸馏水,用电磁炉煮沸;②称取12g琼脂和20g纯KCl,加入沸水中③待固体完全溶解至溶液成浆糊状时,用胶头滴管将液体注入U型玻璃管中,注满且没有气泡;④冷却后即为盐桥;㈢、测定各组电池的电动势a.(-) Zn|ZnSO4(0.1000mol/L)‖KCl(饱和)|Hg2Cl2|Hg (+)b.(-) Zn|ZnSO4(0.1000mol/L)‖KCl(饱和)|AgCl|Ag (+)c.(-) Hg|Hg2Cl2|KCl(饱和) ‖CuSO4(0.1000mol/L) |C u (+)d.(-) Ag|AgCl|KCl(饱和) ‖CuSO4(0.1000mol/L) |Cu (+)e.(-) Zn|ZnSO4(0.1000mol/L)‖CuSO4(0.1000mol/L) |Cu (+)f.(-) Cu|CuSO4(0.0100mol/L)‖CuSO4(0.1000mol/L) |Cu (+)①打开数字式电位差计的电源,打到内标档,各旋钮打至0处,按下归零按钮;②切换到测量档,将以上电池的正负极对应数字式电位差计的正负极连接好;③调整各旋钮,使右侧显示值为零(有时需要等待片刻至数值稳定),此时左侧显示的数值即被测电池的电动势;④依次测定6组电池的电动势并记录下数据。
实验六十七 原电池电动势的测定及其应用

四、实验步骤
3、电动势测定
1)根据Nernst公式计算实验温度下电池1、2、3、4、5、 6的电动势理论值。 2)正确接好测量电池1的线路。用SDC数字电位差计测 量电池1的电动势。每隔2分钟测一次,共测三次。 3)同法,用SDC数字电位差计测量电池2、3、4、5、6 的电动势,要测至平衡时为止。 4)测量完毕后,倒去小烧杯的溶液,洗净烧杯。饱和甘 汞电极淋洗后,浸入饱和氯化钾溶液中保存。
五、注意事项
1、为使极化影响降到最小,测量前可初步估算被测 电池的电动势大小,以便在测量时能迅速找到平衡点。 2、测量电池电动势时,在对消点前,测量回路有电 流通过,在测量过程中不能使测量回路一直连通,应接 通一下调一下,直至平衡。 3、为判断所测量的电动势是否为平衡电势,可在约 15 min内等间隔地测量7~8个数据。若这些数据是在平 均值附近摆动,偏差小于±0.5 mV,则可认为已达平衡, 并取最后三个数据的平均值作为该电池的电动势。 4、盐桥不能完全消除液接电势,一般仍剩余1~2mV, 所以测得结果只能准至mV。
能否用伏特计来测量E ?
EX U IR内
I 0,U EX
电池与伏特计接通后有电流通过,在电池两极上会发生极 化现象,使电极偏离平衡状态。另外,电池本身有内阻,伏特 计所量得的仅是不可逆电池的端电压。 因此电池电动势不能直 接用伏特表来测定。 利用电位差计可在电池无电流(或极小电流)通过时测得 其两极间的电势差,即为该电池的平衡电动势。
2、电池组合
四、实验步骤
将饱和KCl溶液注入50mL小烧杯中作为盐桥,得 电池1: Zn|Zn2+(0.1000mol· -1)||Cu2+(0.1000mol· -1)|Cu L L 电池2: Zn|Zn2+(0.1000mol· -1)||KCl(饱和)|Hg2Cl2(s)|Hg(l) L 电池3: Hg(l)|Hg2Cl2(s)|KCl(饱和)||Cu2+(0.1000mol· -1)|Cu L 电池4: Cu | Cu 2+(0.0100mol· -1)||Cu2+(0.1000mol· -1)|Cu L L 电池5: Zn|Zn2+(0.1000mol· -1)||KCl(饱和)|AgCl(s)|Ag L 电池6: Ag|AgCl(s)|KCl(饱和)||Cu2+(0.1000mol· -1)|Cu L
原电池电动势测定及应用

原电池电动势测定及应用原电池是一种能够将化学能转化为电能的装置。
常见的原电池有干电池、铅酸蓄电池、镉镍蓄电池等。
原电池的电动势是指,在电池内部两个不同电极材料之间,由于电化学反应而产生的电压差。
电动势越大,电池的输出电流和电能就越大,电池的性能也就越好。
本文将介绍原电池电动势的测定方法和其应用。
1. 理论计算法原电池电动势可通过化学反应式计算。
例如,在铅酸蓄电池中,反应式为Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O,化学反应式中所涉及的各元素的标准电极电势都是可以测定的。
因此,可以通过这些标准电极电势,计算出铅酸蓄电池的电动势。
2. 电位差法电位差法是通过将原电池与标准电池相比较,从而测定原电池电动势的一种方法。
假设现在要测量一个铅酸蓄电池的电动势,可以将该电池的电极接到标准氢电极上,并将另一电极与标准铜电极相连。
然后通过电桥法或伏安法测出两电极之间的电位差,从而计算出原电池的电动势。
3. 外施电势法外施电势法是一种直接测量原电池电动势的方法。
首先将原电池的电极接到电阻上,然后将其另一端连接到外部电源的正极上,使得原电池与外部电源并联。
通过调节外部电源的电势差,使得原电池电路中的电流为0,此时外部电源的电势差即为原电池的电动势。
原电池电动势的测定方法可以应用于电池的性能评估、研究和开发。
在电池的生产过程中,需要对电池电动势进行测定,以保证电池的性能能够满足设计要求。
在电池的研究和开发中,电动势的测定可以帮助研究人员评估不同电化学反应条件下的原电池电动势,从而优化电池的性能,提高其效率和能量密度。
在实际应用中,原电池的电动势可以用于驱动电子元件和机械设备等。
例如,在闪光灯中,闪光灯电路中的闪光灯管需要较高的电压来激发气体放电,电动势较高的铅酸蓄电池可以满足这个要求。
在无线传感器网络中,原电池电动势可以用来提供稳定的电源,使得传感器节点能够长时间工作。
总之,原电池电动势的测定和应用可以帮助我们更好地认识和应用电池,从而更好地满足我们的日常和工业生产需求。
实验十六 电极电位和原电池电动势的测定
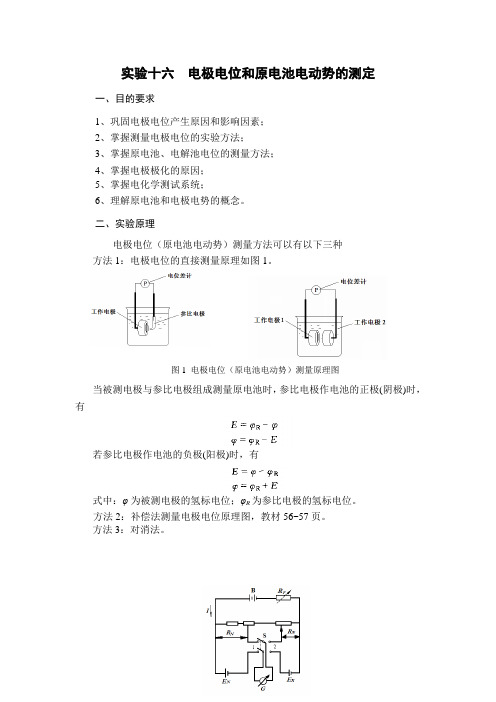
图1 电极电位(原电池电动势)测量原理图实验十六 电极电位和原电池电动势的测定一、目的要求1、巩固电极电位产生原因和影响因素;2、掌握测量电极电位的实验方法;3、掌握原电池、电解池电位的测量方法;4、掌握电极极化的原因;5、掌握电化学测试系统;6、理解原电池和电极电势的概念。
二、实验原理电极电位(原电池电动势)测量方法可以有以下三种 方法1:电极电位的直接测量原理如图1。
当被测电极与参比电极组成测量原电池时,参比电极作电池的正极(阴极)时,有若参比电极作电池的负极(阳极)时,有式中:φ为被测电极的氢标电位;φR 为参比电极的氢标电位。
方法2:补偿法测量电极电位原理图,教材56~57页。
方法3:对消法。
图2 补偿法测量电极电位测量原理图对消法测定电动势就是在所研究的电极(电池)的外电路上加一个方向相反的电压。
当两者相等时,电路的电流为零(通过检流计指示)。
此时,所研究的电池的电动势就可以从外电路的电压数值读出。
原电池是由两个“半电池”组成,每个半电池中有一个电极和相应的溶液。
由不同的半电池可以组成各式各样的原电池,电池中的正极起还原作用,负极起氧化作用,电池的电动势等于两个电极电位的差值:左右ϕϕϕϕ-=-=-+E++++=a nFRT ln 0ϕϕ---+=a nFRT ln 0ϕϕ例如Cu-Zn 电池 Zn|ZnSO 4(a 1)||CuSO 4(a 2)|Cu Zn 的电极电位22201ln2Zn Zn ZnZnZn RT Fa ϕϕ+++=-Cu 的电极电位22201ln2C u C u C uC uC u R T Fa ϕϕ+++=-Cu-Zn 电池的电动势为:++++--=2222Cun /ZnZnCu0ln2)(ααϕϕZ Cu/FRT E三、仪器与药品电化学测试系统 1套 饱和甘汞电极 1只 盐桥 1个 电解池 1套 Cu 电极片 1个 Fe 电极片 1个容量瓶 1个 量筒 1个 广口瓶 3个 饱和KCl 溶液CuSO4(0.1mol.L-1)溶液 CuSO4(0.01mol.L-1)溶液 NaCl (0.1mol.L-1)溶液 四、实验步骤图4 工作电极的结构示意图1、电极制备工作电极表面要平整,不能出现尖角或台阶,这些结构将会影响电极电位的分布。
电极电势的测定---电位差计法

电极电势的测定---电位差计法一、实验目的1.测定Cu-Zn电池的电动势和电极的电极电势;2.学会一些电极的制备和处理方法;3.掌握电位差计的测量原理和正确的使用方法。
4.了解通过原电池电动势测定求算有关热力学函数的原理。
二、实验原理电位差计是采用补偿原理测量电动势(或电压)的一种精密仪器,工作原理如图所示。
其中Rx、Rn和具有滑点C点的电阻R均是电位差计的构件。
而由工作电源Ew、电阻Rf(可以调节)、R及Rx串联而成的电路称辅助电路。
通过调节Rf可改变电路的工作电流。
使用电位差计,基本上可分为两个步骤掌握用万用电表测量电流、电压、电阻的方法。
对消法测定可逆电池电动势的电路图如图所示:图中:Ew: 工作电源E n:标准电池E x:被测电动势R n: 标准电池的补偿电阻;Rx:被测电池的补偿电阻;R: 调节工作电流的变阻器; G: 检流计如上图:可逆电池电池电动势可用电位差计法(对消法)测定,所用仪器为电位差计,原理如图:滑动触点C用于调节电阻R分配在测量回路中的电阻R x的大小。
R n的阻值大小根据工作电池选择,R由已知电阻值的各进位盘组成,通过它可以调节不同的电阻数值与其电位降E x相抵消。
测量时先将开关K合在1的位置上,然后调节r使G指向零点,这时:E n=I*R n得到:I= E n/ R n(1)I为通过R n和R的电流,成为电位差计的工作电流。
工作电流调好后,将K合至2的位置上,同时选进各进位盘的触头C,再次使G指向零点,则:E x=I*R c(2)合并(1)式和(2)式得:E x=(E n/ R n)*R c在完全补偿(G=0)时,工作电路与被测回路之间并无电流通过,只要测得E n/ R n的值,即可在高灵敏度示零的情况下准确测出被测电池的电动势。
标准电池电动势E n/V与温度T/K的关系为:E n=1.01865-4.05×10-5(T-293)2-9.5×10-7(T-293)2 +1×10-8 (T-293)3凡把化学能转变为电能的装置称为化学电源(或电池、原电池)。
原电池电动势银电极电极电势

1.掌握电位滴定法测量离子浓度的一般原理; 2.学会用电位滴定法测定难溶盐的溶度积常数。
二、实验原理
1.原电池:
甘汞电极(参比电极)ㄧ待测溶液ㄧ银电极(指示电极)
银电极电极电势: (Ag , Ag) ( Ag , Ag) RT ln a(Ag )
nF
原电池电动势:
E
K
RT nF
ln
a(Ag )
K
RT nF
ln[
Ag ]
2.卤化银沉淀溶解平衡
Ag+ + X-
AgX
沉淀溶解平衡时:[Ag+]·[X-] =Ksp,
银离子与卤离子完全反应时:[Ag+]=[X-]
所以滴定终点时:[Ag] [X ] Ksp
此时: E K S ln[ Ag ]
3.终点确定方法(作图法):
三、实验内容
①20.00mL水样溶液 25.00mLH2O (100mL烧杯)
②50.00mL蒸馏水 5D6MHNO3 (100mL烧杯) 0.5gBa(NO3)2
3D6MHNO3
搅拌
0.5g录V、E
四、数据记录与处理
E~lg[Ag+]
( 一 )
( 二 )
水
样
测
定
关 系 的 确 定
(三)结果计算(已知c(AgNO3)= mol/L
注: 应用内插法确定终点V (AgNO3)、终点电位E
五、思考题
1.与化学分析法中的容量法相比,电位滴定 法有何特点?
2. 如何计算滴定反应的理论电位值?
电池电动势的测定——实验报告

原电池电动势的测定实验目的1.测定Cu—Zn电池的电动势和Cu、Zn电极的电极电位。
2.了解可逆电池、可逆电极、盐桥的概念。
3.学会一些电极的制备和处理方法。
4.掌握电位差计的测量原理和使用方法。
5.掌握简易电位差计的组装和使用。
实验原理Daniell电池 Zn|ZnSO4(C1)||CuSO4(C2)|Cu负极反应 Zn→Zn2+(αZn2+)+2e-正极反应 Cu2+(αZn2+)+2e-→Cu总电池反应 Zn + Cu2+(αCu 2+)→Zn2+(αZn2+)+ Cu反应的Δr Gm为ΔrGm=ΔrGΘm+RTln(αZn2+/αCu2+)Δr G m=-nFEΘ E=EΘ-RT/2Fln(αZn2+/αCu2+)E=φ+-φ-φ+=φΘCu2+-RT/2Fln(1/αCu2+)φ-=φΘZn2+-RT/2Fln(1/αZn2+)仪器与药品晶体管直流稳压电源1台,电阻箱(9999.9Ω)3个,指针检流计(10A)1台,双刀双掷开关1个,单刀双掷开关(带保护电阻)1个,标准电池1个,甘汞电极1个,铜电极2支,锌电极1支,电极管4支,50ml烧杯4只,饱和KCl溶液,0.1000mol*L-1 CuSO4溶液,0.0100mol*L-1 CuSO4溶液,0.1000mol*L-1 ZnSO4溶液,待测半电池若干个。
实验步骤1.按图接好线路,将R4调在1018.6Ω,R3调在581.4Ω,使R3+R4=1600Ω,接通直流稳压电源,双刀双掷开关掷向标准电池一边调节R2至检流计不偏转为止。
2.接上待测电池,双刀双掷开关掷向待测电池一边,R2保持不变,调整R3及R4。
直到检流计指针不偏转为止,记下读数。
注意:在调整R3及R4时。
应使R3+R4应使等于1600Ω。
将双刀双掷开关掷向待测电池一边,再次复查检流计是否偏转,若不偏转上述测定值可以使用,若有偏转须重调R2使之不偏转,然后掷向待测电池一边重复测定。
原电池电动势和电极电势的测定
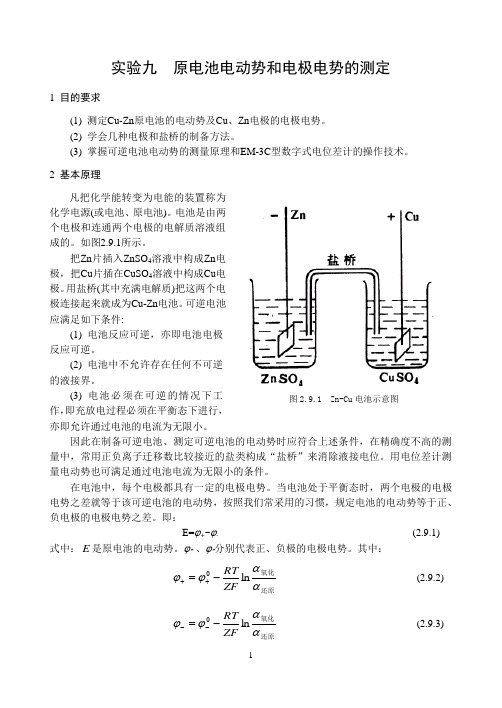
实验九 原电池电动势和电极电势的测定1 目的要求(1) 测定Cu-Zn 原电池的电动势及Cu 、Zn 电极的电极电势。
(2) 学会几种电极和盐桥的制备方法。
(3) 掌握可逆电池电动势的测量原理和EM-3C 型数字式电位差计的操作技术。
2 基本原理凡把化学能转变为电能的装置称为化学电源(或电池、原电池)。
电池是由两个电极和连通两个电极的电解质溶液组成的。
如图2.9.1所示。
把Zn 片插入ZnSO 4溶液中构成Zn 电极,把Cu 片插在CuSO 4溶液中构成Cu 电极。
用盐桥(其中充满电解质)把这两个电极连接起来就成为Cu-Zn 电池。
可逆电池应满足如下条件:(1) 电池反应可逆,亦即电池电极反应可逆。
(2) 电池中不允许存在任何不可逆的液接界。
(3) 电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。
因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。
用电位差计测量电动势也可满足通过电池电流为无限小的条件。
在电池中,每个电极都具有一定的电极电势。
当电池处于平衡态时,两个电极的电极电势之差就等于该可逆电池的电动势,按照我们常采用的习惯,规定电池的电动势等于正、负电极的电极电势之差。
即:E=ϕ+-ϕ- (2.9.1) 式中:E 是原电池的电动势。
ϕ+ 、ϕ-分别代表正、负极的电极电势。
其中:还原氧化ααϕϕln0ZF RT -=++ (2.9.2) 还原氧化ααϕϕlnZF RT -=--(2.9.3)在式(2.9.2)、(2.9.3)中:ϕ+、ϕ-分别代表正、负电极的标准电极电势。
R=8.134J.mol -1.K -1。
T 是绝对温度。
Z 是反应中得失电子的数量。
F=96500C ,称法拉第常数。
α氧化为参与电极反应的物质的还原态的活度。
对于Cu-Zn 电池,其电池表示式为:Zn|ZnSO 4(m 1)||CnSO 4(m 2)|Cu其电极反应为:⎩⎨⎧+→→+++++e Zn Zn Cu e Zn Cu 2)(2)(Cu 2222αα负极反应:正极反应:其电池反应为:)()(2222+++++→+Zn Cu Zn Cu Cu Zn αα其电动势为: Zn Zn Cu Cu E ,,22++-=ϕϕ (2.9.4)+++-=2221ln20,,Cu CuCu CuCu F RT αϕϕ (2.9.5) +++-=2221ln20,,Zn ZnZn ZnZnF RT αϕϕ (2.9.6) 在式2.9.5和2.9.6中,Cu 2+, Zn 2+的活度可由其浓度m i 和相应电解质溶液的平均活度系数γ±计算出来。
原电池电动势的测定 实验报告

电池结构
Hg(I), Hg2Cl2(s)|KCI(饱和)||AgNO3(aAg+)|Ag(s)
银电极的反应
2Ag+ + 2e- -→2Ag(s)
甘汞电极的反应
2Hg(s)-2e- + 2Cl-→Hg2Cl2(s)
电池的电动势
= +, − 22,
电动势值。
3.按所得标准电池电动势标定电位差计的工作电流。
4.测定下列电池的电动势
(1)饱和甘汞电极|| AgNO3 (0.1000mol-L-1) | Ag (s)。
() | Ag(s)。
(二)实验实际步骤
1.开机
用电源线将仪表后面板的电源插座与~220V 电源连接,打开电源开关,
预热 15 分钟后再进入下一步操作。
2.以内标为基准进行测量
(1)校检:用测试线将被测电动势按“+”、
“-”极性与“测量插孔”
连接,负极(黑线)连接饱和甘汞电极,正极(红色)连接 Ag 电极。将
测量旋钮置于“内标”
。将“10°”处的旋钮置于“1”处,“补偿”旋钮
逆时针旋到底,并将其他旋钮处于“0”,此时,电位指示显示“1.00000”
/(mol/L)
电动势 E/V
平均电动势 E/V
1.按饱和甘汞电极的电池电动势温度校正公式,计算室温时饱和甘汞
电极的电极电势。
因为 T=21.0℃,
由22 , =0.2412-6.61x10^-4(t-25)-1.75x10^-6(t-25)^2-9.0x10^-10
物理化学实验报告
实验名称:
原电池电动势的测定
一、化学工程学院物理化学实验报告----预习部分
原电池电动势的测定及其应用实验报告

原电池电动势的测定及其应用实验陈述林传信 高分子101 1017051012一、实验目的1、理解电极、电极电势、电池电动势、可逆电池电动势的意义2、掌握用对消法测定电池电动势的基来源根基理和数字式电子电位差计的使用方法3、学会几种电极和盐桥的制备方法二、对消法侧电动势的基来源根基理:丈量电动势只能在无电流通过电池的情况下进行,因此需要用对消法(抵偿法)来测定电 动势。
对消法测定电动势就是在所研究的电池的外电路上加一个方向相反的电压。
当两者 相等时,电路的电流为零(通过检流计指示)。
对消法测电动势经常使用的仪器为电位差计, 其简单原理如图所示A C A C E E X S 12=电极电势的测定原理:原电池是化学能转变成电能的装置,在电池放电反应中,正极(右边)起还原反应,负极起 氧化反应。
电池的电动势等于组成的电池的两个电极电位的差值。
即: E=+ϕ—-ϕ=右ϕ—左ϕ氧化还原ααϕϕθln ZF RT -=-+氧化还原ααϕϕθln_ZF RT -=- R=8.314J •11--⋅K molF=96500Cα为介入电极反应的物质的活度。
纯固体物质的活度为1。
浓差电池:一种物质从高浓度(或高压力)状态向低浓度(或低压力)状态转移,从而发生电动势,而 这种电池的尺度电动势为零。
三、电池组合:⑴Hg Cl g KCl L mol ZnSO Zn 224H )()1.0(饱和 ⑵Cu L mol KCl Cl Hg Hg )(饱和0.1CuSO )(422 ⑶Cu L mol SO Cu L mol ZnSO Zn )1.0()1.0(44⑷Cu L mol CuSO Cu L mol CuSO )1.0()01.0(44四、数据处理实验室温度T=281.15 尺度电动势Es=1000.03mV五、误差分析 在较长的电极电势丈量过程中,工作回路中电流发生变更,导致丈量误差 部分电解质溶液在丈量过程中发生电解,浓度变更影响丈量的结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
(饱和甘汞)
Cu
2
,Cu
Zn
,Zn
和
Zn
2
,Zn
仪器装置
标准电池 待测电池 工作电源
检流计
电位差计
三、实验步骤
连接时应 注意极性
1. 将标准电 池、工作电 池、检流计 与电位差计 面板相应位 置相连。
2. 调节工作 电池电压约 为 2 V。
3. 计算标准电池的电动势,并调节电位差计面板上的温度补偿旋钮。 标准电池电动势:
基础化学实验——物理化学
原电池电动势和电极电 势的测量
西北大学国家级化学实验教学示范中心
知识点及实验技能训练要点
知识点:
原电池电动势、电极电势、能斯特方程。
实验技能训练要点:
常用电极的制备;检流计、标准电池、稳压电源、
电位差计的使用;原电池电动势的测定。
一、实验目的 二、实验原理 三、实验步骤 四、注意事项 五、实验总结 六、实验延伸 七、思考题
(三)电极电势、电池电动势
每个电极都具有一定的电极电势。当电池处于平衡态时, 两个电极的电极电势之差就等于该可逆电池的电动势,即
E
RT 还原 ln zF 氧化
E是原电池的电动势
RT 还原 _ _ ln zF 氧化
和
分别代表正、负极的电极电势。
5. 测未知电池电动势
“盐桥”的作用是什么?
(1)组装Cu-Zn电池: 在两个干净的小烧杯内分别加入30 mL 0.10 mol/kg ZnSO4和CuSO4溶液,以饱和KCl盐桥联通两烧杯。分别插入打磨干净的Zn、 Cu电极,电极导线与电位差计面板上未知电池1或未知电池2相接。
(2)将电位差计面板 上的转换开关(N、 X1、X2)置于“X1” 或“X2”位置,依次 从大到小调节面板中 部的六个旋钮,直至 检流计不再偏转为止。 读出数字,即为CuZn电池的电动势。 (3)同理测量其他未知电池电动势
电池反应:Zn+Cu2+ (Cu2+) Cu+Zn2 ( Zn2)
该电池的电动势:E Cu2 ,Cu Zn2 ,Zn
Cu
2
,Cu
Cu2 ,Cu
RT 1 ln ZF Cu2
Zn
2
,Zn
RT 1 Zn 2 ,Zn ln ZF Zn2
锌电极的标准电极电势
一、实验目的
1. 学会几种电极和盐桥的制备方法; 2. 掌握对消法测量可逆电池电动势的原理; 3. 掌握UJ-25型电位差计的使用方法; 4. 学会电池的电动势的测定; 5. 计算Cu、Zn电极的电极电势。
二、实验原理
(一)可逆电池
凡把化学能转变为电能的装置称为原电池(或电池)。 电池由两个电极和连通两个电极的电解质溶液组成。 对定温定压下的可逆电池而言:
T
5. 计算电池(1)的 ET(理论) ,并进一步计算 E(理论) T 计算其相对误差。
公式中注意使 用活度
(二). 讨论
1. 工作电源要有足够的容量,才能保证工作电流恒定。
Et / V 1.018646 [40.6(t / ℃ 20) 0.95(t / 20)2 0.01(t / 20)3 ]106
4. 调节工作电流: 将(N、X1、X2) 转换开关置于“N” 依次旋动粗”、 “中”、“细”、 “微” ,直至 检流计不再偏转 为止。 若检流计总朝一 个方向偏转,应 如何排查?
(r Gm )T , p nFE
E可借助于电 位差计测定
式中,F为法拉弟 (Farady)常数; n为电极反应式中 电子的得失数;E 为电池的电动势。
(二)电位差计
电位差计是利用补偿法在电池无 电流(或极小电流)通过时测得 两电极的电位差
工作原理图
E为工作电源 电压 En为标准电 池电动势 Ex为未知电 池电动势
R=8.134 J· mol-1· K-1; F=96500 C· mol-1; T是绝对温度;z
是反应中得失电子的数量,α为参与电极反应的物质的活度。
以Cu-Zn电池为例,其电池表达式为:
Zn ZnSO4(m1) CuSO4 (m2) Cu
负极反应:Zn-2e- Zn2 ( Zn2) 正极反应:Cu2 ( Cu2) + 2e- Cu
五、实验总结
(一).数据处理
1. 写出实验时的室温t及该温度下标准电池的电动势值Et;
2. 列出各电池电动势的测量值:
a) (-)Zn | ZnSO4(0.10 mol/kg)‖CuSO4 (0.10 mol/kg) | Cu (+) E = b) (-)Cu | CuSO4 (0.01 mol/kg)‖CuSO4 (0.10 mol/kg) | Cu(+) E = c) (-)Zn | ZnSO4 (0.10 mol/kg) ‖饱和甘汞电极(+) d) (-)饱和甘汞电极‖CuSO4(0.10 mol/kg) | Cu (+) E= E=
四、注意事项
• 1. 标准电池属精密仪器,行测量前最好先估算电动势的大小。
3. 按电计按钮的时间要短(< 1s),不能一直按下按钮;调节 旋钮时,电计按钮要松开。 4. 为了避免使用汞齐电极时汞的污染,本实验直接使用高纯 度的锌片和铜片为电极,使用前要打磨、冲洗、烘干。 5. 饱和甘汞电极使用时要将电极帽取下,用毕后用饱和氯化 钾溶液浸泡。
铜电极的标准电极电势
(Cu 2+) m2
(Zn 2+) m1
选择一个电极电势已知的电极,如饱和甘汞电极,让它 与Cu电极组成电池,该电池的电动势为:
E Cu2 ,Cu (饱和甘汞)
由饱和甘汞电极的电极电势温度校正公式求得
测得电动势E,则可以确定 进而可求出 同理可以确定
3. 根据饱和甘汞电极的电极电势温度校正公式,计算实验 温度时饱和甘汞电极的电极电势; 4. 电池(3)、(4)的电动势测量值结合饱和甘汞电极的电极电势:
(a) 分别计算铜、锌电极的 T ;
(b) 分别计算铜、锌电极的 T 。
公式中注意使 用活度
(c) 由电极电势温度校正公式分别计算铜、锌电极 (理论) 计算其相对误差。
