s区元素 PPT课件
第十一章-S区元素ppt课件

图片
Be Mg Ca Sr
Ba
Chapter Eleven
5
单质的物理性质:
有金属光泽 密度小 硬度小 熔点低 导电、导热性好
Gc2-705-18.9 图片
s区单质的熔点变化
Chapter Eleven
6
Chapter Eleven
Chapter Eleven
11.2 单质的化学性质
一、与氧、硫、氮、卤素反应
钠长石: NaAlSi3O8
菱镁矿: MgCO3
钾长石: KAlSi3O8
石膏: CaSO4 2H 2O
光卤石:
KCl MgCl2 6H 2O
大理石: CaCO3 萤石 CaF2
明矾石:
天青石: SrSO4
K(AlO)3 (SO4 )2 3H 2O
锂辉石:LiAl(SiO3 )2
重晶石: BaSO4
25
2 锂与镁的相似性: ⑴ 单质与氧作用生成正常氧化物 ⑵ 氢氧化物均为中强碱,且水中溶解度不大 ⑶ 氟化物、碳酸盐、磷酸盐均难溶 ⑷ 氯化物均能溶于有机溶剂中 ⑸ 碳酸盐受热分解,产物为相应氧化物
Chapter Eleven
26
六、S区元素的存在
均以矿物形式存在:
绿柱石:Be3Al2 (SiO3 )6
小阳离子和小阴离子或者大阳离子和大阴离子形 成的化合物的溶解度小,
小阳离子与大阴离子或大阳离子与小阴离子形成 化合物溶解度大。
Chapter Eleven
23
四、含氧酸盐的热稳定性
1. 硝酸盐热稳定性差
2. 碳酸盐
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
T分 /℃ <100 540
元素化学 第二章s区元素

碱金属与碱土金属
(4)溶解度 碱金属氢氧化物(MOH)易溶于水,放热 碱土金属氢氧化物在水中溶解度小于碱金 属氢氧化物。
氢氧化物 溶 解 度 -1 /m o l· L B e(O H ) 2 8× 10
-6
M g (O H ) 2 5× 10
-4
C a(O H ) 2 1 .8 × 1 0
-2
1
1. s区元素概述 1.1 s区元素 碱金属(IA ): ns1 氧化态为+1 s区 Li, Na, K, Rb, Cs, Fr 碱土金属(IIA ): ns2 氧化态为+2 Be, Mg, Ca, Sr, Ba, Ra 都是活泼金属
2
碱金属与碱土金属
存在形式 (1)钠和钾: 熔盐NaCl、海水 天然氯化钾、光卤石(KCl) (2)钙和镁: 白云石 、方解石 、菱镁矿 、石膏 (3)锶和钡: 天青石(SrSO4) ,重晶石(BaSO4)
2NH
2
H 2 (g)
2 Na( s) 2 NH 3 (l ) 2 NaNH 2 H 2 ( g )
(4) 焰色反应 碱金属和碱土金属中的钙、锶、钡及其挥发 性化合物在无色火焰中灼烧,火焰有特征颜橙红 深红 绿
Li
Be
B
Al
C
Si
34
Na Mg
碱金属与碱土金属
4.2 锂与镁的相似性 ⑴ 单质与氧作用生成正常氧化物 ⑵ 氢氧化物均为中强碱,且水中溶解度不大 ⑶ 氟化物、碳酸盐、磷酸盐均难溶 ⑷ 氯化物均能溶于有机溶剂中 ⑸ 碳酸盐受热分解,产物为相应氧化物
碱金属与碱土金属
3.3 氢氧化物 制备: M 2O
H 2 O 2 MOH
MO H 2 O M ( OH ) 2
无机化学第七章S区元素

无机化学第七章S区元素第七章主要介绍了S区元素的性质和应用。
S区元素是指周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素具有一些共同的性质和特点,包括氧化态的规律和趋势、同族元素的化学性质等。
S区元素的氧化态规律和趋势是其重要的特点之一、氧化态是指元素在化合物中的电荷数。
在S区元素中,氧通常呈-2的氧化态,露卜那呈-1的氧化态,硫、硒和碲的氧化态则比较复杂,可以是正或负的多个值。
这种规律是由于这些元素的外层电子结构决定的。
氧的外层有6个电子,可以通过接受2个电子来填满外层,从而达到稳定的8个电子的结构。
而露卜那的外层只有一个电子,可以通过捐赠一个电子来达到稳定的结构。
而硫、硒和碲的外层电子结构类似,有6个电子,可以通过得失2个电子来达到稳定的8个电子的结构。
在S区元素中,氧是一个非金属元素,而硫、硒和碲则是亚稳金属。
氧具有较高的电负性,能够与其他元素形成较强的电负性键。
它在自然界中广泛存在,包括空气中的氧气、水中的水分子等。
由于氧的高电负性,它可以与其他元素形成氧化物,包括过氧化物、酸性氧化物和碱性氧化物等。
氧化物有着重要的应用,例如过氧化氢可用作漂白剂和消毒剂。
硫、硒和碲是黄顺子亚稳金属,它们具有较高的化学活性。
它们主要存在于矿石中,包括铁矿石中的硫化铁矿石。
硫还广泛存在于化学品中,包括硫酸、硫酸铜等。
硫还可以形成众多的无机化合物,例如硫化物和亚硫酸盐。
硫化物在冶金工业中有重要应用,例如焦炭的熔融炉和脱硫设备。
在亚稳金属中,硒是比较特殊的元素。
它可以形成六亚硒酸盐,具有良好的光敏性。
六亚硒酸盐可以用于摄影中的胶片和相纸的显影剂,以及红外线辐射计的探测剂。
此外,硒还可以形成硒化物,具有一定的半导体性能。
碲也是一种亚稳金属,具有类似硒的性质。
它可以形成一种黑色固体的碲化铋,具有比较好的半导体性能。
碲化铋被广泛应用于红外线成像和热电传感器等领域。
除了硫、硒和碲,S区元素中还有钋,它是一种放射性元素。
普通化学S区元素
的电力。一座100千瓦的电厂一年消耗5吨锂。(扎布耶湖)
S区元素用途
金属钠
1. 作为还原剂制造某些难熔的金属如铀、钍、锆等,特别
是还原制备钛:
加热
TiCl4 + 4 Na
Ti + 4 NaCl
2. 因具有高的导热性和低的中子吸收能力,被用做快速增
殖反应堆的致冷剂。
3. 制作钠电缆、钠基电池和钠硫电池等。
(3) 焰色反应 (flame reaction)
碱金属和碱土金属的化合物在无色火焰中燃烧 时 , 会 呈 现 出 一 定 的 颜 色 , 称 为 焰 色 反 应 (flame reaction)。可以用来鉴定化合物中某元素的存在,特 别是在野外。
元 素 Li
Na K
Rb
Cs
Ca
Sr
Ba
颜 色 深红 黄 紫 红紫 蓝 橙红 深红 绿
3.形成配位氢化物
4LiH AlCl 3 (无水)乙醚Li[AlH 4 ] 3LiCl
铝氢化锂
Li[AlH 4 ] 受潮时强烈水解 LiAlH 4 4H 2O LiOH Al(OH) 3 4H 2
12.3.2 氧化物
1.形成三类氧化物 正常氧化物(O2-):1s2 2s2 2p6 过氧化物(O22-):
钾的最主要用途是制造钾肥。
庄稼是非常需要钾的。庄稼缺乏钾,茎秆便不会硬挺直立,易倒伏,对外界的抵抗力也大大减强。平均起来,每收获一吨小麦或 一吨马铃薯,就等于从土壤中取走五公斤钾;收获一吨甜萝卜,相当于取走二公斤钾。全世界平均每年要从土壤中取走2,500万吨钾! 有 入 才 有 出 , 这 也 就 是 说 , 全 世 界 每 年 必 须 至 少 要 往 土 壤 中 施 加 合 钾 2,500 万 吨 的 钾 肥 ! 含钾的化学肥料,主要有硝酸钾、氯化钾、硫酸钾、碳酸钾。人们是从钾长石(花岗岩)、海水等中提取钾的化合物。特别是海水,含 有不少氯化钾。在农家肥料中,以草木灰,特别是向日葵灰,含钾最多,这是因为植物本来就从土壤中吸收了钾,那么,把它烧成灰 后,灰中当然也就含有钾了。在每吨粪便中,大约含有六公斤钾。
s 区 元 素

s 区元素
一、 s区金属
1. s区元素的通性
s区金属又称为成碱金属,包括第Ⅰ A族的碱金属元素Li、Na、K、 Rb、Cs、Fr和第Ⅱ A族的碱土金属元素Be、Mg、Ca、Sr、Ba和Ra。 它们以卤化物、硫酸盐、碳酸盐和硅酸盐存在于地壳中。Rb、Cs在自 然界存在较少,是稀有金属;Fr和Ra是放射性金属,Fr放射性极强,半 衰期极短,在天然放射性衰变和核反应中可形成微量的Fr,而Ra首先被 玛丽·居里(Marie Curie)从沥青油矿中分离出来,其所有的同位素都具 有放射性且寿命最长,如226Ra的半衰期为1602年。
s区元素
成碱金属能与水迅速反应放出氢气,所以不能在水溶 液中用于还原任何物质,但可成为非水介质中有机化学反 应的重要还原剂。同时也是高温条件下从氧化物或氯化物 中制备稀有金属的重要还原剂。当然,这些反应必须在真 空或稀有气体保护下进行。
对比锂和镁的性质,不难发现在它们之间有许多相似 之处,如它们都能与氧或者氮直接化合生成氧化物、氮化 物,它们的氢氧化物、碳酸盐、磷酸盐等都难溶于水。
s 区元素
成碱金属的基本性质列入表8-2中。成碱金属在物理 性质方面表现出金属的外观和良好的导电性,但硬度、熔 点和沸点与其他金属相比很低。这是因为成碱金属成键电 子数少,金属键弱,反映在宏观性质上表现出低熔点、低 沸点和低硬度的特点。第Ⅰ A和第Ⅱ A族元素的电子构型 分别为ns1和ns2,它们能失去1个或2个电子形成氧化数为 +1或+2的离子型化合物。同族中它们的有效核电荷相等, 但自上而下,原子(离子)半径依次增大,电离能、电负 性逐渐降低,金属活泼性增强。
碱金属氢化物中以LiH最稳定,加热到熔点也不分解。其他碱金 属氢化物的稳定性较差。LiH能与AlCl3在无水乙醚中反应生成LiAIH4 (氢配合物):
教学课件第九章s区元素概述讲解

§9-3 氧化物和氢氧化物
一、氧化物
Na2O2+2H2O=H2O2+2NaOH 2H2O2=2H2O+O2↑
2MO2+2H2O=O2+H2O2+2MOH
与水反应
2MO3+2H2O=2O2+H2O2+2MOH
M2O+CO2 = M2CO3
与CO2反应
2M2O2+CO2==2M2CO3+O2 4MO2+2CO2=2M2CO3+3O2
盐类的溶解性和热稳定性。〉 §9-4 锂,铍的特殊性和对角线规则。
§9-1 s区元素概述
第IA族包括锂、 钠、钾、铷、铯 和钫六种元素, 由于它们的氢氧 化物都是易溶于 水的强碱,所以 称它们为碱金属 元素。其中钫是 放射性元素。
ⅠA ⅡA
Li Be Na Mg K Ca Rb Sr Cs Ba Fr Ra
同一周期的金属氢Biblioteka 化物,从右到左碱 性增强。一、晶型
§9-4 盐类
碱金属和碱土金属离子型晶体大多数为NaCl型和CsCl型
面心立方构型,配位数均为6 简单立方构型,配位数均为8
§9-4 盐类
二、溶解性
碱金属盐类易溶,少数难溶:
锂盐:氟化锂 LiF、碳酸锂Li2CO3、 磷酸锂Li3PO4.5H2O 钠盐:六羟基锑酸钠 Na[Sb(OH)6] (白)
碱金属可以用小刀切割,具有金属光泽,但 很快会被氧化而失去光泽 。
成键特征
§9-1 s区元素概述
1、以离子键为主,ⅠA族是离子键特征最强 的元素,其次是ⅡA族;
2、可以形成共价化合物的元素是:Li、Be、 Mg等,气态的Na2、Cs2也是共价分子。
§9-2 单质的化学性质
单质的物理性质
碱金属特殊物理性质: 密度小 钾钠保存于煤油中,锂保存于蜡中。 硬度小 用小刀可以切割它们。
普通化学S区元素

超氧化物(O2-)
KK(σ 2s )2 (σ * 2s )2 (σ 2p )2 (π 2p )4 (π * 2p )3
稳定性: O2- > O2- > O22-
2.制备:
直接:2Na O2 Na 2O2 K O2 KO 2
ns2铍beryllium镁magnesium钙calcium原子半径增大金属性还原原子半径增大金属性还原性电离能电负电离能电负性钾potassium铷rubidium铯caesium钫francium钙calcium锶strontium钡barium镭radium性增强性减小原子半径减小金属性还原性减弱电离能电负性增大原子半径减小金属性还原性减弱电离能电负性增大s区元素概述有金属光泽密度小硬度小熔点低导电导热性好的特点有金属光泽密度小硬度小熔点低导电导热性好的特点1
钾的最主要用途是制造钾肥。
庄稼是非常需要钾的。庄稼缺乏钾,茎秆便不会硬挺直立,易倒伏,对外界的抵抗力也大大减强。平均起来,每收获一吨小麦或 一吨马铃薯,就等于从土壤中取走五公斤钾;收获一吨甜萝卜,相当于取走二公斤钾。全世界平均每年要从土壤中取走2,500万吨钾! 有 入 才 有 出 , 这 也 就 是 说 , 全 世 界 每 年 必 须 至 少 要 往 土 壤 中 施 加 合 钾 2,500 万 吨 的 钾 肥 ! 含钾的化学肥料,主要有硝酸钾、氯化钾、硫酸钾、碳酸钾。人们是从钾长石(花岗岩)、海水等中提取钾的化合物。特别是海水,含 有不少氯化钾。在农家肥料中,以草木灰,特别是向日葵灰,含钾最多,这是因为植物本来就从土壤中吸收了钾,那么,把它烧成灰 后,灰中当然也就含有钾了。在每吨粪便中,大约含有六公斤钾。
常见重要元素及其化合物—S区重要的元素及其化合物(医用化学课件)

在同周期元素中,碱金属的原子半径最大,而核电荷
最小。由于内层电子的屏蔽作用较强,故这些元素很容易 失去最外层的一个s电子,从而使碱金属的第一电离势在同 周期元素中为最低。因此,碱金属是同周期元素中金属性 最强的元素。 M - e - → M+ 极强的还原性
二、碱金属
(二)钠、钾的物理性质和化学性质 1. 钠、钾都是银白色金属,有一定导电性和导热性,熔
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 砹氡
注:人体必需宏量元素,人体必需微量元素,__为有害元素
一、卤族元素
非 金 属 性 逐 渐 减 弱
一、卤族元素
(一)概述
ⅦA: F Cl Br I At (X) ns 2np5
卤素的基本性质
焰色反应 钠和钾发生焰色反应时,钠为黄色,钾为紫色(隔蓝色钴玻璃观察)。
二、碱金属
2.在隔绝空气的条件下,钠、钾均可与水反应,生成氢氧化 物并放出氢气。
2Na + H2O = NaOH+H2↑
二、碱金属
(三)钠和钾的重要化合物
与水反应 2Na2O2 + 2H2O
4NaOH + O2
Na2O2 + H2SO4(稀) 过氧化物 与稀硫酸反应
金属单质都能形成晶体结构,金属呈电中性。
一、金属通论
(二)金属的物理性质和化学性质
物理 性质
化学 性质
具有特殊金属光泽、不透明 银导电性最好。
具有良好的导电性、导热性 铂延性最好。
密度和硬度较大
金展性最好
具有延展性 熔点较高
锇密度最大 (2248g/cm3)。 铬硬度最大。 钨熔点最高,汞熔点最
《s区和p区元素》课件

欢迎来到《S区和P区元素》PPT课件!在本节中,我们将探索元素周期表中的 S区和P区元素,素
元素周期表中分为S区和P区两个区域,S区元素包含具有特殊电子结构的元素,而P区元素则包含一般元素。
S区元素的特点
S区元素具有特殊的电子结构,导致其在物理和化学性质上有独特的表现。
P区元素的特点
P区元素的电子结构与S区元素不同,因此它们在物理和化学性质上与S区元素 有所不同。
S区元素的分类
S区元素可以进一步分为碱金属元素、碱土金属元素、过渡金属元素和内过渡 金属元素。
P区元素的分类
P区元素包括典型非金属元素、金属loid元素和金属元素,它们具有不同的性 质和特点。
应用举例
通过几个具体的例子,我们将探讨S区和P区元素在现实生活中的应用。
总结
通过对S区和P区元素的比较,我们可以更好地理解它们的区别和联系,并分析它们在未来的应用前景。
大学无机化学第十二章S区元素PPT课件

碱土金属的导电性和 导热性良好,其良好 的延展性也使其易于 加工。
碱土金属的密度较大, 且随原子序数增加而 增大。
碱土金属的化学性质
碱土金属的化学性质活泼,有较 强的还原性,容易失去电子成为
正离子。
碱土金属离子具有较强的水合能 力,易与水反应生成氢氧化物。
碱土金属的氧化物大多数为碱性 或两性氧化物,表现出较强的碱
镓的化合物在医药、农业和电子工业等领域也有广泛应用。
镓、铟、铊的性质和用途
铟的性质和用途
铟是一种银白色的软金属,具有较好的延展性和导电性,主要用于制作液晶显示 器和电子元件。
镓、铟、铊的性质和用途
铊的性质和用途 铊是一种银白色的金属,具有较低的熔点和沸点,主要用于制作高温温度计和光电管等器件。
铊的化合物在医药和农业等领域也有一定的应用。
铋的性质和用途
铅是一种青白色的金属,具有较高的密 度和耐腐蚀性,主要用于制作电池、颜 料和涂料等材料。
铅的化合物在医药、农药和染料等领域 也有广泛应用。
THANKS
感谢观看
S区元素在周期表中的位置
总结词
S区元素在周期表中占据第1列和第2 列的位置。
详细描述
在周期表中,S区元素占据第1列和第 2列的位置,这些位置对应于元素周期 表的s区和p区。这些元素具有相似的 电子构型和化学性质,通常表现出强 烈的金属性质。
S区元素的特点和性质
要点一
总结词
S区元素具有低原子序数、小原子半径、高电离能、低电子 亲和能等特点。
大学无机化学第十二章s 区元素ppt课件
• S区元素的概述 •氢 • 碱金属 • 碱土金属 • 其他S区元素
01
S区元素的概述
S区元素的定义
无机化学课件12-s区元素

对土壤的影响
土壤污染
S区元素在工业生产过程中 可能通过废渣、废气等途 径进入土壤,导致土壤污 染。
土壤质量下降
这些元素在土壤中积累, 可能影响土壤的理化性质 ,导致土壤质量下降。
农产品安全问题
被污染的土壤可能影响农 作物的生长和品质,进而 影响农产品安全。
对大气的影响
大气污染
S区元素可能以气态或颗粒物的形 式排放到大气中,造成大气污染 。
SUMMAR Y
01
S区元素的概述
定义与特性
定义
S区元素指的是元素周期表中第12族(IIIB族)的元素,包括钪(Sc)、钇(Y )、镧(La)、锕(Ac)等。
特性
S区元素都是金属元素,具有金属的通性,如导电、导热、延展性等。它们在化 学反应中通常表现出较强的还原性,易于失去电子成为正离子。
S区元素在自然界中的存在形式
金属氢化物是S区元素与氢反应生成的化合物,它们具有高的能量密度和稳定性。金属氢化物在能源储存和转换领域有潜在的 应用价值。
金属氢化物在工业中有一定的应用,如作为储氢材料和制备其他金属氢化物的原料。此外,一些金属氢化物还具有特殊的物 理和化学性质,可用于制备新型材料和器件。
REPORT
CATALOG
环保催化剂
利用硫元素制备的催化剂可用于 处理工业废气,降低污染物排放 。
合成新物质
含硫化合物
硫单质或硫化物可与其他元素合成多 种含硫化合物,如硫酸、硫代硫酸盐 等。
高分子材料
含硫元素的高分子材料具有特殊性能 ,如耐高温、抗氧化等,在航空、航 天等领域有广泛应用。
REPORT
CATALOG
DATE
REPORT
CATALOG
DATE
S区元素

Ca
Sr
Ba
197.3 215.1 217.3 99 593 1152 4942 1.00 112 552 1070 4351 0.95 134 564 971 3575 0.89
第一电离势 第二电离势 第三电离势 电负性 标准电极电势(酸) 标准电极电势(碱) M2+(g)水合热/kJ· -1 mol
Mg 镁 戴维在关于他发现碱土金属元素的论文中
有这样一段话:“令那土质稍带潮气,并 与三分之一的红氧化汞混合,再将混合物 放在白金片上,这片上做有一个窝窑好接
受重为五六十克的水银。将全部器物用一
薄层石脑油遮盖起来,以白金片为正极, 水银为负极,与电池相连接。”戴维用这 种方法成功地制得取钙汞齐。再将钙汞齐 加热,蒸出其中的汞,就得到了银白色的 Humphry Davy分离
KClO4、 Li3PO4 、 K2Na[Co(NO2)3]
•硝酸盐热稳定性差。
•碱土金属碳酸盐的稳定性随金属离子 半径的增大而增强。
BeCO3 MgCO3 CaCO3 SrCO3 BaCO3
10.3.2 氧化物
1.形成三类氧化物
2-): s 2 2s 2 2p6 正常氧化物(O 1
过氧化物(O22-):
KK (σ 2s ) 2 (σ * 2s ) 2 (σ 2p ) 2 (π 2p ) 4 (π * 2p ) 4
超氧化物(O2-)
KK (σ 2s ) (σ
2 * 2s
) (σ 2p ) (π 2p ) (π
菱镁矿:MgCO3
CaSO 4 2H2 O 石膏: 大理石: CaCO3 萤石:CaF2
天青石:SrSO 4
重晶石:BaSO 4
§10.3
s区元素的化合物
第七章 S区元素
Li+
红
Na+
黄
K+ 紫
Rb+ 紫红
Cs+ 紫红
Sr2+ 红
Ca2+ 橙红
Ba2+ 黄绿
无机化学 特别注意:焰色反应是物理变化,不是化学变化
s区元素的单质及其化合物的性质
(1)单质在空气中燃烧,形成相应的氧化物: Li2O BeO Na2O2 MgO KO2 CaO RbO2 SrO CsO2 BaO2
防毒面具的填料 高空飞行或潜水作业的供氧剂 CO2吸收剂
无机化学
s区元素的单质及其化合物的性质
氢氧化物的酸碱性
LiOH 中强 Be(OH)2 两性 NaOH KOH 强 强 Mg(OH)2 Ca(OH)2 中强 强 RbOH CsOH 强 强 Sr(OH)2 Ba(OH)2 强 强
(箭头指向) 溶解度增大, 碱性增强
180.5 1342 97.82 882.9 63.25 760 38.89 686 28.40 669.3
原子序数 Ca 价电子构型 碱金属和 、 Sr 、 Ba (pm ) 均可用刀切割 (℃ ) (℃ ) ∧ (金刚石=10) ∧ ∨ ∧ 属晶体中的金属键很不牢固. 故单质的熔、沸
IA 核电荷 原子半径 熔、沸点 硬度 因为原子的原子半径较大、核电荷较少 ,其金 硬度 金属半径 熔点 沸点 点较低,硬度较小 原子半径 熔、沸点 2 3s 160 648.8 Cs 是最软的金属
Li
无机化学
Na
K
金属钠与水的反应在实验室用于干燥有机溶剂,但不能用于干燥醇
2 s区元素的单质及其化合物的性质
氧化物的化学性质
(1) 与H2O的作用(生成相应的碱)
第九章 s区元素

溶解性:
碱金属氢氧化物,除LiOH,都溶于水。 碱土金属氢氧化物:Be(OH)2, Mg(OH)2难溶, 从Be(OH)2到 Ba(OH)2溶解度增大。
碱性: Be(OH)2为两性, LiOH,Mg(OH)2中强碱,
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 Si + 2NaOH + H2O = Na2SiO3 + 2H2 卤素、硫、磷等在碱中能发生歧化反应。
X2 + 2NaOH = NaX + NaXO + H2O X=Cl,Br,I
9.4 盐 类
9.4.1 晶型 9.4.2 溶解性 9.4.3 含氧酸盐的热稳定性
同一族从上到下,反应剧烈程度增加。Li2O, BeO, MgO反应缓慢。
2.过氧化物
除Be外都可形成过氧化物
Na2O2 白色粉末(工业品一般为黄色),可用作 氧化剂,漂白剂和氧气发生剂。
性质:与水、稀酸、CO2作用 Na2O2 + 2H2O = 2NaOH + H2O2 Na2O2 + H2SO4 = Na2SO4 + H2O2 Na2O2 + 2CO2 = 2Na2CO3 + O2 H2O2易分解 H2O2 = 2H2O + O2 2Na2O2 + 2 H2O(热) = 4NaOH + O2
第九章 s区元素
9.1 s区元素概述 9.2 单质的化学性质 9.3 氧化物和氢氧化物 9.4 盐类 9.5 锂、铍的特殊性和对角线规则
无机化学第五版s区元素42页PPT

41、学问是异常珍贵的东西,从任何源泉吸 收都不可耻。——阿卜·日·法拉兹
42、只有在人群中间,才能认识自 己。——德国
43、重复别人所说的话,只需要教育; 而要挑战别人所说的话,则需要头脑。—— 玛丽·佩蒂博恩·普尔
44、卓越的人一大优点是:在不利与艰 难的遭遇里百折不机化学第五版s区元素
36、如果我们国家的法律中只有某种 神灵, 而不是 殚精竭 虑将神 灵揉进 宪法, 总体上 来说, 法律就 会更好 。—— 马克·吐 温 37、纲纪废弃之日,便是暴政兴起之 时。— —威·皮 物特
38、若是没有公众舆论的支持,法律 是丝毫 没有力 量的。 ——菲 力普斯 39、一个判例造出另一个判例,它们 迅速累 聚,进 而变成 法律。 ——朱 尼厄斯
大学一年级无机化学PPT课件-第十二章-S区元素(1)

Li2O Na2O2 KO2 RbO2 BeO MgO CaO SrO
CsO2 Ba2O2
Li2O
Na2O2
Gc2-706-18.12
KO2
具有很高的化学活泼性,能直接或间接地
与电负性较高的非金属元素形成相应的化台
物。如可与卤素、硫、氧、磷、氮和氢等元
素相化合。一般均形成离子化合物(除Li、Be
及Mg的卤化物外)。例如锂与氮气反应
6Li + N2 = 2Li3N
镁
与
碱土金属活泼性略差, 二
室温下这些金属表面缓
氧 化
慢生成氧化膜。它们在 空气中加热发生反应,
碳 反 应
生成氧化物和少量氮化
物(如:Ca3N2、Mg3N2)。
因此在金属熔炼中常用Li、Ca等除去溶解 在熔融金属中的氮气和氧气,在电子工业中 常用Ba除去真空管中痕量氮气和氧气,在高 温时碱金属和碱土金属还能夺取某些氧化物 中的氧,如镁可使CO2的碳还原成单质。
碱土金属单质的某些典型反应
N2 M3N2 (M = Mg)
H2O M(OH)2 + H2 (M = Ca, Sr, Ba)
MO + H2 (M = Be, Mg)
水蒸气
MX2 O2
MO2 (M = Ba), MO
M
NH3
M(NH2)2 + H2
NaOH HMO2- + H2 (M = Be)
MH2 (M = Ca, Sr, Ba)
12.2.1 物理和化学性质 Physico-chemical property
12.2.2 矿物资源和金属单质制备 Natural recourses, elementary substance abstraction
第十二章 S区元素

2 制备:
直接: 2Na O 2 Na 2 O 2
K O2 KO2
间接: Na 2 O 2 2Na 2Na2 O
2KNO3 10K 6K2 O N 2
MCO3 MO CO 2 (g)
3 化学性质 (1) 与H2O的作用:
⑴ 硝酸盐热稳定性差
⑵
T分 /℃
BeCO3
<100
MgCO3 CaCO3
540 O C 900
2-
SrCO3 BaCO3
1290 1360
O
⑶ 稳定性 M2CO3> MCO3
O
§12.4 锂 、铍的特殊性 对角线规则
对角线规则
1 内容
Li Na Be Mg B Al C Si
2 锂与镁的相似性:
LiAlH4 4H2 O LiOH Al(OH)3 4H2
二.氧化物 1 形成三类氧化物
正常氧化物(O2-)
2-)
1s 2s 2 p
2 * 2s
2
2
6
过氧化物(O2 KK (σ 2s ) (σ
) (σ 2 p ) ( 2 p ) (π
2 2 4
*
2p
)
4
超氧化物(O2-) KK (σ 2s ) 2 (σ * 2s ) 2 (σ 2 p ) 2 ( 2 p ) 4 (π * 2 p )3
(箭头指向) 溶解度增大, 碱性增强
溶解度 MOH易溶于水,放热 碱土金属溶解度(20℃)
氢氧化物 溶 解 度 /mol·L-1 Be(OH)2 8×10-6 Mg(OH)2 5×10-4 Ca(OH)2 1.8×10-2 Sr(OH)2 6.7×10-2 Ba(OH)2 2×.易与H2直接化合成MH、MH2离子型化合物
无机化学PPT课件 元素化学 s区元素 p区元素 d区元素 ds区元素

第 三 部 分 元 素 化 学•熟悉元素性质与电子层结构的关系 •掌握单质和重要化合物的性质•了解它们在医药中的应用结束无机化学 2014/12/1 §12-15 : 2从上到下 半径增大 电离能减小 电负性减小第一节 s 区元素概述第十一章 s 区元素ⅠA ns 1 Li Na K Rb Cs ⅡA ns 2 Be Mg Ca Sr Ba碱金属 碱土金属从左到右,半径减小电离能增大 电负性增大除Li 和Be 外,多数金属形成离子化合物。
p273结束 无机化学 2014/12/1 §12-15 : 7NaHCO 3:小苏打,用于治疗胃酸过多和酸中毒; CaCO 3: 珍珠、钟乳石、贝壳的主要成分;Na 2SO 4·10H 2O : 中药称芒硝或朴硝,作缓泻剂; Na 2SO 4 :中药称玄明粉或元明粉,作缓泻剂; BaSO 4: 重晶石,难溶于水、酸、碱,能强烈吸收X 射线,因无毒用作胃肠造影剂之“钡餐”; BaCl 2:剧毒(致死量0.8g )。
CaSO 4·2H 2O 生石膏,内服清热泻火; CaSO 4· H 2O 熟石膏(煅石膏, 烧石膏)粉末遇水膨胀硬化,石膏绷带,外敷治疗烫伤疥疮等。
MgSO 4·7H 2O :又称泻盐,作缓泻剂。
四、重要的盐类 p28112结束无机化学 2014/12/1 §12-15 : 8 五、对角线规则 p282在周期表s 区和p 区,某元素与左上方或右下方的元素及其化合物的性质相似。
例如:Be 和Al 的还原性相近; Be(OH)2和Al(OH)3 均为两性;例如:LiCl,、MgCl 2 都是共价化合物; LiOH 、Mg(OH)2都是中强碱,微溶于水Li Be B C Na Mg Al Si结束 无机化学 2014/12/1 §12-15 : 9VIIA 族 n s 2n p 59F 17Cl 35Br 53I 85At一、卤族元素的通性 (p284)(1) 是非极性分子,难溶于水,易溶于有机溶剂及碘化钾溶液中:KI + I 2 = KI 3 碘酒(碘酊)(p306习题3) F 2→I 2 的熔点、沸点、密度增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
远不如相邻碱金属那样剧烈,
镁和铍在水和空气中因生成致密 的氧化物保护膜而显得十分稳定。
Question 2
Solution
锂的标准电极电势比钠或钾的标准电极 电势小,为什么 Li与水反应没有其他金属 与水的反应激烈?
电极电势属于热力学范畴,而反应剧烈程度属于动力 学范畴,两者之间并无直接的联系。 Li与水反应不激烈,主要原因(1)锂的熔点较高,与 水反应产生的热量不足以使其熔化; (2)与水反应的产物溶 解度较小,易覆盖在金属锂的上面,阻碍反应继续进行。 性 质 Li Na m.p./K 453.69 370.96 MOH 在水中的 5.3 26.4 溶解度/(mol· L-1) K Rb Cs 336.8 312.04 301.55 19.1 17.9 25.8
锂的原子半径最小、电离能最高,但其溶剂化程度(水合 分子数为25.3)和溶剂化强度 (水合焓为-519 kJ· mol-1 )却 是最大。
Eθ(Be2+/Be) 明显低于同族其余电对 , 与其高电离能有 关。无法被水合焓补偿: I1( Be ) I 2 ( Be ) 2.656 kJ mol 1
过氧离子O22-与F2为等电子体,有一个σ键 超氧离子O2-的结构有一个σ键和一个三电子π键
O O
2-
O
O
-
(2) 与水作用 ● 碱金属被水氧化的反应为: 2 M(s) + 2 H2O (l) → 2 M+(aq) + 2 OH-(aq) + H2(g)
Li
●
Na
K
碱土金属被水氧化的反应为:
M(s) + 2 H2O (l)→ M+(aq) + 2 OH-(aq) + H2(g)
Question 3
Solution
Li 的Eθ值为什么最负?Be的Eθ值最 小?
S 区金属元素相关电对的标准电极电势 E (单位:V)
Li+/Li Na+/Na K+/K Rb+/Rb Cs+/Cs -3.04 -2.71 -2.93 -2.92 -2.92 Be2+/Be Mg2+/Mg Ca2+/Ca Sr2+/Sr Ba2+/Ba -1.97 -2.36 -2.84 -2.89 -2.92
根据循环算得的准电 极电势与下表中的数据十 分接近。在计算时要用到 下面的公式:
θ r Gm
- nFE
(3)
焰色反应 (flame reaction) 碱金属和碱土金属的化合物在无色火焰中燃烧 时,会 呈 现 出 一定的颜色 ,称为焰色反 应 ( flame reaction)。可以用来鉴定化合物中某元素的存在,特 别是在野外。
元 颜
素 色
第9章
s 区元素
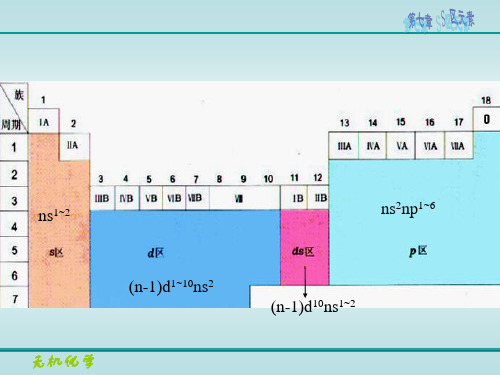
1. 价电子构型:ns1~2 2. 包含元素:IA族(碱金属) IIA族(碱土金属)
S区元素在周期表中的位置
§9-1 概述
碱金属 (alkalin metals) (ⅠA): ns1
电 离 能 、 电 负 性 减 小 金 属 性 、 还 原 性 增 强 原 子 半 径 增 大
碱土金属 (alkalin earth metals) (ⅡA): ns2 铍 beryllium
KO2
CaO
RbO2
SrO
CsO2
Ba O2
ቤተ መጻሕፍቲ ባይዱ
Question 1
Solution
为何空气中燃烧碱金属所得产物不同?
哪一个燃烧反应的Δ rGm负值最大,产物就是哪一个。 Na生成Na2O、Na2O2 和 NaO2的 ΔrGm分别是 ―376 kJ· mol-1, ― 430 kJ· mol-1和― 389.2 kJ· mol-1, 因此燃 烧产物就是 Na2O2 。
离子半径由上到下递增晶体结构中
水合离子半径由上到下递减水溶液中
§9-2 单质
1. 单质的物理性质
有金属光泽,密度小,硬
度小,熔点低、导电、导热
性好的特点
2. 单质的化学性质
(1) 与氧、硫、氮、卤素反应,形成相应的化合物 单质在空气中燃烧,形成相应的氧化物:
Li2O
BeO
Na2O2
MgO
锂 钠 钾
lithium sodium potassium
镁
钙 锶 钡 镭
magnesium
calcium strontium barium radium
铷 铯
钫
rubidium caesium
francium
金属性、还原性减弱
原子半径减小
电离能、电负性增大
1、几个问题的说明
(1).锂和铍的的特殊性
锂和铍离子半径都特别小(60和31pm)。因此其
极化能力很强,其化合物具有一定的共价性。
尤其是Be2+,离子半径特别小,电荷又高,因而
其化合物的共价性往往超过离子性。
LiI的共价性约为50%;BeI2的共价性约为75%。
(2).关于水合能
水合能是指反应M2+(g)+H2OM2+(aq)的热效应,即由气态
离子变为水合离子的热效应。离子的半径越小,电荷越高, 水合能越大,Li+、Be2+具有同族元素中最大的水合能。
同族元素由上到下水合能递减,结合的水分子数也递减,由
于水合分子数减小,造成水合离子的半径由上到下递减。在 离子交换柱上, Li+离子水合分子多,水合离子半径大,与树 脂结合力比较弱,因此在淋洗时先被淋洗下来。(p.197,表 9-3)
碱金属溶于水的能量变化及标准电极电势
性 质 Li Na 109.5 495.7 -413.8 197.3 -454.5 -275.2 -2.67 -2.71 K 91.5 418.6 -342.8 175.1 -454.5 -279.4 -2.90 -2.931 Rb 86.1 402.9 -321.9 165.1 -454.5 -289.4 -3.00 -2.98 Cs 79.9 375.6 -297.1 158 -454.5 -296.5 -3.07 -2.92 升华能 S/kJ•mol-1 150.5 -1 电离能 IM/kJ•mol 520.1 -1 水合能 HM/kJ•mol -514.1 θ 1 H1 / kJ • mol 163.1 θ 1 H 2 / kJ • mol -454.5 总焓变△Hm/kJ•mol-1 -291.4 θ / V (计算值) -3.02 θ (实验值) /V -3.0401
