1 多酚氧化酶活性测定
(精选)保护酶活性测定方法一、过氧化物酶(pod)活性测定1、酶液的制备...

保护酶活性测定方法一、过氧化物酶(POD)活性测定1、酶液的制备:称取样品3 g,加入预冷的0.05 mol/L pH7.8的磷酸缓冲液少量,用粗纱布过滤,定容至10ml,低温离心(12×104r/min,0~4℃)15min,取上清夜置于低温冰箱备用。
2、试剂:0.05 mol/L pH 5.5磷酸缓冲液0.05 mol/L 愈创木酚溶液(2-甲基酚)20%三氯乙酸溶液2%H2O23、仪器:分光光度计、离心机、研钵、容量瓶、量筒、试管、吸量管4、过氧化物酶活性测定:(1)加入反应混合液2.9 ml磷酸缓冲液1 ml愈创木酚溶液(2-甲基酚)1 ml H2O20.1ml酶液(2)37℃水浴锅中保温15min,迅速转入冰浴,并加入2ml三氯乙酸溶液终止反应(3)过滤,适当稀释。
在470nm处测OD470。
5、结果计算:以每分钟内OD变化0.01为1个酶活力单位。
即酶活力=OD×D / 0.01t酶的比活力= OD×D /(0.01tw)其中:OD为反应时间内吸光度的变化W为材料鲜重t为反应时间D为稀释倍数。
即提取的总酶液为反应系统内酶的倍数二、多酚氧化酶(PPO)活性测定1、酶液的制备:称取样品3 g,加入预冷的0.05 mol/L pH7.8的磷酸缓冲液少量,用粗纱布过滤,定容至10ml,低温离心(12×104r/min,0~4℃)15min,取上清夜置于低温冰箱备用。
2、试剂:0.05 mol/L pH 5.5磷酸缓冲液0.05mol/L儿茶酚溶液(邻苯二酚)20%三氯乙酸溶液2%H2O23、仪器:分光光度计、离心机、研钵、容量瓶、量筒、试管、吸量管4、多酚氧化酶活性测定:(1)加入反应混合液3.9 ml磷酸缓冲液1 ml 儿茶酚溶液0.1 ml酶液(2)37℃水浴锅中保温15min,迅速转入冰浴,并立即加入2ml三氯乙酸溶液终止反应。
(3)过滤,适当稀释。
多酚氧化酶活性测定及控制[文献综述]
![多酚氧化酶活性测定及控制[文献综述]](https://img.taocdn.com/s3/m/f3a63c7c580216fc700afd6b.png)
毕业论文文献综述生物工程多酚氧化酶活性测定及控制1 前言多酚氧化酶(PPO)广泛存在于自然界,在果实和蔬菜收获后,PPO所引起的反应常常会使果肉发生褐变、产生异味和损失营养。
本文总结了多酚氧化酶的活性测定方法以及对其活性的控制,主要研究了抑制剂对其活性的影响,为果蔬贮藏和加工中酶促褐变的防治提供思路。
多酚氧化酶(PPO)作为一种植物酶类,是引起果蔬褐变的主要因素。
鲜切果蔬因组织被切分使PPO与酚类底物的接触机会增加,酚类物质被氧化成棕褐色的醌,导致产品褐变。
抑制PPO活性取决于抑制剂的性质和浓度、底物的可利用性、pH值和温度。
一些还原剂、酶类、螯合剂和蜂蜜等均已被用于防止果蔬酶褐变。
本文主要总结了抑制剂对于控制果蔬PPO活性的研究。
2 主题部分2.1 从果蔬中提取PPO(以莲藕为例)2.1.1 丙酮法(丙酮法提取所得酶液比活力最高。
适合需大量制样时使用)将莲藕洗净,去皮,切碎,加4倍量预冷至.18。
C的丙酮(w/v为1:4)捣碎,搅拌3min,抽滤,冷风吹干残渣后,混匀,得丙酮粉。
称取丙酮粉O.5 g,加入0.2 mol/L,pH为5.4的预冷磷酸二氢钠.柠檬酸缓冲液20ml,搅拌3min,8 000r/min离心10min,所得上层清液即为粗酶液。
【1】2.1.2 匀浆法(匀浆法提取的酶液没有活性)将莲藕洗净,去皮,切碎,加入0.05mol/L,pH5.4的预冷磷酸氢二钠.柠檬酸缓冲溶液(含5%的PVPP),料液比为1:2.2,捣碎,搅拌,抽滤。
向滤渣中加入0.05mol/L,pH5.4磷酸氢二钠一柠檬酸缓冲溶液(W/V为1:1)再次搅拌,抽滤,两次滤液合并,8 000r/min离心10rain,所得上清液即为粗酶液。
【2】2.2.3 匀浆浸提法(匀浆浸提法提取所得粗酶液活性最高,操作简便,提取所得粗酶液活性高,且可以直接用于研究)(1)将莲藕洗净,去皮,切碎,加入0.05mol/L,pH5.4的预冷磷酸氢二钠.柠檬酸缓冲溶液(含5%的PVPP),料液比为1:2.2,捣碎,搅拌,4。
多酚氧化酶的测定方法

多酚氧化酶的测定方法试剂:1、0.02mol/l焦儿茶酚溶液:称0.22克焦儿茶酚溶于100毫升蒸馏水中,现用现配。
2、0.1mol/l碘酸钾:0.3567克碘酸钾溶于蒸馏水,定容至100毫升。
3、0.005mol/l碘液:碘化钾2.5克溶于200毫升蒸馏水中,加冰醋酸1毫升,再加0.1mol/l碘酸钾12.5毫升,最后加蒸馏水定容至250毫升。
4、pH6.0磷酸缓冲液:87.7毫升A+12.3毫升B,用蒸馏水稀释至200毫升。
贮备液A:0.2mol/l磷酸二氢钠(27.6g NaH2PO4·H2O用蒸馏水配成1000ml)。
贮备液B:0.2mol/l磷酸氢二钠(53.65g Na2HPO4·7H2O或71.7g Na2HPO4·12H2O用蒸馏水配成1000毫升)5、其它:1%淀粉;10%偏磷酸;0.1%抗坏血酸(现用现配)方法:1、粗酶提取:称取新鲜样品2克,剪碎,置于研钵中,加入少量pH6.0磷酸缓冲液和少许石英砂,于冰浴中迅速研磨至匀浆,将全部材料用缓冲液冲洗入50毫升容量瓶中,并定容至刻度。
在18~20度下每隔3分钟摇动1次,共5次,然后再静置15~20分钟,其上清液即为粗酶提取液(可倾入干洁的三角瓶中备用)。
2、活性测定:取干洁50毫升三角瓶6只(编号),按照下表向各瓶中加入pH6.0磷酸缓冲液、0.1%抗坏血酸、0.02mol/l 焦儿茶酚,并向③号瓶及⑥号瓶各加10%偏磷酸。
然后将三角瓶置于18~20度水浴或放在室温下使内外温度达到平衡之后,每隔1分钟向各瓶中依次加入酶液2毫升,全部加完后保温3分钟,再按原顺序仍然间隔1分钟向①、②、④、⑤号各瓶加入偏磷酸1毫升(注意:加完2号瓶后应间隔2分钟再加4号瓶),用于终止酶的活性。
最后向各瓶中加入1%淀粉溶液3滴作为指示剂,摇匀后用微量滴定管以0.005mol/l 碘液滴定,当溶液呈现淡蓝色为止,记录碘液消耗量。
多酚氧化酶的活性测定的报告

朴东日:多酚氧化酶活性的测定。
一、试验目的本试验的目的在于掌握多酚氧化酶活性测定的一般原理及操作技术。
二、试验原理酚氧化酶(PPO)催化各种酚与O2氧化为醌。
本实验是采用邻苯二酚为底物,在0.2M磷酸氢二钠-0.1M柠檬酸缓冲液PH6.0的反应体系中,PPO催化邻苯二酚形成褐色的醌,在分光光度计410nm处使反应体系的OD值产生变化,通过OD值上升的读数变化确定PPO的酶活大小。
三、试验材料、试剂及试验用品材料:李子样本80个(按照80个预算药品)李子处理:果实发育早期、果实发育中期、果实发育后期、发育中期果实用1-MCP处理、发育中期果实用乙烯处理。
药品:预冷的磷酸缓冲液(pH6.4)20mL1mL(0.1mol/L)邻苯二酚4mL磷酸缓冲液(pH6.4)四、实验方法:1.PPO的提取取1g李子果肉样品,冰浴研磨,加入预冷的磷酸缓冲液(pH6.4)20mL,在4℃下离心(4200r/min)10min,取上清液为蜜柚果肉PPO酶提取液。
2.PPO活性测定采用比色法测定。
将1mL(0.1mol/L)邻苯二酚加入4mL磷酸缓冲液(pH6.4)中,加入1mL酶液,立即于波长420nm下测定吸光度的变化,每隔20s记录1次,共记录3min。
以不加酶提取液的反应液做对照,以每分钟吸光度变化0.01为1个PPO酶活性单位。
3.最后作吸光度A与反应时间的关系曲线图,依据曲线最初直线段的斜率(ΔA/t)计算PPO活力。
(注意空白为:2.5 mL缓冲液和0.5 mL 0.01 mol/L邻苯二酚溶液)一个酶活力单位定义为:以每分钟每毫升增加吸光值0.001的酶量为一个酶活力单位U。
4.多酚氧化酶酶活的计算公式:E=M×60/V (式1)式中:M—每秒钟增加的吸光值V—粗酶液的体积/mL。
实验四多酚氧化酶的活性的测定及酶学性质

实验四多酚氧化酶的活性的测定及酶学性质This model paper was revised by the Standardization Office on December 10, 2020实验四、马铃薯块茎多酚氧化酶(PPO)活性测定及酶学性质一、实验目的1掌握分光光度法测定多酚氧化酶活性的一般原理及操作技术方法。
2了解酶的活性与植物组织褐变以及生理活动之间的关系。
二、实验原理马铃薯不耐储藏,在加工过程中去皮切分后非常容易发生酶促褐变,使外观品质和营养价值大为降低,制约着马铃薯的开发利用。
酶促褐变是马铃薯加工产业必须解决的难题。
其中多酚氧化酶是导致马铃薯等果蔬发生酶促褐变的重要酶类。
多酚氧化酶活性大小直接影响酶促褐变程度。
多酚氧化酶(polyphenol oxidase,PPO)又称酪氨酸酶、儿茶酚酶、酚酶等.是自然界中分布极广的一种含铜氧化酶.普遍存在于植物、真菌、昆虫的质体中。
植物受到机械损伤和病菌侵染后,PPO催化酚与O2氧化形成醌,使组织形成褐变.以便损伤恢复,防止或减少感染,提高抗病能力。
研究多酚氧化酶的特性对食品的加工与保藏工艺有非常重要的意义。
因此,检测食品中多酚氧化酶具有重要意义。
多酚氧化酶是一种含铜的氧化酶,在一定的温度、pH条件下,有氧存在时,能使催化邻苯二酚氧化生成有色物质,单位时间内有色物质在410nm处的吸光度与酶活性强弱成正相关,在分光光度计410nm处使反应体系的OD值产生变化,通过OD值的变化确定PPO的酶活大小。
多酚氧化酶邻苯二酚(儿茶酚)+1∕2O2——————→邻醌+H2O三、试验材料、试剂及试验用品1.材料:马铃薯块茎。
2.仪器:分光光度计;离心机;恒温水浴;研钵;试管;移液管;容量瓶3.试剂:L 磷酸缓冲液(pH=);L邻苯二酚;L磷酸氢二钠;L磷酸二氢钠;10mmol/L 柠檬酸;10mmol/L抗坏血酸;10mmol/L乙二胺四乙酸二钠(EDTA);10mmol/L亚硫酸钠四、实验方法:1.多酚氧化酶的提取取马铃薯块茎样品,加入预冷的磷酸缓冲液()3ml,研磨匀浆,转移到离心管中,再用7mL磷酸缓冲液冲洗研钵,合并提取液,在4℃下离心(8000r/min)5min,取上清液为多酚氧化酶提取液,并量取粗酶液体积。
酶的测定

一、过氧化物酶(POD)活性测定(愈创木酚比色法测定)酶液的制取称取0.5g鲜重叶片,加入1ml磷酸缓冲液(PH=7.8,0.05mol/L),冰浴研磨,研磨后再加入4ml磷酸缓冲液。
将研磨液倒入离心管中,平衡。
12000r/min、0-4℃下离心20min,上清液即为酶提取液。
离心后冷藏保存。
POD: 取上清液20微升加入比色杯中(对照加20微升磷酸),加3ml反应液,马上读470nm 下的OD值并计时,每隔1min读一次(读0,1,2min的OD值)。
反应液:PH=6.0的磷酸缓冲液50ml,加入愈创木酚28微升,于磁力搅拌器上加热溶解,加入30%H2O219微升混合保存于冰箱中。
POD活性=ΔA470*V/(a*W)V-酶液总体积(ml);a-测定时酶液体积(ml);W-样品重(g)可溶性蛋白含量的测定取上清夜20微升(对照加20微升水),加3ml考马斯亮蓝,放置2min后,马上于595mn 下比色。
样品蛋白质含量(mg/g鲜重)=(C*V/a)/(W*1000)C-查标准曲线所得每管蛋白质含量(mg);V-提取液总体积(ml);a-测定所取提取液体积(ml);W-取样量(g)。
可溶性蛋白含量(ug):y=0.0061x-0.0359(R2=0.9563)二、多酚氧化酶(PPO)活性测定(比色法测定)PPO活性的测定参照李焕秀(1994)的方法进行改进。
一、原理:多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化生成醌。
多酚氧化酶活性可以用氧电极测量反应耗氧的速度,或用比色法测量产物的形成,常用的底物如邻苯二酚(儿茶酚)和多巴。
二、材料:树皮韧皮部(分别在压条育苗前期、愈伤组织形成期、根原基形成期和不定根生长期进行取样)三、仪器与用具:高速低温台式离心机;分光光度计;1mL 、5mL的移液管;5mL离心管;研钵;试管数支;10mL容量瓶;秒表;水浴锅;四、试剂:1、0.1mol·L-1,pH 6.0的磷酸柠檬酸缓冲液;2、1%(10g/L)的邻苯二酚(1g用蒸馏水定容至100 mL);3、0.1%(1/L)的脯氨酸(0.1g(0.05)用蒸馏水定容至100 mL(50));4、石英砂;五、方法步骤1、酶液提取取鲜样0. 5-1.0g, 加1 mL 磷酸柠檬酸缓冲液(0.1mol·L-1,pH 6.0),加少量石英砂,在冰浴中研磨成匀浆,加缓冲液9mL稀释(按100mg鲜重材料加1mL提取液的比例),使终体积为10mL(研完冰盘放回冰箱)。
酶活性测定方法

一、过氧化物酶(POD)活性的测定POD测定参照李合生等(2003)的愈创木酚法方法进行测定,略加改动。
测定:称取样品0.5g,加入5mL 1/15mol/L PH=7.0的磷酸缓冲溶液,冰浴研磨成匀浆,4℃条件下12000r/min离心15min,上清液为粗酶液。
然后在试管中加pH 7.0的磷酸缓冲液2 ml,愈创木酚(0.2%)0.5ml,浓度为0.15%的H2O2 0.5ml,取0.3ml的酶提取液加入到试管中,空白以缓冲液代替。
在470nm下测定其吸光度,加入酶液时开始计时,每隔30s读数一次,连续记录5分钟。
以每分钟每克鲜重增加0.1的酶量作为一个酶活性单位。
△470 ×V TPOD活性=0.01×t×Vs×W式中:△470----反应时间内吸光度值的变化;V T ----提取酶液的总体积(ml)t----反应的时间(min)Vs ----测定时取用酶液体积(ml)W----样品鲜重(g)二、多酚氧化酶(PPO)活性的测定多酚氧化酶活性测定参照朱广廉等(1990)的方法,略加改动。
酶液制备:称取样品0.5g,加入5mL 0.1mol/L PH=6.0的磷酸缓冲溶液,冰浴研磨成浆,4℃条件下12000r/min离心15min后上清液即为粗酶液。
PPO活性测定:反应试管中分别加入0.1 mL酶液+3.9 mL磷酸缓冲液+ 1 mL 1m mol/L的邻苯二酚。
混匀后于30℃保温10 min,迅速加入2 mL质量分数为20%的三氯乙酸终止反应,立即于525nm下测定其吸光度值,计算酶活。
PPO活性= O D×V T0.01×t×0.5g×V s= O D×V T0.005OD——反应时间内吸光值的变化;V T ----提取酶液的总体积(ml)Vs ----测定时取用酶液体积(ml)T———反应时间(min);三、吲哚乙酸氧化酶(IAAO)活性的测定参照张志良等(1990)人的方法并稍作改动。
曹建康《果蔬采后生理生化实验指导》中多酚氧化酶活性、过氧化物酶活性、总酚含量和丙二醛含量的测定方法

曹建康《果蔬采后生理生化实验指导》中关于多酚氧化酶活性、过氧化物酶活性、总酚含量和丙二醛含量的测定方法1.多酚氧化酶(PPO)提取及活力测定1.1基本原理:多酚氧化酶(PPO)是一种以铜为辅基的酶,能催化多种简单酚类物质氧化形成醌类化合物,醌类化合物进一步聚合形成呈褐色、棕色或黑色的聚合物。
在后熟衰老过程或采后的贮藏加工过程中,果蔬出现褐变与组织中的多酚氧化酶活性密切相关。
多酚氧化酶催化邻苯二酚氧化物形成的产物在420nm处有最大光吸收峰。
因此,可以用比色法测定多酚氧化酶的活性。
1.2实验试剂和仪器:a.仪器及用具:研钵、高速冷冻离心机、分光光度仪、计时器、移液器、离心管、试管、容量瓶(100mL、1000mL)b.试剂1)0.1mol/L、pH5.5乙酸-乙酸钠缓冲液母液A(200mmol/L醋酸溶液):量取11.55mL冰醋酸,加蒸馏水稀释至1000mL。
母液B(200mmol/L醋酸钠溶液):称取16.4g无水醋酸钠(或称取27.2g三水合乙酸钠),用蒸馏水溶解、定容至1000mL。
取68mL母液A和432mL母液B混合后,调节pH至5.5,加蒸馏水稀释至1000mL。
2)提取缓冲液(含1mmol PEG、4% PVPP和1% Triton X-100)称取340mg PEG 6000(聚乙二醇6000)、4%PVPP(聚乙烯吡咯烷酮,polyvinyl-polypyrrolidone),取1mL Triton X-100,用0.1mol/L、pH5.5乙酸-乙酸钠缓冲液溶解、稀释至100mL。
3)50mmol/L邻苯二酚溶液取275mg邻苯二酚,用0.1mol/L、pH5.5乙酸-乙酸钠缓冲液溶解、稀释至50mL。
1.3实验步骤1)酶液制备称取5.0g果蔬组织样品,置于研钵中,加入5.0mL提取缓冲液,在冰浴条件下研磨成匀浆,于4℃、12000×g离心30min,收集上清液即为酶提取液,低温保存备用。
多酚氧化酶的分离纯化、蛋白质含量、活性测定及电泳

多酚氧化酶的分离纯化、蛋白质含量、活性测定及电泳博哥(中山大学化学与化学工程学院,广州510275)摘要多酚氧化酶与植物组织培养的酶促褐变以及果蔬品质密切相关。
本实验选取蘑菇、茄子、马铃薯为实验材料,提取PPO的粗酶液,再通过考马斯亮兰法法测定蛋白质含量,并采用邻苯二酚、L-多巴为底物,测定PPO活性,最后,进行了聚丙烯酰胺凝胶电泳。
结果显示,马铃薯酶液中PPO含量最多为15766 μmol·L-1,其次是蘑菇为13931 μmol·L-1,茄子酶液PPO最少,含量为4061μmol·L-1。
但是,以邻苯二酚或多巴为底物时,茄子的比活力最高,蘑菇与马铃薯酶液的比活力相近。
聚丙烯酰胺凝胶电泳显示,茄子酶液中存在较多同工酶,蘑菇与马铃薯则较少。
关键词多酚氧化酶考马斯亮兰法聚丙烯酰胺凝胶电泳1引言多酚氧化酶(polyphenoloxidase,PPO,EC.1.10.3.1)是植物体内普遍存在的一类铜结合酶。
多酚氧化酶的共同特征是能够通过分子氧氧化酚或多酚形成对应的醌。
在广义上,多酚氧化酶可分为三大类:单酚单氧化酶(酪氨酸酶tyrosinase,EC.1.14.18.1)、双酚氧化酶(儿茶酚氧化酶catechol oxidse,EC.1.10.3.2)和漆酶(laccase,EC.1.10.3.1)。
在这三大类多酚氧化酶中,儿茶酚酶主要分布在植物中,微生物中的多酚氧化酶主要包括漆酶和酪氨酸酶。
现在大部分文献所说的多酚氧化酶一般是儿茶酚氧化酶和漆酶的统称。
多酚氧化酶与植物组织培养的酶促褐变以及果蔬品质密切相关。
因此,研究多酚氧化酶(酪氨酸酶)的抑制,对防止水果、蔬菜的褐变,化妆品中的皮肤增白,以及因酪氨酸酶催化产生黑色素引起的疾病(黄褐斑等色素沉着性皮肤病等),具有非常重要的治疗意义。
本实验选取蘑菇、茄子、马铃薯为实验材料,通过组织细胞破碎匀浆、过滤、离心、硫酸铵沉淀、透析等步骤获得PPO的粗酶液。
甘薯中多酚氧化酶活性的测定及褐变控制

甘薯中多酚氧化酶活性的测定及褐变控制一、本文概述本文旨在探讨甘薯中多酚氧化酶(Polyphenol Oxidase,PPO)活性的测定方法,并深入研究如何控制甘薯在加工和储存过程中因PPO活性过高引发的褐变现象。
甘薯作为一种重要的农作物,其营养价值和经济价值均较高,但在加工和储存过程中,甘薯常因PPO的作用而发生褐变,这不仅影响了甘薯的外观品质,还可能降低其营养价值,甚至影响消费者的接受度。
因此,研究甘薯中PPO活性的测定方法和褐变控制技术,对于提高甘薯的加工品质和储存稳定性具有重要的理论和实践意义。
在本文中,我们将首先介绍PPO的基本性质及其在甘薯中的功能,然后详细阐述PPO活性的测定方法,包括常用的比色法、光谱法等。
接着,我们将分析甘薯褐变的原因和机理,探讨影响PPO活性的各种因素,如温度、pH值、抑制剂等。
在此基础上,我们将提出一系列控制甘薯褐变的策略和方法,如物理法、化学法和生物法等,并对各种方法的优缺点进行比较和评价。
我们将对甘薯中PPO活性的测定及褐变控制的研究前景进行展望,以期为甘薯的加工和储存提供更为有效的技术支持。
二、甘薯中多酚氧化酶的活性测定在甘薯中,多酚氧化酶(Polyphenol Oxidase,PPO)是一种关键的酶,参与了甘薯褐变的过程。
为了更深入地了解甘薯褐变的机制并寻找有效的褐变控制方法,对甘薯中多酚氧化酶的活性进行精确测定显得尤为重要。
测定多酚氧化酶活性的方法主要基于酶催化底物氧化产生有色产物的原理。
在本研究中,我们采用了经典的邻苯二酚法来测定甘薯中多酚氧化酶的活性。
将甘薯样品进行匀浆处理,以获得含有多酚氧化酶的酶液。
然后,将适量的酶液与底物邻苯二酚混合,并在适宜的温度和pH条件下进行反应。
随着反应的进行,邻苯二酚被多酚氧化酶催化氧化,生成有色产物。
通过测定有色产物的吸光度,可以间接反映多酚氧化酶的活性。
为了获得准确的结果,我们在测定过程中严格控制了实验条件,包括温度、pH值、底物浓度和反应时间等。
多酚氧化酶活性测定

五:计算多酚氧化酶活性
•
• • • • • • • •
50 × 5(a—b)
A=
= 10× n×2
12.5(a—b)
n
• 式中A——多酚氧化酶活性
50——分析材料悬浮液的总体积 n——分析材料的重量 10——测定酶活性所取的悬浮液体积 2——反应时间 a——用于滴定对照的0.01KIO3溶液体积 b——用于样品第定的0.01N KIO3溶液体积 5——0.01N抗坏血酸溶液每毫升换算为微克分子数 抗坏血酸的系数(0.00088/0.000176)
二:实验原理
• 所有上诉过程的主要反应式如下: 酶 邻苯二酚 邻苯二醌 邻苯二醌+抗坏血酸
KIO3+ 5KI+ 6HCL 3I2 + 3Vc
邻苯二酚+脱氢抗坏血酸
6KCL+ 3H2O+ 3I2
3-脱氢Vc+
6HI
三:实验材料与设备
• 材料:苹果 • 设备:研体 烧杯 50ml量瓶 250ml三角瓶 秒表 滴定管 温度计
多酚氧化酶活性测定
• 食品的褐变主要分为酶促褐变与非酶褐变, 多酚氧化酶是引起果蔬褐变的主要酶之一。 学习它的活性测定对于果蔬加工采取的护 色措施具有指导意义
一:实验目的
• 1:掌握酶活性测定的基本要点和技能 • 2:了解多酚氧化酶的作用机制
二:实验原理
• 邻苯二酚在多酚氧化酶催化下受O2作用生成邻苯二 醌,邻苯二醌能够被抗坏血酸还原,如抗坏血酸充 足,少量邻苯二酚可反复不断地氧化还原。由于该 酶最适pH为6,因此这一过程在pH时最快。 • 把分析对象配成pH6左右的样液,在抗坏血酸和邻 苯二酚存在是,于20℃下震荡2min,这时抗坏血酸 被氧化。精确的经过2min后加入偏磷酸以终止反应。 用碘量法(以碘酸钾为基准试剂)进行滴定,测得 剩余的抗坏血酸。由得到的数据求出被氧化的抗坏 血酸量,并计算出酶的活性,并以1g分析物质1min 内氧化抗坏
酶活性测定方法

酶活性测定方法一、过氧化物酶(POD)活性的测定POD测定参照李合生等(2003)的愈创木酚法方法进行测定,略加改动。
测定:称取样品0.5g,加入5mL 1/15mol/L PH=7.0的磷酸缓冲溶液,冰浴研磨成匀浆,4℃条件下12000r/min离心15min,上清液为粗酶液。
然后在试管中加pH 7.0的磷酸缓冲液2 ml,愈创木酚(0.2%)0.5ml,浓度为0.15%的H2O2 0.5ml,取0.3ml的酶提取液加入到试管中,空白以缓冲液代替。
在470nm下测定其吸光度,加入酶液时开始计时,每隔30s读数一次,连续记录5分钟。
以每分钟每克鲜重增加0.1的酶量作为一个酶活性单位。
△470 ×V TPOD活性=0.01×t×Vs×W式中:△470----反应时间内吸光度值的变化;V T ----提取酶液的总体积(ml)t----反应的时间(min)Vs ----测定时取用酶液体积(ml)W----样品鲜重(g)二、多酚氧化酶(PPO)活性的测定多酚氧化酶活性测定参照朱广廉等(1990)的方法,略加改动。
酶液制备:称取样品0.5g,加入5mL 0.1mol/L PH=6.0的磷酸缓冲溶液,冰浴研磨成浆,4℃条件下12000r/min离心15min后上清液即为粗酶液。
PPO活性测定:反应试管中分别加入0.1 mL酶液+3.9 mL磷酸缓冲液+ 1 mL 1m mol/L的邻苯二酚。
混匀后于30℃保温10 min,迅速加入2 mL质量分数为20%的三氯乙酸终止反应,立即于525nm 下测定其吸光度值,计算酶活。
PPO活性= O D×V T0.01×t×0.5g×V s= O D×V T0.005OD——反应时间内吸光值的变化;V T ----提取酶液的总体积(ml)Vs ----测定时取用酶液体积(ml)T———反应时间(min);三、吲哚乙酸氧化酶(IAAO)活性的测定参照张志良等(1990)人的方法并稍作改动。
多酚氧化酶(PPO)活性检测试剂盒说明书
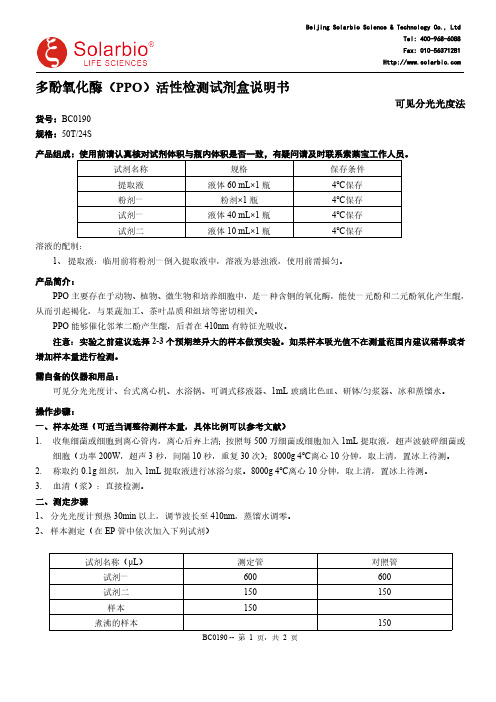
多酚氧化酶(PPO)活性检测试剂盒说明书可见分光光度法货号:BC0190规格:50T/24S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称规格保存条件提取液液体60 mL×1瓶4℃保存粉剂一粉剂×1瓶4℃保存试剂一液体40 mL×1瓶4℃保存试剂二液体10 mL×1瓶4℃保存溶液的配制:1、提取液:临用前将粉剂一倒入提取液中,溶液为悬浊液,使用前需摇匀。
产品简介:PPO主要存在于动物、植物、微生物和培养细胞中,是一种含铜的氧化酶,能使一元酚和二元酚氧化产生醌,从而引起褐化,与果蔬加工、茶叶品质和组培等密切相关。
PPO能够催化邻苯二酚产生醌,后者在410nm有特征光吸收。
注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
需自备的仪器和用品:可见分光光度计、台式离心机、水浴锅、可调式移液器、1mL玻璃比色皿、研钵/匀浆器、冰和蒸馏水。
操作步骤:一、样本处理(可适当调整待测样本量,具体比例可以参考文献)1.收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入1mL提取液,超声波破碎细菌或细胞(功率200W,超声3秒,间隔10秒,重复30次);8000g 4℃离心10分钟,取上清,置冰上待测。
2.称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
8000g 4℃离心10分钟,取上清,置冰上待测。
3.血清(浆):直接检测。
二、测定步骤1、分光光度计预热30min以上,调节波长至410nm,蒸馏水调零。
2、样本测定(在EP管中依次加入下列试剂)试剂名称(μL)测定管对照管试剂一600600试剂二150150样本150煮沸的样本15037℃(哺乳动物)或25℃(其它物种)中准确水浴10min后,迅速放入沸水中加热10min。
冷却后,5000g,常温离心10min,收集上清,410nm处检测测定管和对照管吸光度,计算ΔA=A测定-A对照。
多酚氧化酶活性的测定

多酚氧化酶活性的测定多酚氧化酶(POD)是一种酶类,广泛存在于植物、细菌和真菌等生物体中,具有氧化多酚的功能,可将多酚类物质氧化为其对应的醛酮或烯醇。
多酚氧化酶活性的测定是研究植物生理生态、农业及食品科学等领域的重要技术手段之一。
多酚氧化酶活性的测定方法有多种,常见的测定方法有单宁酸、苯胺、硫脲、芳香胺等底物的光度法、荧光法、色谱法和电化学法等。
其中,光度法测定多酚氧化酶活性是相对最简便、经济、有效的方法之一。
一、实验原理多酚氧化酶活性的测定原理基于多酚类物质的氧化反应,其反应方程式如下:多酚+ H2O2 → 多酚氧化酶→ 合成物 + H2O在光度法中,用苯酚为底物,通过苯酚酸化后生成背景吸光度,再将多酚加到反应体系中,多酚在酸性条件下与过氧化氢发生氧化反应,产生黄色的产物苯醛,可在310nm处检测吸光度增加。
二、实验步骤步骤一:制备反应液(1)苯酚称取1g苯酚溶于50ml0.1mol/L的钠碳酸中,加入2滴酚酞指示剂,用0.1mol/L氢氧化钠溶液滴定至显红色终点,记录滴定体积,再用0.1mol/L的氢氧化钠溶液滴定至淡粉色的时间,同时记录滴定体积,测定得到苯酚的浓度。
(2)过氧化氢称取30%的过氧化氢溶液,在室温下稀释成0.04%过氧化氢溶液。
(3)缓冲液将0.2mol/L的柠檬酸-磷酸缓冲液(PH 6.0)浓度稀释成0.05mol/L。
(4)酶提取液在质量浓度等于1的0.05mol/L的柠檬酸-磷酸缓冲液中先加入1mmol/L的PEG6000,频繁将其混合均匀之后,再加入5%聚乙烯醇,在最后再加入一些几丁糖粉,并不断地搅拌混合均匀之后过滤清除残留物,提取所需酶液。
(1)标准液分别取0-40μmol/L的马尾松酚,加入0.1mol/L的硫酸调节pH至1,在0.1mol/L的缓冲液溶液中进行100μl反应,80℃下控制反应时间在5min在323nm检测吸光度,绘制标准曲线。
(2)样品处理将植物或细胞样品在工作台上用0.1mol/L的N/2 H2SO4溶解,然后过滤,用样品液稀释1倍。
植物多酚氧化酶活性测定方法的改进

第25卷第1期2005年1月云南师范大学学报Journal of Yunnan Normal UniversityVol.25No.1Jan.2005植物多酚氧化酶活性测定方法的改进李忠光, 龚 明(云南师范大学生命科学学院,云南昆明650092)摘 要: 文章介绍了多酚氧化酶反应产物邻醌的吸收光谱和酶测定反应的动力学分析,确定了邻醌的最高吸收光谱和酶测定的适宜参数。
这一测定方法与原方法[1]相比,提高了多酚氧化酶测定的准确性、重复性和可比性,使灵敏度提高了5倍。
关 键 词: 改进;多酚氧化酶;动力学曲线中图分类号: O946.5 文献标识码: A 文章编号: 1007-9793(2005)01-0044-02多份氧化酶(Polyphenol oxidase,PPO)是植物体内普遍存在的一种非线粒体内的末端氧化酶[2,3],它包括单酚氧化酶[酪氨酸酶(tyrosinase), EC.1.10.3.2]、双氧化酶[儿茶酚氧化酶(catechol oxidase),EC.1.10.3.2]、漆酶(laccase,EC.1.10.3.1)[4,5]。
它可以把酚类物质如单酚、邻苯二酚、邻苯三酚、对苯二酚等氧化为相应的醌类物质[6,7]。
醌类物质对病原微生物起着抑制作用或杀伤作用,具有一定的抗病能力。
因此,在感病的植物体中,PPO活性都有不同程度的提高,以抵抗病原体进一步侵染健康的植物组织[4,5]。
此外,PPO对食品和饮料生产也会产生重大影响,它不仅影响食品和饮料的色泽,也影响其品质,特别是在制作绿茶、红茶、烤烟和水果类饮料的过程中更为突出[8,9]。
所以,准确测定PPO活性,具有重要的生理和现实意义。
PPO常用的测定方法有比色法[1]和氧电极法[6],本文通过对比色法的改进,极大地提高了PP0测定的准确性、重现性和可比性,使灵敏度提高了5倍。
1. 材料的准备和处理方法1.1植物材料的培养和选购挑选饱满的玉米(Zea Mays)品种大黄的种子,以0.1%HgCl2消毒10min后,漂洗干净,于26.5 下吸涨12h,播于垫有6层湿润滤纸的带盖白磁盘(24cm 16cm)中,于26.5 下黑暗中萌发60h。
多酚氧化酶(PPO)检测试剂盒(邻苯二酚比色法)

多酚氧化酶(PPO)检测试剂盒(邻苯二酚比色法)产品简介:多酚氧化酶(polyphenol oxidase,PPO)是自然界中分布极广的一种金属蛋白酶,普遍存在于植物、真菌、昆虫的质体中,甚至在土壤中腐烂的植物残渣上都可以检测到多酚氧化酶的活性,多酚氧化酶是一种蛋白体,在茶树生命活动和茶叶加工过程中参与一系列由酶促活动而引起的化学变化,故又被称为生物催化剂。
该酶属于细胞木质素合成途径中间的关键酶,研究该酶可以探讨多种生物细胞发育过程中木质素沉积的代谢机理,为减少水果石细胞含量提高其品质提供依据。
Leagene 多酚氧化酶(PPO)检测试剂盒(邻苯二酚比色法)检测原理是以邻苯二酚作为底物,在酶促反应的最适条件下采用每隔一定时间测定产物生成量的方法,于分光光度计检测吸光度,以吸光度变化所需酶量进行计算。
该试剂盒主要用于植物组织的裂解液或匀浆液、血清等样品中内源性的多酚氧化酶活性,尤其适用于检测水果中多酚氧化酶活性。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
产品组成:自备材料:1、蒸馏水2、研钵或匀浆器3、离心管或试管4、低温离心机5、比色杯6、分光光度计操作步骤(仅供参考):1、准备样品:①植物样品:取植物组织或水果中层果肉加入预冷的PPO Lysis buffer 研磨或匀浆,离心,留取上清液,冻存,用于多酚氧化酶的检测。
②血浆、血清和尿液样品:血浆、血清按照常规方法制备后可以直接用于本试剂盒的测定,编号名称TE042960T Storage试剂(A):PPO Lysis buffer 500ml 4℃试剂(B):PPO Assay buffer 25ml4℃避光使用说明书1份冻存,用于多酚氧化酶的检测。
③细胞或组织样品:取恰当细胞或组织裂解液,如有必要用PPO Lysis buffer进行适当匀浆,离心,取上清液,冻存,用于多酚氧化酶的检测。
④高活性样品:如果样品中含有较高活性的多酚氧化酶,可以使用PPO Lysis buffer进行恰当的稀释。
实验四多酚氧化酶的活性的测定及酶学性质

一、实验目的1掌握分光光度法测定多酚氧化酶活性的一般原理及操作技术方法。
2了解酶的活性与植物组织褐变以及生理活动之间的关系。
二、实验原理马铃薯不耐储藏,在加工过程中去皮切分后非常容易发生酶促褐变,使外观品质和营养价值大为降低,制约着马铃薯的开发利用。
酶促褐变是马铃薯加工产业必须解决的难题。
其中多酚氧化酶是导致马铃薯等果蔬发生酶促褐变的重要酶类。
多酚氧化酶活性大小直接影响酶促褐变程度。
多酚氧化酶(polyphenoloxidase, PPO)又称酪氨酸酶、儿茶酚酶、酚酶等.是自然界中分布极广的一种含铜氧化酶•普遍存在于植物、真菌、昆虫的质体中。
植物受到机械损伤和病菌侵染后,PPO催化酚与02氧化形成醌,使组织形成褐变.以便损伤恢复,防止或减少感染,提高抗病能力。
研究多酚氧化酶的特性对食品的加工与保藏工艺有非常重要的意义。
因此,检测食品中多酚氧化酶具有重要意义。
多酚氧化酶是一种含铜的氧化酶,在一定的温度、pH条件下,有氧存在时,能使催化邻苯二酚氧化生成有色物质,单位时间内有色物质在410 nm处的吸光度与酶活性强弱成正相关,在分光光度计410nm处使反应体系的0D值产生变化,通过0D值的变化确定PPO的酶活大小。
多酚氧化酶邻苯二酚(儿茶酚)+ 1 / 2O2 -------------------------------- 邻醌+ H2O三、试验材料、试剂及试验用品1. 材料:马铃薯块茎。
2. 仪器:分光光度计;离心机;恒温水浴;研钵;试管;移液管;容量瓶3 .试剂:0.1mmol/L 磷酸缓冲液(pH=7.0);0.01mol/L 邻苯二酚;0.1mol/L 磷酸氢二钠;0.1mol/L 磷酸二氢钠;10mmol/L柠檬酸;10mmol/L抗坏血酸;10mmol/L乙二胺四乙酸二钠(EDTA );10mmol/L 亚硫酸钠四、实验方法:1•多酚氧化酶的提取取0.5g马铃薯块茎样品,加入预冷的磷酸缓冲液(pH7.0)3ml,研磨匀浆,转移到离心管中,再用7mL磷酸缓冲液冲洗研钵,合并提取液,在4C下离心(8000r/min)5min,取上清液为多酚氧化酶提取液,并量取粗酶液体积。
1 多酚氧化酶活性测定

一、实验目的: 掌握测定多酚氧化酶活性的方法;了解多酚氧化酶的特性 二、实验原理:
多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化 生成醌。醌有颜色,在525nm下有最大光吸收,通过分光光 度法测定反应体系颜色变化可测定酶活性。 三、器材与试剂 1、仪器:低温离心机、s22pc分光光度计 2、试剂:儿茶酚、pH 7.2磷酸缓冲液 3、材料:马铃薯
四、实验步骤: 1.称取马铃薯0.5克,加入2.5mL pH 7.2磷酸缓冲液,少许 PVP,研磨匀浆,转移到离心管,再用2.5mL pH 7.2磷酸缓 冲液冲洗研钵,合并提取液。4℃ 4000rpm离心15分钟,上 清液即为粗酶液。 2.在试管中,加入2.5mL pH 7.2磷酸缓冲液,1.5mL 儿茶酚 以及1mL 粗酶液,空白调零以1mL磷酸缓冲液代替粗酶液。 3.A值测定:加入粗酶液后迅速混匀,立刻于525nm下测定 反应体系的A值,每隔30秒记录一次,共记录5次。 4.计算酶活力。按下式计算 PPO活性=U/min gFW A值增加0.01定义为一个酶活力单位。
称取马铃薯05克加入25mlph72磷酸缓冲液少许pvp研磨匀浆转移到离心管再用25mlph72磷酸缓冲液冲洗研钵合并提取液
植物生物学实验
实验一
多酚氧化酶(PPO)活性测定
末端氧化酶:处于生物氧化一系列反应的最末端, 把电子传递给O2的酶。 1、细胞色素氧化酶 2、交替氧化酶 3、酚氧化酶: 分为单酚氧化酶和多酚氧化酶。 4、乙醇酸氧化酶 5、抗坏血酸氧化酶
五、实验报告: 计算所测材料的PPO活性。选择A值变化均匀的三组数 值求平均值。
酶活性测定方法

体系一酶和蛋白质提取消过毒的打孔器进行伤口处理后,在每个伤口处添加50μL以下处理:(1)无菌水,对照;(2)浓度为1000μg/mlGA3;(3)浓度为1 ×104 spores/ml P. expansum孢子悬浮液;(4)浓度为1000μg/mlGA3+浓度为1 ×104 spores/ml P. expansum孢子悬浮液。
处理后湿纱布覆盖并用PE塑料膜密封作保湿处理。
贮藏于常温(20-25℃)下。
分别在0、12、24、36和48小时取样进行测定酶活性。
取样时沿伤口用刀小心切下1g果实组织,加入10 mL冷(4℃)的50 mmol/L磷酸缓冲液(PBS)内含1.33 mmol/L EDTA和1% PVPP缓冲液(pH 7.8)。
研钵加入少量液氮预冷后,在冰浴中碾磨,破碎组织,然后在冷冻离心机12000rpm离心15分钟。
取上清液供酶活性和蛋白质含量用。
蛋白质含量测定试验材料和试剂:牛血清白蛋白标准溶液:准确称取100mg 牛血清白蛋白,溶于100mL 蒸馏水中,即为1 000μg/mL的原液。
8.1.2 蛋白试剂考马斯亮蓝G-250:称取100mg 考马斯亮蓝G-250,溶于50mL90%乙醇中,加入85%(W/V)的磷酸100mL,最后用蒸馏水定容到1 000mL。
8.1.3 乙醇;磷酸(85%)。
试验方法:分别取牛血清白蛋白标准溶液(1000μg/mL)0,、10μL、20μL、40μL、60μL、80μL、100μL,无菌水补至100μL,加入考马斯亮蓝G-250试剂5mL,作为标准溶液;分别取标准溶液和上清液(试验7中得到)400μL加到酶标板,以无菌水置零,测定OD595;酶活的测定9.1 试验材料和试剂9.1.1 氮蓝四唑;甲硫氨酸;核黄素;过氧化氢;愈创木酚;邻苯二酚。
9.1.2 Na2HPO4-12H2O;NaH2PO4-2H2O。
9.1.3 磷酸缓冲液PBS配制母液:0.2M Na2HPO4:称取71.6g Na2HPO4-12H2O,溶于1000ml 水;0.2M NaH2PO4:称取31.2g NaH2PO4-2H2O,溶于1000ml 水。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
五、实验报告: 计算所测材料的PPO活性。选择A值变化均匀的三组数 值求平均值。
植物生物学实验
实验一
多酚氧化酶(PPO)活性测定
末端氧化酶:处于生物氧化一系列反应的最末端, 把电子传递给O2的酶。 1、细胞色素氧化酶 2、交替氧化酶 3、酚氧化酶: 分为单酚氧化酶和多酚氧化酶。 4、乙醇酸氧化酶 5、抗坏血酸氧化酶
一、实验目的: 掌握测定多酚氧化酶活性的方法;Biblioteka 解多酚氧化酶的特性 二、实验原理:
多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化 生成醌。醌有颜色,在525nm下有最大光吸收,通过分光光 度法测定反应体系颜色变化可测定酶活性。 三、器材与试剂 1、仪器:低温离心机、s22pc分光光度计 2、试剂:儿茶酚、pH 7.2磷酸缓冲液 3、材料:马铃薯
四、实验步骤: 1.称取马铃薯0.5克,加入2.5mL pH 7.2磷酸缓冲液,少许 PVP,研磨匀浆,转移到离心管,再用2.5mL pH 7.2磷酸缓 冲液冲洗研钵,合并提取液。4℃ 4000rpm离心15分钟,上 清液即为粗酶液。 2.在试管中,加入2.5mL pH 7.2磷酸缓冲液,1.5mL 儿茶酚 以及1mL 粗酶液,空白调零以1mL磷酸缓冲液代替粗酶液。 3.A值测定:加入粗酶液后迅速混匀,立刻于525nm下测定 反应体系的A值,每隔30秒记录一次,共记录5次。 4.计算酶活力。按下式计算 PPO活性=U/min gFW A值增加0.01定义为一个酶活力单位。
